PREPARASI KANDIDAT VAKSIN
AVIAN INFLUENZA H5N1 MENGGUNAKAN PRINSIP
ANTIBODI ANTI-IDIOTIPE
KETUT KARUNI NYANAKUMARI NATIH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi Preparasi Kandidat Vaksin Avian Influenza H5N1 Menggunakan Prinsip Antibodi Anti-Idiotipe adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Pebruari 2010
Ketut Karuni Nyanakumari Natih
ABSTRACT
KETUT KARUNI NYANAKUMARI NATIH. The Preparation of Candidate Vaccine Avian Influenza H5N1 Using The Principle of Anti-idiotype Antibody. Under direction of RETNO D. SOEJOEDONO, I. WAYAN T. WIBAWAN, and FACHRIYAN H. PASARIBU
Avian Influenza (AI) represent one of the greatest concerns for public health that has emerged from the animal reservoir in recent time. The aim of this research was to prepare candidate vaccine AI H5N1 using the principle of anti-idiotype antibody. A polyclonal antibody was collected from guinea pigs which had been immunized with inactivated AI vaccine H5N1 Legok strain. Antibody of H5N1 AI in serum was detected using an Agar Gel Precipitation Testand Hemmaglutination Inhibition Test. The highest titre of antibody was obtained one week after the third immunization. Serum of guinea pigs which contain IgG was purified using the montage antibody purification kit & spin column with prosep A media (Millipore). The AI H5N1 IgG concentration was 8 mg/ml. AI H5N1 IgG, was then cut with a pepsin enzym to obtain F(ab)2; it was called Ab1.The concentration of IgG and F(ab)2 and purity of IgG were determined by UV spectrophotometer and showed that Ab1 concentration was 1 mg/ml. Molecular weight was established by Sodium Dedocyl Sulphate-Poly Acrilamide Gel Electrophoresis. Production of Ab2 was done by inoculation of rabbits with Ab1. The first immunization with 500 µg of Ab1 in Complete Freund Adjuvant was applied subcutaneously. The immunization was repeated with the same dose in Incomplete Freund Adjuvant at 1 week intervals. One week after the second dose of immunization, the rabbit’s serum was harvested and IgG was purified using the montage antibody purification kit & spin column with prosep A media (Millipore). The rabbit IgG, called Ab2, was an anti-idiotype antibody against AI. Identification of Ab2 was determined by Agar Gel Precipitation Test. A precipitation line appeared between Ab1 and Ab2 and a partial identity reaction appeared between Ab2 and the AI H5N1 antigen. The results of immunogenecity test indicated that Ab2 has a possibility to be an antigen for protection against AI virus H5N1 infection.
RINGKASAN
KETUT KARUNI NYANAKUMARI NATIH. Preparasi Kandidat Vaksin Avian Influenza Menggunakan Prinsip Antibodi Anti-idiotipe.Dibimbing oleh RETNO D. SOEJOEDONO, I. WAYAN T. WIBAWAN, dan FACHRIYAN H. PASARIBU
Penyakit flu burung atau Avian Influenza adalah penyakit zoonosa yang sangat fatal. Penyakit ini menginfeksi saluran pernapasan unggas dan juga mamalia. Penyakit ini disebabkan oleh virus influenza tipe A famili Orthomyxoviridae dengan galur bervariasi antigen 16 hemaglutinin dan 9 neuraminidase. Penyakit Avian Influenza
termasuk daftar list A dalam Office International Des Epizooties dan merupakan penyakit eksotik karena sebelumnya tidak pernah ditemukan di Indonesia.
Direktur Jenderal Peternakan pada tanggal 25 Januari 2004 dan diperkuat dengan Surat Keputusan Menteri Pertanian Republik Indonesia nomor 96/KPTS/PP.620/2/2004 tanggal 3 Pebruari 2004, menetapkan bahwa Indonesia telah terjangkit wabah penyakit
Avian Influenza pada unggas yang disebabkan oleh virus influenza tipe A subtipe H5N1. Vaksinasi merupakan salah satu upaya pemerintah Indonesia dalam penanganan
Avian Influenza. Vaksinasi diyakini sebagai salah satu cara untuk mengurangi kasus klinis penyakit Avian Influenza dan secara langsung mengurangi kontaminasi lingkungan oleh virus Avian Influenza. Tujuan penelitian ini adalah untuk menyiapkan kandidat vaksin Avian Influenza H5N1 menggunakan prinsip antibodi anti-idiotipe.
Penelitian diawali dengan pembuatan antibodi poliklonal yang dikoleksi dari marmut yang telah diimunisasi dengan vaksin Avian Influenza H5N1 inaktif strain Legok. Keberadaan antibodi AI H5N1 di dalam serum marmut diperiksa dengan uji Agar Gel Presipitasi dan diukur titernya dengan uji hambatan hemaglutinasi. Titer antibodi tertinggi diperoleh seminggu setelah imunisasi ke tiga dengan Geometric Mean Titer
1351.12.
Pemurnian Imunoglobulin G serum marmut dilakukan dengan montage antibody purification kit & spin column with prosep A media. Konsentrasi Imunoglobulin G Avian
Influenza H5N1 diukur dengan spektrofotometer ultra violet sebesar 8 mg/ml.
Imunoglobulin G AI H5N1 kemudian dipotong dengan enzim pepsin sehingga diperoleh F(ab)2 selanjutnya disebut Ab1. Konsentrasi F(ab)2 ditentukan dengan spektrofotometer ultra violet dan diperoleh konsentrasi Ab1 sebesar 1 mg/ml, sedangkan berat molekulnya ditentukan dengan Sodium Dedocyl Sulphate-Poly Acrilamide Gel Electrophoresis
sebesar 110 kDa.
Produksi antibodi anti-idiotipe dilakukan dengan menginokulasi Ab1 pada kelinci. Imunisasi pertama dengan dosis 500 µg dilarutkan dalam Freund’s Adjuvant
komplit yang diaplikasikan secara subkutan. Imunisasi diulang dengan dosis yang sama dicampur dalam Freund’s Adjuvant inkomplit dengan interval 1 minggu. Setiap minggu setelah imunisasi kedua, serum kelinci dikoleksi dan diidentifikasi dengan uji Agar Gel Presipitasi. Serum kelinci dipanen dan pemurnian Imunoglobulin G kelinci dilakukan dengan montage antibody purification kit & spin column with prosep A media.
Konsentrasi Ab2 ditentukan dengan spektrofotometer ultra violet dan diperoleh konsentrasi Ab2 sebesar 8 mg/ml, sedangkan berat molekulnya ditentukan dengan Sodium
Imunoglobulin G kelinci selanjutnya disebut Ab2 adalah antibodi anti-idiotipe terhadap Avian Influenza H5N1. Identifikasi Ab2 dilakukan dengan uji Agar Gel Presipitasi. Garis presipitasi terbentuk antara Ab1 dan Ab2 dan terbentuk reaksi identitas parsial antara Ab2 dan antigen AI H5N1. Selanjutnya dilakukan uji imunogenesitas pada ayam SPF dengan 4 kelompok yaitu kelompok kontrol, kelompok Imunoglobulin G kelinci kontrol, kelompok antibodi anti-idiotipe dan kelompok vaksin AI H5N1. Pengambilan darah ayam dilakukan setiap minggu selama 4 minggu. Keberadaan titer antibodi diukur dengan uji hambatan hemaglutinasi dan uji serum netralisasi in vitro
terhadap beberapa isolat lokal.
Pengukuran titer antibodi dengan uji hambatan hemaglutinasi menunjukkan bahwa walaupun titer antibodi anti-idiotipe lebih rendah dibandingkan dengan titer vaksin AI H5N1 tapi bersifat protektif baik terhadap antigen AI H5N1 strain Legok (2003), antigen AI H5N1 IPB (2007), antigen AI H5N1 IPB (2008), dan antigen AI H5N1 IPB (2009). Secara statistik antara perlakuan Ab2 dengan vaksin AI H5N1 tidak ditemukan perbedaan yang nyata sehingga antibodi-anti-idiotipe prospektif sebagai kandidat vaksin AI.
Pengukuran titer antibodi dengan uji serum netralisasi menunjukkan bahwa walaupun titer antibodi anti-idiotipe lebih rendah dibandingkan dengan titer vaksin AI H5N1 tapi bersifat protektif terhadap antigen AI H5N1 strain Legok (2003) dan antigen AI H5N1 IPB (2005), tetapi tidak protektif terhadap A/Goose/Bojonggenteng/IPB2-RS/2006. Secara statistik antara perlakuan Ab2 dengan vaksin AI H5N1 tidak ditemukan perbedaan yang nyata terhadap isolat AI H5N1 strain Legok (2003) dan isolat AI H5N1 IPB (2005) sehingga antibodi-anti-idiotipe prospektif sebagai kandidat vaksin AI.
Hasil penelitian ini mengindikasikan adanya peluang Ab2 sebagai antigen dalam pencegahan infeksi virus Avian Influenza H5N1.
©Hak Cipta milik IPB, tahun 2010
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
PREPARASI KANDIDAT VAKSIN
AVIAN INFLUENZA H5N1 MENGGUNAKAN PRINSIP
ANTIBODI ANTI-IDIOTIPE
KETUT KARUNI NYANAKUMARI NATIH
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Sains Veteriner
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Ida Sang Hyang Widhi Wasa, Tuhan Yang Maha Esa atas segala karunia-Nya sehingga disertasi ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2008 sampai Agustus 2009 ini adalah preparasi vaksin Avian Influenza dengan judul Preparasi Kandidat Vaksin Avian Influenza H5N1 Menggunakan Prinsip Antibodi Anti-Idiotipe.
Terima kasih penulis ucapkan kepada Prof. Dr. drh. Retno D. Soejoedono, M.S., sebagai ketua komisi pembimbing dan Dr. drh. I. Wayan T. Wibawan, M.S., serta Prof. Dr. drh. Fachriyan H. Pasaribu sebagai anggota komisi pembimbing, dan Prof. drh. Bambang P. Priosoeryanto, M.S., PhD. sebagai ketua Program Studi Sains Veteriner atas segala bimbingannya dari awal hingga terselesaikannya disertasi ini.
Penulis menyampaikan terimakasih kepada Pemerintah Republik Indonesia melalui Badan Sumber Daya Manusia Departemen Pertanian atas pelimpahan beasiswa untuk mengikuti program doktor pada Program Studi Sains Veteriner di Institut Pertanian Bogor.
Terimakasih penulis sampaikan kepada Dr. drh. Hj. Sri Murtini, M.Si. dan drh Ekowati Handharyani, M.S., PhD. yang telah bersedia menjadi penguji luar komisi pada ujian tertutup dan Nastiti Kusumorini, PhD., sebagai pimpinan sidang pada ujian tertutup. Terimakasih juga kepada drh. H. Agus Setiyono, M.S., PhD. dan Dr. drh. Abdul Rahman, atas kesediaannya menjadi penguji luar komisi pada ujian terbuka dan Dr. drh. I. Wayan T. Wibawan, M.S. sebagai pimpinan sidang pada ujian terbuka. Kepada semua pihak penulis sampaikan terimakasih atas saran, kritik, dan masukan yang diberikan untuk perbaikan dan penyempurnaan disertasi ini.
Penulis juga menyampaikan terimakasih dan penghargaan yang tak terhingga kepada drh. Agus Heriyanto, M.Phil., Kepala Balai Besar Pengujian Mutu dan Sertifikasi Obat Hewan periode tahun 2006-2009 yang memberikan motivasi, dukungan dan fasilitas dari awal hingga selesai penulisan disertasi. Ucapan terimakasih juga penulis sampaikan kepada Dr. drh. Setyo Widodo yang memberikan motivasi dan rekomendasi untuk melanjutkan studi ke jenjang doktor.
Ucapan terimakasih dan penghargaan penulis sampaikan kepada ibu Susandra Kuswandi dan Dra. Inggriani, M. Biomed. dari PT. Nutrilab Pratama, drh, Hartono (Ketua Pinsar), drh. Okti Nadia Poetri, MSi. (Fakultas Kedokteran Hewan IPB), drh. Darsono (PT. Bofarma) dan Risa, S.Si. (BBalitvet) atas bantuan bahan-bahan penelitian dan kerjasamanya yang sangat baik, juga kepada drh. Carolos Baso Darmawan (USDA) atas motivasi dan sumbangan daftar pustakanya dan drh. Roosnilasari Endah Pertiwi, M.Si atas motivasi dan doanya.
Penulis juga menyampaikan rasa terimakasih dan penghargaan kepada teman-teman seperjuangan, terutama kepada Dr. drh. Nyoman Suarsana, M.Si.(Udayana Bali), Dr. Muharam Saepulloh, S.Si.,M.Sc. (BBalitvet Bogor), drh. Sophia Setyawati, M.P. (Karantina Hewan Jakarta), drh. Sutiatuti W., M.Si. (BBalitvet Bogor), drh. Mustofa Sabri, M.P. (Unsyah Aceh), Dr. Ir. Najamudin, M.Si. (Universitas Tadulako Palu), serta teman-teman lain yang tidak bisa saya sebutkan satu persatu.
Terima kasih yang mendalam kepada ayahanda Drs. I. Ketut N. Natih, M.Hum. dan ibunda Ketut Geniki serta kakak-kakak dan adik-adik, atas doanya yang terus menerus, dukungan moril dan finansial. Ucapan terimakasih yang tak terhingga penulis juga sampaikan kepada keponakan-keponakan tersayang yang selalu memberikan semangat dan doa.
Terimakasih kepada keluarga tercinta Kompol I Nengah Ganti, S.H. atas ijin, dan doanya, dan kepada ananda Putu Gayatridevi Ganti Karuni Natih yang selalu mendampingi mama dalam suka dan duka meraih cita-cita mama. Terimakasih sayang atas pengorbanan, pengertian, kesabaran, ketabahan, doa yang tulus serta dorongan semangat yang terus menerus.
Akhir kata penulis berharap semoga hasil penelitian ini bermanfaat.
Bogor, Pebruari 2010
RIWAYAT HIDUP
Penulis dilahirkan di Singaraja (Bali) pada tanggal 21 Desember 1967 sebagai anak ke-empat dari pasangan Drs. I. Ketut N. Natih, M.Hum dan Ketut Geniki. Pendidikan sarjana ditempuh di Program Studi Kedokteran Hewan, Fakultas Kedokteran Hewan, Institut Pertanian Bogor, melalui PMDK, lulus sarjana kedokteran hewan tahun 1992 dan lulus profesi dokter hewan tahun 1993. Pada tahun 2005 penulis menyelesaikan Program Master Sains di Program Studi Sains Veteriner Pascasarjana IPB. Kesempatan untuk melanjutkan ke program doktor pada program studi di perguruan tinggi yang sama diperoleh pada tahun 2006. Beasiswa pendidikan pascasarjana diperoleh dari Departemen Pertanian Republik Indonesia.
Penulis bekerja sebagai Medik Veteriner Unit Uji Virologi di Balai Besar Pengujian Mutu dan Sertifikasi Obat Hewan, Direktorat Jendral Peternakan, Departemen Pertanian sejak tahun 1994 sampai sekarang.
DAFTAR ISI
Halaman
DAFTAR TABEL ... xv
DAFTAR GAMBAR... xvi
DAFTAR LAMPIRAN... xviii
I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Rumusan Permasalahan ... 3
1.3 Maksud dan Tujuan ... 5
1.4 Manfaat Penelitian ... 5
1.5 Hipotesis ... 5
II TINJAUAN PUSTAKA ... 6
2.1 Antibodi ... 6
2.2 Antibodi Anti-idiotipe ... 8
2.3 Antibodi Anti-idiotipe Sebagai Vaksin ... 10
2.4 Virus Influenza ... 11
2.5 Virus Avian influenza (AI)... 16
2.6 Patogenesis Avian influenza ... 18
2.6.1 Reseptor Virus Avian influenza... 18
2.6.2 Mekanisme Infeksi Virus Avian influenza ... 19
2.7 Vaksin dan Vaksinasi Avian influenza ... 23
III BAHAN DAN METODE PENELITIAN ... 28
3.1 Lokasi dan Waktu Penelitian ... 28
3.2 Bahan dan Alat ... 28
3.2.1 Hewan Percobaan ... 28
3.2.2 Bahan dan Media ... 28
3.2.3 Peralatan ... 29
3.3 Metode ... 30
3.3.1 Reidentifikasi Vaksin AI H5N1 ... 30
3.3.2 Produksi Antibodi Poliklonal Avian influenza H5N1 (Ab1) Pada Marmut... 32
3.3.2.2 Pemurnian Imunoglobulin G Anti AI H5N1 (Ab1) 33 3.3.2.3 Pemotongan Imunoglobulin G AI H5N1 dan
Pemurnian Fragmen F(ab)2 ... 34 3.3.3 Produksi Antibodi Anti-Idiotipe (Ab2) Pada Kelinci... 3.3.3.1 Pemurnian Imunoglobulin G Kelinci Antibodi 4.1 Reidentifikasi Vaksin AI H5N1 ...
DAFTAR TABEL
Halaman
1 Protein Influenza A ... 12
2 Persyaratan Vaksin ...
24
3 Primer Untuk mengamplifikasi Virus AI H5N1 ...
31
4 Titer Antibodi Poliklonal virus AI H5N1 ...
42
5 Rataan Titer Antibodi Anti Anti-idiotipe (Ab3)terhadap Antigen AI H5N1 strain Legok (2003) dengan Uji HI... 57
6 Rataan Titer Antibodi Anti Anti-idiotipe (Ab3)terhadap Antigen AI H5N1 IPB (2007) dengan Uji HI... 59
7 Rataan Titer Antibodi Anti Anti-idiotipe (Ab3)terhadap Antigen AI H5N1 IPB (2008) dengan Uji HI... 60
8 Rataan Titer Antibodi Anti Anti-idiotipe (Ab3)terhadap Antigen AI H5N1 IPB (2009) dengan Uji HI... 62
9 Rataan Titer Antibodi Anti Anti-idiotipe (Ab3)terhadap Isolat AI H5N1 strain Legok (2003) dengan Uji SN... 65
10 Rataan Titer Antibodi Anti Anti-idiotipe (Ab3)terhadap Isolat AI H5N1 IPB 2005 dengan Uji SN... 67
11 Rataan Titer Antibodi Anti Anti-idiotipe (Ab3)terhadap Isolat A/Goose/Bojonggenteng/IPB2-RS/2006 dengan Uji SN... 68
DAFTAR GAMBAR
Halaman
1 Tiga Kelas Determinan Antigenik ... 7
2 The idiotypic network ……… 9
3 Virus Influenza Tipe A, B dan C ... 13
4 Ilustrasi Antigenic Drift Virus Influenza... 14
5 Ilustrasi Antigenic Shift Virus Influenza ... 15
6 RNA Virus Influenza A... 17
7 Replikasi Virus Influenza ... 22
8 Uji Identitas Vaksin AI H5N1 inaktif Strain Legok dengan uji RT-PCR menggunakan primer subtipe H5... 40 9 Uji Identitas Vaksin AI H5N1 inaktif Strain Legok dengan uji RT-PCR dengan subtipe N1 ... 40
10 Reaksi Presipitasi Serum Marmut Spesifik Terhadap Antigen Virus Avian influenza H5N1 Pada Uji Agar Gel Presipitasi ... 41 11 Gambaran Titer Antibodi Poliklonal AI H5N1 ... 42 12 Reaksi Presipitasi Imunoglobulin G Marmut Spesifik Terhadap Antigen Virus Avian influenza H5N1 Pada Uji Agar Gel Presipitasi... 46
13 Skema Pemotongan Imunoglobulin dengan Enzim Pepsin ... 47
14 Profil pita protein Imunoglobulin G yang telah dipurifikasi ... 48
15 Profil pita protein Fragmen F(ab)2 ... 48
16 Antibodi Anti-idiotipe sebagai imunogen ... 51
17 Reaksi Identitas Parsial Imunoglobulin G Kelinci Spesifik Terhadap Ab1 dan Antigen Virus Avian influenza H5N1 ... 52
19
AI H5N1... Reaksi Spesifik antara Antibodi Anti-idiotipe dengan Antibodi Anti Anti-idiotipe...
55
55
20 Regulasi idiotipik dari respon imun ... 56
21 Rataan Titer Antibodi Anti anti-idiotipe (Ab3) terhadap antigen H5N1 strain Legok (2003) dengan Uji HI... 58
22 Rataan Titer Antibodi Anti anti-idiotipe (Ab3) terhadap antigen
AI H5N1 IPB (2007) dengan Uji HI... 59
23 Rataan Titer Antibodi Anti anti-idiotipe (Ab3) terhadap antigen AI
H5N1 IPB (2008) dengan Uji HI... 61
24 Rataan Titer Antibodi Anti anti-idiotipe (Ab3) terhadap antigen AI
H5N1 IPB (2009) dengan Uji HI... 62
25 Biakan sel Madin Darby Canine Kidney (MDCK) kontrol ... 64
26 Sel MDCK yang diinfeksi oleh virus AI H5N1 ... 64
27 Rataan Titer Antibodi Anti anti-idiotipe (Ab3) terhadap isolat AI
H5N1 Strain Legok (2003) dengan Uji SN... 66
28 Rataan Titer Antibodi Anti anti-idiotipe (Ab3) terhadap isolat AI
H5N1 IPB (2005) dengan Uji SN... 67
DAFTAR LAMPIRAN
Halaman
1 Daftar Vaksin Avian Influenza di Indonesia ... 84 2 Hasil Pengujian Titer Antibodi Anti Anti-idiotipe (Ab3)terhadap
Antigen AI H5N1 strain Legok (2003) dengan Uji HI ... 85
3 Hasil Pengujian Titer Antibodi Anti Anti-idiotipe (Ab3)terhadap
Antigen AI H5N1 IPB (2007) dengan Uji HI ... 86
4 Hasil Pengujian Titer Antibodi Anti Anti-idiotipe (Ab3)terhadap
Antigen AI H5N1 IPB (2008) dengan Uji HI ... 87
5 Hasil Pengujian Titer Antibodi Anti Anti-idiotipe (Ab3)terhadap
Antigen AI H5N1 IPB (2009) dengan Uji HI ... 88
6 Hasil Pengujian Titer Antibodi Anti Anti-idiotipe (Ab3)terhadap
Isolat AI H5N1 strain Legok (2003) dengan Uji SN... 89
7 Hasil Pengujian Titer Antibodi Anti Anti-idiotipe (Ab3)terhadap
Isolat AI H5N1 IPB (2005) dengan Uji SN... 90
8 Hasil Pengujian Titer Antibodi Anti Anti-idiotipe (Ab3)terhadap
Isolat A/Goose/Bojonggenteng/IPB2-RS/2006 dengan Uji SN... 91
9 Prosedur Polymerase Chain Reaction (PCR) Metode Konvensional .. 92
10 Prosedur Uji Agar Gel Presipitasi (Agar Gel Presipitation = AGP).... 95
11 Prosedur Uji Hambatan Hemaglutinasi (Hemaglutination Inhibition
Test = HI ) ………... 96
12 Prosedur Pemurnian Imunoglobulin G (IgG) ... 98 13 Prosedur Sodium Deodecyl Sulphate Polyacrilamide Gel
Electrophoresis SDS-PAGE ……... 99
I PENDAHULUAN
1.1 Latar Belakang
Penyakit flu burung atau Avian Influenza (AI) adalah penyakit zoonosa yang sangat fatal. Penyakit ini menginfeksi saluran pernapasan unggas dan juga mamalia. Penyebab penyakit ini adalah virus influenza tipe A termasuk dalam famili
Orthomyxoviridae (ICTV 2006). Virus ini mempunyai galur bervariasi yaitu 16 antigen hemaglutinin (HA) dan 9 neuraminidase (NA) (Fouchier 2005). Penyakit AI termasuk daftar list A dalam Office International Des Epizooties (OIE) (OIE 2008) dan merupakan penyakit eksotik karena sebelumnya tidak pernah ditemukan di Indonesia.
Wabah AI H5N1 mulai terjadi pada tahun 1997 di Hongkong kemudian menyebar ke Korea Selatan, Jepang, Thailand, Filipina, Korea Utara, Kamboja, Siberia, Romania, dan Turki. Virus ini bersifat sangat patogen dan zoonosis karena dapat menginfeksi unggas dan manusia (Swayne 2004). Virus influenza berbentuk pleiomorfik yaitu filamen atau sferoid (bola) dengan diameter 80-120 nm (Harris et al. 2006).
Kasus AI H5N1 di Indonesia pertama kali dilaporkan pada bulan Agustus 2003, menyerang beberapa peternakan ayam ras komersial di Jawa Barat dan Jawa Tengah. Direktur Jenderal Peternakan pada tanggal 25 Januari 2004 dan dengan Surat Keputusan Menteri Pertanian Republik Indonesia Nomor 96/KPTS/PP.620/2/2004 tanggal 3 Pebruari 2004 tentang Pernyataan Berjangkitnya Wabah Penyakit Hewan Menular
sudah banyak menelan korban jiwa manusia. Departemen Kesehatan Republik Indonesia melaporkan bahwa jumlah penderita flu burung pada manusia sampai Desember 2009 sebanyak 161 orang diantaranya meninggal dunia sebanyak 134 orang (tingkat kematian 81.71 %) (FAO 2009; WHO 2009). Pola penularan virus ini pada manusia belum diketahui dengan pasti. Keadaan ini mengkhawatirkan akan terjadinya pandemi AI.
Pemerintah Indonesia melakukan upaya penanganan AI berupa 9 (sembilan) langkah strategis dalam rangka pengendalian wabah AI tersebut Salah satunya adalah vaksinasi (Ditjennak 2008). Vaksinasi diyakini sebagai salah satu cara untuk mengurangi kasus klinis penyakit AI dan secara langsung mengurangi kontaminasi lingkungan oleh virus AI (Naipospos 2004) dan sejak tahun 2004 Indonesia sudah menggunakan 400 juta dosis vaksin AI (Bouma et al. 2009).
Vaksin AI yang digunakan di Indonesia saat ini adalah vaksin AI yang telah diinaktifkan Pembuatan vaksin AI umumnya dilakukan dengan menyuntikkan virus pada telur ayam berembrio (TAB) (OIE 2008) atau dibiakkan pada kultur jaringan (sel) dengan menggunakan sel primer Chicken Embrio Fibroblast (CEF) atau sel lestari Madin Darby
Canine Kidney (MDCK). Virus AI ditumbuhkan pada TAB yang tidak mengandung
virus atau patogen apapun yang dikenal dengan istilah Specific Pathogen Free (SPF). Virus AI juga dapat ditumbuhkan sel MDCK karena virus influenza sangat mudah bereplikasi pada sel tersebut sehingga dapat digunakan untuk produksi vaksin influenza
(Liu et al. 2009). Virus AI yang telah ditumbuhkan selanjutnya diinaktifkan dengan bahan kimia (beta-propiolakton) untuk dijadikan vaksin (OIE 2008). Kendalanya vaksin dibuat dari virus yang virulen, maka ada kemungkinan masih terdapat vaksin yang dapat menimbulkan kasus penyakit dan juga membahayakan pekerja laboratorium yang memproduksinya.
mengekspresikan beberapa kumpulan idiotipe di daerah variable yang akan dikenali oleh epitop dari antigen yang disuntikkan. Antibodi (Ab1) bila disuntikkan kepada hewan lain, maka kumpulan atau populasi antibodi yang mengenalinya disebut antibodi anti-idiotipe (Ab2) (Vizcaino 2004).
Penggunaan vaksin antibodi anti-idiotipesebagai vaksin alternatif untuk penyakit-penyakit yang disebabkan oleh agen infeksius yang ganas, berbahaya dan sulit dibiakkan. Vaksin antibodi anti-idiotipe juga tidak mengandung resiko adanya agen infeksius yang dapat menimbulkan penyakit pada hewan yang divaksinasi. Antibodi anti-idiotipe dapat diproduksi dalam jumlah banyak dengan biaya produksi yang lebih murah. Antibodi anti-idiotipe yang hanya bereaksi terhadap epitop tunggal agen infeksius mampu memberikan perlindungan protektif terhadap antigen yang memiliki banyak epitop, selain itu antibodi anti-idiotipe juga mampu meniru sifat antigenik sehingga dapat digunakan sebagai imunogen yang dapat menimbulkan respon spesifik terhadap agen infeksius (Lin & Zhou 1995).
1.2 Rumusan Permasalahan
Penyakit Avian Influenza merupakan penyakit yang menyebabkan kerugian ekonomi yang cukup besar karena dapat menyebabkan kematian massal berbagai macam galur unggas sampai mencapai angka kematian (mortalitas) 100% dalam waktu relatif singkat dan dapat menular pada hewan lain juga manusia (zoonosis).
Pemerintah Indonesia mencanangkan sembilan langkah strategis dalam rangka pengendalian dan pemberantasan penyakit AI. Sembilan langkah strategis tersebut meliputi (1) penerapan biosekuriti secara ketat, (2) depopulasi selektif di daerah tertular, (3) vaksinasi, (4) pengendalian lalu lintas ternak unggas, (5) surveilans dan penelusuran, (6) peningkatan kesadaran masyarakat (public awarness), (7) pengisian kembali (restocking) unggas, (8) stamping out di daerah tertular baru, dan (9) monitoring, pelaporan dan evaluasi (Ditjennak 2008).
oleh suatu negara. Vaksinasi tampaknya akan semakin dipilih karena berbagai pertimbangan antara lain pertimbangan ekonomi, tindakan karantina, eradikasi atau
stamping out yang dilakukan secara berdiri sendiri tidak menjamin keamanan unggas, khususnya unggas-unggas yang dipelihara dengan densitas tinggi pada daerah yang sudah bersifat endemik. Disisi lain pertimbangan etika internasional, khususnya berkaitan dengan penyediaan bahan pangan yang aman dan keamanan lingkungan bagi seluruh makhluk hidup (Wibawan et al. 2006).
Indonesia menerapkan vaksinasi sebagai salah satu strategi kebijakan
penanggulangan AI, hal ini merupakan peluang bisnis bagi kalangan swasta untuk
mendatangkan vaksin dari luar negeri dalam rangka memenuhi kebutuhan vaksin bagi
para peternak maupun industri perunggasan di Indonesia. Keadaan ini berdampak
masuknya bermacam-macam vaksin AI konvensional produksi luar negeri dengan
berbagai subtipe (H5N1, H5N2, dan H5N9) dan strain (Mexico, Wisconsin, dan England)
dan vaksin rekombinan atau GMO (Geneticcally Modified Organism).
Vaksinasi AI di Indonesia saat ini menggunakan vaksin inaktif yang dapat
beresiko masih adanya virus virulen akibat inaktifasi yang tidak sempurna. Penggunaan
vaksin anti-idiotipe selain sebagai vaksin alternatif untuk penyakit-penyakit yang
disebabkan oleh agen infeksius yang ganas, berbahaya dan sulit dibiakkan juga tidak
mengandung resiko adanya agen infeksius yang dapat menimbulkan penyakit pada hewan
yang divaksinasi. Antibodi anti-idiotipe dapat diproduksi dalam jumlah banyak sehingga
biaya produksi menjadi lebih murah. Antibodi anti-idiotipe yang hanya bereaksi terhadap
epitop tunggal agen infeksius mampu memberikan perlindungan protektif terhadap
antigen yang memiliki banyak epitop, antibodi anti-idiotipe juga mampu meniru sifat
antigenik sehingga dapat digunakan sebagai imunogen yang dapat menimbulkan respon
1.3 Maksud dan Tujuan
Maksud dan tujuan penelitian ini adalah:
1. Mengembangkan penggunaan antibodi anti-idiotipe sebagai kandidat vaksin untuk pencegahan Avian Influenza.
2. Mengetahui fenomena kekebalan hasil vaksinasi menggunakan vaksin antibodi anti-idiotipe dan vaksin Avian Influenza yang beredar.
1.4 Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan suatu metode pengembangan antibodi anti-idiotipe yang efektif, protektif dan aman.
1.5 Hipotesis
Hipotesis dalam penelitian ini adalah :
1. Antibodi anti-idiotipe AI bersifat imunogenik dan mampu menginduksi terbentuknya antibodi yang berikatan secara homolog dengan antigen virus AI.
2. Antibodi anti-idiotipe AI dapat digunakan sebagai kandidat vaksin.
II TINJAUAN PUSTAKA
2.1 Antibodi
Respon imun akan terjadi dalam tubuh hewan yang terpapar oleh suatu antigen. Respon humoral tubuh yang terinfeksi akan menghasilkan antibodi. Antibodi merupakan suatu molekul protein atau globulin yang diproduksi oleh sel B dan saling berikatan secara spesifik dengan antigen. Antibodi ditemukan pada darah atau kelenjar tubuh vertebrata lainnya, dan digunakan oleh sistem kekebalan tubuh untuk mengidentifikasikan dan menetralisasikan benda asing seperti bakteri dan virus. Molekul antibodi adalah globulin, maka umumnya dikenal sebagai imunoglobulin (Ig). Ada 5 kelas utama imunoglobulin dalam serum yaitu IgG, IgA, IgM, IgD dan IgE (Alberts et al
2002; Roitt 2003). Bila serum protein dipisahkan dengan cara elektrophoresis, maka imunoglobulin ditemukan terbanyak dalam fraksi globulin gama, meskipun ada beberapa imunoglobulin yang juga ditemukan dalam fraksi globulin alfa dan beta (Bratawidjaja 2002).
Semua molekul imunoglobulin mempunyai 4 rantai polipeptida yang terdiri dari dua pasang rantai polipeptida berat (heavy = H) dan dua rantai ringan (light = L) yang identik. Keempatnya bergabung melalui ikatan disulfida antar rantai. Struktur molekul antibodi berbentuk seperti huruf “Y”, masing-masing mempunyai daerah variabel (VH dan VL) dan daerah konstan (CH dan CL). Fragmen imunoglobulin yang identik disebut Fab (Fragment antigen binding) yang merupakan bagian imunoglobulin yang mengikat antigen serta bereaksi dengan determinan antigen dan hapten. Bagian tunggal imunoglobulin disebut Fc (Fragment crystallizable) oleh karena mudah dikristalkan. Daerah variabel (V) tersusun dari sekitar 110 sampai 130 asam amino, merupakan gugus NH2 sebagai tempat ikatan antara rantai H dan L. Daerah konstan C pada rantai H meliputi daerah aktivasi komplemen dan molekul reseptor Fc dari berbagai jenis sel (Bratawidjaja 2002; Roitt 2003).
lamda ( ) yang terdiri atas 230 asam amino, sedangkan rantai berat yang terdiri dari 450-600 asam amino mempunyai lima isotipe berbeda yang membagi imunoglobulin menjadi lima klas yang berbeda dengan fungsi yang berbeda-beda pula (IgG, IgM, IgA, IgE, IgD); (2) determinan allotypic, dibedakan dari produk gen pada lokus yang sama (IgG1, IgG2a, IgG2b); dan (3) determinan idiotypic, dihubungkan dengan spesifisitas ikatan antigen (Saldanha 2000) (Gambar 1).
Gambar 1 Tiga Kelas Determinan Antigenik (Sumber: Saldanha (2000))
Rantai-rantai pada molekul antibodi tersebut dapat dipisahkan satu sama lain dengan mereduksi ikatan S-S atau dengan pengasaman. Pada IgG yang merupakan tipe antibodi terbanyak, daerah engsel yang terpapar memanjang oleh adanya kandungan prolein yang tinggi, karena itu mudah terkena efek proteolitik; molekul akan terpotong oleh papain menjadi dua fragmen Fab yang identik, masing-masing mengandung satu tempat pengikatan antigen dan fragmen ketiga yaitu Fc yang tidak mempunyai kemampuan mengikat antigen. Pepsin memotong pada tempat yang berbeda, melepaskan Fc dari bagian molekul lainnya berupa fragmen 5S yang besar, yang dikenal sebagai F(ab)2. Fragmen ini mampu mengikat antigen seperti antibodi asal dan masih bersifat divalen. Daerah spesifik untuk berikatan dengan antigen disebut paratop dan mengekspresikan beberapa kumpulan idiotop yang mampu meningkatkan produksi antibodi (Roitt 2003).
Allotypic,
variasi asam amino pada lokus yang
Idiotypic, variasi dihubungkan
Menurut Roitt (2003) dapat dibuat antiserum yang spesifik terhadap molekul antibodi individual dan dapat membedakan antara satu antibodi monoklonal dengan lainnya tanpa tergantung dari struktur isotipik maupun alotipik. Antiserum tersebut dapat menetapkan determinan individual yang khas untuk tiap antibodi dan disebut idiotipe. Determinan idiotipe ini terletak di daerah variabel dari antibodi dan berkaitan dengan daerah hipervariabel.
2.2 Antibodi Anti-idiotipe
Idiotope adalah determinan antigen tunggal pada regio variabel molekul antibodi yang dapat ditemukan pada sel B dan sel T (Kennedy et al. 1983). Lokasi idiotope pada sisi pengikat antigen, pada rantai berat maupun pada rantai ringan antibodi, namun kebanyakan terletak pada rantai berat (Ban et al. 1994).
Idiotipe adalah kumpulan idiotope atau epitop spesifik, diekspresikan sebagai reseptor antigen pada sel B dan sel T. Jerne (1985) membuat suatu teori tentang jaringan idiotipik, bahwa imunisasi dengan suatu antigen dapat menginduksi antibodi spesifik terhadap antigen (Ab1). Antibodi yang dihasilkan dari antigen eksternal disebut antibodi idiotipe (Ab1), antibodi yang dihasilkan oleh Ab1 adalah antibodi anti-idiotipe (Ab2), antibodi yang dihasilkan Ab2 adalah antibodi anti anti-idiotipe (Ab3), dan seterusnya, sehingga pada akhirnya dapat menginduksi terbentuknya serangkaian autoantibodi yang dapat saling mengenali satu sama lain membentuk suatu jaringan idiotipik.
Gambar 2 The idiotypic network: a. Menurut teori jaringan idiotipik dari Jerne, imunisasi dengan antigen dapat mengakibatkan tidak hanya generasi antigen-antibodi spesifik (Ab1) tetapi juga ke antibodi yang mengenali Ab1. Hal ini terjadi karena struktur unik (idiotipe) dari tempat pengikatan antigen dari Ab1 merangsang sistem kekebalan tubuh untuk menghasilkan Ab2 yang meniru struktur antigen. Mekanisme yang sama menghasilkan Ab3. Ab1 dan Ab3 memiliki kapasitas mengikat serupa dan dalam banyak kasus, urutan asam aminonya identik mengikat tempat antigen; b. Seperti yang juga dikemukakan oleh Jerne, struktur unik dalam rangka Ab1 dapat memicu jaringan idiotipik.
(Sumber: Shoenfeld (2004))
Antibodi anti-idiotipe (Ab2) yang memiliki karakteristik serologik internal image sangat potensial digunakan sebagai antigen dalam serodiagnostik, preparasi vaksin atau modulasi respon imun untuk mengontrol infeksi (Zhou et al. 1994). Antibodi anti-idiotipe juga dapat digunakan sebagai prekusor awal sistem imun inang terhadap agen infeksius. Pemberian anti-idiotipe pada simpanse sebelum pemberian antigen HBs meningkatkan titer antibodi terhadap HBs dibandingkan dengan tanpa pemberian anti-idiotipe (Kennedy et al. 1984). Menurut Suartha (2001), antibodi anti-idiotipe mampu memberikan perlindungan 88.8% terhadap serangan bakteri Streptococcus Group C (SGC) ganas.
Antibodi anti-idiotipe juga dapat digunakan sebagai antigen pengganti pada imunisasi dengan antigen yang sulit diperoleh dalam jumlah yang banyak (Roitt 2003). Antibodi anti-idiotipe dapat diproduksi dengan mudah dalam jumlah yang banyak, kesulitan yang berhubungan dengan tenaga, biaya dalam penyediaan antigen dari agen penyakit dapat dieliminasi, bahaya penyebaran agen infeksius dalam pelaksanaan di lapangan dapat dihindari (Lin & Zhou 1995).
Antibodi anti-idiotipe dapat digunakan sebagai vaksin karena dapat meningkatkan respon kebal dari vaksin konvensional yang semula tidak efektif atau lemah (Huang et al.
1988). Paryati et al (2006), mengatakan antibodi anti-idiotipe mampu menginduksi kadar antibodi protektif terhadap rabies. Antibodi anti-idiotipe juga dapat mengurangi efek klinis yang merugikan dari penggunaan vaksin konvensional (Clark et al. 1996), mampu memberikan kekebalan protektif pada sistem imun prematur (Huang et al. 1988), protektif menghambat penyebaran secara vertikal infeksi suatu mikroorganisma (Kennedy et al. 1996). Vaksin antibodi anti-idiotipe juga dapat merangsang klon imun yang toleran dan tersembunyi (McNamara et al. 1984).
Park et al. (2005) dalam penelitiannya mengembangkan penggunaan antibodi anti-idiotipe terhadap kapsular polisakarida dari Neisseria meningitides group B sebagai vaksin karena belum ada vaksin terhadap penyakit ini yang merupakan penyakit serius penyebab sepsis dan meningitis pada bayi dan balita.
2.4 Virus Influenza
Penyakit flu pada manusia dan hewan disebabkan oleh virus dalam famili
Orthomyxoviridae, memiliki pembungkus (envelope), bersegmen dan memiliki
negative-single strand Rybonucleic acid (RNA). Virus ini berukuran 80-120 nm, merupakan
partikel pleimorphic berukuran sedang yang terdiri atas 2 lapis lemak dan terletak diatas matriks M1 yang mengelilingi genom. Permukaan envelope mempunyai dua tonjolan glikoprotein yaitu hemaglutinin (H) dan neuraminidase (N). Protein lain selain H dan N, virus influenza A juga memiliki protein matriks (M1, M2), nukleoprotein (NP), polimerase (P1, Pb2, PA), non structural (NS1), dan NEP. Masing-masing protein mempunyai fungsi yang berbeda (Tabel 1)(Mulyadi & Prihatini 2005).
Sampai saat ini famili Orthomyxoviridae terdiri dari 5 genus yaitu Influenzavirus
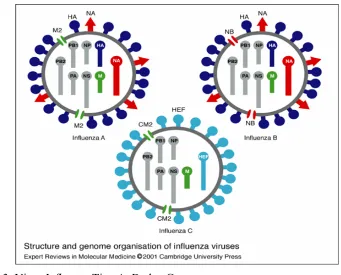
A, Influenzavirus B, Influenzavirus C (tiga genus ini biasa disebut dengan influenza tipe A, B, dan C), Thogotovirus dan Isavirus. Hanya Genus Influenzavirus A yang menginfeksi unggas (Capua & Alexander 2009). Virus influenza tipe A dan B memiliki 8 segmen RNA, namun virus influenza tipe C hanya memiliki 7 segmen (Gambar 3) (Hoffmann et al. 2000).
Tabel 1 Protein Influenza A Protein Tempat (perkiraan jumlah
virion)
Fungsi
Hamaglutinin (HA) Permukaan (500) Perlekatan sel dan penetrasi, aktivitas penyatuan (fusi)
Neuraminidase (NA) Permukaan (100) Pelepasan virus, aktivitas enzim
Membran/matrik (M1)
Di dalam (interna) (3000) Struktur pembungkus (envelope) utama protein, pertemuan virus
M2 Permukaan (20-60) Virus tidak dibungkus dan pertemuan, hubungan ion
Nucleoprotein (NP) Di dalam (interna) (3000) Berkaitan dengan RNA dan protein polymerase
Polymerase (PB1,PB2,PA)
Di dalam (interna) (30-60) Replikasi RNA dan transkripsi
NS1 Nonsruktural(sel terinfeksi)
Pengaturan replikasi virus
NEP Di dalam (interna) (130-200)
Faktor ekspor inti (nuclear)
Gambar 3 Virus Influenza Tipe A, B, dan C (Sumber: Hoffmann et al. (2000))
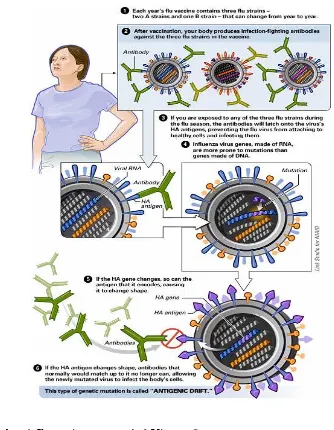
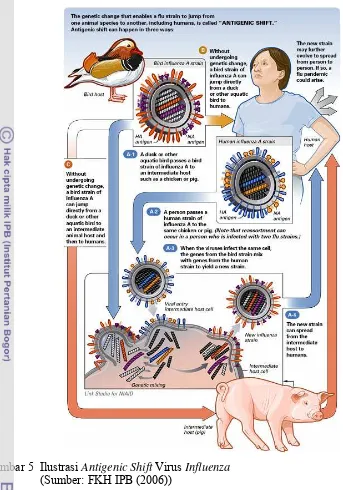
Virus influenza A mempunyai sifat mudah berubah. Antigen permukaan yang dimiliki virus influenza tersebut dapat berubah secara periodik yang lebih dikenal dengan istilah antigenic drift (mutasi titik/minor) dan antigenic shift (pergeseran genetik/mutasi mayor).Antigenic drift merupakan perubahan yang terjadi akibat mutasi genetik struktur protein permukaan virus, sehingga antibodi yang telah terbentuk oleh tubuh akibat vaksinasi sebelumnya tidak dapat mengenali keberadaan virus tersebut, sedangkan
antigenic shift merupakan perubahan genetik virus yang memungkinkan virus ini
Gambar 4 Ilustrasi Antigenic drift Virus Influenza
Gambar 5 Ilustrasi Antigenic Shift Virus Influenza (Sumber: FKH IPB (2006))
Berbeda dengan virus influenza tipe A, virus influenza tipe B tidak diklasifikasikan ke dalam subtipe dan hanya menyerang manusia. Namun, virus ini telah diketahui dapat menginfeksi anjing laut. Virus influenza tipe B dapat menyebabkan epidemi pada manusia, namun tidak sampai menyebabkan pandemi. Virus influenza tipe C, seperti yang telah disebutkan sebelumnya, hanya memiliki 7 segmen RNA, tidak seperti virus influenza tipe A ataupun tipe B yang memiliki 8 segmen. Virus influenza
influenza tipe A dan B, akan tetapi kedua segmen tersebut digantikan oleh glikoprotein tunggal yang disebut dengan haemagglutinin-esterase-fusion (HEF). Virus influenza tipe C hanya menyebabkan gejala penyakit ringan saja dan tidak menyebabkan epidemi maupun pandemi penyakit pada manusia (Nicholson et al. 1998).
2.5 Virus Avian Influenza (AI)
Avian Influenza (AI) menyebabkan angka kematian yang tinggi pada ayam di
Italia pada tahun 1878. Namun baru diketahui pada tahun 1955 bahwa penyebab fowl plague sebenarnya adalah virus AI yang memiliki komposisi gen yang serupa (hampir identik) dengan virus influenza manusia.
Virus AI adalah virus influenza tipe A, pada awalnya hanya ditularkan oleh unggas. Unggas tersebut adalah burung, bebek, ayam, selain itu dapat juga ditularkan oleh beberapa hewan lain seperti babi, kuda, anjing laut, ikan paus, musang, dan kucing. Data lain menunjukkan penyakit ini bisa terdapat diburung puyuh dan burung onta. Penyakit ini ditularkan dari burung ke burung, tetapi dapat juga menular ke manusia (Mulyadi & Prihatini 2005). Keberadaan virus AI H5N1 pada unggas air di Indonesia telah dibuktikan dengan ditemukannya isolat dari unggas air di daerah Jawa Barat (Susanti 2008) dan di kucing (Murtini et al. 2008).
Berdasarkan atas patogenitasnya, virus AI dibedakan menjadi 2 bentuk yaitu Low Pathogenic Avian Influenza (LPAI) dan Highly Pathogenic Avian Influenza (HPAI). Pada umumnya virus AI subtipe H1-H4, H6, H8-H15 ada dalam bentuk LPAI dan umumnya menyebabkan sedikit gejala klinis atau bahkan tidak memperlihatkan gejala klinis sedikitpun. Sifat mudah mutasi dari virus ini menyebabkan keganasannya ditentukan oleh waktu, tempat dan inang yang terinfeksi. Artinya walaupun sama-sama H5 yang menginfeksi belum tentu menunjukkan tingkat keganasan yang sama (Russel & Webster 2005). Menurut Capua dan Alexander (2009), hanya virus AI subtipe H5, H7 dan H10 yang terlihat sebagai penyebab HPAI tapi tidak semua sub tipe H5, H7 dan H10 bersifat virulen.
bagian terbesar dari spike yaitu 80 % dan NA sebesar 20 %. Struktur HA dan NA menentukan subtipe dari virus AI, sedangkan NP dan M digunakan untuk membedakan antara virus influenza A dengan B atau C (Nicholson et al. 1998; Anonim 2010). RNA virus influenza tipe A dapat dilihat pada Gambar 6.
Gambar 6 RNA Virus Influenza A
Angka kematian hewan yang terinfeksi virus LPAI sangat rendah bila tidak terjadi infeksi sekunder. Beberapa strain LPAI mampu bermutasi di bawah kondisi lapang menjadi virus HPAI. Virus HPAI bersifat sangat infeksius dan fatal pada unggas. Virus HPAI dapat menyebabkan kematian hingga 100% dalam waktu yang cepat pada unggas dengan atau tanpa memperlihatkan gejala klinis, dan ketika ini terjadi, maka penyakit dapat menyebar dengan cepat antar flock.
Virus influenza yang sangat virulen (H5N1) dapat hidup di air sampai 4 hari pada suhu 22o C dan lebih dari 30 hari pada 0o C, di dalam kotoran dan tubuh unggas yang sakit virus dapat bertahan lebih lama, virus akan mati dengan pemanasan 60o C selama 30 menit atau 56o C selama 3 jam, deterjen, desinfektan (formalin, iodin) (Horimoto & Kawaoka 2001; Cucunawangsih 2006).
2.6 Patogenesis Avian Influenza
2.6.1 Reseptor Virus Avian Influenza
Penularan virus influenza A dapat terjadi antar spesies termasuk manusia, namun virus AI tidak efisien dalam replikasi pada sel manusia, demikian juga sebaliknya, virus
influenza pada manusia tidak efisien replikasi pada unggas. Hal ini disebabkan oleh perbedaan reseptor yang dimiliki oleh masing-masing sel tersebut. Ikatan pada reseptor merupakan awal patogenesitas virus AI. Virus akan masuk ke sel inang melalui endositosis yang diperantarai oleh reseptor (Elton et al. 2001; Rahardjo 2004).
Reseptor yang dimiliki oleh sel manusia berupa N-acetylsialic acid yang mengikat galaktosa dengan ikatan alfa 2,6 atau disingkat NeuAcα2,6Gal (asam sialat-α2,6), sedangkan pada unggas dan kuda, senyawa galaktosa diikat pada alfa 2,3 atau disingkat NeuAcα2,3Gal (asam sialat-α2,3). Kebanyakan hewan mempunyai reseptor mirip dengan unggas seperti paus dan anjing laut. Khusus untuk babi, sampai saat ini satu-satunya hewan yang mempunyai kedua macam reseptor tersebut, dalam arti bahwa babi sensitif terhadap AI maupun virus influenza manusia (Nicholson et al. 1998; Suzuki et al. 2000). Perbedaan reseptor ini korelasinya dengan letak asam amino nomer 226 yaitu pada virus
influenza manusia diisi oleh leusin (Leu), sedangkan pada pada AI dan virus influenza
pada kuda (Equine Influenza) diisi oleh glisin (Gln) (Rahardjo 2004).
2.6.2 Mekanisme Infeksi Virus Avian Influenza
Mekanisme infeksi virus influenza dimulai dengan perlekatan virus pada permukaan membran plasma. Reseptor untuk virus influenza adalah sialoglycolipid atau
gangliosides atau sialoglycoprotein. Terminal sialic acid akan dikenali oleh hemaglutinin (HA) yang berperan dalam perlekatan virus. Kedudukan reseptor virus pada bagian distal globular hemaglutinin, yaitu daerah molekul yang menunjukkan sedikit perbedaan yang dikelilingi oleh 3 tempat antigen yang berbeda. Virus akan masuk ke dalam sel dengan bantuan ikatan paku HA pada mukoprotein yang mengandung terminal N-acetyl neuraminic acid (NANA = sialic acid) (Manugerra & Hannoun 1999).
Partikel virus setelah melekat akan ditelan melalui proses endositosis dan virus lewat suatu lubang selubung akan masuk ke dalam gelembung endositotik dan akhirnya endosom. mengatakan secara berangsur-angsur lisosom akan menyatu pH akan menurun (pH kira-kira 5). Protein HA akan berikatan dengan reseptor yang terdapat dinding sel inang. Siklus replikasi terjadi dalam saluran pernapasan dan atau saluran pencernaan dengan mengeluarkan bagian dari virus yang bersifat menimbulkan infeksi (Rahardjo 2004). Protein virus eksternal seperti HA yang tahan terhadap degradasi enzim (protease). Protein HA akan mengalami perubahan pada saat kondisi pH yang cukup asam tersebut, yaitu dengan membuka bagian hydrophobic sub unit HA2 sehingga memungkinkan terjadinya penyatuan antara membran endosomal seluler dan lapisan lemak ganda (lipid bilayer) virus. Untuk virus influenza tipe A protein M2 memungkinkan destabilization lapisan protein M1. Virus akan masuk pada saat nukleokapsid dilepaskan ke dalam sitoplasma seluler. Penghambatan masuknya virus dapat bervariasi tergantung pada tingkat kekebalan dan bahan kimia. Pengaktifan pH oleh aliran ion akan membuat protein M2 menjadi penting dalam proses uncoating (pelepasan selubung). Spesifik target rangkaian asam nukleat (sequence nucleat) pada nukleoprotein (NP) akibat translokasi nukleokapsid ke dalam nukleus (Manugerra & Hannoun 1999)
seharusnya dalam bagian untuk menghalangi translasi seluler mRNA. Translasi ada dalam sitoplasma dimana protein virus disintesa. Ini yang menjalani glikosilasi seperti HA dan NA, lewat ke dalam retikulum endoplasmik dan kemudian Golgi dan trans-Golgi apparatus. Pada jalur ini glikoprotein influenza dilekatkan ke dalam lipid bilayer sampai pada permukaan sel. Protein virus yang lain akan datang di bawah membran sel plasma melalui difusi yang sederhana. Virion dibentuk oleh kuncup (budding) pada permukaan membran plasma.
Menurut Garman dan Laver (2004), hemaglutinin adalah sebuah protein yang mengalami glikosilasi dan asilasi (glycosylated and acylated protein) terdiri dari 562-566 asam amino yang terikat dalam sampul virus. Kepala membran distalnya yang berbentuk bulat, daerah eskternal yang berbentuk seperti tombol dan berkaitan dengan kemampuannya melekat pada reseptor sel, terdiri dari oligosakharida yang menyalurkan derivat asam neuroaminic. Daerah eksternal (exodomain) dari glikoprotein transmembran yang kedua, neuroamidase (NA), melakukan aktivitas ensimatik sialolitik (sialolytic enzymatic activity) dan melepaskan progeni virus yang terjebak di permukaan sel yang terinfeksi sewaktu dilepaskan. Fungsi ini mencegah tertumpuknya virus dan mungkin juga memudahkan gerakan virus dalam selaput lendir dari jaringan epitel yang menjadi sasaran. Selanjutnya virus pun akan menempel ke sasaran. Ini membuat neoroamidase merupakan sasaran yang menarik bagi obat antivirus.
virus dan replikasi RNA genomik melalui proses yang rumit yang secara cermat diatur oleh faktor virus dan faktor sel. Protein polimerase yang tergantung pada RNA (RdRp) dibentuk oleh sebuah kompleks (gabungan) dari PB1, PB2 dan protein PA virus, dan memerlukan RNA (RNP) yang terbungkus (encapsidated RNA (RNPs)) untuk tugas ini. Protein virus dan perangkaian nukleokapsid yang membawa RNA genomik yang sudah ter-replikasi setelah terjadi translasi, virion-virion progeni tumbuh dari membran sel yang di dalamnya sudah dimasukkan glikoprotein virus sebelumnya. Penataan antara nukleokapsid berbentuk lonjong dan protein pembungkus virus dimediasi oleh protein matrix-1 virus (M1) yang membentuk struktur serupa cangkang tepat di bawah pembungkus virus. Reproduksi virus di dalam sel yang mudah menerimanya berlangsung cepat (kurang dari sepuluh jam) dan dengan proses yang efisien.
Gambar 7 Replikasi Virus Influenza (Sumber: Rahardjo (2004))
Keterangan gambar:
(3) Segmen-segmen tersebut masuk ke dalam ini sel (nukleus) dan mengalami transkripsi, untuk mengubah bentuk (-) RNA menjadi (+) RNA.
(4) Sebagian segmen keluar kembali ke sitoplasma untuk mempersiapkan protein selubung untuk dipakai oleh virus baru yang akan dihasilkan. Protein yang dimaksud adalah protein hemaglutinin, neuraminidase, matriks dan protein nonstruktural.
(5) Delapan segmen yang berada di inti sel ditambah dengan segmen RNA yang masih tersisa di sitoplasma melakukan replikasi yaitu perbanyakan RNA. Berbeda dengan virus RNA lainnya, dimana replikasinya terjadi di luar inti sel. Dengan berlangsung di dalam inti sel, AI menggunakan bahan-bahan yang diperlukan dari dalam inti sel inang. Proses ini memudahkan terjadinya proses Antigenic drift dan antigenic shift.
(6) Segmen RNA yang sudah mengalami replikasi, keluar ke sitoplasma untuk dibungkus dengan protein HA, NA dan M serta NS, menjadi anak AI yang siap dilepas dari sel inang. Untuk bisa keluar dari sel inang, virus baru ini akan menempel pada reseptor yang terdapat dalam sel inang. Penempelan ini dilakukan oleh protein neuraminidase bukan hemaglutinin seperti pada saat masuk ke sel. Proses ini bisa berlangsung selama 2 jam setelah infeksi (Rahardjo 2004).
2.7 Vaksin dan Vaksinasi Avian Influenza
Salah satu kebijakan pemerintah dalam mengendalikan penyakit AI di Indonesia adalah vaksinasi yang berpedoman pada ketentuan Badan Kesehatan Hewan Dunia (OIE 2004; OIE 2008). Program vaksinasi merupakan 1 (satu) dari 9 (sembilan) langkah strategi penanggulan HPAI yang diterapkan Pemerintah Indonesia sejak tahun 2004. Pada pelaksanaannya, kebijakan vaksinasi ini diterapkan dengan : (a) menggunakan vaksin yang sudah mendapatkan registrasi; (b) pada peternakan sektor 1, 2 dan 3 dilakukan secara swadaya; (c) pada peternakan sektor 4 pengadaan vaksin dan operasional vaksinasinya dibantu pemerintah; dan (d) program vaksinasi dilaksanakan dengan mengikuti SOP (Standar Operasional Prosedur) Pengendalian AI yang telah ditetapkan (Ditjennak 2008).
Vaksin AI mengacu pada ketentuan OIE (2008) adalah sebagai berikut:
2. Vaksin AI inaktif konvensional hanya boleh diproduksi dengan menggunakan
seed virus low pathogenic.
3. Vaksin bersifat imunogenik, dilihat dari respon pembentukkan antibodi yang tinggi.
Vaksin yang baik menurut Pyre et al. (2008) adalah vaksin harus potensial, aman, stabil pada suhu ruang, dapat diberikan hanya dengan dosis tunggal, murah serta mampu dibedakan antara hewan vaksinasi dan infeksi secara alam (Differentiation of Infected From Vaccinated Animals/DIVA).
Tabel 3 Persyaratan Vaksin
Vaksin Ideal Homolog Inaktif
Murah Bervariasi tergantung Negara ( 0.01-0-05 US dollar) Vaksin Eropa lebih mahal dari Asia.
Keterangan : RG. Reverse Genetik ; AI. Avian Influenza; ND. New Castle Disease; FP .Fowl Pox; DIVA. Differentiation of Infected From Vaccinated Animals
(Sumber: Pyre et al. (2008))
Kendala dalam pembuatan vaksin yang sering timbul adalah antigenic drift dan
antigenic shift. Dengan alasan tersebut di atas maka vaksin inaktif yang menggunakan isolat lokal merupakan pilihan yang terbaik. Vaksin ini relatif mudah membuatnya dan memerlukan waktu singkat untuk memproduksinya. Namun demikian, vaksin ini perlu dievaluasi tiap tahun dengan mengamati apakah telah terjadi antigenic drift atau
antigenic shift di lapangan. Apabila hal tersebut terjadi, maka diperlukan isolat baru sebagai bibit vaksin.
2009 adalah untuk menghasilkan vaksin yang baik dengan kualitas, efikasi dan keamanan yang tinggi serta potensi yang optimal diperlukan pemilihan master seed baru dengan prinsip kehati-hatian yang tinggi. Untuk memenuhi prinsip kehati-hatian tersebut, ditentukan kriteria master seed baru sebagai berikut:
1. Subtipe H5N1
2. Sifat imunogenesitas tinggi
3. Sifat antigenesitas dengan cakupan geografis yang luas. 4. Sifat genetik antigenik yang stabil.
5. Tingkat proteksi yang tinggi terhadap uji tantang dengan beberapa isolat virus yang berbeda karakter genetik dan antigeniknya (Ditjennak 2009).
Hingga tahun 2009, Indonesia telah menggunakan vaksin AI impor dan produksi dalam negeri yang masih menggunakan master seed Legok 2003 (HPAI H5N1) dan H5N2. Jumlah vaksin AI di Indonesia yang telah mendapat registrasi sementara dari Departemen Pertanian RI adalah sebanyak 24 vaksin (Lampiran 1) yang menggunakan
master seed, yaitu H5N1 (HPAI, isolat lokal, strain Legok), H5N1 (HPAI, isolat lokal, strain Purwakarta), H5N2 (LPAI, strain England N-28), H5N2 (LPAI, strain Mexico 232), H5N2+ND (LPAI, strain England N-28 dan ND strain Lasota), H5N9 (LPAI, strain Wisconsin 68), dan H5N1 reverse genetic (isolat lokal Legok dengan Puerto Rico), dan vaksin vektor (H5N8 dengan FP 89) (Ditjennak 2009).
Strategi vaksinasi AI yang dilakukan di Indonesia berdasarkan prosedur operasional standar pengendalian penyakit AI (Ditjennak 2008) adalah sebagai berikut:
1. Vaksin AI yang digunakan adalah vaksin inaktif yang strain virusnya homolog dengan subtipe virus isolat lokal (H5) baik yang diproduksi secara konvensional maupun rekayasa genetika.
2. Vaksin yang digunakan harus telah mendapatkan nomor registrasi dari pemerintah c.q Direktorat jenderal Peternakan Departemen Pertanian.
3. Strategi vaksinasi dilaksanakan dengan ketentuan sebagai berikut: a. Pada daerah bebas dilarang melakukan vaksinasi;
c. Pada daerah kasus tinggi atau endemis, dilakukan vaksinasi secara tertarget.
4. Pelaksanaan vaksinasi tertarget tersebut dipilih pada populasi tertentu di daerah tertentu dengan kasus tinggi penyakit pada AI pada unggas, terdapat kasus manusia dan atau terdapat peternakan sektor1,2 dan 3 di sekitarnya. 5. Vaksinasi dilakukan 3-4 kali dalam satu tahun, dan atau sesuai petunjuk
produsen yang tertera pada etiket atau brosur. 6. Vaksinasi hanya dilakukan pada unggas yang sehat.
7. Cakupan vaksinasi meliputi seluruh populasi unggas terancam di daerah tertular yakni ayam buras, bebek, itik, entok, kalkun, angsa, burung merpati, burung puyuh, ayam ras petelur dan ayam ras pedaging yang termasuk peternakan sektor 4.
8. Vaksinasi dilakukan oleh petugas dinas dan atau kader/relawan desa terdidik, yang telah dilatih dan telah mengikuti pelatihan vaksinasi (vaksinator).
9. Program vaksinasi dilakukan dibawah pengawasan dokter hewan setempat. Strategi vaksinasi diharapkan dapat menurunkan kerentanan terhadap infeksi virus sekaligus mengurangi pengeluaran virus dari tubuh unggas, baik dari segi jumlah maupun lamanya waktu, sehingga merupakan alat yang tepat untuk menekan terjadinya kasus baru dan sirkulasi virus di lingkungan. Kesuksesan program vaksinasi dapat tercapai apabila vaksinasi dianggap sebagai alat untuk memaksimalkan tindak biosekuriti tanpa mengesampingkan pelaksanaan surveilans agar setiap perubahan antigenik virus yang bersirkulasi dilapangan dapat segera terdeteksi (Capua & Marangon 2006; Maas et al.
2007).
Efek perlindungan pasca vaksinasi merupakan respon kebal terhadap protein hemaglutinin (HA) pada permukaan virus dan atau neuraminidase (NA). Efek perlindungan yang diberikan oleh sebuah vaksin hanya terhadap subtipe HA individual yang terdapat dalam vaksin.
Pemeriksaan serologi dapat dilakukan untuk mengetahui adanya pembentukkan antibodi terhadap virus influenza A yang dapat diamati pada hari ke7 sampai ke 10 pasca infeksi. Pemeriksaan serologik yang dipakai adalah uji hambatan hemaglutinasi
III BAHAN DAN METODE PENELITIAN
3.1 Lokasi dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Terpadu Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner (IPHK) Fakultas Kedokteran Hewan Institut Pertanian Bogor (FKH IPB) dan di Balai Besar Pengujian Mutu dan Sertifikasi Obat Hewan (BBPMSOH) Gunungsindur Bogor. Penelitian dilaksanakan dari bulan Maret 2008 sampai Agustus 2009.
3.2 Bahan dan Alat 3.2.1 Hewan Percobaan
Hewan yang digunakan dalam penelitian ini adalah marmut (Cavia porcellus) dengan berat badan 300-400 gr untuk produksi antibodi poliklonal AI H5N1 (Ab1); kelinci New Zealand White dengan berat badan berat 2.5 kg untuk preparasi antibodi terhadap Ab1 atau antibodi anti-idiotipe (Ab2); ayam petelur strain White Leghorn
Specific Pathogen Free (SPF) umur 4 minggu untuk produksi antibodi terhadap Ab2
(Ab3) atau uji imunogenesitas kandidat vaksin AI (antibodi anti-idiotipe).
Marmut, kelinci dan ayam diberikan pakan berbentuk pelet sesuai dengan standar pakan hewan laboratorium BBPMSOH.
3.2.2 Bahan dan Media
Bahan yang digunakan dalam penelitian ini adalah vaksin Avian Influenza (AI) H5N1 inaktif strain Legok, PCR kit AI (Super ScriptTM III One-Step RT-PCR System with Platinum R Taq DNA Polymerase-Invitrogen), TRIZOLR LS Reagent (Invitrogen),
Ethanol (Merck), Chloroform (Merck), Isoprophil Alcohol (Merck),
Diethilpyrocarbonate (DEPC) (Invitrogen), Primer H5 (Invitrogen) dan N1 (Eurogentec),
Tris Boric Edta (TBE) (Invitrogen), Agarose (Invitrogen), Ethium Bromide (Sigma),
(Millipore-Montage), Polyethilenglycol 6000 (Merck), Bovine Serum Albumin (Sigma),
Sodium Dodecyl Sulfate (Invitrogen), Acrylamide (Invitrogen), Tris HCl (Sigma), NN-methhylene bis acrilamide (Invitrogen), Amonium persulfat (Sigma), Tetra Methyl Etilen Diamin (TEMED)(Invitrogen), Methanol (Sigma), Marker protein (Invitrogen, Promega),
Mercaptoethanol (Sigma), Tris Base (Sigma), Natrium Sitrat (Merck), Amonium Sulfat (Sigma), Enzim pepsin (Sigma), Diethylaminoethyl (DEAE), Cellulose, Asam acetat glacial (Sigma), Comassie blue (Sigma), Imunoglobulin G kontrol (Promega), Freund’s
Complete Adjuvant (FCA) dan Freund’s Incomplite Adjuvant (FIA)(Sigma), alkohol
70%, aquabidest, formaldehyde, Minimum Eagle Media (Gibco), Fetal Bovine Serum
(Gibco), Penicillin Streptomycin (Gibco), Triptose Phosphate Broth (TPB)(BD),
L-Glutamin (Gibco), NaHCO3 (Merck) dan Thioglycollate (TGC) (Difco).
Bahan lain adalah TAB SPF, biakan jaringan MDCK, isolat AI H5N1 strain Legok (2003), isolat AI IPB (2005), isolat AI H5N1 IPB (2007), isolat AI H5N1 IPB (2008), isolat AI H5N1 IPB (2009), dan isolat A/Goose/Bojonggenteng/IPB2-RS/2006 (Susanti 2008).
3.2.3 Peralatan
Peralatan yang digunakan adalah kandang marmut, kelinci dan ayam dan perlengkapan makan dan minum.
Peralatan lain adalah alat suntik (1 ml, 3 ml, 5 ml dan 10 ml), filter (0.45 µm dan 0.22 µm), tabung sentrifus, mikropipet (single dan multichannel), tips, tabung ependorf
3.3 Metode
3.3.1 Reidentifikasi Vaksin AI H5N1
Vaksin AI H5N1 inaktif strain Legok diekstraksi dengan menggunakan pelarut lemak (kloroform atau eter, disentrifugasi kemudian endapannya diambil untuk uji
Reverse Transcriptase-Polymerase Chain Reaction (RT-PCR) (Ditjennak 2007).
Isolasi RNA dilakukan dengan menggunakan metoda TRIZOLR LS Reagent (Invitrogen) sebagai berikut : sebanyak 250 μl vaksin dan 750 μl Trizol dimasukkan kedalam tabung eppendorf 1.8 ml, kemudian dihomogenkan memakai vortex mixer. Larutan diinkubasi selama 5 menit pada suhu kamar (25–30o C), kemudian ditambahkan 500 μl chloroform. Tabung tersebut dihomogenkan selama 15 detik dan diinkubasi pada suhu kamar selama 10 menit, kemudian disentrifus dengan kecepatan 12.000 g pada suhu 2–8o C selama 15 menit. Sebanyak 500 μl fase cair pada supernatan (putih bening) diambil dan dimasukkan kedalam tabung baru. Fase cair tersebut ditambahkan 500 μl
isoprophil alcohol dan diinkubasi selama 10 menit pada suhu kamar. Larutan selanjutnya disentrifus dengan kecepatan 12.000 g pada suhu 2–8o C selama 10 menit. Supernatan hasil sentrifugasi dibuang. Hasilnya adalah endapan RNA. Ke dalam endapan tersebut ditambahkan 1000 μl ethanol 75% dan disentrifus dengan kecepatan12.000 g selama 5 menit. Endapan RNA dikeringkan selama 7 menit di dalam laminar air flow, selanjutnya dilarutkan dengan 10 μl air suling bebas Rnase atau DEPC. Tahap akhir adalah larutan RNA diinkubasikan dalam penangas air 60o C selama 10 menit. Larutan RNA di simpan pada suhu – 20o C sampai dilakukan RT-PCR.
Reverse transcription adalah pembuatan cDNA yang bersifat komplementer
dengan RNA virus, menggunakan enzim reverse transcriptase. Reverse Transcriptase-Polymerase Chain Reaction (RT-PCR) dilakukan dengan metoda Super ScriptTM III One-Step RT-PCR System with Platinum R Taq DNA Polymerase (Invitrogen). Primer yang digunakan untuk mengamplifikasi gen H5 adalah menurut Lee dan Suarez (2004) dan primer N1 (Tabel 4). Reaksi PCR (PCR mix) dibuat sebanyak 50 µl dengan komposisi sebagai berikut : 25 l 2x reaction PCR mix , 2 l Platinum Taq, 5 l RNA template, 1 l
2001: cDNA synthesis 60o C selama 30 menit, predenaturasi 95o C selama 2 menit, selanjutnya 35 siklus terdiri dari denaturasi 95o C selama 40 detik, penempelan 50o–55o C selama 40 detik, ekstensi 72o C selama 1 menit dan post ekstensi 72o C selama 4 menit. Pita DNA spesifik hasil PCR diidentifikasi dengan elektroforesis pada gel agarose 2 %.
Tabel 4 Primer Untuk mengamplifikasi Virus AI H5N1
___________________________________________________________________ Primer Sekuen basa Produk (pb) ___________________________________________________________________
1 H5N1-H5-forward: 5’AAA CAG AGA GGA AAT AAG TTG AAAA ATT’3 55 H5N1-H5-reverse: 5’AAA GAT AGA CCA GCT ACC ATG ATT GC’3
2 H5N1-N1-forward GD: 5'- TTG CTT GGT C(A/G)G CAA GTG C 120 H5N1-N1-reverse Yong: 5'- TGA T(A/G)G TGT CTG TTA TTA TGC C
____________________________________________________________________
pb: pasangan basa
Elektroforesis produk amplifikasi PCR (DNA) dilakukan menggunakan ultrapure
agarose (Invitrogen) 2%. Sebanyak 2 gram agarose dilarutkan dalam 100 ml TBE
buffer, kemudian dipanaskan dalam microwave sampai larutan menjadi jernih. Ethium bromide ditambahkan ke dalam gel hangat selanjutnya gel dituangkan ke dalam dish mupid (sebanyak 50 ml kedalam dish yang besar) dan dibiarkan pada suhu kamar selama 15 menit. Sambil menunggu, sebanyak 250 ml TBE buffer dituangkan ke dalam
mupid electrophoresis. Gel yang beku diletakkan di dalam mupid elektroforesis dengan aliran listrik negatif mengalir ke positif. Sebanyak 2 μl loading dye (BlueJuice Gel Loading-Invitrogen) dan 8 μl produk amplifikasi PCR dicampur dan dimasukkan ke dalam lubang gel. Voltase yang digunakan sebesar 50 Volt selama 45 menit. Pita atau fragmen DNA yang teramplifikasi dilihat dibawah sinar ultaviolet.
3.3.2 Produksi Antibodi Poliklonal Avian Influenza H5N1 (Ab1)
H5N1 inaktif strain Legok (0,5 ml) secara subkutan. Penyuntikan diulang sebanyak 3 kali dengan interval 3 minggu. Keberadaan antibodi dideteksi dengan uji hambatan hemaglutinasi (Hemaglutination Inhibition/HI) (WHO 2002, OIE 2005) dan uji agar gel presipitasi (Agar Gel Precipitationt/AGP). Serum dikoleksi setelah titer antibodi tinggi dalam darah yaitu seminggu setelah imunisasi ke-3.
3.3.2.1 Reidentifikasi Serum Anti AI H5N1 (Ab1)
Reidentifikasi serum marmut dilakukan dengan uji HI dan uji AGP (OIE 2005). Serum marmut diinaktifasi terlebih dahulu dalam penangas air 56o C selama 30 menit dan diabsorbsi dengan sel darah merah ayam pada suhu ruang selama 30 menit, selanjutnya disentrifus dengan kecepatan 1000 g selama 5 menit dan diambil supernatannya untuk selanjutnya di uji HI. Uji hambatan hemaglutinasi adalah sebagai berikut: pada semua lubang microplate 96 lubang dimasukkan pengencer PBS dan pada lubang pertama dimasukkan 25 µl serum. Pengenceran secara seri kelipatan dua sampai dengan lubang 11, selanjutnya ditambahkan sebanyak 25 µl antigen AI H5N1 4 HAU/25 µl. Campuran tersebut diinkubasikan pada suhu kamar selama 30 menit, kemudian ditambahkan sel darah merah ayam SPF 1% sebanyak 25 µl pada semua lubang dan selanjutnya diinkubasikan pada suhu kamar selama 40 menit. Titer antibodi ditentukan dari pengenceran tertinggi serum yang mampu menghambat aglutinasi sel darah merah.
Uji agar gel presipitasi adalah sebagai berikut: agar gel dibuat dengan melarutkan 0.4 g agarose dan 1.2 g Poly Ethylene Glycol (PEG) 6000, 0.1% Na azide dalam 25 ml PBS pH 7.4 dan 25 ml akuades pH 7.4. Larutan ini dipanaskan dalam microwave sampai larut dan warna larutan menjadi bening. Larutan sebanyak 3.75 ml dituangkan pada gelas obyek dan ditunggu sampai mengeras, kemudian dibuat sumur-sumur dengan puncher. Antigen sebanyak 20 µl dimasukkan ke dalam sumur tengah dan antibodi sebanyak 20 µl dimasukkan ke dalam sumur disekelilingnya.
3.3.2.2 Pemurnian Imunoglobulin G Anti AI H5N1 (Ab1)
media (Millipore). Prosep A dilepaskan dari tutup atas dan bawahnya kemudian dimasukkan kedalam spin colomn. Spin column dicuci dengan 10 ml binding buffer, kemudian disentrifus dengan kecepatan 500 g selama 15 menit. Serum marmut di saring dengan menggunakan steriflip GP filter 0,22 µm, selanjutnya sampel serum dilarutkan dengan binding buffer dengan perbandingan 1:1 v/v, lalu dimasukkan kedalam spin column dan disentrifus pada kecepatan 150 g selama 20 menit. Spin colomn dicuci kembali dengan 10 ml binding buffer dan disentrifus dengan kecepatan 500 g selama 5 menit, pencucian dilakukan sebanyak dua kali. Imunoglobulin G di elusi dengan 10 ml buffer dan elusi dilakukan langsung kedalam tabung sentrifus yang berisi 1,3 ml buffer netral, selanjutnya disentrifus dengan kecepatan 500 g selama 5 menit. Larutan yang ada dibawah ditampung dan merupakan IgG. Imunoglobulin G di desalting dengan menggunakan Amicon Ultra 15 dan disentrifus dengan kecepatan 4500 g selama 30 menit. Larutan yang ada diatas ditampung dan merupakan IgG poliklonal.
Reidentifikasi IgG AI H5N1 dilakukan dengan uji AGP dan untuk mengetahui berat molekul IgG dilakukan SDS-PAGE (Hames & Rickwood 1987) dengan menggunakan sistem diskontinyu. Sistem ini terdiri atas gel pemisah dengan konsentrasi 12 % dan gel pengumpul dengan konsentrasi 4 %. Gel diwarnai dengan commassie blue dan estimasi berat molekul protein berdasarkan perbandingan dengan marker umum berat molekul, selanjutnya konsentrasi IgG dihitung dengan menggunakan spektrofotometer ultra violet.
3.3.2.3 Pemotongan Imunoglobulin G AI H5N1 dan Pemurnian Fragmen F(ab)2
Pemotongan Imunoglobulin G (IgG) dari serum marmut ditujukan untuk memperoleh fragmen F(ab)2 dari imunoglobulin. Fragmen F(ab)2, selanjutnya disebut Ab1,akan digunakan untuk merangsang terbentuknya antibodi spesifik terhadap epitop Ab1 pada kelinci. Antibodi yang akan terbentuk oleh Ab1 ini merupakan antibodi anti-idiotipe (Ab2). Pemotongan dilakukan dengan menggunakan enzim pepsin, sehingga akan diperoleh 1 fragmen F(ab)2 divalen yang mengandung 2 Fab dan 1 fragmen Fc.
dengan kecepatan 10.000 g selama 30 menit. Larutan ini kemudian di desalting dengan
Amicon Ultra 15 dengan kecepatan 4500 g selama 20 menit. Larutan ini kemudian di
dialisis dalam PBS pH 8.0 selama 24 jam untuk menghilangkan garam yang terdapat pada larutan protein. Proses dialisis ini akan menyebabkan molekul-molekul garam keluar melalui pori-pori tabung secara bertahap hingga konsentrasi garam di dalam dan di luar tabung dialisis menjadi sama. Hasil dialisis inilah yang akan digunakan sebagai Ab1 untuk mengimunisasi kelinci.
Reidentifikasi dilakukan dengan metode SDS-PAGE. Fragmen F(ab)2 memiliki berat molekul 110 kDa, selanjutnya konsentrasi ditentukan dengan menggunakan spektrofotometer ultra violet.
3.3.3 Produksi Antibodi Anti-Idiotipe (Ab2) Pada Kelinci
Antibodi anti-idiotipe (Ab2) disiapkan dengan cara menyuntik kelinci dengan Ab1 (F(ab)2). Produksi Ig G menggunakan 3 ekor kelinci New Zealand White berat 2.5 kg. Dua ekor kelinci diimunisasi dengan 500 µg Ab1 H5N1 dalam Freund’s Complete
Adjuvant (FCA) secara subcutan dan satu ekor kelinci sebagai kontrol. Imunisasi ulangan dilakukan satu minggu berikutnya dengan menyuntikkan 500 µg Ab1 dalam Freund’s
Incomplete Adjuvant (FIA) secara subcutan. Satu minggu kemudian serum dikoleksi dan identifikasi keberadaan Ab2 H5N1 strain Legok dengan uji AGP. Berat molekul ditentukan dengan metode SDS-PAGE dan konsentrasinya dihitung dengan spektofotometer ultra violet.
3.3.3.1Pemurnian Imunoglobulin G Kelinci Anti-Idiotipe (Ab2)
Pemurnian Imunoglobulin G (IgG) AI H5N1 dari serum kelinci (Ab2) dilakukan dengan menggunakan Montage Antibody purification kit & spin column with Prosep A
media (Millipore). Prosep A dilepaskan dari tutup atas dan bawahnya kemudian