KEE
DALAM
DA
EFEKTIF
M LIMBA
AN PEMI
DEPA
IN
FAN FOR
AH ORGA
ICU PER
ADDE KARTEME
FAKU
NSTITUT
RMULAS
ANIK SE
RTUMBUH
KEMBARAEN PROT
ULTAS PE
T PERTA
BOGO
2011
SI Pseudo
EBAGAI P
HAN TAN
A RISMAWTEKSI TA
ERTANIA
ANIAN BO
OR
1
monas flu
PESTISID
NAMAN
WANANAMAN
AN
OGOR
uorescens
DA HAYA
CABAI
N
ATI
ii
ABSTRAK
ADDE KEMBARA RISMAWAN. Keefektifan Formulasi Pseudomonas fluorescens dalam Limbah Organik Sebagai Pestisida Hayati dan Pemicu
Pertumbuhan Tanaman Cabai
.
Dibimbing oleh GIYANTO.Pseudomonas fluorescens merupakan bakteri saprofitik yang memiliki
kemampuan untuk bertahan dan berkembang pada sisa-sisa bahan organik. Aplikasi di lapangan dihadapkan pada kendala dalam perbanyakan massal yang memerlukan media alternatif untuk pembiakan P. fluorescens, karena penggunaan media laboratorium membutuhkan biaya yang cukup mahal. Tujuan penelitian ini untuk mengetahui formulasi limbah organik sebagai media alternatif bagi pembiakan P. fluorescens serta kaitannya dengan aktivitas P. fluorescens dalam menekan penyakit rebah kecambah dan pemicu pertumbuhan tanaman cabai. Penelitian ini diharapkan mampu menyediakan teknologi pembiakan P.
fluorescens pada media alternatif sehingga mampu menekan perkembangan
patogen Sclerotium rolfsii dan meningkatkan pertumbuhan tanaman cabai. Dalam penelitian ini dilakukan pengujian pertumbuhan koloni P. fluorescens yang dibiakkan pada formulasi limbah air kelapa, air tahu dan pengolahan ikan serta menguji potensi antagonisme P. fluorecens terhadap S. rolfsii secara in-vitro dan
in-vivo. Hasil penelitian menunjukkan bahwa dari sembilan formulasi uji
diperoleh satu formulasi termodifikasi, yaitu formulasi F8 dengan komposisi limbah air kelapa, air tahu dan pengolahan ikan (15:84:1) memiliki potensi antagonis yang baik dalam menekan perkembangan patogen S. rolfsii pada tanaman cabai dengan pengujian in-vitro maupun in-vivo. Modifikasi formulasi F8 dengan penambahan 1% filtrat orok-orok dan aplikasinya melalui perlakuan benih serta penyiraman 5% konsentrasi formulasi seminggu sekali mampu memicu pertumbuhan tinggi tanaman sebesar 25,15% dan jumlah daun sebesar 23,34% pada 6 MST.
Kata kunci : agens hayati, limbah organik, Pseudomonas fluorescens, Sclerotium
rolfsii, cabai.
KEE
DALAM
DA
sebagEFEKTIF
M LIMBA
AN PEMI
gai salah sat
DEPA
IN
FAN FOR
AH ORGA
ICU PER
ADDE K tu syarat un DepartARTEME
FAKU
NSTITUT
RMULAS
ANIK SE
RTUMBUH
KEMBARA Skrips ntuk mempe temen ProteEN PROT
ULTAS PE
T PERTA
BOGO
2011
SI Pseudo
EBAGAI P
HAN TAN
A RISMAW si roleh gelar eksi TanamaTEKSI TA
ERTANIA
ANIAN BO
OR
1
monas flu
PESTISID
NAMAN
WAN Sarjana Per anANAMAN
AN
OGOR
uorescens
DA HAYA
CABAI
rtanian padaN
iiiATI
aiv
Judul Penelitian : Keefektifan Formulasi Pseudomonas fluorescens dalam Limbah Organik Sebagai Pestisida Hayati dan Pemicu Pertumbuhan Tanaman Cabai.
Nama Mahasiswa : Adde Kembara Rismawan NRP : A34062933
Disetujui Dosen Pembimbing
Dr. Ir. Giyanto, MSi. NIP. 19670709 199303 1 002 Diketahui Ketua Departemen Dr. Ir. H. Dadang, MSc. NIP. 19640204 199002 1 002 Tanggal lulus:
v
RIWAYAT HIDUP
Penulis dilahirkan di Ciamis, pada tanggal 01 November 1988 sebagai anak ketiga dari tiga bersaudara pasangan Bapak Bachrul Ulum dan Ibu Aan Hasanah. Penulis menyelesaikan pendidikan dasar di SDN 1 Cipeujeuh Wetan Cirebon pada tahun 2000 dan menyelesaikan sekolah lanjutan tingkat pertama di SLTPN 13 Cirebon tahun 2003. Penulis melanjutkan ke SMAN 1 Babakan Cirebon dan lulus pada tahun 2006. Pada tahun yang sama penulis diterima di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor melalui jalur Undangan Seleksi Mahasiswa IPB (USMI).
Selama menjadi mahasiswa penulis berkesempatan menjadi asisten praktikum mata kuliah Entomologi Umum pada tahun 2009 dan Dasar-dasar Proteksi Tanaman pada tahun 2010. Pada tahun 2008, penulis mengikuti magang di laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Faperta IPB dari bulan Juli hingga Agustus. Dalam bidang organisasi, penulis berkesempatan menjadi pengurus HIMASITA (Himpunan Mahasiswa Proteksi Tanaman) pada periode 2008/2009 sebagai ketua divisi PSDM (Pengembangan Sumber Daya Manusia). Selain itu, penulis juga mengikuti Program Kreativitas Mahasiswa (PKM) pada tahun 2007, 2008 dan 2009.
vi
PRAKATA
Puji syukur penulis panjatkan ke Hadirat Allah SWT, karena berkat rahmat dan hidayah-Nya penulis dapat menyelesaikan skripsi yang berjudul “Keefektifan Formulasi Pseudomonas fluorescens dalam Limbah Organik Sebagai Pestisida Hayati dan Pemicu Pertumbuhan Tanaman Cabai” dengan baik.
Penulisan skripsi ini bertujuan memenuhi syarat untuk memperoleh gelar Sarjana Pertanian. Penelitian dilakukan dari bulan Februari hingga November 2010 di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Institut Pertanian Bogor. Penulisan skripsi ini banyak dibantu oleh berbagai pihak baik secara moril maupun materiil. Oleh karena itu penulis mengucapkan terima kasih kepada:
1. Dr. Ir. Giyanto, MSi. selaku dosen pembimbing yang telah banyak meluangkan waktunya untuk memberikan arahan, masukan, bimbingan, saran serta motivasi selama penulisan skripsi.
2. Prof. Dr. Ir. Aunu Rauf, MSc. selaku dosen penguji tamu yang telah memberikan saran untuk perbaikan skripsi.
3. Ratdiana, SP yang telah membantu dalam mencari pustaka rujukan dan memberi masukan serta saran.
4. Orang tua dan keluarga yang terus memberikan motivasi.
5. Teman-teman, sahabat serta orang terdekat yang senantiasa memberikan dukungan moril.
6. Semua pihak yang telah membantu dalam proses penyelesaian skripsi ini.
Penulis menyadari masih terdapat banyak kekurangan dalam penulisan skripsi ini, untuk itu diharapkan kritik dan saran yang dapat membangun penulis agar lebih baik dalam penulisan-penulisan selanjutnya. Skripsi ini diharapkan bermanfaat bagi pihak-pihak yang berkepentingan.
Bogor, Januari 2011
vii
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix DAFTAR LAMPIRAN ... x PENDAHULUAN ... 1 Latar Belakang ... 1 Tujuan ... 4 Manfaat ... 4 TINJAUAN PUSTAKA ... 5 Pengendalian Hayati ... 5 Pseudomonas fluorescens ... 6 Limbah Organik ... 8
Penyakit Rebah Kecambah pada Cabai ... 10
BAHAN DAN METODE ... 11
Tempat dan Waktu Penelitian ... 11
Bahan dan Alat ... 11
Metode Penelitian ... 11
Pembiakan P. fluorescens dari Kultur Penyimpanan ... 11
Pembiakan P. fluorescens pada Beberapa Formulasi Limbah Organik ... 12
Uji Keefektifan P. fluorescens sebagai Pestisida Hayati ... 13
Uji Formulasi P. fluorescens dalam Limbah Organik Terhadap Pertumbuhan Cabai ... 15
Analisis Data ... 16
HASIL DAN PEMBAHASAN ... 17
Pembiakan P. fluorescens pada Beberapa Formulasi Limbah Organik .. 17
Keefektifan P. fluorescens pada Formulasi Limbah Organik dalam Menekan Perkembangan S. rolfsii dan Penekanan Penyakit Rebah Kecambah pada Cabai ... 20
Pengaruh Antagonisme P. fluorescens Terhadap S. rolfsii Secara In-vitro ... 20
Halaman Pengaruh Formulasi P. fluorescens dalam Limbah Organik Terhadap
Pertumbuhan Cabai ... 23
Pengaruh Formulasi P. fluorescens Terhadap Kemunculan Bibit (seed emergence) Cabai ... 23
Pengaruh Formulasi Terpilih P. fluorescens dalam Limbah Organik Terhadap Vigor Bibit Cabai ... 24
KESIMPULAN DAN SARAN ... 28
Kesimpulan ... 28
Saran ... 28
DAFTAR PUSTAKA ... 29
ix
DAFTAR TABEL
Nomor Halaman 1. Daftar formulasi media pertumbuhan bakteri yang digunakan dalam
penelitian ini ... 13 2. Rata-rata jumlah koloni P. fluorescens pada formulasi uji setelah 10
jam inokulasi ... 18 3. Persentase penghambatan S. rolfsii oleh P. fluorescens secara
in-vitro ... 21
4. Persentase penghambatan S. rolfsii oleh P. fluorescens secara
in-vivo ... 22
5. Persentase pengaruh formulasi limbah organik terhadap kemunculan benih (seed emergence) cabai ... 24 6. Pengaruh formulasi F8 dengan penambahan 1% filtrat orok-orok
terhadap jumlah daun dan tinggi tanaman cabai ... 25
x
DAFTAR GAMBAR
Nomor Halaman 1. Pertumbuhan koloni P. fluorescens pada masing-masing formulasi
uji ... 17 2. Uji antagonisme P. fluorescens terhadap S. rolfsii pada media
cair ... 21 3. Perbandingan formulasi F8 termodifikasi dangan penambahan
DAFTAR LAMPIRAN
Nomor Halaman 1. Hasil analisis ragam rata-rata jumlah koloni P. fluorescens pada
formulasi uji setelah 10 jam inokulasi ... 32 2. Hasil analisis ragam penghambatan S. rolfsii oleh P. fluorescens
secara in-vivo ... 32
3. Hasil analisis ragam penghambatan S. rolfsii oleh P. fluorescens
secara in-vitro ... 32
4. Hasil analisis ragam persentase pengaruh formulasi limbah organik terhadap kemunculan benih (seed emergence) cabai ... 32 5. Hasil analisis ragam pengaruh formulasi F8 termodifikasi terhadap
tinggi tanaman cabai ... 33 6. Hasil analisis ragam pengaruh formulasi F8 termodifikasi terhadap
PENDAHULUAN
Latar Belakang
Metode pengendalian penyakit tanaman sangat bervariasi dari satu penyakit ke penyakit yang lain, tergantung dari jenis patogen, jenis inang dan interaksi antara keduanya. Beberapa cara pengendalian penyakit yang dapat dilakukan diantaranya pengendalian dengan peraturan atau undang-undang, kultur teknis, pengendalian hayati, pengendalian fisik-mekanik dan pengendalian kimiawi tergantung pada jenis patogen yang akan dikendalikan.
Tindakan pengendalian melalui peraturan atau undang-undang bertujuan untuk mencegah (mengeluarkan atau melarang masuk) suatu patogen dari inang atau daerah geografis tertentu. Sebagian besar pengendalian melalui kultur teknis bertujuan membantu meminimalisasi terjadinya kontak antara tumbuhan dengan patogen dan mengeradikasi atau menurunkan jumlah patogen yang terdapat pada tumbuhan, lahan atau daerah. Pengendalian secara fisik-mekanik dan kimiawi bertujuan melindungi tumbuhan dari inokulum patogen yang berkemungkinan besar mencapai tumbuhan serta menyembuhkan infeksi yang telah berkembang. Sementara itu, pengendalian secara hayati dan beberapa pengendalian secara kultur teknis bertujuan meningkatkan ketahanan inang atau menciptakan kondisi yang menguntungkan bagi mikroorganisme antagonis terhadap patogen.
Menurut Agrios (1996), pengendalian hayati (biological control) terhadap patogen yaitu mengendalikan sebagian atau seluruh populasi patogen dengan bantuan organisme lain (agens hayati). Pengembangan agens hayati saat ini mendapatkan perhatian khusus dalam rangka mendukung sistem pertanian ramah lingkungan yang berkelanjutan. Kecenderungan ini dipicu oleh adanya bukti-bukti yang menguatkan bahwa produk pangan hasil pertanian konvensional dengan menggunakan pupuk dan pestisida sintetik secara berlebihan memiliki dampak negatif yang merugikan bagi kesehatan manusia, lingkungan dan ekosistem pada area pertanaman. Fakta tersebut mendorong kesadaran masyarakat yang peduli terhadap kesehatan dan lingkungan untuk mengembangkan sistem pertanian yang ramah lingkungan atau secara umum dikenal dengan pertanian organik.
2
Upaya mendukung pertanian organik terus dilakukan dan salah satunya adalah penggunaan mikroba bermanfaat yang mampu menekan perkembangan penyakit atau lebih dikenal sebagai pestisida hayati (bio-pesticides) serta dapat memicu pertumbuhan tanaman. Organisme yang mampu melakukan dua sifat tersebut pada hewan dan manusia dikenal sebagai probiotik, sedangkan mikroba yang mampu menekan perkembangan penyakit tanaman dan memicu pertumbuhan tanaman disebut sebagai probiotik tanaman. Pseudomonas
fluorescens merupakan salah satu mikroba probiotik tanaman yang banyak
mendapat perhatian. Berbagai penelitian yang berkaitan dengan eksplorasi, karakterisasi dan uji potensi P. fluorescens sebagai probiotik tanaman telah banyak dilakukan di beberapa negara.
P. fluorescens merupakan agens antagonis yang mampu menekan
perkembangan berbagai macam patogen tumbuhan. P. fluorescens strain 5 (pf-5) merupakan bakteri P. fluorescens pertama yang dilaporkan mampu menekan penyakit layu pada kapas yang disebabkan oleh Rhizoctonia solani (Howell dan Stipanovic 1979) dan Pythium ultimum (Howell dan Stipanovic 1980). Aplikasi
P. fluorescens pada rumput lapangan golf mampu menekan perkembangan
penyakit “dollar spot” yang disebabkan oleh Sclerotinia homoeocarpa dan bercak daun yang disebabkan oleh Drechslera poae, dua penyakit utama yang sangat merusak dan mempunyai daerah sebaran yang luas pada rumput golf dan pertamanan. Hasil uji in-vitro P. fluorescens menunjukkan adanya senyawa antibiosis yang mampu menekan perkembangan bakteri penyebab layu pada tomat, yaitu Ralstonia solanacearum (Giyanto et al. 1998). Selain sebagai agens hayati, P. fluorescens merupakan salah satu jenis bakteri yang digolongkan dalam kelompok PGPR (Plant Growth Promoting Rhizobacteria).
Istilah rhizobakteri pemicu pertumbuhan tanaman mengacu pada jenis bakteri yang mampu menstimulasi pertumbuhan tanaman yang dihasilkan dari berbagai macam mekanisme. Produksi hormon penstimulasi pertumbuhan dan penekanan perkembangan patogen tanaman merupakan aktivitas yang menjadi ciri khas dari jenis bakteri dalam kelompok PGPR. P. fluorescens juga dilaporkan dapat mendegradasi senyawa 2,5-dichlorobenzoate, sehingga mempunyai potensi besar untuk remediasi tanah terpolusi (Crowley et al. 1996).
3
Terlepas dari semua potensi yang dimiliki oleh P. fluorescens, pembiakan P.
fluorescens secara massal memiliki hambatan tersendiri. Media laboratorium yang
digunakan untuk pembiakan P. fluorescens harus diperoleh dengan harga yang cukup mahal. Jika media tersebut digunakan untuk membiakkan P. fluorescens secara massal, maka akan membutuhkan biaya produksi yang tinggi. Oleh karena itu, diperlukan media alternatif yang berasal dari alam dan dengan harga yang relatif lebih murah jika dibandingkan dengan media laboratorium yang selama ini digunakan.
P. fluorescens merupakan bakteri saprofitik yang mampu bertahan dan
berkembang pada sisa-sisa bahan organik. Berdasarkan sifat tersebut dapat diduga bahwa limbah organik cair yang tersedia melimpah di masyarakat dapat digunakan sebagai media pembiakan massal sekaligus sebagai formulasi probiotik. Beberapa modifikasi dan penambahan substrat lain pada media pembiakan seperti yang telah dilakukan oleh Ratdiana (2007) dan Kusumowardani (2008) menunjukkan bahwa media pembiakan dapat dimodifikasi dengan membuat formulasi limbah cair yang terdiri dari air kelapa, air tahu dan ekstrak limbah ikan.
Penelitian ini menggunakan isolat P. fluorescens isolat Indonesia yang merupakan koleksi laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, IPB. Isolat ini mempunyai keunggulan memproduksi senyawa antibiotik yang tinggi seperti yang terlihat dari kuatnya tingkat pendaran (fluoresensi) pigmen hijau kekuningan serta mampu berkembang biak secara cepat pada limbah organik cair (Giyanto et al. 1998).
4
Tujuan Penelitian
Penelitian ini bertujuan mengetahui formulasi limbah air kelapa, air tahu dan pengolahan ikan sebagai media alternatif bagi pembiakan P. fluorescens serta kaitannya dengan aktivitas P. fluorescens dalam menekan penyakit rebah kecambah dan sebagai pemicu pertumbuhan tanaman cabai.
Manfaat Penelitian
Hasil penelitian ini diharapkan mampu menyediakan teknologi pembiakan
P. fluorescens pada media alternatif yang mampu menekan perkembangan
patogen S. rolfsii penyebab penyakit rebah kecambah dan meningkatkan pertumbuhan tanaman cabai.
TINJAUAN PUSTAKA
Pengendalian Hayati
Baker and Cook (1974 dalam Cook 2002) mendefinisikan bahwa pengendalian hayati adalah pengurangan jumlah inokulum atau penurunan aktivitas dari patogen penyebab penyakit dengan introduksi agens antagonis, perbaikan kondisi lingkungan tumbuh atau dengan modifikasi lingkungan yang dapat mendukung perkembangan agens antagonis. Dengan kata lain, pengendalian hayati didefinisikan sebagai pengurangan jumlah inokulum atau aktivitas penyebab penyakit dengan penggunaan organisme lain (agens antagonis).
Pengendalian hayati (biological control) terhadap patogen yaitu menghancurkan sebagian atau seluruh populasi patogen dengan organisme lain dan selalu terjadi secara rutin di alam (Agrios 1996). Sebagai contoh, beberapa jenis penyakit yang patogennya tidak dapat berkembang pada lahan tertentu yang disebut tanah supresif (suppressive soil).
Pemanfaatan agens antagonis tersebut telah banyak digunakan dalam pengembangan strategi pengembangan pengendalian hayati yang efektif dan efisien untuk mengatasi beberapa jenis penyakit tanaman. Walaupun memiliki sejumlah keterbatasan namun agens antagonis dapat diharapkan menjadi bagian penting dalam tindakan pengendalian yang dapat dilakukan terhadap lebih banyak patogen. Sebagai contoh, beberapa jenis cendawan yang mencakup Oomycetes, Chytridiomycetes, Hyphomycetes dan beberapa bakteri Pseudomonas serta Aktinomiset mampu menginfeksi spora istirahat dari cendawan tertentu. Selain itu, ada juga cendawan mikoparasitik seperti Trichoderma harzianum yang memiliki kemampuan dalam memarasit miselium dari cendawan Rhizoctonia dan
Slcerotium, mampu menghambat pertumbuhan banyak cendawan jenis lainnya,
seperti Pythium, Fusarium dan Fomes, dan mampu mengurangi penyakit yang disebabkan oleh sebagian besar patogen tersebut.
6
Selain cendawan, bakteri dari genus Streptomyces dan Pseudomonas juga telah ditemukan dapat memarasit dan atau menghambat cendawan patogenik
Pythium sp. dan Gaeumannomyces tritici. Nematoda mikofagus Aphelencus anenae memarasit Rhizoctonia dan Fusarium, dan amuba Vampyrella memarasit
cendawan patogenik Cochiliobolus sativus dan Gaeumannomyces graminis. Belum seluruhnya dapat dijelaskan dengan cara bagaimana mikroorganisme antagonis mempengaruhi populasi patogen, tetapi umumnya mekanisme tersebut dihubungkan dengan salah satu dari lima pengaruh berikut, yaitu: (1) parasitisme dan membunuh patogen secara langsung, (2) berkompetisi dengan patogen dalam hal nutrisi atau makanan, (3) toksin yang langsung mempengaruhi patogen dengan zat antibiotik yang dilepaskan oleh agens antagonis, (4) toksin yang tidak langsung mempengaruhi patogen melalui zat yang mudah menguap, seperti etilen yang dilepaskan oleh aktivitas metabolik antagonis dan (5) penginduksi ketahanan tanaman inang (Agrios 1996).
Pseudomonas fluorescens
Pseudomonas fluorescens merupakan bakteri gram negatif yang sebagian
besar bersifat non-patogenik dan saprofitik pada tanah dan daerah rizosfer tanaman. P. fluorescens mengkolonisasi tanah, permukaan tanaman dan memanfaatkan bahan organik sebagai sumber nutrisi untuk pertumbuhannya. Bakteri ini memproduksi pigmen biru kehijauan pada saat kandungan Fe (besi) yang rendah serta dapat tumbuh baik pada media yang mengandung garam-garam mineral dengan tambahan sumber karbon yang beragam (Ratdiana 2007).
P. fluorescens merupakan agens antagonis yang potensial dengan
menghasilkan antibiotik dan siderofor. Siderofor berfungsi mengikat ion Fe3+ dari lingkungan sehingga patogen tidak dapat memanfaatkan senyawa tersebut dan mengakibatkan pertumbuhan cendawan terhambat (Leong 1988 dalam Hamdan et
al. 1991). Antibotik tersebut berperan dalam menekan perkembangan patogen
yang ada di lingkungan pertanaman sehingga P. fluorescens dapat berkembang secara optimal (Mazolla et al. 1992). Selain itu, antibiotik yang dihasilkan oleh P.
fluorescens dapat mempengaruhi populasi dari bakteri kelompok Pseudomonas
7
Senyawa antibiotik yang dihasilkan bakteri ini antara lain pyrrolnitrin,
pyoluteorin (PLT), phenazine-1-carboxylase (PCA) dan 2,4-diacetylploroglucinol
(PHL) (Duffy & Defago 1998). Hamdan et al. (1991) menyatakan bahwa antibiotik PCA menjadi faktor utama dalam menekan kejadian penyakit pada tanaman. Sedangkan, siderofor yang dihasilkan antara lain ptochelin dan
pyovedrin. Keduanya merupakan pigmen berwarna kuning kehijauan, tetapi
pigmen yang dihasilkan oleh pyovedrin lebih cerah daripada ptochelin.
P. fluorescens banyak dilaporkan sebagai penghasil fitohormon dalam
jumlah yang besar khususnya IAA untuk merangsang pertumbuhan (Watanabe et
al. 1987 dalam Marwoso 2005). IAA merupakan hormon pertumbuhan kelompok
auksin yang sangat besar peranannya dalam pertumbuhan tanaman (Heddy 1986
dalam Marwoso 2005). Dilaporkan oleh Tjondronegoro et al. (1989), bahwa
pengaruh auksin antara lain: memanjangkan dan membesarkan sel batang, menghambat proses absisi yaitu pengguguran daun, merangsang pembentukan buah, penghambat pucuk lateral yaitu menghambat pertumbuhan tunas ketiak dan dapat merangsang pertumbuhan kambium serta membentuk pertumbuhan floem dan xilem sekunder.
Beberapa contoh produk yang telah menggunakan P. fluorescens sebagai agens hayati antara lain: BlightBan A506, Conquer dan Victus. Produk tersebut tersedia dalam bentuk serbuk dan cairan yang dapat langsung diaplikasikan ke tanaman (Cook 2002).
8
Limbah Organik
Limbah Air Kelapa
Kelapa merupakan bahan utama dalam industri kopra. Air kelapa merupakan limbah dari industri kopra yang mempunyai banyak manfaat antara lain sebagai bahan pembuat permen karet (kernel), bahan pembuat nata de coco (Thirupati et al. 2007), sumber hormon pemicu pertumbuhan dan pengganti dekstrosa.
Air kelapa memiliki kandungan nutrisi yang cukup lengkap. Bobot air kelapa sekitar 25% dari keseluruhan bobot buah kelapa dan komposisi yang terkandung didalamnya yaitu 4% karbohidrat, 0,1% lemak, 0,02% kalsium, 0,01% fosfor, 0,05% besi, protein (9 g/L), vitamin C, vitamin B kompleks dan garam-garam mineral. Umur buah kelapa mempengaruhi kadar gula yang terdapat pada air kelapa. Semakin tua umur buah kelapa maka kadar fruktosa dan glukosa akan meningkat, sedangkan kadar sukrosa akan menurun. Kalor yang terdapat dalam air kelapa adalah sebesar 17,4 kal/100 mg (Thirupati et al. 2007).
Limbah Air Tahu
Pembuatan nata de soya merupakan salah satu pemanfaatan limbah tahu yang telah banyak dilakukan. Pengolahan tersebut melibatkan bakteri Acetobacter
xylinum yang memanfaatkan protein dan karbohidrat dalam limbah tahu sebagai
energi untuk hidup dan berkembang biak (Anonim 2007). Limbah cair tahu mengandung kadar air 99,28%, kadar abu 0,06%, total padatan 0,067%, protein 0,17% dan karbohidrat 0,35% dengan pH 4,27. Analisis tersebut menunjukkan bahwa limbah cair tahu merupakan sumber media yang baik untuk pertumbuhan mikroba, termasuk bakteri antagonis. Akan tetapi untuk memperoleh hasil pertumbuhan yang optimal diperlukan tambahan nutrisi berupa sumber karbon dan nitrogen.
9
Limbah Perikanan
Wilayah perairan Indonesia yang sangat luas merupakan sumberdaya alam yang memiliki sejumlah potensi untuk dimanfaatkan secara optimal. Minimnya pengetahuan dan sarana nelayan dalam mengolah hasil laut menyebabkan masalah terhadap lingkungan khususnya di kawasan pesisir, seperti gangguan terhadap kebersihan, sanitasi dan kesehatan lingkungan. Limbah pengolahan ikan di Cirebon berkisar 10 ton per hari yang berasal dari sekitar 20 industri kecil pengolahan ikan (Meidina et al. 2007).
Limbah pengolahan ikan seperti kulit udang, kepiting dan rajungan mengandung kitin dalam kadar tinggi, berkisar antara 20-60% tergantung spesiesnya (Rochima et al. 2007). Kitin adalah polimer alami kedua yang paling banyak tersedia di alam setelah selulosa dan merupakan polimer aminoglukan dari N-asetil-D-glukosamin yang tidak larut air. Beberapa manfaat yang dapat diambil dari kitin, salah satunya di bidang pertanian antara lain dengan memanfaatkan sifat antifunginya untuk melindungi tanaman dari serangan fungi dan sifat antibakterinya terhadap beberapa patogen (Shahidi et al. 1999).
Kitin dapat diproses lebih lanjut menjadi kitosan yang dapat dimanfaatkan dalam pengendalian penyakit. Kitosan adalah senyawa turunan dari kitin yang telah mengalami deasitilisasi, yaitu penghilangan gugus asetat pada kitin. Kitosan merupakan rangkaian β-1.4-polimer yang berasal dari glukosaamina (2-amino-2-deoksi-β-D-glukosa ) dan terdapat sejumlah N-asetilglukosamin. Zat ini dibentuk oleh poly-N-glukosamin (Rinaudo 1999). Singh and Sitaramaiah (1999) menyatakan bahwa kitosan sebagai substrat tumbuh mikrob antagonis juga dapat menginduksi ketahanan inangnya apabila ditambahkan langsung ke tanah.
Penyakit Rebah Kecambah Pada Cabai
Penyakit rebah kecambah (damping off) adalah penyakit yang menyerang bibit pada persemaian atau tanaman yang baru dipindahkan ke lapangan. Umumnya penyakit ini menyerang tanaman yang masih dalam keadaan sukulen serta belum banyak membentuk kutikula. Tanaman yang terserang penyakit rebah kecambah akan menampakkan gejala busuk basah, mengerut hingga bercak coklat pada leher akar atau bagian bawah batang dan pada akhirnya tanaman mati.
10
Apabila kondisi lingkungan dapat mendukung pertumbuhan patogen, maka kerugian akibat penyakit rebah kecambah berkisar 80-100% (Sugiharso dan Suseno dalam Rina 1993).
Tembakau, jagung, cabai, kapas, sorgum, tomat, kubis-kubisan dan kacang-kacangan adalah tanaman yang mudah terserang penyakit rebah kecambah. Agrios (1996) menyatakan bahwa timbulnya penyakit rebah kecambah dapat terjadi sebelum bibit muncul ke permukaan tanah (pre-emergence damping off) dan setelah bibit muncul ke atas permukaan tanah (post-emergence damping off). Penyakit rebah kecambah telah tersebar di seluruh dunia terutama daerah tropis dan daerah beriklim basah.
Sclerotium rolfsii adalah salah satu cendawan patogen penyebab penyakit
rebah kecambah. Cendawan patogen ini bersifat saprofit fakultatif yang tumbuh secara saprofit dalam lapisan tanah ketika tidak ada tanaman inang (Frederiksen 1986). Berbagai usaha telah dilakukan dalam mengendalikan penyakit rebah kecambah, diantaranya adalah penggunaan fungisida. Alternatif pengendalian yang lebih ramah lingkungan adalah dengan pemanfaatan spesies organisme yang bersifat antagonis terhadap patogen penyebab penyakit, atau secara umum dikenal sebagai pengendalian hayati (Campbell 1989).
Penggunaan bakteri antagonis P. fluorescens berpotensi untuk mengendalikan penyakit rebah kecambah. Penelitian yang telah dilakukan Howell dan Stipanovic (1979 & 1980) menunjukkan bahwa P. fluorescens dapat mengendalikan patogen Rhizoctonia solani dan Pythium spp. sebagai penyebab penyakit rebah kecambah pada persemaian kapas. Ganesan dan Gnanamanikam (1986) menyatakan bahwa P. fluorescens juga mampu mengendalikan patogen S.
rolfsii penyebab penyakit rebah kecambah pada kacang tanah. P. fluorescens
memiliki kemampuan dalam menekan penyakit rebah kecambah yang disebabkan oleh S. rolfsii pada persemaian cabai dan kedelai (Rina 1993).
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor mulai bulan Februari hingga November 2010.
Bahan dan Alat Penelitian
Bahan yang digunakan adalah limbah air kelapa, limbah air tahu, ekstrak limbah pengolahan ikan, P. fluorescens, S. rolfsii, Escherichia coli (DHα5), benih cabai varietas TM99, media King’s B Agar, media PDA (Potatoes Dextrose Agar) dan Luria Broth (LB). Alat yang digunakan adalah cawan petri, laminar flow, tabung reaksi, micropipet, erlenmeyer dan rak penanaman untuk pembenihan cabai.
Metode Penelitian
Kegiatan yang dilakukan dalam penelitian ini meliputi pembiakan P.
fluorescens dari kultur penyimpanan, pembiakan P. fluorescens pada beberapa
formulasi organik, uji keefektifan P. fluorescens sebagai pestisida hayati dan uji formulasi P. fluorescens dalam limbah organik terhadap pertumbuhan cabai.
Pembiakan P. fluorescens dari Kultur Penyimpanan
Penelitian ini menggunakan P. fluorescens sebagai bakteri terpilih untuk pengembangan probiotik tanaman. Isolat ini merupakan kultur stok yang dimiliki laboratorium Bakteriologi Tumbuhan, Dapartemen Proteksi Tanaman, Fakultas Pertanian IPB sebagai hasil penelitian sebelumnya (Giyanto et al. 1998). P.
fluorescens dibiakkan pada medium King`s B Agar ( 20 g protease peptone, 1,5 g
K2HPO4, 1,5 g MgSO4.7H2O, 15 ml Gliserol, 15 g Agar dan 1 liter aquades) dan
diinkubasikan pada suhu ruang selama 24 jam. Kemurnian isolat bakteri ditandai dengan koloni yang menghasilkan pigmen hijau kekuningan sebagai indikasi penghasil senyawa antibiotika dan siderofor. Koloni murni akan digunakan pada uji selanjutnya.
12
Pembiakan P. fluorescens pada Beberapa Formulasi Limbah Organik
Formulasi limbah organik yang digunakan pada penelitian ini terdiri dari tiga jenis limbah yaitu limbah air kelapa (AK), limbah air tahu (TH), dan limbah pengolahan ikan (LI). Limbah air kelapa diperoleh dari tempat penggilingan kelapa yang terdapat di pasar-pasar tradisional, limbah tahu diperoleh dari pabrik tahu yang terletak di daerah Cibanteng, Bogor. Sedangkan, limbah pengolahan ikan diperoleh dari pasar ikan desa Gebang, Cirebon. AK dan TH yang diambil dari lokasi segera diproses dengan penyaringan menggunakan kertas wattman no. 3 , sedangkan limbah pengolahan ikan yang berupa campuran antara organ dalam ikan, sisik dan bagian ikan yang lain disiapkan dengan cara menghancurkan limbah pengolahan ikan tersebut menggunakan blender yang sebelumnya telah ditambahkan air dengan perbandingan LI : air (1:1). Campuran LI dan air tersebut selanjutnya direbus hingga mendidih selama 20 menit, kemudian disaring dengan kertas saring untuk memisahkan bagian padatan dan cairan. Bagian padatan dibuang sedangkan bagian cairan disimpan sebagai stok limbah LI dan stok tersebut dianggap 100% LI. Ketiga jenis limbah tersebut diformulasikan menjadi media untuk pertumbuhan bakteri P. fluorescens. Terdapat sembilan formulasi media pertumbuhan bakteri yang diuji pada penelitian ini (Tabel 1).
13
Tabel 1 Daftar formulasi media pertumbuhan bakteri yang digunakan dalam penelitian
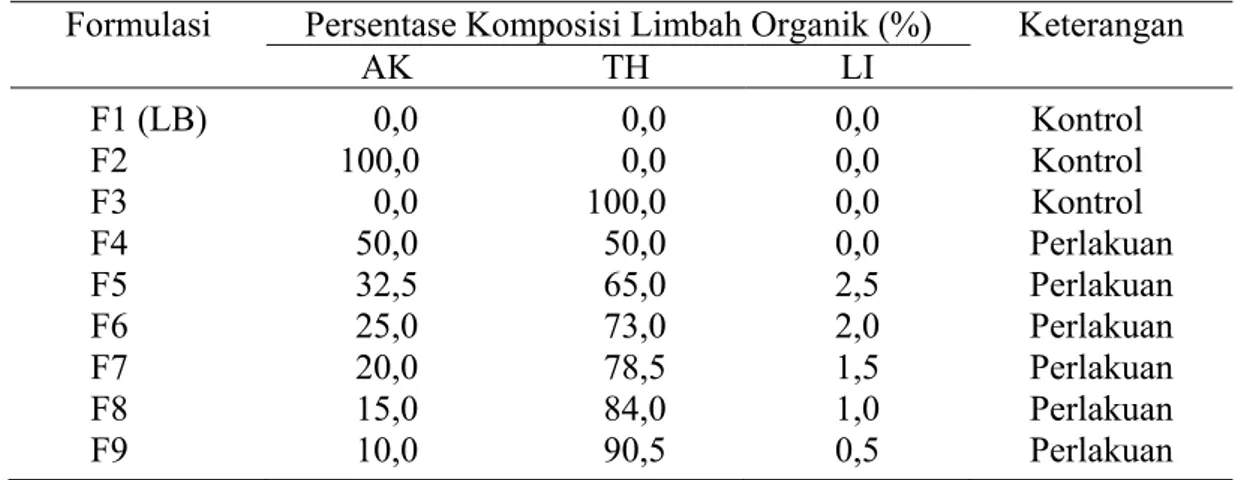
Formulasi Persentase Komposisi Limbah Organik (%) Keterangan AK TH LI F1 (LB) 0,0 0,0 0,0 Kontrol F2 100,0 0,0 0,0 Kontrol F3 0,0 100,0 0,0 Kontrol F4 50,0 50,0 0,0 Perlakuan F5 32,5 65,0 2,5 Perlakuan F6 25,0 73,0 2,0 Perlakuan F7 20,0 78,5 1,5 Perlakuan F8 15,0 84,0 1,0 Perlakuan F9 10,0 90,5 0,5 Perlakuan
Semua formulasi disesuaikan pH 7.0 dengan penambahan larutan NaOH 1 M. Pengujian formulasi limbah organik sebagai media biakan P. fluorescens dilakukan pada volume 50 ml pada erlenmeyer 250 ml yang sebelumnya telah disiapkan secara steril dengan autoklaf pada suhu 121oC selama 15 menit. Formulasi diinokulasi P. fluorescens sebanyak 0.5 ml yang telah dikulturkan semalam pada 20 ml LB yang diinkubasikan pada inkubator bergoyang selama 12 jam dengan kecepatan 100 rpm. Kemudian setiap formulasi dilakukan penghitungan populasi P. fluorescens dengan teknik pengenceran berseri dan pencawanan pada media King’s B 10 % pada jam ke-0, 2, 4, 6, 8 dan 10 dengan tiga kali ulangan dan masing-masing ulangan dilakukan secara duplo.
Uji Keefektifan P. fluorescens sebagai Pestisida Hayati
Uji penekanan S. rolfsii secara in-vitro. Formulasi P. fluorescens dalam beberapa komposisi limbah organik yang telah berhasil dirancang seperti terlihat dari hasil langkah kedua dari penelitian ini selanjutnya diuji keefektifannya dalam menekan perkembangan patogen S. rolfsii. Isolat S. rolfsii disiapkan dengan menumbuhkan sklerotia cendawan tersebut pada media Potato Dextrose Agar (PDA) lalu diinkubasi selama 7 hari pada suhu ruang untuk mempersiapkan isolat
S. rolfsii. Isolat S. rolfsii yang siap pakai ditandai dengan adanya hifa yang
14
Formulasi P. fluorescens pada beberapa jenis kombinasi limbah organik disiapkan seperti pada langkah 2 tersebut di atas. Formulasi limbah organik yang telah disiapkan sebanyak 50 ml dalam 250 ml labu erlenmeyer dengan perbandingan PDB : formulasi media (1:1). Pada masing-masing formulasi limbah organik disiapkan 3 erlenmeyer yang akan digunakan sebagai satu unit perlakuan. Erlenmeyer pertama berisi formulasi media ditambah S. rolfsii, sedangkan pada erlenmeyer ke-dua sebelum diinokulasi S. rolfsii formulasi media tersebut diinokulasi dengan 0,5 ml biakan P. fluorescens yang telah dikulturkan semalam pada 20 ml media LB. Sebagai perbandingan digunakan E. coli DHα5 yang telah dikulturkan selama semalam pada 20 ml media LB kemudian diinokulasikan sebanyak 0,5 ml pada erlenmeyer ke-tiga sebelum diinokulasi S. rolfsii. Biakan S.
rolfsii yang telah disiapkan selanjutnya diinokulasikan pada formulasi media yang
telah disiapkan dan selanjutnya diinokulasikan pada formulasi media limbah organik tersebut dengan memasukkan inokulum S. rolfsii (diameter 0,5 cm) yang telah dibuat dengan pelubang gabus (cork borer). Media biakan yang telah diberi perlakuan tersebut selanjutnya diinkubasikan pada suhu ruang selama 1 minggu.
Pengamatan dilakukan terhadap pertumbuhan miselium S. rolfsii pada setiap perlakuan. Pemanenan S. rolfsii dilakukan dengan penyaringan menggunakan kertas saring dan biomassa miselium cendawan ditimbang. Persen penghambatan pertumbuhan S. rolfsii dihitung berdasarkan rumus P = (M2-M1)/M2 x 100% (P: persen penghambatan pertumbuhan S. rolfsii; M2: bobot biomassa S. rolfsii pada media tanpa inokulasi P. fluorescens; dan M1: bobot biomassa S. rolfsii pada media dengan inokulasi P. fluorescens). Percobaan diulang sebanyak 3 kali.
Uji penekanan rebah kecambah oleh S. rolfsii secara in-vivo. Percobaan dilakukan dengan menggunakan media tumbuh steril yang terdiri dari campuran tanah dan pupuk kandang (1:1). Media tumbuh steril diinokuasi dengan miselium cendawan S. rolfsii umur 7 hari dengan mencampurkan secara merata 3 cawan petri (diameter 9 cm) biakan S. rolfsii pada setiap 2 kg media tumbuh yang sebelumnya biakan cendawan patogen tersebut telah dihaluskan dengan blender (ditambahkan 10 ml air steril) selama 2 menit. Media yang telah diinokulasi dengan cendawan patogen ditempatkan pada baki plastik (ukuran 36 x 27 x 5 cm) yang telah dilubangi bagian bawahnya untuk drainase air. Benih cabai merah
15
Varietas TM 99 direndam semalam dalam biakan P. fluorescens pada berbagai formulasi limbah organik (F1 – F9) yang telah disiapkan sebelumnya. Benih selanjutnya ditiriskan dan ditanam pada media tumbuh yang telah diinokulasi dengan patogen S. rolfsii. Setiap baki ditanam 100 benih cabai sebagai satu unit perlakuan. Perlakuan diulang 3 kali dan disusun dalam Rancangan Acak Lengkap (RAL). Parameter yang diamati adalah persentasi kemunculan benih cabai pada media tumbuh dari benih cabai yang telah diberi perlakuan dengan P. fluorescens yang dibiakan pada berbagai jenis komposisi limbah organik.
Uji Formulasi P. fluorescens dalam Limbah Organik Terhadap Pertumbuhan Cabai
Uji pengaruh formulasi P. fluorescens terhadap kemunculan bibit (seed emergence) cabai. Pengujian pengaruh P. fluorescens pada beberapa formulasi limbah organik (F1-F9) terhadap perkecambahan benih cabai diuji dengan menggunakan media steril yang merupakan campuran antara pupuk kandang dan tanah dengan perbandingan 1:1 pada rak pembibitan. Penyiapan formulasi P.
fluorescens dilakukan seperti pada pengujian sebelumnya. Benih cabai varietas
TM 99 direndam semalam dengan formulasi P. fluorescens. Benih ditiriskan pada kertas tissue steril dan ditanam pada rak pembenihan yang sebelumnya telah diisi dengan media tanam steril. Jumlah benih cabai yang berkecambah diamati setiap hari hingga tanaman berumur 2 MST.
Uji pengaruh formulasi terpilih P. fluorescens terhadap vigor bibit cabai. Formulasi terpilih dengan potensi terbaik selanjutnya dimodifikasi dengan penambahan 1% filtrat orok-orok (Crotalaria sp.) kemudian dilakukan pengujian lanjutan tentang aspek pengaruhnya terhadap vigor benih cabai. Penambahan filtrat orok-orok ini diharapkan mampu memberi nutrisi tambahan bagi P.
fluorescens. Ada tiga perlakuan dalam penelitian ini yaitu:
K : benih cabai direndam dengan formulasi terpilih tanpa P. fluorescens, kemudian disemai dalam pot dan disiram seminggu sekali dengan 5% formulasi yang sama untuk perendaman benih.
S : benih cabai direndam dalam formulasi terpilih dengan P. fluorescens, kemudian disemai dalam pot dan seminggu sekali disiram dengan 5% formulasi F8 tanpa P. fluorescens.
16
S1 : benih cabai direndam dalam formulasi terpilih dengan P. fluorescens, kemudian disemai dalam pot dan disiram seminggu sekali dengan 5% formulasi yang sama untuk perendaman benih.
Perlakuan disusun dalam rancangan acak lengkap dengan tiga ulangan. Masing-masing unit perlakuan terdiri dari 50 bibit cabai. Bibit cabai dipelihara secara baik dari serangan gulma, hama maupun patogen lain. Penyiraman dilakukan secara teratur untuk mencegah kekeringan. Setelah tanaman berumur 6 MST dilakukan pengamatan terhadap tinggi tanaman dan jumlah daun yang terbentuk.
Analisis Data
Kurva pertumbuhan koloni P. fluorescens pada beberapa formulasi limbah organik dan data perkecambahan benih dapat dilihat dengan menggunakan program Microsoft Excel 2007. Sedangkan, data pertumbuhan koloni bakteri P.
fluorescens pada limbah organik dan modifikasinya, pengujian antagonisme
secara in-vitro maupun in-vivo pada media cair, pengujian formulasi P.
fluorescens terhadap kemunculan benih dan pengujian formulasi termodifikasi
terhadap vigor tanaman cabai dilakukan dengan rancangan acak lengkap (RAL) yang terdiri dari tiga ulangan diolah dengan menggunakan Analisis Ragam (Anova). Apabila terdapat perlakuan yang berbeda nyata dilakukan uji lanjutan dengan uji Tukey pada taraf nyata α= 0.05.
HASIL DAN PEMBAHASAN
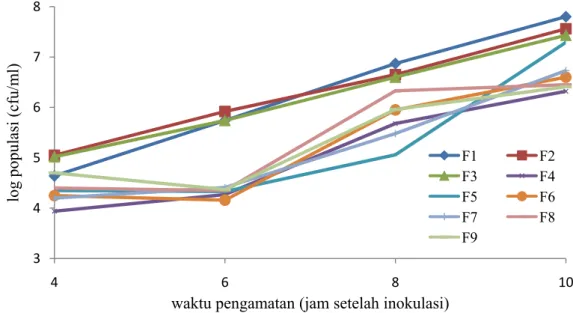
Pembiakan P. fluorescens pada Beberapa Formulasi Limbah Organik Populasi P. fluorescens pada beberapa limbah organik menunjukkan adanya peningkatan populasi. Pengaruh komposisi limbah organik pada setiap formulasi
P. fluorescens menunjukkan hasil yang berbeda-beda terhadap kontrol (Gambar
1). Populasi formulasi kontrol berada diatas rata-rata formulasi hasil modifikasi. Pertumbuhan koloni P. fluorescens pada formulasi kontrol mengalami peningkatan yang signifikan pada waktu pengamatan 4 jam setelah inokulasi. Peningkatan formulasi kontrol berlangsung secara berkelanjutan hingga jam ke-10 setelah inokulasi. Pada jam ke-4 hingga jam ke-10 setelah inokulasi rata-rata populasi tertinggi pada formulasi kontrol dengan nilai log populasi 7,8 (F1), yang diikuti dengan F2 dan F3 dengan nilai log populasi 7,56 dan 7,43. Sedangkan rata-rata populasi tertinggi pada formulasi hasil modifikasi dengan nilai 7,29 (F5). Formulasi F4 adalah formulasi P. fluorescens hasil modifikasi dengan nilai log populasi terendah, yaitu 6,32 cfu/ml.
Gambar 1 Pertumbuhan koloni P. fluorescens pada masing-masing formulasi uji 3 4 5 6 7 8 4 6 8 10 log populasi (cfu/m l)
waktu pengamatan (jam setelah inokulasi)
F1 F2
F3 F4
F5 F6
F7 F8
18
Formulasi hasil modifikasi menunjukkan rata-rata populasi yang beragam pada jam ke-10 setelah inokulasi. Formulasi F5 merupakan salah satu formulasi dengan jumlah koloni yang mampu mendekati kontrol. Rata-rata koloni P.
fluorescens formulasi F5 berbeda secara nyata terhadap formulasi hasil modifikasi
lainnya dan formulasi kontrol (Tabel lampiran 1).
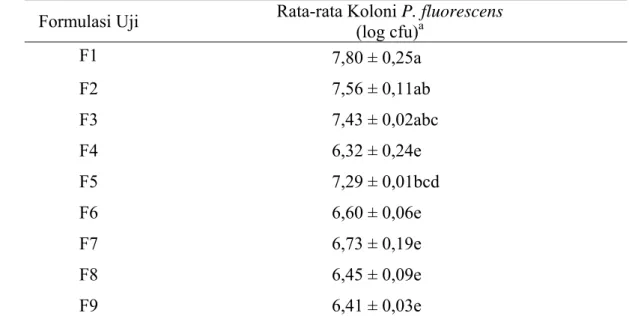
Tabel 2 Rata-rata Jumlah Koloni P. fluorescens Pada Formulasi Uji Setelah 10 jam Inokulasi
Formulasi Uji Rata-rata Koloni P. fluorescens (log cfu)a
F1 7,80 ± 0,25a F2 7,56 ± 0,11ab F3 7,43 ± 0,02abc F4 6,32 ± 0,24e F5 7,29 ± 0,01bcd F6 6,60 ± 0,06e F7 6,73 ± 0,19e F8 6,45 ± 0,09e F9 6,41 ± 0,03e
a Angka selajur yang diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji Tukey pada taraf α 0,05.
Formulasi F1 memiliki nilai rata-rata jumlah koloni tertinggi dibandingkan dengan formulasi lainnya (Tabel 2). Hal ini dikarenakan formulasi F1 merupakan formulasi kontrol yang terdiri dari 100% media LB, sehingga koloni P.
fluorescens dapat tumbuh dengan sangat baik. Formulasi F5 memiliki nilai
rata-rata jumlah koloni yang paling mendekati kontrol jika dibandingkan dengan formulasi hasil modifikasi yaitu F4, F5, F6, F7, F8 dan F9. Berdasarkan hasil tersebut, dapat dikatakan bahwa formulasi F5 merupakan formulasi hasil modifikasi yang paling baik untuk pertumbuhan koloni P. fluorescens jika dibandingkan dengan keenam formulasi hasil modifikasi lainnya. Formulasi F5 diharapkan mampu menjadi media alternatif bagi pertumbuhan P. fluorescens, meskipun nilai rata-rata log cfu formulasi F5 tidak mampu melebihi formulasi kontrol.
19
Berdasarkan pertumbuhan koloni dan jumlah populasi P. fluorescens pada masing-masing formulasi uji menunjukkan bahwa P. fluorescens mampu beradaptasi dengan baik terhadap media alternatif yang terdiri dari beberapa komponen limbah organik. Perpaduan antara limbah air kelapa, air tahu dan limbah pengolahan ikan terbukti dapat mendukung pertumbuhan P. fluorescens.
Tingginya jumlah koloni pada Formulasi F5 dengan komposisi limbah air kelapa, air tahu dan pengolahan ikan (32,5 : 65 : 2,5) diduga karena komposisi pada formulasi F5 merupakan komposisi yang sesuai bagi pertumbuhan P.
fluorescens. Limbah tahu yang menjadi komposisi utama formulasi F5
mendapatkan nutrisi tambahan berupa sumber karbon dari limbah air kelapa yang banyak mengandung karbon dan tersedia dalam bentuk sederhana sehingga mudah dimanfaatkan oleh P. fluorescens.
Sumber karbon yang tersedia pada air kelapa lebih banyak dalam bentuk senyawa gula sederhana seperti fruktosa, sukrosa dan glukosa yang dapat langsung digunakan untuk metabolisme sel sehingga pertumbuhan P. fluorescens cukup baik pada air kelapa. Selain itu, penambahan limbah pengolahan ikan juga turut berperan untuk mendukung pertumbuhan koloni P. fluorescens. Limbah pengolahan ikan diduga mengandung sejumlah mineral yang mampu dimanfaatkan oleh P. fluorescens sehingga dapat dikonfersi menjadi nutrisi yang mampu mendukung pertumbuhan koloni P.fluorescens.
Menurut Pelczar dan Chan (2006) pertumbuhan bakteri dipengaruhi oleh nutrisi-nutrisi seperti karbon (C), nitrogen (N), fosfat (P) dan lainnya. Sumber karbon yang tersedia pada air kelapa lebih banyak dalam bentuk senyawa gula sederhana seperti fruktosa, sukrosa dan glukosa (Vigliar et al. 2006) yang dapat langsung digunakan untuk metabolisme sel sehingga pertumbuhan P. fluorescens cukup baik pada air kelapa. Menurut Vigliar et al. (2006), air kelapa memiliki kandungan nutrisi yang cukup lengkap. Bobot air kelapa sekitar 25% dari bobot keseluruhan buah kelapa dan komposisi yang terkandung didalamnya yaitu 4% karbohidrat, 0,1% lemak, 0,02% kalsium, 0,01% fosfor, 0,05% besi, total protein (9g/L), vitamin C, vitamin B kompleks dan garam-garam mineral.
20
Umur buah kelapa mempengaruhi kadar gula yang terdapat dalam air kelapa. Semakin tua umur buah kelapa maka kadar fruktosa dan glukosa akan meningkat, sedangkan kadar sukrosa akan menurun. Kalori yang terdapat dalam air kelapa sebesar 17,4 kal/100mg (Thirupati et al. 2007). Hariyadi et al. (2002) mengemukakan bahwa limbah cair tahu mengandung kadar air 99,28%, kadar abu 0,06%, total padatan 0,67%, protein 0,17% dan karbohidrat 0,35%. Analisis tersebut menunjukkan bahwa limbah cair tahu merupakan sumber media yang baik untuk pertumbuhan mikroba, termasuk bakteri antagonis.
Keefektifan P. fluorescens pada Formulasi Limbah Organik dalam Menekan Perkembangan S. rolfsii dan Penekanan Penyakit Rebah Kecambah Cabai Pengaruh Antagonisme P. fluorescens Terhadap S. rolfsii Secara In-vitro
Formulasi P. fluorescens menunjukkan penghambatan S. rolfsii dengan baik pada skala laboratorium. Salah satu mekanisme yang dilakukan oleh P.
flourescens untuk menghambat perkembangan S. rolfsii adalah antibiosis. P. fluorescens akan menghasilkan antibiotik yang dapat menghambat pertumbuhan S. rolfsii. Antibiosis ditunjukkan dengan minimnya miselium cendawan patogen
yang tumbuh pada erlenmeyer pengujian yang diinokulasi P. fluorescens dan adanya perubahan warna menjadi kehijauan jika dibandingkan dengan erlenmeyer pengujian tanpa inokulasi P. fluorescens (Gambar 2). Warna kehijauan tersebut diduga sebagai aktivitas bakteri dalam menghasilkan senyawa-senyawa metabolit sekunder khususnya siderofor. Selain antibiosis, mekanisme lain yang terjadi adalah persaingan nutrisi. Organisme yang memiliki kemampuan dalam memanfaatkan nutrisi akan mampu bertahan hidup.
Menurut Anjaiah dalam Cook (2002) menerangkan bahwa kelompok Pseudomonands menunjukkan mekanisme yang berbeda seperti kompetisi nutrisi, produksi siderofor (pyoverdin), antibiotik (hydrogen cyanide, oomycin A,
pyoluteorin, pyrrolnitrin, 2,4-diacetyl phloroglucinol, phenazine 1-carboxylic acid dan pyocyanin) dan menginduksi ketahanan tanaman.
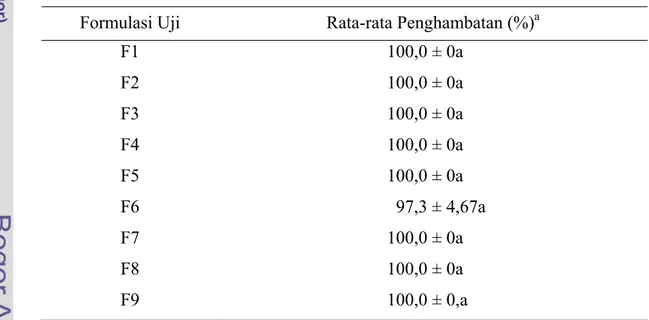
Persentase penghambatan S. rolfsii oleh P. fluorescens yang ditumbuhkan pada beberapa formulasi limbah organik tidak berbeda nyata (Tabel lampiran 3) antara masing-masing formulasi karena setiap formulasi uji memiliki
21
penghambatan S. rolfsii sebesar 100% kecuali formulasi F6 yang mencapai 97,3%.
Gambar 2. Uji antagonisme P. fluorescens terhadap S. rolfsii pada media cair. Keterangan gambar dari kiri ke kanan: Formulasi Uji + E. coli, Formulasi Uji + S. rolfsii dan Formulasi Uji + P. fluorescens + S.
rolfsii.
Hal ini menunjukkan bahwa formulasi kontrol maupun formulasi hasil modifikasi mampu menekan pertumbuhan S. rolfsii dengan baik dalam skala laboratorium. Rata-rata persentase penghambatan antar formulasi dapat dilihat pada Tabel 3. Tabel 3 Persentase Penghambatan S. rolfsii oleh P. fluorescens secara in-vitro
Formulasi Uji Rata-rata Penghambatan (%)a
F1 100,0 ± 0a F2 100,0 ± 0a F3 100,0 ± 0a F4 100,0 ± 0a F5 100,0 ± 0a F6 97,3 ± 4,67a F7 100,0 ± 0a F8 100,0 ± 0a F9 100,0 ± 0,a
a Angka selajur yang diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji Tukey pada taraf α 0,05.
Mineral dan karbon merupakan sumber penting yang mempengaruhi produksi antibiotik pada P. fluorescens (Duffy & Defago 1998). Kandungan mineral dan karbon yang tinggi pada limbah air kelapa diduga memicu senyawa
22
antibiotik yang dihasilkan P. fluorescens. Selain itu, faktor yang mempengaruhi produksi antibiotik pada P. fluorescens adalah populasinya (Nielsen et al. 1998). Jumlah populasi bakteri berbanding lurus dengan produksi antibiotik yang dihasilkan.
Penekanan Rebah Kecambah oleh P. fluorescens Secara In-vivo
P. fluorescens dapat menekan penyakit rebah kecambah secara in-vivo.
Mekanisme yang dilakukan oleh P. fluorescens dalam menekan perkembangan penyakit rebah kecambah adalah dengan mengolonisasi akar atau permukaan benih yang menjadi pintu utama masuknya patogen menuju sistem pembuluh. Parke et al. (1991) menyatakan bahwa P. fluorescens dapat diaplikasikan sebagai perlakuan benih untuk mengendalikan penyakit rebah kecambah.
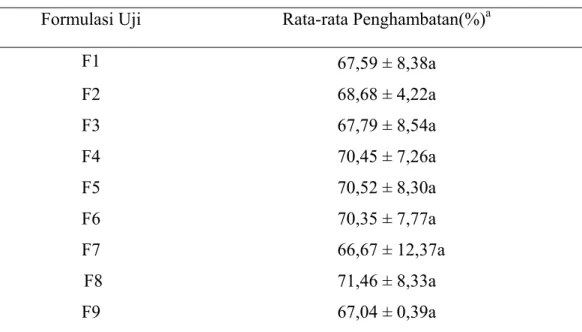
Tabel 4 Persentase Penghambatan S. rolfsii oleh P. fluorescens secara in-vivo Formulasi Uji Rata-rata Penghambatan(%)a
F1 67,59 ± 8,38a F2 68,68 ± 4,22a F3 67,79 ± 8,54a F4 70,45 ± 7,26a F5 70,52 ± 8,30a F6 70,35 ± 7,77a F7 66,67 ± 12,37a F8 71,46 ± 8,33a F9 67,04 ± 0,39a
a Angka selajur yang diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji Tukey pada taraf α 0,05.
Kemampuan P. fluorescens dalam menghambat perkembangan penyakit rebah kecambah dapat dilihat dari nilai persentase penghambatan S. rolfsii. Pengujian kemampuan P. fluorescens secara in-vivo menunjukkan bahwa P.
fluorescens mampu menghambat pertumbuhan S. rolfsii hingga 70%.
Berdasarkan Tabel 4, formulasi F8 merupakan formulasi uji yang memiliki nilai persentase penghambatan sebesar 71,46%. Nilai tersebut merupakan nilai tertinggi jika dibandingkan dengan formulasi uji lainnya. Hal ini mengindikasikan bahwa formulasi F8 dapat digunakan oleh P. fluorescens sebagai media alternatif yang
23
dapat mendukung pertumbuhannya, meskipun secara statistik tidak berbeda nyata antara satu formulasi dengan formulasi lainnya (Tabel lampiran 2).
Cole dan Zvenyika (1988) mengatakan bahwa aplikasi agens hayati pada tanah lebih efektif dan efisien dalam menghambat pertumbuhan patogen sehingga menciptakan kondisi lingkungan yang kondusif bagi perkembangan agens hayati. Kondisi ini akan semakin baik jika benih diberi perlakuan dengan menggunakan agens hayati dalam bentuk cair atau serbuk.
Pengaruh Formulasi P. fluorescens dalam Limbah Organik Terhadap Pertumbuhan Cabai
Pengaruh Formulasi P. fluorescens Terhadap Kemunculan Bibit (seed emergence) Cabai.
Perlakuan benih (seed treatment) merupakan teknik yang cukup potensial untuk menginduksi agens hayati dalam jumlah, tempat dan waktu yang tepat. Perlakuan benih cabai dengan formulasi P. fluorescens pada limbah organik dapat melindungi tumbuhan dari serangan patogen akar. Agrios (1996) menyatakan bahwa kelompok rhizobakteri, terutama P. fluorescens yang digunakan terhadap benih dan akar tanaman telah berhasil mengurangi beberapa penyakit seperti busuk lunak dan rebah kecambah serta dapat meningkatkan pertumbuhan dan hasil tanaman.
Benih cabai mulai berkecambah pada 6 HST dengan persentase kemunculan benih tertinggi pada formulasi F8, meskipun secara statistik nilai persentase kemunculan benih dari setiap formulasi uji tidak berbeda nyata (Tabel lampiran 4). Rata-rata kemunculan benih cabai menunjukkan bahwa perlakuan dengan formulasi F8 memiliki persentase kemunculan benih dengan nilai tertinggi yaitu 95,83%. Hal ini mengindikasikan bahwa formulasi F8 mampu meningkatkan persentase perkecambahan benih cabai, sedangkan formulasi F3 adalah formulasi hasil modifikasi dengan persentase kemunculan benih paling rendah (Tabel 5).
24
Tabel 5 Persentase Pengaruh Formulasi Limbah Organik Terhadap Kemunculan Benih (Seed Emergence) Cabai Pada 14 HST
Formulasi Uji Rata-rata Kemunculan Benih (%)a F1 83,86 ± 8,60a F2 89,06 ± 12,20a F3 82,30 ± 10,05a F4 91,15 ± 7,38a F5 81,25 ± 12,78a F6 82,81 ± 18,02a F7 91,66 ± 3,24a F8 95,83 ± 0,91a F9 85,93 ± 10,24a
a Angka selajur yang diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji Tukey pada taraf α 0,05.
Tingginya persentase perkecambahan benih cabai terutama pada formulasi F8 diduga karena adanya aktivitas P. fluorescens yang memiliki kemampuan memicu pertumbuhan tanaman (PGPR). Kloepper dan Schroth dalam Hasanuddin (2003) mengatakan bahwa kemampuan PGPR sebagai agens pengendalian hayati adalah karena memiliki kemampuan bersaing untuk mendapatkan zat makanan, atau karena hasil-hasil metabolit sekunder seperti siderofor, hidrogen sianida, antibiotik, atau enzim ekstraselluler yang bersifat antagonis melawan patogen. Perlakuan benih dengan isolat rhizobakteri (P. fluorescens) memberikan dampak positif terhadap perkecambahan benih dan pertumbuhan bibit cabai (Widodo et al. 2006).
Pengaruh Formulasi Terpilih P. fluorescens dalam Limbah Organik Terhadap Vigor Bibit Cabai
Berdasarkan data-data pengamatan sebelumnya didapatkan bahwa formulasi F8 (AK: TH: LI = 15 : 84 : 1) memberikan hasil yang baik bagi perkecambahan benih cabai dan menekan perkembangan S. rolfsii serta mengurangi intensitas penyakit rebah kecambah. Formulasi F8 adalah formulasi dengan potensi terbaik yang dapat digunakan pada uji lanjut yaitu pengujian terhadap vigor tanaman. Formulasi dengan potensi terbaik memiliki arti bahwa formulasi uji tersebut mampu menunjukkan hasil mendekati, menyamai atau melebihi formulasi kontrol
25
serta bersifat konsisten. Formulasi F8 memiliki nilai penghambatan penyakit rebah kecambah dan kemunculan benih paling tinggi diantara semua formulasi uji. Oleh karena itu, formulasi F8 diduga sebagai formulasi yang memiliki komposisi terbaik sehingga aplikasi P. fluorescens dapat optimal. Penambahan filtrat orok-orok pada formulasi F8 bertujuan untuk meningkatkan kandungan nutrisi yang dimiliki F8 sehingga kinerja formulasi F8 di lapangan diharapkan mampu menunjukkan performa yang lebih baik.
Penambahan filtrat orok-orok digunakan untuk meningkatkan nutrisi formulasi F8 yang dapat dimanfaatkan oleh P. fluorescens sehingga keefektifannya sebagai agens hayati dan pemicu pertumbuhan tanaman meningkat. Akan tetapi, jumlah konsentrasi filtrat orok-orok sangat mempengaruhi kemampuan P. fluorescens, hal ini dapat terlihat dari pendaran (fluoresensi) yang dihasilkan P. fluorescens. Diantara konsentrasi 0%, 1%, 2,5% dan 5% terlihat bahwa formulasi F8 yang telah ditambahkan 1% filtrat orok-orok memiliki pendaran yang paling terang diantara konsentrasi lainnya (Gambar 3). Hal ini mengindikasikan bahwa penambahan ekstrak orok-orok dengan konsentrasi tersebut dapat meningkatkan kemampuan P. fluorescens dalam meningkatkan senyawa antibiotik dan siderofor.
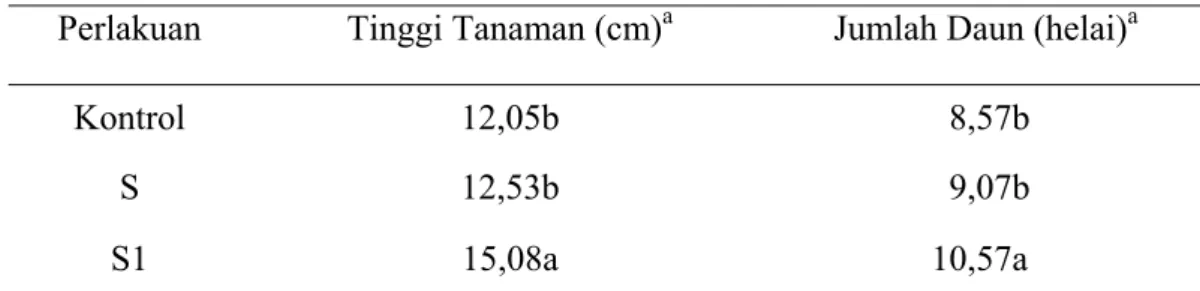
Tabel 6 Pengaruh Formulasi F8 dengan Penambahan 1% Filtrat Orok-orok Terhadap Jumlah Daun dan Tinggi Tanaman Cabai
Perlakuan Tinggi Tanaman (cm)a Jumlah Daun (helai)a Kontrol 12,05b 8,57b
S 12,53b 9,07b
S1 15,08a 10,57a
a Angka selajur yang diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji Tukey pada taraf α 0,05.
Pengujian keefektifan formulasi F8 termodifikasi (penambahan 1% filtrat orok-orok) yang dilakukan terhadap pembibitan cabai dapat mempengaruhi vigor tanaman meliputi tinggi tanaman dan jumlah daun. Tinggi tanaman dan jumlah daun yang diaplikasi P. fluorescens pada perlakuan S1 berbeda nyata dengan kontrol dan S (Tabel lampiran 5 dan 6). Pengaruh formulasi F8 termodifikasi
26
menunjukkan bahwa perlakuan S1 mampu menghasilkan tinggi tanaman dan jumlah daun yang lebih baik dibandingkan dengan perlakuan (Tabel 6).
Gambar 3. Perbandingan formulasi F8 termodifikasi dengan penambahan filtrat orok-orok 0% (kiri) dan 1% (kanan)
Modifikasi formulasi F8 dengan penambahan 1% filtrat orok-orok diduga mampu menambah nutrisi pada formulasi P. fluorescens sehingga dapat mengaktivasi hormon pemicu pertumbuhan tanaman (IAA). Selain itu, komposisi limbah organik formulasi F8 mengindikasikan bahwa nutrisi yang terkandung dalam limbah organik dapat meningkatkan kemampuan P. fluorescens dalam menginduksi ketahanan terhadap tanaman cabai. Hal ini dapat dilihat dari tingginya persentase kemunculan benih dan penghambatan S. rolfsii secara in-vivo pada formulasi F8.
Aplikasi formulasi F8 dengan penambahan 1% filtrat orok-orok pada perlakuan S1 dapat memicu pertumbuhan tinggi tanaman dan jumlah daun sebesar 25,15% dan 23,34% pada 6 MST. Selain menghasilkan senyawa metabolit sekunder seperti antibiotik, P. fluorescens juga menghasilkan siderofor yang dapat mengkelat zat besi sehingga patogen dalam tanah tidak memperoleh zat besi untuk pertumbuhannya. Zat besi sangat penting sebagai mikronutrisi yang digunakan bakteri untuk melakukan metabolisme. Siderofor adalah senyawa organik selain antibiotik yang dapat berperan dalam pengendalian hayati penyakit tumbuhan. Siderofor diproduksi secara ekstrasel, senyawa dengan berat molekul rendah dan affinitas yang sangat kuat terhadap besi (III). Kemampuan siderofor mengikat besi (III) merupakan pesaing terhadap mikroorganisme lain, dengan kata lain siderofor
27
berperan aktif dalam menekan pertumbuhan mikroorganisme patogen (Fravel 1988).
Selain berperan sebagai agen pengkelat zat besi, siderofor juga aktif sebagai faktor pertumbuhan dan beberapa diantaranya berpotensi sebagai antibiotik (Neilands dalam Hasanuddin 2003). Wong dan Baker (1984) menyatakan bahwa salah satu mekanisme P. fluorescens dalam menekan pertumbuhan cendawan patogen adalah dengan persaingan zat besi. Cendawan patogen tidak menunjukkan kemampuan menghasilkan siderofor jenis yang sama dengan yang dihasilkan P. fluorescens sehingga cendawan patogen mengalami defisit unsur besi yang menyebabkan pertumbuhan patogen menjadi terhambat (Neilands dan Leong dalam Hasanuddin 2003).
KESIMPULAN DAN SARAN
Kesimpulan
Limbah air kelapa, air tahu dan pengolahan ikan berpotensi sebagai media alternatif bagi pertumbuhan P. fluorescens. Komposisi formulasi F8 dengan perbandingan air kelapa, air tahu dan pengolahan ikan 15:84:1 mampu mendukung pertumbuhan P. fluorescens serta menekan S. rolfsii secara in-vitro dan in-vivo. Penambahan 1% filtrat orok-orok pada formulasi F8 dan aplikasinya seminggu sekali (S1) dapat meningkatkan tinggi dan jumlah daun tanaman cabai sebesar 25,15% dan 23,34%.
Saran
Perlu dilakukan penelitian lanjutan tentang peningkatan keefektifan formulasi P. fluorescens melalui pengujian jumlah konsentrasi dan waktu aplikasi di lapangan untuk menekan penyakit rebah kecambah oleh S. rolfsii dan pemicu pertumbuhan tanaman cabai. Perlu juga dilakukan pengkajian terhadap daya simpan dan efektifitas dalam jangka waktu yang cukup lama.
DAFTAR PUSTAKA
Agrios GN. 1996. Ilmu Penyakit Tumbuhan. Edisi Ketiga. Munzir Busnia, penerjemah.Yogyakarta: Gadjah Mada University Press. Terjemahan dari:
Plant Pathology.
Anonim. 2007. Nata dibuat, lingkungan sehat. www.indomedia.com/intisari [26 Juni 2009].
Campbell R. 1989. Biological control of microbial plant pathogens. Cambridge: Cambridge Univeristy Press.
Cole JS dan Zvenyika Z. 1988. Integrated control of Rhizoctonia solani dan
Fusarium solani in tobacco transplant with Trichoderma harzianum and
tridimenol. Plant Pathology 37:271-277.
Cook RJ. 2002. Biological control of crop diseases. New York: Marcel Dekker Inc.
Crowley DE, M. U. Brennerova, C. Irwin, V. Brenner, dan Focht DD. 1996. Rhizosphere effects on biodegradation of 2,5-dichlorobenzoate by bioluminescens strain of root colonizing Pseudomonas fluorescens. FEMS.
Microbiol. Ecol. 20:79-80.
Duffy BK, Defago G. 1998. Environmental factors modulating antibiotics and siderophore bioshynthesis by Pseudomonas fluorescens biocontrol strain.
Applied and Environmental Microbiology 65(6):2429-2438.
Fravel DR. 1988. Role of antibiosis in the biocontrol of plant diseases.
Phytopathology 26:75-91.
Frederiksen RA. 1986. Compendium of sorghum diseases. Phytophatology 33:35-36.
Ganesan P dan Gnanamanickam. 1986. Biological control of Sclerotium rolfsii
sacc. in peanut by inoculation with Pseudomonas fluorescens . Centre of
Advanced Study in Botany. University of Madras India.
Giyanto, Nawangsih AA dan Mutaqin KH. 1998. Analisis keragaman molekuler
Pseudomonas kelompok fluorescens dengan teknik RAPD (Random
Amplified Polymorphic DNA) dan studi antagonistik terhadap Ralstonia
solanacearum pada tomat. Laporan Penelitian Proyek Pengkajian dan
Penelitian Ilmu Pengetahuan dasar. Dirjen Pendidikan Tinggi. Departemen Pendidikan Nasional.
Hamdan H, Weller DM, Thomashow LS. 1991. Relative importance of fluorescent shiderophores and other factors in biological control of
Gaeumannomyces graminis var tritici by Pseudomonas fluorescens 2-79
and M4-80R. Applied and Environmental Microbiology 57(11):3270-3277. Hasanuddin. 2003. Peningkatan peranan mikroorganisme dalam sistem
pengendalian penyakit tumbuhan secara terpadu [artikel on-line]. www.digi.usu.ac.id [13 Januari 2011].
30
Hariyadi P, Budijanto S dan Permana AW. 2002. Pemanfaatan limbah cair tahu untuk memproduksi ingredient pangan fungsional [LP]. Bogor: Lembaga Penelitian, Institut Pertanian Bogor.
Howell CR, Stipanovic RD. 1979. Control of Rhizoctonia solani in cotton seedling with Pseudomonas fluorescens with an antibiotic produced by this bacterium. Phytopatology 69:480-482.
Howell CR, Stipanovic RD. 1980. Supression Phytium ultimum induced damping-off of cotton seedlings by Pseudomonas fluorescens and its antibiotic pyoluteorin. Phytopatology 70:712-715.
Kloepper JW, Leong J, Teinze M dan Schruth MN. 1980. Enhanced plant growth by siderophores produced by plant growth promoting rhizobacteria. Natur 286:885-886.
Kusumowardani, A. 2008. Kajian jenis limbah, suhu dan lama penyimpanan terhadap daya tahan dan potensi antagonisme Pseudomonas
fluorescens[skripsi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor.
Marwoso E. 2005. Pemanfaatan bakteri perakaran pemacu pertumbuhan tanaman (PGPR) untuk mengendalikan virus daun kecil kacang panjang (Cowpea
little leaf virus) [skripsi]. Bogor: Fakultas Pertanian, Institut Pertanian
Bogor.
Mazolla M, Cook RJ, Thomashow LS, Weller DM, Pierson LS. 1992. Contribution of phenazine antibiotic bioshynthesis to the ecological competence of fluorescens pseudomonads in soil habitans. Apllied and
Environmental Microbiology 64(10):3563-3569.
Meidina, Sugiyono, Jenie BSL, Suhartono MT. 2007. Aktivitas antibakteri oligomer kitosan yang diproduksi menggunakan kitonase dari isolat B.
licheriformis MB-2 [jurnal on-line]. www.menlh.go.id [13 Januari 2011].
Natsch A, Keel C, Hebecker N, Laasik E, Defago G. 1997. Influence of biocontrol strain Pseudomoonas fluorescens CHAO and its antibiotic overproducing derivative on the diversity of residents root colonizing pseudomonands.
FEMS Microbiol. Ecol. 23:341-352
Nielsen MN, Sorensen J dan Pedersen JC. 1998. Secondary metabolite and endochitinase dependent antagonisme toward plant pathogenic microfungi of Pseudomonas fluorescens isolated from sugar beet rhizosfer. Applied and
Environmental Microbiology 65(10):3563-3569.
Parke JL, Rand RE, Joy AE, King EB. 1991. Biological control of damping-off and Aphanomyces root rot of peas by aplication of Pseudomonas cepacia or
P. fluorescens to seed. Plant Diseases. 75:987-992.
Pelczar MJ, Chan ECS. 2006. Dasar-dasar Mikrobiologi. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah. Jakarta: UI Press. Terjemahan dari: Elements of Microbiology.
31
Ratdiana. 2007. Kajian pemanfaatan air kelapa dan limbah cair peternakan sebagai media alternatif perbanyakan Pseudomonaas fluorescens serta uji potensi antagonismenya terhadap Ralstonia solanacearum [skripsi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor.
Rina Z. 1993. Pengaruh bakteri Pseudomonas fluorescens dalam menekan serangan Sclerotium rolfsii sacc. penyebab penyakit rebah kecambah pada cabai dan kedelai [skripsi]. Padang: Fakultas Pertanian, Universitas Andalas.
Rinaudo M. 1999. Influence of acetic acid concentration on the solubilization of chitosan. Polymer 40:7029-7032
Rochima E, Suhartono MT, Syah D, Sugiyono. 2007. Viskositas dan berat molekul kitosan hasil reaksi enzimatis kitin deasetilase isolat Bacillus
papandayan K29-14 [jurnal on-line]. www.unpad.ac.id [13 Januari 2011].
Shahidi F, Arachchi JKV, Jeon Y. 1999. Food applications of chitin and chitosans. Trend Foods Sci Technol 10:37-51.
Singh RS, Sitaramaiah K. 1999. Plant pathogens: the plant parasitic nematodes. New York: International Science Publisher.
Tjondronegoro PD, Natasaputra M, Gunawan AW, Djaelani M, Suwanto, A. 1989. Botani umum. Bogor: PAU Ilmu Hayati Institut Pertanian Bogor. Thirupati V, Rajam P, Narayanan L. 2007. Value added product from coconut.
Science Tech Enterpreneur. www.technopreneur.net [26 Juni 2009].
Vigliar R, Sdepanin VL, Neto UF. 2006. Biochemical profile of coconut water from coconut palms planted in an inland region. Jornal de Pediatria 82(4):308-312.
Widodo, Sudarsono, Ilyas S, Sutariati GAK. 2006. Pengaruh perlakuan rhizobakteri pemacu pertumbuhan tanaman terhadap viabilitas benih serta pertumbuhan bibit cabai. Bul. Agron 34(1):46-54 [jurnal on-line]. www.journal.ipb.ac.id [16 Januari 2011].
Wong PTW dan Baker R. 1984. Supression of wheat take-all and Ophiobolus patch by fluorescens Pseudomonads from Fusarium-suppressive soil. Biol.
LAMPIRAN
Lampiran 1 Hasil analisis ragam rata-rata jumlah koloni P. fluorescens pada formulasi uji setelah 10 jam inokulasi
Sumber
Keragaman Derajat Bebas Kuadrat Jumlah Kuadrat Tengah F Hitung (Fh) F Tabel (Ft) Perlakuan 8 7,82299643 0,977874553 35,66148146 2,48
Galat 19 0,52099957 0,02742103
Total 27 8,343996
Lampiran 2 Hasil analisis ragam penghambatan S. rolfsii oleh P. fluorescens secara in-vivo
Sumber
Keragaman Derajat Bebas Kuadrat Jumlah Kuadrat Tengah F Hitung (Fh) F Tabel (Ft) Perlakuan 8 75,391111 9,423888875 0,1499 2,51
Galat 18 1131,389989 62,85499939
Total 26 1206,784
Lampiran 3 Hasil analisis ragam penghambatan S. rolfsii oleh P. fluorescens secara in-vitro
Sumber
Keragaman Derajat Bebas Kuadrat Jumlah Kuadrat Tengah F Hitung (Fh) F Tabel (Ft) Perlakuan 8 19,436667 2,429583375 0,99 2,51
Galat 18 43,743333 2,430185167 Total 26 63,18
Lampiran 4 Hasil analisis ragam persentase pengaruh formulasi limbah organik terhadap kemunculan benih (seed emergence) cabai Sumber
Keragaman Derajat Bebas Kuadrat Jumlah Kuadrat Tengah F Hitung (Fh) F Tabel (Ft) Perlakuan 8 18,69945967 2,337432459 1,116911377 1,8
Galat 45 59,27428333 1,317206296 Total 53 77,973743
33
Lampiran 5 Hasil analisis ragam pengaruh formulasi F8 termodifikasi terhadap tinggi tanaman cabai
Sumber Keragaman Derajat Bebas Jumlah Kuadrat Kuadrat Tengah F Hitung (Fh) F Tabel (Ft) Perlakuan 2 159,3722267 79,68611335 31,92091958 3,19 Galat 87 217,1833378 2,496360205 Total 89 376,55556
Lampiran 6 Hasil analisis ragam pengaruh formulasi F8 termodifikasi terhadap jumlah daun tanaman cabai
Sumber Keragaman Derajat Bebas Jumlah Kuadrat Kuadrat Tengah F Hitung (Fh) F Tabel (Ft) Perlakuan 2 66 33 22,15277778 3,19 Galat 87 129,6 1,489655 Total 89 195,6