BAB II
TINJAUAN PUSTAKA
2.1 Bahan Tambahan Pangan
Bahan Tambahan Pangan (BTP) adalah bahan yang ditambahkan ke dalam pangan untuk mempengaruhi sifat dan bentuk pangan, baik yang mempunyai atau tidak mempunyai nilai gizi (BPOM RI, 2011 dan BPOM RI, 2004).
Menurut ketentuan yang ditetapkan, ada beberapa kategori Bahan Tambahan Makanan. Pertama, Bahan Tambahan Makanan yang bersifat aman, dengan dosis yang tidak dibatasi, misalnya pati. Kedua, Bahan Tambahan Makanan yang digunakan dengan dosis tertentu, dan dengan demikian dosis maksimum penggunaannya juga telah ditetapkan. Ketiga, bahan tambahan yang aman dan dalam dosis yang tepat, serta telah mendapatkan izin beredar dari instansi yang berwenang, misalnya zat pewarna yang sudah dilengkapi sertifikat aman (Yuliarti, 2007).
Menurut Yuliarti (2007), beberapa Bahan Tambahan Makanan yang telah diizinkan oleh Badan POM, diantaranya:
1. Pengawet: natrium benzoat, kalium sorbat, nisin 2. Pewarna: tartrazin
3. Pemanis: aspartam, sakarin dan siklamat 4. Penyedap rasa: monosodium glutamat
5. Antikempal: aluminium silikat, magnesium karbonat, trikalsium fosfat 6. Antioksidan: asam askorbat, alfa tokoferol
7. Pengemulsi, pemantap dan pengental: lesitin, sodium laktat dan potassium laktat.
2.2. Pembagian Pemanis 2.2.1 Pemanis Alami
Pemanis alami yang sering digunakan untuk makanan, terutama adalah tebu dan bit. Kedua jenis pemanis ini sering disebut gula alam atau sukrosa. Selain itu ada berbagai pemanis lain yang dapat digunakan untuk makanan, diantaranya laktosa, maltosa, galaktosa, glukosa, fruktosa, sorbitol, manitol (Yuliarti, 2007). 2.2.2 Pemanis Buatan
Pemanis buatan merupakan bahan tambahan yang dapat memberikan rasa manis dalam makanan, tetapi tidak memiliki nilai gizi. Sebagai contoh adalah sakarin, siklamat, aspartam. Sekalipun penggunaannya diizinkan, pemanis buatan dan juga bahan kimia yang lain sesuai peraturan penggunaannya harus dibatasi. Alasannya, meskipun pemanis buatan tersebut aman dikonsumsi dalam kadar yang kecil, tetap saja dalam batas-batas tertentu akan menimbulkan bahaya kesehatan bagi manusia maupun hewan yang mengonsumsinya (Yuliarti, 2007).
2.3 Aspartam
Aspartam ditemukan secara kebetulan oleh James Schulter pada tahun 1965, ketika mensintesis obat-obat untuk bisul atau borok. Asparrtam adalah senyawa metil ester dipeptida, yaitu L-aspartil-L-alanin-metilester dengan rumus C14H18N2O5 memiliki daya kemanisan 100-200 kali sukrosa (Cahyadi, 2009; Tan,
2007).
Pada penggunaannya dalam minuman ringan, aspartam kurang menguntungkan karena penyimpanan dalam waktu yang lama mengakibatkan
turunya rasa manis. Selain itu, aspartam tidak tahan panas sehingga tidak baik digunakan dalam bahan pangan yang diolah melalui pemanasan (Cahyadi, 2009). 2.3.1 Sifat Fisika dan Kimia
2.3.1.1 Struktur
Gambar 1. Struktur kimia dari Aspartam (Butchko, 2001). 2.3.1.2 Rumus Molekul C14H18N2O5 (O’Donnell, 2006). 2.3.1.3 Berat Molekul 294,30 (Glória, 2003). 2.3.1.4 Nama Kimia (3S)-3-Amino-4-[[(2S)-1-methoxy-1-oxo-3-phenylpropan-2-yl]amino]-4- oxobutanoic acid (The Department of Health, 2012).
2.3.1.5 Pemerian
Senyawa yang tidak berbau, putih atau hampir putih, sedikit higroskopis, serbuk kristal (Cahyadi, 2009; Martindale, 2009; The Department of Health, 2012). 2.3.1.6 Stabilitas
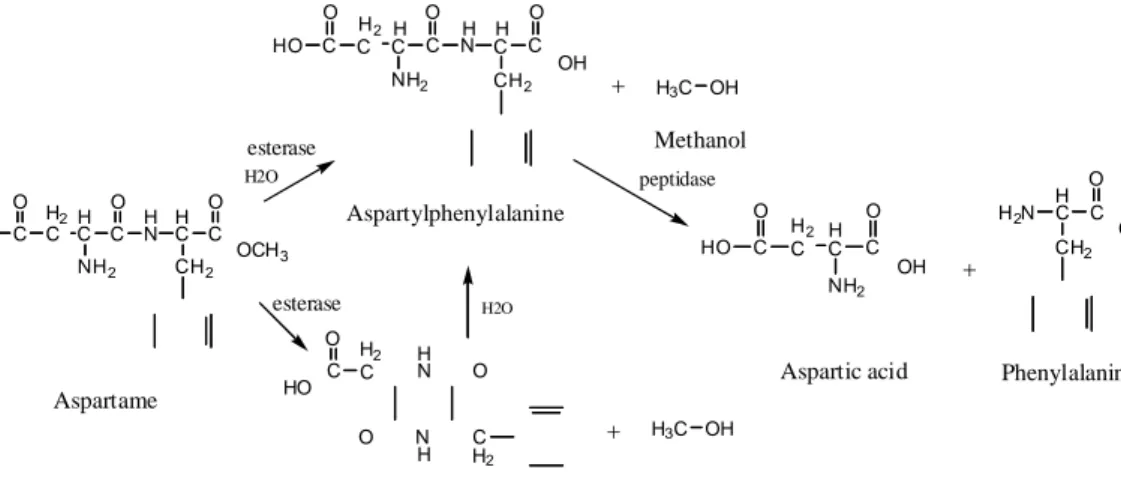
Dalam larutan dan pada keadaan tertentu seperti pencampuran, temperatur, dan pH, ikatan ester terhidrolisis membentuk dipeptida aspartilfenilalain dan metanol. Pada akhirnya, aspartilfenilalanin dapat terhidrolisis menjadi dua asam amino, yaitu asam aspartat dan fenilalanin. Kemungkinan yang lain, metanol
mungkin juga dihidrolisis dari siklisasi aspartam menjadi diketopiperazin (DKP) (Butchko, 2001). Hal serupa terjadi juga dalam tubuh, dimana aspartam akan dihidrolisis oleh enzim proteolitik yang ada dalam usus halus dan sel mukosa menjadi asam aspartat (40%), fenilalanin (50%), dan metanol (10%) (O’Donnel, 2006). O O O H2 H H H HO C esterase H2O C C C NH2 N C C OH CH2 + H3C OH Methanol peptidase O H O H 2 H O H H O Aspartylphenylalanine O O H2N C C HO C C C C N C C H2 H OH NH2 CH2 OCH3 esterase O H 2 H H2O HO C C C C OH + NH2 CH2 Aspartame C C N O HO O N C H H2 + H3C OH
Aspartic acid Phenylalanine
Diketopiperazine Methanol
Gambar 2. Prinsip konversi produk aspartam (Butchko, 2001).
Pada suhu 25 °C, stabilitas maksimum aspartam ditunjukkan pada pH 4,3. Aspartam berfungsi dengan sangat baik di atas interval pH 3-5, tetapi kebanyakan stabil pada suasana asam lemah yang mana kebanyakan digunakan dalam industri makanan, yaitu antara pH 3 dan 5 (Butchko, 2001; O’Donnel, 2006; Smith, 2003).
Gambar 3. Stabilitas aspartam dalam larutan dapar pada suhu 25°C (Butchko, 2001).
2.3.1.7 Kelarutan
Sedikit larut dalam air (pada suhu 20 °C, pH 4,5-6,0 sebanyak 36%) dan dalam alkohol (pada suhu 25 °C sebanyak 0,4%) (Smith, 2003); praktis tidak larut dalam diklorometana, n-heksan dan dalam metilen klorida (Martindale, 2009; The Department of Health, 2012)
2.3.2 Sinonim
N-L-α-Aspartyl-L-phenylalanine-1-Methyl Ester; Aspartylphenylalanine methyl ester; 3-Amino-N-(α-carboxyphenethyl)succinamic acid N-methyl ester; N- L-α-aspartyl-L-phenylalaninate; APM; Aspartaam; Aspartamas; Aspartamo; Aspartamum (Commite of Food Chemical Codex, 2004; Smith, 2003; The United State Pharmacopoeia Convention, 2007; Martindale, 2009).
2.3.3 Sintesis
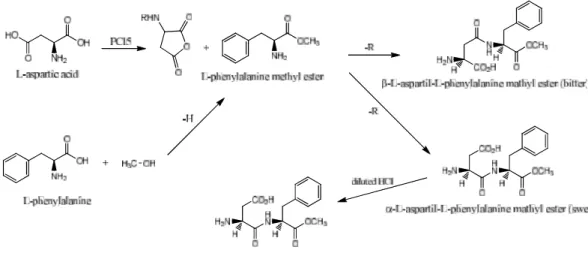
Sintesis aspartam dalam skala besar diperoleh melalui reaksi:
Gambar 4. Reaksi sintesis pembentukan aspartam (Belitz, 2009).
Bahan baku untuk produksi aspartam adalah dua asam amino, yaitu fenilalanin dan asam aspartat. Gugus reaktif dari asam amino diproteksi pertama kali, dengan pengecualian gugus yang akan membentuk ikatan metil ester. Kedua
asam amino kemudian digandengkan dengan yang lain secara kimia atau enzimatis dan gugus reaktif dihilangkan. Langkah ini diikuti dengan tahap melarutkan dengan HCl dan kristalisasi untuk menghilangkan pengotor atau zat asing (O’Donnell, 2006).
2.3.4 Metabolisme
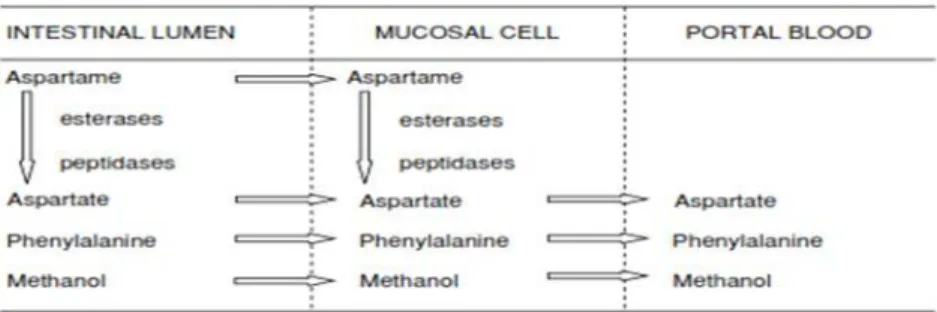
Aspartam dapat dihidrolisis dan dimetabolisme dalam dua jalur utama, yaitu melalui intesitnal lumen dan sel mukosa. Dalam keduanya, keadaan dosis aspartam yang besar akan melepaskan aspartat, fenilalanin dan metanol ke dalam aliran darah, dan senyawa ini dimetabolisme dan atau diekskresikan (Salminen dan Hallikainen, 2002). Aspartam diabsorbsi dan dimetabolisme mengikuti laju kinetika orde pertama. Aspartam dihidrolisis dalam usus halus oleh enzim proteolitik dan hidrolitik menjadi aspartat, fenilalanin, dan metanol (Glória, 2003).
Gambar 5. Diagram metabolisme Aspartam (Glória, 2003) 2.3.5 Toksisitas
Efek samping yang tersering timbul pada dosis tinggi dapat berupa nyeri kepala dan lambung, pusing, mual, muntah dan perubahan suasana jiwa, lebih jarang reaksi alergi dan serangan epilepsi. Ada kalanya aspartam dalam Cola light dapat mencetuskan serangan migrain. Tidak boleh diberikan pada anak-anak dan wanita hamil dengan fenilketonuria (PKU), dimana terdapat kekurangan enzim yang mengubah fenilalanin menjadi tirosin. Sebabnya adalah fenilalanin akan menumpuk dalam darah dan dapat merusak saraf otak (Tan dan Rahardja, 2007).
2.3.6 Metode Analisis Lain untuk Penetapan Kadar Aspartam
2.3.6.1 Penetapan Kadar Aspartam dengan Metode Titrasi Bebas Air
Penetapan kadar Aspartam dengan metode titrasi bebas air menggunakan asam perklorat 0,1 N sebagai pentiter. Prosedur penetapan kadar aspartam dengan metode titrasi asam basa, yaitu dengan menimbang secara teliti 300 mg sampel (aspartam) dan dilarutkan dengan 1,5 ml asam formiat 96% dalam erlenmeyer 150 ml. Ditambah 60 ml asam asetat glasial dan kristal violet sebagai indikator, kemudian dititrasi dengan asam perklorat 0,1 N hingga terbentuk warna hijau. Setiap ml asam perklorat 0,1 N setara dengan 29,43 mg C14H18N2O5 (The United
State Pharmacopoeia Convention, 2007).
2.3.6.2 Penetapan Kadar Aspartam dengan Metode Spektrofotometri Ultraviolet
Penentuan kadar aspartam secara kuantitatif dapat dilakukan dengan spektrofotometri. Mula-mula aspartam dilarutkan dengan HCl 2 N. Kemudian panaskan supaya terjadi hidrolisis menghasilkan fenilalanin. Analisis kuantitatif memerlukan tahap pemisahan zat aktif dengan zat pengotor lainnya dengan cara ekstraksi. Ekstraksi yang dilakukan adalah ekstraksi cair-cair, yaitu zat yang telah dilarutkan diekstraksi dengan kloroform sebanyak 2 kali masing-masing 10 menit, kemudian fase organik dipisahkan dari fase air. Fase air diekstraksi kembali dengan petroleum eter selama 10 menit. Pengukuran dilakukan pada fase air (Cahyadi, 2009) pada panjang gelombang 200-217 nm (Glória, 2003).
2.4 Kromatografi
2.4.1 Sejarah Kromatografi
Kromatografi pertama kali dikembangkan oleh ahli botani Rusia pada tahun 1903 yang bernama Michael Tswett untuk memisahkan pigmen warna dalam
tanaman dengan cara perkolasi ekstrak petroleum eter dalam kolom gelas yang berisi CaCO3. Oleh karena itu, diberi nama kromatografi yang berasal dari bahasa
Yunani “chroma” yang berarti warna dan “grapein” yang berarti menulis (Wonorahardjo, 2013). Saat ini kromatografi merupakan teknik pemisahan yang paling umum dan paling sering digunakan dalam bidang kimia analisis dan dapat dimanfaatkan untuk melalukan analisis, baik analisis kualitatif, analisis kuantitatif, atau preparatif dalam bidang farmasi, industri dan lain sebagainya (Gandjar dan Rohman, 2008).
Organisasi standar internasional IUPAC (International Union of Pure and
Applied Chemistry) mendefinisikan kromatografi sebagai metode pemisahan secara
fisika yang mana komponen-komponen yang akan dipisahkan terbagi diantara dua fase, yang satu adalah fase diam sementara yang lain adalah fase gerak yang bergerak pada arah tertentu (Gandjar dan Rohman, 2012).
2.4.2 Klasifikasi Kromatografi
Prinsip dari metode kromatografi adalah distribusi komponen sampel antara dua fase, yakni fase diam dan fase gerak. Fase diam dalam praktiknya adalah cairan yang terikat pada permukaan padatan sehingga tidak dapat bergerak, atau padatan itu sendiri. Sedangkan, fase gerak adalah cairan atau gas pembawa yang tidak bereaksi dengan senyawa-senyawa yang dipisahkan (Wonorahardjo, 2013).
Klasifikasi tipe kromatografi yang paling umum adalah berdasarkan tipe fase gerak dan fase diam. Kromatografi gas-cair atau kromatografi cair-cair, kromatografi gas, sering menjadi penanda suatu jenis kromatografi. Yang sering digunakan adalah tipe fase geraknya, seperti kromatografi gas merujuk pada fase gerak gas (dan fase diam padat atau cair, tetapi tidak disebut), kromatografi cair
menunjukkan fase gerak cair (dan fase diam padat atau cair, tetapi tidak disebut). Jika kedua fase disebut ini berarti bahwa kromatografi dibuat secara spesifik untuk tujuan tertentu (Wonorahardjo, 2013).
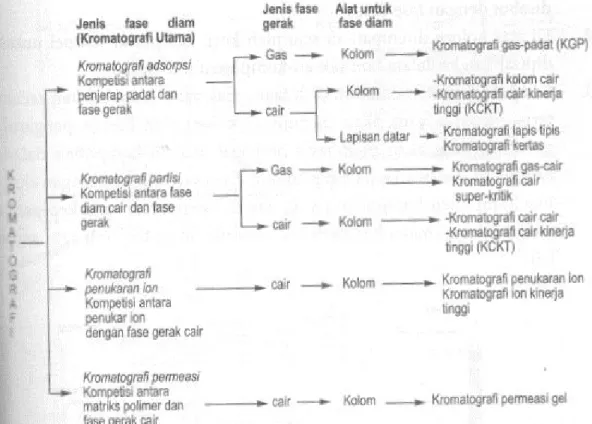
Berdasarkan pada mekanisme pemisahannya, kromatografi dibedakan menjadi : (a) kromatografi adsorbsi; (b) kromatografi partisi; (c) kromatografi pasangan ion; (d) kromatografi penukar ion (e) kromatografi eksklusi ukuran dan (f) kromatografi afinitas (Rohman, 2009).
Berdasarkan pada alat yang digunakan, kromatografi dapat dibagi atas: (a) kromatografi kertas; (b) kromatografi lapis tipis, yang kedua sering disebut kromatografi planar; (c) kromatografi cair kinerja tinggi (KCKT) dan (d) kromatografi gas (KG) (Rohman, 2009).
Gambar 6. Pengelompokkan kromatografi secara umum (Gandjar dan Rohman, 2012).
2.5 Kromatografi Cair Kinerja Tinggi 2.5.1 Jenis KCKT
Hampir semua jenis campuran solut dapat dipisahkan dengan KCKT karena banyaknya fase diam yang tersedia dan selektifitas yang dapat ditingkatkan dengan mengatur fase gerak. Pemisahan dapat dilakukan dengan fase normal atau fase terbalik tergantung pada polaritas relatif fase diam dan fase gerak. Berdasarkan pada kedua pemisahan ini, sering kali KCKT dikelompokkan menjadi KCKT fase normal dan KCKT fase terbalik. Berdasarkan mekanisme interaksi antara analit dengan fase diam, kromatografi cair dapat dibagi menjadi 4 metode, yakni: kromatografi fase normal (normal phase chromatography) atau disebut juga kromatografi adsorpsi (adsorption chromatography), kromatografi fase balik (reversed-phase chromatography), kromatografi penukar ion (ion-exchange
chromatography) dan kromatografi eksklusi ukuran (size-exclusion
chromatography) (Gandjar dan Rohman, 2008).
Kromatografi fase balik menggunakan fase diam dari silika yang dimodifikasi secara kimiawi. Fase diam yang paling popular digunakan adalah oktadesilsilan (ODS atau C18) yang relatif non polar sedangkan fase geraknya relatif
lebih polar daripada fase diam. Kondisi kepolaran kedua fase ini merupakan kebalikan dari kromatografi fase normal sehingga disebut kromatografi fase balik (Meyer, 2010).
2.5.2 Proses Pemisahan dalam Kolom Kromatografi Cair
Pemisahan analit dalam kolom kromatografi berdasarkan pada aliran fase gerak yang membawa campuran analit melalui fase diam dan perbedaan interaksi
analit dengan permukaan fase diam sehingga terjadi perbedaan waktu perpindahan setiap komponen dalam campuran (Meyer, 2010).
Sebagai contoh, campuran dua komponen dimasukkan ke dalam sistem kromatografi adsorbsi (fase normal) yang dinotasikan sebagai partikel ● (nonpolar) dan ▲ (polar) (Gambar 7a). Masuknya eluen (fase gerak/nonpolar) ke dalam kolom akan menimbulkan kesetimbangan baru.
Gambar 7 . Ilustrasi proses pemisahan yang terjadi di dalam kolom KCKT (Meyer, 2010).
Molekul sampel dalam fase gerak diadsorpsi sebagian oleh permukaan fase diam berdasarkan pada koefisien distribusinya, di mana komponen ▲ cenderung menetap di fase diam dan komponen ● lebih cenderung di dalam fase gerak (Gambar 7b), sedangkan molekul yang sebelumnya diadsorpsi akan muncul kembali di fase gerak (Gambar 7c). Setelah proses ini terjadi berulang kali, kedua komponen akan terpisah. Komponen ● yang lebih suka dengan fase gerak akan berpindah lebih cepat daripada komponen ▲ yang cenderung menetap di fase diam, sehingga komponen ● akan muncul terlebih dahulu dalam kromatogram, kemudian diikuti oleh komponen ▲(Gambar 7d) (Meyer, 2010).
2.5.3 Parameter Penting dalam Kromatografi Cair 2.5.3.1 Tinggi dan Luas Puncak
Tinggi dan luas puncak berkaitan secara proporsional dengan kadar atau jumlah analit tertentu yang terdapat dalam sampel (memiliki informasi kuantitatif). Namun demikian, luas puncak lebih umum digunakan dalam perhitungan kuantitatif karena lebih akurat/cermat daripada perhitungan menggunakan tinggi puncak. Hal ini dikarenakan luas puncak relatif tidak banyak dipengaruhi oleh kondisi kromatografi, kecuali laju alir. Sementara itu, tinggi puncak dipengaruhi oleh banyak faktor seperti misalnya faktor tambat, suhu kolom serta cara injeksi sampel (Ornaf dan Dong, 2005).
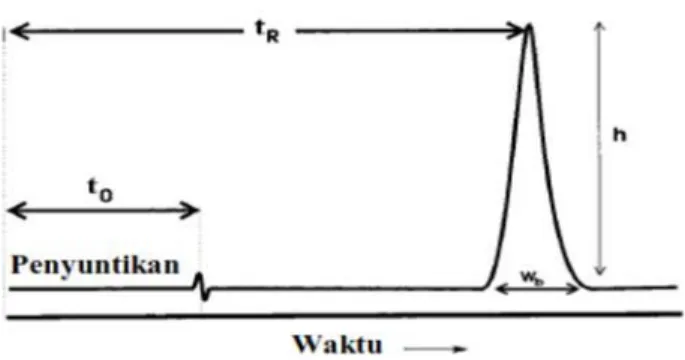
Sebuah puncak memiliki lebar puncak (Wb), tinggi (h) dan luas puncak
seperti yang dapat dilihat pada Gambar 8 berikut:
Gambar 8. Kromatogram yang diperoleh dari analisis KCKT (Ornaf dan Dong, 2005).
Lebar puncak yang diukur biasanya merupakan lebar pada 5% tinggi puncak (Ornaf dan Dong, 2005).
2.5.3.2 Waktu tambat
Periode waktu antara penyuntikan sampel dan puncak maksimum yang terekam oleh detektor disebut sebagai waktu tambat/retention time (tR). Waktu
sebagai waktu hampa/void time (t0). Waktu tambat merupakan fungsi dari laju alir
fase gerak dan panjang kolom. Jika fase gerak mengalir lebih lambat atau kolom semakin panjang, waktu hampa dan waktu tambat akan semakin besar, dan sebaliknya bila fase gerak mengalir lebih cepat atau kolom semakin pendek, maka waktu hampa dan waktu tambat akan semakin kecil (Meyer, 2010).
2.5.3.3 Faktor Kapasitas
Waktu tambat dipengaruhi oleh laju alir, ukuran kolom dan parameter yang lain. Oleh karena itu, diperlukan suatu ukuran derajat tambatan dari analit yang lebih independen yaitu faktor kapasitas (k’). Faktor kapasitas dihitung dengan membagi waktu tambat bersih (t’R) dengan waktu hampa (t0) seperti yang dapat
dilihat pada rumus berikut ini (Ornaf dan Dong, 2005).
Dalam beberapa literatur lain, faktor kapasitas juga disebut sebagai faktor tambat (k). Idealnya, analit yang sama jika diukur pada dua instrumen yang berbeda namun memiliki fase diam dan fase gerak yang sama, maka faktor tambat dari analit pada kedua system KCKT tersebut secara teoritis adalah sama (Meyer, 2010).
Faktor tambat yang disukai berada diantara nilai 1 hingga 10. Jika nilai k terlalu kecil menunjukkan bahwa analit terlalu cepat melewati kolom sehingga tidak terjadi interaksi dengan fase diam dan oleh karena itu tidak akan muncul dalam kromatogram. Sebaliknya nilai k yang terlalu besar mengindikasikan waktu analisis akan panjang (Meyer, 2010).
Faktor kapasitas dipengaruhi oleh perbandingan komposisi fase gerak yang digunakan sehingga akan dihasilkan resolusi dan waktu retensi dari puncak-puncak
kromatogram yang berbeda pada setiap perbandingan komposisi fase gerak (Snyder, 2010).
2.5.3.4 Selektivitas
Kemampuan sistem kromatografi dalam memisahkan/membedakan analit yang berbeda dikenal sebagai selektivitas (α). Selektivitas umumnya tergantung pada sifat analit itu sendiri, interaksinya dengan permukaan fase diam serta jenis fase gerak yang digunakan (Meyer, 2010).
Selektivitas ditentukan sebagai rasio perbandingan dua faktor kapasitas dari analit yang berbeda. Selektivitas ditentukan dengan rumus sebagai berikut:
Nilai selektivitas yang didapatkan dalam sistem KCKT harus lebih besar dari 1 (Ornaf dan Dong, 2005).
2.5.3.5 Efisiensi Kolom
Ukuran kuantitatif dari efisiensi kolom disebut sebagai nilai lempeng/plate
number (N) (Ornaf dan Dong, 2005). Kolom yang efisien adalah kolom yang
mampu menghasilkan puncak yang sempit dan memisahkan analit dengan baik. Nilai lempeng akan semakin tinggi jika ukuran kolom semakin panjang, hal ini berarti proses pemisahan yang terjadi semakin baik. Hubungan proporsionalitas antara nilai lempeng dengan panjang kolom disebut sebagai nilai HETP/High
Equivalent of a Theoritical Plate. Praktik HPLC yang baik adalah mendapatkan
nilai HETP yang kecil untuk nilai N yang maksimum dan efisiensi kolom yang tertinggi (Snyder, 2010).
Parameter yang dapat mempengaruhi nilai lempeng antara lain waktu tambat puncak, ukuran partikel kolom, laju alir fase gerak, suhu kolom, viskositas fase gerak dan berat molekul analit. FDA merekomendasikan agar tiap analisis KCKT yang valid mempunyai nilai lempeng lebih besar dari 2000 (Meyer, 2010). 2.5.3.6 Resolusi
Resolusi merupakan derajat pemisahan dari dua puncak analit yang bersebelahan (Ornaf dan Dong, 2005).
Harga resolusi yang semakin besar memiliki arti proses pemisahan semakin bagus dan sebaliknya resolusi yang kecil merupakan pertanda proses pemisahan yang buruk. Dua puncak yang tidak terpisah dengan sempurna namun sudah dapat terlihat memiliki resolusi 1. Sedangkan bila kedua puncak yang saling berdekatan terpisah sempurna tepat pada garis alas, resolusi bernilai 1,5. Oleh karena itu pada analisis kuantitatif, resolusi yang ditunjukkan harus lebih besar dari 1,5. Sementara bila kedua puncak memiliki perbedaan yang signifikan, maka diperlukan nilai resolusi yang lebih besar (Meyer, 2010).
2.5.3.7 Faktor Ikutan dan Faktor Asimetri
Puncak kromatogram dalam kondisi ideal akan memperlihatkan bentuk Gaussian dengan derajat simetris yang sempurna (Ornaf dan Dong, 2005). Namun kenyataannya dalam praktik kromatografi, puncak yang simetris secara sempurna jarang dijumpai. Jika diperhatikan dengan cermat, maka hamper setiap puncak dalam kromatografi memperlihatkan tailing dalam derajat tertentu (Dolan, 2003).
Gambar 9. Tiga jenis puncak. (Meyer,2010)
Ada dua cara yang digunakan untuk pengukuran derajat asimetris puncak, yakni faktor ikutan dan faktor asimetri. Faktor ikutan/tailing factor (Tf) seperti yang
diterangkan dalam Farmakope Amerika Serikat (USP) Edisi Ketigapuluh dihitung dengan menggunakan lebar puncak pada ketinggian 5% (W0,05), rumusnya
dituliskan sebagai berikut:
Dengan nilai a dan b merupakan setengah lebar puncak pada ketinggian 5% seperti yang ditunjukkan pada Gambar 10.
Gambar 10. Pengukuran derajat asimetris puncak (Snyder, 2010).
Sementara itu, faktor asimetri/asymmetry factor (As) dihitung dengan rumus
sebagai berikut.
Namun nilai a dan b dalam perhitungan faktor asimetri merupakan setengah lebar puncak pada ketinggian 10% seperti yang ditunjukkan pada Gambar 10 . Jika nilai
a=b, maka faktor ikutan dan asimetri bernilai 1. Kondisi ini menunjukkan bentuk puncak yang simetris sempurna (Dolan, 2003). Bila puncak berbentuk tailing, maka kedua faktor ini akan bernilai lebih besar dari 1 dan sebaliknya bila puncak berbentuk fronting, maka faktor ikutan dan asimetri akan bernilai lebih kecil dari 1 (Hinshaw, 2004).
2.5.4 Instrumen Kromatografi Cair Kinerja Tinggi
Instrumen KCKT tersusun atas 6 bagian dasar, yakni wadah fase gerak (reservoir), pompa (pump), tempat injeksi sampel (injector), kolom (coloumn), detector (detector) dan perekam (recorder) (McMaster, 2007). Ilustrasi instrument dasar KCKT dapat dilihat pada Gambar 11.
Gambar 11. (a) Sistem KCKT secara skematik yang menunjukkan semua komponen utamanya. (b) Gambaran grafik suatu sistem KCKT isokratik (Dong, 2006).
2.5.4.1 Wadah Fase Gerak
Wadah fase gerak harus bersih dan inert. Wadah pelarut kosong ataupun labu laboratorium dapat digunakan sebagai wadah fase gerak. Wadah ini biasanya dapat menampung fase gerak antara 1 sampai 2 liter pelarut. Fase gerak sebelum
digunakan harus dilakukan degassing (penghilangan gas) yang ada pada fase gerak, sebab adanya gas akan berkumpul dengan komponen lain terutama dipompa dan detektor sehingga akan mengacaukan analisis (Gandjar dan Rohman, 2008).
2.5.4.2 Pompa
Pompa yang cocok digunakan untuk KCKT adalah pompa yang mempunyai syarat sebagaimana syarat wadah pelarut yakni : pompa harus inert terhadap fase gerak. Bahan yang umum dipakai untuk pompa adalah gelas, baja tahan karat, teflon, dan batu nilam. Pompa yang digunakan sebaiknya mampu memberikan tekanan sampai 6000 psi dan mampu mengalirkan fase gerak dengan kecepatan alir 0,1-10 ml/menit. Aliran pelarut dari pompa harus tanpa denyut untuk menghindari hasil yang menyimpang pada detektor (Gandjar dan Rohman, 2007).
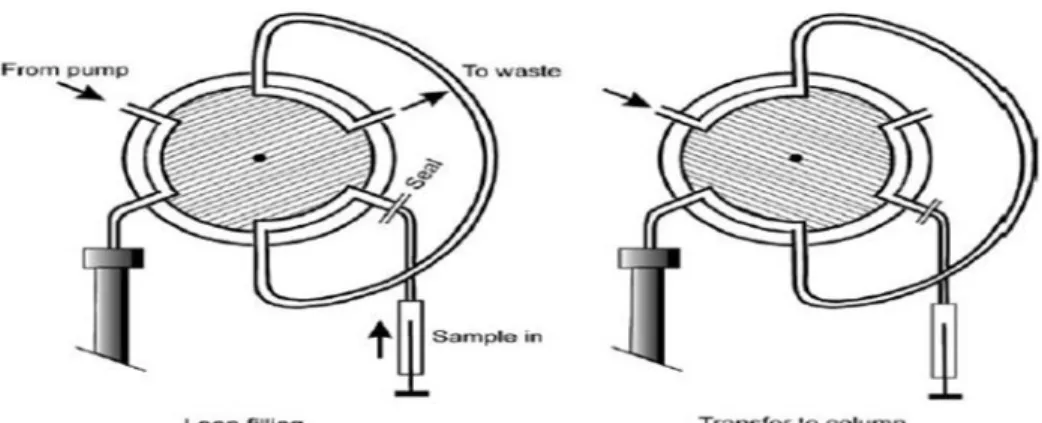
2.5.4.3 Tempat Injeksi Sampel
Ada 3 jenis injektor, yakni syringe injector, loop valve dan automatic
injector (autosampler). Syringe injector merupakan bentuk injektor yang paling
sederhana (Meyer, 2010).
Pada waktu sampel diinjeksikan ke dalam kolom, diharapkan agar aliran pelarut tidak mengganggu masuknya keseluruhan sampel ke dalam kolom. Sampel dapat langsung diinjeksikan ke dalam kolom (on column injection) atau digunakan katup injeksi (Meyer, 2010).
Katup putaran (loop valve), tipe injektor ini umumnya digunakan untuk menginjeksi volume lebih besar daripada 10 µ l dan sekarang digunakan dengan cara otomatis (dengan adaptor khusus, volume-volume lebih kecil dapat diinjeksikan secara manual). Bila katup difungsikan, maka cuplikan di dalam putaran akan bergerak ke dalam kolom (Meyer, 2010).
Automatic injector atau disebut juga autosampler memiliki prinsip yang
mirip, hanya saja sistem penyuntikannya bekerja secara otomatis (Meyer, 2010).
Gambar 12. Tipe Injektor katup putaran (Meyer, 2010). 2.5.4.4 Kolom
Kolom merupakan jantung dari instrument KCKT karena proses pemisahan terjadi disini. Kolom umumnya terbuat dari 316- grade stainless steel yang relative tahan karat dan dikemas dengan fase diam tertentu. Ukuran kolom untuk tujuan analitik berkisar antara panjang 10 hingga 25 cm dan diameter dalam 3 hingga 9 cm. Sedangkan untuk tujuan preparative digunakan kolom dengan diameter 10 mm hingga 1 inchi (25,4 mm) (Meyer, 2010).
Ada 2 jenis kolom pada KCKT, yaitu kolom konvensional dan kolom mikrobor. Kolom merupakan bagian KCKT yang mana terdapat fase diam untuk berlangsungnya proses pemisahan solut analit (Rohman, 2009).
Kolom mikrobor mempunyai 3 keuntungan yang utama dibanding dengan kolom konvensional, yakni:
− Konsumsi fase gerak kolom mikrobor hanya 80% atau lebih kecil dibanding dengan kolom konvensional karena pada kolom mikrobor kecepatan alir fase gerak lebih lambat (10-100 µ l/menit)
− Adanya aliran fase gerak yang lebih lambat membuat kolom mikrobor lebih ideal jika digabung dengan spektrometer massa
− Sensitifitas kolom mikrobor ditingkatkan karena solut lebih pekat, karenanya jenis kolom ini sangat bermanfaat jika jumlah sampel terbatas
Meskipun demikian, dalam prakteknya, kolom mikrobor ini tidak setahan kolom konvensional dan kurang bermanfaat untuk analisis rutin (Rohman, 2009).
2.5.4.5 Detektor
Detektor pada KCKT dikelompokkan menjadi 2 golongan, yaitu detektor universal (yang mampu mendeteksi zat secara umum, tidak bersifat spesifik,dan tidak selektif) seperti detektor indeks bias dan detektor spektrometri massa; dan golongan detektor yang spesifik dan selektif, seperti detektor UV-Vis, detektor fluoresensi dan elektrokimia (Gandjar dan Rohman, 2008).
Idealnya, suatu detektor harus mempunyai karakteristik sebagai berikut: − Mempunyai respon terhadap solut yang cepat dan reprodusibel
− Mempunyai sensitifitas yang tinggi, yakni mampu mendeteksi solut pada kadar yang sangat kecil
− Stabil dalam pengoperasian
− Mempunyai sel volume yang kecil sehingga mampu meminimalkan pelebaran pita
− Signal yang dihasilkan berbanding lurus dengan konsentrasi solut pada kisaran yang luas (kisaran dinamis linier)
− Tidak peka terhadap perubahan suhu dan kecepatan alir fase gerak (Gandjar dan Rohman, 2008).
Suatu detektor dibutuhkan untuk mendeteksi adanya komponen cuplikan dalam aliran yang keluar dari kolom. Detektor-detektor yang baik memiliki sensitifitas yang tinggi, gangguan (noise) yang rendah, kisaran respons linier yang luas, dan memberi tanggapan/respon untuk semua tipe senyawa. Suatu kepekaan yang rendah terhadap aliran dan fluktuasi temperatur sangat diinginkan, tetapi tidak selalu dapat diperoleh (Johnson dan Stevenson, 1991).
2.5.4.6 Perekam Data
Komponen yang terelusi mengalir ke detektor dan dicatat sebagai puncak- puncak yang secara keseluruhan disebut sebagai kromatogram (Johnson dan Stevenson, 1991).
Alat pengumpul data seperti komputer, integrator, atau rekorder, dihubungkan dengan detektor.Alat ini akan mengukur sinyal elektronik yang dihasilkan oleh detektor lalu men-plotkannya sebagai suatu kromatogram yang selanjutnya dapat dievaluasi oleh seorang analis atau pengguna (Gandjar dan Rohman, 2008).
Rekorder saat ini jarang digunakan karena rekorder tidak dapat mengintegrasikan data, sementara itu baik integrator maupun komputer mampu mengintegrasikan puncak-puncak dalam kromatogram. Komputer mempunyai keuntungan lebih karena komputer secara elektronik mampu menyimpan kromatogram untuk evaluasi di kemudian hari (Gandjar dan Rohman, 2008). 2.6 Validasi Metode
Validasi merupakan persyaratan mendasar yang diperlukan untuk menjamin kualitas dan hasil dari semua aplikasi analitik (Ermer dan Miller, 2005).
Adapun karakteristik dalam validasi metode menurut USP (United States
Pharmacopeia) XXX yaitu akurasi (ketepatan), presisi, spesifisitas/selektifitas,
batas deteksi, batas kuantitasi, linieritas, rentang/kisaran dan kekuatan/ketahanan dan kekasaran/ketangguhan.
Suatu metode analisis harus divalidasi untuk melakukan verifikasi bahwa parameter-parameter kinerjanya cukup mampu untuk mengatasi problem analisis, karenanya suatu metode harus divalidasi ketika:
− Metode baru dikembangkan untuk mengatasi problem analisis tertentu
− Metode yang sudah baku direvisi untuk menyesuaikan perkembangan atau karena munculnya suatu problem yang mengarahkan bahwa metode baku tersebut harus direvisi
− Penjaminan mutu yang mengindikasikan bahwa metode baku telah berubah seiring dengan berjalanya waktu
− Metode baku digunakan dilaboratorium yang berbeda, dikerjakan oleh analis yang berbeda, atau dikerjakan dengan alat yang berbeda
− Untuk mendemonstrasikan kesetaraan antar 2 metode, seperti antara metode baru dan metode baku (Gandjar dan Rohman, 2008).
2.6.1 Akurasi (Kecermatan)
Akurasi merupakan ketelitian metode analisis atau kedekatan antara nilai terukur dengan nilai sebenarnya. Akurasi dinyatakan dalam persen perolehan kembali (% recovery) (Harmita, 2004).
2.6.2 Presisi (Keseksamaan)
Presisi merupakan ukuran keterulangan metode analisis yang diperoleh dari beberapa kali pengukuran pada sampel yang sama dan biasanya diekspresikan sebagai Relatif Standar Deviasi (RSD) (Gandjar dan Rohman, 2008).
2.6.3 Spesifisitas (Selektifitas)
Spesifisitas/selektifitas adalah kemampuan untuk mengukur analit yang dituju secara tepat dan spesifik dengan adanya komponen lain dalam matriks sampel seperti ketidakmurnian, produk degradatif dan komponen matriks (Ermer dan Miller, 2005).
2.6.4 Batas Deteksi dan Batas Kuantitasi
Batas deteksi adalah konsentrasi analit terendah dalam sampel yang masih dapat dideteksi, meskipun tidak selalu dapat dikuantifikasi. Sedangkan batas kuantitasi adalah konsentrasi analit terendah dalam sampel yang dapat ditentukan dengan presisi dan akurasi yang dapat diterima pada kondisi metode yang digunakan (The United States Pharmacopeia Convention, 2007).
2.6.5 Linearitas
Linieritas adalah kemampuan suatu metode untuk memperoleh hasil uji yang secara langsung proposional dengan konsentrasi analit pada kisaran yang diberikan. Linieritas dapat ditentukan secara langsung dengan pengukuran sampel (analit) yang ditambahkan baku pada sekurang-kurangnya lima titik konsentrasi yang mencakup seluruh rentang konsentrasi kerja (Ermer dan Miller, 2005).
2.6.6 Rentang (Kisaran)
Rentang/kisaran adalah konsentrasi terendah dan tertinggi yang mana suatu metode analitik menunjukkan akurasi, presisi dan linieritas yang dapat digunakan untuk menganalisis sampel (Ermer dan Miller, 2005).
2.6.7 Kekuatan (Ketahanan)
Kekuatan/ketahanan merupakan pengujian kemampuan dari suatu metode untuk tidak terpengaruh oleh adanya perubahan parameter dalam melakukan metode analitik seperti persentase kandungan pelarut organik dalam fase gerak, pH larutan dapar, waktu pengekstraksian analit, komposisi pengekstraksi dan perbandingan konsentrasi fase gerak (Épshtein, 2004).
2.6.8 Kekasaran (Ketangguhan)
Kekasaran/ketangguhan merupakan tingkat reprodusibilitas hasil yang diperoleh dengan kondisi yang bervariasi dan dinyatakan sebagai simpangan baku relatif/relative standard deviation (RSD). Kondisi ini meliputi laboratorium, analis, reagen dan waktu percobaan yang berbeda (Gandjar dan Rohman, 2008).