KARAKTERISTIK KETAHANAN BAKTERI ASAM LAKTAT
INDIGENOUS KEFIR SEBAGAI KANDIDAT BAKTERI
PROBIOTIK PADA KONDISI SALURAN
PENCERNAAN in vitro
SKRIPSI AIP WIYANA
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR 2011
RINGKASAN
Aip Wiyana. D14062017. 2011. Karakteristik Ketahanan Bakteri Asam Laktat Indigenous Kefir sebagai Kandidat Bakteri Probiotik pada Kondisi Saluran Pencernaan in vitro
.
Skripsi. Departemen Ilmu Produksi dan Teknologi Peternakan,Fakultas Peternakan, Institut Pertanian Bogor.
Pembimbing Utama : Dr. Ir. Rarah Ratih Adjie Maheswari, DEA Pembimbing Anggota : Prof. Dr. Ir. Komang Gede Wiryawan
Makanan yang mengandung probiotik tergolong kedalam pangan fungsional karena berpotensi meningkatkan fungsi fisiologis usus dengan memodifikasi mikroflora usus. Bakteri probiotik merupakan mikroorganisme hidup yang bila diberikan dalam jumlah yang cukup akan memberikan manfaat kesehatan bagi penggunanya. Probiotik dapat diseleksi dari Bakteri Asam Laktat (BAL) yang terkandung dalam biji kefir. BAL indigenous kefir dapat digolongkan kedalam bakteri probiotik, bila mempunyai karakterisitk diantaranya mampu bertahan dalam kondisi saluran pencernaan sehingga mampu menggantikan fungsi antibiotik untuk melawan bakteri patogen. Bifidobacterium longum dan Lactobacillus acidophilus sering ditambahkan ke produk kefir sebagai mixes culture, sehingga khasiat kefir menjadi jauh lebih bermanfaat.
Tujuan dari penelitian ini adalah menentukan karakteristik ketahanan BAL indigenous kefir dan asal produk olahan susu sapi Bifidobacterium longum Y-01 dan Lactobacillus acidophilus Y-01 pada kondisi saluran pencernaan, meliputi resistensi atau ketahanan terhadap kondisi pH yang berbeda (pH 2; 2,5; 3,2 dan 7,2), garam empedu dan antibiotik yang berbeda (amoksisilin dan klorampenikol) serta mengetahui kemampuan antagonistik BAL terhadap bakteri patogen (Staphylococcus aureus ATCC 25923, Escherichia coli ATCC 25922 dan Salmonella Typhimurium ATCC 14028). Penelitian ini dilaksanakan di Laboratorium Mikrobiologi Bagian Teknologi Hasil Ternak, Fakultas Peternakan, Institut Pertanian Bogor pada bulan Maret – September 2010.
Penelitian dilakukan melalui beberapa tahap: (a) pertama yakni persiapan starter yang terdiri atas pemeriksaan kemurniaan BAL dan patogen; (b) tahap kedua adalah tahap penelitian utama meliputi pengujian BAL indigenous kefir dan asal olahan susu sapi pada kondisi pH yang berbeda, garam empedu, antibiotik yang berbeda, serta aktivitas antagonistik terhadap bakteri patogen. Data yang diperoleh dianalisis dengan uji t untuk menentukan ketahanan bakteri terhadap kondisi pH yang berbeda, garam empedu, dan antibiotik berbeda serta Rancangan Acak Lengkap (RAL) untuk menentukan aktivitas antagonistik terhadap bakteri patogen.
Hasil pengujian menunjukkan bahwa bakteri asam laktat indigenous kefir maupun produk olahan susu sapi B.longum Y-01 dan L. acidophilus Y-01 dapat bertahan hidup dalam kondisi saluran pencernaan secara in vitro yaitu media dengan (a) pH yang berbeda, (b) garam empedu dan (c) antibiotik yang berbeda. Berdasarkan pengujian tersebut, BAL indigenous kefir, B.longum Y-01 dan L. acidophilus Y-01 tidak mengalami penurunan jumlah populasi dan ketiganya lebih tahan terhadap antibiotik kloramphenikol daripada antibiotik amoksisilin. Hasil uji antagonistik terhadap bakteri patogen menunjukkan bahwa BAL kefir, B. longum Y-01 dan L. acidophilus Y-Y-01 memiliki penghambatan yang beragam terhadap tiga
ii bakteri patogen indikator. Spesies BAL yang berbeda mempengaruhi nilai diameter penghambatan pada bakteri patogen S. aureus, E. coli dan S. Typhimurium. Nilai diameter zona hambat terhadap S. aureus ATCC, E. coli dan S. Typhimurium ATCC 14028 berturut-turut adalah 13,77 mm; 14,71 mm dan 13,24 mm dihasilkan oleh B. longum Y-01, 12,53 mm; 15,15 dan 15,35 mm dihasilkan oleh L. acidophilus Y-01 dan 8,46 mm; 9,10dan 7,72 mm dihasilakan oleh BAL kefir. Hasil pengujian in vitro pada kondisi saluran pencernaan manusia dan uji antagonistik mendapatkan bahwa BAL indigenous kefir, B.longum Y-01 dan L. acidophilus Y-01 yang diisolasi dari olahan susu sapi, ketiganya berpotensi dikembangkan sebagai bakteri probiotik. Kata-kata kunci: kefir, bakteri asam laktat, probiotik, saluran pencernaan
ABSTRACT
Resistance of Lactic Acid Bacteria Indigenous Kefir on In Vitro Gastrointestinal Conditions as Probiotic Candidates
Wiyana. A, R. R. A. Maheswari, K. G. Wiryawan
Functional food containing probiotic bacteria is potential for modification intestine microflora. The objective of this research was to assess the resistance characteristics of kefir indigenous Lactic Acid Bacteria (LAB) (LABs from kefir, Bifidobacterium longum Y-01 and Lactobacillus acidophilus Y-01) as probiotic bacteria through its ability to grow in gastrointestinal conditions such as pH conditions (pH 2, 2.5, 3.2 and 7.2), the presence of bile salts in the small intestine, its resistance to antibiotics (amoxycillin and chloramphenicol) and its microbial activity to inhibit the pathogenic bacteria growth (Staphylococcus aureus ATCC 25923, Escherichia coli ATCC 25922 and Salmonella Typhimurium ATCC 14028). The results of Gram staining and catalase assay showed that the three kefir indigenous LABs were not contaminated with other microorganisms. Three kefir indigenous LABs had good resistance in gastro intestinal conditions, as the population of all kefir indigenous LABs observed did not decrease when they were exposed to gastrointestinal condition. Kefir indigenous LABs were more resistant to chloramphenicol antibiotics than amoxycillin antibiotics. The antagonistic test of kefir indigenous LABs to pathogen bacteria showed that the three kefir indigenous LABs had a variety inhibition. The statistical analysis showed that different types of LABs had a significant influenced on the inhibition zone of S. aureus, E. coli and S. Typhimurium. Therefore, the three tested kefir indigenous LABs had potential characteristics as probiotic bacteria.
KARAKTERISTIK KETAHANAN BAKTERI ASAM LAKTAT
INDIGENOUS KEFIR SEBAGAI KANDIDAT BAKTERI
PROBIOTIK PADA KONDISI SALURAN
PENCERNAAN in vitro
AIP WIYANA D14062017
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR 2011
Judul : Karakteristik Ketahanan Bakteri Asam Laktat Indigenous Kefir sebagai Kandidat Bakteri Probiotik pada Kondisi Saluran Pencernaan in vitro Nama : Aip Wiyana
NIM : D14062017
Menyetujui:
Mengetahui: Ketua Departemen
Ilmu Produksi dan Teknologi Peternakan Fakultas Peternakan IPB
(Prof.Dr.Ir.Cece Sumantri, M.Agr.Sc.) NIP. 19591212198603 1 004
Tanggal ujian: 22 Desember 2010 Tanggal lulus: 14 Januari 2011 Pembimbing Utama,
(Dr. Ir. Rarah R.A. Maheswari, DEA) NIP. 19620504198703 2 002
Pembimbing Anggota,
(Prof. Dr. Ir. Komang G. Wiryawan) NIP: 19610914198703 1 002
RIWAYAT HIDUP
Penulis dilahirkan di Indramayu pada tanggal 02 Juli 1988. Penulis merupakan anak pertama dari dua bersaudara dari pasangan Bapak Nana Sunarya dan Ibu Eti Rohaeti, S.Pd. Penulis menempuh pendidikan dasar di SDN Manangga (1994-2000), kemudian melanjutkan pendidikan di SMPN 2 Haurgeulis (2000-2003), pendidikan lanjutan tingkat atas dilanjutkan di SMAN 1 Cimalaka-Sumedang (2003-2006). Penulis diterima di Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI) (2006), setelah menyelesaikan pendidikan di Tingkat Persiapan Bersama IPB, penulis diterima sebagai mahasiswa mayor jurusan Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor dengan minor Manajemen Fungsional.
Selama mengikuti pendidikan di Institut Pertanian Bogor, penulis aktif di beberapa organisasi diantaranya Himpunan Mahasiswa Ilmu Produksi dan Teknologi peternakan sebagai ketua divisi Kewirausahaan (2007-2008) dan ketua divisi Peduli Pangan Peternakan (2008-2009), EMULSI (Majalah Peduli Pangan dan Gizi) (2007-2009) dan Himpunan Mahasiswa Peduli Pangan Indonesia (HMPPI) (2008-(2007-2009). Penulis juga bergabung di Himpunan Wadah Pelajar dan Mahasiswa Asal Lingga Sumedang (WAPEMALA ) (2006-2010).
Penulis pernah magang kerja di Balai Inseminasi Buatan (BIB) Lembang (2007) dan Rumah Potong Hewan Kota Bogor (2008). Penulis juga Pernah menjadi Asisten Praktikum pada mata kuliah Dasar Teknologi Hasil Ternak (2009 dan 2010) Ilmu dan Teknologi Pengolahan Susu (2009). Pelatihan yang pernah diikuti oleh penulis diantaranya pelatihan Hazard Analytic Critical Control Poin (HACCP) (2010) dan pelatihan Kewirausahaan Building Entrepreneur Student Program (BEST) (2010). Penulis pernah mendapat penghargaan sebagai juara 1 Lomba Business Plan Kewirausahaan In Action Fakultas Peternakan IPB tahun 2009 dan Juara Harapan 1 National Food Innovation Competition HIMATEPA IPB (2009). Penulis merupakan salah satu penerima beasiswa Supersemar pada tahun 2009 dan beasiswa Bantuan Belajar Mahasiswa (BBM) pada tahun 2010.
KATA PENGANTAR
Bismillahirrahmanirrahim,
Alhamdulillah. Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segala nikmat dan karunia-Nya yang telah diberikan sehingga penulis memperoleh kemudahan dalam menyusun dan menyelesaikan skripsi ini. Tugas akhir dalam bentuk skripsi yang berjudul “Karakteristik Ketahanan Bakteri Asam Laktat Indigenous Kefir sebagai Kandidat Bakteri Probiotik pada Kondisi Saluran Pencernaan secara In Vitro” merupakan salah satu syarat untuk memperoleh gelar
Sarjana Peternakan di Fakultas Peternakan, Institut Pertanian Bogor.
Penelitian ini dilatarbelakangi oleh meningkatnya pengetahuan masyarakat mengenai kesehatan sehingga menimbulkan implikasi yang luas dalam memilih bahan makanan. Bahan makanan yang mengandung probiotik dipercaya mampu menjaga kesehatan secara preventif melelui perbaikan keseimbangan mikroflora usus. Probiotik dapat diseleksi pada Bakteri Asam Laktat (BAL) yang terkandung dalam kefir. Kultur indigenous tunggal BAL Bifidobacterium longum dan Lactobacillus acidophilus sering ditambahkan ke produk kefir, sehingga khasiat kefir menjadi jauh lebih bermanfaat. Agar mampu menyeimbangkan mikroflora usus, BAL yang terkandung dalam kefir harus mampu melewati beberapa rintangan dalam saluran pencernaan serta mampu menekan perkembangan bakteri patogen. Oleh karena itu, pembuktian terhadap potensi kultur BAL indigenous kefir sebagai probiotik dilakukan agar mendukung ketersediaan produk pangan yang dapat menguntungkan bagi kesehatan manusia.
Penulis menyadari bahwa skripsi ini belum sempurna. Penulis mengharapkan skripsi ini dapat bermanfaat bagi pembaca sebagai sumber informasi dan referensi dalam pengembangan penyediaan produk probiotik. Penulis menyampaikan rasa terima kasih yang tak terhingga kepada pihak yang telah turut membantu proses penyusunan skripsi ini. Semoga Allah SWT senantiasa membalasnya. Amin.
Bogor, Desember 2010
DAFTAR ISI Halaman RINGKASAN ... ABSTRACT ... LEMBAR PERNYATAAN ... LEMBAR PENGESAHAN ... RIWAYAT HIDUP ... KATA PENGANTAR ... DAFTAR ISI ... DAFTAR TABEL ... DAFTAR GAMBAR ... DAFTAR LAMPIRAN ... PENDAHULUAN ... Latar Belakang ... Tujuan ... TINJAUAN PUSTAKA ... Bakteri Asam Laktat ... Kefir ... Probiotik ... Karakteristik Probiotik ... Ketahanan terhadap Asam Lambung ... Ketahanan terhadap Garam Empedu ... Ketahanan terhadap Antibiotik ... Aktivitas Antimikroba terhadap Bakteri Patogen ... Bakteri Probiotik ... Bifidobacterium longum ... Lactobacillus acidophilus ... Bakteri Patogen ... Staphylococcus aureus ... Escherichia coli ... Salmonella enteritidis serotipe Typhimurium (S. Typhimurium) ... METODE ...
Lokasi dan Waktu ... Materi ... Bahan ... Alat ... Prosedur ... Pemeriksaan Kultur Bakteri Asam Laktat dan Patogen ....
i iii iv v vii viii ix xi xii xv 1 1 2 3 3 4 6 7 7 8 10 11 12 12 13 14 14 14 15 16 16 16 16 16 17 17
x Penentuan Standar Populasi Bakteri Asam Laktat ...
Metode Hitungan Cawan ... Metode Turbidimetrik ... Penelitian Utama ... Persiapan Sel-sel Kultur Bakteri Asam Laktat ... Uji Ketahanan terhadap pH yang Berbeda ... Uji Ketahanan terhadap Garam Empedu ... Uji Ketahanan terhadap antibiotik ... Uji Sifat Antimikroba terhadap Bakteri Patogen ...
Persiapan Filtrat Bebas Sel (FBS) dan FBS Terkonsentrasi ... Persiapan Bakteri Indikator ... Konfrontasi Filtrat Bebas Sel dengan Bakteri Indikator ... Diagram Alir Penelitian ... Rancangan Percobaan ... Uji t ... Rancangan Acak Lengkap (RAL) ... ..
HASIL DAN PEMBAHASAN ... Pemeriksaan Bakteri Asam Laktat dan Bakteri Patogen ... Penelitian Utama ... Karakteristik Pertumbuhan Kultur Starter BAL Indigenous Kefir pada pH Berbeda ... Karakteristik Pertumbuhan Kultur Starter BAL Indigenous Kefir terhadap Garam Empedu ... Karakteristik Pertumbuhan Kultur Starter BAL Indigenous Kefir terhadap Antibiotik ... Aktivitas Antagonistik BAL Indigenous Kefir terhadap Bakteri Patogen ... KESIMPULAN DAN SARAN ... Kesimpulan ... Saran ... UCAPAN TERIMA KASIH... DAFTAR PUSTAKA ... LAMPIRAN ... 17 18 18 19 19 19 20 20 21 21 21 21 23 24 24 24 26 26 30 30 36 39 43 50 50 50 51 52 56
DAFTAR GAMBAR
Nomor Halaman
1. Biji Kefir dan Mikroflora yang Terkandung dalam Biji Kefir ... 4
2. Mekanisme Skematik Sirkulasi Hepatik Asam Empedu ... 8
3. Skema Pengukuran Zona Hambat ... 22
4. Diagram Alir Proses Penelitian ... 23
5. Morfologi Bakteri Asam Laktat Kefir ... 28
6. Morfologi (a) B. longum Y-01 dan (b) L.acidophilus Y-01 ... 29
7. Morfologi (a) S. aureus ATCC 25923 (b) E. coli ATCC 25922 dan (c) S. Typhimurium ATCC 14028 ... 29
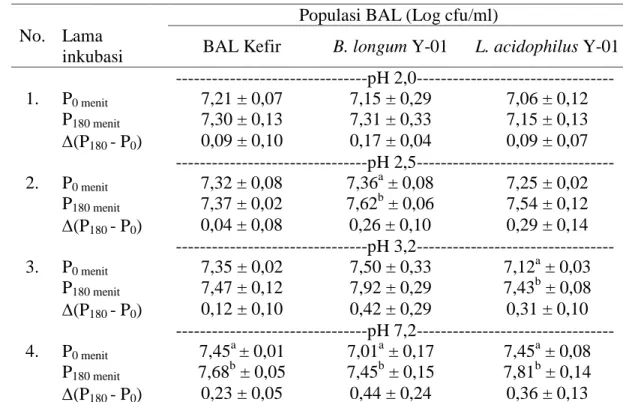
8. Histogram Pertumbuhan Populasi Kultur BAL pada pH 2; pH 2,5; pH 3,2 dan pH 7,2 ... 34
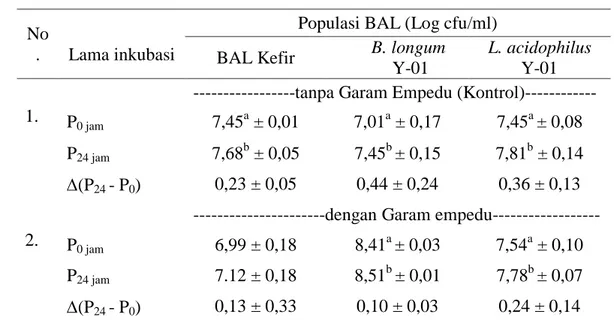
9. Histogram Pertumbuhan Populasi Kultur BAL pada Konsentrasi Garam Empedu 0,3% dan Kontrol ... 38
10. Kurva Pertumbuhan Kultur BAL pada Kontrol; Antibiotik Amoksisilin dan Antibiotik Kloramfenikol ... 42
11. Total Zona Hambat (a) BAL Kefir, (b) B. longum Y-01 dan (c) L. acidophilus Y-01 terhadap S. aureus ATCC 25923 ... 44
12. Total Zona Hambat (a) BAL Kefir, (b) B. longum Y-01 dan (c) L. acidophilus Y-01 terhadap E. coli ATCC 25922 ... 45
13. Total Zona Hambat (a) BAL Kefir, (b) B. longum Y-01 dan (c) L.acidophilus Y-01 terhadap S. Typhimurium ATCC ... 47
DAFTAR TABEL
Nomor Halaman
1. Mikroflora yang Terkandung dalam Biji Kefir ... 5
2. Populasi Kelompok Bakteri Utama pada Usus Manusia ... 9
3. Persamaan Linier BAL Indigenous Kefir dan Produk Olahan Susu Sapi ... 19
4. Karakteristik BAL Indigenous Kefir dan Bakteri Patogen ... 26
5. Jumlah Populasi BAL pada pH yang Berbeda ... 35
6. Jumlah Populasi BAL pada Garam Empedu ... 37
7. Jumlah Populasi BAL pada Antibiotik ... 40
8. Aktivitas Antagonistik BAL terhadap S. aureus ATCC 25923 ... 44
9. Aktivitas Antagonistik BAL terhadap E. coli ATCC 25922 ... 45
10. Aktivitas Antagonistik BAL terhadap S. Typhimurium ATCC 14028 ... 46
DAFTAR LAMPIRAN
Nomor Halaman
1. Nilai Rataan optical density (OD) pada Pengujian Garam empedu .. 57 2. Nilai Rataan optical density (OD) pada Pengujian Antibiotik ... 58 3. Nilai Rataan optical density (OD) pada Pengujian pH yang
Berbeda… ... 59 4. Hasil Uji-t Jumlah Populasi BAL Indigenous Kefir dalam pH 2,5 ... 59 5. Hasil Uji-t Jumlah Populasi BAL Indigenous Kefir dalam pH 2,5 ... 60 6. Hasil Uji-t Jumlah Populasi BAL Indigenous Kefir dalam pH 3,2 ... 60 7. Hasil Uji-t Jumlah Populasi BAL Indigenous Kefir dalam pH 7,2 ... 61 8. Hasil Uji-t Jumlah Populasi BAL Indigenous Kefir pada Kontrol
Garam Empedu ... 61 9. Hasil Uji-t Jumlah Populasi BAL Indigenous Kefir pada Garam
Empedu ... 62 10. Hasil Uji-t Jumlah Populasi BAL Indigenous Kefir Kontrol
Antibiotik ... 62 11. Hasil Uji-t Jumlah Populasi BAL Indigenous Kefir pada Antibiotik
Amoksisilin ... 63 12. Hasil Uji-t Jumlah Populasi BAL Indigenous Kefir pada Antibiotik
Kloramphenikol ... 63 13. Persentase BAL yang Hidup pada Kondisi pH yang Berbeda... 64 14. Persentase BAL yang Hidup pada Media tanpa atau dengan Garam
Empedu …. ... 64 15. Persentase BAL yang Hidup pada Media tanpa atau dengan
Antibiotik ………. ... 64 16. Hasil Analisis Ragam Aktivitas Antagonistik BAL Indigenous
Kefir terhadap S. aureus ATCC 25923 ... 64 17. Hasil Uji perbandingan Aktivitas Antagonistik BAL Indigenous
Kefir terhadap S. aureus ATCC 25923 ... 65 18. Hasil Analisis Ragam Aktivitas Antagonistik BAL Indigenous
Kefir terhadap E. coli ATCC 25923 ... 65 19. Hasil Uji perbandingan Aktivitas Antagonistik BAL Indigenous
Kefir terhadap E. coli ATCC 25923 ... 65 20. Hasil Analisis Ragam Aktivitas Antagonistik BAL Indigenous
Kefir terhadap S. Typhimurium ATCC 14028 ... 66 21. Hasil Uji perbandingan Aktivitas Antagonistik BAL Indigenou
Kefir terhadap S. Typhimurium ATCC 14028 ... 66 22. Komposisi Buffer Pepton Water (BPW)-OXOID.. ... 66
xvi
23. Komposisi deMan Rogose Sharpe Agar (MRSA)-OXOID ... 66
24. Komposisi Phosphate Buffered Saline (PBS)-OXOID ... 67
25. Komposisi de Man Rogosa Sharpe (MRSB)-OXOID ... 67
PENDAHULUAN
Latar Belakang
Kesadaran masyarakat akan pentingnya kesehatan saat ini semakin meningkat, sehingga menimbulkan implikasi yang luas dalam memilih bahan makanan untuk kelangsungan hidup. Hal tersebut mendorong berkembangnya riset-riset mengenai makanan dan minuman yang mempunyai efek menyehatkan, termasuk pangan fungsional yang berasal dari ternak. Bioproduk atau makanan yang mengandung probiotik tergolong kedalam pangan fungsional karena selain mengenyangkan, berpotensi pula meningkatkan fungsi fisiologis usus dengan memodifikasi mikroflora usus. Makanan yang mengandung probiotik selain mempunyai nilai nutrisi yang baik, dianggap pula memberi manfaat kesehatan dan terapeutik serta bisa dijadikan sebagai pengganti antibiotik untuk menekan pertumbuhan bakteri patogen.
Mikroflora usus merupakan bagian yang terpenting bagi manusia untuk mengoptimalkan kesehatan. Kondisi kesehatan yang baik dipengaruhi oleh “mikroba baik” yang berguna bagi kesehatan yang kebanyakan dikelompokkan sebagai Bakteri Asam Laktat (BAL). Karakteristik yang dipertimbangkan untuk menentukan syarat utama isolat BAL sebagai bakteri probiotik diantaranya bersifat nonpatogenik, harus mampu bertahan hidup dan bersaing serta tidak hanya sekedar tumbuh dalam saluran pencernaan (Wahyudi dan Samsundari, 2008). Bakteri tersebut harus mampu melewati beberapa rintangan seperti keasaman lambung yang tinggi, keberadaan antibiotik dan sekresi garam empedu dalam usus halus. Selain itu BAL juga mampu menghasilkan senyawa antimikroba untuk menekan pertumbuhan bakteri patogen (Salminen et al., 2004; Winarno et al., 2003).
Bakteri asam laktat umumnya dapat tumbuh dalam susu segar, susu fermentasi dan produk olahan berbahan baku susu, salah satunya adalah kefir. Keistimewaan kefir dibandingkan susu fermentasi lainnya adalah penggunaan biji kefir dalam cara pembuatannya. Jenis BAL yang terkandung pada biji kefir cukup beragam, namun semuanya hidup bersama dan saling mempengaruhi. Selain biji kefir dalam industri pengolahan susu, Bifidobacterium longum dan Lactobacillus acidophilus sering ditambahkan ke produk kefir dan produk tersebut dinamakan
2 biokefir. Dengan adanya penambahan bakteri tersebut produk kefir akan jauh lebih bermanfaat.
Bifidobacterium longum Y-01 dan Lactobacillus acidophilus Y-01 merupakan kultur yang telah diisolasi dari produk olahan susu sapi dan telah dikembangkan untuk pembuatan biokefir secara terkontrol dengan penambahan biji kefir. Pembuktian terhadap potensi kultur tersebut sebagai probiotik perlu dilakukan untuk mendukung ketersediaan produk pangan fungsional yang menguntungkan bagi kesehatan manusia.
Tujuan
Mempelajari karakterisasi potensi BAL pada kefir, B. longum Y-01 dan L. acidophilus Y-01 terseleksi sebagai kandidat bakteri probiotik melalui resistensi/ketahanan terhadap kondisi saluran pencernaan manusia, khususnya pada kondisi pH yang berbeda (pH 2; 2,5; 3,2 dan 7,2), garam empedu dan antibiotik serta mengetahui kemampuan BAL dalam memproduksi antimikroba dan kemampuan daya hambatnya terhadap bakteri patogen (Staphylococcus aureus ATCC 25923, Escherichia coli ATCC 25922 dan Salmonella Typhimurium ATCC 14028).
TINJAUAN PUSTAKA Bakteri Asam Laktat
Bakteri Asam Laktat (BAL) didefinisikan sebagai suatu kelompok bakteri Gram positif yang disatukan oleh berbagai morfologi. Karakteristik BAL secara umum tidak berspora, katalase negatif, berbentuk bulat atau batang, memerlukan nutrisi yang kompleks seperti asam-asam amino, vitamin (B1, B6, B12 dan biotin), purine dan pyrimidin. Kelompok bakteri ini mampu memproduksi asam laktat sebagai produk akhir metabolik utama selama fermentasi karbohidrat. Berdasarkan jenis fermentasinya BAL dibagi menjadi dua kelompok yaitu homofermentatif dan heterofermentatif. Produk akhir dari proses metabolisme homofermentatif sebagian besar berupa asam laktat sedangkan produk akhir dari proses metabolisme heterofermentatif adalah asam laktat, etanol, asam asetat dan CO2 (Surono, 2004). Adanya BAL homofermentatif digunakan dalam pengawetan makanan karena produksi asam laktat dalam jumlah besar serta mampu menghambat bakteri penyebab kebusukan makanan dan bakteri patogen lainnya. Golongan BAL heterofermentatif lebih ditujukan kepada pembentukan flavor dan komponen aroma, seperti asetildehid dan diasetil (Fardiaz, 1992).
Menurut Mitsuoka (1990), BAL dapat dibagi atas 4 grup, berdasarkan kemampuan hidupnya di dalam saluran pencernaan manusia, yaitu :
a) Grup yang berhasil hidup di dalam lumen usus dan merupakan organisme yang paling banyak ditemukan dalam spesimen usus manusia, contohnya galur-galur dari Bifidobacterium (B. bifidus, B. breve, B. longum, B. adolecentris, B. infantis).
b) Grup yang berhasil hidup di dalam lumen usus dan sering ditemukan dalam spesimen usus manusia, contohnya Lactobacillus (L. acidophillus, L. salivarus, L. fermentum).
c) Grup yang berhasil hidup di dalam lumen usus dan kadang-kadang ditemukan dalam spesimen usus manusia, contohnya Lactobacillus (L. casei, L. brevis, L. plantarum, L.buchneri).
d) Grup yang sering digunakan dalam pembuatan produk susu dan tidak dapat dijumpai dalam spesimen usus manusia, contohnya lactobacillus (L. bulgaricus) dan Streptococcus (S. thermophilus dan S. cremoris).
4 Mitsuoka (1990) menyatakan bahwa BAL yang paling sering dijumpai pada usus dalam keadaan hidup serta dapat digunakan sebagai kultur starter produk fermentasi adalah Lactobacillus dan Bifidobacterium. Adanya BAL yang berasal dari genus Lactococcus dan Streptococcus hanya dapat digunakan sebagai starter produk fermentasi dan tidak dijumpai pada usus. Oleh karena itu, BAL yang umum digunakan dalam produk probiotik adalah Lactobacillus dan Bifidobacterium. Golongan BAL tersebut di antaranya adalah L. acidophilus, L. casei, L. johnsonii, L. reuteri, L. rhamnosus, L. gasseri, L. bulgaricus, B. longum, B. lactis,dan B. bifidum (Surono, 2004).
Kefir
Kefir merupakan salah satu produk susu fermentasi yang dihasilkan dari susu sapi, domba atau kambing yang difermentasi dengan cara menambahkan butir kefir/ biji kefir (kefir grain). Kefir mempunyai rasa asam beralkohol dengan kekentalan seperti krim dan sedikit berbuih. Selain itu, kefir mempunyai sensasi rasa berbusa (foam) dan beruap (fizzy) seperti bir. Rasa asam yang timbul dalam kefir disebabkan oleh aktivitas bakteri yang menghasilkan asam laktat, sedangkan alkohol, rasa berbusa dan beruap dihasilkan oleh khamir yang memfermentasi laktosa menjadi alkohol dan CO2. Kefir mengandung 0,5 - 1% alkohol dan 0,9 - 1,1% asam laktat (Rahman et al., 1992). Komposisi kefir menurut Codex (2003) terdiri atas: protein susu minimal 2,7% b/b, lemak susu kurang dari 10% b/b, Total Asam Tertitrasi (TAT) 0,7%, etanol minimal 0,5% v/b, jumlah mikroorganisme kultur starter minimal 107, dan khamir minimal 104 cfu/g.
Gambar 1. Biji Kefir dan Mikroflora yang Terkandung dalam Biji Kefir (Anfiteatro, 2009)
Biji kefir memiliki warna putih kekuningan berbentuk seperti butir-butir nasi, ukurannya tidak seragam, tidak larut dalam air dan bersifat seperti gelatin (Rahman
5 et al., 1992). Biji kefir mengandung 24 persen polisakarida yang bersifat lengket. Biji kefir ini merupakan simbiosis antara bakteri asam laktat dan khamir dengan permukaan dilapisi kapang dalam perbandingan yang seimbang. Karakteristik sensori yang dimiliki kefir menurut Tamime (2006) adalah: (a) warnanya putih atau kekuningan; (b) aroma seimbang dan aroma yeasty; (c) rasanya asam, tetapi menyenangkan dan menyegarkan; dan (d) teksturnya lebih tebal, tetapi tidak lengket dan mempunyai konsistensi yang elastis.
Tamime dan Marshall (1994) menjelaskan bahwa jenis mikroorganisme yang terdapat dalam biji kefir tergantung pada sumber dan negara asal, serta teknik pembuatan kultur yang digunakan untuk mengidentifikasi spesies yang beragam tersebut. Bakteri asam laktat yang termasuk penyusun mikroflora kefir adalah Lactobacillus sp. dan Streptococcus sp. yang bersifat homofermentatif (Fardiaz, 1992). Contoh mikroflora yang terkandung dalam biji kefir terdapat pada Tabel 1. Table 1. Mikroflora yang Terkandung dalam Biji Kefir
Lactobacillus sp Streptococcus sp/ Lactococci sp
Yeasts
L. galactose S. cremeris Saccharomyces cerevisiae
L. brevis S. faecalis Sacc. florentinus
L. casei subsp. casei S. lactis Sacc. pretoriensis L. paracasei subsp.
paracasei
Leuconostoc mesenteroides
Candida valida L. casei subsp. ramos Pediococcus damnosus C. lambica
L. casei subsp. tolerant Kloeckera apiculata
L. coraciiform subsp. torquens Hansenula yalbensis L. fructose L. hilarities L. homophobia L. plantarum L. pseudo plantarum L. admonishes Sumber : Anfiteatro (2009)
6
Probiotik
Probiotik atau dikenal dengan mikroorganisme “baik” adalah preparat yang terdiri atas mikroba hidup yang dimasukkan ke dalam tubuh manusia atau hewan secara oral. Mikroba hidup itu diharapkan mampu memberikan pengaruh positif terhadap kesehatan manusia atau hewan dengan cara memperbaiki sifat-sifat yang dimiliki mikroba alami yang tinggal di dalam tubuh manusia atau hewan tersebut. Syarat - syarat probiotik yang baik adalah probiotik harus mempunyai kemampuan untuk bertahan hidup ketika melalui saluran pencernaan dan bermanfaat bagi kesehatan (Ardiansyah, 2007).
Keseimbangan yang baik dalam ekosistem mikroflora usus bisa menguntungkan kesehatan tubuh dan dapat dipengaruhi oleh konsumsi probiotik setiap hari (Lisal, 2005). Keuntungan dalam mengkonsumsi bakteri probiotik menurut Wahyudi dan Samsundari (2008) antara lain :
1. Meningkatkan pertumbuhan inang. Peningkatan pertumbuhan terjadi sebagai hasil dari penurunan infeksi subklinis akibat tertekannya pertumbuhan mikroorganisme penyebab penyakit. Mekanisme yang terjadi mirip dengan mekanisme kerja dari penggunaan antibiotik sebagai growth-promotor. 2. Memperbaiki penggunaan nutrisi makanan. Hal ini dapat terjadi melalui
peningkatan efisiensi proses pencernaan atau peningkatan kecernaan senyawa-senyawa yang awalnya tidak tercerna.
3. Meningkatkan kesehatan. Resistensi inang terjadi terhadap penyakit infeksi baik secara langsung melalui mekanisme antagonis maupun melalui status kekebalan. Manusia menjadi kebal secara alami terhadap berbagai penyakit infeksi.
Ada beberapa manfaat probiotik dalam peningkatan kesehatan. Pertama, adalah mencegah terjadinya kanker yaitu dengan menghilangkan bahan prokarsinogen (bahan penyebab kanker) dari tubuh dan mengaktifkan sistem kekebalan tubuh. Kedua, dapat menghasilkan bahan aktif antitumor. Ketiga, memproduksi berbagai vitamin yaitu thiamin (B1), riboflavin (B2), piridoksin (B6), asam float, sianokobalamin (B12) yang mudah diserap ke dalam tubuh. Keempat, berperan dalam penurunan kadar kolesterol. Kelima, kemampuannya memproduksi asam laktat dan asam asetat di usus dapat menekan pertumbuhan bakteri E. coli dan
7 Clostridium perfringens penyebab radang usus dan menekan bakteri patogen lainnya (Ardiansyah, 2007).
Karakteristik Probiotik
Syarat utama agar probiotik mampu memberikan efek positif bagi kesehatan inang adalah probiotik tersebut harus berada dalam keadaan hidup dan dikonsumsi dalam jumlah yang cukup. Kriteria yang perlu dipertimbangkan untuk mendapatkan produk probiotik dengan pengaruh positif optimal bagi inangnya, di antaranya adalah : (a) memiliki kemampuan untuk bertahan selama proses pengolahan dan selama waktu penyimpanan, (b) memiliki karakteristik sensorial yang baik, (c) memiliki kemampuan menempel dan mengkolonisasi usus, (d) memiliki sifat antagonistik terhadap mikroba patogen enterik, (e) terbukti memiliki pengaruh menguntungkan bagi kesehatan inang, (f) produk probiotik diharapkan memiliki jumlah sel hidup besar (10 7 -10 9 cfu/ml) dan (g) total konsumsi produk probiotik sekitar 300-400 Gram per minggu (Surono, 2004).
Salminen et al. (2004) menambahkan bahwa suatu bakteri dapat dikatakan sebagai bakteri probiotik apabila memenuhi beberapa kriteria yakni bersifat nonpatogenik, masih aktif dalam kondisi asam lambung dan konsentrasi garam empedu yang tinggi dalam usus halus, mampu tumbuh dan melakukan metabolisme dengan cepat dan tepat dalam jumlah yang banyak dalam usus serta memiliki sifat antimikroba terhadap bakteri merugikan. Kriteria yang lain adalah dapat mengkolonisasi beberapa bagian dari saluran usus untuk sementara dan dapat memproduksi asam-asam organik secara efisien dan mudah diproduksi.
Ketahanan terhadap Asam Lambung
Ketahanan terhadap asam lambung merupakan syarat penting suatu BAL untuk dapat menjadi probiotik. Setiap organisme mempunyai kisaran nilai pH pertumbuhan, yaitu kondisi lingkungan pH yang masih memungkinkan pertumbuhan terjadi dan masing-masing bakteri biasanya mempunyai pH optimum. Kebanyakan mikroorganisme dapat tumbuh pada kisaran pH 6,0-8,0 dan nilai pH di luar kisaran kurang dari 2,0 dan lebih dari 10,0 biasanya bersifat merusak (Buckle et al., 2007).
Waktu yang diperlukan BAL mulai saat bakteri masuk sampai keluar dari lambung sekitar 90 menit (Mitsuoka, 1990). Lambung setiap hari memproduksi lebih
8 kurang dari 2-3 liter getah lambung. Getah lambung merupakan cairan jernih berwarna kuning pucat yang mengandung HCl 0,2 - 0,5% dengan pH sekitar 2 bila lambung dalam kondisi kosong (Chou dan Weimer, 1999).
Bakteri Asam Laktat (BAL) merupakan mikroorganisme fermentatif yang dapat hidup pada kisaran pH yang luas. Setiap galur BAL memiliki ketahanan yang berbeda terhadap asam atau pH rendah, seperti contoh adalah Lactobacillus dan Bifidobacteria yang lebih toleran terhadap pH rendah daripada laktokoki dan streptokoki (Zavaglia et al., 1998; Chou dan Weimer, 1999).
Ketahanan terhadap Garam Empedu
Ketahanan BAL terhadap garam empedu juga merupakan salah satu syarat penting untuk probiotik. Asam empedu disintesis dalam hati dari kolesterol, menghasilkan senyawa asam empedu primer. Asam empedu ini berkonjugasi dengan glisin atau taurin dan disekresikan ke dalam kantung empedu sebagai asam empedu terkonjugasi. Asam empedu di dalam kantung empedu dilepaskan ke lumen duodenum dalam bentuk misel dengan asam lemak dan gliserol yang dihasilkan oleh pencernaan lipase pankreatik. Sebanyak 5.500 sampai 35.500 mg asam empedu terkonjugasi disekresikan ke dalam usus kecil manusia setiap harinya (Corzo dan Gilliland, 1999). Asam empedu terkonjugasi diserap dari usus kecil (sekitar 97%) dan dikembalikan ke dalam hati melalui sirkulasi hepatik. Sebagian kecil dari asam empedu (250-400 mg) yang tidak terserap hilang dari tubuh manusia sebagai asam empedu bebas di feses. Mekanisme proses terjadinya penyerapan asam empedu dalam usus kecil dan kolon, dikenal dengan sirkulasi hepatik (Gambar 2).
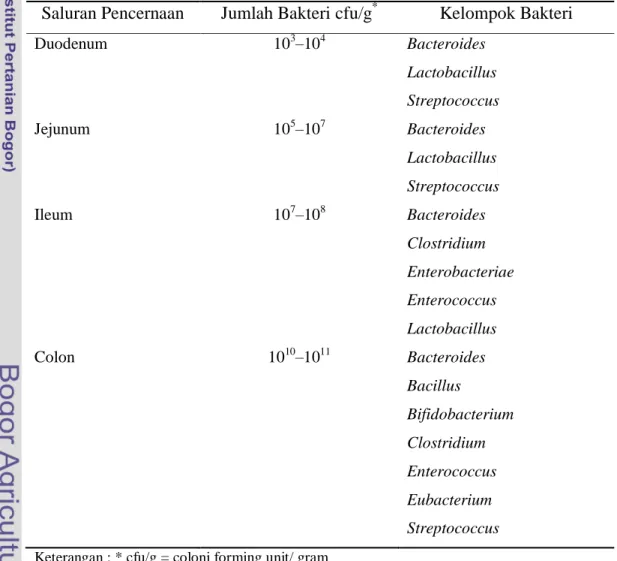
9 Menurut Zavaglia et al. (1998), semua mikroba yang berhasil hidup setelah ditumbuhkan dalam MRSA yang ditambah 0,3% oxgal, dinyatakan bersifat tahan terhadap garam empedu. Konsentrasi garam empedu sebesar 0,3% merupakan konsentrasi kritikal dan merupakan nilai yang cukup tinggi untuk menyeleksi isolat yang resisten terhadap garam empedu. Laktobasili yang paling bersifat resisten terhadap garam empedu terdapat pada bagian atas usus halus. Hal tersebut dilaporkan oleh Tappenden et al. (2007) bahwa BAL ditemukan dalam usus halus yang terdapat dalam jumlah yang lebih rendah di duodenum dibanding jejunum, ileum dan kolon. Hal ini dikarenakan konsentrasi garam empedu pada bagian duodenum paling tinggi, disebabkan lokasinya paling dekat bila garam empedu masuk ke dalam saluran usus. Populasi kelompok bakteri utama pada usus manusia disajikan pada Tabel 2.
Table 2. Populasi Kelompok Bakteri Utama pada Usus Manusia
Saluran Pencernaan Jumlah Bakteri cfu/g* Kelompok Bakteri
Duodenum 103–104 Bacteroides Lactobacillus Streptococcus Jejunum 105–107 Bacteroides Lactobacillus Streptococcus Ileum 107–108 Bacteroides Clostridium Enterobacteriae Enterococcus Lactobacillus Colon 1010–1011 Bacteroides Bacillus Bifidobacterium Clostridium Enterococcus Eubacterium Streptococcus
Keterangan : * cfu/g = coloni forming unit/ gram Sumber : Tappenden et al. (2007)
10
Ketahanan terhadap Antibiotik
Salah satu syarat BAL yang bermanfaat sebagai probiotik adalah memiliki ketahanan terhadap antibiotik. Antibiotik adalah suatu jenis senyawa antibakteri, baik alami maupun sintetik yang mempunyai efek menekan atau menghentikan suatu proses biokimia di dalam organisme. Setiap antibiotik sangat beragam keefektifannya dalam melawan jenis bakteri, baik bakteri Gram positif atau Gram negatif maupun yang memiliki spektrum luas (Black, 2004). Antibiotik bekerja sesuai dengan peptisida dengan menekan atau memutus suatu mata rantai metabolisme, hanya saja targetnya adalah bakteri. Jenis antibiotik yang dilihat dari target atau sasaran kerjanya di antaranya yakni:
1). Kloramfenikol
Kloramfenikol merupakan sutu antibiotik dengan spektrum luas. Kloramfenikol digunakan untuk peyembuhan penyakit tifus (demam tifoid) dan paratifoid, infeksi berat karena Salmonella sp, H. influenza (terutama meningitis), rickettzia, limfogranuloma, psitakosis, gastroenteristis, bruselosis, disentri.
Kloramfenikol dapat merusak sistem pembentukan darah seperti anemia aplastik anemia (dapat berlanjut menjadi leukemia). Senyawa ini termasuk antibiotik yang paling stabil larut dalam air pada pH 6 menunjukkan kecenderungan terurai yang paling rendah. Antibiotik ini diabsorsi dalam saluran pencernaan secara cepat dan sempurna dengan bantuan hati dan ginjal (Scuhnack et al., 1990).
2). Amoksisilin
Amoksisilin adalah antibiotik yang termasuk ke dalam golongan penisilin, dengan aktivitasnya membunuh bakteri secara langsung. Amoksisilin sangat efektif untuk beberapa bakteri seperti H. influenza, N. gonorrhoea, E. coli, Pneumococci, Strptococci, dan beberapa strain dari Staphylococci. Amoksisilin dapat menghambat pertumbuhan mikroorganisme Gram positif dan Gram negatif. Amoksisilin stabil dalam kondisi asam serta memiliki keuntungan tambahan dengan tidak berikatan dengan makanan seperti pada kebanyakan antibiotik lainnya. Hal ini karena Amoksisilin ini disekresikan secara cepat ke dalam bentuk urin (Schunack et al, 1990).
11 Amoksisilin biasa digunakan dalam pengobatan infeksi yang diduga disebabkan karena bakteri (Kline, 2009).
Aktivitas Antimikroba terhadap Bakteri Patogen
Syarat lain agar BAL layak digolongkan dengan bakteri probiotik yakni harus mampu menghasilkan senyawa antimikroba. Senyawa antimikroba merupakan suatu kemampuan antagonistik suatu senyawa kimia untuk menghambat pertumbuhan mikroba yang tidak diinginkan. Komponen antimikroba yang dimiliki BAL dapat menghambat bakteri patogen. Cotter dan Hill (2003) menyatakan bahwa asam laktat mampu menghambat pertumbuhan berbagai tipe bakteri pembusuk dan patogen termasuk spesies Gram negatif dalam famili Enterobacteriaceae dan Pseudomonadaceae. Lactobacillus dapat menghasilkan antibakteri, karena filtrat Lactobacillus mampu menghambat pertumbuhan bakteri patogen Staphylococcus aureus dan Escherichia coli (Hardiningsih et al., 2006).
Mekanisme penghambatan pertumbuhan mikroba oleh senyawa anti mikroba diantaranya : (1) perusakan dinding sel sehingga mengakibatkan lisis atau menghambat pertumbuhan dinding sel pada sel yang sedang tumbuh, (2) mengubah permeabilitas membran sitoplasma yang menyebabkan kebocoran nutrien di dalam sel, (3) denatuarasi protein sel, (4) perusakan sistem metabolisme dalam sel dengan cara menghambat kerja enzim intraseluler. Umumnya bakteri Gram negatif mempunyai ketahanan yang lebih baik terhadap senyawa antimikroba dibanding bakteri Gram positif. Struktur dinding sel bakteri Gram negatif lebih kompleks dari pada bakteri Gram positif, sehingga senyawa antimikroba akan lebih mudah masuk ke dalam sel bakteri Gram positif (Pelezar and Chan, 2007).
Kemampuan suatu zat antimikroba dalam menghambat pertumbuhan mikroba dipengaruhi oleh beberapa faktor, antara lain konsentrasi zat pengawet, waktu penyimpanan, suhu lingkungan, sifat-sifat mikroba (jenis, konsentrasi, umur dan keadaan mikroba), sifat-sifat fisik dan kimia makanan, termasuk kadar air, pH, jenis dan jumlah senyawa di dalamnya (Fardiaz,1992). Metabolit-metabolit bakteri asam laktat yang berfungsi sebagai senyawa antimikroba antara lain asam organik (asam laktat dan asam asetat), bakteriosin, hidrogen peroksida, diasetil, CO2 dan semua metabolit yeng mempunyai aktivitas antimikroba (Salminen et al., 2004).
12 Asam organik merupakan substansi alami dari berbagai jenis makanan. Aksi antimikroba dari asam organik berdasarkan pada kemampuannya untuk menurunkan pH dalam pangan yang berfase air (Samelis dan Sofos, 2003). Bakteriosin merupakan senyawa protein aktif dan kompleks yang dihasilkan oleh bakteri asam laktat yang mempunyai aktivitas antimikroba misalnya melawan patogen pencemar makanan penyebab food borne disease dan organisme berspora lainnya (Ray, 2004). Hidrogen peroksida merupakan salah satu agen pengoksidasi yang kuat dan dapat dijadikan sebagai zat antimikroba melawan bakteri, fungi dan bahkan virus (Ray, 2004).
Bakteri Probiotik Bifidobacterium longum
Bifidobacterium longum memiliki bentuk batang dan termasuk ke dalam golongan bakteri Gram positif, anaerob strict, tidak berspora, katalase negatif, pertumbuhan optimal pada suhu 36-37oC, memiliki pH optimum 6,5-7. Bakteri B. longum bersifat homofermentatif dengan rasio asam asetat dan asam laktat yang dihasilkan 1,5 : 1 (Nakazawa dan Hasono, 1992). Bifidobacterium hidup pada lapisan lumen kolon dan lebih spesifik lagi membentuk koloni dalam jumlah banyak, mensekresi asam laktat, asam asetat dan senyawa antimikroba. Bifidobacterium dominan pada dinding usus sehingga mencegah dinding usus dari kolonisasi bakteri yang tidak diinginkan (E. coli) atau 7 khamir (candida) (Tamime dan Robinson, 1999).
Bifidobacterium sangat efektif untuk melawan bakteri yang merugikan atau patogen yang masuk dari luar maupun bakteri yang merugikan dalam saluran pencernaan seperti Shigella dysenteria, Salmonella typhosa, Staphylococcus aureus, E. coli, dan bakteri lainnya. Bakteri ini memproduksi zat-zat yang bersifat asam lemak rantai pendek terutama asam asetat dan laktat, dan bisa juga menghasilkan zat bersifat antibiotik (Winarno et al., 2003). Bakteri B. longum diberikan untuk mengurangi frekuensi gangguan pencernaan, diare dan rasa sakit kepala karena pengobatan antibiotik dan dapat meningkatkan nilai gizi makanan, selain itu, bakteri tersebut juga mempunyai aktivitas antitumor pada kolon (Wahyudi dan Samsundari, 2008).
13 Lactobacillus acidophilus
Lactobacillus acidophilus merupakan bakteri dari famili Lactobacillaceae yang termasuk dalam golongan Gram positif, berbentuk batang, bersifat mesofilik dan tidak dapat membentuk spora. Bakteri L. acidophilus bersifat homofermentatif dengan asam laktat sebagai produk utama fermentasi karbohidrat (Rahman et al., 1992). Saat ini telah diketahui bahwa keberadaan bakteri ini tidak bersifat patogen dan aman bagi kesehatan sehingga sering digunakan dalam industri pengawetan makanan, minuman dan berpotensi sebagai produk probiotik. Sifat yang menguntungkan dari bakteri Lactobacillus dalam bentuk probiotik adalah dapat digunakan untuk mendukung peningkatan kesehatan. Bakteri tersebut berperan sebagai flora normal dalam sistem pencernaan yang berfungsi untuk menjaga keseimbangan asam dan basa sehingga pH dalam kolon konstan (Hardianingsih et al., 2006). Karakteristik L. acidophilus adalah : (1) tidak tumbuh pada suhu 15oC dan tidak memfermentasi ribosa; (2) pertumbuhan optimum pada suhu 35-38oC dan pH optimum 5,5-6,0; (3) pada susu sapi memproduksi 0,30%-1,90% DL asam laktat (Nakazawa dan Hosono, 1992).
Bakteri L. acidophilus merupakan salah satu spesies penyusun mikroflora alami usus yang mampu melewati hambatan di dalam saluran pencernaan. Spesies ini resisten terhadap enzim dalam saliva, asam lambung dan asam empedu sehingga mampu mencapai usus dalam keadaan hidup. Bakteri L. acidophilus banyak ditemukan pada bagian akhir usus halus dan bagian awal usus besar. Bakteri ini mampu memproduksi berbagai zat metabolit, seperti : asam organik, hidrogen peroksida dan berbagai bakteriosin yang dapat menghambat perkembangan bakteri patogen (Kanbe, 1992). Bakteri L. acidophilus dapat digolongkan dalam probiotik potensial untuk digunakan pada ayam yang ditujukan untuk pengendalian salmonellosis, colibacillosis dan clostridial necrotic enteritis (Natalia dan Priadi, 2006). Bakteri tersebut membantu mengendalikan infeksi dan peradangan usus, dengan fungsi tersebut maka mengurangi potensi diare, serta mampu menghalangi terbentuknya kanker dan membantu mengendalikan kadar kolesterol darah (Wahyudi dan Samsundari, 2008).
Bakteri Patogen
Bakteri yang dapat mengkontaminasi makanan terbagi menjadi dua jenis yaitu bakteri yang menyebabkan makanan menjadi rusak atau disebut bakteri perusak
14 dan bakteri yang menyebabkan keracunan atau penyakit pada manusia atau disebut bakteri patogen. Food borne disease terjadi pada manusia melalui dua cara, yaitu : 1) intoksikasi, yakni makanan mengandung toksin yang dihasilkan bakteri yang tumbuh di dalam makanan tersebut, dan 2) infeksi, yakni penyakit yang disebabkan oleh masuknya bakteri ke dalam tubuh melalui makanan yang telah terkontaminasi dan adanya reaksi dari tubuh terhadap keberadaan suatu metabolit yang dihasilkan oleh bakteri yang bersifat patogen dan digunakan sebagai acuan untuk mengetahui besarnya tingkat aktivitas antimikroba (Suriawiria, 2005). Beberapa mikroba yang diketahui sebagai bakteri pembusuk dan patogen pada produk fermentasi adalah dari famili Enterobacteriaceae, meliputi famili Enterobacter, Erwina, Citobacter, Klebsiella, Proteus, Salmonella, Serattia, Shigella dan Yersinia (Fardiaz, 1992). Staphlococcus aureus
Staphlococcus aureus merupakan bakteri Gram positif, berbentuk kokus yang terdapat dalam bentuk tunggal, berpasangan tetrad atau kelompok, seperti buah anggur berdiameter berkisar 0,5-1,5 µm, anaerob fakultatif, tidak bergerak, tidak berspora dan biasanya termasuk katalase positif (Holt et al., 1994). Bakteri ini sering berada pada pori-pori dan permukaan kulit, kelenjar keringat dan saluran usus serta dapat menyebabkan intoksikasi dan infeksi bisul (Fardiaz, 1992).
Suhu optimum pertumbuhan S. aureus adalah 35-57 oC, dengan kisaran suhu minimum adalah 6,7 oC dan suhu maksimum 45,5 oC. Bakteri ini dapat tumbuh pada kisaran pH 4,0-9,8 dengan pH optimum sekitar 7,0-7,8. Pertumbuhan pada pH mendekati 9,8 hanya mungkin apabila substratnya mempunyai komponen yang baik untuk pertumbuhannya (Buckle et al., 2007).
Escherichia coli
Escherichia coli merupakan bakteri Gram negatif, tidak mempunyai kapsul, umumnya mempunyai fimbriae, bersifat motil atau nonmotil dengan flagella, berukuran lebar 1-1,5 µm dan panjang 2-6 µm, bersifat anaerob fakultatif, tunggal atau berpasangan, mempunyai suhu optimal pertumbauhan 37oC, tetapi dapat tumbuh pada rentang suhu 15-45oC dan nilai aw optimum untuk pertumbuhannya adalah 0,96. (Willshaw et al., 2000).
Eschericia coli merupakan bakteri alami penghuni usus besar manusia. E. coli berpotensi sebagai penyebab diare dan infeksi saluran pencernaan yang akut.
15 Bayi yang baru dilahirkan di ususnya terdapat E. colli dan jumlahnya akan semakin meningkat sesuai dengan peningkatan umur. E. coli dengan jumlah 105 – 108 cfu/g feses dapat menyebabkan diare dan kanker (Mitsuoka, 1990).
Salmonella enteritidis serotipe Typhimurium (S. Typhimurium)
Salmonella Typhimurium merupakan bakteri Gram negatif, berbentuk batang, tidak berspora dan bersifat fakultatif anerobik. S. Typhimurium tumbuh optimum pada suhu 37oC, dengan suhu terendah 20oC dan suhu tertinggi 60oC (Buckle et al., 2007). Nilai pH untuk pertumbuhan S. Tyhimurium berkisar antara 4,0 – 9,0 dan nilai pH optimum 6,5 – 7,5, pada pH dibawah 4 dan di atas 9 bakteri ini akan mati perlahan-lahan. Viabilitas Salmonella akan menurun selama penyimpanan beku (Pelczar dan Chan, 2007).
Bakteri dari genus S. Typhimurium menyebabkan demam tipus yang akan terjadi setelah 7-14 hari terinfeksi dan umumnya penderita penyakit merasakan sakit kepala, kehilangan nafsu makan, lemah dan demam yang terus menerus. Penyakit yang disebabkan oleh S. Typhimurium dapat mengakibatkan tingkat kematian sekitar 10%. Makanan yang pada umumnya terkontaminasi oleh S. Typhimurium adalah telur dan hasil olahannya, daging ayam, daging sapi serta susu, sehingga untuk mencegah perkembangbiakannya bahan pangan tersebut tidak boleh terlalu lama disimpan di suhu kamar (Buckle et al., 2007).
METODE Lokasi dan Waktu
Penelitian dilaksanakan di Laboratorium Mikrobiologi, Bagian Teknologi Hasil Ternak, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor. Penelitian berlangsung pada bulan Maret -September 2010.
Materi Bahan
Bahan yang digunakan dalam penelitian ini berupa kultur starter Bakteri Asam Laktat (BAL) yang berasal dari Kefir dan bakteri hasil isolasi dari produk olahan susu sapi yaitu B. longum Y-01 dan L. acidophilus Y-01 yang merupakan bakteri koleksi Laboratorium Mikrobiologi Bagian Teknologi Hasil Ternak, Fakultas Peternakan IPB. Bakteri patogen yang digunakan adalah S. aureus ATCC 25923, E. coli ATCC 25922, dan S. Typhimurium ATCC 14028. Bahan-bahan lain yang dipergunakan adalah media tumbuh bakteri dan bahan kimia diantaranya meliputi susu skim, deMan’s Rogosa Sharpe Agar (MRSA), deMan’s Rogosa Sharpe Broth (MRSB), Buffer Pepton Water (BPW), Phosphate Buffered Saline (PBS), Eosin Methilen Blue Agar (EMBA), Salmonella Shigella Agar (SSA), Mueller Hinton Agar (MHA), HCl, NaOH, NaCl, bile salt, antibiotik (amoksisilin dan kloramfenikol), alkohol 70%, kristal violet, iodin, safranin, minyak imersi, aquadestilata, alumunium foil dan kapas.
Alat
Peralatan yang digunakan meliputi ruang steril, tabung reaksi, cawan petri, pipet, botol Scott, labu Erlenmeyer, inkubator, autoclave, spektrofotometer, penangas air, mikroskop, pH meter, timbangan digital, pemanas Bunsen, jangka sorong, lemari es, jarum Öse, sentrifuse, oven, gelas ukur, vortex, panci, cork borer, jangka sorong, kompor , sendok pengaduk dan flux laminaire (ruang steril).
17
Prosedur
Pemeriksaan Kultur Bakteri Asam Laktat dan Patogen (Pelczar dan Chan, 2007)
Kultur BAL kefir, B. longum Y-01, L. acidophilus Y-01 dan bakteri patogen S. aureus ATCC 25923, E. coli ATCC 25922 dan S. typhimurium ATCC 14028 diperiksa karakteristik morfologinya. Pengujian morfologi dilakukan dengan pewarnaan Gram diikuti dengan pengujian katalse.
Pewarnaan Gram dilakukan dengan cara pengolesan preparat bakteri pada gelas objek, dilanjutkan dengan fiksasi di atas api. Setelah itu kristal violet diteteskan di atas preparat, didiamkan selama ±1 menit, kemudian dibilas dengan akuadestilata. Preparat dikeringudarakan kemudian ditetesi dengan larutan lugol iodin selama ±1 menit dan dibilas kembali dengan akuadestilata. Preparat kemudian dikeringudarakan, selanjutnya ditetesi dengan alkohol 95% sebagai bahan pemucat selama ±5 detik, dibilas kembali dengan akuadestilata dan dikeringudarakan. Pewarnaan terakhir menggunakan safranin selama ±30 detik dan dibilas kembali dengan akuadestilata, lalu preparat dikeringudarakan. Bakteri yang telah diwarnai diamati di bawah mikroskop dengan perbesaran 10 x 100 dengan bantuan minyak imersi.
Uji katalase menggunakan bahan kimia H2O2. Satu Öse preparat bakteri dioleskan pada gelas objek, kemudian ditetesi dengan satu tetes H2O2. Jika dihasilkan gelembung gas O2, maka bakteri yang diuji termasuk kelompok bakteri katalase positif (+), sebaliknya bila bakteri yang diuji tidak menghasilkan gelembung gas maka bakteri tersebut termasuk kelompok bakteri katalase negatif (-).
Penentuan Standar Populasi Bakteri Asam Laktat (Waluyo, 2008)
Tahap ini bertujuan untuk menentukan jumlah populasi BAL selama diberikan perlakuan (ketahanan dalam lingkungan pH yang berbeda, keberadaan garam empedu dan adanya antibiotik) yang dihitung dengan pendekatan dua metode yaitu metode pour plate (hitungan cawan) dan metode turbidimetrik dengan spektrofotometer. Metode pour plate digunakan untuk penentuan populasi BAL sebelum dan sesudah perlakuan, sedangkan metode turbidimetri digunakan untuk penentuan perubahan populasi BAL selama perlakuan.
18
Metode Hitungan Cawan (Bakteriological Analytical Manual, 2001). Tahap ini
diawali dengan pengenceran yang dilakukan dengan mengambil 1 ml sampel yang sudah homogen menggunakan pipet steril, lalu dimasukkan ke dalam tabung reaksi berisi 9 ml laruran pengencer yaitu BPW, sehingga terbentuk pengenceran 10-1. Pengenceran terus dilakukan sampai pada pengenceran 10-9. Pengambilan sampel dilakukan menggunakan pipet steril pada pengenceran 10-6, 10-7, 10-8 dan 10-9 sebanyak 1 ml dan dipindahkan ke dalam cawan Petri steril secara duplo. Media MRSA ditambahkan ke dalam cawan Petri dengan metode tuang (pour plate) sebanyak 12-15 ml. Campuran tersebut dihomogenkan dengan cara cawan Petri digerakkan dengan arah membentuk angka delapan. Cawan Petri diinkubasikan setelah agar mengeras, dengan posisi terbalik pada suhu 37 C selama 24–48 jam. Koloni mikroba yang terbentuk dihitung berdasarkan Standard Plate Count (SPC) dengan rumus sebagai berikut :
Populasi (cfu/ml) =
[n1 + (0,1 x n2)] x d
Keterangan :
N = Jumlah koloni yang berbeda dalam kisaran hitung (25-250 koloni) n1 = Jumlah cawan pertama yang koloninya dapat dihitung
n2 = Jumlah cawan kedua yang koloninya dapat dihitung d = Tingkat pengenceran pertama yang dihitung
Metode Turbidimetrik (Waluyo, 2008). Tahap ini diawali dengan penentuan
korelasi antara nilai optical density (OD) dengan populasi bakteri hasil pemupukan dengan metode pour plate. Semakin tinggi nilai OD maka jumlah populasi bakteri yang dipupukkan juga semakin banyak, sehingga membentuk persamaan linier y = a + bx (y jumlah populasi BAL, x nilai OD bakteri dan a dan b konstanta persamaan). Persamaan linier yang didapat (Tabel 3) digunakan dalam penentuan populasi BAL kefir, B. Longum Y-01 dan L. acidophilus Y-01 pada pengujian ketahanan terhadap pH yang berbeda, garam empedu, dan antibiotik yang berbeda. Nilai R2 merupakan nilai detrminan dari persamaan linier yang didapat, nilai R2 yang
19 mendekati nilai 1 maka persamaan linier akan semakin akurat dengan populasi yang dipupukkan.
Tabel 3. Persamaan Linier BAL Indigenous Kefir dan Produk Olahan Susu Sapi
No. Bakteri Persamaaan Linier R2
1. Bakteri Asam Laktat Kefir y = 7,1955 + 0,7034x 0,9246 2. B. longum Y-01 y = 6,6840 + 1,093x 0,9579 3. L. acidophilus Y-01 y = 7,2057 + 1,812x 0,9768
Penelitian Utama Persiapan Sel-sel Kultur Bakteri Asam Laktat
Sel-sel kultur BAL kefir, B. longum Y-01 dan L. acidophilus Y-01 yang berumur 24 jam masing-masing dalam MRSB dipanen melalui sentrifugasi pada kecepatan 3500 rpm selama 15 menit dalam suhu 4 0C. Bagian presipitat atau endapan dipisahkan dari bagian supernatannya. Presipitat selanjutnya distandarisasi dengan populasi awal ±107 cfu/ml ke dalam larutan PBS.
Uji Ketahanan terhadap pH yang Berbeda (Chou dan Weimer, 1999)
Presipitat sel-sel kultur BAL kefir, B. longum Y-01 dan L. acidophilus Y-01 yang sudah distandarisasi dengan populasi awal ±107 cfu/ml dimasukkan ke dalam larutan PBS yang telah dikondisikan pada pH 2,0 dengan bantuan HCl dan NaOH. Kultur bakteri dalam PBS diinkubasi pada suhu 37 0C selama 180 menit. Penghitungan populasi awal sebelum (t0) dan sesudah diinkubasi selama 180 menit (t180) dihitung dengan metode hitungan cawan. Perubahan populasi BAL selama perlakuan dalam pH yang berbeda diamati setiap 30 menit, melalui pengukuran nilai absorbansi ( 620 nm) dengan menggunakan spektrofotometer. Nilai OD (x) yang diperoleh dikonversikan dalam persamaan y a bx (Tabel 3) yang ada untuk memperoleh penyetaraan populasi BAL. Uji ketahanan kultur BAL kefir, B. longum Y-01 dan L. acidophilus Y-01 terhadap pH yang berbeda ditentukan berdasarkan jumlah kematian bakteri, yaitu bila kultur starter BAL mampu mempertahankan populasinya hingga 50% dinyatakan sebagai probiotik.
20 Penelitian ini mengamati kemampuan bertahan atau tumbuh BAL pada saluran pencernaan. Kondisi keasaman lambung mempunyai kisaran pH antara 2-3,5 sehingga nilai pH yang diamati adalah 2; 2,5; 3,2. Kondisi pH pada usus adalah netral sehingga pengamatan dilakukan pada pH 7,2.
Uji Ketahanan terhadap Garam Empedu (Lin et al., 2006)
Uji ketahanan terhadap garam empedu dilakukan terhadap isolat bakteri BAL kefir, B. longum Y-01 atau L. acidophilus Y-01 yang dapat tumbuh pada pH 2,0. Pengujian disesuaikan dengan kadar garam empedu pada saluran pencernaan yaitu dengan menggunakan bile salt sebanyak 0,3% oxgall b/v dalam media PBS dengan pH 7,2. PBS yang telah ditambahkan garam empedu dengan konsentrasi 0,3% pada pH 7,2, kemudian disterilisasi pada suhu 121 oC selama 15 menit.
Presipitat sel-sel kultur BAL kefir, B. longum Y-01 dan L. acidophilus Y-01 yang sudah distandarisasi dengan populasi awal ±107 cfu/ml diinokulasikan pada media PBS yang telah ditambahkan garam empedu 0,3% steril. Kultur diinkubasi pada suhu 37 0C selama 24 jam. Penghitungan populasi awal sebelum (t0) dan sesudah diinkubasi selama 24 jam (t24j) dihitung dengan metode hitungan cawan. Perubahan populasi BAL selama perlakuan dengan penambahan garam empedu 0,3% oxgal diamati setiap 1 jam selama 24 jam, melalui pengukuran nilai absorbansi ( 620 nm) dengan menggunakan spektrofotometer. Nilai OD (x) yang diperoleh dikonversikan dalam persamaan y a bx (Tabel 3) untuk memperoleh penyetaraan populasi BAL. Uji ketahanan kultur BAL kefir, B. longum Y-01 atau L. acidophilus Y-01 terhadap garam empedu ditentukan berdasarkan jumlah kematian bakteri, yaitu bila kultur starter BAL mampu mempertahankan populasinya hingga 50% dinyatakan sebagai probiotik.
Uji Ketahanan terhadap Antibiotik (Modifikasi Liasi et al., 2009)
Uji ketahanan terhadap antibiotik dilakukan terhadap isolat BAL dapat bertahan tumbuh pada pH 2,0 dan adanya garam empedu 0,3%. Bakteri selanjutnya diuji berdasarkan sensitifitasnya terhadap antibiotik. Presipitat distandarisasi dengan populasi awal ±107 cfu/ml, lalu diinokulasikan ke dalam media MRSB yang telah ditambahkan antibiotik (amoksisilin atau kloramphenikol) sebanyak 30 μg/ml.
21 Pengukuran populasi awal dihitung dengan metode pemupukan sebelum diinkubasi (t0). Kultur diinkubasi pada suhu 37 0C selama 24 jam.
Penghitungan populasi awal sebelum (t0) dan sesudah diinkubasi selama 24 jam (t24j) dihitung dengan metode hitungan cawan. Perubahan populasi BAL selama perlakuan dalam pH yang berbeda diamati setiap 1 jam, melalui pengukuran nilai absorbansi ( 620 nm) dengan menggunakan spektrofotometer. Nilai OD (x) yang diperoleh dikonversikan dalam persamaan y a bx (Tabel 3) untuk memperoleh penyetaraan populasi BAL. Uji ketahanan kultur BAL kefir, B. longum Y-01 atau L. acidophilus Y-01 terhadap pH yang berbeda ditentukan berdasarkan jumlah kematian bakteri, yaitu bila kultur starter BAL mampu mempertahankan populasinya hingga 50% dinyatakan sebagai probiotik.
Uji Sifat Antimikroba terhadap Bakteri Patogen (Modifikasi Maheswari, 2008) Persiapan Filtrat Bebas Sel (FBS) dan FBS Terkonsentrasi. Kultur bakteri yang
sudah disegarkan (populasi 107 CFU/ml) diinokulasikan dalam MRSB ( 5% v/v), lalu diinkubasi pada 37 oC selama 18 jam. Filtrat bebas sel (FBS) diperoleh dengan penyaringan steril menggunakan filter 0,22 m (Millipore). FBS dikonsentrasikan dengan cara menambahkan ke dalam FBS metanol (MeOH) dengan rasio 1:1, kemudian dievaporasi dalam rotary evaporator pada suhu 40-45 0C selama ± 60 menit atau hingga mencapai 1/5 volume awal, dengan tujuan untuk meningkatkan aktivitas antimikroba dari BAL. FBS terkonsentrasi segera disimpan dalam refrigerator (4 oC) sebelum digunakan.
Persiapan Bakteri Indikator. Bakteri uji (BAL dan bakteri patogen) yang
digunakan adalah bakteri yang berumur 24 jam. Bakteri patogen dengan populasi awal minimal 108 cfu/ml (standar Mc Farland no.2) dalam media NB terlebih dahulu diencerkan dalam media NaCl fisiologis hingga populasi mencapai 105 cfu/ml.
Konfrontasi Filtrat Bebas Sel dengan Bakteri Indikator. Pengujian aktivitas
antimikroba kultur BAL kefir, B. longum Y-01 dan L. acidophilus Y-01 terhadap bakteri patogen dilakukan dengan metode difusi agar sumur. Sebanyak masing-masing 1 ml kultur bakteri patogen yang telah diencerkan dengan populasi 105 cfu/ml dipipet ke dalam cawan petri, lalu ditambahkan media Muller Hinton Agar dengan suhu 50oC sebanyak 20 ml/cawan, lalu dihomogenkan dengan cara digerakkan
22 membentuk angka delapan. Media MHA berisi bakteri indikator dibiarkan memadat, kemudian dibuat sumur difusi berdiameter 7 mm dengan alat pelubang atau cork borer, lalu bagian bawah sumur dilapisi dengan media Bacteriological Agar untuk menghindari filtrat merembes di dasar sumur. Sebanyak 50l FBS terkonsentrasi dipipet ke dalam sumur, lalu cawan beserta isi diletakkan dalam refrigerator untuk memberi kesempatan FBS berdifusi ke dalam agar. Cawan selanjutnya diinkubasi pada 37 oC selama 24 jam. Diameter penghambatan berupa zona bening di sekeliling sumur diukur dengan jangka sorong pada empat tempat yang berbeda, lalu hasil pengukuran dirata-ratakan. Percobaan dilakukan dengan 2 kali ulangan.
Gambar 3. Skema Pengukuran Zona Hambat a
b d
Area bakteri patogen Zona hambat/bening
Lubang sumur (d=7 mm) c
Diameter rata-rata (mm) = (A-7) + (B-7) + (C-7) + (D-7) 4
23
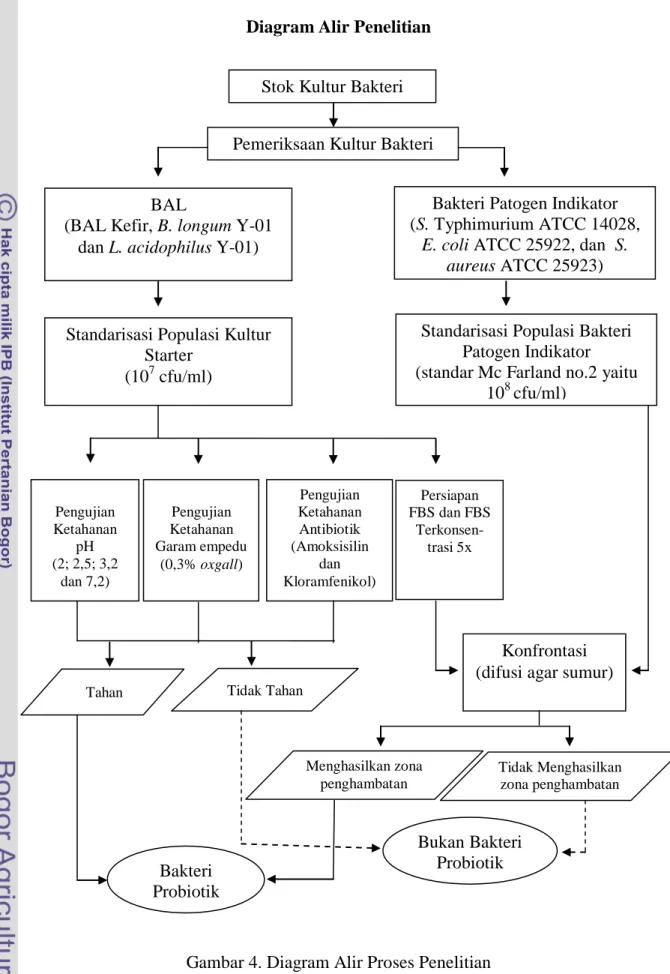
Diagram Alir Penelitian
Gambar 4. Diagram Alir Proses Penelitian Stok Kultur Bakteri
Pemeriksaan Kultur Bakteri
Bakteri Patogen Indikator (S. Typhimurium ATCC 14028,
E. coli ATCC 25922, dan S. aureus ATCC 25923) Pengujian Ketahanan pH (2; 2,5; 3,2 dan 7,2) Persiapan FBS dan FBS Terkonsen-trasi 5x Pengujian Ketahanan Garam empedu (0,3% oxgall) Pengujian Ketahanan Antibiotik (Amoksisilin dan Kloramfenikol) Konfrontasi (difusi agar sumur) BAL
(BAL Kefir, B. longum Y-01 dan L. acidophilus Y-01)
Standarisasi Populasi Kultur Starter
(107 cfu/ml)
Standarisasi Populasi Bakteri Patogen Indikator (standar Mc Farland no.2 yaitu
108 cfu/ml) Tidak Tahan Menghasilkan zona penghambatan Tahan Bakteri Probiotik Tidak Menghasilkan zona penghambatan Bukan Bakteri Probiotik
24
Rancangan Percobaan Uji t.
Data ketahanan BAL kefir, B. longum Y-01 dan L. acidophilus Y-01 terhadap perlakuan pH yang berbeda (2; 2,5; 3,2 dan 7,2), keberadaan garam empedu 0,3% dan antibiotik yang berbeda (amoksisilin dan kloramfenikol) dianalisis dengan uji t. Data populasi BAL kefir, B. longum Y-01 dan L. acidophilus Y-01 dianalisis dengan membandingkan populasi masing-masing BAL sebelum diberi perlakuan (t0) dan setelah diberi perlakuan (tx). Analisis data dipergunakan untuk melihat pengaruh perlakuan terhadap peubah yang diamati dengan masing-masing perlakuan terdiri atas tiga ulangan. Rumus yang digunakan dalam Uji t adalah sebagai berikut :
Keterangan :
μi = rata-rata perlakuan ke-i μj = rata-rata perlakuan ke-j s = simpangan baku n = jumlah data
Rancangan Acak Lengkap (RAL)
Rancangan Acak Lengkap digunakan untuk menganalisis aktivitas antimikroba BAL terhadap bakteri patogen yang berbeda (S. aureus ATCC 25923, E. coli ATCC 25922 dan S. typhimurium ATCC 14028) dan untuk menganalisis persentase bakteri yang hidup pada kondisi pH yang berbeda, garam empedu dan antibiotik berbeda. Persamaaan model rancangannya menurut Gaspersz (1994).
Keterangan :
Yij = Pengamatan pada perlakuan ke-i dan ulangan ke-j μ = Rataan Umum
δi = Pengaruh perlakuan ke-i
εij = Pengaruh galat percobaan pada perlakuan ke-i ulangan ke-j i = BAL uji yang berbeda
25 j = Ulangan 1, 2, dan 3
Data hasil kedua rancangan selanjutnya dianalisis dengan Analysis of variance (ANOVA). Apabila pada analisis ragam didapatkan hasil yang berbeda nyata, maka dilakukan uji lanjut dengan uji Tukey (Gaspersz, 1994).
HASIL DAN PEMBAHASAN
Pemeriksaan Bakteri Asam dan Bakteri Patogen
Pemeriksaan terhadap kultur bakteri meliputi Bakteri Asam Laktat (BAL) dan bakteri patogen dilakukan diawal penelitian untuk memastikan bahwa kultur bakteri koleksi yang digunakan tidak terkontaminasi oleh kapang, khamir atau bakteri lain. Pemeriksaan secara sederhana yang umum dilakukan yaitu mengamati morfologi bakteri secara mikroskopik meliputi bentuk dan susunannya dengan bantuan pewarnaan Gram serta pengujian sifat katalase.
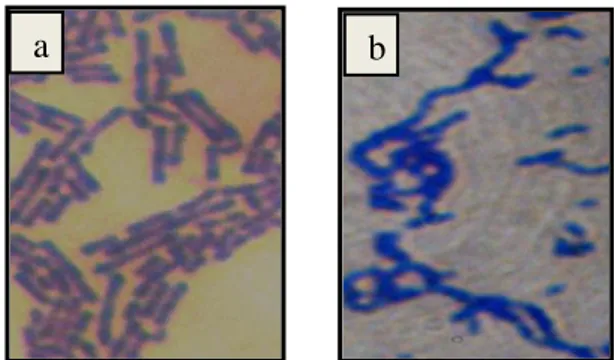
Hasil pemeriksaan terhadap BAL kefir, B. longum Y-01, L. acidophilus Y-01 serta bakteri patogen S. aureus ATCC 25923, E. coli ATCC 25922 dan S. Typhimurium ATCC 14028 secara mikroskopik dengan bantuan pewarnan Gram mendapatkan bahwa semua kultur bakteri mempunyai koloni yang homogen, tidak terdapat kontaminasi dan menunjukkan kesesuaian karakteristik morfologi dari masing-masing kultur bakteri. Pengujian sifat katalase juga menunjukkan kesesuaian. Karakteristik morfologi dan sifat katalase kultur bakteri asam laktat asal kefir dan bakteri patogen indikator dapat dilihat pada Tabel 4.
Tabel 4. Karakteristik BAL Indigenous Kefir dan Bakteri Patogen Jenis Bakteri Pewarnaan
Gram
Morfologi Bentuk dan Susunan
Sifat Katalase ---Bakteri Asam Laktat--- Bakteri asam laktat kefir Positif Bulat dan batang Negatif B. longum Y-01 Positif Batang pendek berantai Negatif L. acidophilus Y-01 Positif Batang berantai panjang Negatif ---Bakteri Patogen--- S. aureus ATCC 25923 Positif Bulat bergerombol Positif E. coli ATCC 25922 Negatif Batang pendek Positif S. Typhimurium ATCC 14028 Negatif Batang pendek Positif
Metode pewarnaan Gram sangat membantu dalam menentukan kelompok bakteri berdasarkan susunan dinding selnya. Komposisi kimia dinding sel bakteri sangat bervariasi sehingga terdapat perbedaan kemampuan mengabsorpsi bahan-bahan pewarna yang diberikan di antara spesies, galur dan bahkan diantara tipe sel
27 pada organisme yang sama (Yuniarti et al., 2003). Bakteri berdasarkan reaksi terhadap pewarna selama proses pewarnaan Gram dibedakan menjadi kelompok bakteri Gram positif dan Gram negatif.
BAL asal kefir, B. longum Y-01, L. acidophilus Y-01 dan S. aureus ATCC 25923 tergolong ke dalam kelompok bakteri Gram positif karena mampu mempertahankan warna ungu kristal violet setelah diberikan pewarna tandingan safranin, sebaliknya E. coli ATCC 25922 dan S. Typhimurium ATCC 14028 tidak mampu mempertahankan warna ungu kristal violet setelah diberikan pewarna tandingan safranin, sehingga dikelompokkan ke dalam bakteri Gram negatif. Pengelompokan bakteri ke dalam Gram positif dan Gram negatif menunjukkan bahwa keduanya mempunyai susunan dinding sel yang berbeda. Bakteri Gram positif dapat mempertahankan warna ungu kristal violet karena memiliki dinding sel yang lebih tebal dari pada bakteri Gram negatif sehingga membuat zat pewarna kristal violet tidak dapat keluar dari sel. Menurut Fardiaz (1992), dinding sel bakteri Gram positif 90% terdiri atas lapisan peptidoglikan dengan ketebalan 18 sampai 80 nm dan 10% lapisan tipis yakni asam teikoat sehingga mampu menyerap warna ungu lugol dan tetap mempertahankan warna tersebut ketika dicuci dengan alkohol. Kandungan utama dinding sel bakteri Gram negatif yaitu lipopolisakarida tidak dapat mempertahankan warna ungu kristal violet sehingga berwarna merah setelah diberi zat pewarna tandingannya yaitu safranin.
Kelompok bakteri Gram positif dapat mempertahankan warna ungu disebabkan ketika ditetesi oleh alkohol 95%, dinding sel mengalami dehidrasi, pori-pori menciut, daya rembes dinding sel dan membran menurun sehingga membuat zat pewarna kristal violet tidak dapat keluar dari sel. Pemberian pewarna tandingan berupa safranin yang berwarna merah tidak akan berpengaruh karena tidak masuk ke dalam dinding sel. Bakteri Gram negatif tidak dapat mempertahankan zat pewarna kristal violet disebabkan ketika ditetesi dengan alkohol 95% lipid dari dinding sel terekstraksi, pori-pori mengembang sehingga membuat zat pewarna kristal violet keluar dari sel dan membuat sel menjadi tidak berwarna. Sel bakteri yang tidak berwarna tersebut apabila ditetesi dengan safranin, maka sel tersebut akan menyerap zat pewarna safranin sehingga akan tampak berwarna merah ketika dilihat di bawah mikroskop (Pelczar dan Chan, 2007).