Patra Rijalul Harly, Ruli Herman Sitanggang, Tinni T. Maskoen
Departemen Anestesiologi dan Terapi Intensif Fakultas Kedokteran Universitas Padjadjaran Rumah Sakit Dr. Hasan Sadikin Bandung
Abstrak
Leptospirosis adalah zoonosis akibat leptospira yang banyak ditemukan di daerah tropis dengan curah hujan yang tinggi. Manifestasi klinis bervariasi mulai dari penyakit yang self-limited dengan tanda dan gejala yang tidak spesifik, meningitis aseptik benigna, Weil’s disease (ikterus, disfungsi renal, dan perdarahan), hingga perdarahan pulmonal yang memiliki mortalitas tinggi. Seorang laki – laki 18 tahun datang ke unit gawat darurat Rumah Sakit Dr. Hasan Sadikin pada bulan Juni 2016 dengan Weil’s disease
yang disertai perdarahan pulmonal. Terjadi kegagalan fungsi organ multipel yang memberat, sehingga dikonsulkan ke ICU pada hari ke 2 perawatan di rumah sakit. Didapatkan APACHE II Score 17 dengan prediksi mortalitas 25% pada saat masuk ICU. Kegagalan fungsi organ yang didapatkan adalah respirasi (P/F Ratio 52,6), ginjal (Kreatinin 5,36mg/dL), dan hati (bilirubin total 26,26 mg/dL). Diagnosis leptospirosis ditegakkan dengan skor Modified Faine Criteria 31. Manajemen di ICU pada pasien ini dilakukan dengan ventilasi mekanis, hemodialisis, meropenem dan methylprednisolone. Kortikosteroid diberikan mengingat patofisiologi leptospirosis yang diperkirakan akibat reaksi autoimun. Terjadi perbaikan pada fungsi respirasi (P/F Ratio 445), ginjal (Kreatinin 0,52/dL), dan hati (bilirubin total 10,76 mg/dL). Pasien diekstubasi pada hari ke 7 perawatan di ICU dan pindah ke ruang perawatan pada hari ke 8 perawatan di ICU.
Kata kunci: Weil’s disease, Perdarahan Pulmonal, Methylprednisolone
Weil’s Disease with Pulmonary Hemorrhage
Abstract
Leptospirosis is a zoonosis caused by leptospira spp. mainly found in high rainfall tropical area. Clinical manifestation
greatly varies from self limited non specific disease, benign aseptic meningitis, Weil’s disease (jaundice, acute kidney injury, and hemorrhage), to a highly lethal pulmonary hemorrhage. An 18years old male came to the
Dr. Hasan Sadikin Hospital emergency department on June 2016, diagnosed as Weil’s disease with pulmonary hemorrhage. He has a worsening multiple organ failure, and consulted to the ICU at the 2nd day of hospitalization.
Apache II score at ICU admission is 17 with predicted mortality 25%. Organ failure at ICU admission were respiration (P/F Ratio 52,6), kidney (Creatinine 5,36mg/dL), and liver (Total Bilirubin 26,26 mg/dL). Diagnosis of leptospirosis is made based on Modified Faine Criteria score of 31. ICU management consist of menchanical ventilation, hemodialysis, meropenem, and methylprednisolone. Rationale of corticosteroid administration is due to pathophysiology of leptospirosis, which is believed to be related to an autoimmune process. Respiration function (P/F Ratio 445), kidney function (Creatinine 0,52/dL), and liver function (Total Bilirubin 10,76 mg/dL) were resolved. Patient was extubated on the 7th day after ICU admission, and discharged to the ward on the 8th day
after ICU admission.
Key words: Weil’s disease, Pulmonary Hemorrhage, Methylprednisolone
Korespondensi: Patra Rijalul Harly, dr., SpAn, Departemen Anestesiologi dan Terapi Intensif Fakultas Kedokteran Universitas Padjadjaran /Rumah Sakit Dr. Hasan Sadikin Bandung, Alamat Rumah Lorong Madrasah Beringin The Hak, Jambi Selatan, Mobile 082232758891, Email drpatra81@gmail.com
Pendahuluan
Leptospirosis adalah zoonosis akibat bakteri Leptospira. Penularan dari manusia ke manusia sangat jarang terjadi. Leptospirosis terjadi di seluruh dunia, terutama di daerah tropis dan subtropis dengan curah hujan yang tinggi. Penularan terjadi akibat kontak antara mukosa manusia dengan urine hewan yang terinfeksi. Hewan yang paling sering menularkan leptospirosis adalah tikus, landak, sapi, babi, anjing, domba, kambing, kuda, dan kerbau. Insiden di daerah tropis yang lembab mencapai 10–100 per 100.000 populasi per tahun. Sedangkan pada daerah beriklim lebih dingin insiden berkisar antara 0,1 hingga 1 per 100.000 populasi per tahun. (1)
Leptospirosis pertama kali ditemukan oleh Adolf Weil pada tahun 1886. Sampai saat ini namanya masih digunakan pada bentuk berat dari leptospirosis, yaitu Weil’s disease. (1) Pada 90% kasus, infeksi Leptopsira adalah penyakit yang self-limited dengan tanda dan gejala yang tidak spesifik. Juga dapat bermanifestasi sebagai sindroma meningitis aseptik benigna. Pada Weil’s disease didapatkan ikterus, disfungsi renal, dan perdarahan. Weil’s disease memiliki angka mortalitas yang tinggi. Selain itu dapat juga terjadi bentuk pulmonal berat dari leptospirosis, yaitu pneumonitis hemoragik. Dapat terjadi tanpa ikterus maupun sebagai bagian dari Weil’s disease. (2) Mortalitas pada Weil’s disease adalah 10%, sedangkan mortalitas pada leptospirosis dengan penumonitis hemoragik adalah 50%, walau dengan pengobatan optimal. (3)
Manifestasi pulmonal dari leptospirosis pertama kali dilaporkan oleh Moeschlin pada tahun 1943. (4) Sejak saat itu, telah banyak publikasi mengenai perdarahan pulmonal pada leptospirosis dari seluruh dunia. (5,6,7,8,9,10,11,12,13,14) Namun hingga saat ini penyebab perdarahan pulmonal pada leptospirosis masih belum jelas. Dalam penelitian oleh Nally et.al (2004) dengan model guinea pig pada leptospirosis dengan perdarahan pulmonal didapatkan lapisan imunoglobulin (IgA, IgG, dan IgM) dan komplemen C3 pada permukaan alveolus. (15) Serupa dengan penelitian tersebut, Croda et.al (2009) meneliti 30 spesimen paru pasien dengan
perdarahan pulmonal akibat leptospirosis, juga didapatkan lapisan imunoglobulin (IgA, IgG, dan IgM) dan komplemen C3 pada permukaan alveolus. Diperkirakan akibat adanya peningkatan permeabilitas vaskuler akibat aktivasi endotel dan overproduksi nitric oxide, terjadi kebocoran IgA, IgG, dan IgM ke ruang alveoli. Akibat pelapisan imunoglobulin terhadap pneumosit tipe I dan II terjadi aktivasi komplemen. Hal ini dapat menyebabkan nekrosis sel epitel yang disertai oleh kebocoran sel dan perdarahan kedalam lumen alveoli. (16)
Diagnosis definitif leptospirosis dengan kultur sulit dilakukan, memerlukan beberapa minggu inkubasi dan memiliki sensitifitas yang rendah. Leptospira bisa diisolasi dari darah antara hari ke 7–10 sejak infeksi dan dari urine antara minggu 2–3 sejak infeksi. Bahkan pada kondisi optimum, leptospira tumbuh dengan lambat, dan dilaporkan sebagai kultur negatif, bahkan setelah enam hingga delapan minggu. Kultur disarankan untuk dilakukan selama empat bulan. Diagnostik juga dapat dilakukan dengan PCR. Pendekatan serologi adalah yang paling sering digunakan dalam diagnosis leptospirosis. Microscopic agglutination test (MAT) adalah strandar pada tes serologi leptospira karena sensitifitas dan spesifisitas yang tinggi. IgM anti leptospira dapat mulai dideteksi pada minggu pertama infeksi. (17)
Hingga saat ini, terapi antibiotika pada leptospirosis adalah kontroversial, karena sebagian besar kasus leptospirosis membaik dengan sendirinya. Namun mayoritas klinisi akan memberikan antibiotika pada pasien yang dicurigai ataupun terbukti terinfeksi leptospirosis. (18) Sebuah review dari Cochrane Library oleh Brett-Major & Coldren (2012) menyatakan bahwa pada saat ini tidak ada cukup bukti yang dapat menyarankan ataupun menentang pemberian antibiotika pada terapi leptospirosis. Pemberian penisilin, doksisiklin, maupun sefalosporin tidak memengaruhi mortalitas maupun durasi demam. (19)
Untuk terapi perdarahan pulmonal pada leptospirosis, berbagai terapi dilaporkan memberikan efek yang menguntungkan. Shenoy et.al (2006) melaporkan pemberian methilprednisolone intravena 1 gram selama 3 hari yang diikuti dengan pemberian prednisolone
oral 1mg/kg selama 7 hari berhasil menurunkan angka mortalitas dari 62% menjadi 18% (p<0,02). (20) Kularatne et.al (2011) juga melaporkan bahwa terapi methylprednisolone pada pasien leptospirosis berat dengan dosis 500 mg IV selama 3 hari, diikuti 8 mg per hari per oral selama 5 hari berhasil meningkatkan survival dari 38% menjadi 100%. (21) Namun perlu disadari bahwa terapi kortikosteroid membawa risiko infeksi jamur seperti Candida dan aspergillus, bahkan pada dosis 250 mg methylprednisolon per hari. (22) Chen et.al (2007) melaporkan keberhasilan penanganan kasus perdarahan pulmonal pada leptospirosis dengan plasma exchange. (23) Penggunaan desmopressin oleh Pea et.al (2003) berhasil menghentikan dengan cepat perdarahan pulmonal pada lima dari enam kasus leptospirosis dengan gagal napas. (24)
Ilustrasi Kasus
Pasien laki-laki 18 tahun, berat 60 kg dengan keluhan demam sejak 6 hari sebelum masuk rumah sakit disertai nyeri kepala, batuk berdahak kemerahan, hilangnya nafsu makan, mual, muntah dan myalgia di seluruh tubuh, terutama pada betis kaki. Didapatkan conjunctival suffusion. Tiga hari sebelum masuk rumah sakit
pasien mulai tampak kuning pada seluruh tubuh disertai kencing yang berwarna pekat kecoklatan dan sedikit. Pasien bekerja di sawah dan tinggal di rumah dengan higine yang kurang baik. Curah hujan di tempat tinggal tinggi.
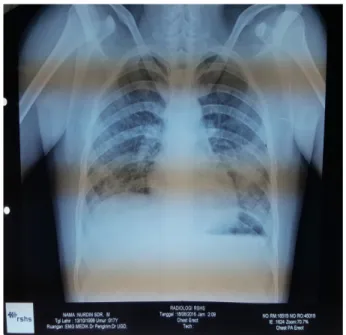
Pada saat pasien masuk rumah sakit (hari ke 0) dilakukan pemeriksaan penunjang dan didapatkan Hemoglobin 8,2 g/dL, Hematokrit 24%, Leukosit 21.900/mm3, Trombosit 15.000/mm3. Didapatkan penurunan fungsi ginjal dengan kreatinin 8,47 mg/dL dan Ureum 316 mg/dL. Fungsi hati juga didapatkan memburuk dengan Bilirubin Total 26,26 mg/dL, Bilirubin Direk 23,27 mg/dL, AST 128 U/L, dan ALT 61 U/L. Juga terjadi gangguan elektrolit, yaitu Natrium 125 mEq/L. Dari hasil pemeriksaan gas darah didapatkan pH 7,469; PCO2 30,7 mmHg; PO2 126 mmHg; HCO3 22,1; Base excess -0,3; dan saturasi O2 98,9%. Dilakukan rontgen thorax dan didapatkan bercak retikulonoduler di lapang atas sampai bawah paru bilateral yang sebagian berkonfluens di lapang bawah paru kiri et causa DD/ lung involvement, interstitial lung disease (Gambar 1).
Pasien dirawat di ruang penyakit dalam, Pada hari ke 1 perawatan dilakukan hemodialisa. Pada hari ke 2 dilakukan tranfusi Thrombocyte Concentrate sebanyak 6 kantong karena 15.000/ mm3 dan perdarahan dari paru. Dalam 6 jam
setelah tranfusi pasien mengeluh sesak yang semakin memberat. Pada hari tersebut dilakukan intubasi dan pasien alih rawat ke ICU. Diagnosa saat itu oleh sejawat penyakit dalam adalah Weil’s
disease dan suspek TRALI. Hasil pemeriksaan
fisik saat masuk ICU didapatkan ronchi dan darah segar keluar dari pipa endotrakea. Diberikan ventilasi mekanis dengan mode CPAP + PSV, PS 17 cmH2O, PEEP 10 cmH2O, FiO2 100%. Didapatkan frekuensi total 26x/menit, VT 350 mL, MV 9,1 L, dan Cstat 20,59. Perfusi dingin, basah, ikterik. Tekanan darah 118/56 (77) mmHg dengan denyut jantung 99x/menit, reguler.
Kesadaran alert, setara GCS E 4 M 6 V terintubasi. Produksi urine 80mL/jam, kuning pekat.
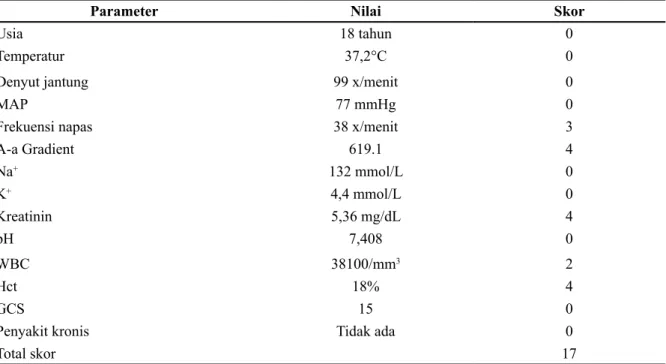
Dilakukan analisa gas darah dan didapatkan pH 7,408; PCO2 33 mmHg; PO2 52,6 mmHg; HCO3 19,9 mmol/L; BE 2,6 mmol/L; SaO2 83,8 %; dan P/F ratio 52,6. Pasien masuk ICU dengan APACHE II score 17 (Tabel 1) dan SOFA score 11 (Tabel 2). Sedangkan Modified Faine Criteria mendapatkan skor 41 (Tabel 3). Faal hemostasis dalam batas normal (PT 11,2 detik; aPTT 22,8 detik). Laktat 1,3 mmol/L.
Pasien didiagnosis dengan Weil’s disease (leptospirosis dengan acute kidney injury, Tabel 1 APACHE II score
Parameter Nilai Skor
Usia 18 tahun 0
Temperatur 37,2°C 0
Denyut jantung 99 x/menit 0
MAP 77 mmHg 0
Frekuensi napas 38 x/menit 3
A-a Gradient 619.1 4 Na+ 132 mmol/L 0 K+ 4,4 mmol/L 0 Kreatinin 5,36 mg/dL 4 pH 7,408 0 WBC 38100/mm3 2 Hct 18% 4 GCS 15 0
Penyakit kronis Tidak ada 0
Total skor 17
Keterangan: Mortalitas 25%
Tabel 2 SOFA Score
Parameter Nilai Skor
P/F Ratio 52.6 4 Kreatinin 5,36 mg/dL 4 Platelet 188.000/mm3 0 Bilirubin 26,26 mg/dL 4 MAP 77 mmHg 0 GCS 15 0 Total Skor 12 Keterangan: Mortalitas 40-50 %
hiperbilirubinemia, dan perdarahan), sepsis, severe ARDS et causa leptospira pulmonary hemorrhage syndrome, differential diagnosis: possible TRALI (indeterminate), TB Paru. Diberikan fentanil 25 mcg/jam, Midazolam 3 mg/jam i.v, Omeprazole 2x40mg i.v, Meropenem 3x 1 gram i.v, Methylprednisolone 2x125mg i.v, Nebulizer NaCl 0,9%/6jam, dan Asam Traneksamat 3 x 500 mg
Selama perawatan di ICU terjadi trend penurunan frekuensi napas setelah pemberian support ventilasi dengan ventilasi mekanis. Pada hari ke-2 perawatan di ICU pemberian midazolam dihentikan dan frekuensi napas sedikit meningkat, namun masih dalam batas yang normal. PEEP yang diberikan berhasil diturunkan dari yang tertinggi 12 cmH2O hingga 5 cmH2O. Pressure support juga berhasil diturunkan selama perawatan. Fraksi inspirasi oksigen dapat diturunkan dari 100% hingga ke 35% pada hari ke-7 perawatan di ICU. Didapatkan perbaikan saturasi dari yang awalnya 84% dan selalu berada
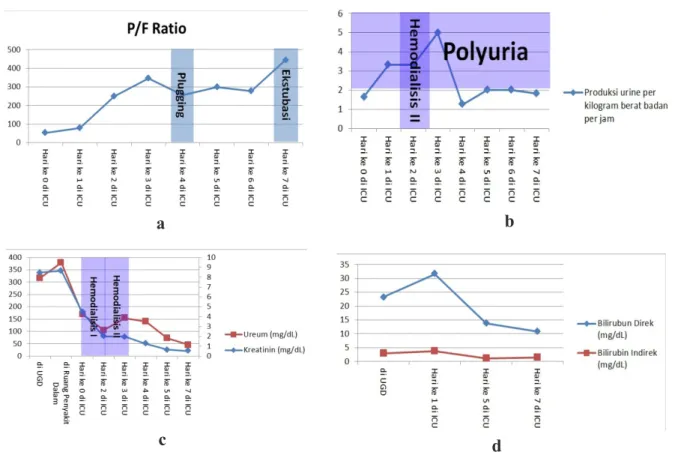
diatas 90% sejak hari pertama perawatan di ICU. Juga dapat dilihat adanya perbaikan compliance statis sepanjang perawatan di ICU. Selain itu juga nampak perbaikan P/F ratio (Gambar 2). Namun, pada hari ke-4 perawatan di ICU terjadi sedikit penurunan P/F ratio karena plugging oleh bekuan darah, sehingga dilakukan reintubasi. P/F ratio kembali naik bertahap setelah reintubasi. Pada hari ke-7 perawatan di ICU dilakukan ekstubasi dengan pertimbangan perdarahan dari ETT sudah tidak didapatkan lagi. Dari pemeriksaan foto rontgen thorax didapatkan peningkatan densitas bercak retikulonoduler pada hari pertama perawatan di ICU bila dibandingkan dengan pada saat di UGD (Gambar 3). Namun, selama perawatan di ICU tampak perbaikan gambaran rontgen thorax.
Status hemodinamika pasien sejak pertama masuk ke ICU selalu stabil dengan MAP selalu diatas 65 mmHg. Terlihat trend penurunan denyut jantung pasien seiring dengan perbaikan klinis selama perawatan di ICU. Terjadi penurunan
Tabel 3 Modified Faine Criteria Data Klinis
Nyeri kepala 2 (+)
Demam 2 (+)
Bila demam, diatas 39°C 2
Conjunctival suffusion (bilateral) 4 (+)
Meningismus 4
Nyeri otot (terutama betis kaki) 4 (+)
Conjunctival suffusion + meningismus + nyeri otot 10
Ikterus 1 (+)
Albuminuria atau retensi nitrogen 2
Faktor Epidemiologi
Hujan 5 (+)
Kontak dengan lingkungan terkontaminasi 4 (+)
Kontak dengan hewan 1
Temuan laboratorium
Isolasi leptospira pada kultur Diagnosis certain Serologi positif
ELISA IgM positif*; SAT positif*; MAT single high
titre* (salah satu) 15 (+)
Titer MAT meningkat (paired sera) 25
hemoglobin menjadi 6,2 g/dL pada hari pertama perawatan di ICU. Dilakukan tranfusi PRC 500 mL, dan hemoglobin menjadi 9 g/dL. Didapatkan trombositopenia (15.000/mm³) sejak saat di UGD. Saat di ruangan penyakit dalam mendapatkan tranfusi thrombocyte concentrate, sebanyak 6 kantong, trombosit memiliki trend meningkat sampai ke nilai yang normal selama perawatan di ICU. Pasien mendapatkan sedasi pada saat masuk ke ICU, dan pada hari ke-2 saat sedasi dihentikan didapatkan kesadaran pasien Alert, setara GCS E 4 M 6 V terintubasi. Pada hari-hari berikutnya tidak pernah didapatkan penurunan kesadaran.
Pasien sudah menjalani hemodialisis sehari sebelum masuk ke ICU. Pada hari pertama perawatan di ICU dilakukan hemodialisis untuk yang kedua kalinya. Dari pemantauan urine, didapatkan fase poliuria dengan puncak pada hari ke 3 perawatan di ICU (Gambar 2). Dari hasil pemeriksaan ureum dan kreatinin tampak trend yang membaik (Gambar 2).
Diet per sonde mulai diberikan pada hari ke-2 perawatan di ICU, dinaikkan bertahap mulai dari 500 kkal hingga 1.500 kkal pada hari ke-4 perawatan di ICU. Kadar bilirubin menunjukkan trend yang membaik selama perawatan di ICU (Gambar 2). Tidak ditemukan pertumbuhan bakteri pada kultur darah. Pemeriksaan BTA negatif. Dari pemeriksaan imunologi didapatkan IgM anti leptospira reaktif. Terapi dengan meropenem 3 x 1 gr diberikan selama 7 hari. Methylprednisolon diberikan 2 x 125 mg, dan mulai dilakukan tappering off pada hari ke 5 perawatan di ICU. Pasien pindah ke ruang penyakit dalam pada hari ke-8 perawatan di ICU.
Pembahasan
Leptospirosis adalah penyakit zoonosis yang sering tidak terdiagnosis karena gejala yang tidak spesifik dan lambatnya pertumbuhan leptospira pada kultur. Leptospirosis memiliki spektrum
a
b
c
d
Gambar 2 Fungsi Organ Selama Perawatan
gejala klinis yang bervariasi, mulai dari pasien dengan gejala nonspesifik hingga pasien dengan
Weil’s disease dan pasien dengan perdarahan
pulmonal. Angka mortalitas tertinggi didapatkan pada pasien dengan perdarahan pulmonal, yaitu 50%.
Pada ilustrasi kasus, didapatkan pasien dengan
Weil’s disease yang disertai dengan perdarahan pulmonal. Higine tempat tinggal pasien dan pekerjaannya di sawah memberikan risiko paparan terhadap urine hewan yang terinfeksi leptospirosis. Sejak dari datangnya pasien di UGD, pasien telah meunjukkan gejala dan tanda dari Weil’s disease, yaitu ikterus, gagal ginjal akut dan perdarahan. Manifestasi perdarahan yang muncul adalah perdarahan pulmonal, tampak dari adanya batuk berdahak kemerahan. Seiring dengan perjalanan penyakit, pada perawatan hari ke 2 di rumah sakit terjadi gagal napas, sehingga pasien dialihrawat ke ICU.
Dari APACHE II score pada 24 jam pertama perawatan di ICU didapatkan perkiraan mortalitas 25%. Sedangkan dari SOFA score didapatkan perkiraan angka mortalitas 40–50%. Didapatkannya perubahan SOFA score lebih dari 2 poin dari baseline (tidak ada riwayat gagal organ sebelumnya, SOFA score 12) sehingga memenuhi kriteria sepsis menurut Sepsis-3. Karena itu diberikan antibiotika spektrum luas,
yaitu meropenem 3 x 1 gram. Hasil kultur darah menunjukkan tidak ada pertumbuhan kuman. Hal ini menunjukkan tidak adanya infeksi kuman selain leptospirosis. Pertumbuhan leptospira pada kultur sangat lambat, diperlukan setidaknya 6 hingga 8 minggu untuk mendapatkan hasil yang positif. Karenanya adalah wajar bahwa pada pasien dengan leptospirosis bila dilakukan kultur hasilnya negatif. Adanya leptospirosis diperkuat dengan didapatkannya IgM anti leptospira. Didapatkan skor modified Faine criteria diatas 26 (skor 31), sehingga memenuhi kriteria diagnosis leptospirosis.
Pada sistem respirasi, pasien masuk ke ICU Severe ARDS et causa Leptospira pulmonary hemorrhage syndrome. Differential diagnosis dengan TRALI. Berdasarkan konsensus dari The National Heart Lung and Blood Institute (NHLBI) Working Group on TRALI (2005) diagnosis trali harus dapat memenuhi dua kriteria, yaitu Acute Lung Injury baru muncul setelah tranfusi, dan onset dalam 6 jam setelah tranfusi. Selain itu, bila ada faktor risiko Acute Lung Injury selain tranfusi masif maka diagnosis tidak bisa dipastikan (indeterminate), dan disebut sebagai possible TRALI. Pada kasus ini ARDStelah ada sebelumnya, namun memburuk setelah tranfusi. Selain itu ada faktor risiko lain selain tranfusi masif, yaitu sepsis. Saat ini tidak Gambar 3 Foto Thorax Selama Perawatan di ICU
(a.) Foto thorax pada hari pertama perawatan di ICU. (b.) Foto thorax pada hari keenam perawatan di ICU
ada tes laboratorium definitif untuk TRALI.25 Pemeriksaan BTA negatif, sehingga diagnosis TB paru disingkirkan.
Terapi dengan ventilasi mekanis, nebulizer, dan kortikosteroid menunjukkan perbaikan pada fungsi respirasi, seperti terlihat pada P/F ratio dan compliance yang terus membaik. Dari foto rontgen thorax nampak perbaikan selama perawatan di ICU. Pada kasus ini kortikosteroid diberikan karena leptospirosis berfungsi untuk menekan reaksi autoimun yang menyebabkan perdarahan pulmonal. Faal hemostasis pasien berada dalam batas yang normal. Selama di ICU trombosit meningkat dengan sendirinya sejalan dengan perbaikan klinis. Untuk mencegah perdarahan kembali, pasien mendapatkan antifibrinolitik asam traneksamat 3 x 500 mg. Ekstubasi dilakukan setelah memastikan perdarahan pulmonal tidak aktif lagi, karena walau fungsi paru sudah baik, bila masih ada perdarahan dapat terjadi bekuan darah yang menimbulkan obstruksi pada bronchus ataupun cabang-cabangnya.
Hemodinamika selama perawatan di ICU stabil tanpa topangan obat-obat vasoaktif. Oleh karena perdarahan pulmonal, sempat terjadi anemia yang pada saat masuk ICU. DIlakukan koreksi dengan tranfusi PRC. Juga didapatkan trombositopenia, dimana sebelumnya telah diberikan tranfusi thrombocyte concentrate di ruang penyakit dalam. Kadar trombosit meningkat bertahap sejalan dengan perbaikan kondisi klinis pasien. Trend leukosit juga membaik selama perawatan di ICU. Kesadaran pasien sejak sedasi dihentikan selalu alert selama perawatan di ICU.
Pasien masuk ke ICU dengan acute kidney injury. Dapat dilihat bahwa terjadi fase poliuria selama perawatan di ICU yang menunjukkan kembalinya fungsi filtrasi glomerulus, namun belum disertai kembalinya fungsi reabsorpsi di loop henle. Hal ini umum ditemukan pada pasien dengan acute tubular necrosis yang membaik. Pasien mendapatkan hemodialisis dua kali selama perawatan, yaitu saat perawatan di ruang penyakit dalam, dan pada hari ke-1 perawatan di ICU. Selama perawatan di ICU fungsi ginjal membaik, hal ini terlihat pada berkurangnya kadar ureum dan kreatinin.
Selama perawatan di ICU, bising usus baik,
dan tidak didapatkan retensi dari NGT. Karenanya setelah respirasi stabil dengan ventilasi mekanis, segera diberikan nutrisi enteral. Pemberian nutrisi dinaikkan bertahap dan telah mencapai 1500 kkal pada hari ke-3 perawatan di ICU. Fungsi hati membaik selama perawatan di ICU, terlihat dari berkurangnya kadar bilirubin serum.
Daftar Pustaka
1. Terpstra WJ. Human leptospirosis: guidance for diagnosis, surveillance, and control. Malta: World Health Organization; 2003. 2. Marchiori E, Lourenco S, Setubal S, Zanetti
G, Gasparetto TD, Hochhegger B. Clinical and imaging manifestations of hemorrhagic pulmonary leptospirosis: a state-of-the-art review. Lung. 2011;189:1–9.
3. McBride AJ, Athanazio DA, Reis MG, Ko AI. Leptospirosis. Curr Opin Infect Dis. 2005;18(5):376–86.
4. Moeschlin S. Lungeninfiltrate beim Ikterus infectiosus Weil. Schweiz Med Wschr. 1943;73:1227–30.
5. Garcia MAM, Damia AdD, Villanueva RM, Hontagas JLL. Pulmonary involvement in leptospirosis. Eur J Clin Microbiol Infect Dis. 2000;19:471–4.
6. O'Neil KM, Rickman LS, Lazarus AA. Pulmonary manifestations of leptospirosis. Rev Infect Dis. 1991;13:705–9.
7. Luks AM, Lakshminarayanan S, Hirschmann JV. Leptospirosis presenting as diffuse alveolar hemorrhage. Chest. 2003;123(2):639–43. 8. Yersin C, Bovet P, Merlen F, Clement
J, Laille M, Ranst MV, dkk. Pulmonary haemorrhage as a predominant cause of death in leptospirosis in Seychelles. Transaction of the Royal Society of Tropical Medicine and Hygine. 2000;94:71–6.
9. Gouveia EL, Metcalfe J, deCarvalho ALF, Aires TSF, Villasboas-Bisneto JC, Queirroz A, dkk. Leptospirosis-associated severe pulmonary hemorrhagic syndrome, Salvador, Brazil. Emerg Infect Dis. 2008;14(3):505–8. 10. Spichler A, Moock M, Chapola EG, Vinetz
J. Weil’s Disease: an unusually fulminant presentation characterized by pulmonary hemorrhage and shock. Brazil J Infect Dis.
2005;9(3):336–40.
11. daSilva JJP, Dalston MO, deCarvalho JEM, Setubal S, deOliveira JMC, Pereira MM. Clinicopathological and immunohistochemical features of the severe pulmonary form of leptospirosis. Revista da Sociedade Brasileira de Medicina Tropical. 2002;35:395–9.
12. Im JG, Yeon KM, Han MC, Kim CW, Webb WR, Lee JS, dkk. Leptospirosis of the lung: radiographic findings in 58 patients. Am J Roentgenol. 1989;152:955–9.
13. Maroun E, Kushawaha A, El-Charabaty E, Mobarakai N, El-Sayegh S. Fulminant Leptospirosis (Weil’s disease) in an urban setting as an overlooked cause of multiorgan failure: a case report. J Med Case Reports. 2011;5(7):1–5.
14. Trevejo RT, Perez JGR, Ashford DA, MmLure EM, Jarquin-Gonzales C, Amador JJ, dkk. Epidemic leptospirosis associated with pulmonary hemorrhage-Nicaragua, 1995. J Infect Dis. 1998;178:1457–63. 15. Nally JE, Chantranuwat C, Wu XY, Fishbein
MC, Pereira MM, daSilva JJP, dkk. Alveolar septal deposition of immunoglobulin and complement parallels pulmonary hemorrhage in a guinea pig model of severe pulmonary leptospirosis. Am J Pathol. 2004;163:1115– 27.
16. Croda J, Neto AND, Brasil RA, Pagliari C, Nicodemo AC, Duarte MIS. Leptospirosis pulmonary haemorrhage syndrome is associated with linear deposition of immunoglobulin and complement on the alveolar surface. Clin Microbiol Infect. 2010;16:593–9.
17. Bharti AR, Nally JE, Ricaldi JN, Matthias MA, Diaz MM, Lovett MA, et al. Leptospirosis: a
zoonotic disease of global importance. The Lancet Infectious Disease. 2003;3:757–71. 18. Vinetz JM. A Mountain out of a molehill: do
we treat acute leptospirosis, and if so, with what?. Clin Infect Dis. 2003;36:1514–5. 19. Brett-Major DM, Coldren R. Antibiotics for
leptospirosis (Review). Cochrane Database of Systematic Reviews. 2012;(2): p. CD008264. 20. Shenoy VV, Nagar VS, Chowdury AA, Bhalgat
PSJNI. Pulmonary leptospirosis: an excellent response to bolus methylprednisolone. Postgrad Med J. 2006;82:602–6.
21. Kularatne SA, Budagoda BD, deAlwis VK, Wickramasinghe WM, Bandara JM, Pathirage LP, dkk. High efficacy of bolus methylprednisolone in severe leptospirosis: a descriptive study in Sri Lanka. Postgrad Med J. 2011;87(1023):13–7.
22. Hingorani RV, Kumar R, Hegde, VA, Soman, NR, dkk. Is it time to rethink the use of steroids for pulmonary leptospirosis?. J Associat Physici India. 2016;64:78–9.
23. Chen YS, Cheng SL, Wang HC, Yang PC. SumLessful treatment of pulmonary hemorrhage associated with leptospirosis and scrub typhus coinfection by early plasma exchange. J Formos Med Assoc. 2007;106(2 Suppl):s1–6.
24. Pea L, Roda L, Boussaud V, Lonjon B. Desmopressin Therapy for Massive Hemoptysis Associated with Severe Leptospirosis. Am J Respir Crit Care Med. 2003;167:726–8.
25. Toy P, Lowell C. TRALI – definition, mechanisms, incidence and clinical relevance. Best Pract Res Clin Anaesthesiol. 2007;21(2):183–93.