LAPORAN PRAKTIKUM KIMIA FISIKA
PENENTUAN BERAT MOLEKUL BERDASARKAN
PENGUKURAN MASSA JENIS GAS
Oleh:
NI PUTU WIDIASTI
(1113031049)/D
NI PUTU MERRY YUNITHASARI
(1113031059)/D
I DEWA GEDE ABI DARMA
(1113031064)/D
JURUSAN PENDIDIKAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS PENDIDIKAN GANESHA
SINGARAJA
2014
PENENTUAN BERAT MOLEKUL BERDASARKAN PENGUKURAN MASSA JENIS GAS
I. Tujuan
1. Menentukan berat molekul CHCl3 berdasarkan pengukuran massa jenis gas.
2. Menentukan berat molekul senyawa volatile unknown berdasarkan pengukuran massa jenis gas.
II. Dasar Teori
Setiap zat terdiri atas partikel-partikel yang senantiasa bergerak dengan kecepatan yang tergantung pada suhu dan keadaan fisik suatu zat (padat, cair, atau gas). Pergerakan partikel tersebut akibat dari energi kinetik yang dimiliki dengan ukuran yang partikel sangat kecil (atom, molekul, ion, dan sebagainya). (Suardana, 2001).
Pada keadaan gas, partikel-partikel memiliki jarak yang relatif jauh lebih besar dari ukuran partikel dengan pergerakan secara acak, mengakibatkan gaya tarik-menarik antar partikel dapat diabaikan karena gaya yang dihasilkan sangat kecil (Suardana, 2001). Menurut Isana, Yatiman dan Suharto, 2003 Yang dimaksud dengan zat yang mudah menguap yaitu zat-zat yang mempunyai titik didih normal lebih rendah dari titik didih normal air. Jadi, titik didih zat < 100 oC. Dimana gas dapat bercampur sempurna
satu sama lain membentuk satu fase yang homogen, karena secara fisik gas satu dengan yang lain tidak dapat dibedakan.
Gas diperoleh dengan cara memanaskan suatu zat cair, dan umumnya masih berada dalam keadaan dua fasa, yaitu fasa gas dan fasa cair dalam keadaan seimbang. Jika tekanan uap zat cair sama dengan tekanan udara luar, maka zat cair akan mendidih dengan temperatur tetap. Jika tekanan udara luar sama dengan 1 atm, maka zat cair mendidih pada titik didih normalnya. Secara umum, gas dengan sifat-sifatnya dapat dikelompokkan menjadi dua golongan, yaitu:
Gas ideal atau gas sempurna dengan sifat-sifat sebagai berikut:
a. Molekul-molekul gas dianggap tidak memiliki volume.
b. Gaya tarik menarik atau tolak menolak antar molekul dianggap nol. c. Tumbukan antar molekul dengan dinding bejana adalah lenting sempurna. d. Memenuhi hukum gas PV= nRT (Isana, 2003).
Gas real/nyata atau sejati memiliki sifat yang tidak memenuhi sifat dari gas ideal, melainkan memenuhi sifat gas sejati di antaranya persamaan van der Waals. Semua gas yang dikenal sehari-hari adalah termasuk gas sejati, sedangkan gas ideal pada kenyataannya tidak pernah ada, namun sifat-sifatnya didekati oleh gas sejati pada tekanan yang sangat rendah. Jadi pada tekanan mendekati nol semua gas memenuhi sifat gas ideal, sehingga persamaan PV = nRT dapat diberlakukan. Untuk mendapatkan tekanan mendekati nol sangat sulit maka dilakukan ekstrapolasi (Isana, 2003).
Persamaan gas ideal dan massa jenis gas dapat digunakan untuk menentukan berat senyawa yang mudah menguap. Dari persamaan gas ideal didapat
P·V = n R T atau
PV = (m/BM) RT dengan mengubah persamaan
P(BM) = (m/V) RT = ρRT di mana: BM : Berat molekul P : Tekanan gas V : Volume gas T : Suhu absolut R : Tetapan gas ideal ρ : Massa jenis
Densitas fasa uap lebih mudah ditentukan dari pada zat gas, karena uap tersebut dapat ditimbang dengan teliti jika dikondensasikan menjadi zat cair pada suhu kamar. Dengan cara ini maka densitas uap dapat ditentukan lebih mudah dan lebih teliti hasilnya (Isana, 2003). Nilai BM hasil perhitungan akan mendekati nilai sebenarnya, tetapi masih mengandung kesalahan. Ketika labu erlenmeyer kosong ditimbang, labu ini penuh dengan udara. Setelah pemanasan dan pendinginan dalam desikator, tidak semua uap cairan kembali kebentuk cairannya, sehingga akan mengurangi jumlah udara yang masuk kembali ke dalam labu erlenmeyer. Jadi massa labu erlenmeyer dalam keadaan ini lebih kecil dari pada massa labu erlenmeyer dalam keadaan semua uap cairan kembali kebentuk cairannya. Oleh karena itu massa cairan X sebenarnya harus ditambahkan dengan massa udara yang tidak dapat masuk kembali ke dalam labu erlenmeyer karena adanya uap cairan yang tidak mengembun. Massa udara tersebut dapat dihitung dengan menganggap bahwa tekanan parsial udara yang tidak dapat masuk sama dengan tekanan
uap cairan pada suhu kamar. Nilai ini dapat diketahui dari literature (Basuki dan Bismo, 2003)
Dengan faktor koreksi:
Dimana, P adalah tekanan uap (mmHg) dan t adalah suhu kamar (oC). Jadi dengan menggunakan rumus di atas, tekanan uap pada berbagai suhu dapat diketahui.
Dengan diketahuinya nilai tekanan uap pada suhu kamar, data mengenai volume labu Erlenmeyer, dan berat molekul udara, yaitu 28,8 gram/mol, maka dapat dihitung faktor koreksi yang harus ditambahkan pada massa cairan sehingga akan didapat nilai berat molekul (BM) yang lebih tepat.
III. Alat dan Bahan - Alat:
Alat Ukuran Jumlah
Labu Erlenmeyer 100 mL 2 buah
Gelas kimia 500 mL 1 buah
Gelas ukur 10 mL 1 buah
Pipet tetes - 2 buah
Penjepit tabung reaksi - 1 buah
Jarum - 1 buah
Termometer 100oC - 1 buah
Heater - 1 buah
Desikator - 1 buah
Neraca analitik - 1 buah
Statif dan klem - 1 pasang
- Bahan:
Bahan Jumlah
Cairan volatile CHCl3 5 mL Cairan volatile unknown 10 mL
Akuades 100 mL
Karet gelang 4 buah
Aluminium foil 8x8 cm ) 4 , 227 ( 03 , 1163 90328 , 6 log t P
IV. Prosedur Kerja dan Hasil Pengamatan Senyawa CHCl3
No. Prosedur Kerja Hasil Pengamatan
1. Sebuah labu erlenmeyer berleher kecil yang bersih dan kering diambil, yang ditutup dengan aluminium foil serta dikencangkan dengan menggunakan karet gelang.
Labu Erlenmeyer yang digunakan adalah labu Erlenmeyer yang berukuran 100 mL yang ditutup dengan aluminium foil dan diikat dengan karet gelang.
2. Labu erlenmeyer beserta aluminium foil dan karet gelang tersebut ditimbang dengan menggunakan neraca analitik.
Massa labu Erlenmeyer + aluminium foil + karet gelang adalah 63,84 gram.
3. Sebanyak 5 mL senyawa CHCl3 dimasukkan ke dalam labu erlenmeyer, dan ditutup kembali dengan karet gelang erat-erat sehingga tutup ini bersifat kedap gas. Kemudian dibuat sebuah lubang kecil pada aluminium foil dengan menggunakan jarum, agar uap dapat keluar.
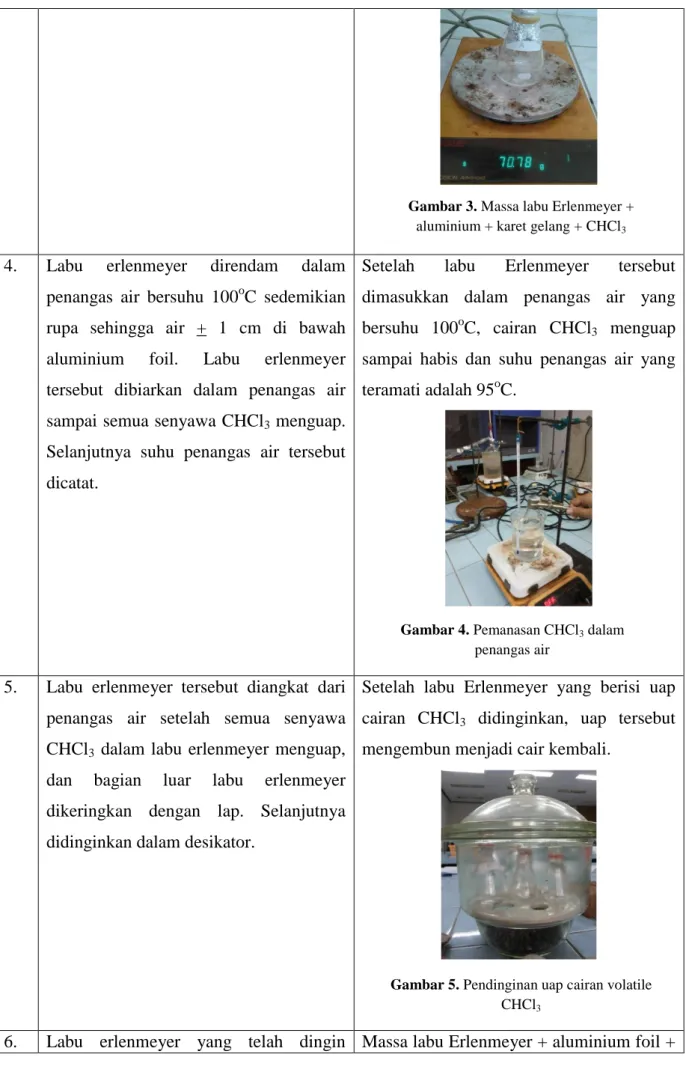
5 mL senyawa CHCl3 dimasukkan ke dalam labu erlenmeyer, dan ditutup kembali dengan aluminium foil yang selanjutnya diikat dengan karet gelang. Sebuah lubang kecil pada aluminium foil dibuat dengan menggunakan jarum. Massa labu erlenmeyer + aluminium foil + karet gelang + senyawa CHCl3 adalah 70,78 gram.
Gambar 1. Labu erlenmeyer yang ditutup
dengan aluminium foil
Gambar 2. Massa labu Erlenmeyer +
4. Labu erlenmeyer direndam dalam penangas air bersuhu 100oC sedemikian rupa sehingga air + 1 cm di bawah aluminium foil. Labu erlenmeyer tersebut dibiarkan dalam penangas air sampai semua senyawa CHCl3 menguap. Selanjutnya suhu penangas air tersebut dicatat.
Setelah labu Erlenmeyer tersebut dimasukkan dalam penangas air yang bersuhu 100oC, cairan CHCl3 menguap sampai habis dan suhu penangas air yang teramati adalah 95oC.
5. Labu erlenmeyer tersebut diangkat dari penangas air setelah semua senyawa CHCl3 dalam labu erlenmeyer menguap, dan bagian luar labu erlenmeyer dikeringkan dengan lap. Selanjutnya didinginkan dalam desikator.
Setelah labu Erlenmeyer yang berisi uap cairan CHCl3 didinginkan, uap tersebut mengembun menjadi cair kembali.
6. Labu erlenmeyer yang telah dingin Massa labu Erlenmeyer + aluminium foil +
Gambar 4. Pemanasan CHCl3 dalam
penangas air
Gambar 5. Pendinginan uap cairan volatile
CHCl3
Gambar 3. Massa labu Erlenmeyer +
ditimbang dengan neraca analitik.
NB: Tutup aluminium foil beserta karet gelang sebelum ditimbang jangan dilepaskan.
karet gelang + uap cairan CHCl3 yang telah mengembun adalah 64,41 gram.
7. Volume labu erlenmeyer ditentukan dengan jalan mengisi labu erlenmeyer dengan air sampai penuh dan mengukur massa air yang terdapat dalam labu erlenmeyer. Suhu air dalam labu erlenmeyer diukur pula. Jadi volume air dapat diketahui, apabila massa jenis air pada suhu air dalam labu erlenmeyer diketahui dengan rumus:
V m
- Massa labu Erlenmeyer = 62,92 gram
- Masa labu Erlenmeyer + air = 209,10 gram
- Suhu air dalam labu elenmeyer adalah 27oC
- Massa air = 209,10 gram - 62,92 gram = 146,18 gram
8. Tekanan atmosfer diukur dengan Tekanan atmosfer setelah diukur dengan
Gambar 6. Massa cairan volatile CHCl3 yang
telah mengembun
Gambar 7. Massa labu Erlenmeyer
menggunakan barometer. barometer adalah 763 mmHg.
Senyawa Unknown
No. Prosedur Kerja Hasil Pengamatan
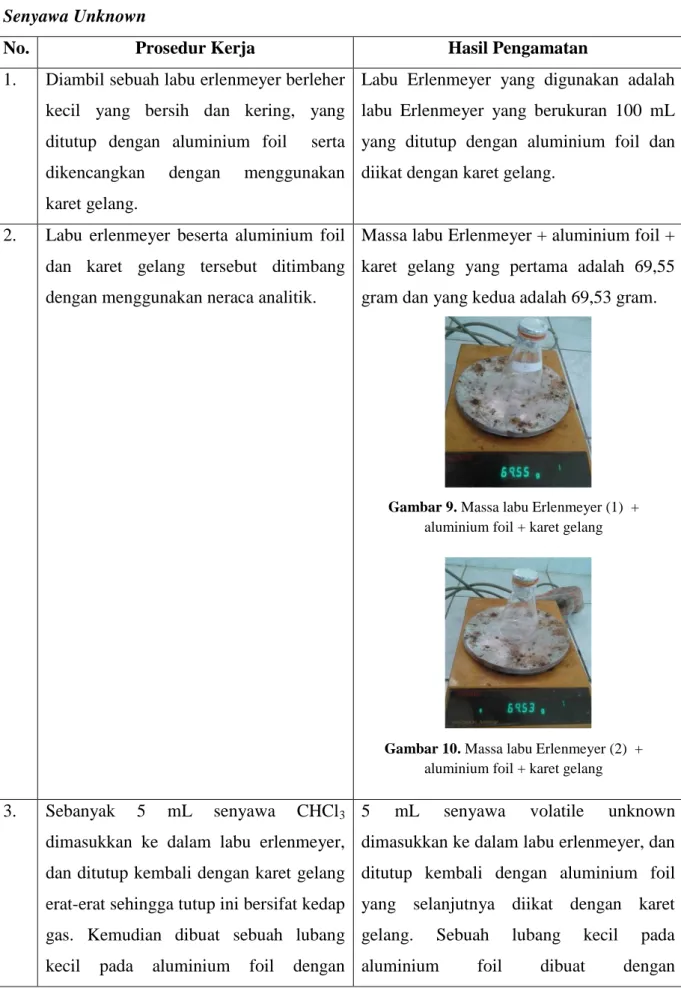
1. Diambil sebuah labu erlenmeyer berleher kecil yang bersih dan kering, yang ditutup dengan aluminium foil serta dikencangkan dengan menggunakan karet gelang.
Labu Erlenmeyer yang digunakan adalah labu Erlenmeyer yang berukuran 100 mL yang ditutup dengan aluminium foil dan diikat dengan karet gelang.
2. Labu erlenmeyer beserta aluminium foil dan karet gelang tersebut ditimbang dengan menggunakan neraca analitik.
Massa labu Erlenmeyer + aluminium foil + karet gelang yang pertama adalah 69,55 gram dan yang kedua adalah 69,53 gram.
3. Sebanyak 5 mL senyawa CHCl3 dimasukkan ke dalam labu erlenmeyer, dan ditutup kembali dengan karet gelang erat-erat sehingga tutup ini bersifat kedap gas. Kemudian dibuat sebuah lubang kecil pada aluminium foil dengan
5 mL senyawa volatile unknown dimasukkan ke dalam labu erlenmeyer, dan ditutup kembali dengan aluminium foil yang selanjutnya diikat dengan karet gelang. Sebuah lubang kecil pada aluminium foil dibuat dengan
Gambar 9. Massa labu Erlenmeyer (1) +
aluminium foil + karet gelang
Gambar 10. Massa labu Erlenmeyer (2) +
menggunakan jarum, agar uap dapat keluar.
menggunakan jarum. Massa labu erlenmeyer + aluminium foil + karet gelang + senyawa volatile unknown yang pertama adalah 76,65 gram dan massa yang kedua adalah 76,67 gram.
4. Labu erlenmeyer direndam dalam penangas air bersuhu 100oC sedemikian rupa sehingga air + 1 cm di bawah aluminium foil. Labu erlenmeyer tersebut dibiarkan dalam penangas air sampai semua senyawa CHCl3 menguap. Selanjutnya suhu penangas air tersebut dicatat.
Setelah labu Erlenmeyer tersebut dimasukkan dalam penangas air yang bersuhu 100oC, cairan volatile unknown menguap sampai habis dan suhu penangas air yang teramati adalah 98oC. Untuk pengulangan ke dua suhu penangas air yang teramati adalah 99oC.
Gambar 11. Massa labu Erlenmeyer (1) +
aluminium foil + karet gelang + senyawa unknown
Gambar 12. Massa labu Erlenmeyer (2) +
aluminium foil + karet gelang + senyawa unknown
5. Labu erlenmeyer tersebut diangkat dari penangas air setelah semua senyawa CHCl3 dalam labu erlenmeyer menguap, dan bagian luar labu erlenmeyer dikeringkan dengan lap. Selanjutnya didinginkan dalam desikator.
Setelah labu Erlenmeyer yang berisi uap cairan volatile unknown didinginkan, uap tersebut mengembun menjadi cair kembali.
6. Labu erlenmeyer yang telah dingin ditimbang dengan neraca analitik.
NB: Tutup aluminium foil beserta karet gelang sebelum ditimbang jangan dilepaskan.
Massa labu Erlenmeyer + aluminium foil + karet gelang + uap cairan volatile unknown yang telah mengembun adalah 70,19 gram dan untuk pengulangan yang ke dua massa adalah 70,17 gram.
Gambar 13. Pemanasan cairan volatile
unknown dalam penangas air
Gambar 14. Pendinginan uap cairan volatile
unknown
Gambar 15. Massa cairan volatile unknown
7. Volume labu erlenmeyer ditentukan dengan jalan mengisi labu erlenmeyer dengan air sampai penuh dan mengukur massa air yang terdapat dalam labu erlenmeyer. Suhu air dalam labu erlenmeyer diukur pula. Jadi volume air dapat diketahui, apabila massa jenis air pada suhu air dalam labu erlenmeyer diketahui dengan rumus:
V m
- Massa labu Erlenmeyer (1) = 68,62 gram
Massa labu Erlenmeyer (2) = 68,57 gram
- Masa labu Erlenmeyer + air (1) = 218,10 gram
Masa labu Erlenmeyer + air (2) = 218,09 gram.
Gambar 16. Massa cairan volatile unknown
yang telah mengembun (2)
Gambar 17. Massa labu Erlenmeyer (1)
Gambar 18. Massa labu Erlenmeyer (2)
- Suhu air dalam labu elenmeyer (1) dan (2) = 28oC
- Massa air labu Erlenmeyer 1 = 218,10 gram - 68,62 gram = 149,48 gram
- Massa air labu Erlenmeyer 1 = 218,09 gram - 68,57 gram = 149,52 gram
8. Tekanan atmosfer diukur dengan menggunakan barometer.
Tekanan atmosfer setelah diukur dengan barometer adalah 763 mmHg.
V. Analisis Data 1. Senyawa CHCl3 Tanpa Faktor Koreksi
Dari hasil percobaan diketahui:
Massa labu Erlenmeyer + aluminium foil + karet gelang = 63,84 gram.
Massa labu Erlenmeyer + aluminium foil + karet gelang + cairan volatil CHCl3= 70,78 gram.
Massa cairan volatil = 70,78 gram – 63,84 gram = 6,94 gram. Suhu air pada penangas air = 95o
C = 368 K.
Massa labu Erlenmeyer + aluminium foil + karet gelang + uap cairan volatil CHCl3 yang telah mengembun = 64,41 gram.
Massa kloroform:
= (Massa labu Erlenmeyer + aluminium foil + karet gelang + uap cairan volatil CHCl3 yang telah mengembun) – (Massa labu Erlenmeyer + aluminium foil + karet gelang) = 64,41 gram – 63,84 gram = 0,57 gram.
Massa labu Erlenmeyer + air = 209,10gram. Massa labu Erlenmeyer = 62,92 gram Suhu air dalam labu elenmeyer adalah 27o
C Massa air = 146,18 gram
Tekanan (P) yang tercatat pada barometer adalah 763 mmHg = 1,0039 atm. Perhitungan:
Vlabu = Vair = Vgas Vair =
Menghitung massa jenis gas
liter V Vlabu air 0,14672 liter gram liter gram V volatil zat massa gas gas 3,88 / 14672 , 0 57 , 0 Berat Molekul CHCl3 mol g atm K x K mol atm L x L g P T R BM 116,71 / 0039 , 1 368 08206 , 0 / 88 , 3 1 1
Berat molekul CHCl3 secara teoritis = [(12 x 1)] + (1) + (35,5 x 3)] = 119,5 g/mol Menghitung Kesalahan Relatif (KR)
% 78 , 2 % 100 5 , 119 5 , 119 71 , 116 % 100 sec sec teoritis ara BM teoritis ara BM percobaan hasil BM KR
Dengan Faktor Koreksi
Berikut merupakan perhitungan berat molekul senyawa CHCl3 dengan menggunakan faktor koreksi :
Diketahui :
BMudara = 28,8 gram/mol Suhu air = 27ºC = 300K
Suhu penangas air = 95ºC = 368 K Maka : t P 4 , 227 03 , 1163 90328 , 6 log C P 27 4 , 227 03 , 1163 90328 , 6 log 544 , 4 4 , 254 03 , 1163 90328 , 6 logP atm x mmHg x P2,85 105 3,75 108
Untuk menentukan BM dengan faktor koreksi dapat dilakukan melalui langkah-langkah berikut :
Penentuan Berat Molekul CHCl3
1. Menentukan massa udara yang tidak dapat masuk
gr X gram x K K mol atm L mol gr atm x T R BM V P m T R BM m V P udara 9 7 1 1 8 10 436 , 6 618 , 24 10 584 , 1 300 . 08206 , 0 / 8 , 28 . L 0,14672 . 10 75 , 3 . . .
Ket : BM udara = BM N2 = 28,8 g/mol T = 27oC = 300 K
2. Menghitung massa jenis gas
L gr gr x gr V m m gas udara zat gas 3,8849 L 0,14672 10 436 , 6 57 , 0 9
3. Menghitung Berat molekul senyawa volatil
mol gr atm K K mol atm L L gr P T R BM 116,86 1,0039 368 . 08206 , 0 . 8849 , 3 . . % 2 , 2 % 100 5 , 119 5 , 119 86 , 116 % 100 5 , 119 5 , 119 : BM Kesalahan Besar 2. Senyawa Unknown Tanpa Faktor Koreksi
Dari hasil percobaan diketahui:
Massa labu Erlenmeyer 1 + aluminium foil + karet gelang = 69,55 gram. Massa labu Erlenmeyer 2 + aluminium foil + karet gelang = 69,53 gram.
Massa labu Erlenmeyer 1 + aluminium foil + karet gelang + cairan unknown = 76,65 gram.
Massa labu Erlenmeyer 2 + aluminium foil + karet gelang + cairan unknown = 76,67 gram.
Massa cairan volatile 1 = 76,65 gram – 69,55 gram = 7,1 gram. Massa cairan volatile 1 = 76,67 gram – 69,53 gram = 7,14 gram. Suhu air pada penangas air 1 = 98o
C = 371 K. Suhu air pada penangas air 2 = 990
C = 372 K.
Massa labu Erlenmeyer 1+ aluminium foil + karet gelang + uap cairan volatile unknown yang telah mengembun = 70,19 gram.
Massa labu Erlenmeyer 1+ aluminium foil + karet gelang + uap cairan volatile unknown yang telah mengembun = 70,17 gram.
Massa zat unknown :
Percobaan 1 = (Massa labu Erlenmeyer 1 + aluminium foil + karet gelang + uap cairan volatil unknown yang telah mengembun) – (Massa labu Erlenmeyer 1 + aluminium foil + karet gelang) = 70,19 gram – 69,55 gram = 0,64 gram. Percobaan 2 = (Massa labu Erlenmeyer 2 + aluminium foil + karet gelang + uap cairan
volatil unknown yang telah mengembun) – (Massa labu Erlenmeyer 2 + aluminium foil + karet gelang) = 70,17 gram – 69,53 gram = 0,64 gram. Massa labu Erlenmeyer 1 + air = 218,10 gram.
Massa labu Erlenmeyer 2 + air = 218,09 gram. Massa labu Erlenmeyer 1 = 68,62 gram
Massa labu Erlenmeyer 1 = 68,57 gram
Suhu air dalam labu elenmeyer 1 dan 2 adalah 28o C Massa air 1 = 218,10 gram – 68,62 gram = 149,48 gram Massa air 2 = 218,09 gram – 68,57 gram = 149,52 gram
Tekanan (P) yang tercatat pada barometer adalah 763 mmHg = 1,0039 atm. Perhitungan:
Volume labu Erlenmeyer adalah segabai berikut: Volume Erlenmeyer 1
Vlabu = Vair = Vgas Vair =
Volume Erlenmeyer 2
Vlabu = Vair = Vgas Vair =
Menghitung massa jenis gas
Massa jenis gas labu Erlenmeyer 1 : liter V Vlabu air 0,15003513 liter gram liter gram V volatil zat massa labu gas 4,265667647 / 03513 150 , 0 64 , 0
Massa jenis gas labu Erlenmeyer 1 : liter V Vlabu air 0,15007528 liter gram liter gram V volatil zat massa gas gas 4,264526443 / 07528 150 , 0 64 , 0
Berat Molekul Zat Unknown Berat Molekul Labu Erlenmeyer 1
mol g atm K x K mol atm L x L g P T R BM 129,36 / 0039 , 1 371 08206 , 0 / 265667647 , 4 1 1
Berat Molekul Labu Erlenmeyer 2
mol g atm K x K mol atm L x L g P T R BM 129,67 / 0039 , 1 372 08206 , 0 / 264526443 , 4 1 1
Dengan Faktor Koreksi
Berikut merupakan perhitungan berat molekul senyawa Unknown dengan menggunakan faktor koreksi :
Diketahui :
BMudara = 28,8 gram/mol
Suhu air labu Erlenmeyer 1 dan 2 = 28ºC = 301K Suhu penangas air Labu Erlenmeyer 1 = 98ºC = 371 K Suhu penangas air Labu Erlenmeyer 2 = 99ºC = 372 K Maka :
Labu Erlenmeyer 1 dan 2 :
t P 4 , 227 03 , 1163 90328 , 6 log C P 28 4 , 227 03 , 1163 90328 , 6 log 5267 , 4 4 , 255 03 , 1163 90328 , 6 logP
atm x
mmHg x
P2,9735 105 3,9125 108
Untuk menentukan BM dengan faktor koreksi dapat dilakukan melalui langkah-langkah berikut :
Penentuan Berat Molekul Zat Unknown
4. Menentukan massa udara yang tidak dapat masuk Labu Erlenmeyer 1 gram x K K mol atm L mol gr atm x T R BM V P m T R BM m V P udara 9 1 1 8 10 844540914 , 6 301 . 08206 , 0 / 8 , 28 . L 0,15003513 . 10 9125 , 3 . . . Labu Erlenmeyer 2 x gram K K mol atm L mol gr atm x T R BM V P m T R BM m V P udara 9 1 1 8 10 84637254 , 6 301 . 08206 , 0 / 8 , 28 . L 0,15007528 . 10 9125 , 3 . . .
Ket : BM udara = BM N2 = 28,8 g/mol T = 28oC = 301 K
5. Menghitung massa jenis gas Labu Erlenmeyer 1 L gr gr x gr V m m gas udara zat gas 4,265667693 L 0,15003513 10 844540914 , 6 64 , 0 9 Labu Erlenmeyer 2 L gr gr x gr V m m gas udara zat gas 4,264526489 L 0,15007528 10 84637254 , 6 64 , 0 9
6. Menghitung Berat molekul senyawa volatile Labu Erlenmeyer 1
mol gr atm K K mol atm L L gr P T R BM 129,36 1,0039 371 . 08206 , 0 . 265667693 , 4 . . Labu erlenmeyer mol gr atm K K mol atm L L gr P T R BM 129.67 1,0039 372 . 08206 , 0 . 264526489 , 4 . . VI. Pembahasan
Pada praktikum ini dilakukan penentuan berat molekul senyawa volatile, yaitu kloroform (CHCl3) dan senyawa unknown. Pengukuran berat molekul senyawa volatile ini didasarkan atas pengukuran massa jenis gas dari cairan volatile yang diidentifikasi. Kloroform merupakan salah satu senyawa volatile yang memiliki titik didih di bawah 100oC, yaitu 61,2oC. Kloroform dan senyawa unknown yang bersifat volatile dengan titik didih lebih kecil dari 100oC ditempatkan dalam labu Erlenmeyer tertutup yang mempunyai lubang kecil pada bagian tutupnya dan kemudian labu tersebut dipanaskan sampai suhu 100oC, maka kloroform dan senyawa unknown tersebut akan menguap dan uap tersebut akan mendorong udara yang terdapat dalam labu keluar melalui lubang kecil. Setelah semua udara yang ada dalam labu Erlenmeyer keluar, maka uap cairan tersebut akan ikut keluar sampai pada akhirnya uap berhenti keluar bila keadaan kesetimbangan tercapai. Pada keadaan kesetimbangan ini tekanan uap cairan dalam labu Erlenmeyer sama dengan tekanan udara luar. Dalam labu Erlenmeyer hanya berisi uap cairan yang memiliki tekanan sama dengan tekanan atmosfir, volume sama dengan volume labu Erlenmeyer, dan suhu sama dengan suhu penangas air. Labu Erlenmeyer yang telah terisi oleh uap dari kloroform dan senyawa unknown tersebut selanjutnya diangkat dari penangas air dan didinginkan. Pendinginan ini bertujuan agar udara luar akan masuk kembali ke dalam labu Erlenmeyer sehingga uap kloroform dan senyawa unknown akan mengembun. Setelah cairan volatile mengembun selanjutnya dilakukan penimbangan.
Berdasarkan analisis data di atas, berat molekul kloroform yang dihitung dengan menggunakan persamaan gas ideal tanpa faktor koreksi adalah 116,71g /mol. Secara teoritis kloroform mempunyai berat molekul 119,5 gram/mol, dari hasil perhitungan berat molekul kloroform yang didapatkan pada praktikum ini mendekati teoritis. Walaupun mendekati teoritis masih terdapat kesalahan, karena ketika labu erlenmeyer kosong ditimbang, labu ini penuh dengan udara tetapi setelah pemanasan dan pendinginan dalam desikator, tidak semua uap
cairan kembali kebentuk cairannya, sehingga akan mengurangi jumlah udara yang masuk kembali ke dalam labu erlenmeyer. Jadi massa labu erlenmeyer dalam keadaan ini lebih kecil dari pada massa labu erlenmeyer dalam keadaan semua uap cairan kembali kebentuk cairannya. Oleh karena itu massa cairan kloroform sebenarnya harus ditambahkan dengan massa udara yang tidak dapat masuk kembali ke dalam labu erlenmeyer karena adanya uap cairan yang tidak mengembun. Massa udara tersebut dapat dihitung dengan menganggap bahwa tekanan parsial udara yang tidak dapat masuk sama dengan tekanan uap cairan pada suhu kamar. Berdasarkan hasil perhitungan dengan menggunakan faktor koreksi
didapatkan berat molekul kloroform adalah
mol gr
86 ,
116 . Berat molekul yang didapat
berdasarkan perhitungan dengan faktor koreksi mendekati teoritis. Hal ini menunjukkan bahwa pada proses pendinginan hampir semua uap cairan kloroform kembali ke bentuk cairnya.
Sedangkan untuk senyawa unknown berat molekul yang dihitung dengan menggunakan persamaan gas ideal tanpa faktor koreksi 129,36 g / mol untuk labu Erlenmeyer 1, sedangkan 129,67 g / mol untuk labu Erlenmeyer 2 dan berat molekul menggunakan faktor koreksi untuk labu Erlenmeyer 1 sebesar 129,36 g / mol dan labu Erlenmeyer 2 sebesar 129,67 g / mol . Berdasarkan hal tersebut, baik menggunakan perhitungan persamaan gas ideal tanpa faktor koreksi maupun dengan faktor koreksi berat molekul senyawa unknown yang didapatkan sama.
Dari analisis literature senyawa volatile yang memiliki berat molekul mendekati 129,36 g / mol dan 129,67 g / mol adalah Karbon Tetra Klorida (CCl4) yang memiliki berat molekul 153,84 g/mol dengan titik didih 76,80C. Kecilnya berat molekul yang didapatkan berdasarkan perhitungan praktikum disebabkan karena penggunaan persamaan gas ideal dalam perhitungan yang pada kenyataannya, gas cairan volatil yang terbentuk bukan merupakan gas ideal. Selain itu dapat juga disebabkan karena belum semua uap cairan yang ada di dalam labu Erlenmeyer yang ditaruh di dalam desikator mengembun. Sehingga besar kesalahan relatif dapat dihitung sebagai berikut :
% 91 , 15 % 100 84 , 153 84 , 153 36 , 129 % 100 84 , 153 84 , 153 : 1 BM eyer LabuErlenm Kesalahan Besar
% 71 , 15 % 100 84 , 153 84 , 153 67 , 129 % 100 84 , 153 84 , 153 : 2 BM eyer LabuErlenm Kesalahan Besar VII. Kesimpulan
Dari hasil percobaan dapat disimpulkan bahwa berat molekul suatu zat cair volatil yang memiliki titik didih di bawah 1000C dapat ditentukan dengan pengukuran massa jenisnya.
Senyawa CHCl3
- Berat Molekul yang dihitung tanpa faktor koreksi adalah 116,71 g/mol - Berar Molekul yang dihitung dengan faktor koreksi adalah 116,86 g/mol - Kesalahan relatif Berat Molekul yang dihitung tanpa faktor koreksi adalah
2,78%
- Kesalahan relatif Berat Molekul yang dihitung dengan faktor koreksi adalah 2,2%
Dengan perhitungan menggunakan faktor koreksi didapatkan Berat Molekul kloroform lebih besar dibandingkan perhitungan tanpa faktor koreksi. Sedangkan kesalahan relatif dari perhitungan menggunakan faktor koreksi lebih kecil dari perhitingan tanpa menggunakan faktor koreksi Senyawa Unknown
- Berat Molekul labu erlenmeyer 1 yang dihitung tanpa faktor koreksi adalah 129,36 g/mol
- Berat Molekul labu erlenmeyer 2 yang dihitung tanpa faktor koreksi adalah 129,67 g/mol
Dilihat dari berat molekul yang diperoleh dapat disimpulkan senyawa volatil yang memiliki Berat Molekul mendekati 129,36 g/mol dan 129,67 g/mol adalah CCl4 dengan berat molekul 153,84 g/mol dan titik didih sebesar 76,80C
- Kesalahan relatif dari berat molekul CCl4 adalah 15,91% untuk Labu Erlenmeyer 1 dan 15,71% untuk Labu Erlenmeyer 2
VIII. Daftar Pustaka
Basuki, A.S. dan Setijo Bismo, 2003, Buku Petunjuk Laboratorium Kimia Fisika, Depok: Laboratorium Dasar Proses Kimia, TGP FTUI.
http://staff.ui.ac.id/system/files/users/setijo.bismo/material/panduankimiaf isika.pdf
Isana, S.Y.L., P. Yatiman dan Suharto, 2003, Petunjuk Praktikum Kimia Fisika I, Yogyakarta: Laboratorium Kimia Fisika, FMIPA UNY.
Suardana, I. N., I.M. Kirna, I.N. Retug, 2001, Buku Ajar Kimia Fisika I, Singaraja: Jurusan Pendidikan Kimia, FPMIPA, IKIPN Singaraja.
Retug, Nyoman dan Dewa Sastrawidana. 2004. Penuntun Praktikum Kimia