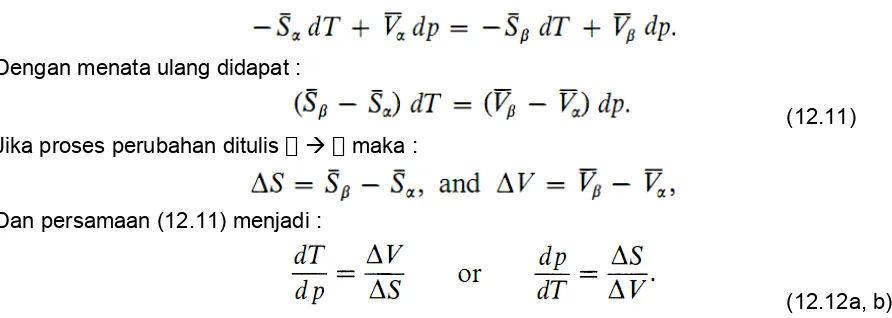BAB 12
KESETIMBANGAN FASA DAN SISTEM SEDERHANA ; ATURAN FASA
12.1. Kondisi Kesetimbangan
Untuk sistem yang berada dalam kesetimbangan, potensial kimia dari tiap – tiap penyusun haruslah memiliki nilai yang sama dimanapun dalam sistem. Jika ada beberapa jenis fasa didalam sistem, maka potensial kimia masing – masing senyawa harus memiliki nilai sama pada setiap fasa dimana senyawa itu nampak.
Untuk sistem satu komponen, = G/n. jika persamaan fundamental dibagi dengan n maka
diperoleh :
(12.1) Dimana Ŝ dan Ṽ adalah entropi molar dan volume molar, sehingga :
(12.2a, b) Turunan persamaan (12.2a, b) adalah slope dari masing – masing kurva versus T dan kurva versus p.
12.2. Stabilitas Fasa Senyawa Murni
Berdasarkan hukum ketiga Termodinamika, entropi suatu senyawa selalu positif. Fakta ini dikombinasikan dengan persamaan (12.2a) menunjukkan (/T)p selalu negatif. Sehingga plot versus T pada tekanan konstan adalah kurva dengan slope negatif.
Untuk tiga fasa dari satu senyawa tunggal :
(12.3)
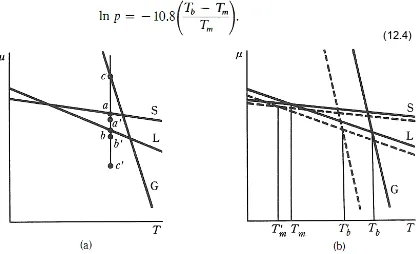
Pada sembarang temperature Ŝgas » Ŝliq > Ŝsolid. Entropi solid memiliki nilai kecil sehingga pada gambar 12.1 kurva versus T untuk solid kurva S memiliki slope yang sedikit negatif. Kurva
versus T untuk liquid memiliki slope yang agak lebih negatif disbanding solid, kurva L.Entropi gas memiliki nilai yang jauh lebih besar disbanding liquid sehingga slope dari kurva G memiliki nilai yang negatif besar. Kurva – kurva digambar sebagai garis lurus walaupun seharusnya agak sedikit cekung ke bawah. Namun demikian argument yang dikemukakan tetap berlaku. Kondisi termodinamika untuk kesetimbangan antar fasa – fasa pada tekanan konstan terlihat pada gambar 12.1. Solid dan liquid dapat dijumpai dalam kesetimbangan saat solid = liquid.
Sumbu termperatur dibagi 3 interval, Dibawah Tm solid memiliki potensial kimia terendah, antara Tm dan Tb liquid memiliki potensial terendah, diatas Tb gas yang memiliki potensial kimia terendah. Fasa dengan nilai potensial kimia terendah adalah fasa stabil. Jika sistem ada pada sistem dibawah temperature Tm gambar 12.2 maka potensial kimia liquid akan memiliki nilai a sementara solid memiliki nilai b. Dan liquid dapat membeku secara spontan pada temperatur
ini, karena membeku akan menurunkan energi Gibbs. Pada temperatur diatas Tm, situasinya terbalik solid lebih besar dibanding liquid sehingga solid akan meleleh secara spontan untuk
menurunkan energi Gibbs sistem. Pada Tm potensial kimia solid dan liquid sama, sehingga tidak ada diantara kedua fasa tersebut yang lebih dominan, keduanya ada dalam kesetimbangan. Situasai serupa juga terjadi didekat Tb. Persis dibawah Tb liquid stabil, sedangkan persis diatas Tb gas merupakan fasa stabil.
Diagram tersebut memperlihatkan urutan yang cukup familiar fasa yang teramati saat solid dipanaskan pada tekanan konstan. Pada temperature rendah sistem sepenuhnya berupa solid, pada temperatur tertentu Tm liquid mulai terbentuk, dan liquid menjadi stabil hingga ia menguap pada temperatur Tb. Urutan fasa ini adalah konsekuensi dari urutan nilai entropi yang juga berarti konsekuensi dari fakta bahwa kalor diserap dalam perubahan dari solid ke liquid dan dari liquid ke gas.
12.3. Ketergantungan Kurva versus T terhadap Tekanan
Pada titik ini hal yang biasa jika kita bertanya apa yang terjadi pada kurva jika tekanan diubah. Pertanyaan ini dijawab dengan menggunakan persamaan (12.2b) dalam bentuk d = Ṽ dp. Jika
tekanan turun, dp akan negatif, Ṽ positif maka d negatif dan potensial kimia akan turun
sehingga nilai d hanya turun sedikit saja. Untuk solid dari a ke a untuk liquid dari b ke b
(Gambar 12.3a) Volume gas secara kasar memiliki nilai 1000 kali solid atau liquid, sehingga
gas akan sangat turun dari c ke c. Kurva pada tekanan terendah terlihat sebagai garis putus –
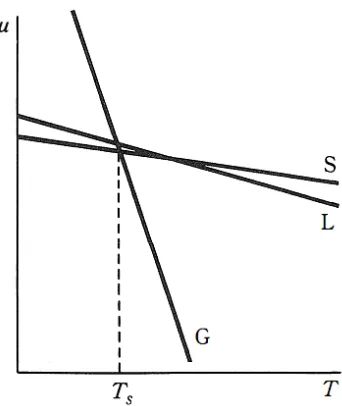
putus parallel terhadap garis awal pada gambar (12.3b). (Gambar ini diasumsikan Ṽliq > Ṽsolid. Gambar (12.3) menunjukkan bahwa kedua temperature kesetimbangan (kedua titik potong) telah bergeser. Pergeseran pada titik leleh kecil sementara pergeseran pada titik didih relative besar. Pergeseran titik leleh kurvanya diperbesar agar dapat jelas walaupun sebetulnya sangat kecil. Pada tekanan rendah range stabilitas liquid turun cukup signifikan. Jika tekanan direduksi pada nilai yang cukup rendah. Titik didih liquid bisa saja berada dibawah titik leleh solid (gambar 12.4) sehingga tidak ada temperature dimana liquid bersifat stabil, solid akan menyublimasi. Pada temperature Ts solid dan vapor dijumpai dalam kesetimbangan, temperatur Ts adalah tenperatur sublimasi padatan dan sangat tergantung pada tekanan.
Jelas bahwa ada beberapa tekanan dimana tiga kurva saling berpotongan pada temperatur yang sama. Temperatur dan tekanan ini mendefinisikan titik triple (triple point), dimana semua fasa dapat dijumpai pada kesetimbangan di triple point.
Apakah material tertentu akan tersublimasi pada tekanan tereduksi atau meleleh sangat tergantung sepenuhnya pada sifat individu senyawa tersebut. Misalnya air akan tersublimasi dibawah 611 pa. Semakin tinggi titik leleh maka semakin kecil perbedaan titik leleh dan titik didih pada 1 atm maka semakin tinggi tekanan dimana sublimasi dapat teramati. Tekanan dibawah dimana sublimasi teramati dapat diperkirakan untuk senyawa yang mematuhi aturan Trouton dengan rumus :
Gambar 12.4 versus T untuk senyawa yang menyublimasi
12.4. Persamaan Clapeyron
Kondisi untuk kesetimbangan antara dua fasa dan senyawa murni adalah :
(12.5)
Jika bentuk analitik dari fungsi dan diketahui maka dimungkinkan untuk menyelesaikan
persamaan (12.5) dimana :
(12.6a, b) Persamaan (12.6a) mengekspresikan fakta yang diilustrasikan oleh gambar (12.3b) bahwa temperature kesetimbangan tergantung pada tekanan.
Tanpa adanya pengetahuan rinci dari fungsi dan maka masih dimungkinkan untuk
memperoleh nilai turunan temperature terhadap tekanan. Misalkan kesetimbangan antara 2 fasa dan pada tekanan p, temperature kesetimbangan T, maka pada T dan p kita peroleh :
(12.7)
Jika tekanan berubah ke nilai p + dp, temperature kesetimbangan akan berubah ke T + dT dan nilai dari masing – masing akan berubah menjadi + d. sehingga pada T + dT dan p + dp
kondisi kesetimbangan adalah :
(12.8) Dengan mengurangkan persamaan (12.8) dengan (12.7) didapat :
(12.9)
Kita tulis d secara eksplisit dalam term dp dan dT dengan menggunakan persamaan
fundamental (12.1) :
Dengan menata ulang didapat :
(12.11) Jika proses perubahan ditulis maka :
Dan persamaan (12.11) menjadi :
(12.12a, b) Kedua persamaan (12.12) disebut persamaan Clapeyron.
Persamaan Clapeyron adalah persamaan fundamental untuk pembahasan kesetimbangan antara dua fasa senyawa murni. Sebagai catatan sisi kiri kedua persamaan adalah turunan biasa bukan turunan parsial.
Gambar (12.3b) menunjukkan temperature kesetimbangan tergantung pada tekanan karena titik potong tergantung pada tekanan. Persamaan Clapeyron mengekspresikan ketergantungan secara kuantitatif temperature kesetimbangan pada tekanan (12.12a) atau variasi pada tekanan kesetimbangan terhadap temperature (12.12b). Dengan menggunakan persamaan ini kita bisa membuat plot tekanan kesetimbangan versus temperature untuk sembarang perubahan fasa. 12.4.1. Kesetimbangan Solid – Liquid
Dengan menerapkan persamaan Clapeyron pada perubahan solid liquid
Pada temperature kesetimbangan perubahan bersifat reversible sehingga Sfus = Hfus/T.
Perubahan dari solid ke liquid selalu disertai penyerapan/absorpsi panas (Hfus = +) sehingga Sfus bernilai positif untuk semua senyawa
Kuantitas Vfus bisa positif atau negatif tergantung pada apakah densitas solid lebih besar atau
lebih kecil dibanding liquid sehingga
Besaran umum untuk kuantitas diatas adalah :
Sfus = 8 hingga 25 J/(K mol) Vfus = (1 hingga 10) cm3/mol
Jika sebagai ilustrasi kita memilih Sfus = 16 j/K moldan Vfus 4 cm3/mol maka untuk garis
Jika dibalik maka kita mendapatkan dT/dp = 0,02 K/atm. Nilai ini menunjukkan bahwa
perubahan tekanan sebesar 1 atm akan menggeser titik leleh sebesar beberapa ratus Kelvin. Dalam plot tekanan sebagai fungsi dari temperature, slope diberikan oleh persamaan (12.12b) (40 atm/K dalam contoh) slope ini cukup besar dan kurva hampir vertical. Untuk dp/dT + diperlihatkan pada gambar (12.5a); pada range tekanan moderat kurva akan linier.
Garis pada gambar (12.5a) adalah locus dari semua titik (T, p) dimana solid dan liquid bisa dijumpai pada kesetimbangan. Titik – titik yang terletak disebelah kiri garis menunjukkan temperature dibawah titik leleh, titik – titik ini adalah kondisi (T, p) dimana hanya solid yang stabil. Titik – titik disebelah kanan garis menunjukkan temperature diatas titik leleh sehingga titik – titik ini adalah kondisi (T, p) dimana liquid stabil.
12.4.2. Kesetimbangan Liquid – Gas
Aplikasi persamaan Clapeyron untuk perubahan liquid gas menghasilkan :
Konsekuensinya :
Akan tetapi V sangat tergantung pada T dan p karena Ṽgas sangat tergantung pada T dan p.
slope kurva liquid – gas kecil nilainya dibanding kurva solid – liquid.
Gambar (12.5b) memperlihatkan kurva l – g dan juga kurva s – l. Pada gambar (12.5b) kurva l -g adalah locus dari semua titik (T, p) dimana liquid dan -gas dijumpai dalam kesetimban-gan. Titik – titik dikiri kurva l – g ada dibawah titik didih sehingga kondisi disini liquid stabil. Titik – titik dikanan l – g adalah kondisi dimana gas stabil.
Perpotongan kurva s – l dan l – g menunjukkan temperature dan tekanan dimana solid, liquid dan gas dijumpai dalam kesetimbangan. Nilai T dan p pada titik ini ditentukan oleh kondisi :
(12.13)
Persamaan (12.13) secara prinsip dapat diselesaikan untuk memberikan nilai numeric yang definit dari T dan p yaitu :
(12.14)
Dimana Tt dan pt adalah temperature dan tekanan triple point. Hanya ada satu triple point seperti ini dimana specific set dari tiga fasa (solid-liquid-gas) bisa berada dalam kesetimbangan. 12.4.3. Kesetimbangan Solid – Gas
Untuk perubahan solid-gas kita memiliki :
Dan persamaan Clapeyron adalah:
Slope kurva s-g lebih curam pada triple point dibanding slope kurva l-g. Karena Hsub = Hfus + Hvap, maka
V pada kedua persamaan hampir sama nilainya, karena Hsub lebih besar dari Hvap, slope
kurva s-g pada gambar (12.6) lebih curam dibanding kurva l-g.
memotong satu sama lain pada triple point berdasarkan kondisi yang dituliskan pada persamaan (12.13).
12.5. Diagram Fasa
Pembahasan terhadap gambar (12.6) pada tekanan konstan diperlihatkan dengan garis horizontal putus – putus menunjukkan titik leleh dan titik didih senyawa sebagai perpotongan garis horizontal dengan kurva s-l dan l-g, Titik potong ini menunjukkan perpotongan kurva -T
pada gambar 12.1. Pada temperature dibawah Tm solid stabil, titik antara Tm dan Tb liquid stabil dan diatas Tb gas stabil. Ilustrasi seperti ditunjukkan gambar 12.6 menyampaikan informasi lebih banyak dibanding gambar 12.1 dan 12.3b. Gambar 12.6 dinamakan diagram fasa atau diagram kesetimbangan.
Diagram fasa memperlihatkan secara ringkas sifat – sifat senyawa : titik leleh, titik didih, titik transisi, triple point. Tiap – tiap titik pada diagram fasa mewakili keadaan sistem karena titik ini mewakili nilai T dan p tertentu.
Garis – garis pada diagram fasa membagi diagram menjadi 3 daerah yang dilabeli solid, liquid dan gas. Jika titik yang menjelaskan sistem berada pada daerah solid maka senyawa eksis sebagai solid. Jika berada pada daerah liquid maka senyawa eksis sebagai liquid dan jika titik berada pada garis seperti l-g maka senyawa eksis sebagai liquid dan vapor dalam kesetimbangan.
Kurva l-g memiliki batas atas yang definit pada temperature dan tekanan kritis, karena tidak mungkin membedakan antara liquid dan gas diatas temperature dan tekanan ini.
12.6. Integrasi Persamaan Clapeyron 12.6.1. Kesetimbangan Solid – Liquid Persamaan Clapeyron :
Maka
Jika Hfus dan Vfus hampir – hampir tidak tergantung pada p dan T persamaan diatas
diintegralkan menjadi :
(12.15)
Dimana Tm adalah titik leleh pada p2, Tm adalah titik leleh pada p1, karena Tm – Tm biasanya
cukup kecil, logaritma dapat diekspansi menjadi :
(12.16) Dimana T adalah kenaikan titik leleh sehubungan dengan kenaikan tekanan p.
12.6.2. Kesetimbangan Fasa Terkondensasi – Gas
Untuk kesetimbangan fasa terkondensasi baik solid maupun liquid dengan fasa uap, berlaku
Dimana H adalah kalor penguapan molar liquid atau kalor sublimasi molar solid dan Ṽc volume
molar solid atau liquid. Dalam sebagian besar kondisi; Ṽg - Ṽc Ṽg dan hal ini dengan
mengasumsikan gas ideal akan sama dengan RT/p, sehingga persamaan menjadi :
(12.17)
Adalah persamaan Clausius – Clapeyron menghubungkan tekanan uap liquid (solid) terhadap kalor penguapan (sublimasi) dan temperature. Dengan mengintegralkan diantara batas – batas, pada kondisi asumsi H tidak tergantung pada temperature akan menghasilkan :
(12.18)
Dimana p0 adalah tekanan uap pada T0 dan p adalah tekanan uap pada T. jika p0 = 1 atm maka T0 adalah titik didih normal dari liquid (atau titik sublimasi normal solid) sehingga :
(12.19)
Berdasarkan persamaan (12.19) jika ln p atau log10 p diplot versus 1/T akan dihasilkan kurva linier dengan slope -H/R atau -H/2,303R. Intersep pada 1/T = 0 menghasilkan nilai H/RT0,
sehingga dari slope dan intersep H dan T0 keduanya dapat dihitung. Kalor penguapan dan
sublimasi seringkali ditentukan melalui pengukuran tekanan uap zat sebagai fungsi dari temperature. Gambar 12.11 menunjukkan plot log10 p versus 1/T untuk air. Gambar 12.12 menunjukkan plot yang sama untuk CO2 padat (es kering).
Untuk senyawa yang mengikuti aturan Trouton, persamaan (12.19) biasanya mengambil bentuk sederhana yang amat berguna dalam mengestimasi tekanan uap senyawa pada sembarang temperature T berdasarkan data titik didih semata.
12.7. Pengaruh Tekanan Terhadap Tekanan Uap
Dalam pembahasan kedepan tentang kesetimbangan liquid-uap, akan diasumsikan secara implicit bahwa kedua fasa berada dalam tekanan yang sama p. Jika dengan cara – cara tertentu dimungkinkan menahan liquid pada tekanan P dan uap pada tekanan p, maka tekanan uap akan tergantung pada P. Jika dimisalkan liquid dimasukkan pada wadah seperti ditunjukkan pada gambar 12.13. Pada ruang diatas liquid, uap akan memenuhi bersama-sama dengan gas lainnya yang tidak larut dalam liquid. Tekanan uap p ditambah tekanan gas lainnya adalah P, tekanan total yang memberikan gaya dorong pada liquid. Kondisi kesetimbangan adalah :
(12.20)
Pada temperature konstan persamaan ini mengimplikasikan bahwa p = (P). Untuk
menemukan fungsionalitasnya persamaan (12.20) diturunkan terhadap P pada T konstan
Dengan menggunakan persamaan fundamental (12.2b) akan menjadi
(12.21)
Dimana p adalah tekanan uap pada P, p0 adalah tekanan uap saat liquid dan uap berada pada tekanan yang sama pada p0 tekanan ortobarik. Sehingga :
(12.22)
Kita akan menggunakan persamaan (12.21) dan (12.22) dalam mendiskusikan tekanan osmotic larutan.
12.8. Aturan Fasa
Adanya dua fasa dalam kesetimbangan mengimplikasikan kondisi :
(12.23)
Yang berarti bahwa dua variable intensif yang diperlukan untuk menguraikan keadaan sistem tidak lagi bersifat independen tetapi saling berhubungan. Karena adanya hubungan ini, hanya satu variable intensif baik tekanan atau temperature diperlukan untuk menguraikan keadaan sistem. Sistem memiliki satu derajat kebebasan atau bersifat univarian sementara jika hanya satu fasa yang ada, diperlukan 2 variabel untuk mendeskripsikan sistem dan sistem memiliki dua derajat kebebasan atau bivarian. Jika ada tiga fasa, maka ada dua hubungan antara T dan p
(12.24)
Dua hubungan ini akan menentukan T dan p secara komplit. Tidak ada lagi informasi yang diperlukan untuk mendeskripsikan keadaan sistem. Sistem seperti itu dinamakan invariant dan tidak memiliki derajat kebebasan. Tabel 12.1 memperlihatkan hubungan antara jumlah derajat kebebasan dan jumlah fasa yang ada pada sistem satu komponen. Tabel ini menyimpulkan suatu aturan yang menghubungkan derajat kebebasan F terhadap jumlah fasa yang ada P.
F = 3 – P, (12.25)
Yang merupakan aturan fasa untuk sistem satu komponen.
sistem. Biasanya dalam studi tentang sistem dengan banyak komponen dan banyak fasa, penyederhanaan terhadap aturan dapat diperbolehkan.
Kita awali dengan menemukan jumlah total variable intensif (yang dapat dibayangkan) yang diperlukan untuk menguraikan keadaan suatu sistem yang mengandung C komponen -komponen dan P fasa – fasa. Hal ini didaftar pada table 12.2
Tiap – tiap persamaan yang menghubungkan variable – variable ini mengimplikasikan bahwa satu variable bersfiat dependen ketimbang independen, maka kita harus menentukan jumlah total persamaan yang menghubungkan variable – variable ini (table 12.3).
Jumlah variable independen F didapat dengan mengurangkan jumlah total persamaan dari jumlah total variable :
F = PC + 2 – P – C(P – 1),
Persamaan (12.26) adalah aturan fasa J. Willard Gibbs. Cara terbaik untuk menghafal aturan fasa adalah dengan menyadari bahwa kenaikan jumlah komponen akan meningkatkan jumlah variable, sehingga C akan memiliki tanda positif. Kenaikan jumlah fasa meningkatkan jumlah kondisi kesetimbangan dan jumlah persamaan, sehingga mengeliminasi beberapa variable, oleh karenanya P akan bertanda negatif.
Pada sistem satu komponen, C = 1 sehingga F = 3 – P. Hasil ini sama dengan persamaan (12.25) berdasarkan table 12.1. Persamaan (12.25) menunjukkan jumlah terbesar fasa yang bisa ada pada kesetimbangan pada sistem satu komponen adalah 3. Dalam sistem sulfur misalnya tidak dimungkinkan untuk sulfur rhombic, monoclinic, liquid dan gas ada dalam kesetimbangan satu sama lain. Kesetimbangan kuadruple berarti 3 kondisi independen pada dua variable dan tidak dimungkinkan hal ini terjadi.
Untuk sistem dengan satu komponen dimungkinkan untuk menurunkan dengan mudah konsekuensi dari aturan fasa seperti ditunjukkan pada table 12.1. Kesetimbangan diwakili oleh garis dan perpotongannya dalam diagram 2 dimensi seperti yang sudah digunakan dalam bab ini. Namun jika sistem memiliki 2 komponen maka diperlukan tiga variable dan diagram fasa tersusun atas surface dan perpotongannya secara tiga dimensi. Jika ada tiga komponen, diperlukan surface dengan empat dimensi ruang. Visualisasi dari situasi secara menyeluruh akan sulit dalam tiga dimensi dan mustahil untuk empat dimensi atau lebih. Walau demikian, aturan fasa dengan kesederhanaannya mengekspresikan batasan pada titik perpotongan surface ruang multidimensional ini. Atas alasan ini aturan fasa Gibbs diperhitungkan diantara generalisasi utama dalam ilmu Fisika.
12.9. Permasalahan Komponen-komponen
Jumlah komponen dalam sistem didefinisikan sebagai jumlah minimal chemically independent species yang dibutuhkan untuk menjelaskan komposisi tiap-tiap fasa dalam sistem. Sepintas definisi ini terlihat cukup sederhana dan dalam contoh-contoh biasa juga terbilang sederhana. Namun beberapa contoh berikut menunjukkan adanya kerumitan yang terjadi.
Contoh 12.1 Sistem yang terdiri dari PCl5, PCl3, Cl2. Ada 3 spesies namun hanya dua komponen karena adanya kesetimbangan :
PCl5 PCl3 + Cl2
Yang terbentuk dalam sistem, seseorang dapat leluasa mengubah jumlah mol dua diantara spesies ini secara sembarang, namun perubahan ini jumlah mol spesies ketiga sudah ditetapkan berdasarkan kondisi kesetimbangan Kx = x(PCl3) x(Cl2)/x(PCl5), sehingga dua spesies kimia bersifat chemically independent tetapi yang ketiga tidak. Maka hanya ada dua komponen dalam sistem.
Sehingga, jika ada n spesies maka aka nada n – 1 kesetimbangan yang menghubungkan satu sama lain, oleh karenanya hanya ada 1 spesies yang chemically independent dan berarti hanya ada satu komponen dan kita bisa pilih spesies H2O sebagai komponen tsb.
Contoh 12.3 Dalam sistem air – etil alcohol, ada dua spesies. Tidak ada kesetimbangan yang menghubungkan keduanya pada suhu ruang sehingga ada 2 komponen dalam sistem.
Contoh 12.4 Dalam sistem CaCO3-CaO-CO2 ada 3 spesies, juga ada 3 fasa yang berbeda yaitu CaCO3 padat, CaO padat dan CO2 gas. Karena adanya kesetimbangan CaCO2 CaO + CO2
maka hanya ada 2 komponen. Kita pilih yang sederhana yaitu CaO dan CO2, komposisi CaCO3 dapat dijelaskan jika ada satu mol CaO ditambah satu mol CO2. Jika CaCO3 dan CO2 dipilih sebagai komponen maka komposisi CaO ditentukan dari satu mol CaCO3 dikurangi satu mol CO2.
Contoh 12.5 Berapa variable intensive yang dapat ditentukan secara bebas pada titik triple point air?
Berdasarkan aturan fasa Gibbs : F = C – P + 2 Air = 1 komponen
Pada triple point ada 3 fasa Sehingga : F = 1 – 3 + 2 = 0
TIDAK ADA variable intensive yang dapat secara bebas kita tentukan karena triple point air terjadi pada T dan p yang sudah tertentu !
Contoh 12.6 Pada suhu 5oC dan 1 atm, berapa variable intensive heptan dapat kita tentukan secara bebas ?
Aturan fasa Gibbs : F = C – P + 2 Dimana C = 1 komponen
P = 1 fasa