PENGGUNAAN ANTIGEN EKSKRESI/SEKRESI
Fasciola gigantica
DALAM UJI ELISA UNTUK
DETEKSI
FASCIOLOSIS
PADA SAPI
(The use of
Fasciola gigantica
Excretory/Secretory Antigen on ELISA Test
for Detection of Cattle Fasciolosis)
Made Sriasih1, Andayani GAS2, Zuliadi L3, Depamede SN1
1Laboratorium Mikrobiologi dan Bioteknologi Fakultas Peternakan Universitas Mataram Jl. Majapahit No. 62, Mataram
madesriasih@yahoo.co.nz 2
Laboratorium Imunobiologi Fakultas MIPA Universitas Mataram Jl. Majapahit No. 62, Mataram
3Rumah Potong Hewan Gerung - Lembar, Lombok Barat.
ABSTRACT
Fasciolosis, caused by Fasciola gigantica, on affected animals were generally not showing any spesific clinical symptoms so that the success to diagnose the disease as early as possible, especially on the pre-patent period/acute, is believed to be very helpful in disease control efforts. Early detection can be performed by serological tests such as Enzyme-linked Immunosorbent Assay (ELISA) using antigens isolated from Fasciola worms. Among the sources of protein antigen, excretory/secretory antigen (ES antigen) has the properties that can be recognized by the immune response system thus it was more protective to boost immune response. This study aimed to examine the use of excretory/ secretory of F. gigantica especially for detection of Fasciolosis in cattle using the ELISA method. F. gigantica ES antigens were collected from the cows after slaughter at the abattoir, and then used to coat the microplate ELISA to measure antibody responses of cattle samples (n = 49). The ES antigen-based ELISA results compared to the finding of F. gigantica worms in the post-mortem examination has a sensitivity of 77.8% and a specificity of 41.9%. Results of this study suggested that the use of ES antigen on ELISA test has a quite high of sensitivity, although less specific. Nevertheless, the sensitivity of ELISA value of 77.8% indicated that ES antigen of F. gigantica has the potential to be used for detection of Fasciolosis.
Key Words: F. Gigantica, Fasciolosis, ES Antigen, ELISA, Sensitivity
ABSTRAK
Fasciolosis pada ternak umumnya tidak memperlihatkan gejala klinis yang menciri. Keberhasilan untuk mendiagnosa adanya penyakit ini sedini mungkin terutama pada periode prepaten/akut diyakini akan sangat membantu dalam usaha pengendalian penyakit. Deteksi dini dapat dilakukan dengan uji serologi seperti
Enzyme-linked Immunosorbent Assay (ELISA) menggunakan antigen yang diisolasi dari cacing Fasciola gigantica. Diantara sumber protein antigen, antigen ekskretori/sekretori (antigen ES) mempunyai sifat yang lebih dapat dikenali oleh sistem tanggap kebal sehingga diduga lebih protektif untuk memacu respon tanggap kebal. Penelitian ini bertujuan untuk mengkaji penggunaan cairan ekskresi/sekresi F. gigantica untuk deteksi Fasciolosis terutama pada ternak sapi dengan mempergunakan metoda ELISA. Antigen ES F. gigantica
dikoleksi dari sapi-sapi setelah pemotongan di rumah potong hewan, dan selanjutnya digunakan untuk melapisi ELISA mikroplat untuk mengukur respon antibodi ternak sampel (n = 49). Hasil uji ELISA menggunakan antigen ES setelah dibandingkan dengan pemeriksaan adanya cacing F. gigantica pada pemeriksaan post-mortem memiliki sensitivitas sebesar 77,8% dan spesifisitas sebesar 41,9%. Hasil penelitian ini mengindikasikan bahwa penggunaan antigen ES dalam uji ELISA memiliki kepekaan yang cukup tinggi meskipun kurang spesifik. Sungguhpun demikian, dengan nilai sensitivitas ELISA sebesar 77,8% menunjukkan bahwa antigen ES cacing F. gigantica memiliki potensi untuk dipergunakan dalam deteksi Fasciolosis.
PENDAHULUAN
Penyakit merupakan salah satu faktor yang dapat menghambat peningkatan produktivitas dan populasi ternak dalam rangka menuju pemenuhan kebutuhan pangan asal ternak. Diantara penyakit parasiter yang menyerang ternak, Fasciolosis yang disebabkan oleh dua spesies cacing dari genus Fasciola yaitu F. gigantica atau F. hepatica, merupakan masalah serius dalam bidang peternakan. Di Indonesia, Fasciolosis yang umumnya diakibatkan oleh infeksi cacing F. gigantica mengakibatkan suatu penyakit hepatitis parenkhimatosa akut dan kholangitis kronis yang dapat mengganggu pertumbuhan ternak, menurunkan bobot hidup, anemia dan dapat menyebabkan kematian (Tuasikal dan Suhardono, 2006).
Prevalensi terjadinya Fasciolosis pada ternak ruminansia di Indonesia masih sangat tinggi dengan tingkat kerugian mencapai lebih dari US $3.2 milyar per tahun (Spithill et al. 1999; Raadsma et al. 2007). Di provinsi Nusa Tenggara Barat, berdasarkan hasil penelitian yang dilakukan oleh Purwanti(2011) di enam kecamatan di Kabupaten Lombok Barat dengan jumlah sampel 108 ekor sapi Bali, tingkat kejadian Fasciolosis mencapai 58,3%. Kasus Fasciolosis mencapai 90% di Jawa Barat dan 40-90% di daerah Istimewa Yogyakarta (Estuningsih et al. 2004).
Permasalahan utama dalam pengendalian dan pencegahan Fasciolosis pada ternak ruminansia adalah sulitnya melakukan deteksi penyakit sedini mungkin sehingga peluang distribusi penyakit ke ternak/hewan lain semakin tinggi. Metoda penghitungan jumlah telur cacing dalam tinja (eggs fecal count) merupakan metoda gold standar untuk deteksi Fasciolosis (Boray, 1985). Metoda ini mempunyai kelebihan, namun deteksi dini tidak dimungkinkan karena telur cacing Fasciola tidak dapat ditemukan di dalam tinja sampai cacing mencapai dewasa kelamin yang biasanya 10-14 minggu setelah infeksi dimana kerusakan jaringan telah terjadi (Velusamy et al. 2006).
Hasil studi yang dilakukan oleh beberapa peneliti menunjukkan bahwa deteksi dini dapat dilakukan dengan uji serologi, yaitu dengan mengukur banyaknya antigen atau antibodi yang bersirkulasi dalam serum ataupun feses ternak penderita. Uji serologi untuk deteksi antigen atau antibodi terhadap Fasciola umumnya dapat dilakukan dengan beberapa
cara seperti Immunofluoresen, Immunoblotting, Enzyme immuno assay (EIA) maupun Enzyme-linked immunosorbent assay (ELISA), namun ELISA merupakan teknik yang paling digemari dan berkembang saat ini. Deteksi antibodi dengan uji ELISA dilaporkan telah berhasil mendeteksi adanya infeksi awal cacing Fasciola pada ternak ruminansia pada minggu ke- 2-4 setelah infeksi (Reichel, 2002; Salimi-Bejestani et al. 2005; Kooshan et al. 2010) menggunakan antigen yang diisolasi dari cacing Fasciola.
Penelitian terhadap sumber protein antigen F. gigantica dapat dilakukan pada larva (antigen metasercaria), ekstrak cacing muda atau dewasa (antigen somatik), antigen permukaan dan antigen ekskretori/sekretori (antigen ES). Diantara sumber-sumber protein antigen, antigen ES mempunyai sifat yang lebih dapat dikenali oleh sistem tanggap kebal sehingga diduga lebih protektif untuk memacu respon tanggap kebal (Morphew et al. 2007).
Saat ini studi penggunaan antigen ES dalam uji serologi untuk deteksi Fasciolosis lebih didasarkan pada hasil-hasil penelitian menggunakan antigen ES cacing F. hepatica. Piedrafita et al. (2004) menyatakan bahwa F. hepatica dan F. gigantica secara biologis tidak sama meskipun keduanya termasuk dalam genus yang sama. Variasi geografis dan perbedaan spesies cacing dari spesies inang yang berbeda juga dilaporkan mempengaruhi komponen-komponen penyusun antigen ES (Sobhon et al. 1996; Meshgi et al. 2008). Mengingat bahwa penyebab tingginya kejadian Fasciolosis khususnya pada sapi di Indonesia adalah cacing F. gigantica, maka perlu adanya studi imunologik yang memadai dengan menggunakan F. gigantica sebagai obyek penelitian dalam rangka pengendalian dan pencegahan Fasciolosis. Studi ini bertujuan untuk mengkaji penggunaan hasil ekskresi/sekresi F. gigantica untuk deteksi Fasciolosis terutama pada ternak sapi dengan mempergunakan metoda ELISA.
MATERI DAN METODE
Penelitian yang dilakukan adalah penelitian eksperimental yaitu penelitian yang dilakukan dengan mengambil data di lapangan dan selanjutnya dilakukan pemeriksaan di laboratorium. Data (sampel darah) dikoleksi
dari rumah potong hewan (RPH) Gerung, Lembar, sedangkan pemeriksaan laboratorium dilaksanakan di Lab. Mikrobiologi dan Bioteknologi Fakultas Peternakan, dan Lab. Imunobiologi Fakultas MIPA Universitas Mataram.
Penyiapan sampel serum
Serum sampel dikoleksi dari 45 ekor sapi yang diduga positif berdasarkan pemeriksaan ante-mortem (pemeriksaan fisik ternak sebelum dipotong) dan keadaan organ dalam terutama hepar setelah pemotongan (post -mortem). Ternak kontrol (sampel sera negatif) dikoleksi dari 4 ekor sapi yang masih muda (0,5 bulan) dengan asumsi bahwa ternak belum digembalakan secara ekstensif sehingga kecil kemungkinan ternak terinfeksi cacing. Hal ini didukung pula dengan hasil pemeriksaan telur cacing dalam tinja yang menunjukkan bahwa tidak terdapat telur cacing dalam feses ternak tersebut.
Sampel darah (whole blood) diambil dari vena jugularis. Darah ditampung dalam tabung gelas steril kemudian dibiarkan selama 3 jam pada suhu ruang. Darah kemudian diputar dengan kecepatan 1500 rpm selama 20 menit untuk memisahkan serum dan sel-sel darah. Serum kemudian disimpan pada suhu -20°C sampai saatnya dipergunakan.
Penyiapan antigen ekskresi/sekresi (ES) cacing F. gigantica
Metoda yang digunakan untuk
mempersiapkan antigen dari hasil ekskresi/sekresi cacing F. gigantica sesuai dengan metoda dari Wijffels et al. (1994). Cacing dewasa dikoleksi dari hati hewan terinfeksi dalam waktu 1 jam setelah pemotongan. Dua puluh ekor cacing dewasa kemudian dimasukkan ke dalam gelas piala yang sudah terisi 10 ml PBS (phosphate buffer saline) dan didiamkan selama 20 menit. Regurgitan pertama yang umumnya mengandung darah, empedu dan kotoran dibuang kemudian ditambahkan PBS baru. Proses ini diulangi tiga kali, kemudian cacing dewasa diinkubasikan dalam PBS selama 6 jam pada suhu ruang. Setelah inkubasi, cairan yang mengandung antigen ES diputar dengan kecepatan 2500 rpm pada suhu 4°C selama 20
menit. Supernatan disaring dengan filter Millipore 0,22 m, dikonsentrasikan dengan menggunakan konsentrator, kemudian disimpan pada suhu -20°C sebelum digunakan. Konsentrasi protein yang terdapat dalam cairan
ES diukur dengan menggunakan
spektrofotometer pada panjang gelombang 280 nm.
Uji ELISA (Enzyme-linked Immunosorbent
assay)
Teknik ELISA yang dipergunakan sesuai dengan metoda Wijffels et al. (1994). Konsetrasi antigen dan reagensia lainnya distandarisasi terlebih dahulu dengan cara checkerboard titrations untuk menentukan nilai optimal untuk deteksi antibodi dalam sampel serum. Pengujian sampel serum dilakukan duplo (duplicate).
Plate ELISA (96 sumuran) dilapisi dengan 50l (10 g/ml) antigen ES dan diinkubasikan selama 1 jam pada suhu 37oC (inkubator). Setelah inkubasi, antigen ES dibuang dan lubang-lubang sumuran dicuci 5 kali menggunakan PBS yang mengandung 0,05 Tween 20 (PBS-T). Pada tiap-tiap lubang kemudian ditambahkan 100 l PBS yang mengandung 5% susu skim dan diinkubasikan selama 1 jam. Setelah proses pencucian, 50 l serum (pengenceran 1 : 100) ditambahkan ke dalam tiap lubang sumuran dan diinkubasikan selama 1 jam. Proses pencucian diulangi kembali kemudian 50l sheep anti bovine IgG horse-radish peroxidase conjugate (1 : 5000) ditambahkan ke dalam lubang sumuran. Setelah inkubasi selama 1 jam, buang cairan dalam sumuran, kemudian tambahkan 100l substrat (ABTS dalam 100ml buffer sitrat) dan inkubasikan selama 15 menit pada suhu kamar. Optical density (OD) kemudian diukur pada gelombang 405nm dengan mempergunakan ELISA reader. Cut-off point OD ditentukan berdasarkan nilai rata-rata titer antibodi kontrol (sampel negatif) + 3SD (Spencer, 1993). Sampel dikatakan positif apabila titer antibodinya di atas nilai cut-off point dan negatif apabila titer antibodinya dibawah nilai cut-off point.
Analisis data
Data respon antibodi spesifik terhadap antigen dari hasil ekskresi/sekresi F. gigantica
diolah dan dianalis menggunakan perhitungan statistik sederhana (Mean SD) (Spencer, 1993). Nilai Kappa (K) untuk menilai reliabilitas tes uji ditentukan berdasarkan metoda Murti (2011).
HASIL DAN PEMBAHASAN
Fasciolosis pada ternak umumnya tidak mempelihatkan gejala parasitisma yang menonjol. Gejala yang mungkin terlihat berupa kekurusan, kurang nafsu makan, pucat, lemah, odema di sekitar rahang bawah yang menyebar ke bagian bawah leher dan dada (bottle jaw), diare dan bulu kusam (Martindahet al. 2005).
Pengamatan terhadap 45 ekor sapi yang diduga positif berdasarkan pemeriksaan ante-mortem dalam penelitian ini menunjukkan bahwa ternak dalam kondisi kurus, bulu berdiri, selaput lendir mata pucat, feses cair dan 16 dari 45 ternak sampel menunjukkan gejala ‘bottle jaw’. Dari hasil pengamatan post-mortem ditemukan bahwa tidak pada semua ternak yang menunjukkan gejala terinfeksi cacing pada pemeriksaan ante-mortem akan ditemukan cacing pada pemeriksaan pasca mati. Dari total 45 ternak yang menunjukkan gejala terinfeksi, cacing F. gigantica hanya ditemukan pada 18 ternak sampel (36,73%).
Pada sapi sampel lainnya (63,27%) hanya nampak adanya gejala pengapuran dan pengerasan pada saluran empedu maupun hati. Sapi kontrol (n = 4) dalam kondisi sehat dan menunjukkan hasil pemeriksaan negatif adanya telur cacing dalam tinja.
Bahan-bahan antigenik, yang pada umumnya berupa protein, yang dipergunakan dalam pemeriksaan serologis untuk mengetahui respon antibodi pada ternak yang menderita Fasciolosis sebagian besar diisolasi dari hasil ekskresi/sekresi maupun ekstrak F. hepatica. Cairan ekskresi/sekresi F. gigantica juga mengandung sejumlah besar protein maupun enzim yang mungkin memiliki potensi untuk dipergunakan dalam pemeriksaan serologis, namun tidak ditunjang oleh adanya studi imunologik yang memadai (Allam et al. 2002; Gupta et al. 2003; Raadsma et al. 2007; Meshgi et al. 2008). Cairan ES yang dikoleksi dari cacing F. gigantica dewasa pada penelitian ini mempunyai total kandungan protein 2mg/ml berdasarkan pengukuran menggunakan spektrofotometer pada panjang gelombang 280nm. Hasil pemeriksaan ELISA (OD405nm) dengan mempergunakan cairan ES
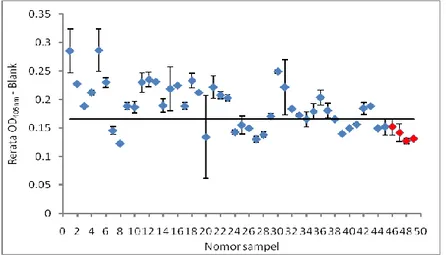
hasil koleksi sebagai antigen disajikan pada Gambar 1. Nilai batas ambang (cut off point) adalah 0,165 yang diperoleh dari hasil nilai rerata OD405nm kontrol negatif negatif + 3SD.
Gambar 1. Respon antibodi ternak sapi (n = 49) terhadap antigen ES pada uji ELISA. = Nilai absorbansi ternak sapi sampel yang diduga positif berdasarkan pemeriksaan ante-mortem.
= Nilai abosorbansi ternak sapi kontrol (negatif) = Cut off point (0,165)
Data pada Gambar 1 menunjukkan bahwa 71,1% (32 dari 45 sampel) sera yang dikoleksi dari sapi yang dikategorikan positif berdasarkan pemeriksaan ante-mortem memiliki nilai OD405nm ≥ 0,165 dengan nilai
absorbansi berkisar antara 0,165-0,287 Sebanyak 13 sampel yaitu sampel nomor 7; 8; 20; 24-28; 39-41; 44 dan 45 menunjukkan nilai OD405nm dibawah nilai batas ambang. Ternak
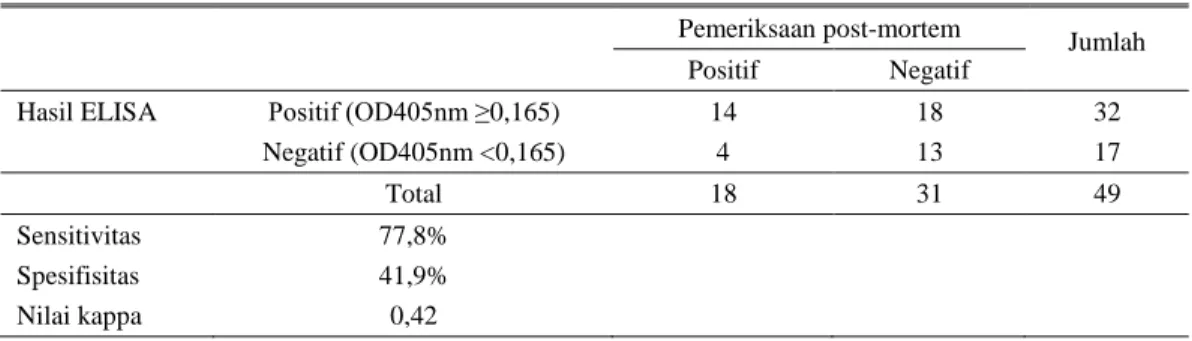
sapi kontrol (n = 4) menunjukkan nilai absorbansi berkisar antara 0,1275-0,152. Perbandingan hasil uji ELISA berbasis antigen ES dengan pemeriksaan adanya cacing F. gigantica yang juga merupakan gold standard diagnosis Fasciolosis disajikan pada Tabel 1.
Berdasarkan hasil perbandingan uji ELISA dan pemeriksaan post-mortem ditemukan adanya hasil pemeriksaan positif palsu sebanyak 18. Banyaknya hasil pemeriksaan positif palsu dalam uji ELISA dapat disebabkan oleh beberapa faktor. Pemberian anthelmintika yang efektif dilaporkan dapat menurunkan jumlah cacing Fasciola dewasa pada saluran empedu tetapi antibodi spesifik dalam serum tetap bertahan sampai dengan 2-7 bulan setelah pengobatan (Castro et al. 2000). Meskipun dalam penelitian ini data pemberian anthelmintika tidak tersedia, dapat diasumsikan bahwa praktek pemberian anthelmintika yang umumnya rutin dilakukan peternak berkontribusi terhadap adanya hasil pemeriksaan positif palsu. Adanya antigen umum yang dimiliki oleh spesies cacing yang berbeda juga berpengaruh terhadap timbulnya hasil pemeriksaan positif palsu (Awad et al. 2009). Lebih lanjut Awad et al. (2009) menyatakan bahwa kedua faktor penyebab timbulnya hasil positif palsu dalam pemeriksaan di atas merupakan masalah utama dalam serodiagnosis Fasciolosis, dan oleh
karena itu, tes-tes serodiagnostik yang digunakan untuk mendiagnosa infeksi pada ternak harus dinterpretasikan secara cermat.
Data pada Tabel 1 menunjukkan adanya hasil pemeriksaan negatif palsu (false negatif) sebanyak 4 sampel (8,1%). Awad et al. (2009) dalam studinya menggunakan tiga sumber antigen cacing F. gigantica yaitu antigen somatik, antigen ES dan antigen GST untuk mendeteksi Fasciolosis pada sapi (n = 60), domba (n = 75) dan keledai (n = 69) dengan metoda indirect-ELISA juga melaporkan adanya hasil pemeriksaan negatif palsu. Uji indirect-ELISA berbasis antigen ES pada studi Awad et al. (2009) menunjukkan hasil pemeriksaan negatif palsu sebesar 3,3% pada sapi, 2,7% pada domba, dan 1,5% pada keledai. Hasil pemeriksaan negatif palsu dalam uji serologis disebabkan oleh adanya perubahan respon imun oleh cacing Fasciola seperti yang dilaporkan oleh Zimmerman et al. (1983) dalam studinya yang menunjukkan adanya penekanan kekebalan yang signifikan selama infeksi cacing F. hepatica.
Hasil uji ELISA menggunakan antigen ES setelah dibandingkan dengan pemeriksaan adanya cacing F. gigantica pada pemeriksaan post-mortem (Tabel 1) memiliki sensitivitas sebesar 77,8% dan spesifisitas sebesar 41,9% dengan nilai Kappa sebesar 0,42 (reliabilitas sedang). Peneliti lain melaporkan hasil uji ELISA dengan sensitivitas lebih tinggi dari hasil penelitian ini yaitu antara 85-98% (Estuningsih et al. 2004; El Ridi et al. 2007; Awad et al. 2009). Spithill et al. (1999) menjelaskan bahwa banyak faktor yang mempengaruhi sensitivitas suatu tes, diantaranya adalah jenis antigen dan kemurnian antigen yang dipergunakan. Jenis antigen juga berkaitan erat dengan faktor
Tabel 1. Standarisasi berdasarkan hasil pemeriksaan post-mortem
Pemeriksaan post-mortem
Jumlah Positif Negatif
Hasil ELISA Positif (OD405nm ≥0,165) 14 18 32 Negatif (OD405nm <0,165) 4 13 17
Total 18 31 49
Sensitivitas 77,8% Spesifisitas 41,9% Nilai kappa 0,42
lingkungan dimana parasit itu berada. Hal-hal lain yang harus dipertimbangkan adalah bahwa sensitivitas dan spesifisitas tes akan bervariasi sesuai dengan populasi yang digunakan, dan musim pada saat pengambilan sampel untuk bahan uji (Whiting et al. 2004; Leeflang dan Bossuyt, 2005). Sementara itu, spesifisitas yang rendah kemungkinan disebabkan karena positif palsu yang diperoleh dalam penelitian inicukup banyak sehingga menyebabkan uji kurang spesifik. Velusamy et al. (2005) menyatakan bahwa penggunaan antigen yang diisolasi dari cacing hati dewasa dalam uji serologi juga merupakan faktor penyebab rendahnya spesifisitas, sehingga disarankan untuk menggunakan antigen yang diisolasi dari larva untuk meningkatkan spesifisitas tes uji.
Hasil penelitian ini mengindikasikan bahwa penggunaan antigen ES dalam uji ELISA memiliki kepekaan yang cukup tinggi meskipun kurang spesifik. Sungguhpun demikian, dengan nilai sensitivitas ELISA sebesar 77,8% menunjukkan bahwa antigen ES cacing F. gigantica memiliki potensi untuk dipergunakan dalam deteksi Fasciolosis. Keberhasilan untuk mendiagnosa adanya infeksi Fasciola terutama pada perioda prepaten/akut akan sangat membantu dalam usaha pengendalian penyakit, menghambat efek negatif penurunan produktivitas ternak dan mencegah kerugian ekonomi yang tinggi.
KESIMPULAN
Hasil studi ini menunjukkan bahwa penggunaan antigen ES yang diisolasi dari cacing F. gigantica dalam uji ELISA dapat diaplikasikan untuk deteksi Fasciolosis pada sapi. Nilai sensitivitas hasil uji ELISA, dibandingkan dengan ada dan tidaknya cacing pada pemeriksaan post-mortem, adalah77,8% sedangkan nilai spesifisitas tes adalah 41,9%. Diperlukan studi lanjut agar hasil uji serologi menggunakan antigen ES F. gigantica lebih sensitif dan spesifik.
DAFTAR PUSTAKA
Allam AF, El-Agamy ESI, Helmy MH. 2002. Molecular and immunological characterization of fasciola species. J Biomed. 59: 191-195.
Awad WS, Ibrahim AK, Salib FA. 2009. Using indirect ELISA to assess different antigens for the serodiagnosis of Fasciola giganticA
infection in cattle, sheep and donkeys. Res Vet Sci. 86:466-471.
Boray JC. 1985. Flukes of domestic animals. In: Gaafar SM, Howard WE, Marsh RE. (Eds),
Parasites, Pests and Predators. Elsevier, New York.
Castro E, Freyre A, Hernandez Z. 2000. Serological responses of cattle after treatment and during natural re-infection with Fasciola hepatica measured using a dot-ELISA system. Vet Parasitol. 90:201-208.
El Ridi R, Salah M, Wagih A, William H, Tallima H, El Shafie MH, Abdel Khalek T, El Amir A, Abo Ammou FF, Motawi H. 2007. Fasciola gigantica excretory-secretory products for immunodiagnosis and prevention of sheep fasciolosis. Vet Parasitol. 149:219-228. Estuningsih SE, Widjajanti S, AdiwinataG. 2004.
Perbandingan antara uji ELISA-Antibodi dan pemeriksaan telur cacing untuk mendeteksi infeksi Fasciola gigantica pada sapi. JITV. 9:55-60.
Gupta SC, Ghosh S, Joseph D, Singh BP. 2003. Diagnosis of experimental Fasciola gigantica
in cattle by affinity purified antigen. Indian J Anim. 7:963-966.
Kooshan M, Hashemi GR, Naghibi A. 2010. Use of somatic and excretory-secretory antigens of
Fasciola hepatica in diagnosis of sheep by ELISA. American-Eurasian J Agric Environ Sci. 7:170-175.
Leeflang MG, Bossuyt PMM. 2005. Test accuracy is likely to vary depending on the population it is based on. Vet Parasitol. 134:189.
Martindah E, Widjajanti S, Estuningsih SE, Suhardono. 2005. Meningkatkan kesadaran dan kepedulian masyarakat terhadap fasciolosis sebagai penyakit zoonosis. Wartazoa.15:143-154.
Meshgi B, Eslami A, Hemmatzadeh F. 2008. Determination of somatic and excretory-secretory antigens of Fasciola hepatica and
Fasciola gigantica using SDS-PAGE. Iranian J Vet Res. 9:77-80.
Morphew RM, Wright HA, LaCourse EJ, Woods DJ, Brophy PM. 2007. Comparative proteomics of excretory-secretory proteins released by the liver fluke Fasciola hepatica
in sheep host bile and during in vitro culture ex host. Mol Cell Proteom. 6:963-971.
Murti B. 2011. Validitas dan Reliabilitas Pengukuran. Materi disajikan pada Program Matrikulasi Program Studi Doktoral Fakultas Kedokteran, UNS.
Piedrafita D, Raadsma H, Prowse R, Spithill TW. 2004. Immunology of the host parasite relationship in Fasciolosis (Fasciola hepatica and Fasciola gigantica). Can J Zool. 82:233-250.
Purwanti G. 2011. Identifikasi Parasit Internal pada Sapi Bali (Bos sondaicus) di Kabupaten Lombok Barat. Skripsi. Universitas Mataram. Raadsma HW, Kingsford NM, Suharyanta, Spithill
TW, Piedrafita D. 2007. Host reponses during experimental infection with Fasciola gigantica or Fasciola hepatica in Merino sheep: I. Comparative immunological and plasma biochemical changes during early infection. Vet Parasitol. 143:275-286. Reichel MP. 2002. Performance characteristic of an
enzyme-linked immunosorbent assay for the detection of liver fluke (Fasciola hepatica) infection in sheep and cattle. Vet Parasitol.
107:65-72.
Salimi-Bejestani MR, McGarry JW, Felstead S, Ortiz P, Akca A, Williams DJL. 2005. Development of an antibody-detection ELISA for Fasciola hepatica and its evaluation against a commercially available test. Res Vet Sci. 78:177-181.
Sobhon PS, Anantavara T, Dangprasert A, Meepool C, Wanichanon V, Viyanant S. Upatham, T. Kusamram, T. Chompoonchan, S. Thammasart, P. Prasittirat. 1996. Fasciola gigantica: identification of adult antigens, their tissue sources and possible origins. J Sci Soc Thai. 22:143-162.
Spencer T. 1993. Standardisation of serology. Penyakit Hewan. 25:1-6.
Spithill TW, Smooker PM, Copeman DB. 1999.
Fasciola gigantica: epidemiology, control, immunology and molecular biology. In: Dalton, J.P. (Ed), Fasciolosis. CAB International, Wallingford, pp. 465-525. Tuasikal BJ, Suhardono. 2006. Pengaruh infeksi
Fasciola gigantica (cacing hati) iradiasi terhadap gambaran darah kambing (Capra hircus Linn). JITV. 11:317-323.
Velusamy R, Singh BP, Gosh S, Chandra D, Raina OK, Gupta SC, Jayraw AK. 2006. Prepatent detection of Fasciola gigantica infection in bovine calves using metacercarial antigen. Indian J Exp Biol. 44:749-753.
Whiting P, Rutjes AW, Reitsma JB, Glas AS, Bossuyt PM, Kleijnen J. 2004. Sources of variation and bias in studies of diagnostic accuracy: a systematic review. Ann Intern Med. 140:189-202.
Wijffels GL, Salvatore L, Dosen M, Waddington J, Wilson L, Thompson C, Campbell N, Sexton J, Bowen F, Friedel T, Spithill TW. 1994. Vaccination of sheep with purified cysteineproteinase of Fasciola hepatica decreases worm fecundity. Exp Parasitology 78:132-148.
Zimmerman GL, Kerkvliet NY, Brauner JA, Cerro JE. 1983. Modulation of the host immune response by Fasciola hepatica: response of peripheral lymphocyte to mitogens during liver fluke infection of sheep. J Parasitol. 69:473-477.