PERANAN INHIBITOR KATEPSIN ALAMI DARI
IKAN PATIN (Pangasius hypophthalmus) DALAM
MENGHAMBAT KEMUNDURAN MUTU
IKAN BANDENG (Chanos chanos Forskal)
ARY APRILAND
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
Bandeng (Chanos chanos Forskal). Dibimbing oleh KOMARIAH TAMPUBOLON dan ELLA SALAMAH.
Salah satu penyebab terjadinya proses kemunduran mutu ikan adalah adanya aktivitas enzim proteolitik. Katepsin merupakan salah satu enzim proteolitik yang terdapat pada jaringan tubuh ikan yang berperan dalam proses pelunakan tekstur daging ikan akibat degradasi protein miofibril selama proses kemunduran mutu ikan. Untuk menghambat kemunduran mutu ikan karena aktivitas enzim katepsin maka diperlukan suatu senyawa penghambat yang disebut dengan inhibitor. Inhibitor dapat diperoleh secara alami dari dalam tubuh ikan dengan melalui serangkaian proses ekstraksi. Aktivitas inhibitor katepsin pada ikan patin (omnivora) diduga lebih tinggi dibandingkan dengan ikan bandeng (herbivora). Penelitian ini bertujuan untuk mendapatkan inhibitor katepsin dari ikan patin dan mengaplikasikannya untuk menghambat kemunduran mutu ikan bandeng selama penyimpanan suhu chilling (0-4 ºC).
Penelitian ini dilakukan dalam tiga tahap. Tahap (1) yaitu penentuan suhu optimum ekstraksi inhibitor katepsin, tahap (2) penentuan konsentrasi inhibitor katepsin yang efektif untuk aplikasi, dan tahap (3) aplikasi inhibitor katepsin dalam menghambat kemunduran mutu ikan bandeng. Pengamatan dilakukan terhadap ikan bandeng dengan dua perlakuan yang berbeda, yaitu ikan bandeng dengan perendaman inhibitor dan ikan bandeng yang direndam dengan buffer sebagai kontrol. Pengamatan post mortem ikan bandeng dilakukan setiap 24 jam selama 576 jam (24 hari) untuk mengetahui lama waktu yang diperlukan ikan untuk memasuki fase pre rigor, rigor, post rigor, dan busuk selama penyimpanan. Selain itu juga dilakukan uji pada setiap fase pre rigor, rigor, post rigor, dan busuk ikan bandeng selama penyimpanan.
Hasil penelitian menunjukkan bahwa suhu optimum untuk ekstraksi inhibitor adalah 80 ºC dengan aktivitas inhibisi sebesar 92,88 % dan pengenceran 1:1 adalah konsentrasi larutan inhibitor yang digunakan untuk tahap aplikasi dengan aktivitas inhibisi sebesar 85,29 %. Fase pre rigor, rigor mortis, post rigor, dan busuk ikan bandeng kontrol berlangsung selama 504 jam (21 hari) dengan interval waktu berturut-turut terjadi setelah penyimpanan selama 0 jam (0 hari), 96 jam (4 hari), 360 jam (15 hari), dan 504 jam (21 hari), sedangkan ikan bandeng dengan perlakuan perendaman inhibitor berlangsung selama 576 jam (24 hari) dengan interval waktu berturut-turut terjadi setelah penyimpanan selama 0 jam (0 hari), 96 jam (4 hari), 365 jam (24 hari), dan 576 jam (24 hari). Nilai organoleptik ikan bandeng mengalami penurunan dari fase pre rigor hingga busuk yang diikuti dengan kenaikan nilai TPC dan TVB. Nilai pH mengalami penurunan pada fase rigor mortis dan mengalami kenaikan pada fase post rigor hingga busuk. Pada penyimpanan suhu chilling tersebut pola kemunduran mutu ikan bandeng kontrol dari fase pre rigor hingga ikan busuk berlangsung lebih cepat dari pada ikan bandeng dengan perendaman inhibitor. Hal ini menunjukkan bahwa perendaman dengan inhibitor alami dari ikan patin dapat memperpanjang fase post mortem ikan bandeng sebanyak 3 hari (72 jam).
PERANAN INHIBITOR KATEPSIN ALAMI DARI
IKAN PATIN (Pangasius hypophthalmus) DALAM
MENGHAMBAT KEMUNDURAN MUTU
IKAN BANDENG (Chanos chanos Forskal)
ARY APRILAND
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Teknologi Hasil Perairan
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
NIM : C34052050
Menyetujui,
Pembimbing I, Pembimbing II,
(Ir. Komariah Tampubolon, M.S.) (Dra. Ella Salamah, M.Si.) NIP. 19451110 197104 2 001 NIP. 19530629 198803 2 001
Mengetahui : Ketua Departemen,
(Dr. Ir. Ruddy Suwandi, M.S, M.Phil.) NIP. 19580511 198503 1 002
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi saya yang berjudul “Peranan Inhibitor Katepsin Alami dari Ikan Patin (Pangasius
hypophthalmus) dalam Menghambat Kemunduran Mutu Ikan Bandeng (Chanos chanos Forskal)” adalah hasil karya saya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Pebuari 2010
Ary Apriland C34052050
rahmat-Nya sehingga skripsi dengan judul ”Peranan Inhibitor Katepsin Alami dari Ikan Patin (Pangasius hypophthalmus) dalam Menghambat Kemuduran Mutu Ikan Bandeng (Chanos chanos Forskal)” ini dapat diselesaikan oleh penulis. Adapun tujuan dari peyusunan skripsi ini adalah sebagai syarat untuk memperoleh gelar Sarjana di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Pada kesempatan ini penulis mengucapkan terima kasih yang sebesar-besarnya kepada semua pihak yang telah membantu dalam penulisan skripsi ini, terutama kepada:
1. Ibu Ir. Komariah Tampubolon, M.S dan ibu Dra. Ella Salamah, M.Si selaku komisi pembimbing, atas segala bimbingan dan pengarahan yang diberikan kepada penulis.
2. Ibu Dr. Tati Nurhayati, S.Pi, M.Si yang bersedia memberikan kesempatan kepada penulis untuk bergabung dalam program Hibah Bersaing 2009 dan penulis juga berterima kasih untuk nasehat dan masukannya.
3. Bapak Dr. Ir. Ruddy Suwandi, M.S, M.Phil selaku ketua Departemen Teknologi Hasil Perairan.
4. Seluruh staf dosen dan TU THP, terima kasih atas dukungan dan bantuan selama ini.
5. Ayah dan ibu tercinta, atas semua dukungan dan kasih sayang yang diberikan serta doanya selama ini.
6. Ibu Emma, Rita (Laboran THP), mba Selin dan mas Wahyu (Laboran FKH) yang telah banyak membantu selama penelitian.
7. Teman-teman satu tim: Zen, Febri, Fahrul, mas Sevri, dan mba Tatty Yuniarti.
8. Pak ucit beserta keluarga di Tangerang, terima kasih atas bantuannya selama pengambilan sampel penelitian.
9. Ellis Permatasari untuk doa dan dukungannya kepada penulis.
10.Teman-teman THP 42, yaitu Ado, Melda, Ika, Seno, Inka, Irma, Dan, Ticil, Ulie, Dewi, Uut, Puspita, Sugara, Sofi, Junide, Nina, Rodi, Mifta,
Fathu, Binyo, Nina, Dini, Tyas, Fauzi, Indri, Ifa, Tika, Evi, Irfan, dan teman-teman yang tidak dapat penulis sebutkan satu persatu untuk kebersamaan dan semangat yang diberikan.
11.Adik-adik kelasku di THP 43 (Nanda, Uuk, dan Wati) dan THP 44 untuk semangat yang sudah diberikan kepada penulis.
12.Teman-teman satu tim asisten Biokimia Hasper, Iktiologi, Biotoksikologi, PHP, Diversifikasi, dan Limbah untuk kebersamaan yang sudah diberikan. Penulis menyadari bahwa skripsi ini masih jauh dari sempurna. Oleh karena itu kritik dan saran yang bersifat membangun dari semua pihak sangat diharapkan.
Bogor, Pebuari 2010
Ary Apriland, dilahirkan pada tanggal 4 April 1987 di Jakarta, sebagai anak keempat dari empat bersaudara pasangan Bapak Madju Sihombing dan Ibu Ida Ambarita. Penulis memulai pendidikan formal di Sekolah Dasar Negeri 05 Jakarta Timur dan lulus pada tahun 1999 kemudian melanjutkan ke Sekolah Menegah Pertama di SMP Negeri 252 Jakarta Timur dan lulus pada tahun 2002. Sekolah Menengah Atas penulis tempuh di SMA Negeri 71 Jakarta Timur dan lulus pada tahun 2005.
Pada tahun 2005 penulis diterima menjadi mahasiswa Institut Pertanian Bogor melalui Undangan Seleksi Masuk IPB (USMI) di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan. Selama menjalani pendidikan akademik penulis pernah mengikuti organisasi Uni Konservasi Fauna (UKF) pada tahun 2005 dan Aquatic Processing Science Club (APSC) pada tahun 2008. Selain itu penulis juga aktif sebagai asisten paraktikum mata kuliah Penanganan Hasil Perairan tahun ajaran (2007/2008) dan (2008/2009), Biokimia Hasil Perairan pada tahun ajaran (2007/2008) dan (2008/2009), Iktiologi tahun ajaran (2008/2009), Diversifikasi dan Pengembangan Produk Hasil Perairan tahun ajaran (2008/2009), Teknologi Hasil Samping dan Limbah Hasil Perairan tahun ajaran (2008/2009), Dasar-dasar Teknologi Hasil Perairan tahun ajaran (2008/2009), dan koordinator asisten Biotoksikologi Hasil Perairan tahun ajaran (2009/2010). Penulis juga pernah mengikuti seminar dan pelatihan ISO 22000 yang diselenggarakan oleh Himpunan Mahasiswa Teknologi Hasil Perikanan (HIMASILKAN) pada tahun 2008.
Penulis menyusun skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan dengan judul “Peranan Inhibitor Katepsin Alami dari Ikan Patin (Pangasius hypophthalmus) dalam Menghambat Kemunduran Mutu Ikan Bandeng
(Chanos chanos Forskal)”, dibimbing oleh Ir. Komariah Tampubolon, M.S dan Dra. Ella Salamah, M.Si.
DAFTAR ISI Halaman DAFTAR TABEL ... ix DAFTAR GAMBAR ... x DAFTAR LAMPIRAN ... xi 1 PENDAHULUAN ... 1 1.1 Latar Belakang ... 1 1.2 Tujuan ... 3 2 TINJAUAN PUSTAKA ... 4
2.1 Deskripsi dan Klasifikasi Ikan Bandeng (Chanos chanos Forskal) ... 4
2.2 Deskripsi dan Klasifikasi Ikan Patin (Pangasiushypophthalmus) ... 5
2.3 Mutu Ikan ... 7
2.4 Kemunduran Mutu Ikan ... 7
2.4.1 Pre rigor ... 8
2.4.2 Rigor mortis ... 8
2.4.3 Post rigor ... 9
2.5 Aktivitas Proteolitik Selama Post Mortem Ikan ... 10
2.6 Enzim Katepsin ... 10
2.7 Peranan Katepsin dalam Kemunduran Mutu ... 11
2.8 Inhibitor Enzim ... 12
2.8.1 Mekanisme kerja inhibitor enzim ... 12
2.8.2 Inhibitor protease alami ... 13
2.8.3 Inhibitor katepsin alami ... 13
3 METODE ... 15
3.1 Waktu dan Tempat ... 15
3.2 Bahan dan Alat ... 15
3.3 Tahapan Penelitian ... 16
3.3.1 Penentuan suhu optimum ekstraksi inhibitor katepsin ... 16
3.3.2 Pentuan konsentrasi inhibitor katepsin yang efektif untuk aplikasi ... 16
3.3.3 Aplikasi inhibitor katepsin dalam menghambat kemunduran mutu ikan bandeng ... 17
3.4 Prosedur Analisis ... 17
3.4.1 Assay aktivitas enzim katepsin (Dinu et al. 2002) ... 17
3.4.2 Assay aktivitas inhibitor katepsin (Dinu et al. 2002) ... 18
viii
3.4.3 Pengukuran konsentrasi protein enzim (Bradford 1976) ... 19
3.4.4 Uji organoleptik (BSN 2006) ... 20
3.4.5 Uji nilai pH (Apriyantono et al. 1989) ... 20
3.4.6 Uji total plate count (TPC) (Fardiaz 1987) ... 21
3.4.7 Uji totalvolatile base (TVB) (Apriyantono et al. 1989) ... 21
3.5 Analisis Data ... 22
4 HASIL DAN PEMBAHASAN ... 24
4.1 Penentuan Suhu Optimum Ekstraksi Inhibitor Katepsin ... 24
4.2 Penentuan Konsentrasi Inhibitor Katepsin yang Efektif untuk Aplikasi ... 26
4.3 Penentuan Fase Post Mortem Ikan Bandeng ... 28
4.4 Pola Kemunduran Mutu Ikan Bandeng ... 31
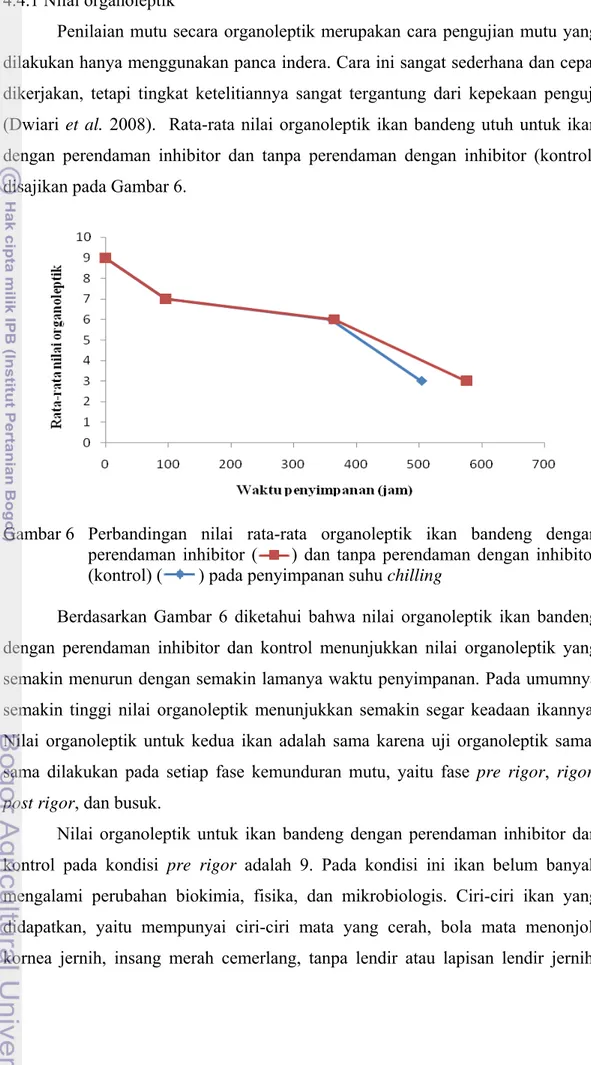
4.4.1 Nilai organoleptik ... 32
4.4.2 Nilai pH ... 33
4.4.3 Nilai TPC ... 35
4.4.4 Nilai TVB ... 37
4.5 Hubungan antar Parameter Kesegaran Ikan ... 38
5 KESIMPULAN DAN SARAN ... 41
5.1 Kesimpulan ... 41
5.2 Saran ... 41
DAFTAR PUSTAKA ... 42
ix
DAFTAR TABEL
Halaman 1 Komposisi kimia ikan bandeng segar ... 5 2 Komposisi kimia ikan patin segar ... 7 3 Persyaratan mutu ikan basah (SNI 01-2729-2006) ... 7 4 Beberapa penelitian mengenai isolasi inhibitor protease dari jaringan
ikan ... 13 5 Pembuatan larutan BSA konsentrasi 0,1-1,0 mg/ml ... 20
x
DAFTAR GAMBAR
Halaman 1 Morfologi ikan bandeng (Chanos chanos Forskal) ... 5 2 Ikan patin (Pangasius hypophthalmus) ... 6 3 Hasil pengujian aktivitas inhibitor katepsin dari ikan patin pada berbagai suhu ekstraksi ... 24 4 Hasil pengujian aktivitas inhibitor katepsin dari ikan patin pada berbagai pengeceran ... 26 5 Konsentrasi protein inhibitor katepsin dari ikan patin pada berbagai
pengeceran ... 27 6 Perbandingan nilai rata-rata organoleptik ikan bandeng dengan
perendaman inhibitor dan tanpa perendaman dengan inhibitor
(kontrol) pada penyimpanan suhu chilling ... 32 7 Perbandingan nilai pH ikan bandeng dengan perendaman inhibitor dan
tanpa perendaman dengan inhibitor (kontrol) pada penyimpanan suhu
chilling ... 34 8 Perbandingan nilai rata-rata log TPC ikan bandeng dengan
perendaman inhibitor dan tanpa perendaman dengan inhibitor
(kontrol) pada penyimpanan suhu chilling ... 35 9 Perbandingan nilai rata-rata TVB ikan bandeng dengan perendaman
inhibitor dan tanpa perendaman dengan inhibitor (kontrol) pada
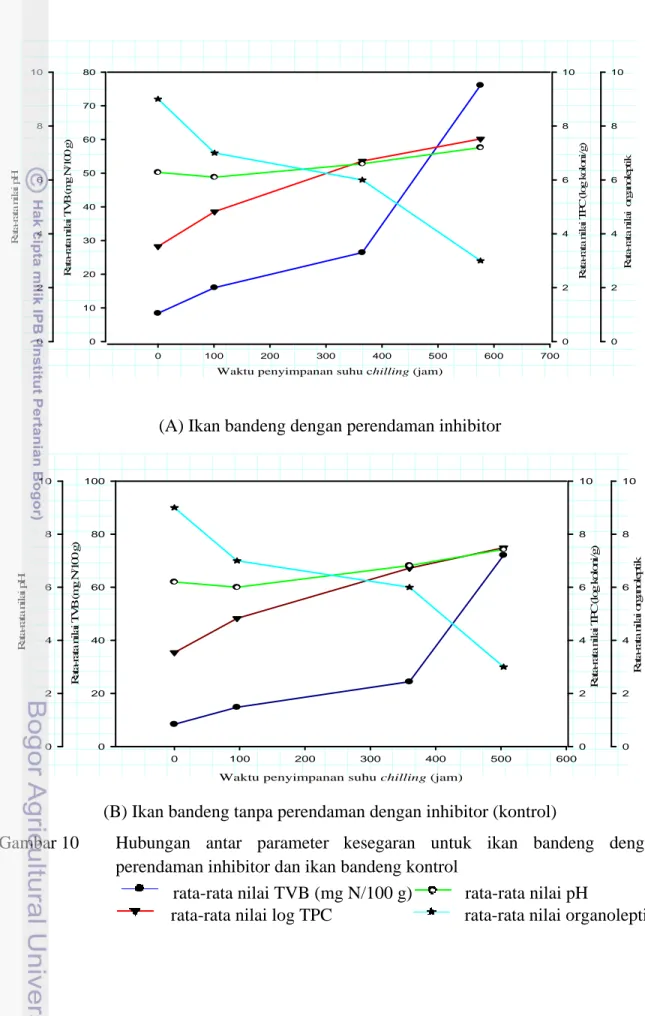
penyimpanan suhu chilling ... 37 10 Hubungan antar parameter kesegaran ikan bandeng dengan
xi
DAFTAR LAMPIRAN
Halaman
1 Format uji organoleptik ikan segar (SNI 01-2346-2006) ... 47
2a Bahan-bahan yang digunakan untuk ekstraksi enzim katepsin (Dinu et al. 2002) ... 49
2b Bahan-bahan yang digunakan untuk ekstraksi inhibitor katepsin (An et al. 1995) ... 49
3a Bahan-bahan yang digunakan untuk pengukuran aktivitas enzim dan inhibitor katepsin (Dinu et al. 2002) ... 50
3b Prosedur pengukuran aktivitas enzim katepsin ... 50
3c Prosedur pengukuran aktivitas inhibitor katepsin ... 51
4 Kurva standar penentuan konsentrasi protein inhibitor ... 52
5a Hasil uji ragam (ANOVA) aktivitas katepsin pada berbagai suhu ekstraksi ... 54
5b Hasil uji ragam (ANOVA) aktivitas inhibitor katepsin pada berbagai pengenceran ... 54
5c Hasil uji ragam (ANOVA) konsentrasi protein inhibitor katepsin pada berbagai pengenceran ... 55
6 Dokumentasi penelitian ... 56
Salah satu faktor yang menentukan nilai jual ikan dan hasil perikanan yang lain adalah tingkat kesegaran. Semakin segar ikan sampai ke tangan pembeli maka harga jual ikan tersebut akan semakin mahal. Salah satu komoditi hasil perikanan yang umumnya dijual dalam keadaan segar adalah ikan bandeng. Ikan bandeng merupakan komoditi yang digunakan dalam beberapa jenis pemanfaatan seperti untuk tujuan konsumsi, umpan bagi industri perikanan tuna cakalang maupun
untuk pasar ekspor dengan jumlah permintaan yang cukup tinggi (Warta Penelitian Perikanan Budidaya 2005).
Produksi ikan bandeng di Indonesia terus mengalami peningkatan setiap tahun, yaitu 245.100 ton pada tahun 2007 menjadi 550.000 ton pada tahun 2008 dan diperkirakan pada tahun 2009 dapat mencapai 822.000 ton (DKP 2009 diacu dalam Kompas 2009). Namun dibalik besarnya potensi tersebut terdapat suatu permasalahan, yaitu produk dalam bentuk segar ini cepat mengalami kemunduran mutu.
Proses kemunduran mutu ikan segar terutama diawali dengan proses perombakan oleh aktivitas enzim yang secara alami terdapat di dalam jaringan tubuh ikan. Katepsin merupakan salah satu enzim proteolitik pada jaringan tubuh ikan yang sangat berperan dalam proses pelunakan tekstur daging ikan akibat degradasi protein miofibril sehingga turut mempercepat proses kemunduran mutu ikan (Jiang 2000). Kerusakan yang ditimbulkan oleh enzim ini, yaitu dapat menyebabkan timbulnya akumulasi metabolit, perubahan cita rasa, terbentuknya komponen volatil serta peningkatan jumlah bakteri yang pada akhirnya menimbulkan kebusukan pada ikan (Lawrie 1985). Kebusukan ikan ini tentu dapat menimbulkan kerugian karena nilai jual ikan menjadi turun dan bagi konsumen mengakibatkan ikan tidak sehat untuk dikonsumsi. Untuk menghambat kemunduran mutu yang disebabkan oleh aktivitas enzim katepsin, diperlukan suatu senyawa inhibitor yang dapat mengurangi laju aktivitas enzim tersebut. Inhibitor merupakan molekul atau ion yang dapat menghambat sisi aktif enzim untuk berikatan dengan substrat (Lehninger 1993).
2
Inhibitor dapat diperoleh secara kimiawi dan alami. Inhibitor kimiawi adalah inhibitor yang berasal dari suatu senyawa kimia, seperti ethylene diamine tetraacetic acid (EDTA) dan diisopropyl fluoro phosphate (DFP) (Zevaco & Desmazeaud 1976), sedangkan inhibitor alami berasal dari suatu bahan
alami, seperti sistatin (putih telur), aprotinin (pankreas), dan hirudin (Hirudo medicinalis) (Carreno & Cortes 2000). Kerja atau aksi inhibitor alami ini sama baiknya dengan cara menambahkan logam atau mengatur pH lingkungan (Olonen 2004).
Inhibitor alami juga dapat diperoleh dari dalam tubuh ikan. Aktivitas inhibitor alami di dalam tubuh ikan diduga dipengaruhi dari jenis makanan yang dimakan oleh ikan tersebut. Ikan pemakan tumbuhan dan hewan (omnivora) diduga memiliki aktivitas inhibitor enzim proteolitik yang lebih tinggi dibandingkan dengan ikan pemakan tumbuhan (herbivora). Ini diduga karena ikan omnivora memiliki enzim proteolitik dengan aktivitas yang lebih tinggi dibandingkan ikan herbivora. Enzim proteolitik ini digunakan untuk memecah protein yang ada pada makanan sehingga untuk mengendalikannya juga diperlukan inhibitor dengan aktivitas yang tinggi. Inhibitor yang ada pada jaringan tubuh ikan memiliki peranan penting dalam mengontrol aktivitas katepsin secara alami selama ikan hidup (Rondanelli 2002).
Ikan patin adalah komoditi yang termasuk ke dalam kelompok ikan omnivora (Susanto & Amri 1996). Inhibitor katepsin yang berasal dari ikan patin diduga memiliki aktivitas yang lebih tinggi dibandingkan ikan bandeng yang termasuk ke dalam kelompok ikan herbivora (Gufron & Kardi 1997). Jika didapatkan inhibitor katepsin alami dari ikan patin dengan aktivitas penghambatan yang lebih tinggi dari pada inhibitor dari ikan bandeng maka akan menjadi suatu potensi untuk menghambat kemunduran mutu ikan bandeng.
1.2. Tujuan
Tujuan penelitian ini adalah:
1) menentukan suhu optimum ekstraksi inhibitor katepsin dari ikan patin 2) menentukan konsentrasi inhibitor katepsin yang efektif untuk aplikasi 3) mengetahui pola kemunduran mutu ikan bandeng setelah perendaman
dengan inhibitor katepsin dari ikan patin berdasarkan analisis tingkat kesegaran ikan pada penyimpanan suhu chilling (0-4 ºC)
2. TINJAUAN PUSTAKA
2.1 Deskripsi dan Klasifikasi Ikan Bandeng (Chanos chanos Forskal)
Ikan bandeng merupakan salah satu jenis ikan budidaya air payau yang potensial dikembangkan. Jenis ikan ini mampu mentolelir salinitas perairan yang luas (0-158 ppt) sehingga digolongkan sebagai ikan euryhaline. Ikan bandeng
mampu beradaptasi terhadap perubahan lingkungan seperti suhu, pH, dan kekeruhan air serta tahan terhadap serangan penyakit (Ghufron & Kardi 1997).
Menurut Bagarinao (1994) ikan bandeng memiliki hubungan yang erat dengan ikan-ikan yang hidup di air tawar. Ikan bandeng diduga berasal dari wilayah Eropa dan Amerika Utara serta melakukan migrasi ke wilayah laut tropis. Saat ini ikan bandeng lebih banyak ditemukan pada daerah tropis.
Klasifikasi ikan bandeng menurut Saanin (1984) adalah sebagai berikut: Filum : Chordata
Sub filum : Vertebrata Kelas : Pisces Sub kelas : Teleostei Ordo : Malacopterigii Family : Chanidae Genus : Chanos
Spesies : Chanos chanos Forskal
Ikan bandeng mempunyai badan yang memanjang seperti terpedo dengan sirip ekor bercabang sebagai tanda bahwa ikan bandeng tergolong sebagai perenang cepat. Kepala ikan bandeng tidak bersisik, mulut kecil terletak di ujung
rahang tanpa gigi, lubang hidung terletak di depan mata. Mata diliputi oleh selaput bening (subcutaneus). Warna badan putih keperak-perakan dan
punggung biru kehitaman (Ghufron & Kardi 1997). Morfologi ikan bandeng secara lengkap disajikan pada Gambar 1.
Gambar 1 Morfologi ikan bandeng (Chanos chanos Forskal) Sumber : Oceanleader (2009)
Di Indonesia, ikan bandeng dapat dengan mudah ditemukan di daerah Sumatra Selatan, Borneo, Jawa, dan Sulawesi. Ikan bandeng mempunyai komposisi zat gizi yang cukup tinggi. Komposisi kimia ikan bandeng disajikan pada Tabel 1.
Tabel 1 Komposisi kimia ikan bandeng segar
Komponen kimia Kadar (%)
Air 74,00 Protein 20,00 Lemak 4,80 Abu 1,19 Sumber : Saparinto et al. (2006)
2.2 Deskripsi dan Klasifikasi Ikan Patin (Pangasiushypophthalmus)
Ikan patin memiliki badan memanjang berwarna putih seperti perak dengan punggung berwarna kebiru-biruan. Kepala ikan patin relatif kecil dengan mulut terletak di ujung kepala agak di sebelah bawah yang merupakan ciri khas golongan cat fish. Sirip punggung patin memiliki sebuah jari-jari keras yang
berubah menjadi patil yang bergerigi dan besar. Habitat asli ikan patin adalah di sungai-sungai besar dan muara sungai. Ikan patin termasuk ke dalam ikan dasar (demersal) (Susanto & Amri 1996).
Ikan patin sangat toleran terhadap derajat keasaman (pH) air. Artinya ikan ini dapat bertahan hidup pada kisaran pH air yang luas, yaitu dari perairan yang agak asam (pH 5) sampai perairan yang basa (pH 9). Kandungan oksigen terlarut yang dibutuhkan adalah berkisar antara 3-6 ppm, sementara karbondioksida yang bisa ditolerir berkisar antara 9-20 ppm (Khairuman & Suhenda 2002). Pada bidang perikanan dan jasa boga, ikan ini dikenal sebagai komoditi yang
6
berprospek cerah, rasa dagingnya lezat dan gurih mengakibatkan harga jual ikan patin tinggi (Susanto & Amri 1996).
Klasifikasi ikan patin menurut Saanin (1984) adalah sebagai berikut: Filum : Chordata
Sub filum : Vertebrata Kelas : Pisces Sub kelas : Teleostei Ordo : Ostariophysi Sub Ordo : Siluridae Family : Pangasidae Genus : Pangasius
Spesies : Pangasius hypophthalmus
Ikan patin tidak memiliki sisik tetapi memiliki sirip dubur yang panjang, terdiri dari 30-33 jari-jari lunak, sedangkan sirip perutnya memiliki enam jari-jari lunak. Sirip dada memiliki 12-13 jari-jari lunak, dan sebuah jari-jari keras yang berubah menjadi senjata yang dikenal sebagai patil (Susanto & Amri 1996). Morfologi ikan patin dapat dilihat pada Gambar 2.
Gambar 2 Ikan patin (Pangasiushypophthalmus) Sumber: Nautic Seafood (2009)
Ikan patin di alam bebas biasanya selalu bersembunyi di dalam liang-liang tepi sungai atau kali. Ikan ini baru keluar dari liang persembunyiannya pada malam hari setelah hari mulai gelap. Hal ini sesuai dengan sifat hidupnya yang
nocturnal (aktif pada malam hari). Ikan patin adalah ikan omnivora atau golongan
ikan pemakan segala (Khairuman & Suhenda 2002). Di alam, makanan ikan ini antara lain adalah ikan-ikan kecil, cacing, detritus, serangga, biji-bijian,
udang-udang kecil, dan moluska (Susanto & Amri 2002). Komposisi kimia ikan patin disajikan pada Tabel 2.
Tabel 2 Komposisi kimia ikan patin segar
Komposisi Kadar (%)
Air 75,70 Protein 16,10 Lemak 5,70 Abu 1,00 Sumber : BPMHP (1998) diacu dalam Erdiansyah (2006)
2.3 Mutu Ikan
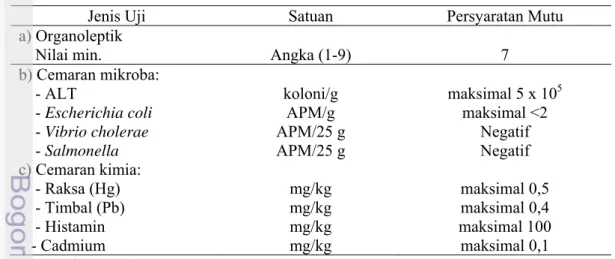
Mutu ikan segar adalah identik dengan kesegaran. Kesegaran ikan akan memberikan pengaruh bagi kesehatan orang yang mengkonsumsinya. Mutu pada ikan segar dapat diketahui melalui penilaian secara subjektif dan objektif (kimia/biokimia, fisika, dan mikrobiologi). Ikan yang sangat segar belum banyak mengalami perubahan-perubahan secara kimia, fisik, dan mikrobiologi (Alasavar & Taylor 2002). Adapun persyaratan mutu ikan segar dapat dilihat pada Tabel 3.
Tabel 3 Persyaratan mutu ikan basah (SNI 01-2729-2006)
Jenis Uji Satuan Persyaratan Mutu
a) Organoleptik
Nilai min. Angka (1-9) 7
b) Cemaran mikroba: - ALT - Escherichia coli - Vibrio cholerae - Salmonella c) Cemaran kimia: - Raksa (Hg) - Timbal (Pb) - Histamin - Cadmium koloni/g APM/g APM/25 g APM/25 g mg/kg mg/kg mg/kg mg/kg maksimal 5 x 105 maksimal <2 Negatif Negatif maksimal 0,5 maksimal 0,4 maksimal 100 maksimal 0,1 Sumber: BSN (2006)
Keterangan: ALT = Angka Lempeng Total, APM = Angka Paling Memungkinkan 2.4 Kemunduran Mutu Ikan
Segera setelah ikan mati, terjadi perubahan-perubahan yang dapat mengakibatkan penurunan mutu ikan. Penurunan tingkat kesegaran ikan ini terlihat dengan adanya perubahan fisik, kimia, dan organoleptik pada ikan yang
8
disebabkan oleh aktivitas enzim, bakteri, dan kimiawi. Lamanya waktu perubahan yang berlangsung pada ikan tergantung pada jenis ikan, ukuran, cara kematian, metode penangkapan, penanganan, dan suhu penyimpanan (Robb 2002). Urutan proses perubahan yang terjadi setelah ikan mati, meliputi perubahan pre rigor, rigos mortis, dan post rigor.
2.4.1 Pre rigor
Pre rigor merupakan kondisi pada saat otot ikan dalam keadaan relaksasi
setelah ikan mengalami kematian. Pada kondisi ini terjadi penurunan kreatin fosfat (CP) secara cepat. Konsentrasi ATP coba dipertahankan untuk beberapa saat dengan proses resintesis dari ADP dan CP (Iwamoto et al. 1988 diacu dalam
Wang et al. 1998). Pada kondisi pre rigor juga terjadi peristiwa terlepasnya lendir
dari kelenjar-kelenjar yang ada di dalam kulit (hyperaemia). Lendir tersebut
terdiri dari glukoprotein dan merupakan substrat yang baik untuk pertumbuhan bakteri (Dwiari et al. 2008).
2.4.2 Rigor mortis
Pada saat ikan mati, otot ikan seluruhnya dalam keadaan relaksasi dan memiliki tekstur daging yang elastis. Setelah itu, otot ikan mengalami kontraksi yang mengakibatkan tubuh ikan menjadi keras, kaku, dan tidak fleksibel (FAO 1995). Penurunan kelenturan otot terus berlangsung seiring dengan semakin sedikitnya jumlah ATP. Hilangnya kelenturan otot ikan ini akibat ion Ca2+ yang berikatan dengan protein troponin sehingga menyebabkan terjadinya ikatan elektrostatik antara filamen aktin dan miosin (aktomiosin) yang ditandai dengan terjadinya pengkerutan atau kontraksi serabut otot yang tidak dapat balik (irreversible) (Eskin 1990).
Adenosin triposfat merupakan sumber energi tertinggi bagi aktivitas ikan. Setelah ikan mati, ATP diperoleh dari penguraian kreatin fosfat. Kemudian ATP mulai mengalami penguraian ketika kandungan kreatin fosfat dan ATP mencapai titik yang sama. Hidrolisis ATP menjadi ADP dengan bantuan enzim ATPase akan menghasilkan energi. Penguraian tersebut terjadi berdasarkan reaksi berikut ini (Eskin 1990):
ATP + H O 2 ADP + H3PO4
ATPase
Otot ikan ketika baru mati memiliki pH netral atau sedikit basa. Selama
rigor mortis, nilai pH perlahan-lahan turun menjadi 6,2-6,5 karena akumulasi
asam laktat. Kandungan glikogen yang lebih banyak pada otot ikan mati akan memperlambat dan memperpanjang fase rigor mortis (Govidan 1985).
Penguraian ATP berkaitan erat dengan terjadinya rigor mortis. Pada saat
ATP mulai mengalami penurunan, rigor mortis pun mulai terjadi dan mencapai
kejang penuh (full-rigor) ketika kandungan ATP sekitar 1 µmol/g. Energi pada
jaringan otot ikan setelah ikan mati diperoleh secara anaerobik dari pemecahan glikogen melalui proses glikolisis menghasilkan ATP dan asam laktat. Akumulasi asam laktat selain menurunkan pH otot, juga diikuti oleh peristiwa rigor mortis
(Eskin 1990). 2.4.3 Post rigor
Pada saat otot ikan kembali elastis setelah melewati fase rigor mortis
terjadi kenaikan pH ikan secara perlahan-lahan dengan meningkatnya laju perubahan autolitik yang ditandai dengan proses pelunakan daging ikan (Govidan 1985). Pada fase post rigor terjadi pelunakan daging yang disebabkan
aktivitas enzim meningkat sehingga terjadi penguraian daging ikan yang selanjutnya menghasilkan substansi yang baik bagi pertumbuhan bakteri (Dwiari et al. 2008).
Setelah ikan mati, enzim masih mempunyai kemampuan untuk bekerja secara aktif. Namun sistem kerja enzim menjadi tidak terkontrol karena organ pengontrol tidak berfungsi lagi. Akibatnya enzim dapat merusak organ tubuh ikan itu sendiri. Peristiwa ini disebut autolisis. Ciri terjadinya perubahan secara autolisis adalah dengan dihasilkannya amoniak sebagai hasil akhir. Penguraian protein dan lemak karena aktivitas autolisis menyebabkan perubahan rasa, tekstur, dan penampakan ikan (Afrianto & Liviawaty 1989).
Selain terjadi penguraian protein, proses kemunduran mutu ikan juga ditandai dengan terjadinya kerusakan lemak akibat proses oksidasi menghasilkan sejumlah substansi yang dapat menyebabkan timbulnya bau dan rasa tengik yang disebut proses ketengikan. Tingginya kandungan asam lemak tidak jenuh pada daging ikan menyebabkan terjadinya autooksidasi radikal asam lemak tidak jenuh dengan oksigen membentuk senyawa hidroperoksida yang dapat menimbulkan
10
ketengikan. Proses ini dipercepat oleh adanya faktor enzim-enzim lipoksidase, cahaya, dan panas. Senyawa hasil pemecahan hidroperoksida merupakan produk sekunder yang sebagian besar berupa aldehid, keton, alkohol, asam karboksilat, dan alkana yang menyebabkan timbulnya diskolorisasi dan bau tengik pada ikan (FAO 1995).
2.5 Aktivitas Proteolitik Selama Fase Post Mortem Ikan
Aktivitas protease endogenus merupakan masalah serius selama post mortem ikan. Protease endogenus adalah enzim proteolitik yang berasal dari tubuh
ikan itu sendiri (Rondanelli 2002). Penguraian protein daging ikan karena aktivitas enzim proteolitik mengakibatkan daging ikan menjadi lunak, mudah dilepaskan dari tulang, kehilangan elastisitasnya, dan meninggalkan bekas jari pada saat ditekan (Govidan 1985).
Peptida berbobot molekul rendah dan asam-asam amino bebas dihasilkan dari penguraian protein oleh enzim. Aktivitas autolisis juga menyediakan lingkungan yang mendukung untuk pertumbuhan bakteri (FAO 1995). Seluruh proses pelunakan daging ikan selama post mortem diduga adalah hasil aktivitas
protease yang berasal dari sel di dalam daging ikan. Katepsin lisosomal diduga mempunyai peran dalam setiap aktivitas proteolitik dan pelunakan daging ikan selama fase post mortem (Rondanelli 2002).
2.6 Enzim Katepsin
Lisosom diketahui sebagai sumber katepsin yang memiliki peranan dalam perubahan daging ikan selama fase post mortem. Diantara enzim lisosom tersebut,
katepsin B,C, D, L, dan S berhasil dimurnikan dan dikarakterisasi dari daging ikan atau kerang. Jenis katepsin tersebut merupakan protease utama yang berperan dalam pemecahan protein intraseluler (Yamashita & Kanagaya 1990 diacu dalam Rondanelli 2002). Enzim katepsin di dalam tubuh ikan memiliki peranan yang penting selama ikan itu hidup, yaitu berperan dalam metabolisme intraseluler, aktivasi prohormon, proenzim, proalbumin, pembelahan sel, dan pelepasan fibrinogen (Olonen 2004; Otto & Schirmeister 1997).
Katepsin A termasuk jenis eksopeptidase yang memiliki pH optimum 5-6, serta inaktif oleh panas dan alkali (Shahidi & Botta 1994). Katepsin B merupakan
enzim utama pada daging ikan tetapi memiliki aktivitas proteolitik yang lemah dengan protein miosin dan miofibril (Warrier et al. 1988 diacu dalam
Shahidi & Botta 1994). Katepsin B merupakan sistein eksopeptidase yang memiliki berat molekul sebesar 30 kDa dan aktivitas maksimum pada pH 6,0 (Jiang 2000). Katepsin B mampu mendegradasi rantai miosin dengan cepat sementara katepsin L mampu mendegradasi troponin T, dan I, serta C-protein dengan cepat tetapi mendegradasi miosin, aktin dan tropomiosin dengan lambat. Katepsin D yang diisolasi dari daging putih Carassius auratus gibelio memiliki
berat molekul sebesar 38.000-50.000 Da dan pH optimum 3,5. Enzim Katepsin D mampu mendegradasi miosin, aktin, dan tropomiosin tetapi mampu dihambat oleh pepstatin (Dinu et al. 2002). Katepsin L merupakan jenis protease lain yang
sangat aktif dalam mendegradasi protein miofibril. Aktivitas molekular dari katepsin L dengan substrat miosin adalah 10 kali lebih besar dari pada katepsin B. Katepsin L dapat mendegradasi miofibril termasuk aktin, miosin, dan tropomiosin pada pH 6,5 (Shahidi & Botta 1994).
2.7 Peranan Katepsin dalam Kemunduran Mutu
Ketika ikan mati (fase pre rigor), maka kondisi menjadi anaerob dan ATP
terurai oleh enzim yang terdapat di dalam tubuh ikan dengan melepaskan energi. Proses ini kemudian diikuti dengan peristiwa glikolisis yang akan menguraikan glikogen menjadi asam laktat. Pembentukan asam laktat akan menyebabkan terjadinya penurunan pH (Afrianto & Liviawaty 1989). Pada saat pH turun selama proses glikolisis post mortem membuat dinding lisosom melepaskan protease
lisosomal, seperti katepsin B, H, dan L (Etherrington 1984; Jiang et al. 1994
diacu dalam Rondanelli 2002).
Pengaktifan enzim katepsin selanjutnya akan menyebabkan terjadinya penguraian protein menjadi senyawa-senyawa yang lebih sederhana. Hal ini menimbulkan terjadinya akumulasi metabolit dan pembentukan senyawa-senyawa basa volatil yang berakibat terhadap kenaikan pH dan peningkatan jumlah bakteri karena senyawa-senyawa basa tersebut merupakan media yang sangat cocok bagi pertumbuhan bakteri terutama golongan bakteri pembusuk (Lawrie 1985).
12
2.8 Inhibitor Enzim
Mekanisme enzim dalam suatu reaksi, yaitu melalui pembentukan kompleks enzim-substrat (ES). Oleh karena itu, hambatan atau inhibisi pada suatu reaksi yang menggunakan enzim sebagai katalis dapat terjadi apabila penggabungan pada bagian aktif enzim mengalami hambatan. Molekul atau ion yang dapat menghambat reaksi tersebut dinamakan inhibitor (Lehninger 1993). 2.8.1 Mekanisme kerja inhibitor enzim
Hambatan yang dilakukan oleh inhibitor dapat dibagi menjadi dua jenis, yaitu hambatan tidak dapat balik (irraversible) dan hambatan dapat balik
(reversible). Hambatan tidak dapat balik pada umumnya disebabkan karena
terjadinya proses destruksi atau modifikasi sebuah gugus atau lebih yang terdapat pada molekul enzim. Contoh inhibitor tidak dapat balik adalah senyawa
diisopropil fluoro fosfat (DFP) yang menghambat enzim asetilkolinesterase yang
penting di dalam proses transmisi impuls syaraf (Lehninger 1993).
Hambatan dapat balik (reversible) terdiri dari hambatan bersaing
(kompetitif) dan tidak bersaing (non-kompetitif). Hambatan bersaing disebabkan karena ada molekul yang mirip dengan substrat dan dapat pula membentuk kompleks, yaitu kompleks enzim inhibitor (EI). Pembentukan kompleks EI ini sama dengan pembentukan kompleks ES, yaitu melalui penggabungan inhibitor dengan enzim pada bagian aktif enzim sehingga terjadi persaingan antara inhibitor dengan sustrat terhadap bagian aktif enzim. Inhibitor bersaing menghalangi terbentuknya kompleks ES dengan cara membentuk kompleks EI. Berbeda dengan kompleks ES, kompleks EI tidak dapat membentuk produk (P). Ciri inhibitor kompetitif ini adalah penghambatan dapat dibalikkan atau diatasi hanya dengan meningkatkan konsentrasi substrat (Lehninger 1993).
Hambatan tidak bersaing (non-kompetitif) tidak dipengaruhi oleh besarnya konsentrasi substrat dan inhibitor yang melakukannya atau disebut juga inhibitor tidak bersaing. Inhibitor dapat bergabung dengan enzim pada suatu bagian enzim di luar bagian aktif. Penggabungan antara inhibitor dengan enzim bebas menghasilkan kompleks EI, sedangkan penggabungan inhibitor dengan kompleks ES menghasilkan kompleks ESI. Baik kompleks EI maupun ESI bersifat inaktif.
Ini berarti bahwa kompleks tersebut tidak dapat menghasilkan produk reaksi yang diharapkan (Lenhninger 1993).
2.8.2 Inhibitor protease alami
Lebih dari 100 inhibitor protease alami sudah dapat diindentifikasi sejauh ini. Inhibitor protease ini dapat diisolasi dari berbagai organisme seperti bakteri, hewan, dan tanaman. Protease inhibitor terakumulasi dalam jumlah yang tinggi dalam biji tanaman, telur burung, dan berbagai cairan tubuh (Rondanelli 2002). Inhibitor protease pada ikan diperkirakan dapat memberikan perlindungan dari mikroorganisme dan berperan dalam proses embriogenesis pada regulasi pertumbuhan awal embrio. Inhibitor protease seperti sistatin juga berperan sebagai perlawanan untuk melawan protease virus yang dibutuhkan untuk replikasi virus (Ustadi et al. 2005). Beberapa hasil penelitian mengenai isolasi protease inhibitor
dari jaringan ikan dapat dilihat pada Tabel 4.
Tabel 4 Beberapa penelitian mengenai isolasi inhibitor protease dari jaringan ikan Peneliti Bahan Aktivitas dan
karakteristik Keterangan Toyohara et al. (1983) Daging ikan carp Calpastatin memiliki stabilitas yang tinggi sampai 100 ºC Calpastatin dan inhibitor tripsin Cao et al. (2000) Daging ikan croaker Optimum suhu 55 ºC Inhibitor protease serin Ustadi et al. (2005) Telur ikan
glassfish
Stabil pada suhu 50-65 ºC dan pH 8
Inhibitor protease sistein Lie et al. (2008) Plasma ikan
chum salmon - pH 6,0-9,0 - optimum pH 7,0 - suhu 20-40 ºC Inhibitor protease sistein
2.8. 3 Inhibitor katepsin Alami
Enzim proteolitik dapat dibagi menjadi empat kelas berdasarkan daya katalitiknya, yaitu serin, sistein, aspartat, dan logam. Penggolongan enzim ini berdasarkan komponen pada sisi aktifnya. Katepsin lisosomal umumnya termasuk
14
dalam kelompok besar protease sistein. Berdasarkan fungsi biologinya, sistein protease berperan dalam metabolisme intraseluler, aktivasi banyak prohormon dan proenzim. Kerja atau aksi dari protease sistein ini dapat dikendalikan dan dihambat oleh inhibitor alami sama baiknya dengan cara menambahkan logam atau mengatur pH lingkungan (Olonen 2004).
Inhibitor katepsin dapat diperoleh secara alami dari organisme hidup. Inhibitor katepsin alami diantaranya, yaitu sistatin (putih telur), leupeptin (Actinomycetes), pepstatin (streptomyces testaceus), dan α-macroglobulin
(plasma) (Carreno & Cortes 2000). Menurut penelitian Dinu et al. (2002),
inhibitor pepstatin dengan konsentrasi 1 µM mampu menghambat aktivitas katepsin E sampai dengan 98,2 % dan mengambat aktivitas katepsin D sebesar 97,5 %.
Penelitian ini dilaksanakan pada Bulan April 2009 sampai Bulan September 2009 di Laboratorium Karakteristik Bahan Baku Hasil Perikanan, Laboratorium Bioteknologi 2 Hasil Perikanan, Laboratorium Mikrobiologi Hasil Perikanan, Laboratorium Biokimia Hasil Perikanan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan serta Laboratorium Imunologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
3.2 Bahan dan Alat
Bahan-bahan yang digunakan pada penelitian ini terdiri dari bahan utama berupa ikan patin (Pangasius hypophthalmus) hidup yang berasal dari pasar
Laladon, Bogor sebagai sumber inhibitor katepsin dan ikan bandeng (Chanos chanos Forskal) hidup yang berasal dari tambak Salembaran Jaya, Tangerang
yang digunakan untuk pengamatan kemunduran mutu ikan. Bahan-bahan untuk analisis pH (larutan buffer standar pH 4 dan pH 7, akuades), analisis TPC (larutan garam 0,85 % steril, nutrient agar), dan analisis TVB (H3BO3, K2CO3,
trichloroacetic acid (TCA) 7 %, HCl 0,01 N).
Bahan-bahan yang digunakan untuk ekstraksi enzim katepsin adalah buffer tris HCl (pH 7,4) (Lampiran 2a), assay aktivitas enzim dan inhibitor
katepsin (hemoglobin, TCA 5 %, pereaksi folin, tirosin) (Lampiran 3a), dan pengukuran konsentrasi protein enzim (bovine serum albumin (BSA), coomassie brilian blue G-250, etanol 95 % (v/v), asam fosfat 85 % (w/v), dan akuades).
Bahan-bahan untuk ekstraksi inhibitor katepsin adalah akuades, asam sitrat, dan sodium fosfat (Lampiran 2b).
Alat-alat yang digunakan, yaitu inkubator (Thermolyne), oven (Yamato), sentifuse suhu dingin (Sorvall), spektrofotometer UV-Vis (Yamato), mikropipet (Gilson), pipet tip, timbangan analitik (Sartorius), homogenizer (Nissei), pipet volumetrik, bulb, pipet tetes, tabung reaksi, erlenmeyer, pH meter, alumunium
foil, bunsen, beaker glass, dan peralatan gelas lainnya serta peralatan uji
16
3.3 Tahapan Penelitian
Penelitian ini dilakukan dalam tiga tahap. Meliputi penelitian tahap (1), yaitu penentuan suhu optimum ekstraksi inhibitor katepsin, tahap (2) penentuan konsentrasi inhibitor katepsin yang efektif untuk aplikasi, dan tahap (3) aplikasi inhibitor katepsin dalam menghambat kemunduran mutu ikan bandeng.
3.3.1 Penentuan suhu optimum ekstraksi inhibitor katepsin
Penelitian tahap ini bertujuan untuk memperoleh suhu optimum ekstraksi katepsin dari daging ikan patin. Ekstraksi inhibitor katepsin dilakukan pada sampel ikan patin pada kondisi pre rigor. Proses ekstraksi inhibitor katepsin
dilakukan dengan metode An et al. (1995).
Pertama dilakukan preparasi untuk mendapatkan daging ikan. Kemudian daging ikan tersebut dicincang sampai halus dan ditimbang sebanyak 400 gram. Selanjutnya daging ikan yang telah halus ditambahkan dengan akuades sebanyak 400 ml, lalu dihomogenisasikan pada suhu 0-4 ºC. Sampel tersebut kemudian disentrifugasi pada kecepatan 5000 g selama 30 menit. Supernantan yang dihasilkan ditambahkan dengan larutan Mcllvaine’s buffer (0,2 M sodium fosfat dan 0,1 M sitrat, pH 5,5) pada volume yang sama. Campuran ini dibagi dalam empat wadah dengan ukuran yang sama. Masing-masing wadah yang berisi larutan ekstrak diinkubasi pada suhu 60, 70, 80, dan 90 ºC selama 10 menit. Setelah itu ekstrak disentrifugasi kembali dengan kecepatan 7000 g selama 15 menit. Supernatan yang dihasilkan merupakan ekstrak kasar inhibitor katepsin yang siap untuk diukur aktivitas penghambatannya melalui metode analisis menurut Dinu et al. (2002).
3.3.2 Penentuan konsentrasi inhibitor katepsin yang efektif untuk aplikasi
Setelah didapatkan inhibitor dengan suhu ekstraksi yang terbaik maka selanjutnya dilakukan penentuan konsentrasi inhibitor yang efektif dengan cara pengenceran. Pengenceran dilakukan dengan cara mencampurkan larutan ekstrak inhibitor dengan Mcllvaine’s buffer pada perbandingan 1:1, 1:2, dan 1:3. Masing-masing pengenceran inhibitor diukur aktivitas penghambatan dan konsentrasi proteinnya melalui metode analisis menurut Dinu et al. (2002) dan
3.3.3 Aplikasi inhibitor katepsin dalam menghambat kemunduran mutu ikan
bandeng
Setelah didapatkan inhibitor katepsin dari ikan patin dengan konsentrasi pengenceran yang efektif maka selanjutnya dilakukan perendaman ikan bandeng dengan inhibitor katepsin dari ikan patin selama 1 jam pada kondisi suhu chilling
(0-4 ⁰C) sedangkan untuk kontrol digunakan Mcllvaine’s buffer pH 5,5 sebagai
media perendaman. Kemudian dilakukan pengamatan organoleptik setiap 24 jam selama penyimpanan suhu chilling (0-4 ºC) untuk menentukan pola kemunduran
mutu ikan bandeng. Analisis dilakukan pada setiap fase kemunduran mutu ikan yang meliputi uji organoleptik menggunakan score sheet berdasarkan
SNI 01-2346-2006 (BSN 2006), uji nilai pH (Apriyantono et al. 1989), uji total
plate count (TPC) (Fardiaz 1987), dan uji total volatil base (TVB)
(Apriyantono et al. 1989). 3.4 Prosedur Analisis
Analisis yang dilakukan sebelum tahap aplikasi, yaitu assay aktivitas
katepsin, assay aktivitas inhibitor katepsin serta pengukuran konsentrasi protein
enzim dan inhibitor katepsin. Pada tahap aplikasi dilakukan analisis tingkat kesegaran ikan pada setiap fase kemunduran mutu, meliputi penilaian organoleptik, penentuan nilai pH, perhitungan total bakteri dengan menggunakan metode TPC, dan perhitungan TVB .
3.4.1 Assay aktivitas katepsin (Dinu et al. 2002)
Ekstraksi katepsin dilakukan pada sampel ikan bandeng pada fase post rigor. Tahap pertama dilakukan preparasi sampel untuk mendapatkan daging.
Kemudian daging ikan bandeng disuspensikan dalam akuades dengan perbandingan daging ikan dan akuades sebesar 1:1, lalu dihomogenisasikan pada suhu 0-4 ºC. Selanjutnya ekstrak daging hasil homogenisasi ini disentrifugasi pada 1.000 g selama 10 menit dan supernatan yang diperoleh kemudian disentrifugasi lagi pada 10.000 g selama 10 menit. Pellet yang dihasilkan dari sentrifugasi ini kemudian dilarutkan dalam 0,1 M buffer tris HCl 7,4 dengan jumlah yang sama seperti jumlah akuades tadi dan disentrifugasi pada 4.000 g selama 10 menit. Supernatan (ekstrak kasar enzim) yang diperoleh merupakan protein utama dari lisosom yang siap untuk diteliti aktivitasnya lebih lanjut.
18
Aktivitas proteolitik dari katepsin diuji dengan menggunakan hemoglobin terdenaturasi asam sebagai substratnya. Sebanyak 8 % (w/v) hemoglobin dilarutkan dalam akuades dengan perbandingan 1:3. Kemudian pH dibuat menjadi 2,0 dengan HCl 1 N dan konsentrasi akhir hemoglobin dibuat sebesar 2 % (w/v) dengan akuades. Selanjutnya 1 ml dari larutan substrat diinkubasi dengan 0,2 ml larutan enzim pada 37 ºC selama 10 menit. Reaksi dihentikan dengan penambahan 2 ml TCA 5 % (w/v). Campuran disaring dan hasil penyaringan (filtrat) ditambahkan dengan 1 ml pereaksi folin serta diukur absorban pada panjang gelombang 750 nm. Selain itu dilakukan pula pengukuran untuk larutan blanko dan larutan standar dengan prosedur yang sama seperti pada larutan sampel hanya untuk larutan blanko dan larutan standar, larutan enzim diganti dengan akuades dan tirosin (Lampiran 3b). Aktivitas enzim katepsin dapat dihitung dengan rumus berikut :
UA = Absorbansi sampel – absorbansi blanko x P x 1 Absorbansi standar – absorbansi blanko T Keterangan: P = faktor pengenceran; T = waktu inkubasi 3.4.2 Assay aktivitas inhibitor katepsin (Dinu et al. 2002)
Pengujian ini dilakukan dengan mencampurkan 0,1 ml enzim dicampurkan dengan 0,1 ml larutan inhibitor (enzim : inhibitor = 1:1). Kemudian campuran diinkubasi pada 37 ºC selama 30 menit. Setelah itu ditambahkan 0,5 ml substrat hemoglobin terdenaturasi asam dan diinkubasi pada suhu 37 ºC selama 10 menit. Reaksi dihentikan dengan penambahan 2 ml TCA 5 % (w/v). Campuran disaring dan hasil penyaringan (filtrat) ditambah dengan 1 ml pereaksi folin, selanjutnya diukur absorbannya dengan spektrofotometer pada panjang gelombang 750 nm. Selain itu dilakukan pula pengukuran untuk larutan blanko dan larutan standar dengan prosedur yang sama seperti larutan sampel hanya untuk larutan blanko dan larutan standar, enzim diganti dengan akuades dan tirosin (Lampiran 3c). Inhibitor yang digunakan adalah inhibitor katepsin dari ikan patin dan pepstatin
Persentase penghambatan enzim dapat dihitung dengan rumus berikut : % inhibisi = [1-( Aktivitas inhibitor katepsin) x P x 1 ] x 100 %
Aktivitas enzim katepsin T Keterangan:
P = Faktor pengenceran; T = waktu inkubasi
3.4.3 Pengukuran konsentrasi protein enzim dan inhibitor (Bradford 1976)
Konsentrasi protein ditentukan dengan menggunakan metode Bradford dengan bovine serum albumin sebagai standar. Persiapan pereaksi Bradford dilakukan dengan cara melarutkan 25 mg coomasie brilliant blue G-250 dalam
12,5 ml etanol 95 % (v/v), lalu ditambahkan dengan 25 ml asam fosfat 85 % (w/v). Jika telah larut dengan sempurna maka ditambahkan akuades hingga 0,5 liter. Campuran disaring dengan kertas saring Whatman no.1 dan diencerkan lima kali sesaat sebelum digunakan.
Sampel yang diuji untuk penelitian ini adalah enzim dan inhibitor. Konsentrasi protein ditentukan dengan cara 0,1 ml enzim atau inhibitor dimasukkan ke dalam tabung reaksi. Kemudian ditambahkan sebanyak 5 ml pereaksi Bradford, diinkubasi selama lima menit dan diukur absorbannya dengan spektrofotometer pada panjang gelombang 595 nm. Demikian pula untuk larutan standar dilakukan pengujian yang sama seperti larutan sampel hanya sampel diganti dengan bovine serum albumin (BSA). Selain itu dibuat juga blanko dengan cara yang sama seperti larutan sampel dan standar hanya sampel atau BSA diganti dengan akuades. Hasil absorban dari sampel dan standar dikurangi dengan nilai absorban blanko. Nilai ini kemudian dimasukkan ke dalam kurva standar untuk menentukan konsentrasi protein yang terkandung dalam sampel enzim dan inhibitor.
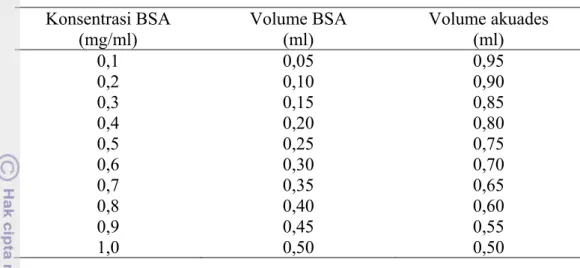
Larutan standar dibuat dengan cara melarutkan 100 mg protein BSA ke dalam 50 ml akuades, sebagai larutan stok dengan konsentrasi 2 mg/ml. Kemudian larutan stok BSA diencerkan menjadi beberapa larutan dengan konsentrasi yang lebih rendah yaitu 0,1-1,0 mg/ml. Komposisi volume larutan dalam pembuatan larutan standar konsentrasi 0,1-1,0 mg/ml dari larutan stok BSA konsentrasi 2 mg/ml disajikan pada Tabel 5.
20
Tabel 5 Pembuatan larutan standar BSA konsentrasi 0,1 – 1,0 mg/ml Konsentrasi BSA (mg/ml) Volume BSA (ml) Volume akuades (ml) 0,1 0,05 0,95 0,2 0,10 0,90 0,3 0,15 0,85 0,4 0,20 0,80 0,5 0,25 0,75 0,6 0,30 0,70 0,7 0,35 0,65 0,8 0,40 0,60 0,9 0,45 0,55 1,0 0,50 0,50 3.4.4 Uji organoleptik (BSN 2006)
Metode yang digunakan untuk uji organoleptik adalah dengan menggunakan score sheet berdasarkan SNI 01-2346-2006 (BSN 2006). Pengujian
organoleptik merupakan cara pengujian yang bersifat subjektif menggunakan panca indera yang ditujukan pada mata, insang, lendir permukaan badan, daging, bau, dan tekstur (Lampiran 1). Pada uji organoleptik ini ada beberapa syarat yang harus dipenuhi oleh seorang panelis (SNI 01-2346-2006), antara lain tertarik dan mau berpartisipasi dalam uji organoleptik, terampil, dan konsisten dalam mengambil keputusan, siap sedia pada saat dibutuhkan dalam pengujian, tidak menolak contoh yang akan diuji, berbadan sehat, bebas dari penyakit THT dan tidak buta warna (psikologis), tidak merokok, serta jumlah panelis minimum untuk satu kali pengujian adalah 15 orang (panelis semi terlatih). Berdasarkan data yang diperoleh, kemudian dilakukan analisis kesegaran ikan dengan kriteria sebagai berikut (SNI 01-2346-2006):
Segar : nilai organoleptik berkisar antara 7-9 Agak segar : nilai organoleptik berkisar antara 5-6 Tidak segar : nilai organoleptik berkisar antara 1-3 3.4.5 Uji nilai pH (Apriyantono et al. 1989)
Nilai derajat keasaman (pH) ditentukan menggunakan alat pH meter yang sebelumnya telah dikalibrasi terlebih dahulu. Alat pH meter dinyalakan dan dibiarkan stabil selama 15-20 menit, kemudian elektroda dibilas dengan larutan buffer atau akuades. Bila menggunakan akuades, elektroda dikeringkan dengan
kertas tisu. Elektroda dicelupkan ke dalam larutan buffer dan didiamkan beberapa saat hingga diperoleh pembacaan yang stabil. Angka pH meter disesuaikan dengan pH buffer, yaitu buffer pH 4 dan buffer pH 7. Daging ikan bandeng
sebanyak 10 gram dihomogenkan dengan 90 ml akuades, lalu dibiarkan ± 15 menit untuk diukur pH-nya.
3.4.6 Uji total plate count (TPC) (Fardiaz 1987)
Prinsip kerja analisis TPC adalah perhitungan jumlah bakteri yang ada di dalam sampel (daging ikan) dengan pengenceran sesuai keperluan dan dilakukan secara duplo. Pembuatan larutan contoh dilakukan dengan mencampurkan 10 gram daging ikan bandeng yang telah dihancurkan lalu dimasukkan ke dalam erlenmeyer yang berisi 90 ml larutan garam fisiologis 0,85 % steril, kemudian dikocok sampai larutan homogen. Campuran larutan contoh tersebut diambil 1 ml dan dimasukkan ke dalam tabung reaksi berisi 9 ml larutan garam 0,85 % (w/v) steril sehingga diperoleh contoh dengan pengenceran 10-2, setelah itu dikocok agar homogen. Banyaknya pengenceran dilakukan sesuai dengan keperluan penelitian, biasanya sampai pengenceran 10-5. Pemipetan dilakukan dari masing-masing tabung pengenceran sebanyak 1 ml larutan contoh dan dipindahkan ke dalam cawan petri steril secara duplo menggunakan pipet steril. Media agar dimasukkan ke dalam cawan petri sebanyak 10 ml dan digoyangkan sampai permukaan agar merata (metode tuang), kemudian didiamkan beberapa saat hingga dingin dan mengeras. Cawan petri yang telah berisi agar dan larutan contoh dimasukkan ke dalam inkubator pada suhu 30 ºC selama 48 jam dengan posisi cawan petri yang dibalik. Selanjutnya dilakukan pengamatan dengan menghitung jumlah koloni yang ada di dalam cawan petri tersebut. Jumlah koloni bakteri yang dihitung adalah cawan petri yang mempunyai koloni bakteri 30-300 koloni.
3.4.7 Uji total volatile base (TVB) (Apriyantono et al. 1989)
Penentuan TVB bertujuan untuk menentukan komponen volatil yang terbentuk akibat proses pembusukan daging ikan. Preparasi sampel dilakukan dengan cara menimbang 15 gram sampel yang diambil dari daging ikan, kemudian ditambahkan 45 ml TCA 7 % (w/v) dan dihomogenkan selama 1 menit. Hasil homogenisasi kemudian disaring sehingga diperoleh filtrat yang berwarna jernih. Setelah penyiapan sampel maka dilakukan uji TVB dengan cara
22
memasukkan 1 ml H3BO3 ke dalam inner chamber cawan conway dan tutup
cawan diletakkan dengan posisi hampir menutupi cawan. Pipet 1 ml yang lain digunakan untuk memasukkan filtrat ke dalam outer chamber di sebelah kiri.
Kemudian 1 ml larutan K2CO3 jenuh ditambahkan ke dalam outer chamber
sebelah kanan sehingga filtrat dan K2CO3 tidak tercampur. Cawan segera ditutup
dengan sebelumnya pinggir cawan diolesi vaselin agar proses penutupan sempurna, lalu digerakkan memutar sehingga kedua cairan di outer chamber
tercampur. Disamping itu dikerjakan blanko dengan prosedur yang sama tetapi filtrat diganti dengan TCA 7 % (w/v). Kemudian kedua cawan Conway tersebut
diinkubasi selama 24 jam pada suhu 37 ºC. Setelah diinkubasi, larutan asam borat dalam inner chamber cawan conway yang berisi blanko dititrasi dengan larutan
HCl 0,01 N dan cawan digoyang-goyangkan sampai larutan asam borat berubah warna menjadi merah muda. Selanjutnya cawan Conway yang berisi sampel juga
dititrasi dengan larutan yang sama dengan blanko. Kadar TVB dapat dihitung dengan menggunakan rumus:
% N (mg N/100 g) = (j – i) x n HCl x 100 x fp x 14 mg N/100 g g contoh 1
Keterangan :
j : ml titrasi sampel fp : faktor pengenceran i : ml titrasi blanko n : normalitas HCl (0,01 N) 3.5 Analisis Data
Hasil yang diperoleh dari pengamatan serta pengukuran terhadap nilai organoleptik, pH, TPC, TVB, aktivitas enzim katepsin, konsentrasi protein enzim, dan inhibitor katepsin dicari nilai rata-ratanya. Nilai rata-rata tersebut dihitung menggunakan rumus berikut (Walpole 1975):
X = Nilai rata-rata n = Jumlah data Xi = Nilai X ke-i n Xi X n i
∑
= = 1Rancangan percobaan yang digunakan untuk tahap penelitian penentuan suhu optimum ekstraksi dan konsentrasi inhibitor yang efektif adalah Rancangan Acak Lengkap (RAL) dengan satu perlakuan dan dua kali ulangan. Perlakuan
yang diberikan ada dua macam, yaitu pertama perlakuan perbedaan suhu untuk penentuan suhu optimum ekstraksi inhibitor katepsin dan kedua, yaitu perlakuan pengenceran inhibitor untuk pengujian aktivitas dan konsentrasi protein inhibitor. Hipotesis yang digunakan adalah:
H0 : pengaruh perlakuan tidak berbeda nyata
H1 : minimal ada 1 perlakuan yang memberikan pengaruh berbeda nyata
Persamaan umum model untuk rancangan tersebut sebagai berikut (Mattjik & Made 2002):
Yij = µ + τ i + εij
Keterangan:
Yij = Nilai pengamatan pada perlakuan ke-I dan ulangan ke-j
µ = Rata-rata umum
τ i = Pengaruh perlakuan ke-i
εij = Pengaruh acak pada perlakuan ke-i dan ulangan ke-j
Analisis data yang digunakan untuk tahap penelitian aplikasi inhibitor katepsin dari ikan patin pada ikan bandeng adalah menggunakan analisis deskriptif dengan membandingkan antara ikan bandeng dengan perendaman inhibitor dan ikan bandeng tanpa perendaman dengan inhibitor (kontrol).
4. HASIL DAN PEMBAHASAN 4.1 Penentuan Suhu Optimum Ekstraksi Inhibitor Katepsin
Penentuan suhu optimum ekstraksi inhibitor katepsin bertujuan untuk mengetahui suhu optimum untuk pemisahan antara kompleks inhibitor dengan enzim katepsin dari ikan patin. Pada penelitian ini ekstraksi inhibitor katepsin berasal dari daging ikan patin dalam kondisi pre rigor atau sangat segar. Pada
kondisi pre rigor atau tepatnya setelah ikan baru memasuki fase post mortem
diduga inhibitor katepsin belum mengalami kerusakan dibandingkan ketika ikan sudah memasuki fase rigor mortis dan post rigor. Proses ekstraksi inhibitor
katepsin dilakukan menurut metode An et al. (1995), inhibitor didapatkan dengan
cara mengekstrak inhibitor katepsin secara langsung dari daging ikan patin. Untuk 400 gram daging ikan patin didapatkan larutan inhibitor sebanyak ± 800 ml. Hasil pengujian aktivitas inhibitor katepsin dari ikan patin pada berbagai suhu ekstraksi dapat dilihat pada Gambar 3.
Gambar 3 Hasil pengujian aktivitas inhibitor katepsin dari ikan patin pada berbagai suhu ekstraksi
Berdasarkan Gambar 3 diketahui bahwa aktivitas inhibitor katepsin tertinggi didapatkan pada suhu ekstraksi 80 ºC dengan nilai inhibisi sebesar 92,88 %. Suhu 80 ºC diduga merupakan suhu optimum untuk pemisahan antara
kompleks inhibitor dengan enzim katepsin. Penggunaan suhu ekstraksi yang sama juga dilakukan oleh Ustadi et al. (2005) pada pemurnian telur ikan glassfish.
Pada suhu ekstraksi 60 dan 70 ºC dihasilkan nilai inhibisi yang lebih rendah dari suhu ekstraksi 80 ºC karena kompleks inhibitor dan enzim belum terlepas secara maksimal. Nilai aktivitas inhibisi pada perlakuan suhu ekstraksi 60 dan 70 ºC berturut-turut, yaitu sebesar 68,46 % dan 85,78 %. Pada suhu ekstraksi ini juga diduga masih terdapat inhibitor lain selain dari golongan inhibitor sistein protease. Menurut Olonen (2004), enzim proteolitik dapat dibagi menjadi empat kelas berdasarkan daya katalitiknya, yaitu serin, sistein, aspartat, dan logam. Penggolongan enzim ini berdasarkan komponen pada sisi aktifnya. Katepsin lisosomal umumnya termasuk dalam kelompok besar protease sistein. Aktivitas protease sistein dapat dihambat dengan inhibitor dari golongan inhibitor protease sistein. Pengolongan enzim sangat penting untuk mengetahui inhibitor yang spesifik.
Selain itu pada suhu ekstraksi 60 dan 70 ºC diduga masih terdapat aktivitas katepsin pada larutan inhibitor. Menurut Jiang (2000), jenis katepsin B, H, dan L mampu aktif pada suhu 50-70 ºC (modori) yang dapat mengakibatkan kerusakan pada pembentukan gel surimi. Adanya aktivitas katepsin pada larutan inhibitor dapat mengakibatkan katepsin di dalamnya ikut bereaksi dengan substrat pada saat pengujian aktivitas.
Inhibitor katepsin tetap menunjukkan aktivitas inhibisi yang tinggi pada suhu ekstraksi 90 ºC, yaitu sebesar 81,73 %. Aktivitas inhibisi pada suhu ekstraksi ini mengalami penurunan jika dibandingkan dengan suhu ekstraksi 80 ºC yang mencapai 92,88 %. Beberapa jenis inhibitor memiliki stabilitas yang tinggi terhadap suhu yang tinggi. Menurut Rondanelli (2002), asam-asam amino yang bersifat hidrofobik, interaksi elektrostatik, dan jembatan sulfida yang terdapat pada struktur inhibitor protease menentukan stabilitas inhibitor tersebut terhadap perubahan kondisi lingkungan. Umumnya sistein protease inhibitor (sistatin) dapat stabil pada suhu tinggi (lebih dari 100 ºC) dan pH ekstrim (pH 2-12) (Otto & Schirmeister 1997). Inhibitor yang digunakan pada penelitian ini merupakan ekstrak kasar yang masih mengandung berbagai jenis inhibitor dan masing-masing inhibitor memiliki stabilitas yang berbeda-beda. Berbagai macam
26
jenis inhibitor ini diduga dapat bereaksi dan menghambat kerja katepsin pada saat pengujian.
Berdasarkan hasil uji ragam (ANOVA) dapat disimpulkan bahwa perlakuan perbedaan suhu ekstraksi memberikan pengaruh yang berbeda nyata terhadap aktivitas inhibisi inhibitor katepsin pada selang kepercayaan 95 % (Lampiran 3a). Hasil uji lanjut menunjukkan bahwa perlakuan suhu ekstraksi 60 ºC memberi pengaruh yang berbeda nyata dengan perlakuan suhu ekstraksi 70 ºC, 80 ºC, dan 90 ºC.
4.2 Penentuan Konsentrasi Inhibitor Katepsin yang Efektif untuk Aplikasi Penentuan konsentrasi inhibitor katepsin dari ikan patin pada berbagai pengenceran dilakukan dengan cara mencampurkan larutan inhibitor katepsin (suhu ekstraksi 80 ºC) dengan larutan Mcllvaine buffer (0,2 M sodium fosfat dan 0,1 M sitrat pH 5,5) pada beberapa perbandingan. Perbandingan larutan inhibitor dengan buffer yang digunakan pada penelitian ini, yaitu 1:0, 1:1, 1:2, dan 1:3. Masing-masing pengenceran diuji aktivitas penghambatannya terhadap enzim katepsin. Adapun aktivitas inhibitor katepsin dari ikan patin yang diperoleh untuk masing-masing pengenceran disajikan pada Gambar 4.
Gambar 4 Hasil pengujian aktivitas inhibitor katepsin dari ikan patin pada berbagai pengenceran
Berdasarkan hasil pengujian pada Gambar 4 diperoleh nilai inhibisi dari inhibitor dengan pengenceran 1:0 (tanpa pengenceran) sebesar 90,20 %, inhibitor
dengan pengenceran 1:1 sebesar 85,29 %, inhibitor dengan pengenceran 1:2 sebesar 70,59 %, dan inhibitor dengan aktivitas terendah didapatkan dari aktivitas inhibitor pengenceran 1:3 sebesar 55,88 %. Menurut hasil pengujian tersebut dapat disimpulkan bahwa proses pengenceran mengakibatkan menurunnya aktivitas inhibisi dari inhibitor yang dihasilkan. Penurunan aktivitas inhibisi ini berkaitan dengan konsentrasi inhibitor yang terkandung di dalam larutan inhibitor. Berdasarkan hasil uji ragam (ANOVA) dapat disimpulkan bahwa perlakuan pengenceran memberikan pengaruh yang berbeda nyata terhadap aktivitas inhibisi inhibitor katepsin pada selang kepercayaan 95 % (Lampiran 3b). Hasil uji lanjut menunjukkan bahwa perlakuan pengenceran 1:1 memberikan hasil yang tidak berbeda nyata terhadap perlakuan pengenceran 1:0 tetapi memberikan pengaruh yang berbeda nyata untuk perlakuan yang lain. Oleh karena itu inhibitor katepsin dengan pengenceran 1:1 dipilih sebagai konsentrasi inhibitor yang paling efektif. Sebagai perbandingan pepstatin 1 µM hasil pengujian didapatkan nilai inhibisi sebesar 86,95 %. Pepstatin merupakan salah satu jenis inhibitor yang mampu menghambat aktivitas katepsin(Carreno & Cortes 2000). Pada penelitian ini juga dilakukan pengukuran konsentrasi protein inhibitor katepsin dari ikan patin (Lampiran 4). Konsentrasi protein inhibitor katepsin dari ikan patin pada berbagai pengenceran dapat dilihat pada Gambar 5.
Gambar 5 Konsentrasi protein inhibitor katepsin dari ikan patin pada berbagai pengenceran
28
Berdasarkan Gambar 5 diketahui bahwa konsentrasi protein inhibitor katepsin semakin menurun dengan meningkatnya pengenceran. Penambahan larutan buffer sebagai media pengencer mengakibatkan konsentrasi protein yang terkandung pada inhibitor berkurang. Konsentrasi protein inhibitor dengan pengenceran 1:0 (tanpa pengenceran) sebesar 1,23 mg/ml, inhibitor dengan pengenceran 1:1 sebesar 0,76 mg/ml, inhibitor dengan pengenceran 1:2 sebesar 0,28 mg/ml, dan inhibitor dengan pengenceran 1:3 sebesar 0,12 mg/ml. Menurut hasil uji ragam (ANOVA) dapat disimpulkan bahwa perlakuan pengenceran memberikan pengaruh yang berbeda nyata terhadap konsentrasi protein inhibitor katepsin pada selang kepercayaan 95 % (Lampiran 3c). Inhibitor katepsin pada penelitian ini berasal dari ekstrak daging ikan patin yang mengandung protein. Menurut BPMHP (1998) diacu dalam Erdiansyah (2006), kadar protein daging ikan patin adalah sebesar 16,10 %.
Inhibitor protease dapat diisolasi dari berbagai organisme seperti bakteri, hewan, dan tanaman. Diketahui bahwa inhibitor alami yang mengatur protease di dalam tubuh organisme ini adalah protein dan hanya beberapa mikroorganisme menghasilkan sedikit komponen inhibitor non-protein untuk menghalangi aktivitas protease dari inang yang diserang. Protease inhibitor terakumulasi dalam jumlah yang tinggi dalam biji tanaman, telur burung, jaringan hewan, dan berbagai cairan tubuh (Rondanelli 2002). Hasil ini juga menjelaskan bahwa inhibitor katepsin yang didapatkan diduga merupakan suatu protein.
4.3 Penentuan Fase Post Mortem Ikan Bandeng
Penentuan fase post mortem ikan bandeng dilakukan untuk mengetahui
dan menilai derajat kesegaran ikan bandeng serta waktu dan lama terjadinya beberapa tahapan kemunduran mutu pada ikan bandeng melalui metode penilaian sensori, yaitu secara organoleptik. Penentuan kesegaran ikan dengan cara ini menekankan pada pengamatan faktor-faktor mutu organoleptik yang dimiliki ikan seperti bau, rupa, cita rasa (flavor), dan tekstur atau konsistensi daging ikan tersebut secara visual (Lampiran 1).
Sebelum dilakukan penentuan tahap post mortem, dilakukan penanganan
ikan bandeng yang diperoleh dari Tambak Salembaran Jaya, Tangerang. Ikan bandeng dibawa dalam kondisi hidup dengan menggunakan kantong plastik
polybag yang berisi air dari tambak dimana ikan dipelihara dan diberi tambahan
oksigen. Ikan bandeng kemudian langsung dimatikan dengan cara menusuk medula oblongatanya.
Ikan bandeng yang baru mati langsung direndam secara bersamaan ke dalam larutan inhibitor dengan pengenceran 1:1 selama 1 jam dalam kondisi suhu
chilling (<5 ºC). Kondisi suhu chilling dilakukan untuk menjaga kesegaran ikan
selama proses perendaman berlangsung dan suhu ini juga dapat menjaga stabilitas inhibitor. Proses yang sama juga dilakukan untuk ikan kontrol, tetapi media perendaman yang digunakan adalah Mcllvaine buffer (0,2 M sodium fosfat dan 0,1 M sitrat, pH 5,5). Kedua proses ini dilakukan secara bersamaan dan ikan yang sudah melalui proses perendaman 1 jam lalu disimpan dalam media tupperware
selama masa penyimpanan suhu chilling (0-4 ºC).
Pengamatan terhadap kondisi post mortem ikan bandeng selama
penyimpanan suhu chilling menghasilkan empat titik untuk dilakukan analisis
pola kemunduran mutu ikan. Pada ikan bandeng dengan perendaman inhibitor dan ikan bandeng tanpa perendaman dengan inhibitor (kontrol), kondisi pre rigor
(sesaat setelah ikan dimatikan) terjadi pada penyimpanan selama 0 jam (0 hari). Fase rigor mortis pada ikan bandeng dengan perendaman inhibitor dan kontrol
dicapai setelah penyimpanan selama 96 jam (4 hari). Fase post rigor untuk ikan
bandeng dengan perendaman inhibitor terjadi setelah penyimpanan selama 365 jam (15 hari) dan ikan bandeng kontrol terjadi setelah penyimpanan selama 360 jam (15 hari). Fase busuk untuk ikan bandeng dengan perendaman inhibitor terjadi setelah penyimpanan selama 576 jam (24 hari) dan ikan bandeng kontrol terjadi setelah penyimpanan selama 504 jam (21 hari).
Fase pre rigor merupakan kondisi pada saat ikan baru mati dan tubuh ikan
memiliki tekstur yang elastis (FAO 1995). Ikan badeng dengan perendaman inhibitor dan kontrol sama-sama mengalami fase pre rigor selama 96 jam (4 hari).
Inhibitor pada fase ini belum bekerja dengan baik karena proses yang paling berperan pada fase ini adalah pembentukan ATP dari ADP dan kreatin fosfat (CP). Pada kondisi pre rigor terjadi penurunan CP secara cepat. Konsentrasi ATP
coba dipertahankan untuk beberapa saat dengan proses resintesis dari ADP dan CP. Namun ketika konsentrasi CP sama dengan ATP maka terjadi proses
30
penurunan ATP dan rigor mortis pun dimulai (Iwamoto et al. (1988) diacu dalam
Wang et al. 1998).
Fase rigor mortis adalah keadaan pada saat otot ikan mengalami kontraksi
yang mengakibatkan tubuh ikan manjadi keras dan kaku (Lawrie 1995). Pada ikan bandeng dengan perendaman inhibitor mengalami fase rigor mortis selama
269 jam (11 hari) dan ikan bandeng kontrol mengalami fase rigor mortis selama
264 jam (11 hari). Ikan bandeng dengan perendaman inhibitor mengalami fase
rigor mortis lebih lama 5 jam dibanding dengan ikan bandeng kontrol. Pada fase
ini diduga kerja inhibitor belum bekerja dengan baik. Lama atau tidaknya fase
rigor mortis ditentukan oleh kandungan glikogen ikan pada saat ikan itu mati
(Govidan 1985).
Fase post rigor terjadi setelah ikan melewati fase rigor mortis, fase ini
ditandai dengan melemasnya daging ikan kembali. Lembeknya daging ikan disebabkan aktivitas enzim yang semakin meningkat sehingga terjadi pemecahan daging ikan yang selanjutnya menghasilkan substansi yang baik bagi pertumbuhan bakteri (Dwiari et al. 2008). Ikan bandeng dengan perendaman
inhibitor mengalami fase post rigor selama 211 jam (9 hari) dan ikan bandeng
kontrol mengalami fase post rigor selama 144 jam (6 hari). Perendaman dengan
inhibitor katepsin dapat memperpanjang fase post rigor ikan bandeng sebanyak
72 jam atau 3 hari lebih lama dibanding ikan bandeng kontrol. Inhibitor katepsin lebih berperan dalam menghambat kemunduran mutu pada saat ikan sudah memasuki fase post rigor.
Menurut hasil penelitian Rustamadji (2009) menunjukkan bahwa aktivitas tertinggi enzim katepsin pada ikan bandeng terjadi pada saat ikan memasuki fase
post rigor. Berdasarkan hal ini dapat diketahui bahwa inhibitor katepsin lebih
terlihat perannya selama ikan memasuki fase post rigor atau pada saat aktivitas
katepsin memiliki aktivitas tertinggi sehingga perannya tidak begitu terlihat pada fase pre rigor dan rigor mortis.
Enzim lisosomal (katepsin) mempunyai peran dalam setiap aktivitas proteolitik dan pelunakan daging ikan selama fase post mortem. Hal ini
dikarenakan enzim ini mendegradasi protein (substrat) yang sama selama fase