5 BAB II
TINJAUAN PUSTAKA
2.1 Definisi dan Jenis Korosi
Korosi logam didefinisikan sebagai peristiwa kerusakan atau penurunan mutu logam akibat berinteraksi dengan lingkungan korosif. Proses korosi dapat berlangsung melalui reaksi kimia secara langsung dan reaksi secara elektrokimia (Dalimunthe, 2004). Pada dasarnya proses korosi adalah pelarutan logam oleh adanya reaksi permukaan logam dengan zat-zat kimia yang terkandung dalam lingkungan logam. Berdasarkan kondisi lingkungan, korosi diklasifikasikan ke dalam korosi basah dan korosi kering. Korosi basah terjadi jika terdapat cairan (larutan) di lingkungan, sedangkan korosi kering terjadi dalam lingkungan yang tidak mengandung cairan, biasanya terjadi pada suhu tinggi, ≥ 200 oC. Contoh korosi dalam medium kering adalah penyerangan logam besi oleh gas oksigen (O2) atau oleh gas belerang dioksida (SO2).
Bentuk-bentuk korosi basah yang mungkin terjadi dapat bersifat merata atau setempat. Bentuk korosi setempat dapat bersifat makroskopik dan mikroskopik. Korosi makroskopik dapat berupa korosi galvanik, korosi celah (crevice), korosi sumuran (fitting), korosi selektif, dan korosi erosi, sedangkan korosi mikroskopik dapat berupa korosi antar-butir (intergranular) dan korosi retak (environmentally induced craking). (Juhanda, 2004)
2.2 Teori Elektrokimia pada Proses Korosi 2.2.1 Reaksi Elektrokimia
Reaksi korosi merupakan proses spontan, besi berusaha mencapai tingkat energi yang lebih rendah. Hasil korosi logam besi mempunyai tingkat energi yang lebih rendah dibandingkan logamnya. Logam mulia seperti emas dan platina mempunyai tingkat energi yang lebih rendah dibandingkan dengan oksidanya. Karena itu logam mulia sukar terkorosi. Di alam, emas dan platina dijumpai dalam bentuk logamnya, sedangkan besi dalam bentuk oksidanya yang berupa bijih besi.
Proses korosi merupakan reaksi elektrokimia yang menyangkut perpindahan elektron dari suatu fasa ke fasa yang lain. reaksi ini dikatakan pula sebagai reaksi oksidasi-reduksi. Logam yang terkorosi mengalami reaksi oksidasi dengan melepaskan elektron, sedangkan di lingkungan terdapat zat lain yang mengalami reaksi reduksi dengan menerima elektron yang dilepaskan oleh logam. Logam besi mengalami reaksi oksidasi di daerah anoda. Dimana logam besi mengalami pelarutan berupa ion-ion :
Fe (s) Fe2+ (aq) + 2e
-selanjutnya ion Fe2+ yang terbentuk akan bergabung dengan ion negatif yang ada di lingkungannya. Hasil reaksi ion logam biasa berupa oksida ataupun hidroksidanya. Seringkali ion Fe2+ berubah ke tingkat oksida yang lebih tinggi :
-Elektron-elektron yang dilepaskan logam Fe selama mengalami reaksi oksidasi diambil oleh senyawa lain yang ada dalam lingkungan untuk mengalami reaksi reduksi. Reaksi reduksi ini berlangsung bersamaan dengan reaksi oksidasi logam. Reaksi reduksi dikatakan pula sebagai reaksi katodik karena berlangsung di daerah katodik. Reaksi reduksi selama proses korosi bergantung pada senyawa yang ada pada lingkungan tersebut.
2.2.2 Korosi dalam Lingkungan yang Mengandung Oksigen
Apabila logam besi terpapar dalam medium air laut atau air tawar yang mempunyai pH mendekati netral maka logam secara spontan akan teroksidasi menurut reaksi:
Fe (s) → Fe2+ (aq) + 2e
-Reaksi katodik yang terjadi pada kondisi ini adalah : H+ (aq) + 2e- → H2 (g)
O2 (g) + 4H2O (l) + 4e- → OH- (aq)
Oleh karena ion-ion klorida, nitrat dan anion lain tidak terlibat dalam reaksi ini, maka keseluruhan reaksi dapat ditulis sebagai berikut :
2Fe (s) + H2O (l) + O2(g) → 2Fe(OH)2 (s)
Senyawa Fe(OH)2 yang dihasilkan akan mengendap pada permukaan logam
membentuk lapisan. Lapisan yang terbentuk bersifat porous sehingga oksigen dapat berdifusi ke dalam lapisan, yang pada gilirannya proses oksidasi akan berlangsung secara perlahan. Fe(OH)2 merupakan senyawa yang kurang stabil,
dengan adanya oksigen, senyawa Fe(OH)2 akan teroksidasi lebih lanjut
membentuk oksida besi yang lebih stabil atau disebut juga karat besi. 2Fe(OH)2 (s) + H2O (l) + ½ O2 (g) → 2Fe(OH)3.nH2O (s)
2.2.3 Korosi dalam lingkungan yang mengandung gas karbon dioksida
Korosi CO2 dapat didefinisikan sebagai kerusakan yang dialami oleh
permukaan logam akibat keberadaan spesi CO2 dalam lingkungannya. Jika logam
yang dimaksud adalah besi, maka dalam lingkungan yang mengandung air jenuh CO2, besi akan terkorosi membentuk besi karbonat. Pengaruh gas CO2 terhadap
korosi diakibatkan karena keasamannya. Hal ini disebabkan CO2 bereaksi dengan
pelarut/air membentuk asam karbonat, H2CO3. Keberadaan H2CO3 dalam larutan
menjadi pemicu terjadinya korosi logam (Videem, 2000)
Besi karbonat akan mengendap dipermukaan logam membentuk lapisan tipis (film). Film dari besi karbonat membentuk kesetimbangan dengan fasa ruahnya, dan ketika sebagian besi karbonat terlarut kembali ke dalam air akan terbentuk besi karbonat yang baru. Pembentukan besi karbonat tersebut akan menyebabkan besi mengalami pelarutan.
Mekanisme reaksi yang menggambarkan korosi besi dapat dituliskan sebagai berikut:
a. CO2 terlarut kedalam air akan menghasilkan CO2 (aq)
CO2 (g) → CO2 (aq)
b. Hidrolisis oleh CO2(aq) menghasilkan asam karbonat
c. Penguraian asam karbonat, H2CO3 menjadikan medium bersifat asam
H2CO3 (aq) → H+ (aq) + HCO3- (aq)
Reaksi pada proses korosi adalah sebagai berikut: Reaksi anodik : Fe (s) → Fe2+
+ 2e -Reaksi Katodik : H+(aq) + 2e- → H2(g)
2HCO3- (aq) + 2e- → H2 (g) + 2CO32-(aq)
Maka reaksi keseluruhannya adalah :
2Fe (s) + 2HCO3- (aq) → 2FeCO3 (s) + H2 (g) + 2e
-Secara umum dapat dikatakan bahwa suatu logam yang terkorosi sama halnya dengan sebuah sel elektrokimia yang terdiri dari anoda, katoda, elektrolit, dan konduktor elektronik (Isdiriayani,1991). Sesuai dengan konvensi bahwa anoda didefinisikan sebagai elektroda tempat berlangsungnya reaksi oksidasi, dan katoda didefinisikan sebagai tempat berlangsungnya reaksi reduksi.
Karena pada reaksi oksidasi selalu terjadi pelepasan elektron, maka peristiwa korosi akan selalu bersamaan dengan reaksi reduksi yang memanfaatkan elektron tersebut. Dengan demikian dapat disimpulkan bahwa reaksi korosi dapat dihambat, baik dari sisi anodik maupun dari sisi katodik bahkan dari kedua sisi katodik-anodik (Isdiriayani, 1991).
2.3 Faktor-faktor yang Mempengaruhi Korosi
Korosi terjadi karena logam berinteraksi dengan lingkungannya. Oleh karena itu, faktor-faktor yang mempengaruhi proses korosi ditentukan oleh logam itu sendiri dan lingkungannya, atau secara umum faktor-faktor yang mempengaruhi korosi dibagi menjadi dua yaitu, faktor internal dan faktor eksternal. Yang termasuk faktor-faktor internal adalah keragaman struktur, perlakuan panas, segregasi, pendinginan, pengerjaan permukaan, dan keberadaan kerak adalah faktor yang selalu ada di dalam logam (Eli, 2006). Sedangkan untuk faktor-faktor eksternal adalah fenomena korosi yang merupakan interaksi elektrokimia yang terjadi antara logam dengan lingkungannya. Lingkungan dalam reaksi elektrokima ini berfungsi sebagai elektrolit yang ikut berperan dalam menentukan kecendrungan terjadinya korosi. Lingkungan tersebut meliputi udara, air, dan tanah.
2.4 Pencegahan Korosi
Metode pencegahan korosi bergantung pada jenis korosi yang dialami oleh material terkorosi. Saat ini ada beberapa metode yang digunakan dalam upaya pencegahan korosi, diantaranya adalah pemilihan material, perubahan lingkungan, pelapisan, dan Proteksi katodik (Callister, 1997). Salah satu metode yang saat ini terus dikaji adalah metode pencegahan korosi dengan menggunakan inhibitor korosi. Selain biayanya yang dinilai relatif murah, prosesnyapun cukup sederhana (Ilim dan Beni, 2008).
2.4.1 Inhibitor Korosi
Inhibitor korosi adalah bahan yang jika ditambahkan ke dalam lingkungan korosif dalam jumlah sedikit terhadap suatu logam atau material dapat menurunkan laju korosi terhadap logam atau material tersebut (Nathan, 1973). Pada prinsipnya pemakaian inhibitor bertujuan untuk mengubah antarmuka antara logam dan lingkungannya dengan cara isolasi satu dan lainnya.
Proses inhibisi dapat dicapai melalui inhibisi antarmuka (interface
inhibition) atau melalui inhibisi antarfasa (interphase inhibition). Inhibisi
antarmuka adalah antaraksi antara molekul inhibitor dan permukaan logam membentuk lapisan pelindung (protective) atau lapisan pasif (pasivation). Inhibisi antarfasa adalah berubahnya lingkungan kimia menjadi tidak korosif akibat pengikatan atau penetralan spesi yang menginduksi korosi, seperti penangkapan oksigen (oxygen scavenging), penetralan gas-gas terlarut yang bersifat asam, atau pengaturan pH. (Tran, 1991)
Inhibitor korosi dapat diklasifikasikan berdasarkan mekanisme proteksi, seperti: (1) inhibitor anodik, (2) inhibitor katodik, (3) inhibitor campuran, dan (4) inhibitor teradsorpsi.
• Inhibitor Anodik
Inhibitor anodik disebut juga inhibitor antarmuka. Inhibitor jenis ini dapat menurunkan laju korosi dengan cara menghambat transfer ion-ion logam ke dalam larutan ruah. Hal ini terjadi karena berkurangnya daerah anoda akibat pasivasi.
• Inhibitor Katodik
Inhibitor katodik disebut juga inhibitor antarfasa. Inhibitor jenis ini dapat menurunkan laju korosi dengan cara menghambat salah satu tahap dari proses katodik, seperti pembebasan ion-ion hidrogen atau penangkapan gas oksigen.
• Inhibitor Campuran
Inhibitor campuran menurunkan laju korosi dengan cara menghambat proses katodik dan anodik secara bersamaan. Pada umumnya, inhibitor komersial berfungsi ganda, yakni sebagai inhibitor katodik dan anodik.
• Inhibitor Teradsorpsi
Inhibitor teradsorpsi adalah jenis inhibitor dari golongan senyawa organik yang dapat mengisolasi permukaan logam dari lingkungan korosif melalui pembentukan lapisan teradsorpsi, sehingga dapat menurunkan laju korosi. Terjadinya adsorpsi akibat dari sifat muatan atau kepolaran molekul atau spesi ion organik yang membentuk lapisan permukaan secara fisikosorpsi dan distabilkan melalui kemisorpsi.
Antaraksi inhibitor teradsorpsi dengan permukaan logam dapat terjadi melalui: (1) pembentukan penghalang secara fisika, (2) isolasi langsung situs-situs anodik dan katodik, atau (3) berantaraksi dengan antarmediasi reaksi korosi.
2.4.2 Mekanisme Kerja Inhibitor
Mekanisme kerja inhibitor korosi dapat dibedakan sebagai berikut :
tipis dengan ketebalan beberapa molekul inhibitor. Lapisan ini tidak dapat dilihat oleh kasat mata, tetapi dapat menginhibisi serangan terhadap logam.
2. Melalui pengaruh lingkungan (misalkan pH) yang menyebabkan inhibitor dapat mengendap, selanjutnya teradsorpsi pada permukaan logam dan melindunginya dari serangan korosi. Endapan yang terjadi cukup banyak, sehingga lapisan yang terjadi dapat dilihat oleh mata. 3. Inhibitor lebih dulu mengkorosi logam dan menghasilkan suatu zat
kimia yang kemudian melalui peristiwa adsorpsi dari produk korosi tersebut membentuk suatu lapisan pasif pada permukaan logam.
4. Inhibitor menangkap konstituen yang agresif dari lingkungannya. Berdasarkan sifat korosi logam secara elektrokimia, inhibitor dapat mempengaruhi polarisasi anodik dan katodik. Jika suatu sel korosi dapat dianggap terdiri dari empat komponen yaitu: anoda, katoda, elektrolit, dan penghantar elektronik, maka inhibitor korosi memberikan kemungkinan kenaikan polarisasi anodik atau menaikkan polarisasi katodik atau menaikkan tahanan listrik dari rangkaian melalui pembentukan selaput tipis pada permukaan logam. Mekanisme kerja inhibitor korosi tersebut dapat diukur melaui beberapa metode yaitu: dengan pengukuran kehilangan berat, pengukuran polarisasi potensiodinamik, dan pengukuran impedansi.
2.5 Bahan Alam sebagai Alternatif Inhibitor Korosi
Pada umumnya inhibitor korosi berasal dari senyawa-senyawa organik dan anorganik mengandung gugus-gugus yang memiliki pasangan elektron bebas, seperti nitrit, kromat, fospat, urea, fenilalanin, imidazolin, dan senyawa-senyawa amina. Tetapi pada kenyataanya bahan kimia sintesis ini merupakan bahan kimia yang relatif berbahaya, harganya relatif mahal, dan tidak ramah lingkungan (Sinly, dkk, 2008). Oleh karena itu, penggunaan inhibitor yang aman, mudah didapatkan, bersifat biodegradable, biaya murah, dan ramah lingkungan sangat diperlukan.
Syarat umum suatu senyawa yang dapat digunakan sebagai inhibitor korosi logam adalah senyawa-senyawa yang mampu membentuk kompleks baik kompleks terlarut maupun kompleks yang mengendap. Untuk itu perlu gugus fungsi yang mengandung atom-atom yang mampu membentuk ikatan kovalen koordinasi, seperti atom nitrogen, belerang, pada suatu senyawa tertentu. (Dalimunthe, 2004).
Kenyataanya senyawa-senyawa yang menjadi syarat di atas banyak ditemukan di alam. Dari beberapa hasil penelitian seperti Fraunhofer (1996) (dalam Sinly, 2008), diketahui bahwa ekstrak daun tembakau, teh dan kopi dapat efektif sebagai inhibitor pada sampel logam besi, tembaga, dan alumunium dalam medium larutan garam.
Salah satu senyawa yang terkandung dalam tumbuhan seperti teh yang berpotensi menjadi inhibitor korosi adalah tanin. Dasar pemikiran bahwa tanin
dapat berpotensi sebagai inhibitor korosi karena tanin dapat membentuk kelat dengan logam-logam seperti besi dan lain-lain (Hagerman, 2002).
2.6 Tanin
Tanin merupakan senyawa organik yang mengandung gugus polifenol yang terdapat dalam hampir semua jenis tanaman baik pada bagian kulit kayu, buah, daun, maupun akarnya. Pada angiospermae terdapat secara khusus dalam jaringan kayu. Tanin adalah senyawa penolik yang larut dalam air, gliserol, metanol, hidroalkoholik, propilena glikol, tetapi tidak larut dalam benzena kloroform, eter, dan karbon disulfida (Hilyatuzzahroh, 2006)
Umumnya tanin berasal dari senyawa-senyawa fenol alam yang memiliki kemampuan mengendapkan protein melalui pembentukan kopolimer mantap yang tidak larut dalam air, dan dapat mengubah kulit hewan mentah menjadi siap pakai akibat kemampuannya dalam menyambung ikatan silang protein. Sifat fisik dan kimia lainnya adalah mempunyai rasa sepat, sehingga ternak selalu menghindar dari tanaman yang mengandung tanin. Tanin juga bersifat sebagai anti bakteri dan astrigen atau menciutkan dinding usus yang rusak akibat asam atau bakteri (Harbone, 1987).
Kristal tanin berwarna putih-kuning sampai coklat muda, jika terkena sinar matahari akan teroksidasi menjadi coklat tua (Hilyatuzzahroh, 2006). Tanin dapat membentuk endapan dengan garam logam seperti besi, kromat, alumunium, dan timah sehingga peristiwa ini digunakan dalam industri tinta, cat, dan pewarna kain. Selain itu, tanin juga merupakan senyawa yang efektif untuk penyerapan
logam-logam berat termasuk uranium (Subiarto, 2000). Ditinjau dari struktur kimianya, tanin memiliki rumus empiris yang dapat ditulis sebagai C14H14O11
dengan berat molekul antara 500-3000. Tanin juga dibedakan ke dalam dua bagian yaitu, tanin terkondensasi atau tanin katekin dan tanin terhidrolisis.
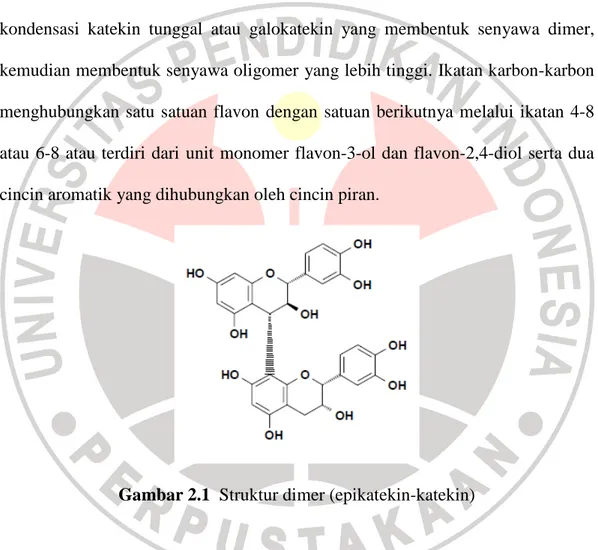
Tanin terkondensasi atau katekin terjadi melalui biosintesis dengan cara kondensasi katekin tunggal atau galokatekin yang membentuk senyawa dimer, kemudian membentuk senyawa oligomer yang lebih tinggi. Ikatan karbon-karbon menghubungkan satu satuan flavon dengan satuan berikutnya melalui ikatan 4-8 atau 6-8 atau terdiri dari unit monomer flavon-3-ol dan flavon-2,4-diol serta dua cincin aromatik yang dihubungkan oleh cincin piran.
Gambar 2.1 Struktur dimer (epikatekin-katekin)
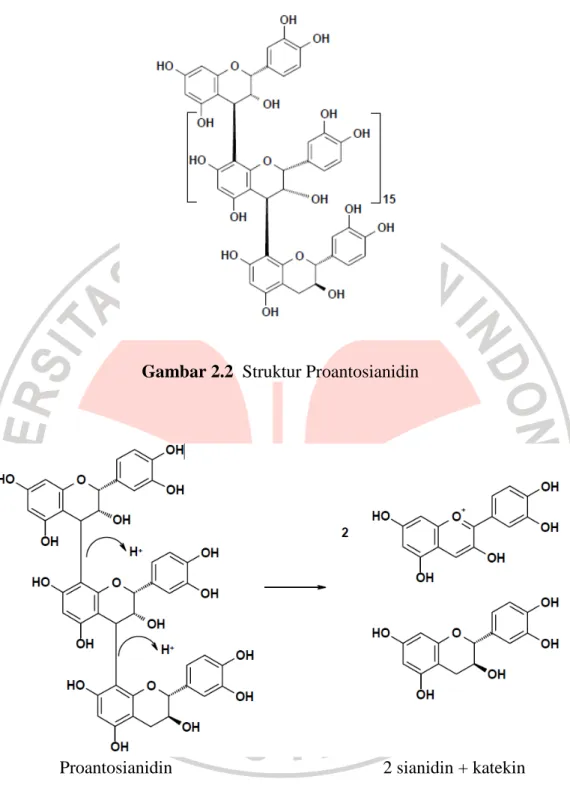
Nama lain untuk tanin terkondensasi adalah proantosianidin, karena jika direaksikan dengan asam panas, beberapa ikatan karbon penghubung satuan putus dan dibebaskan monomer antosianidin (Harbone, 1987).
Gambar 2.2 Struktur Proantosianidin
Proantosianidin 2 sianidin + katekin Gambar 2.3 Monomer Antosianidin
Monomer tanin adalah digalic acid dan D-glukosa. Ekstrak tanin terdiri dari campuran senyawa polifenol yang sangat kompleks dan biasanya tergabung
dengan karbohidrat rendah. Tanin terkondensasi sangat reaktif terhadap formaldehid dan dapat membentuk produk kondensasi yang berguna untuk bahan perekat termosetting, yakni suatu material yang tahan terhadap air dan panas (Hilyatuzzahroh, 2006).
Tanin terhidrolisis umumnya ditemukan dalam tumbuhan berkeping dua. Tanin terhidrolisis merupakan senyawa ester dari gula sederhana. Ikatan ester tersebut dapat terhidrolisis jika dididihkan dalam asam klorida encer. Hidrolisis dengan asam atau enzim akan menghasilkan asam galat dan asam elegat yang merupakan bentuk dimer dari asam galat (Hilyatuzzahroh, 2006). Tanin terhidrolisis terbagi ke dalam dua kelas yaitu, galotanin (ester asam galat dan glukosa) dan elegitanin (ester asam heksadihidroksidifenat dan glukosa) (Harbone, 1987). Salah satu contoh galotanin yang banyak ditemukan dalam beberapa spesies tumbuhan adalah acertanin (Hagerman, 2002):
Gambar 2.4 Acertanin
2.7 Metode Pengukuran Korosi
2.7.1 Metode kehilangan berat (weight loss)
Pada metoda kehilangan berat (weight loss method) ini, sampel baja karbon ditimbang beratnya, baik tanpa inhibitor maupun dengan adanya inhibitor. Selisih berat baja karbon merupakan indikator adanya korosi baja karbon. Laju korosi ditentukan berdasarkan persamaan berikut:
DAT Wt
Vkor =1,44* (2.1)
dengan Vkor adalah laju korosi baja karbon (mm.th-1), Wt adalah kehilangan berat (mg), D adalah massa jenis baja karbon (g.cm-3), A adalah luas baja karbon yang terpapar (dm2), T adalah waktu (hari) (Eli, 2006).
Efektifitas inhibisi korosi dinyatakan dengan persen efisiensi, EI(%), yaitu selisih laju korosi tanpa inhibitor dan dengan adanya inhibitor dibandingkan dengan laju korosi tanpa inhibitor melalui persasamaan berikut:
(2.2)
Dengan EI menyatakan persen inhibisi (%), Wt(0) dan Wt(inh) adalah pengurangan baja karbon tanpa inhibitor dan adanya inhibitor. Suatu inhibitor dinyatakan efektif jika efisiensinya mencapai 90% untuk konsentrasi inhibitor 40 ppm atau mencapai 95% untuk konsentrasi 80 ppm (Roberge, 1990).
2.7.2 Metode Polarisasi Potensiodinamik
Salah satu teknik untuk menentukan perilaku korosi logam berdasarkan hubungan potensial dan arus anodik atau katodik adalah metode polarisasi
potensiodinamik (Sunarya, 2008). Jika anoda dan katoda yang ada dalam suatu elektrolit terhubung singkat, maka reaksi-reaksi anodik dan katodik akan berlangsung secara serempak, disebabkan terbentuknya sistem mikrosel elektrokimia. Korosi logam terjadi jika terdapat arus anodik yang besarnya sama dengan arus katodik, walaupun tidak ada arus yang diberikan dari luar sistem. Hal ini disebabkan karena adanya beda potensial antara logam dan larutan elektrolit sebagai lingkungannya. Beda potensial ini dinamakan dengan potensial korosi (Ekor) (Sunarya, 2008).
Beda halnya jika ke dalam sitem dialirkan arus searah (DC) dari luar sistem, maka akan mempengaruhi potensial sel. Sehingga ada kecendrungan potensial logam menjadi lebih positif atau lebih negatif dibandingkan dengan potensial korosinya. Maka perubahan potensial pada logam ini dinamakan dengan polarisasi atau potensial lebih.
Ada dua macam jenis polarisasi yaitu, polarisasi anodik dan polarisasi katodik. Kedua polarisasi ini akan diterjemahkan ke dalam persamaan Tafel menjadi tetapan Tafel anodik (βa) dan tetapan Tafel katodik (βc).
Tahanan polarisasi (Rp) merupakan ketahanan spesimen terhadap oksidasi selama diberi arus dari luar. Penggunaan tahanan polarisasi yang paling utama adalah menentukan laju korosi. Laju korosi akan diperoleh berdasarkan kemiringan kurva potensial sebagai fungsi rapat arus di sekitar potensial korosinya.
Jika proses korosi logam dikendalikan oleh transfer muatan, maka Ekor dan arus korosi Ikor dapat ditentukan dari perpotongan garis Tafel anodik dan garis
Tafel katodik. Akan tetapi terlebih dahulu harus ditentukan nilai Ikor dan konstanta Tafel dari kurva polarisasi.
Gambar 2.5 Plot Tafel
Kelebihan dari penggunaan metode ini selain dapat menentukan laju korosi, Vkor, juga dapat mengukur tahanan polarisasi (Rp) dan kerapatan arus korosi, Ikor dengan cepat serta kecendrungan logam untuk mengalami salah satu bentuk korosi juga dapat diramalkan.
Untuk menentukan kerapatan arus korosi, Ikor, dapat diketahui dari tetapan Tafel anodik βa, tetapan Tafel katodik βc, dan tahanan polarisasi, Rp pada baja karbon. Nilai Ikor ditentukan dengan menggunakan persaman :
(2.3)
Laju korosi ditentukan dari nilai kerapatan arus korosi melalui persamaan berikut:
(2.4) log iap P o te n si a l (-) (+) Ekor EM/M+ EH+/H2 Ikor
dimana Vkor merupakan laju korosi (mm.th-1), Ae adalah massa ekivalen logam (g.mol-1.ek-1), Ikor adalah rapat arus korosi (µA.cm-2), dan adalah massa jenis logam yang diukur (g.cm-3) (Sunarya, 2008).
2.7.3 Metode Spektroskopi impedansi elektrokimia (EIS)
Spektroskopi impedansi elektrokimia (electrochemical impedance
spectroscopy, EIS) adalah suatu metoda untuk menganalisis respon suatu
elektroda terkorosi terhadap sinyal potensial AC pada amplitudo rendah (∼10 mV) dari rentang frekuensi yang sangat lebar. Pada prinsipnya, EIS digunakan untuk menentukan parameter kinetika elektrokimia berkaitan dengan unsur-unsur listrik seperti tahanan, R, kapasitansi, C, dan induktansi, L (Jones, 1992).
Tahanan listrik dalam EIS dinyatakan dengan impedansi (Z). Impedansi adalah ukuran kemampuan suatu rangkaian dalam menahan aliran arus listrik. Dalam impedansi, sinyal potensial dan arus AC berada dalam fase berbeda, dan nilainya dipengaruhi oleh frekuensi. Impedansi elektrokimia diukur melalui potensial AC yang diterapkan pada sel elektrokimia untuk mengukur arus dengan asumsi bahwa potensial yang dibangkitkan adalah sinusiodal. Dalam fungsi kompleks, impedansi dapat diungkapkan dalam bentuk impedansi real, Zr dan impedansi imajiner (imaginary), Zi, yaitu sebagai berikut:
(2.5) Jika impedansi bagian real dialurkan pada sumbu-x dan bagian imajiner pada sumbu-y akan diperoleh aluran Nyquist, yang menyatakan aluran impedansi imajiner sebagai fungsi impedansi real dari
ω
→
0 sampaiω
→
∞
. Padaω
→
∞
,nilai Zr = Rs (tahanan larutan). Pada
ω
→
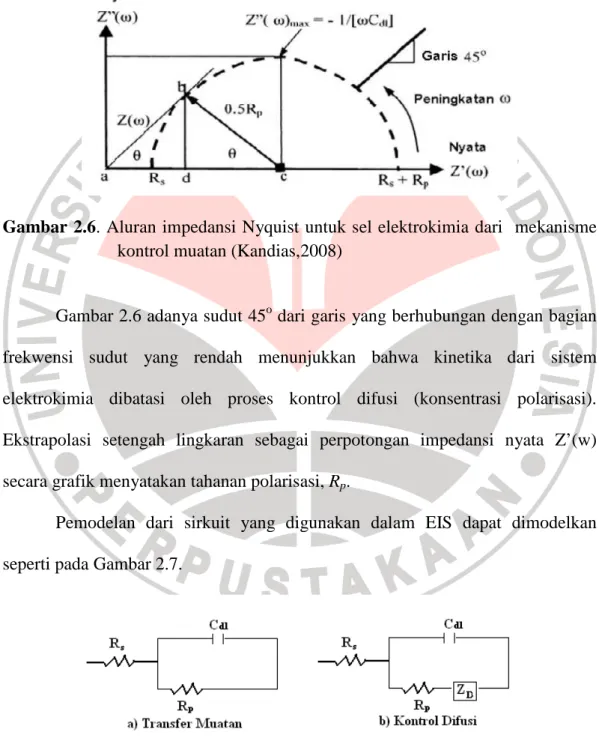
0, nilai Zr = Rs + Rp, dengan Rp adalah tahanan polarisasi. Aluran Nyquist membentuk setengah lingkaran dengan kenaikan frekuensi berlawanan arah jarum jam, seperti tampak pada Gambar 2.6.Gambar 2.6. Aluran impedansi Nyquist untuk sel elektrokimia dari mekanisme kontrol muatan (Kandias,2008)
Gambar 2.6 adanya sudut 45o dari garis yang berhubungan dengan bagian frekwensi sudut yang rendah menunjukkan bahwa kinetika dari sistem elektrokimia dibatasi oleh proses kontrol difusi (konsentrasi polarisasi). Ekstrapolasi setengah lingkaran sebagai perpotongan impedansi nyata Z’(w) secara grafik menyatakan tahanan polarisasi, Rp.
Pemodelan dari sirkuit yang digunakan dalam EIS dapat dimodelkan seperti pada Gambar 2.7.
Model pada Gambar 2.7 menunjukkan bahwa potensial yang digunakan pada sirkuit dan respon hantaran sebagai sinyal frekwensi dijadikan sebagai data impedansi. Data impedansi dihubungkan dengan tahap perubahan sudut dan variasi potensial serta luas hantaran. Gambar 2.7(a) merupakan tahanan larutan (Rs), tahanan transfer muatan (Rct), dan kapasitansi lapis rangkap (Cdl) yang digunakan dalam sirkuit sederhana. Jika sistem elektrokimianya merupakan kontrol difusi, Gambar 2.7(b), maka impedansi difusi (ZD) dimasukkan dalam
rangkaian sirkuit dan disebut sebagai impedansi Warburg.
Dengan menggunakan metode EIS ini dapat ditentukan efektivitas inhibisi melalui persamaan berikut:
(2.6)
dengan dan berturut-turut adalah tahanan transfer muatan tanpa inhibitor dan dengan inhibitor.