INTISARI
Dewasa ini, paparan radikal bebas makin meningkat yang disebabkan oleh antara lain polusi udara. Paparan radikal bebas tersebut merupakan masalah serius yang dapat membawa banyak dampak negatif bagi kesehatan. Karena itu, dibutuhkan antioksidan sebagai penangkal radikal bebas. Senyawa fenolik merupakan salah satu golongan senyawa yang berhubungan dengan aktivitas antioksidan. Adas (Foeniculum vulgare Mill.) memiliki kandungan fenolik utama berupa kuersetin dan glikosida kamferol. Penelitian ini bertujuan menentukan kandungan fenolik total dan nilai aktivitas antioksidan fraksi etil asetat ekstrak etanolik daun adas.
Penentuan aktivitas antioksidan fraksi etil asetat ekstrak etanolik daun adas dilakukan dengan metode DPPH (1,1-Diphenyl-2-pycrylhydrazyl). Reaksi antara DPPH dan senyawa antioksidan akan mengubah warna larutan DPPH dari ungu menjadi kuning. Nilai aktivitas antioksidan dinyatakan dengan IC50, yang menunjukkan konsentrasi senyawa antioksidan yang dibutuhkan untuk menangkap radikal bebas sebesar 50%. Penentuan kandungan fenolik total dilakukan dengan metode Folin-Ciocalteu, yang hasilnya dinyatakan sebagai massa ekivalen asam galat.
Hasil penelitian menunjukkan bahwa fraksi etil asetat ekstrak etanolik daun adas memiliki kandungan fenolik total sebesar 4,88 + 0,09 mg ekivalen asam galat per g fraksi etil asetat dan nilai IC50 sebesar 218,63 + 5,85 μg/mL. Nilai aktivitas antioksidan fraksi etil asetat ekstrak etanolik daun adas termasuk kategori lemah.
ABSTRACT
In this era, there is an increasing in the amounts of free radical that caused by air polution. It has become a serious problem that can damage our health. Therefore, antioxidant is needed as free radical scavenging. Phenolic compound is a kind of compounds that have antioxidant activity. Fennel (Foeniculum vulgare Mill.) has quercetin and caempferol glycoside as the main total phenolic contents. This study will determine the total phenolic contents and antioxidant activity in ethyl acetate fraction of fennel leaves ethanolic extract.
The antioxidant activity is determined by using DPPH (1,1-Diphenyl-2-pycrylhydrazyl) method. The reaction between DPPH and antioxidant compounds will change the colour from purple to yellow. The antioxidant activity is presented by IC50, which is state the concentration of antioxidant that is needed to reduce
50% of free radical activity. The total phenolic contents are determined by using Folin-Ciocalteu method and the results are presented as mg eqivalent gallic acid.
The results of this study show that the total phenolic contents of ethyl acetate fraction of fennel leaves ethanolic extract is 4.88 + 0.09 mg eqivalent gallic acid per gram fraction and the IC50 is 218.63 + 5.85 μg/mL. It is belonging
to the weak antioxidant activity.
PENETAPAN KADAR FENOLIK TOTAL DAN UJI AKTIVITAS ANTIOKSIDAN FRAKSI ETIL ASETAT EKSTRAK ETANOL DAUN
ADAS (Foeniculum vulgare Mill.) MENGGUNAKAN METODE DPPH
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh: Benny Ade Saputra
NIM : 098114114
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
PENETAPAN KADAR FENOLIK TOTAL DAN UJI AKTIVITAS ANTIOKSIDAN FRAKSI ETIL ASETAT EKSTRAK ETANOL DAUN
ADAS (Foeniculum vulgare Mill.) MENGGUNAKAN METODE DPPH
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh: Benny Ade Saputra
NIM : 098114114
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
HALAMAN PERSEMBAHAN
Apapun hal positif yang kita lakukan, anggaplah itu sebagai bentuk balas jasamu terhadap orang-orang yang selama ini mengasihimu. Anggaplah Kau akan mempersembahkan usaha dan hasilnya kepada mereka. Dengan demikian, Kau akan memiliki
kesungguhan dalam melakukannya.
Kupersembahkan karya ini untuk: Ibu, Bapak, dan segenap keluarga besarku, tercurah segenap hormat dan baktiku.
vii
PRAKATA
Puji syukur Penulis haturkan kepada Tuhan yang telah memberikan rahmat dan berkat-Nya sehingga Penulis dapat menyelesaikan skripsi yang berjudul “Penetapan Kadar Fenolik Total dan Uji Aktivitas Antioksidan Fraksi Etil Asetat Ekstrak Etanol Daun Adas (Foeniculum vulgare Mill.) Menggunakan Metode DPPH”. Skripsi ini disusun dalam rangka memenuhi salah satu syarat yang diwajibkan untuk memperoleh gelar Sarjana Farmasi (S. Farm) di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Penulis menyadari bahwa terselesaikannya skripsi ini tidak terlepas dari bimbingan, bantuan, serta dukungan dari berbagai pihak. Dalam kesempatan ini, dengan segala kerendahan hati, Penulis ingin menyampaikan rasa terima kasih kepada:
1. Bapak Ipang Djunarko, M.Sc., Apt., selaku Dekan Fakultas Farmasi Universitas Sanata Dharma.
2. Bapak Prof. Dr. C.J. Soegihardjo, Apt., selaku Dosen Pembimbing yang telah berkenan memberikan bimbingan kepada Penulis hingga selesainya skripsi ini.
3. Bapak Yohanes Dwiatmaka, M.Si., selaku Dosen Penguji yang telah berkenan memberikan kritik dan saran demi penyempurnaan skripsi ini.
viii
5. Segenap staf pengajar, laboran, dan karyawan Fakultas Farmasi, atas bantuan, dukungan, serta kerja sama yang telah terjalin baik selama ini.
6. Rekan-rekan seperjuanganku, yang telah berjuang bersama dengan Penulis menyelesaikan skripsi ini; serta sahabat-sahabatku, terima kasih atas dukungan, bantuan, semangat, dan kebersamaan kita dalam suka maupun duka selama ini.
7. Rekan-rekan mahasiswa Fakultas Farmasi, khususnya angkatan 2009, terima kasih untuk kebersamaan dan dukungannya selama ini.
8. Semua pihak yang tidak dapat Penulis sebutkan satu persatu yang telah memberikan dukungan dan bantuan sehingga Penulis dapat menyelesaikan skripsi ini.
Penulis menyadari bahwa masih terdapat banyak kekurangan dalam penyusunan skripsi ini. Segala saran dan kritik yang bersifat membangun akan Penulis terima dengan senang hati.
Akhir kata, Penulis berharap semoga skripsi ini dapat bermanfaat bagi pihak-pihak yang membutuhkan dan dapat memberikan sumbangan bagi kemajuan ilmu pengetahuan, khususnya dalam bidang kefarmasian.
ix
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... v
PERNYATAAN KEASLIAN KARYA ... vi
PRAKATA ... vii
DAFTAR ISI ... ix
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
INTISARI ... xvi
ABSTRACT... xvii
BAB I PENDAHULUAN ... 1
A.Latar Belakang ... 1
1. Permasalahan ... 3
2. Keaslian penelitian ... 3
x
B.Tujuan ... 5
1. Tujuan umum ... 5
2. Tujuan khusus ... 5
BAB II PENELAAHAN PUSTAKA ... 6
A.Adas (Foeniculum vulgare Mill.) ... 6
B.Senyawa Fenolik ... 7
C.Ekstraksi ... 9
D.Antioksidan ... 11
E. Metode DPPH (1,1-Difenil-2-Pikrilhidrazil) ... 14
F. Metode Folin-Ciocalteu ... 15
G.Landasan Teori ... 16
H.Hipotesis ... 17
BAB III METODE PENELITIAN ... 18
A.Jenis dan Rancangan Penelitian ... 18
B.Variabel ... 18
1. Variabel bebas ... 18
2. Variabel terikat ... 18
3. Variabel pengacau terkendali ... 18
4. Variabel pengacau tak terkendali ... 18
C.Definisi Operasional ... 19
1. Daun adas ... 19
2. Ekstrak daun adas ... 19
xi
4. Persen Inhibition Concentration (%IC) ... 19
5. Inhibition Concentration 50 (IC50) ... 19
D.Bahan dan Alat Penelitian ... 20
1. Bahan ... 20
2. Alat ... 20
E. Tata Cara Penelitian ... 20
1. Determinasi tanaman ... 20
2. Pengumpulan bahan ... 20
3. Preparasi sampel ... 21
4. Pembuatan larutan DPPH, pembanding, dan uji ... 21
5. Uji pendahuluan ... 22
6. Penentuan kandungan fenolik total ... 23
7. Optimasi metode uji antioksidan ... 24
8. Pengukuran absorbansi larutan kontrol, pembanding, dan uji ... 24 F. Analisis Hasil ... 25
BAB IV HASIL DAN PEMBAHASAN ... 26
A.Hasil Determinasi Tanaman ... 26
B.Hasil Pengumpulan Bahan ... 26
C.Hasil Uji Pendahuluan ... 27
1. Uji pendahuluan senyawa fenolik ... 27
2. Uji pendahuluan aktivitas antioksidan ... 28
xii
1. Penentuan Operating Time (OT) ... 29
2. Penentuan panjang gelombang maksimum ... 30
E. Hasil Estimasi Kandungan Senyawa Fenolik Total ... 31
F. Hasil Optimasi Uji Aktivitas Antioksidan ... 34
1. Penentuan Operating Time (OT) ... 34
2. Penentuan panjang gelombang maksimum ... 36
G.Hasil Uji Aktivitas Antioksidan ... 37
BAB V KESIMPULAN DAN SARAN ... 42
A.Kesimpulan ... 42
B.Saran ... 42
DAFTAR PUSTAKA ... 43
LAMPIRAN ... 46
xiii
DAFTAR TABEL
Halaman Tabel I. Tingkat kekuatan antioksidan dengan metode DPPH
(Ariyanto cit., Widodo dan Soegihardjo, 2012) ... 15 Tabel II. Hasil pengukuran panjang gelombang maksimum untuk
penetapan kadar asam galat ... 31 Tabel III. Persamaan regresi linier dari baku asam galat ... 33 Tabel IV. Kandungan senyawa fenolik total fraksi etil asetat ekstrak
etanolik daun adas ... 33 Tabel V. Hasil penentuan panjang gelombang maksimum DPPH .... 36 Tabel VI. Hasil uji aktivitas antioksidan rutin dengan metode DPPH
... 39 Tabel VII. Hasil uji aktivitas antioksidan fraksi etil asetat ekstrak
etanolik daun adas dengan metode DPPH ... 39 Tabel VIII. Nilai IC50 rutin dan fraksi etil asetat ekstrak etanolik daun
xiv
DAFTAR GAMBAR
Halaman Gambar 1. Reaksi radikal DPPH dengan antioksidan (Widyastuti,
2010) ... 15
Gambar 2. Uji pendahuluan senyawa fenolik ... 28
Gambar 3. Uji pendahuluan aktivitas antioksidan ... 29
Gambar 4. Kurva Operating Time (OT) asam galat replikasi 2 ... 30
Gambar 5. Struktur asam galat (Hernawan dan Setyawan, 2003) ... 32
Gambar 6. Kurva Operating Time (OT) rutin replikasi 1 ... 35
Gambar 7. Kurva Operating Time (OT) fraksi etil asetat ekstrak etanolik daun adas replikasi 1 ... 35
Gambar 8. Reaksi radikal DPPH dengan antioksidan ... 37
xv
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Surat Keterangan Determinasi ... 46
Lampiran 2. Foto Daun Adas (Foeniculum vulgare Mill.) ... 47
Lampiran 3. Data Konsentrasi Uji Aktivitas Antioksidan ... 48
Lampiran 4. Penentuan OT Rutin ... 50
Lampiran 5. Penentuan OT Fraksi Etil Asetat ... 52
Lampiran 6. Panjang Gelombang ( ) Maksimum DPPH ... 54
Lampiran 7. Scanning Pengoreksi ... 56
Lampiran 8. Uji Aktivitas Antioksidan Menggunakan Radikal DPPH ... 58
Lampiran 9. Perhitungan Nilai IC50 Fraksi Etil Asetat dan Rutin ... 59
Lampiran 10. Optimasi Penentuan Kandungan Fenolik Total ... 61
Lampiran 11. Panjang Gelombang ( ) Maksimum Asam Galat ... 63
Lampiran 12. Penentuan Kandungan Fenolik Total ... 65
xvi
INTISARI
Dewasa ini, paparan radikal bebas makin meningkat yang disebabkan oleh antara lain polusi udara. Paparan radikal bebas tersebut merupakan masalah serius yang dapat membawa banyak dampak negatif bagi kesehatan. Karena itu, dibutuhkan antioksidan sebagai penangkal radikal bebas. Senyawa fenolik merupakan salah satu golongan senyawa yang berhubungan dengan aktivitas antioksidan. Adas (Foeniculum vulgare Mill.) memiliki kandungan fenolik utama berupa kuersetin dan glikosida kamferol. Penelitian ini bertujuan menentukan kandungan fenolik total dan nilai aktivitas antioksidan fraksi etil asetat ekstrak etanolik daun adas.
Penentuan aktivitas antioksidan fraksi etil asetat ekstrak etanolik daun adas dilakukan dengan metode DPPH (1,1-Diphenyl-2-pycrylhydrazyl). Reaksi antara DPPH dan senyawa antioksidan akan mengubah warna larutan DPPH dari ungu menjadi kuning. Nilai aktivitas antioksidan dinyatakan dengan IC50, yang menunjukkan konsentrasi senyawa antioksidan yang dibutuhkan untuk menangkap radikal bebas sebesar 50%. Penentuan kandungan fenolik total dilakukan dengan metode Folin-Ciocalteu, yang hasilnya dinyatakan sebagai massa ekivalen asam galat.
Hasil penelitian menunjukkan bahwa fraksi etil asetat ekstrak etanolik daun adas memiliki kandungan fenolik total sebesar 4,88 + 0,09 mg ekivalen asam galat per g fraksi etil asetat dan nilai IC50 sebesar 218,63 + 5,85 g/mL. Nilai aktivitas antioksidan fraksi etil asetat ekstrak etanolik daun adas termasuk kategori lemah.
xvii
ABSTRACT
In this era, there is an increasing in the amounts of free radical that caused by air polution. It has become a serious problem that can damage our health. Therefore, antioxidant is needed as free radical scavenging. Phenolic compound is a kind of compounds that have antioxidant activity. Fennel (Foeniculum vulgare Mill.) has quercetin and caempferol glycoside as the main total phenolic contents. This study will determine the total phenolic contents and antioxidant activity in ethyl acetate fraction of fennel leaves ethanolic extract.
The antioxidant activity is determined by using DPPH (1,1-Diphenyl-2-pycrylhydrazyl) method. The reaction between DPPH and antioxidant compounds will change the colour from purple to yellow. The antioxidant activity is presented by IC50, which is state the concentration of antioxidant that is needed to reduce
50% of free radical activity. The total phenolic contents are determined by using Folin-Ciocalteu method and the results are presented as mg eqivalent gallic acid.
The results of this study show that the total phenolic contents of ethyl acetate fraction of fennel leaves ethanolic extract is 4.88 + 0.09 mg eqivalent gallic acid per gram fraction and the IC50 is 218.63 + 5.85 g/mL. It is belonging
to the weak antioxidant activity.
1 BAB I
PENDAHULUAN
A. Latar Belakang
Polusi udara merupakan salah satu masalah serius yang sedang dihadapi Indonesia. Menurut World Bank, dalam kurun waktu 6 tahun mulai 1995 hingga 2001, pertumbuhan jumlah kendaraan bermotor di Indonesia hampir 100%. Sebagian besar kendaraan bermotor itu menghasilkan emisi gas buang yang buruk. World Bank juga menempatkan Jakarta sebagai kota dengan kadar polutan tertinggi keempat sedunia setelah Beijing, New Delhi, dan Mexico City. Polusi udara yang terjadi sangat berpotensi mengganggu kesehatan, bahkan dapat menyebabkan kematian (Anonimb, 2010). Hal itu terjadi karena polusi udara mengakibatkan tubuh terpapar radikal bebas dalam jumlah yang lebih tinggi. Karena itu, perlu dipikirkan cara untuk menanggulangi dampak radikal bebas itu.
udara. Antioksidan banyak terdapat pada buah-buahan dan sayuran segar (Anonima, 2010). Maka dari itu, perlu dieksplorasi lagi mengenai tanaman yang dapat dijadikan sumber antioksidan.
Adas (Foeniculum vulgare Mill.) merupakan satu di antara sembilan tumbuhan obat yang dianggap bermukjizat di Anglo-Saxon. Adas memiliki kandungan fenolik utama berupa kuersetin dan glikosida kamferol. Kandungan fenolik ini menyebabkan adanya aktivitas antioksidan (Hinneburg, Dorman, and Hiltunen, 2005). Di Indonesia, tanaman adas telah dibudidayakan. Adas dimanfaatkan sebagai bumbu dan juga dapat mengharumkan ramuan obat. Daunnya dapat dimakan sebagai sayuran (Anonim, 2005).
RI, 1986). Hal tersebut mengakibatkan aktivitas antioksidan yang terukur hanya sedikit. Oleh karena itu, dalam penelitian ini dilakukan fraksinasi untuk memisahkan berbagai senyawa yang ada di dalam ekstrak, sehingga didapat senyawa yang dikehendaki, yakni senyawa fenolik. Senyawa fenolik kuersetin dalam adas merupakan aglikon, sehingga bersifat nonpolar. Berdasarkan hal tersebut, maka fraksi yang digunakan dalam penelitian ini adalah fraksi etil asetat karena memiliki kepolaran yang lebih rendah dibandingkan fraksi air.
1. Permasalahan
a. Berapa kandungan fenolik total pada fraksi etil asetat ekstrak etanolik daun adas?
b. Berapa nilai aktivitas antioksidan fraksi etil asetat ekstrak etanolik daun adas yang dinyatakan sebagai IC50?
2. Keaslian penelitian
Sejauh pengamatan penulis, penelitian mengenai uji aktivitas antioksidan menggunakan radikal DPPH dan penetapan kandungan fenolik total pada tanaman adas antara lain:
a. Penelitian mengenai potensi antioksidan pada berbagai bagian tanaman adas, antara lain tunas, daun, dan batang. Tanaman adas pada penelitian ini didapat dari Portugal. Penetapan kandungan fenolik total dilakukan dengan metode Folin-Ciocalteu. Aktivitas antioksidan ditentukan dengan metode DPPH, Reducing power, Inhibition of β-carotene bleaching, dan Inhibition of lipid peroxidation using thiobarbituric acid reactive substances
b. Penelitian mengenai aktivitas antioksidan, anti-5-lipoksigenase dan antiasetilkholinesterase pada minyak esensial dan air dekoksi beberapa tanaman aromatis. Salah satu tanaman yang digunakan adalah adas, yang diperoleh dari toko sayuran “Segredo da Planta”, Portugal. Bagian
tanaman adas yang digunakan adalah semua bagian tanaman kecuali akar. Aktivitas antioksidan ditentukan dengan metode DPPH (menggunakan pembanding berupa Butylated hydroxytoluene/BHT) dan Superoxide anion scavenging activity. Penetapan kandungan fenolik total dilakukan dengan metode Folin-Ciocalteu (Albano et al., 2011).
Perbedaan penelitian ini dengan penelitian sebelumnya terletak pada tempat diambilnya tanaman adas, yakni dari Kopeng, Kabupaten Semarang, Indonesia; serta dari segi pembanding yang digunakan pada uji aktivitas antioksidan, yakni rutin. Pembibitan tanaman pada daerah yang berbeda mengakibatkan perbedaan komposisi maupun jumlah senyawa bioaktif dalam tanaman (Wangcharoen and Morasuk, 2007).
3. Manfaat penelitian
a. Manfaat teoritis. Mengetahui aktivitas antioksidan serta kandungan fenolik total fraksi etil asetat ekstrak etanolik daun adas.
b. Manfaat metodologis. Memberi informasi mengenai aplikasi penggunaan metode DPPH sebagai uji antioksidan untuk bahan alam.
B. Tujuan 1. Tujuan umum
Tujuan umum penelitian ini, yaitu menguji aktivitas antioksidan serta menentukan kandungan senyawa fenolik total fraksi etil asetat ekstrak etanolik daun adas menggunakan metode DPPH.
2. Tujuan khusus
a. Mengetahui kandungan fenolik total fraksi etil asetat ekstrak etanolik daun adas.
6 BAB II
PENELAAHAN PUSTAKA
A. Adas
Adas (Foeniculum vulgare Mill.) termasuk dalam famili Apiaceae. Tanaman ini mempunyai berbagai nama lain yakni: das pedas (Aceh); adeh, manih (Minangkabau); adas, adas pedas (Melayu); hades (Sunda); adas, adas londa, adas landi (Jawa); adhas (Madura); adas (Bali); wala wunga (Sumba); kumpasi (Sangir Talaud); paapang, paampas (Manado); denggu-denggu (Gorontalo); papaato (Buol); porotomo (Baree); adase (Bugis); adasa, rempasu (Makassar); popoas (Alfuru); hsiao hui (China); phong karee, mellet karee (Thailand); jintan manis (Malaysia) (Anonim, 2005).
agak kuning sampai sepenuhnya cokelat. Akan tetapi, warna buahnya ini berbeda-beda tergantung negara asalnya. Buah masak berbau khas aromatik, bila dicicipi rasanya relatif seperti kamfer (Anonim, 2005).
Berbagai kandungan senyawa aktif yang terkandung dalam adas, yaitu minyak atsiri (Oleum foeniculi) sebanyak 1 – 6%; anetol 50 – 60%; fenkon dan pinena sekitar 20%, limonena, dipentena, felandrena, metilkavikol, anisaldehid, asam anisat; serta minyak lemak 12% (Utami dan Puspaningtyas, 2013).
Adas memiliki kandungan fenolik utama berupa kuersetin dan glikosida kamferol. Kandungan fenolik inilah yang menyebabkan adanya aktivitas antioksidan (Hinneburg et al., 2005).
B. Senyawa Fenolik
Senyawa fenolik adalah suatu kelompok besar substansi organik yang terdiri atas senyawa-senyawa aromatik dengan substituen hidroksil. Senyawa induknya adalah fenol, tetapi sebagian besar adalah polifenolik. Sebagian besar ditemukan pada tumbuhan, hanya sedikit fenolik yang ditemukan pada hewan. Di antara polifenol yang berasal dari tumbuhan (telah diketahui lebih dari 8000), flavonoid seperti kuersetin memiliki jumlah paling banyak (Mann et al., 1994).
biosintesis senyawa fenolik dari fenilalanin asam amino aromatik (Cartea, Francisco, Soengas, and Velasco, 2010).
Senyawa fenolik dapat diklasifikasikan berdasarkan jumlah dan susunan atom karbonnya menjadi flavonoid (flavonol, flavon, flavan-3-ol, antosianidin, flavanon, isoflavon, dan sebagainya) dan non-flavonoid (asam fenolik, hidroksisinamat, stilben, dan sebagainya), yang umumnya ditemukan terkonjugasi dengan gula dan asam organik (Cartea et al., 2010).
Flavonoid adalah senyawa polifenol yang mengandung 15 atom karbon dengan dua cincin aromatik yang dihubungkan dengan jembatan tiga atom karbon, C6-C3-C6. Flavonoid merupakan golongan senyawa fenolik yang memiliki jumlah terbanyak. Flavonoid yang paling sering ditemukan adalah flavonol. Sementara itu, asam hidroksisinamik adalah senyawa fenolik non-flavonoid yang memiliki struktur C6-C3 (Cartea et al., 2010).
Peran senyawa fenolik yang terpenting adalah sebagai antioksidan. Di samping itu, senyawa fenolik memiliki aktivitas antiinflamasi, inhibitor enzim, antimikrobia, anti-alergi, serta antitumor sitotoksik dan vaskular. Senyawa fenolik bekerja dengan memblok inisiasi penyakit tertentu pada manusia (Cartea et al., 2010).
antioksidan menjadi lebih rendah pada beberapa flavonoid seperti kuersetin (Cartea et al., 2010).
C. Ekstraksi
Ekstrak adalah sediaan pekat yang didapat dengan mengekstraksi zat aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian hingga memenuhi baku yang telah ditetapkan (Anonim, 1995).
Penyarian atau ekstraksi adalah kegiatan penarikan zat yang dapat larut dari bahan yang tidak dapat larut dengan pelarut cair. Simplisia yang disari mengandung zat aktif yang dapat larut dan zat yang tidak larut seperti karbohidrat, protein, serat, dan sebagainya (Direktorat Jenderal Pengawasan Obat dan Makanan RI, 1986).
Faktor yang memengaruhi kecepatan penyarian, yaitu kecepatan difusi zat yang larut melalui lapisan-lapisan batas antara cairan penyari dengan bahan yang mengandung zat itu (Direktorat Jenderal Pengawasan Obat dan Makanan RI, 1986).
Dalam memilih pelarut untuk ekstraksi, perlu mempertimbangkan kemampuannya dalam mengekstrak komponen-komponen zat terlarut. Sebaiknya digunakan pelarut murni. Semakin efisien langkah ekstraksi, makin besar jumlah senyawa yang akan didapat pada ekstrak (Colegate & Molyneux, 1993).
(1) murah dan mudah didapat, (2) stabil secara fisika dan kimia, (3) bereaksi netral,
(4) tidak mudah menguap serta tidak mudah terbakar,
(5) selektif (hanya menarik zat berkhasiat yang dikehendaki), (6) tidak memengaruhi zat berkhasiat, dan
(7) diperbolehkan oleh peraturan (Direktorat Jenderal Pengawasan Obat dan Makanan RI, 1986).
Salah satu penyari yang dapat dipergunakan, yaitu etanol. Etanol mudah masuk ke dalam membran sel untuk mengekstraksi bahan-bahan intraseluler dari dalam sel seperti senyawa fenolik dan komponen organik lainnya (Tiwari, Kumar, Kaur, Kaur, and Kaur, 2011).
Etanol mampu melarutkan alkaloida basa, minyak menguap, glikosida, kurkumin, kumarin, antrakinon, flavonoid, steroid, damar, dan klorofil. Lemak, malam, tanin serta saponin hanya sedikit larut. Hal tersebut berarti bahwa zat pengganggu yang larut hanya terbatas (Direktorat Jenderal Pengawasan Obat dan Makanan RI, 1986).
Menurut Direktorat Jenderal Pengawasan Obat dan Makanan RI (1986) cara penyarian dapat dibedakan sebagai berikut.
1. Infundasi
2. Maserasi
Maserasi merupakan cara ekstraksi yang sederhana; dilakukan dengan cara merendam serbuk simplisia dalam cairan penyari. Contoh cairan penyari yang dapat digunakan, yaitu air, etanol, air-etanol atau pelarut lain. Maserasi digunakan untuk penyarian simplisia yang mengandung zat aktif yang mudah larut dalam cairan penyari, tidak mengandung zat yang mudah mengembang dalam cairan penyari, serta tidak mengandung benzoin, stirak dan sebagainya. 3. Perkolasi
Perkolasi adalah cara penyarian yang dilakukan dengan mengalirkan cairan penyari melalui serbuk simplisia yang sudah dibasahi. Kelemahan metode ini, yaitu kadar perkolat yang dihasilkan tidak maksimal.
4. Penyarian berkesinambungan
Penyarian berkesinambungan dengan menggunakan alat Soxhlet, merupakan cara penyarian yang menggabungkan proses untuk menghasilkan ekstrak cair dan proses penguapan.
D. Antioksidan
Menurut Peraturan PFA (Prevention of Food Adulteration) No. 58 tahun 1955, antioksidan didefinisikan sebagai suatu substansi yang ketika ditambahkan ke makanan akan mencegah atau menghambat perusakan oksidatif makanan, tidak termasuk gula, sereal, minyak, tepung, jamu, dan rempah-rempah. Menurut Benzie & Strain, 1996, dan Albu et al., 2004, dalam sistem biologis, antioksidan
substrat (misal: lipid, protein, dan DNA), secara signifikan menunda atau
mencegah oksidasi substratnya dan beraksi sebagai “penangkap radikal bebas”
(Sing, 2007).
Secara umum, antioksidan dapat diklasifikasikan ke dalam antioksidan alami dan sintetik.
1. Antioksidan alami
Antioksidan alami banyak ditemukan pada tumbuhan tingkat tinggi (sayuran, buah-buahan, dan teh) (Weisburger, 1999) yang kemungkinan berperan sebagai agen pereduksi, penangkap radikal bebas atau oksigen aktif (Duh, 1998), atau kompleksan logam transisi pro-oksidan. Antioksidan alami juga dapat memproteksi tubuh manusia dari radikal bebas dan menghambat perkembangan penyakit kronis (Sing, 2007).
2. Antioksidan sintetik
Antioksidan sintetik meliputi galat propil, oktil dan duodesil (PG, OG, dan DG), tert-butyl hydroquinone (TBHQ), butylated hydroxyanisole (BHA),
butylated hydroxytoluene (BHT), dan nordihydroguaiaretic acid (NDGA) (Sing, 2007).
Berdasarkan fungsinya antioksidan diklasifikasikan ke dalam antioksidan primer dan antioksidan sekunder (sinergis).
1. Antioksidan primer
akan menjadi pro-oksidan karena keterlibatannya pada reaksi inisiasi (Cillard et al., 1980; Bartosz et al., 1997). Antioksidan fenolik (primer), baik yang alami maupun sintetik, menghambat urutan reaksi dengan berperan sebagai donor hidrogen atau akseptor radikal bebas, sehingga membentuk produk yang lebih stabil. Mereka terlibat secara langsung dalam proses propagasi radikal bebas dan memblok urutan reaksi (Sing, 2007).
2. Antioksidan sekunder
Yang termasuk antioksidan sekunder adalah pengkhelat logam (Khokhar & Owusu Apenten, 2003; Andrade Jr. et al., 2005), tipe-tipe fenolik yang tidak secara cepat dirusak oleh radikal bebas yang dihasilkan dari dekomposisi peroksida, sehingga efektif dalam jangka waktu yang lama. Ada sedikit efek langsung terhadap autooksidasi lipid, tetapi dapat banyak meningkatkan aksi antioksidan primer (Sing, 2007).
Adanya aktivitas antioksidan senyawa fenolik terkait dengan struktur kimianya yang mengakibatkan ia memiliki sifat-sifat redoks, sehingga berperan penting dalam mengadsorbsi dan menetralisasi reactive oxygen species (ROS), memisahkan oksigen singlet dan triplet, atau menguraikan peroksida. Reactive oxygen species, yang diperoleh dari proses oksidasi, merupakan salah satu bagian penting dalam mekanisme pertahanan melawan infeksi. Namun, adanya jumlah radikal bebas oksigen yang terlalu besar dapat merusak jaringan. Ketika terjadi ketidakseimbangan antara ROS dan mekanisme pertahanan antioksidan, ROS
akumulasi peroksida lipid. Tekanan oksidatif dapat mengakibatkan kanker, penuaan, atherosklerosis, inflamasi dan penyakit neurodegeneratif seperti
Parkinson’s (PA) dan Alzheimer’s (AD). Oleh karena itu, antioksidan, seperti senyawa fenolik diperhitungkan sebagai agen protektif, mengurangi kerusakan oksidatif yang diakibatkan ROS pada tubuh manusia, dan menghambat perkembangan penyakit kronik (Cartea et al., 2010).
E. Metode DPPH (1,1-Difenil-2-Pikrilhidrazil)
Senyawa radikal bebas yang mantap, yaitu 1,1-difenil-2-pikrilhidrazil
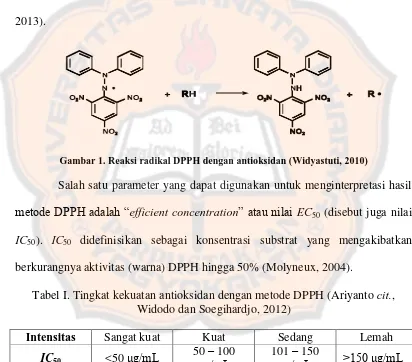
(α,α-difenil-β-pikrilhidrazil; DPPH) merupakan molekul yang berupa radikal bebas yang menjadi stabil karena delokalisasi sisa elektron ke seluruh molekul, sehingga molekul itu tidak terdimerisasi. Delokalisasi ini juga mengakibatkan terbentuknya warna violet tua (Molyneux, 2004).
Metode DPPH adalah metode yang banyak digunakan untuk menetapkan aktivitas antioksidan. Hal tersebut dikarenakan metode ini sederhana, cepat, sensitif dan reprodusibel (Savatovic, Cetkovic, Canadanovic-Brunet, and Djilas, 2012).
menghasilkan larutan berwarna kuning, kemudian dilakukan pengukuran panjang gelombang pada 517 nm. Aktivitas antioksidan diperoleh dari nilai absorbansi yang selanjutnya akan digunakan untuk menghitung persentase inhibisi 50% (IC50) yang menyatakan konsentrasi senyawa antioksidan yang mengakibatkan
[image:35.595.98.510.265.627.2]50% dari DPPH kehilangan karakter radikal bebasnya. Makin tinggi kadar senyawa antioksidan dalam sampel maka akan makin rendah nilai IC50 (Anonim, 2013).
Gambar 1. Reaksi radikal DPPH dengan antioksidan (Widyastuti, 2010)
Salah satu parameter yang dapat digunakan untuk menginterpretasi hasil
metode DPPH adalah “efficient concentration” atau nilai EC50 (disebut juga nilai
IC50). IC50 didefinisikan sebagai konsentrasi substrat yang mengakibatkan
berkurangnya aktivitas (warna) DPPH hingga 50% (Molyneux, 2004).
Tabel I. Tingkat kekuatan antioksidan dengan metode DPPH (Ariyanto cit., Widodo dan Soegihardjo, 2012)
Intensitas Sangat kuat Kuat Sedang Lemah
IC50 <50 μg/mL
50 – 100
μg/mL 101 μg/mL– 150 >150 μg/mL
F. Metode Folin-Ciocalteu
(Na2WO4 . 2H2O, 100 g), natrium molibdat (Na2MoO4 . 2H2O, 25 g), konsentrat
asam hidroklorik (100 mL), asam fosforik 85% (50 mL), dan air (700 mL). Setelah dididihkan, ditambahkan lithium sulfat (Li2SO4 . 4H2O, 150 g) sehingga
terbentuk reagen Folin-Ciocalteu yang berupa larutan berwarna kuning. Reagen FC mengandung heteropoli-fosfotungstat-molibdat. Rangkaian satu atau dua reaksi reduksi elektron reversibel mengakibatkan terbentuknya warna biru, kemungkinan (PMoW11O40)4-. Diyakini bahwa molibdenum lebih mudah
tereduksi, dan reaksi transfer elektron terjadi antara reduktan dan Mo(VI): Mo(VI) + e Mo(V)
Disosiasi suatu proton fenolik mengakibatkan terbentuknya anion fenolat, yang dapat mereduksi reagen FC. Hal ini memperkuat pemikiran bahwa reaksi pada metode FC terjadi melalui mekanisme transfer elektron. Senyawa yang berwarna biru terbentuk dari reaksi antara fenolat dan reagen FC (Huang, Ou, and Prior, 2005).
Uji kandungan fenolik total dengan reagen Folin-Ciocalteu memiliki beberapa kelebihan, yaitu mudah, sederhana, dan reprodusibel (Huang et al., 2005).
G. Landasan Teori
memiliki sifat-sifat redoks, sehingga berperan penting dalam mengadsorbsi dan menetralisasi reactive oxygen species (ROS). Antioksidan, seperti senyawa fenolik diperhitungkan sebagai agen protektif, mengurangi kerusakan oksidatif yang diakibatkan ROS pada tubuh manusia, dan menghambat perkembangan penyakit kronik. Hal tersebut mendorong penulis melakukan penelitian terhadap aktivitas antioksidan daun adas, melalui pengujian kualitatif dan kuantitatif.
Salah satu metode yang banyak digunakan untuk menetapkan aktivitas antioksidan adalah metode DPPH. Bila senyawa antioksidan direaksikan dengan DPPH maka senyawa antioksidan tersebut akan menetralkan radikal bebas dari DPPH. Tingkat kekuatan antioksidan dengan metode DPPH dinyatakan dengan nilai IC50, yang menunjukkan konsentrasi substrat yang mengakibatkan berkurangnya aktivitas (warna) DPPH hingga 50%.
Kandungan fenolik total ditetapkan dengan metode Folin-Ciocalteu. Disosiasi suatu proton fenolik mengakibatkan terbentuknya anion fenolat, yang dapat mereduksi reagen FC. Reaksi antara fenolat dan reagen FC mengakibatkan terbentuknya senyawa yang berwarna biru.
H. Hipotesis
1. Fraksi etil asetat ekstrak etanol daun adas memiliki kandungan senyawa fenolik.
18
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk jenis penelitian eksperimental murni.
B. Variabel 1. Variabel bebas
Variabel bebas pada penelitian ini adalah konsentrasi fraksi etil asetat daun adas.
2. Variabel terikat
Variabel terikat pada penelitian ini adalah kadar fenolik total dan persen (%) aktivitas antioksidan.
3. Variabel pengacau terkendali
Variabel pengacau terkendali pada penelitian ini adalah tempat tumbuh tanaman.
4. Variabel pengacau tak terkendali
C. Definisi Operasional 1. Daun adas
Daun adas adalah daun (folium) dari tanaman adas yang dipetik dari daerah Kopeng, Kabupaten Semarang, Jawa Tengah, dibeli dari pemasok sayuran di Yogyakarta, yaitu Depot Sayur Segar.
2. Ekstrak daun adas
Ekstrak daun adas adalah ekstrak kental yang didapat dari hasil maserasi dengan etanol daun adas.
3. Fraksi etil asetat
Fraksi etil asetat adalah fraksi kental yang didapat dari ekstrak kental etanolik yang sudah melalui proses fraksinasi. Fraksi kental dari fraksi etil asetat dipekatkan menggunakan vacuum rotary evaporator hingga tidak ada lagi pelarut yang menetes, lalu diuapkan pada oven sampai didapatkan bobot tetap.
4. Persen inhibition concentration (%IC)
Persen inhibition concentration (%IC) adalah persen yang menyatakan kemampuan fraksi etil asetat ekstrak etanolik daun adas untuk menangkap radikal DPPH.
5. Inhibition concentration 50 (IC50)
Inhibition concentration 50 (IC50) adalah nilai konsentrasi fraksi etil
D. Bahan dan Alat Penelitian 1. Bahan
Bahan yang digunakan pada penelitian ini antara lain: simplisia daun adas yang berasal dari Kopeng, Kabupaten Semarang, Jawa Tengah; etanol 70% kualitas farmasetis; wasbensin; etil asetat (PT Brataco); rutin; DPPH; reagen Folin-Ciocalteu (Sigma.Chem); metanol p.a. (E. Merck); natrium karbonat; aquadest dari laboratorium Farmakognosi-Fitokimia.
2. Alat
Alat yang digunakan dalam penelitian ini, yaitu spektrofotometer UV-Vis (Shimadzu), kuvet, neraca analitik (Scaltec SBC 22, BP 160P), vacuum rotary evaporator (Junke & Kunkle), alat-alat gelas dari Pyrex, blender, oven, waterbath
(labo- tech, Heraeus), dan corong Buchner.
E. Tata Cara Penelitian 1. Determinasi tanaman
Determinasi tanaman adas dilakukan di Laboratorium Farmakognosi Fitokimia, Fakultas Farmasi Universitas Sanata Dharma menurut http://www.plants.usda.gov/core/profile?symbol=FOVU.
2. Pengumpulan bahan
3. Preparasi sampel
Sebanyak 1,4 kg daun adas segar dikumpulkan. Daun dipilih yang tidak berwarna kekuningan dan tidak terlalu muda, tanpa mengikutsertakan tangkai daun. Selanjutnya, daun dikeringkan dengan menggunakan oven pada suhu 40 °C selama tiga hari, lalu digiling dengan blender hingga terbentuk serbuk halus. Selanjutnya, serbuk dimaserasi menggunakan pelarut etanol 70% selama dua hari. Setelah itu, ampas dipisahkan dari pelarut dengan menggunakan corong Buchner.
Ampas sisa yang dihasilkan kemudian diremaserasi selama dua hari. Selanjutnya kembali dipisahkan antara pelarut dan ampas dengan menggunakan corong
Buchner. Pelarut hasil pemisahan dicampurkan dengan pelarut yang diperoleh dari maserasi terdahulu, lalu dipekatkan menggunakan vacuum rotary evaporator
hingga didapat ekstrak kental etanolik. Ekstrak kental etanolik tersebut ditambah 300 mL aquades hangat dan dipartisi menggunakan wasbensin. Fase air akan berada pada bagian bawah, sedangkan fase wasbensin berada pada bagian atas. Fase air diambil untuk dipartisi lagi menggunakan etil asetat sehingga didapatkan fraksi air dan etil asetat.Sesudah dipisahkan fraksi etil asetat diuapkan dengan
vacuum rotary evaporator sampai diperoleh fraksi kental etil asetat. Lalu fraksi ini digunakan untuk dianalisis lebih lanjut.
4. Pembuatan larutan DPPH, pembanding, dan uji
b. Pembuatan larutan stok rutin. Sebanyak 2,5 mg rutin dilarutkan dalam metanol p.a hingga 10,0 mL.
c. Pembuatan larutan pembanding. Diambil 0,6; 0,7; 0,8; 0,9; 1,0 mL larutan stok rutin, kemudian ditambahkan metanol p.a sampai 10,0 mL sehingga
diperoleh konsentrasi larutan standar rutin sebesar 15; 17,5; 20; 22,5; 25 μg/mL.
d. Pembuatan larutan uji. Sebanyak 20 mg ekstrak ditimbang, kemudian ditambahkan metanol p.a. sampai 20,0 mL. Dari larutan itu kemudian diambil 2,0; 2,25; 2,5; 2,75; 3,0 mL untuk kemudian dilarutkan dalam 10 mL metanol.
5. Uji pendahuluan
a. Uji fenolik. Sejumlah 0,5 mL larutan uji ditambahkan 5 mL pereaksi fenol Folin-Ciocalteu yang sudah diencerkan dengan akuades (1:10; v/v) ke dalam tabung reaksi. Larutan tersebut ditambahkan dengan 4,0 mL natrium karbonat 1M. Selanjutnya, diamati warna pada larutan tersebut. Terbentuknya warna biru menunjukkan adanya polifenol.
b. Uji pendahuluan aktivitas antioksidan. Disiapkan metanol
6. Penentuan kandungan fenolik total
a. Pembuatan kurva baku asam galat. Sejumlah 0,5 mL larutan asam
galat 50, 75, 100, 125 dan 150 μg/mL ditambahkan dengan 5,0 mL larutan reagen
Folin-Ciocalteu yang sudah diencerkan dengan menggunakan aquadest (1:10). Larutan selanjutnya ditambah dengan 4,0 mL larutan Na2CO3 1M. Sesudah 30
menit, absorbansinya dibaca pada panjang gelombang 760 nm. b. Optimasi penetapan kandungan fenolik total.
1) Penentuan Operating Time (OT)
Diambil 0,5 mL larutan induk asam galat 50, 100 dan 150 μg/mL,
lalu ditambahkan dengan 5,0 mL reagen Folin-Ciocalteu yang sudah diencerkan dengan aquadest (1:10). Selanjutnya, ditambahkan dengan 4,0 mL larutan Na2CO3
1M. Absorbansi diukur tiap 5 menit selama 40 menit pada panjang gelombang 760 nm.
2) Penentuan panjang gelombang maksimum
Sejumlah 0,5 mL larutan asam galat 50, 100 dan 150 μg/mL ditambahkan dengan 5,0 mL larutan reagen Folin-Ciocalteu yang sudah diencerkan dengan aquadest (1:10), lalu ditambahkan dengan 4,0 mL larutan Na2CO3 1M. Dilakukan scanning pada panjang gelombang 600 – 800 nm.
c. Estimasi penetapan kadar senyawa fenolik total sampel. Diambil
0,5 mL larutan uji 500 μg/mL, lalu ditambahkan dengan 5,0 mL larutan reagen
Folin-Ciocalteu yang telah diencerkan dengan aquadest (1:10), dan dilanjutkan dengan penambahan 4,0 mL larutan Na2CO3 1M. Sesudah 30 menit, dibaca
total dinyatakan sebagai massa ekivalen asam galat (mg ekivalen asam galat per g fraksi etil asetat).
7. Optimasi metode uji antioksidan
a. Penentuan operating time. Sebanyak 1 mL larutan DPPH dimasukkan kedalam masing-masing tiga labu ukur 5 mL kemudian ditambahkan masing-masing dengan 1 mL larutan pembanding rutin 15; 20 dan 25 μg/mL. Selanjutnya, larutan tersebut ditambahkan dengan metanol p.a hingga tanda batas. Setelah itu dibaca absorbansinya dengan spektrofotometer visibel pada panjang gelombang 517 nm selama 1 jam. Dilakukan demikian juga untuk larutan uji 200; 250; 300 μg/mL.
b. Penentuan panjang gelombang serapan maksimum. Dilakukan
scanning pada larutan DPPH dengan konsentrasi sebesar 0,02 mM, 0,04 mM dan 0,08 mM pada panjang gelombang 400-600 nm. Panjang gelombang maksimum didapat dari hasil ketiga rata-rata pengukuran DPPH dengan tiga konsentrasi yang berbeda.
8. Pengukuran absorbansi larutan kontrol, pembanding, dan uji
a. Pengukuran absorbansi larutan kontrol. Sebanyak 1 mL larutan DPPH ditambah dengan 4 mL metanol. Campuran larutan tersebut dibaca absorbansinya pada panjang gelombang maksimum.
b. Pengukuran absorbansi larutan pembanding dan uji. Sebanyak 1
tanda batas. Larutan tersebut kemudian didiamkan selama OT. Larutan dibaca absorbansinya dengan spektrofotometer visibel pada panjang gelombang maksimum. Pengerjaan dilakukan 3 kali.
F. Analisis Hasil
Aktivitas penangkapan radikal DPPH (%) dihitung menggunakan rumus :
% IC = (absorbansi larutan kontrol – absorbansi larutan uji)/absorbansi larutan kontrol x 100%
Data aktivitas tersebut dianalisis dan dihitung nilai IC50 menggunakan persamaan regresi linear dengan sumbu x adalah konsentrasi larutan uji maupun pembanding sedangkan sumbu y adalah %IC.
26 BAB IV
HASIL DAN PEMBAHASAN
A. Hasil Determinasi Tanaman
Determinasi tanaman merupakan langkah awal dalam penelitian yang menggunakan tanaman sebagai sampel. Determinasi bertujuan untuk memastikan kebenaran identitas tanaman yang akan digunakan sehingga terjadinya kesalahan dalam pengambilan sampel untuk analisis fitokimia dapat dihindari. Hasil determinasi menunjukkan bahwa tanaman yang akan digunakan dalam penelitian ini adalah Foeniculum vulgare Mill. atau adas.
B. Hasil Pengumpulan Bahan
menjadi buah sebagai cadangan makanan tumbuhan, sehingga kandungan metabolit sekunder pada bagian daun tidak maksimal.
Daun adas yang digunakan dipilih yang masih segar, tidak terdapat warna kekuningan, dan tidak terlalu muda. Daun adas harus segera diolah untuk mencegah terjadinya fenomena phenolic browning, yaitu berubahnya warna tanaman menjadi coklat atau bahkan hitam. Penyebab terjadinya fenomena ini adalah terjadinya oksidasi senyawa fenolik pada tanaman (Galati, McKay, and Tan, 2005).
C. Hasil Uji Pendahuluan 1. Uji pendahuluan senyawa fenolik
Uji pendahuluan senyawa fenolik bertujuan mengetahui ada atau tidaknya kandungan senyawa fenolik dalam fraksi etil asetat ekstrak etanolik daun adas. Pada penelitian ini, digunakan metode Folin-Ciocalteu. Pada uji ini, larutan uji ditambahkan dengan pereaksi fenol Folin-Ciocalteu dan natrium karbonat1M, lalu didiamkan selama 30 detik dan diamati perubahan warna yang terjadi. Pembanding yang digunakan adalah asam galat.
ditunjukkan dengan berubahnya warna larutan menjadi biru. Demikian pula pada senyawa pembanding asam galat.
Gambar 2. Uji pendahuluan senyawa fenolik Keterangan: 1 = Pereaksi Folin-Ciocalteu + Na2CO3
2 = Pereaksi Folin-Ciocalteu + Na2CO3 + asam galat
3 = Pereaksi Folin-Ciocalteu + Na2CO3 + fraksi etil
asetat 2. Uji pendahuluan aktivitas antioksidan
Uji pendahuluan aktivitas antioksidan bertujuan untuk mengetahui apakah fraksi etil asetat ekstrak etanolik daun adas mempunyai aktivitas antioksidan. Pada uji pendahuluan ini, baik larutan uji maupun larutan pembanding rutin, ditambahkan dengan larutan DPPH dalam metanol. Hasilnya dibandingkan dengan kontrol yang berupa larutan DPPH dalam metanol. Adanya aktivitas antioksidan ditunjukkan dengan berubahnya warna larutan dari ungu menjadi kekuningan. Hasil pengujian pada Gambar 3 menunjukkan bahwa baik larutan uji maupun larutan pembanding rutin memiliki aktivitas antioksidan, yang ditandai dengan berubahnya warna larutan menjadi kekuningan, sedangkan warna larutan kontrol tetap ungu.
Gambar 3. Uji pendahuluan aktivitas antioksidan Keterangan: 1 = DPPH + metanol
2 = DPPH + metanol + rutin
3 = DPPH + metanol + fraksi etil asetat
D. Hasil Optimasi Penetapan Kandungan Fenolik Total 1. Penentuan Operating Time (OT)
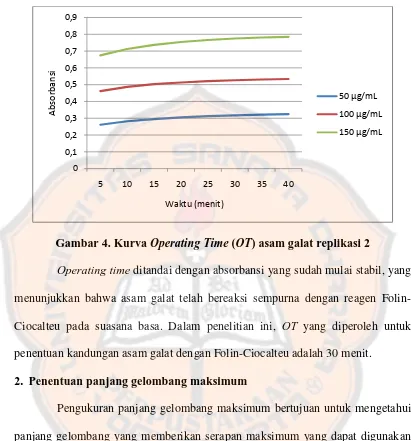
Penentuan Operating Time bertujuan untuk mengetahui waktu yang diperlukan untuk mencapai reaksi yang optimal antara asam galat dan reagen Folin-Ciocalteu. Untuk menentukan OT, dilakukan pengukuran absorbansi tiap lima menit sekali selama 40 menit. Pengukuran dilakukan pada panjang gelombang maksimum, yakni 760 nm.
3 2
Gambar 4. Kurva Operating Time (OT) asam galat replikasi 2
Operating time ditandai dengan absorbansi yang sudah mulai stabil, yang menunjukkan bahwa asam galat telah bereaksi sempurna dengan reagen Folin-Ciocalteu pada suasana basa. Dalam penelitian ini, OT yang diperoleh untuk penentuan kandungan asam galat dengan Folin-Ciocalteu adalah 30 menit.
2. Penentuan panjang gelombang maksimum
Pengukuran panjang gelombang maksimum bertujuan untuk mengetahui panjang gelombang yang memberikan serapan maksimum yang dapat digunakan dalam pengukuran. Dilakukan scanning pada tiga seri konsentrasi asam galat (rendah, sedang, dan tinggi), yaitu 50, 100, dan 150 μg/mL pada panjang gelombang 600 – 800 nm. Pengukuran panjang gelombang maksimum dilakukan sesudah OT supaya diperoleh serapan yang stabil.
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9
5 10 15 20 25 30 35 40
Ab so rb a n si Waktu (menit)
Tabel II. Hasil pengukuran panjang gelombang maksimum untuk penetapan kadar asam galat
Konsentrasi asam
galat (μg/mL) Panjang gelombang maksimum
Rata-rata panjang gelombang maksimum
Panjang gelombang maksimum
teoretis
50 761
748,6 760
100 742
150 743
Dari hasil scanning pada tiga seri konsentrasi asam galat tersebut, didapat rata-rata panjang gelombang maksimum sebesar 748,6 nm.
E. Hasil Estimasi Kandungan Senyawa Fenolik Total
Senyawa fenolik merupakan salah satu golongan fitokimia yang terpenting berkaitan dengan aktivitas antioksidan (Cartea et al., 2010). Makin tinggi kandungan senyawa fenolik total, makin tinggi pula aktivitas antioksidan (Anesini, Ferarro, and Filip, 2008). Oleh karena itu dalam penelitian ini juga dilakukan penetapan kandungan senyawa fenolik total pada fraksi etil asetat ekstrak etanolik daun adas.
Gambar 5. Struktur asam galat (Hernawan dan Setyawan, 2003) Prinsip reaksi dalam metode Folin-Ciocalteu adalah reaksi reduksi-oksidasi. Senyawa fenolik akan mengalami oksidasi sehingga menjadi bentuk keton, sedangkan kompleks fosfotungstat-fosfomolibdat dari pereaksi Folin-Ciocalteu akan mengalami reduksi, sehingga menghasilkan kompleks
Tabel III. Persamaan regresi linier dari baku asam galat
Replikasi Konsentrasi (μg/mL) Absorbansi Persamaan regresi linier
1
50 0,313
A = 0,1096 B = 4,14 . 10-3
r = 0,9990 y = 4,14 . 10-3x + 0,1096
75 0,420
100 0,535
125 0,619
150 0,731
2
49 0,329
A = 0,1038 B = 4,644 . 10-3
r = 0,9996
y = 4,644 . 10-3x + 0,1038
74 0,445
99 0,572
124 0,680
149 0,792
3
50 0,305
A = 0,0942 B = 4,268 . 10-3
r = 0,9996
y = 4,268 . 10-3x + 0,0942
75 0,412
100 0,528
125 0,631
150 0,729
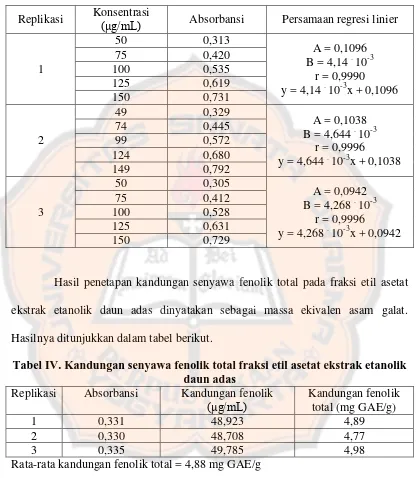
[image:53.595.102.519.136.614.2]Hasil penetapan kandungan senyawa fenolik total pada fraksi etil asetat ekstrak etanolik daun adas dinyatakan sebagai massa ekivalen asam galat. Hasilnya ditunjukkan dalam tabel berikut.
Tabel IV. Kandungan senyawa fenolik total fraksi etil asetat ekstrak etanolik daun adas
Replikasi Absorbansi Kandungan fenolik
(μg/mL) Kandungan fenolik total (mg GAE/g)
1 0,331 48,923 4,89
2 0,330 48,708 4,77
3 0,335 49,785 4,98
F. Hasil Optimasi Uji Aktivitas Antioksidan 1. Penentuan Operating Time (OT)
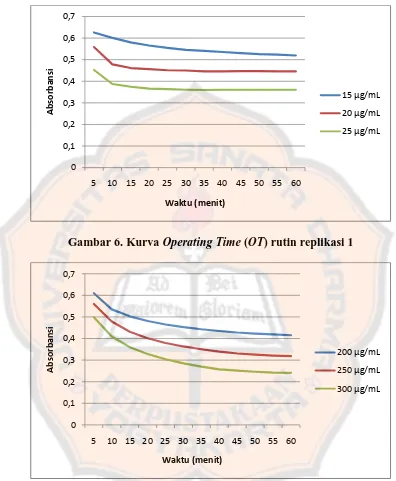
Penentuan Operating Time bertujuan untuk mengetahui waktu yang dibutuhkan untuk mencapai reaksi yang optimal antara DPPH dengan rutin maupun dengan fraksi etil asetat ekstrak etanolik daun adas. Penentuan OT rutin dilakukan dengan cara mengukur absorbansi larutan DPPH yang sudah dicampur dengan rutin pada tiga konsentrasi rutin yang berbeda (15, 20, dan 25 μg/mL).
Demikian juga, penentuan OT fraksi etil asetat ekstrak etanolik daun adas dilakukan dengan cara mengukur absorbansi larutan DPPH yang telah dicampur dengan larutan uji pada tiga konsentrasi senyawa uji yang berbeda, yaitu 200, 250, dan 300 μg/mL. Absorbansi diukur setiap 5 menit selama 1 jam. Pembacaan
absorbansi dilakukan pada panjang gelombang maksimum dari DPPH, yaitu sebesar 517 nm. Penurunan absorbansi tiap satuan waktu menunjukkan jumlah DPPH yang tertangkap oleh senyawa yang berpotensi sebagai antioksidan.
Gambar 6. Kurva Operating Time (OT) rutin replikasi 1
Gambar 7. Kurva Operating Time (OT) fraksi etil asetat ekstrak etanolik daun adas replikasi 1
Dari gambar 6 dan 7 dapat disimpulkan bahwa operating time larutan pembanding rutin adalah 30 menit, sedangkan OT larutan uji adalah 45 menit. Hal ini ditandai dengan absorbansi yang mulai cukup stabil pada menit itu.
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7
5 10 15 20 25 30 35 40 45 50 55 60
Ab so rb an si Waktu (menit)
5 μg/mL μg/mL 5 μg/mL
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7
5 10 15 20 25 30 35 40 45 50 55 60
2. Penentuan panjang gelombang maksimum
Penentuan panjang gelombang maksimum bertujuan mengetahui panjang gelombang larutan DPPH yang dapat memberikan hasil pengukuran yang maksimal. Panjang gelombang maksimum ini digunakan pada saat melakukan pengukuran terhadap kurva baku rutin dan sampel pada penentuan aktivitas antioksidan.
[image:56.595.99.513.220.572.2]Pengukuran panjang gelombang maksimum dilakukan terhadap larutan DPPH pada tiga konsentrasi yang berbeda. Pengukuran dilakukan dengan melakukan scanning pada panjang gelombang 400-600 nm.
Tabel V. Hasil penentuan panjang gelombang maksimum DPPH
Konsentrasi larutan DPPH
Hasil scanning
pengukuran panjang gelombang maksimum
larutan DPPH
Rata-rata panjang gelombang maksimum
0,02 mM 515,5 nm
515,5 nm
0,04 mM 515,5 nm
0,08 mM 515,5 nm
Dari tabel di atas dapat dilihat bahwa rata-rata panjang gelombang maksimum yang didapatkan adalah 515,5 nm. Adapun panjang gelombang maksimum DPPH secara teoretis adalah 517 nm. Berarti terdapat selisih sebesar 1,5 nm antara panjang gelombang maksimum DPPH secara teoretis dengan hasil
G. Hasil Uji Aktivitas Antioksidan
Pada penelitian ini, dilakukan pengujian aktivitas antioksidan dengan metode DPPH. Metode ini menggunakan radikal bebas berupa DPPH (1,1-difenil-2-pikrilhidrazil). DPPH berperan sebagai penangkap radikal hidrogen bebas (hydrogen radical scavenger) atau penangkap elektron yang berasal dari suatu senyawa yang dapat mendonorkan elektronnya. Tiap molekul yang dapat mendonorkan elektron atau hidrogen akan bereaksi dan menyebabkan penurunan intensitas warna atau absorbansi larutan DPPH. Warna DPPH akan berubah dari ungu menjadi kuning.
[image:57.595.100.504.237.550.2]Ungu Kuning
Gambar 8. Reaksi radikal DPPH dengan antioksidan
Aktivitas antioksidan diperoleh dari nilai absorbansi yang selanjutnya akan digunakan untuk menghitung IC50. IC50 ini menyatakan konsentrasi senyawa
Absorbansi yang diukur dalam metode DPPH, yaitu absorbansi larutan DPPH yang tidak bereaksi dengan bahan uji atau DPPH yang tersisa dalam larutan. Oleh karena itu, dengan bertambahnya konsentrasi senyawa penangkap radikal bebas dalam larutan, maka absorbansi larutan akan berkurang, yang berarti bahwa aktivitas penangkapan radikal bebasnya makin meningkat.
[image:58.595.98.504.261.570.2]Uji aktivitas antioksidan fraksi etil asetat ekstrak etanolik daun adas ini menggunakan rutin sebagai pembanding. Rutin merupakan salah satu senyawa fenolik yang tergolong dalam flavonoid. Menurut Lopez, Martinez, Del-Valle, Ferrit, and Luque (2003) gugus O-dihidroksi pada cincin B diasosiasikan dengan gugus fungsi dalam rutin yang menyebabkan terdapatnya aktivitas antioksidan.
Tabel VI. Hasil uji aktivitas antioksidan rutin dengan metode DPPH Replikasi Konsentrasi rutin (μg/mL) Absorbansi Aktivitas antioksidan
(% IC)
Persamaan regresi linier
1
14,4 0,552 33,414
A = 0,1333 B = 2,31116 r = 0,999985 y = 2,31116x + 0,1333
16,9 0,504 39,204
19,4 0,456 44,994
21,9 0,409 50,663
24,4 0,360 56,574
2
15 0,548 33,976
A = 4,8656 B = 1,96156
r = 0,99840 y = 1,96156x + 4,8656
17,5 0,505 39,157
20 0,460 44,578
22,5 0,420 49,398
25 0,384 53,735
3
15 0,536 35,422
A = 10,9884 B = 1,63372 r = 0,9996 y = 1,63372x + 10,9884
17,5 0,501 39,639
20 0,466 43,855
22,5 0,436 47,470
[image:59.595.103.520.133.729.2]25 0,399 51,928
Tabel VII. Hasil uji aktivitas antioksidan fraksi etil asetat ekstrak etanolik daun adas dengan metode DPPH
Replikasi Konsentrasi fraksi (μg/mL) Absorbansi Aktivitas antioksidan
(% IC)
Persamaan regresi linier
1
201 0,507 44,71%
A = 4,918 B = 0,20092
r = 0,98479 y = 0,20092x + 4,918 226,125 0,448 51,15%
251,25 0,399 56,49% 276,375 0,383 58,23% 301,5 0,308 66,41%
2
199 0,507 44,89%
A = 9,656 B = 0,18263
r = 0,97990 y = 0,18263x + 9,656 223,875 0,436 52,61%
248,75 0,414 55,00% 273,625 0,386 58,04% 298,5 0,323 64,89%
3
200 0,478 43,57%
A = -12,948 B = 0,29888 r = 0,97390 y = 0,29888x – 12,948
225 0,354 58,21%
250 0,312 63,16%
275 0,273 67,77%
Tabel VIII. Nilai IC50 rutin dan fraksi etil asetat ekstrak etanolik daun adas Bahan uji IC50 (μg/mL) Rata-rata (μg/mL) (μg/mL)SD CV (%)
Rep. 1 Rep. 2 Rep. 3
Rutin 21,58 23,01 23,88 22,82 0,95 4,16 Fraksi
etil asetat
224,38 220,91 210,61 218,63 5,85 2,68
Nilai IC50 pada Tabel VIII merupakan hasil analisis regresi linier. Persamaan regresi linier tersebut (Tabel VI dan VII) menyatakan hubungan antara konsentrasi senyawa uji (x) dengan aktivitas antioksidan yang dihasilkan (y). Dalam perhitungan nilai IC50, y = 50. Dari tabel tersebut dapat dilihat bahwa nilai rata-rata IC50 rutin adalah sebesar 22,82 μg/mL sedangkan nilai rata-rata IC50
fraksi etil asetat ekstrak etanolik daun adas adalah 218,63 μg/mL. Hal ini berarti
untuk menangkap radikal bebas sebesar 50%, konsentrasi rutin yang diperlukan adalah sebesar 22,82 μg/mL, sedangkan konsentrasi fraksi etil asetat ekstrak
etanolik daun adas yang dibutuhkan adalah 218,63 μg/mL. Makin kecil nilai IC50, berarti makin tinggi kekuatan senyawa antioksidan dalam sampel uji. Oleh karena itu, dari hasil penelitian ini, dapat disimpulkan bahwa rutin mempunyai aktivitas antioksidan yang lebih baik dibandingkan fraksi etil asetat ekstrak etanolik daun adas. Pada Tabel IX, dapat dilihat bahwa aktivitas antioksidan rutin tergolong sangat kuat karena mempunyai nilai IC50 di bawah 50 μg/mL, sedangkan aktivitas
Tabel IX. Tingkat kekuatan antioksidan dengan metode DPPH
Sampel IC50 (μg/mL)
Tingkat aktivitas antioksidan (IC50) dengan metode DPPH
Sangat kuat (<50 μg/mL)
Kuat (50 – 100 μg/mL)
Sedang (101 – 150
μg/mL)
Lemah (>150 μg/mL) Rutin 22,82 V
Fraksi etil
42 BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
1. Nilai aktivitas antioksidan fraksi etil asetat ekstrak etanolik daun adas yang dinyatakan dengan IC50 sebesar 218,63 + 5,85 μg/mL.
2. Kandungan senyawa fenolik total fraksi etil asetat ekstrak etanolik daun adas sebesar 4,88 + 0,09 mg ekivalen asam galat per g fraksi etil asetat.
B. Saran
43
DAFTAR PUSTAKA
Albano, S.M., Lima, A.S., Miguel, M.G., Pedro, L.G., Barroso, J.G., and Figueiredo, A.C., 2011, Antioxidant, Anti-5-lipoxygenase and Antiacetylcholinesterase Activities of Essential Oils and Decoction Waters of Some Aromatic Plants, Rec. Nat. Prod., 6:1 (2012), 35-48. Anesini, C., Ferarro, G.E., and Filip, R., 2008, Total Polyphenol Content and
Antioxidant Capacity of Commercially Available Tea (Camellia sinensis) in Argentina, J. Agric. Food Chem, 56, 9225-9229.
Anonim, 2005, Adas (Foeniculum vulgare Mill.), http://www.iptek.net.id/ind/ pd_tanobat/view.php?mnu=2&id=106, diakses tanggal 2 Desember 2013. Anonima, 2010, Antioksidan & Radikal Bebas, http:// www.galenium.com/ ID/ news/articel/index.php?module=detailberita&id=54, diakses tanggal 4Mei 2012.
Anonimb, 2010, Dampak Polusi Udara Terhadap Kesehatan,
http://wartawarga.gunadarma.ac.id/2010/05/dampak-polusi-udara-terhadap-kesehatan/, diakses tanggal 3 Mei 2012.
Anonim, 2013, Uji Senyawa Antioksidan Dengan Metode Difenilpikril Hidrazil, http://www.merckmillipore.com/indonesia/life-science-research/uji-
senyawa-antioksidan-dengan-metode-dpph-difenilpikril-hidrazil/c_H5yb.s1OVf8AAAEumQxQn72P?WFSimpleSearch_NameOr ID=dpph&BackButtonText=search+results, diakses tanggal 3 Desember 2013.
Barros, L., Heleno, S.A., Carvalho, A.M., and Ferreira, I.C.F.R., 2009, Systematic Evaluation of The Antioxidant Potential of Different Parts of Foeniculum vulgare Mill. from Portugal, Laporan Penelitian, Centro de Investigacao de Montanha, ESA, Instituto Politecnico de Braganca, Braganca, Portugal.
Cartea, M.E., Francisco, M., Soengas, P., and Velasco, P., 2010, Review: Phenolic Compounds in Brassica Vegetables, Molecules, 16, 251-280. Colegate, S.M., Molyneux, R.J., (Eds.), 1993, Bioactive Natural Products:
Detection, Isolation, and Structural Determination, CRC Press, Florida, pp. 27.
Direktorat Jenderal Pengawasan Obat dan Makanan RI, 1986, Sediaan Galenik, Jilid 2, Departemen Kesehatan RI, Jakarta, pp. 1-25.
dos Santos, S.X., Mazo, L.H., and Cavalheiro, E.T.G., 2008, The Use of a Graphite-Silicone Rubber Composite Electrode in The Determination of Rutin in Pharmaceutical Formulation, J. Braz. Chem. Soc., 19 (8), 1603. Galati, A., McKay, A., and Tan, S.C., 2005, Minimising Post-Harvest Losses of
Carrots, Farmanote, 75, 95.
Hernawan, U.E., dan Setyawan, A.D., 2003, Review: Ellagitanin; Biosintesis, Isolasi, dan Aktivitas Biologi, Biofarmasi, 1 (1), 25-38.
Hinneburg, I., Dorman, H.J.D., and Hiltunen, R., 2005, Antioxidant Activities of Extracts from Selected Culinary Herbs and Spices, Food Chemistry, 97 (2006), 122-129.
Huang, D., Ou, B., and Prior, R.L., 2005, The Chemistry Behind Antioxidant Capacity Assays, J. Agric. Food Chem, 53, 1841-1856.
Kurniawan, A., 2011, Uji Aktivitas Antioksidan Menggunakan Radikal 1,1-Difenil-2-Pikrilhidrazil (DPPH) dan Penetapan Kandungan Fenolik Total Fraksi Etil Asetat Ekstrak Etanolik Herba Seledri (Apium graveolens L.),
Skripsi, 63, Universitas Sanata Dharma, Yogyakarta
Lopez, M., Martinez, F., Del-Valle, C., Ferrit, M., and Luque, R., 2003, Study of Phenolic Compounds as Natural Antioxidants by a Fluorescence Method,
Talanta, 60, 609-616.
Mann, J., Davidson, R.S., Hobbs, J.B., Banthorpe, D.V. and Harborne, J.B., 1994,
Natural Products: Their Chemistry and Biological Significance, 1st ed., Longman Group UK Limited, London, pp. 361.
Molyneux, P., 2004, The Use of The Stable Free Radical Diphenylpicrylhydrazyl (DPPH) for Estimating Antioxidant Activity, Songklanakarin J. Sci. Technol., 26 (2), 211-219.
Savatovic, S.M., Cetkovic, G.S., Canadanovic-Brunet, J.M., and Djilas, S.M., 2012, Kinetic Behaviour of The DPPH Radical-Scavenging Activity of Tomato Waste Extracts, J. Serb. Chem. Soc., 77 (10), 1381-1389.
Sing, Y.Y., 2007, Determination of Synthetic Phenolic Antioxidants in Food Items Using HPLC and Total Antioxidants Using Fia Approaches,
Thesis, 3-11, Universiti Sains Malaysia, Penang.
Tiwari, P., Kumar, B., Kaur, M., Kaur, G., and Kaur, H., 2011, Phytochemical Screening and Extraction: A Review, International Pharmaceutica Sciencia, 1, 98-104.
Wangcharoen, W. and Morasuk, W., 2007, Antioxidant Capacity and Phenolic Content of Holy Brasil, Songklanakarin J. Sci. Technol., 29 (5), 1407-1415.
Widodo, Y.R. dan Soegihardjo, C.J., 2012, Uji Aktivitas Antioksidan Menggunakan Radikal 1,1-Difenil-2-Pikrilhidrazil (DPPH) dan Penetapan Kandungan Fenolik Total Fraksi Etil Asetat Ekstrak Etanolik Daun Selasih (Ocimum sanctum L.), JFSK, 9 (1), 43-51.
46 LAMPIRAN
Lampiran 3. Data Konsentrasi Uji Aktivitas Antioksidan
a. Konsentrasi larutan DPPH
BM DPPH = 394,32
Replikasi 1
Mol = (massa/BM) = (15,0 mg/394,32) = 0,0380 mmol
M = (mol/volume) = (0,0380 mmol/0,1 L) = 0,380 mM
Replikasi 2
Mol = (massa/BM) = (16,0 mg/394,32) = 0,0406 mmol
M = (mol/volume) = (0,0406 mmol/0,1 L) = 0,406 mM
Replikasi 3
Mol = (massa/BM) = (15,6 mg/394,32) = 0,0396 mmol
M = (mol/volume) = (0,0396 mmol/0,1 L) = 0,396 mM
b. Konsentrasi larutan induk rutin Replikasi 1 = (2,4 mg/10 mL) = 240 μg/mL
Replikasi 2 = (2,5 mg/10 mL) = 250 μg/mL
Konsentrasi seri baku rutin:
Replikasi Konsentrasi (μg/mL)
Seri 1 Seri 2 Seri 3 Seri 4 Seri 5
1 14,4 16,9 19,4 21,9 24,4
2 15 17,5 20 22,5 25
3 15 17,5 20 22,5 25
c. Konsentrasi larutan induk fraksi etil asetat Replikasi 1 = 20,1 mg/20 mL = 1005 μg/mL
Replikasi 2 = 19,9 mg/20 mL = 995 μg/mL
Replikasi 3 = 20 mg/20 mL = 1000 μg/mL
Konsentrasi seri baku fraksi etil asetat:
Replikasi Konsentrasi (μg/mL)
Seri 1 Seri 2 Seri 3 Seri 4 Seri 5 1 201 226,125 251,25 276,375 301,5 2 199 223,875 248,75 273,625 298,5
Lampiran 4. Penentuan OT Rutin Replikasi 1
Waktu (menit)
Absorbansi
15 μg/mL 20 μg/mL 25 μg/mL
5 0,626 0,558 0,452
10 0,601 0,478 0,387
15 0,580 0,461 0,374
20 0,565 0,456 0,365
25 0,554 0,451 0,363
30 0,545 0,450 0,360
35 0,540 0,446 0,359
40 0,535 0,446 0,360
45 0,530 0,447 0,360
50 0,525 0,447 0,360
55 0,523 0,446 0,360
60 0,519 0,446 0,360
OT yang diperoleh adalah 30 menit.
Replikasi 2 Waktu (menit)
Absorbansi
15 μg/mL 20 μg/mL 25 μg/mL
5 0,653 0,495 0,461
10 0,623 0,435 0,402
15 0,607 0,423 0,383
20 0,599 0,417 0,375
25 0,591 0,415 0,370
30 0,587 0,414 0,365
35 0,583 0,414 0,359
40 0,582 0,414 0,359
45 0,581 0,414 0,359
50 0,579 0,413 0,358
55 0,578 0,412 0,359
60 0,576 0,414 0,358
Replikasi 3 Waktu (menit)
Absorbansi
15 μg/mL 20 μg/mL 25 μg/mL
5 0,618 0,380 0,365
10 0,552 0,366 0,342
15 0,538 0,359 0,329
20 0,531 0,355 0,322
25 0,528 0,353 0,317
30 0,524 0,351 0,314
35 0,521 0,353 0,312
40 0,521 0,353 0,310
45 0,522 0,353 0,310
50 0,522 0,354 0,308
55 0,522 0,353 0,308
60 0,520 0,354 0,308
OT yang diperoleh adalah 30 menit.
Lampiran 5. Penentuan OT Fraksi Etil Asetat Replikasi 1
Waktu (menit)
Absorbansi
200 μg/mL 250 μg/mL 300 μg/mL
5 0,610 0,560 0,498
10 0,535 0,479 0,409
15 0,503 0,431 0,360
20 0,481 0,401 0,328
25 0,465 0,379 0,304
30 0,453 0,363 0,285
35 0,443 0,350 0,270
40 0,435 0,339 0,257
45 0,428 0,330 0,251
50 0,423 0,325 0,246
55 0,419 0,321 0,242
60 0,415 0,318 0,241
OT yang diperoleh adalah 45 menit.
Replikasi 2 Waktu (menit)
Absorbansi
200 μg/mL 250 μg/mL 300 μg/mL
5 0,568 0,558 0,432
10 0,511 0,490 0,349
15 0,479 0,456 0,303
20 0,457 0,427 0,275
25 0,443 0,405 0,255
30 0,432 0,387 0,241
35 0,423 0,373 0,230
40 0,418 0,359 0,222
45 0,411 0,348 0,218
50 0,407 0,344 0,213
55 0,402 0,339 0,212
60 0,399 0,335 0,210
Replikasi 3 Waktu (menit)
Absorbansi
200 μg/mL 250 μg/mL 300 μg/mL
5 0,571 0,560 0,551
10 0,510 0,493 0,428
15 0,471 0,453 0,367
20 0,446 0,424 0,328
25 0,426 0,400 0,300
30 0,412 0,382 0,280
35 0,402 0,366 0,269
40 0,393 0,352 0,261
45 0,385 0,341 0,257
50 0,380 0,337 0,257
55 0,375 0,332 0,256
60 0,371 0,328 0,258
OT yang diperoleh adalah 45 menit.