SINTESIS NANOPARTIKEL MAGNETIT (Fe3O4) SECARA ELEKTROKIMIA DAN APLIKASINYA SEBAGAI PENYERAP Pb(II)
Eka Nuril Susilowati1, Fauziatul Fajaroh1, Surjani Wonorahardjo1
1
Jurusan Kimia, FMIPA, Universitas Negeri Malang E-mail: nurileka99@yahoo.com; fau_kim_um@yahoo.co.id;
s_wonorahardjo@yahoo.com
ABSTRAK: Nanopartikel Magnetit adalah oksida besi yang banyak dimanfaatkan di berbagai bidang, salah satunya adalah sebagai penyerap logam berat. Fokus penelitian adalah sintesis nanopartikel Magnetit secara elektrokimia dengan cara elektro-oksidasi besi dalam air demineralisasi pada voltase 30, 50, dan 70 V yang diaplikasikan sebagai adsorpsi ion Pb(II). Hasil penelitian diperoleh nanopartikel Magnetit dengan ukuran berkisar 21,14-41,37 nm. Kondisi optimum persentase Pb(II) teradsorpsi diperoleh pada pH 7, waktu pengadukan 30 menit dan konsentrasi 10 mg/L sebesar 85,46%.
Kata-kata kunci: nanopartikel, Magnetit, elektrokimia, adsorpsi, Pb(II)
ABSTRACT: Magnetite nanoparticle is the metal oxides are widely be exploited in any application, one as adsorbent of heavy metals. Focus of the research are synthesis of Magnetite nanoparticles by electrochemical with electro-oxidation way iron in demineralized water with the various voltage 30, 50 and 70 V was applicated as adsorption of Pb(II) ion. The results showed that the Magnetite nanoparticle with sizes ranging between 21,14-41,37 nm. Optimum condition the percentage of Pb(II) ion adsorpted was obtained at pH 7, agitation times of 30 minutes, and concentration of 10 mg/L respectively by 85,46%.
Key words: nanoparticle, Magnetite, electrochemical, adsorption, Pb(II)
Magnetit (Fe3O4) merupakan salah satu oksida besi selain maghemit (
-Fe2O3) dan hematit (-Fe2O3) yang menunjukkan kemagnetan paling kuat di
antara oksida-oksida besi yang lain sehingga banyak dimanfaatkan di berbagai bidang (Teja & Koh, 2009). Magnetit menunjukkan manfaat yang semakin luas dengan sifat kemagnetan yang kuat dan dalam skala nanometer, salah satunya adalah sebagai pengikat logam berat yang terkandung dalam air limbah. Daya serapnya yang besar terhadap logam didukung oleh luas permukaannya yang besar serta kemampuan merespons medan magnet sehingga memudahkan proses pemisahan adsorben dari larutan.
Sintesis nanopartikel Magnetit telah dikembangkan dengan berbagai metode, baik konvensional (seperti kopresipitasi) maupun inovatif (misalnya sol-gel, hidrotermal, dan elektrokimia) (Fajaroh dkk., 2009). Metode elektrokimia adalah metode yang berbasis elektro-oksidasi besi dalam air demineralisasi menggunakan rapat arus rendah (sekitar 400 μA/cm2 yang dihasilkan oleh penerapan voltase 20 V) diperoleh nanopartikel Magnetit di daerah anode setelah 12 jam dengan ukuran rata-rata 18,5 nm (Fajaroh dkk., 2012). Metode ini menawarkan kemudahan dalam mengontrol ukuran partikel melalui pengaturan parameter seperti voltase/rapat arus, kondisi elektrolit, dan jarak antar elektrode.
Seiring dengan kemajuan teknologi dan berkembangnya kegiatan industri, selain membawa dampak positif juga membawa dampak negatif, salah satunya adalah limbah yang dihasilkan berupa limbah logam berat. Timbal (Pb)
merupakan salah satu logam berat yang dihasilkan dari proses industri baterai, industri bahan bakar, industri kabel, dan industri kimia yang menggunakan bahan pewarna. Penyerapan Pb oleh tubuh dalam jumlah sedikit sangat membahayakan karena sangat beracun dan tidak terbiodegradasi (Darmono, 2001). Melihat dampak yang ditimbulkan tersebut, maka limbah yang mengandung Pb(II) harus diolah sedemikian rupa sampai diperoleh limbah yang memenuhi standar kualitas lingkungan dengan metode adsorpsi.
Metode adsorpsi adalah salah satu metode alternatif yang dapat diandalkan karena prosesnya yang relatif sederhana, dapat bekerja pada konsentrasi rendah, dapat didaur ulang, dan memerlukan biaya yang relatif murah (Wang dkk., 2008). Salah satu material yang memiliki potensi besar untuk dikembangkan sebagai adsorben adalah nanopartikel Magnetit (Pang dkk., 2007).
Pada penelitian dilakukan pembuatan nanopartikel Magnetit secara elektrokimia dengan voltase tinggi dan aplikasinya sebagai penyerap Pb(II). Diharapkan dengan metode elektrokimia pada voltase yang tinggi maka
dihasilkan Magnetit dengan kristalinitas yang baik dengan ukuran yang halus serta sifat magnet yang kuat, sehingga akan memiliki kemampuan penyerapan yang baik terhadap ion logam berat Pb(II) dan mudah dipisahkan dengan menggunakan bantuan medan magnet.
Metode Penelitian
1. Pelapisan Elektrode Besi melalui Elektroplating
Proses pelapisan besi melalui elektroplating pada bejana kaca berukuran 10 x 12 x 16 cm dengan 500 mL larutan FeSO4 0,02 M sebagai elektrolit.
Elektroplating besi menggunakan metode penelitian yang telah dilakukan Fajaroh
dkk. (2012) dengan variasi konsentrasi dan rapat arus yang berbeda. Lempeng besi yang akan dilapisi ditempatkan sebagai katode sedangkan anodenya dipakai elektrode inert yaitu karbon. Proses pelapisan besi dilakukan pada rapat arus 0,016 A/cm2 selama 3 jam.
2. Sintesis Nanopartikel Magnetit secara Elektrokimia
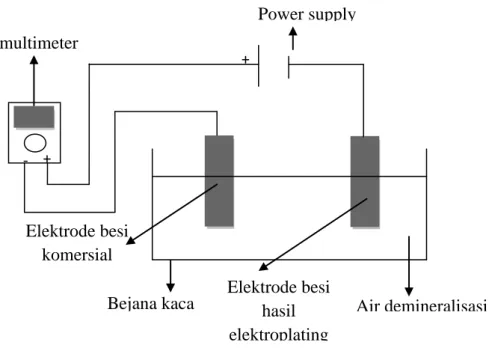
Langkah pertama yang dilakukan adalah menyusun rangkaian alat seperti tampak pada Gambar 1. Proses sintesis menggunakan metode penelitian yang telah dilakukan Fajaroh dkk. (2012) dengan variasi voltase dan waktu sintesis yang berbeda. Bejana kaca diisi dengan 500 mL air demineralisasi pH 7. Lempeng besi hasil elektroplating sebagai anode dan lempeng besi komersial sebagai katode. Arus listrik dialirkan dari power supply DC selama 3 jam sesuai dengan parameter yang ditetapkan, meliputi variasi voltase 30, 50, dan 70 V, jarak antar elektrode 2 cm. Pada akhir sintesis, produk yang dihasilkan berupa Fe3O4
dipisahkan, disaring menggunakan kertas saring Whattman No. 41 dan dikeringkan dalam oven pada suhu 50-60C selama 30 menit.
3. Karakterisasi Produk
Produk yang telah kering diamati warna dan dikarakterisasi dengan X-Ray Diffraction (XRD) untuk identifikasi fasa, Fourier Transform InfraRed (FTIR) untuk identifikasi jenis ikatan, Brunauer-Emmet-Taller (BET) untuk menentukan diameter partikel rata-rata, dan Scanning Electron Microscopy (SEM) untuk mendeskripsikan morfologi, rerata ukuran, dan distribusi ukuran partikel.
Gambar 1 Skema Alat Elektro-oksidasi Besi 4. Adsorpsi Pb(II) dengan Nanopartikel Magnetit
a. Penentuan Persentase Pb(II) Teradsorpsi terhadap Variasi pH
Nanopartikel Magnetit hasil sintesis pada voltase 30 V sebanyak 0,05 g dimasukkan ke dalam 25 mL larutan Pb(II) dengan konsentrasi 10 mg/L dengan variasi pH 2, 5, 7 dan 9. Pengaturan pH larutan menggunakan HNO3 dan NaOH
0,01 M. Kemudian larutan dikocok dengan shaker pada kecepatan 250 rpm selama 120 menit. Larutan disentrifuge pada 1500 rpm selama 30 menit untuk memisahkan supernatan dengan adsorben. Selanjutnya supernatan ditentukan kadar Pb(II) dengan menggunakan AAS (Atomic Absorption Spectrophotometer) pada λ = 283,3 nm. Proses adsorpsi menggunakan metode penelitian yang telah dilakukan Amin dkk. (2010).
b. Penentuan Persentase Pb(II) Teradsorpsi terhadap Variasi Waktu Pengadukan
Nanopartikel Magnetit hasil sintesis pada voltase 30 V sebanyak 0,05 g dimasukkan ke dalam 25 mL larutan Pb(II) dengan konsentrasi 10 mg/L dengan pH 7. Kemudian larutan dikocok dengan shaker pada kecepatan 250 rpm selama 10, 30, 60, 120, dan 150 menit. Larutan disentrifuge pada 1500 rpm selama 30 menit untuk memisahkan supernatan dengan adsorben. Selanjutnya supernatan ditentukan kadar Pb(II) dengan menggunakan AAS (Atomic Absorption Spectrophotometer) pada λ = 283,3 nm.
c. Penentuan Persentase Pb(II) Teradsorpsi terhadap Variasi Konsentrasi Nanopartikel Magnetit hasil sintesis pada voltase 30 V sebanyak 0,05 g dimasukkan ke dalam 25 mL larutan Pb(II) variasi konsentrasi 5, 10, 25, 50, dan 100 mg/L pada pH optimum. Kemudian larutan dikocok dengan shaker pada kecepatan 250 rpm selama 30 menit. Larutan disentrifuge pada 1500 rpm selama 30 menit untuk memisahkan supernatan dengan adsorben. Selanjutnya supernatan
Bejana kaca + Elektrode besi komersial + multimeter Power supply -- Air demineralisasi - Elektrode besi hasil elektroplating
ditentukan kadar Pb(II) dengan menggunakan AAS (Atomic Absorption Spectrophotometer) pada λ = 283,3 nm.
Hasil dan Pembahasan
Produk hasil elektro-oksidasi berupa serbuk berwarna hitam (seperti pada Gambar 2), dapat ditarik magnet, larut dalam asam dan tidak larut dalam basa.
Gambar 2 Serbuk Magnetit Hasil Sintesis
Reaksi pembentukan Magnetit diawali dengan oksidasi besi sebagai anode menjadi ion Fe2+ dan melepaskan elektron. Air di permukaan anode juga akan teroksidasi menjadi O2 dan melepaskan H+ Kemudian ion Fe2+ bereaksi dengan
ion hidroksida hasil reduksi air demineralisasi membentuk Fe(OH)2. Selanjutnya,
Fe(OH)2 bereaksi dengan O2 dari oksigen yang terlarut juga berasal dari reaksi
oksidasi air dan dari udara yang terlarut dalam elektrolit membentuk FeOOH di sekitar anode. Pembentukan FeOOH dapat diamati dengan terjadinya perubahan warna larutan dari tidak berwarna menjadi coklat kemerahan. Selanjutnya Fe(OH)2 dan FeOOH yakan bereaksi membentuk Magnetit, pembentukan Fe3O4
ditandai dengan berubahnya warna larutan menjadi hitam dan keruh. Secara ringkas mekanisme sintesis Fe3O4 secara elektrokimia yang diusulkan adalah
(Fajaroh dkk., 2012):
(1) Fe (s) Fe2+ + 2e -(2) Fe2+ + 2OH- Fe(OH)2
(3) 3Fe(OH)2 + ½ O2 Fe(OH)2 + 2FeOOH + H2O
(4) Fe(OH)2 + 2FeOOH Fe3O4 + 2H2O
Variabel bebas yang digunakan dalam proses elektro-oksidasi adalah voltase. Parameter ini diduga mempengaruhi ukuran, sifat kemagnetan dan laju pembentukan nanopartikel Magnetit. Makin besar voltase, makin besar laju reaksi yang terjadi pada proses elektro-oksidasi.
Analisis XRD
Analisis XRD yang dilakukan untuk mengidentifikasi fasa suatu produk elektro-oksidasi dengan mengacu pada pola puncak standar difraksi sinar X untuk Fe3O4. Hasil yang didapatkan disajikan pada Gambar 3.
Dari Gambar tersebut tampak bahwa ada tujuh puncak khas Magnetit yang bersesuaian antara sudut 25 hingga 65 antara pola XRD Fe3O4 hasil sintesis
dengan pola XRD standar dari Fe3O4 (JCPDS card no. 01-071-6336), yaitu pada
sudut-sudut 30,5; 35,9; 37,0; 43,5; 53,6; 57.3; dan 63,1. Hal ini menunjukkan bahwa senyawa Magnetit telah berhasil disintesis.
Gambar 3 Pola XRD Fe3O4 Hasil Sintesis
Analisis FTIR
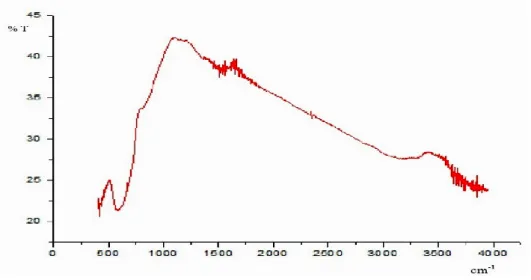
Identifikasi jenis ikatan pada hasil sintesis bertujuan untuk mengetahui puncak khas dari suatu ikatan kimia pada partikel hasil sintesis. Identifikasi jenis ikatan dilakukan menggunakan FTIR. Hasil analisis FTIR pada sampel dengan voltase 50 V ditunjukkan oleh Gambar 5.
Daerah serapan FTIR pada senyawa Magnetit hasil sintesis ditunjukkan dengan adanya puncak-puncak vibrasi pada daerah 416,62 cm-1 dan 547,78 cm-1. Serapan pada daerah ini menunjukkan bahwa terdapat ikatan gugus logam dengan oksigen yaitu ikatan Fe-O dari Fe3O4 yang terbentuk. Pada daerah 3000-3600 cm-1
menunjukkan adanya gugus OH dari air.
Gambar 5 Spektrum Fe3O4 Hasil Sintesis
Analisis BET
Penentuan diameter partikel rata-rata Magnetit yang dihasilkan dari sintesis secara elektrokimia dilakukan dengan mengukur luas permukaan spesifik menggunakan metode BET. Setelah luas permukaan spesifik didapatkan, dihitung diameter masing-masing sampel dengan rumus sebagai berikut:
Densitas ( ) Magnetit adalah 5,18 g/cm3, sehingga didapatkan diameter partikel rata-rata masing-masing sampel.
Tabel 1 Data luas Permukaan Spesifik dan Diameter Partikel Magnetit Hasil Sinteis
Voltase (V)
Luas Permukaan (m2/g)
Diameter Partikel Rata-rata (nm)
30 54,786 21,14
70 27,997 41,37
Pada Tabel 1 terlihat bahwa Magnetit hasil sintesis voltase 30 V menghasilkan diameter partikel yang lebih kecil daripada 70 V. Makin besar voltase yang digunakan maka diameter partikel rata-rata Magnetit yang dihasilkan makin besar. Voltase makin besar maka reaksi lebih cepat berlangsung karena difusivitas masing-masing ion meningkat jika voltase meningkat, dimana voltase berbanding lurus dengan rapat arus. Perjalanan ion-ion makin cepat seiring dengan naiknya voltase sehingga mempercepat terjadi reaksi maka pembentukan partikel makin cepat dan diamter partikel makin besar.
Analisis SEM
Analisis morfologi dan ukuran partikel dilakukan dengan SEM. Pada foto SEM tampak bahwa nanopartikel Fe3O4 yang disintesis pada voltase 50 V
menunjukkan morfologi sferik, masih teraglomerasi dan diperoleh ukuran partikel Magnetit sekitar 26,23-37,88 nm.
Gambar 6 Foto SEM Magnetit Hasil Sintesis Pada Voltase 50 V dengan Perbesaran 100.000x Penentuan Persentase Pb(II) Teradsorpsi terhadap Variasi pH
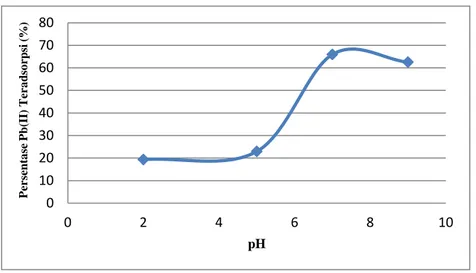
pH merupakan parameter yang dapat mempengaruhi persentase Pb(II) teradsorpsi. Persentase Pb(II) teradsorpsi rendah pada pH < 7. Hal ini
sehingga persentase ion logam yang terserap juga rendah. Selain itu, pada pH rendah permukaan Magnetit akan bermuatan positif yang disebabkan oleh banyaknya H+ yang berasal dari HNO3, sehingga terjadi tolak-menolak antara
permukaan Magnetit dengan ion Pb(II). Dengan kata lain terjadi kompetisi antara ion H+ dan ion Pb(II) dalam berinteraksi dengan sisi aktif yang dimiliki Magnetit sebagai adsorben, sehingga persentase teradsorpsi menjadi rendah.
Pada pH netral, persentase teradsorpsi Pb(II) mencapai kondisi optimum. Persentase optimum ini tercapai karena pada pH netral terjadi keadaan
kesetimbangan antara laju adsorpsi dengan desorpsi Magnetit sebagai adsorben dengan larutan Pb(II) sebagai adsorbat, sehingga proses penyerapan ion Pb(II) berada pada kondisi optimum.
Pada pH > 7 terjadi penurunan persentase Pb(II) teradsorpsi yang diperkirakan akibat meningkatnya konsentrasi ion OH-. Ion OH- dalam larutan yang semakin banyak cenderung berikatan dengan Pb(II) membentuk endapan Pb(OH)2 berwana putih, endapan Pb(II) dapat diamati pada dasar Erlenmeyer,
sehingga interaksi ion Pb(II) dengan atom O pada gugus hidroksil terganggu dan ion Pb(II) yang dapat diserap Magnetit berkurang.
Gambar 7 Kurva Pengaruh pH terhadap Persentase Pb(II) Teradsorpsi
Pada Gambar 7 dapat dilihat bahwa Persentase Pb(II) teradsorpsi
mengalami kenaikan pada pH 2, 5, dan 7 sebesar 19,34%, 22,94%, dan 65,95%. Sedangkan pada pH 9 mengalami penurunan persentase teradsorpsi yaitu sebesar 62,55%
Penentuan Persentase Pb(II) Teradsorpsi terhadap Variasi Waktu Pengadukan
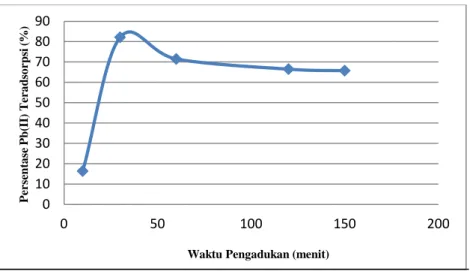
Variasi waktu pengadukan antara nanopartikel Magnetit dengan ion logam Pb(II) ditujukan untuk melihat lamanya kontak antara adsorben dengan adsorbat dalam hal kemampuan nanopartikel Magnetit secara maksimal menyerap ion logam Pb(II). Pada Gambar 8 terlihat bahwa persentase Pb(II) teradsorpsi
meningkat dan menurun seiring dengan bertambahnya waktu pengadukan. Hal ini terjadi karena peningkatan waktu pengadukan dapat dianggap sebagai proses ketidakstabilan pada permukaan adsorben.
0 10 20 30 40 50 60 70 80 0 2 4 6 8 10 Pe rsent a se Pb( II) T er a d so rp si ( % ) pH
Gambar 8 Kurva Pengaruh Waktu Pengadukan terhadap Persentase Pb(II) Teradsorpsi
Peningkatan proses penyerapan terjadi sampai waktu pengadukan 30 menit sebesar 82,14%. Pada saat itu nanopartikel Magnetit sudah mencapai
kesetimbangan antara laju adsorpsi dengan desorpsi. Pada waktu pengadukan 60 menit dan waktu pengadukan berikutnya, persentase Pb(II) teradsorpsi mengalami penurunan karena ikatan antar gugus yang terdapat dalam adsorben dengan ion logam makin melemah dan akhirnya lepas kembali ke dalam larutan. Sehingga hanya gugus yang berikatan kuat dengan adsorben saja yang masih dapat berikatan atau sering disebut proses desorpsi. Dengan demikian, disimpulkan bahwa waktu pengadukan optimum penyerapan nanopartikel Magnetit terhadap ion logam Pb(II) adalah 30 menit.
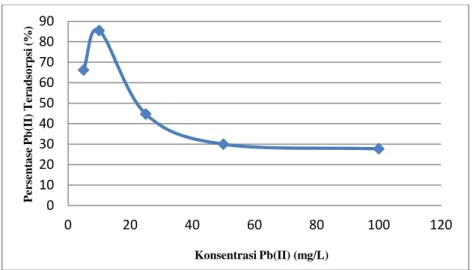
Penentuan Persentase Pb(II) Teradsorpsi terhadap Variasi Konsentrasi Konsentrasi ion logam berhubungan dengan jumlah sisi aktif yang terdapat pada permukaan Magnetit, bila jumlah sisi aktif cukup besar dibanding jumlah ion logam maka persentase teradsorpsi akan tinggi sampai pada jumlah sisi aktif sama dengan ion logam. Namun pada kondisi tertentu persentase teradsorpsi akan konstan bahkan terjadi penurunan karena telah terjadi kejenuhan pada material penyerap akibat kontak antara Magnetit sebagai adsorben dan larutan Pb(II) sebagai adsorbat yang telah mengalami kesetimbangan.
Pada Gambar 9 dapat diamati bahwa pada konsentrasi Pb(II) 5 mg/L, persentase Pb(II) teradsorpsi sebesar 66,17%, sedangkan pada konsentrasi 10 mg/L terjadi kondisi optimum adsorpsi nanopartikel Magnetit terhadap ion Pb(II) dengan persentase Pb(II) teradsorpsi sebesar 85,46%. Persentase Pb(II) teradsorpsi mengalami penurunan pada konsentrasi 25, 50, dan 100 mg/L sebesar 44,71%, 29,96%, dan 27,74%. 0 10 20 30 40 50 60 70 80 90 0 50 100 150 200 Pe rsent a se Pb( II) T er a d so rp si ( % )
Gambar 9 Kurva Pengaruh Konsentrasi terhadap Persentase Pb(II) Teradsorpsi Meningkatnya konsentrasi larutan Pb(II) diikuti oleh penurunan persentase Pb(II) teradsorpsi. Hal ini karena Magnetit sebagai adsorben mempunyai jumlah situs aktif yang terbatas sehingga daya adsorpsi nanopartikel Magnetit terhadap ion Pb(II) sudah mencapai kejenuhan dan terjadi desorpsi sehingga persentase teradsorpsi akan menurun. Selain itu, terjadi superdifusi (gerakan pelarut yang sangat cepat) karena adanya pengaruh dari gaya tarik permukaan dan gerakan random tiap molekul. Superdifusi partikel-partikel adsorbat pada permukaan dapat menghalangi partikel adsorbat yang lain untuk berinteraksi dengan permukaan adsorben karena terjadinya tumbukan akibat konsentrasi yang besar. Tumbukan ini akan menyebabkan partikel adsorbat yang menempel pada permukaan
adsorben dapat mengalami desorpsi (Kimmich, 2002). Sehingga pada konsentrasi lebih dari 10 mg/L, penyerapan ion Pb(II) mengalami penurunan.
Kesimpulan dan Saran 1. Kesimpulan
Berdasarkan hasil penelitian dapat disimpulkan bahwa: (1) nanopartikel Magnetit dapat disintesis dengan cara elektro-oksidasi besi dalam air demineralisasi dengan penerapan voltase 30, 50, dan 70 V. (2) Hasil analisis BET menunjukkan bahwa partikel Magnetit memiliki ukuran rata-rata partikel antara 21,14-41,37 nm. Dari hasil SEM tampak bahwa nanopartikel Magnetit yang dihasilkan bermorfologi sferik (bola) dan masih teraglomerasi. (3) nanopartikel Daya adsorpsi nanopartikel Magnetit terhadap Pb(II) dipengaruhi oleh pH, waktu pengadukan dan konsentrasi ion Pb(II). Persentase Pb(II) teradsorpsi mencapai optimal sebesar 85,46% pada pH 7 dengan waktu pengadukan 30 menit dan konsentrasi awal ion Pb(II) 10 mg/L.
2. Saran
Melakukan penelitian sintesis nanopartikel Magnetit dengan variasi waktu elektro-oksidasi. Mengembangkan penelitian yang difokuskan pada usaha
mencegah adanya agglomerasi dengan cara memodifikasi larutan elektrolit. Melakukan penelitian tentang adsorpsi dengan nanopartikel Magnetit lebih lanjut dengan mengganti logam berat lain, dengan memvariasi temperatur, memvariasi
0 10 20 30 40 50 60 70 80 90 0 20 40 60 80 100 120 Pe rsent a se Pb( II) T er a d so rp si ( % ) Konsentrasi Pb(II) (mg/L)
waktu pengadukan pada rentang yang lebih sempit antara 0 hingga 30 menit, dan melihat penggunaan ulang nanopartikel Magnetit sebagai adsorben. Mengingat besarnya penyerapan nanopartikel Magnetit pada logam Pb(II).
DAFTAR RUJUKAN
Amin, M.H., Khodabakhshi, A., Mozafari, M., Bina, B. & Kheiri, S. 2010. Removal of Cr(VI) from Simulated Electroplating Wastewater by Magnetite Nanoparticles. Environmental Engineering and Management Journal, 9 (7): 921-927.
Darmono. 2001. Logam dalam Sistem Biologi Mahluk Hidup. Jakarta: UI-Press.
Fajaroh, F., Setyawan, H., Winardi, S., Widyastuti, W., Raharjo, W. & Sentosa, E. 2009. Sintesis Nanopartikel Magnetite dengan Metode Elektrokimia
Sederhana. Jurnal Nanosains & Nanoteknologi, 2009: 22-25.
Fajaroh, F., Setyawan, H., Widiyastuti, W. & Winardi, S. 2012. Synthesis of Magnetite Nanoparticles by Surfactant-Free Electrochemical Method in an Aqueous System. Advanced Powder Technology, 2012 (23): 328-333.
Kimmich, R. 2002. Strange Kinetics, Porous Media, and NMR. Chemical Physics, 2002 (284): 253-285.
Pang, K.M., Ng, S., Chung, W.K. & Wong, P.K. 2007. Removal of
Pentachlorophenol by Adsorption on Magnetite-Immobilized Chitin. Water Air Soil Pollut, 2007 (183): 355-365.
Teja, A.S. & Koh, P. 2009. Synthesis, Properties, and Application of Magnetic Iron Oxide Nanoparticles. Progress in Crystal Growth and
Characterization of Materials, 2009 (55): 22-45.
Wang, S., Terdkiatburana, T. & Tade, M.O. 2008. Adsorption of Cu(II), Pb(II) and Humic Acid on Natural Zeolite Tuff in Single and Binary Systems.