UJI AKTIVITAS PENANGKAPAN RADIKAL
1,1-DIFENIL-2-PIKRILHIDRAZIL (DPPH) DAN PENETAPAN KANDUNGAN FENOLIK TOTAL FRAKSI ETIL ASETAT EKSTRAK ETANOLIK
KULIT BUAH JERUK PURUT (Citrus hystrix DC.) SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Ilmu Farmasi
Oleh :
Putut Wibisono
NIM : 098114132
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
UJI AKTIVITAS PENANGKAPAN RADIKAL
1,1-DIFENIL-2-PIKRILHIDRAZIL (DPPH) DAN PENETAPAN KANDUNGAN FENOLIK TOTAL FRAKSI ETIL ASETAT EKSTRAK ETANOLIK
KULIT BUAH JERUK PURUT (Citrus hystrix DC.) SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Ilmu Farmasi
Oleh :
Putut Wibisono
NIM : 098114132
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
2013
ii
UJI AKTIVITAS PENANGKAPAN RADIKAL
1,1-DIFENIL-2-PIKRILHIDRAZIL (DPPH) DAN PENETAPAN KANDUNGAN FENOLIK TOTAL FRAKSI ETIL ASETAT EKSTRAK ETANOLIK
KULIT BUAH JERUK PURUT (Citrus hystrix DC.)
Persetujuan Pembimbing
skripsi yang diajukan oleh: Putut Wibisono
NIM : 098114132
telah disetujui oleh
Pembimbing
iii
iv
PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma: Nama : Putut Wibisono
Nomor mahasiswa : 098114132
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan Universitas Sanata Dharma karya ilmiah saya yang berjudul “UJI AKTIVITAS PENANGKAPAN RADIKAL 1,1-DIFENIL-2-PIKRILHIDRAZIL (DPPH) DAN PENETAPAN KANDUNGAN FENOLIK TOTAL FRAKSI ETIL ASETAT EKSTRAK ETANOLIK KULIT BUAH JERUK PURUT (Citrus hystrix DC.)” beserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, mengalihkan dalam bentuk media lain, mengelolanya dalam bentuk pengkalan data, mendistribusikan secara terbatas dan mempublikasikannya dalam internet atau media lain untuk kepentingan akademis tanpa meminta izin dari saya maupun memberikan royalti kepada saya selama tetap mencantumkan nama saya sebagai penulis.
Demikian pernyataan ini saya buat dengan sebenarnya.
Yogyakarta, 8 Juli 2013 Yang menyatakan
v
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Apabila di kemudian hari ditemukan indikasi plagiarisme dalam naskah ini, maka saya bersedia menanggung segala sanksi sesuai peraturan perundang-undangan yang berlaku.
Yogyakarta, 8 Juli 2013 Penulis
vi
heavy and long struggle that will not
produce a beautiful piece with no sense
of gratitude to God, family and fellow
Kupersembahkan skripsi ini untuk:
Alhamdulillah, terimakasih Allah perjuangan berat
hambaMu yang lemah ini berakhir juga, Puji syukur selalu
hamba panjatkan kehadiratMu ya Allah, terima kasih
Allah, dengan kerikil-kerikil cobaan dariMu, hamba dapat
mengerti arti hidup yang sesungguhnya
.
Serta untuk kedua orang tua dan seluruh keluarga
besar saya.
And to someone special
^_^
vii
PRAKATA
Puji syukur kepada Tuhan atas semua berkat dan penyertaan-Nya kepada penulis sehingga penulis dapat menyelesaikan skripsi yang berjudul ”UJI AKTIVITAS PENANGKAPAN RADIKAL 1,1-DIFENIL-2-PIKRILHIDRAZIL (DPPH) DAN PENETAPAN KANDUNGAN FENOLIK TOTAL FRAKSI ETIL ASETAT EKSTRAK ETANOLIK KULIT BUAH JERUK PURUT (Citrus hystrix DC.)” ini dengan baik. Laporan akhir ini disusun untuk memenuhi salah satu syarat guna memperoleh gelar Sarjana Farnasi Universitas Sanata Dharma Yogyakarta.
Dalam proses penelitian dan penyusunan skripsi ini tidak lepas dari bantuan dan dukungan dari semua pihak sehingga skripsi ini dapat terselesaikan dengan baik. Oleh karena itu, dengan segala kerendahan hati atas segala bantuan yang telah diberikan penulis ingin mengucapkan terima kasih kepada:
1. Ipang Djunarko, M.Sc., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma.
2. Yohanes Dwiatmaka, M.Si., selaku Dosen Pembimbing yang telah memberikan bantuan dan bimbingan selama rancangan, pengusulan skripsi, saat dilakukan penelitian dan selama penulisan skripsi dengan kesabaran dan penuh perhatian.
3. Prof. Dr. C. J. Soegihardjo, Apt., sebagai Dosen Penguji atas pengarahan, kritik, saran yang membangun dan kesediaannya menguji skripsi ini.
4. Enade Perdana Istyastono, Ph.D., Apt. sebagai Dosen Penguji atas pengarahan, kritik, saran yang membangun dan kesediaannya menguji skripsi ini.
viii
5. Segenap laboran Laboratorium Farmakognosi-Fitokimia (Mas Wagiran) dan Kimia Analisis Instrumental (Mas Bima) atas segala bantuan selama penulis melakukan penelitian di laboratorium.
6. Augustinus Teti, Febrin Nessy Triana dan Wisnu Brahmana Putra , tim DPPH 2009 yang saling melengkapi, tanpa bantuan kalian skripsi ini tidak akan selesai.
7. Victor Purnama Agung, Agnes Mutiara , Novia Sarwoningtyas, Metri Styiawardani, dan Sisilia Mirsya sebagai teman berjuang satu lab. Dan Gank Galak (Saka Adhiyuda, Felix Pradana, dan Jati Panantya) sebagai pericuh jadwal kerja saya.
8. Teman-teman kelas C dan angkatan 2009 atas dukungan, doa, semangat, kritik, saran dan segala masukannya, yang selalu ada dan siap membantu. 9. Nur Hida sebagai pewarna hidup dan pemberi motivasi dalam skripsi ini. 10.Semua pihak yang telah memberikan bantuan dan dukungan yang tidak dapat
ix
Penulis menyadari bahwa dalam penulisan skripsi ini banyak kesalahan dan kekurangan mengingat keterbatasan kemampuan dan pengetahuan penulis. Untuk itu penulis mengharapkan saran dan kritik yang membangun dari semua pihak. Akhir kata semoga laporan ini dapat berguna bagi pembaca.
Yogyakarta, 8 Juli 2013
Putut Wibisono
x
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS ... iv
PERNYATAAN KEASLIAN KARYA ... v
HALAMAN PERSEMBAHAN ... vi
B. Perumusan masalah ... 2
C. Keaslian penelitian ... 2
D. Manfaat penelitian... 4
xi
2. Manfaat metodologis ... 4
3. Manfaat praktis ... 4
E. Tujuan Penelitian ... 5
1. Tujuan umum ... 5
2. Tujuan khusus ... 5
BAB II PENELAAHAN PUSTAKA ... 6
A. Jeruk Purut ... 6
2. Senyawa antioksidan ... 9
3. Mekanisme ... 9
4. Manfaat antioksidan ... 11
5. Metode pengujian antioksidan ... 11
D. Metode DPPH ... 13
E. Ekstraksi ... 13
F. Kesahihan Metode Analisis ... 14
xii
1. Kesalahan sistemik ... 14
2. Kesalahan sistematik ... 16
H. Landasan Teori ... 16
I. Hipotesis ... 17
BAB III METODE PENELITIAN ... 18
A. Jenis dan Rancangan Penelitian ... 18
B. Variabel Penelitian ... 18
C. Bahan-bahan Penelitian ... 18
D. Alat-alat Penelitian ... 18
E. Cara Kerja penelitian ... 19
1. Pemilihan dan pengumpulan sampel ... 19
2. Pembuatan ... 19
3. Ekstraksi dan fraksinasi ... 19
4. Penetapan aktivitas antioksidan ... 20
5. Penetapan kadar fenolik dalam ekstrak ... 22
BAB IV HASIL DAN PEMBAHASAN... 24
A. Hasil Determinasi Tanaman ... 24
B. Hasil Pengumpulan Bahan ... 24
C. Hasil Preparasi Sampel ... 25
D. Hasil Uji Pendahuluan ... 27
E. Optimasi Metode ... 29
1. Penentuan operating time (OT) ... 29
xiii
F. Hasil Validasi Metode Uji Aktivitas Antioksidan ... 34
1. Presisi ... 36
2. Linearitas... 37
3. Spesifitas ... 41
G. Hasil Estimasi Aktivitas Antioksidan dengan Radikal DPPH... 42
H. Hasil Validasi Metode Penetapan Kandungan Fenolik Total ... 45
1. Presisi ... 46
2. Linearitas... 46
3. Spesifitas ... 47
I. Hasil Estimasi Kandungan Fenolik Total ... 47
J. Hasil Analisa Statistik ... 50
BAB V KESIMPULAN DAN SARAN ... 54
A. Kesimpulan ... 54
B. Saran ... 54
DAFTAR PUSTAKA ... 55
LAMPIRAN ... 58
xiv
DAFTAR TABEL
Halaman Tabel I. Hasil pengukuran absorbansi seri rutin yang direaksikan
dengan DPPH ... 35 Tabel II. Hasil pengukuran absorbansi seri fraksi etil asetat ekstrak
etanol kulit buah jeruk purut yang direaksikan dengan DPPH .... 36 Tabel III. Hasil presisi aktivitas antioksidan standar rutin ... 37 Tabel IV. Hasil presisi aktivitas antioksidan fraksi etil asetat ... 37 Tabel V. Hasil aktivitas antioksidan rutin dengan metode DPPH ... 38 Tabel VI. Hasil aktivitas antioksidan fraksi etil asetat ekstrak etanol
dengan metode DPPH ... 40 Tabel VII. Hasil perhitungan IC50 rutin dan fraksi etil asetat ekttrak etanol
kulit buah jeruk purut ... 44 Tabel VIII. Penggolongan tingkat kekuatan antioksidan rutin dan fraksi etil
asetat ekstrak etanol kulit buah jeruk purut (Aryanto, 2006) ... 44 Tabel IX. Hasil presisi asam galat dari beberapa parameter ... 46 Tabel X. Hasil pengukuran absorbansi asam galat yang direaksikan
dengan reagen Folin-Ciocalteau ... 47 Tabel XI. Hasil penentuan jumlah fenolik total fraksi etil asetat ekstrak
xv
DAFTAR GAMBAR
Halaman Gambar 1. Hasil uji pendahuluan fenolik (A = kontrol negatif [blanko
reagen fenol Folin-Ciocalteu], B = larutan uji [fraksi etil asetat ekstrak etanol kulit buah jeruk purut] + reagen Folin-Ciocalteu,
C = kontrol positif [asam galat] + reagen Folin-Ciocalteu) ... 28
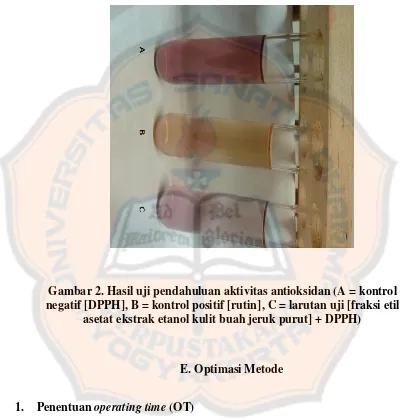
Gambar 2. Hasil uji pendahuluan aktivitas antioksidan (A = kontrol negatif [DPPH], B = kontrol positif [rutin], C = larutan uji [fraksi etil asetat ekstrak etanol kulit buah jeruk purut] + DPPH) ... 29
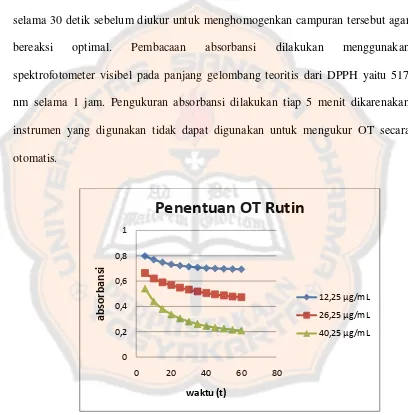
Gambar 3. Kurva penentuan OT rutin ... 30
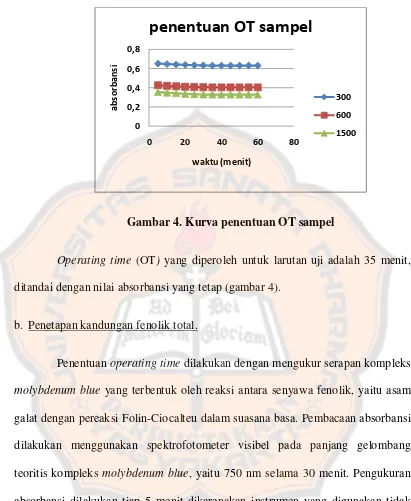
Gambar 4. Kurva penentuan OT sampel ... 31
Gambar 5. Penentuan OT fenolik sampel ... 32
Gambar 6. Kurva persamaan regresi linear antioksidan rutin ... 39
Gambar 7. Kurva persamaan regresi linear antioksidan fraksi etil asetat ... 40
Gambar 8. Reaksi terbentuknya warna kuning dari DPPH oleh adanya antioksidan (Molyneux, 2004) ... 42
Gambar 9. Struktur rutin (dos Santos et al., 2008). ... 43
Gambar 10. Kurva baku asam galat ... 45
Gambar 11. Struktur asam galat (Lopez, et al., 2003) ... 48
xvi
Gambar 13. Reaksi asam galat dengan pereaksi Folin-Ciocalteu (Oliveira et
al., 2099b) ... 49
Gambar 14. Hasil uji normalitas rutin ... 51
Gambar 15. Hasil uji normalitas sampel ... 51
Gambar 16. Hasil uji variansi data... 52
xvii
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Surat pengesahan determinasi tanaman jeruk purut ... 59
Lampiran 2. Gambar buah jeruk purut ... 60
Lampiran 3. Bobot fraksi etil asetat ekstrak etanol kulit jeruk purut ... 60
Lampiran 4. Data penimbangan uji aktivitas antioksidan ... 61
Lampiran5. Data perhitungan konsentrasi larutan DPPH, larutan pembanding rutin, dan larutan uji ... 62
Lampiran 6. Optimasi metode uji aktivitas antioksidan ... 63
Lampiran 7. Uji akitivitas antioksidan dengan menggunakan radikal DPPH ... 66
Lampiran 8. Perhitungan nilai IC50 rutin dan Fraksi etil asetat ekstrak etanol kulit jeruk Purut... 68
Lampiran 9. Data penimbangan penetapan kandungan fenolik total ... 69
Lampiran 10. Optimasi penetapan kandungan fenolik total ... 69
Lampiran 12. Penetapan Kandungan fenolik total ... 72
xviii
INTISARI
Penelitian ini bertujuan untuk mengetahui aktivitas antioksidan pada fraksi etil asetat ekstrak etanol kulit buah jeruk purut (Citrus hystrix DC.)
menggunakan radikal bebas DPPH dan untuk mengetahui kandungan ekivalen fenolik totalnya. Maserasi menggunakan pelarut etanol untuk mendapatkan ekstrak etanolnya. Ektraksi cair-cair menggunakan etil asetat untuk mendapatkan fraksi etil asetat ekstrak etanol.
Fraksi etil asetat yang didapat diuji aktivitas antioksidannya menggunakan radikal 1,1-diphenyl-2-picrylhydrazyl. Hasil dari pengukuran aktivitas antioksidan dinyatakan melalui harga Inhibition Concentration 50 (IC50) yang menyatakan konsentrasi yang menurunkan 50% dari konsentrasi DPPH awal yang dilihat dari absorbansinya. Adanya senyawa antioksidan akan mengubah warna ungu larutan DPPH menjadi kuning, disertai penurunan absorbansi DPPH. Penentuan kandungan fenolik total menggunakan metode Folin-Ciocalteau dinyatakan dengan nilai massa ekivalen asam galat per g fraksi etil asetat ekstrak etanol kulit buah jeruk purut. Senyawa fenolik akan dioksidasi oleh pereaksi fenol Folin-Ciocalteau dalam suasana basa sehingga terbentuk larutan berwarna ungu.
Hasil penelitian ini menunjukkan bahwa fraksi etil asetat ekstrak mempunyai nilai IC50 sebesar 962,667 ± 4,34 µg/mL dan kandungan fenolik total sebesar 417,33 ± 1,76 mg ekivalen asam galat per gram fraksi etil asetat ekstrak etanol kulit buah jeruk purut (Citrus hystrix DC.).
xix
ABSTRACT
This study aims to determine the antioxidant activity of the ethyl acetate fraction of the ethanol extract of the fruit peel lime (Citrus hystrix DC.) using DPPH free radicals and to determine the total phenolic content of equivalence. Maceration using ethanol solvent to obtain an extract ethanol. Liquid-liquid extraction using ethyl acetate to obtain ethyl acetate fraction of ethanol extract.
Ethyl acetate fraction obtained using the tested antioxidant activity radical 1,1-diphenyl-2-picrylhydrazyl. Results of measuring the antioxidant activity expressed through value Inhibition Concentration 50 (IC50) which states that lower the concentration of 50% of the initial DPPH concentration is seen from the absorbance. Presence of antioxidant compounds will change color purple DPPH solution to yellow, accompanied by decrease in absorbance of DPPH. Determination of total phenolic content using the Folin-Ciocalteau method revealed the mass value of gallic acid equivalents per g of ethyl acetate fraction of ethanol extract of lime rind. Phenolic compounds will be oxidized by the Folin-Ciocalteau phenol reagent under alkaline conditions, forming a purple solution.
Results of this study showed that the ethyl acetate extract fraction has a value of 1C50 962.667 ± 4.34 mcg / mL and total phenolic content of 417.33 ± 1.76 mg gallic acid equivalents per gram of ethyl acetate fraction of ethanol extract of the fruit peel lime (Citrus hystrix DC.).
Keywords: antioxidants, fruit peel lime (Citrus hystrix DC.), ethyl acetate fraction, DPPH, total phenolic content in the equivalent.
1
BAB I
PENGANTAR
A. Latar belakang
Tidak disadari bahwa gaya hidup modern dapat mempengaruhi proses rusaknya sel oleh senyawa radikal dari pengaruh luar, baik dari mengkonsumsi makanan kurang sehat, polusi lingkungan,dan sinar ultraviolet. Jika proses inti terjadi terus-menerus tanpa ada penanganan dapat merusak sel hingga organ fisiologi dan kerusakan genetika.
Antioksidan merupakan suatu spesies atau senyawa yang mempunyai aktifitas menetralkan radikal bebas dalam tubuh. Menurut sumbernya senyawa antioksidan dibagi menjadi dua, yaitu: antioksidan buatan (sintesis) dan antioksidan alami (Dalimarta dan Sudibyo, 1999). Biasanya senyawa antioksidan memiliki kelebihan pasangan elektron bebas yang dapat disumbangkan pada suatu senyawa radikal, sehingga senyawa radikal tidak aktif lagi.
Penentuan aktivitas antioksidan dapat dilakukan dengan beberapa macam metode, yaitu ferric thiocyanate (FTC), asam tiobarbiturat (TBA), Cupric ion antioksidant (CUPRAC), Ferric Reducing Ability of Plasma (FRAP), 2,2 dhipenyl-I-picrylhydrazil (DPPH), dan sebagainya. Alasan memilih menggunakan
2
Jeruk merupakan tanaman yang menghasilkan buah, dan ditanam terbesar ke-2 dieluruh dunia setelah tanaman anggur (Spiegel-roy dan Goldschmidt, 1996). Pengkonsumsian buah berkorelasi positif dengan penurunan tingkat penyakit jantung dan kanker (Cano, Medina, and Bermejo, 2008). Pada buah jeruk kandungan yang berperan positif bagi kesehatan adalah vitamin C, flavonoid, karotinoid, lemonoid, dan mineral. Flavonoid berperan penting sebagai senyawa antioksidan yang mampu menetralisir senyawa oksigen reaktif dan mencegah terjadinya penyakit kronis misalnya kanker (Fergusson 2002, Paulose 2005, Tripoli et al, 2007). Turunan flavonoid utama pada jeruk adalah naringenin, hesperidin, dan narirutin (Jacob et al, 2000) yang terdapat pada daging, kulit,dan biji (Tripoli et al, 2007).
B. Perumusan Masalah
Berdasarkan latar belakang yang telah dikemukakan, dapat dirumuskan permasalahan sebagai berikut.
1. Berapakah kandungan fenolik total fraksi etil asetat ekstrak etanolik kulit buah jeruk purut, yang dinyatakan dengan berat ekivalensi asam galat? 2. Apakah fraksi etil asetat ekstrak etanolik kulit buah jeruk purut memiliki
potensi aktivitas sebagai penangkap radikal (antioksidan), dengan metode DPPH yang dinyatakan dengan 𝐼𝐶50?
C. Keaslian Penelitian
Sudah ada beberapa penelitian tentang aktivitas antioksidan atau terkait dengan tanaman jeruk purut.
1. Penelitian kandungan flavonoid dan limonoid dalam jeruk purut dan jeruk kalamodin.
Devy, Yulianti, dan Andriani (2010) dengan judul “ Kandungan Flavonoid dan Limonoid pada Berbagai Fase Pertumbuhan Tanaman Jeruk Kalamodin (Citrus mitis Blanco) dan Purut (Citrus hystrix DC)“. Pada penelitian ini bertujuan mengetahui kandungan senyawa flavonoid dan limonoid pada tanaman jeruk purut dan kalamodin. Dengan determinasi pada umur buah dan daun (umur tua dan muda). Dapat diasumsikan flavonoid sebagai senyawa antioksidan
2. Isolasi dan karakteristik senyawa pada kulit jeruk purut.
Palupi, dan Kristani Adhitakarya (2011) dengan judul “Isolasi dan Karakterisasi Minyak Atsiri Kulit Buah Jeruk Purut (Citrus hystrix DC.) Serta Uji Toksisitasnya Terhadap Larva Udang Laut (Artemia salina L.)”. Penelitian ini bertujuan untuk mengetahui komponen penyusun minyak atsiri kulit buah jeruk purut, pengaruh waktu penampungan distilat terhadap profil komponen serta mengetahui pengaruh komposisi minyak atsiri kulit buah jeruk purut terhadap toksisitas pada A. salina L. Untuk mengetahui waktu efektif distilasi dilakukan penampungan distilat pada jam ke-1, 2, 3, 4 dan 5 kemudian dianalisis dengan Kromatografi Gas (KG).
3. Uji aktivitas bakteri pada minyak atsiri buah jeruk purut.
4
Staphylococcus aureus Dan Escherichia coli”.Pada penelitian ini dilakukan pengujian daya anti bakteri buah jeruk purut,dengan mendestilasi minyak atsiri dan mengujikan pada pertumbuhan bakteri Staphylococcus aureus dan Escherichia coli. Dan menghitung daya hambatnya dengan berbagai varian kadar minyak atsirinya.
Dari penelitian tersebut baik yang menggunakan buah dan kulit buah jeruk purut belum dilakukan penelitan uji aktivitas antioksidan fraksi etil asetat ekstrak etanol kulit buah jeruk dan penetapan kadar fenolik.
D. Manfaat Penelitian 1. Manfaat teoritis
Hasil penelitian ini diharapkan dapat membuktikan aktivitas penangkapan radiakal DPPH oleh fraksi etil asetat ekstrak etanolik kulit buah jeruk purut yang dinyatakan dengan 𝐼𝐶50?
2. Manfaat metodologis
Penelitian dapat digunakan sebagai acuan uji aktivitas antioksidan metode DPPH dan kandungan fenolik pada simplisa lain.
3. Manfaat praktis
Penelitian ini diharapkan mampu memberikan informasi tentang aktivitas antioksidan pada kandungan kulit jeruk purut, sehingga bisa dimanfaatkan dan berkorelasi positif terhadap bidang pendidikan dan kesehatan.
E. Tujuan 1. Tujuan umum
Penelitian ini bertujuan untuk mengetahui kandungan fenolik total dan aktivitas senyawa antioksidan, pada fraksi etil asetat ekstrak etanol kulit buah jeruk purut.
2. Tujuan khusus
a. Untuk mengetahui kandungan fenolik total fraksi etil asetat ekstrak etanolik kulit buah jeruk purut, yang dinyatakan dengan berat ekivalensi asam galat.
6
BAB II
PENELAAHAN PUSTAKA
A. Jeruk Purut 1. Klasifikasi tanaman
Menurut USDA (2013) dalam sistematika tumbuhan (taksonomi), tanaman jeruk purut mempunyai klasifikasi sebagai berikut.
Kerajaan : Plantae
Subkingdom : Tracheobionta Super Devisi : Spermatophyta Divisi : Magnoliophyta
Spesies : Citrus hystrix ( USDA, 2013) 2. Nama tumbuhan
Nama Latin : Citrus hystrix DC.
Nama Indonesia : Jeruk Purut
Nama Daerah : Jeruk Wangi (jawa)
3. Morfologi
Batang : batang bercabang dan berduri.
Daun : berbentuk khas, seperti dua helai yang tersusun vertikal akibat pelekukan bergerigi pada tepinya tebal dan permukaannya licin, agak berlapis lilin.
Buah : kecil, tidak pernah berdiameter lebih daripada 4cm, membulat dengan tonjolan-tonjolan dan permukaan kulitnya kasar, kulit buah tebal.
4. Kandungan kimia
Pada buah jeruk kandungan yang berperan positif bagi kesehatan adalah vitamin C, flavonoid, karotenoid, lemonoid, mineral, dan minyak atsiri. Flavonoid berperan penting sebagai senyawa antioksidan yang mampu menetralisir senyawa oksigen reaktif dan mencegah terjadinya penyakit kronis misalnya kanker (Fergusson 2002; Paulose 2005; Tripoli et al., 2007). Turunan flavonoid utama pada jeruk adalah naringenin, hesperidin, dan narirutin ( Jacob et al., 2000) yang terdapat pada daging, kulit, dan biji (Tripoli et al., 2007).
5. Manfaat
8
B. Senyawa Fenolik
Senyawa fenolik biasanya terdapat dalam berbagai jenis sayuran, buah-buahan dan tanaman. Turunan senyawa fenol merupakan metabolit sekunder terbesar yang diproduksi oleh tanaman. Senyawa ini diproduksi dalam tanaman melalui jalur sikimat dan metabolisme fenil propanoid. Senyawaan fenolik dapat memiliki aktivitas antioksidan, antitumor, antiviral, dan antibiotik (Apak et al., 2007).
Senyawa fenolik dalam suatu sampel secara kualitatif dan kuantitatif dapat ditentukan menggunakan metode Folin-Ciocalteu (Veeru et al., 2009). Metode ini menggunakan reagen fenol asam fosfomolibdat-fosfotungstat yang biasa disebut reagen fenol Folin-Ciocalteu. Prinsip metode ini adalah dengan adanya senyawa yang dapat mereduksi reagen fenol Folin-Ciocalteu, akan menyebabkan terbentuk senyawa yang berwarna biru. Intensitas warna biru yang terbentuk proporsional dengan jumlah senyawa yang dapat mereduksi dan dapat dideteksi dengan spektrofotometer dengan rentang panjang gelombang 500-750 nm (Abul-Fadl, 1949).
C. Antioksidan 1. Radikal bebas
Radikal bebas adalah atom atau molekul yang memiliki elektron tidak berpasangan (unpaired electron). Adanya elektron yang tidak berpasangan menyebabkan senyawa tersebut sangat reaktif mencari pasangan, dengan cara
menyerang dan mengikat elektron molekul yang berada di sekitarnya. Target utama radikal bebas adalah protein, asam lemak tak jenuh dan lipoprotein, serta unsur DNA termasuk karbohidrat. Dari molekul-molekul target tersebut, yang paling rentan terhadap serangan radikal bebas adalah asam lemak tak jenuh. Senyawa radikal bebas di dalam tubuh dapat merusak asam lemak tak jenuh ganda pada membran sel sehingga dinding sel menjadi rapuh, merusak basa DNA sehingga mengacaukan sistem genetika, dan berlanjut pada pembentukan sel kanker (Winarsi, 2007).
Sedangkan asam galat sering digunakan dalam berbagai jurnal ilmiah pengujian kandungan fenolik total sebagai ekivalen terhadap kandungan fenolik total bahan tumbuhan yang diuji (Javanmardi, Stushnoff, Locke, dan Vivanco, 2003; Wangcharoen dan Morasuk, 2007 a&b; Dehpour et al., 2009; Inglett, Rose, Chen, Stevenson, dan Biswas, 2009; Veeru et al., 2009).
2. Senyawa antioksidan
Berdasarkan sumbernya, antioksidan dapat dibedakan menjadi antioksidan endogen dan eksogen. Antioksidan endogen terdapat secara alamiah dari dalam tubuh sedangkan antioksidan eksogen dari luar tubuh (Percival, 1998). Antioksidan eksogen sendiri dibedakan menjadi antioksidan alami dan sintetik (Miller, 1996).
3. Mekanisme
Secara non-enzimatik, senyawa antioksidan bekerja melalui empat cara, yaitu sebagai berikut:
10
b) Pengkelat logam transisi, misalnya EDTA,
c) Inhibitor enzim oksidatif, misalnya aspirin dan ibuprofen, dan
d) Kofaktor enzim antioksidan, misalnya selenium sebagai kofaktor glutation peroksidase (Huang et al., 2005).
Menurut sumbernya, antioksidan dapat digolongkan menjadi dua macam, yaitu antioksidan sintetik dan alami (Gulcin, 2004).
hewan uji. Semua publikasi juga setuju dengan fakta tersebut. Lain halnya vitamin E yang merupakan antioksidan alami tidak memiliki sifat karsinogenik. BHT yang diadministrasikan secara kronis terhadap mencit menyebabkan menurunnya konsentrasi alpha isozyme of protein kinase C (PKCa) dalam paru-paru sehingga dapat menginisiasi terjadinya tumor (Kahl, 1984; dan Malkinson, 1999).
b. Antioksidan alami. Antioksidan alami merupakan antioksidan yang diproduksi langsung oleh tanaman maupun tubuh, contohnya: senyawa polifenol flavonoid, tanin, katalase dan glutation peroksidase bekerja dengan cara mengubah H2O menjadi H2O dan O2, sedangkan superoksid dismutase bekerja dengan cara mengkatalisis reaksi dismutasi dari radikal anion superoksida menjadi HO (Percival, 1998; Gulcin et al., 2004; Winarsi, 2007).
4. Manfaat antioksidan
12
5. Metode pengujian antioksidan
Terdapat beberapa metode pengujian aktivitas antioksidan baik secara kualitatif maupun secara kuantitatif. Uji kualitatif untuk mengetahui apakah suatu senyawa memiliki aktivitas antioksidan dapat dilakukan dengan metode kromatografi baik kromatografi lapis tipis atau kromatografi kertas. Metode ini dapat untuk memisahkan campuran antioksidan yang kompleks sekalipun. Pereaksi semprot yang digunakan untuk deteksi dapat dibedakan menjadi empat kelompok, yaitu sebagai berikut.
a. Senyawa-senyawa yang dapat membentuk warna ketika tereduksi (kalium permanganat, ferri-sianida, ferri-dipiridil, dan asam fosfomolibdat).
b. Senyawa yang dapat berikatan dengan senyawa fenol, seperti senyawa diazo, pereaksi diazo, magnesium sulfat, aldehid aromatic-anisaldehid, vanillin dan pereaksi Gibbs yang membentuk indofenol (akan membentuk garam berwarna dalam kondisi basa).
c. Radikal bebas stabil yang menerima radikal hidrogen dari antioksidan (1,1-difenil-2-pikrilhidrazil).
d. Senyawa-senyawa yang membentuk senyawa adisi yang berwarna (palladium klorida dan pentadium klorida) (Davidek, 1997).
Pada tahun 2005, Shivaprasad, Mohan, Kharya, Shiradkar, dan Lakshman melaporkan bahwa uji aktivitas antioksidan dapat dilakukan secara spektrofotometri. Uji tersebut dilakukan secara in-vitro.
D. Metode DPPH
Metode yang paling sering digunakan untuk menguji aktivitas antioksidan tanaman obat adalah metode uji dengan menggunakan radikal bebas DPPH (Shivaprasad et al., 2005). Tujuan metode ini adalah mengetahui parameter konsentrasi yang ekuivalen memberikan 50% efek aktivitas antioksidan (IC50). Hal ini dapat dicapai dengan cara menginterpretasikan data eksperimental dari metode tersebut (Molyneux, 2004). DPPH merupakan radikal bebas yang dapat bereaksi dengan senyawa yang dapat mendonorkan atom hidrogen, dapat berguna untuk pengujian aktivitas antioksidan komponen tertentu dalam suatu ekstrak (Dinis, Maderia, dan Almeida, 1994).
E. Ekstraksi
Ekstrak adalah sediaan pekat yang diperoleh dengan cara mengekstraksi zat aktif dari simplisia nabati atau hewani menggunakan pelarut yang sesuai, selanjutnya pelarut diuapkan sampai semua atau hampir semua pelarut menguap (Direktorat Jenderal Pengawasan Obat dan Makanan RI, 1995).
Dalam memilih cairan penyari, seseorang harus mempertimbangkanbanyak faktor. Cairan penyari yang baik harus memenuhi kriteria berikut ini:
(a) Murah dan mudah diperoleh, (b) stabil secara fisika dan kimia, (c) bereaksi netral,
14
(e) selektif,
(f) tidak mempengaruhi zat berkhasiat, dan
(g) diperbolehkan oleh peraturan yang berlaku (Anonim, 1986).
Metode penyarian yang digunakan tergantung dari wujud dan kandungan zat dari bahan yang akan disari. Cara penyarian dapat dibedakan menjadi: infundasi, maserasi, perkolasi, dan penyarian berkesinambungan (Anonim, 1986).
F. Kesahihan Metode Analisis
Kesahihan metode analisis diartikan sebagai suatu prosedur yang digunakan untuk membuktikan bahwa metode analisis tersebut dapat memberikan hasil seperti yang diharapkan dengan kecermatan dan ketelitian yang memadai. Metode analisis instrumen merupakan metode yang terpilih dan memadai untuk mengantisipasi persoalan analisis, yaitu sangat kecilnya kadar senyawa yang dianalisis dan kompleksnya matriks sampel yang dianalisis (Mulja dan Suharman, 1995). Untuk itu diperlukan suatu pedoman mengenai kesahihan metode analisis yang didukung oleh parameter-parameter presisi, linearitas, dan spesifisitas.
G. Kesalahan dalam Metode Analisis
Kesalahan dalam metode analisis sangat sukar untuk dihilangkan namun sumber kesalahan tetap harus ditekan seminimal mungkin. Kesalahan dalam analisis kimia dapat dikategorikan menjadi dua kelas utama.
1. Kesalahan sistemik
Kesalahan sistemik adalah hasil analisis yang menyimpang secara tetap dari harga kadar yang sebenarnya karena proses pelaksanaan prosedur analisis, sehingga kesalahan ini disebut juga kesalahan prosedur (Mulja dan Suharman, 1995). Kesalahan sistematik dapat disebabkan oleh beberapa faktor, yaitu sebagai berikut.
a. Kesalahan personil dan operasi. Kesalahan ini disebabkan oleh cara pelaksanaan analisis, bukan karena metode. Kesalahan operasi umumnya bersifat fisis (bukan khemis), misalnya kesalahan pengamatan visual pada titik akhir titrasi, kekeliruan cara pencucian endapan, dan sebagainya. Jadi kesalahan ini bersifat individual dan sangat dipengaruhi oleh ketrampilan analis dalam melakukan pekerjaan analisis.
b. Kesalahan alat dan pereaksi. Kesalahan ini disebabkan oleh pereaksi yang kurang murni, alat yang kurang valid atau pemakaian alat yang kurang tepat walaupun alatnya sendiri baik, contohnya pengambilan volume tepat dengan pipet ukur atau gelas ukur, penggunaan buret 50 mL (buret makro) untuk analisis mikro, dan sebagainya.
16
2. Kesalahan sistematik
Kesalahan sistematik adalah penyimpangan yang tidak tetap dari hasil penentuan kadar dengan instrumen yang disebabkan fluktuasi dari instrument yang dipakai. Penyebab kesalahan ini tidak dapat ditentukan dan tidak dapat dikontrol maka kesalahan ini disebut juga kesalahan acak (Mulja dan Suharman,1995).
H. Landasan Teori
Radikal bebas adalah atom atau molekul yang memiliki elektron tidak berpasangan. Radikal bebas akan menstabilkan diri dengan cara menyerang dan mengikat elektron molekul yang berada di sekitarnya sehingga dapat menyebabkan kerusakan oksidatif sel yang berdampak menimbulkan berbagai macam penyakit seperti penyakit kardiovaskuler, kanker, dan penuaan dini. Suatu senyawa radikal dapat ditemukan didalam tubuh maupun dari luar tubuh dari luar tubuh sangat berpengaruh dalam proses penuaan dini oleh faktor gaya hidup dan faktor lingkungan.
Jeruk merupakan tanaman yang mudah dibudidayakan di berbagai tempat, budidaya jeruk menempati urutan nomer 2 setelah anggur sebagai buah konsumtif. Banyak masyarakat yang mengkonsumsi buah jeruk untuk mendapatkan manfaatnya sebagai asupan vitamin c. Dalam kandungan jeruk terdapat vitamin C ,flavonoid ,karotinoid, limonoid dan minyak atsiri.
Aktivitas antioksidan dapat diuji dengan metode menggunakan radikal bebas DPPH. Karena adanya elektron yang tidak berpasangan, DPPH
memberikan serapan kuat pada 517 nm. Ketika elektronnya menjadi berpasangan oleh keberadaan penangkap radikal bebas, maka absorbansinya menurun secara stokiometri sesuai jumlah elektron yang diambil. Keberadaan senyawa antioksidan dapat mengubah warna larutan DPPH dari ungu menjadi kuning.
I. Hipotesis
18 BAB III
METODOLOGI PENELITIAN
A. Jenis Penelitian dan Rancangan Penelitian
Penelitian ini termasuk penelitian eksperimental dengan tahapan penelitian sebagai berikut :
(a.)Pemilihan dan pengumpulan sampel, (b.)pembuatan simplisia,
(c.)ekstraksi dan fraksinasi simplisia, (d.)eenetapan aktivitas antioksidan, dan (e.)penetapan kadar fenolik dalam ekstrak.
B. Variabel penelitian Variabel bebas :Konsentrasi ekstrak sampel. Variabel tergantung : Nilai IC50.
C. Bahan-bahan penelitian
Serbuk sampel kulit jeruk, etanol, etil asetat, reagen DPPH, DPPH dalam etanol, metanol.
D. Alat-alat Penelitian
Spektrofotometer uv-visibel Simadzhu®. alat-alat gelas, corong pisah, corong Buchner, ayakan, vortex, ultrasonik, maserator, vacuum rotary evaporator.
E. Cara Kerja Penelitian 1. Pemilihan dan pengumpulan sampel
Pengumpulan sampel kulit jeruk diambil langsung di perkebunannya dengan memilih jeruk dengan usia tertentu yang merupakan usia konsumsi dari buah jeruk tersebut.
2. Pembuatan simplisia
Kulit jeruk dicuci bersih, ditiriskan dan diiris tipis. Kemudian dikeringkan dalam oven pada suhu 50-55o C selama 24 jam. Simplisia kering ditandai dengan kult jeruk yang telah menjadi rapuh kemudian diserbuk kasar dengan menggunakan mesin penyerbuk dan dilewatkan ayakan no mesh40.
3. Ekstraksi dan fraksinasi simplisia
Sebanyak 1 kg serbuk simplisia kulit jeruk dimasukkan ke dalam bejana maserasi, ditambah dengan etanol sampai terendam sempurna dan dicampur homogen. Campuran dimaserasi pada suhu ruangan selama tiga hari. Filtrat diperoleh melalui penyaringan menggunakan kertas saring kasar dengan bantuan corong Buchner dan pompa vakum. Ampas penyaringan diremaserasi dengan etanol kembali selama tiga hari. Kemudian filtrat dicampur dengan filtrat terdahulu. Keseluruhan filtrat diuapkan pelarutnya dengan vacuum rotary evaporator sehingga diperoleh ekstrak etanol kental kulit jeruk.
20
didapatkan fraksi air dan fraksi etil asetat. Fraksi etil asetat diuapkan dengan vacuum rotary evaporator sehingga didapatkan ekstrak etil asetat kental dengan
parameter berat konstan dalam pengeringan. Ekstrak ini yang digunakan untuk analisis selanjutnya.
4. Penetapan aktivitas antioksidan a. Kualitatif
1) Uji fenolik. Sejumlah 0,5 mL larutan uji 500,0 µg/mL dan larutan pembanding asam galat 150,0 µg/mL dimasukan ke dalam tiga tabung reaksi. Lalu ditambahkan 5 mL pereaksi fenol Folin-Ciocalteu yang telah diencerkan dengan akuades (1:10 v/v) kedalam tabung reaksi. Diamkan selama 10 menit. Tambahkan 4 mL larutan natrium karbonat 1 M. Kemudian amati warna larutan tersebut.
2) Uji pendahuluan aktivitas antioksidan. Sebanyak 1 mL larutan DPPH dimasukkan ke dalam masing-masing tiga tabung reaksi. Ditambahkan masing-masing dengan 1 mL metanol p.a, larutan pembanding rutin 37,5 μg/mL, dan larutan fraksi etil asetat sampel 500,0 μg/mL. Selanjutnya, larutan tersebut ditambahkan dengan 3 mL
metanol p.a. Larutan tersebut kemudian di vortex selama 30 detik. Setelah 30 menit, amati warna pada larutan tersebut.
b. Kuantitatif
1) Pembutan larutan DPPH 0,4 mM
Sebanyak 15,8 mg serbuk DPPH dimasukkan ke dalam labu takar 100,0 ml, lalu ditambahkan etanol hingga batas tanda. Dihomogenkan dengan bantuan vortex untuk melarutkan DPPH.
2) Pembuatan larutan rutin 0,250 mg/ml
Sebanyak 2,5 mg rutin dimasukkan dalam labu takar 10 ml, masukkan etanol hingga batas tanda. Ambil sebanyak 0,5; 1,0; 1,5; 2,0; 2,5 ml larutan stok rutin masukkan dalam labu takar, tambahkan etanol hingga batas tanda hingga diperoleh larutan pembanding 12,5; 2,5; 37,5; 50,0; dan 62,5 μg/ml.
3) Pembuatan larutan uji aktivitas antioksidan
75 mg ekstrak ditimbang kemudian ditambahkan metanol sampai 25,0 ml. Dari larutan tersebut diambil 1,0; 2,0; 3,0; 4,0; 5,0 ml kemudian ditambahkan metanol sampai 10,0 ml sehingga diperoleh larutan uji dengan konsentrasi 0,3; 0,6; 0,9; 1,2; dan 1,5 mg/ml.
4) Penentuan operating time
Sebanyak 2,0 ml larutan DPPH 0,4 mM dimasukkan ke dalam labu takar 10,0 ml, tambahkan larutan stok rutin 2 ml kemudian tambahkan etanol hingga batas tanda. Larutan dihomogenkan dengan vortex selama 30 detik. Setelah itu baca absorbansinya pada λ 517 nm tiap 10 menit selama
1 jam. Tentukan operating time reaksi. 5) Penentuan aktivitas antioksidan
22
diketahui konsentrasinya. Tambahkan metanol hingga batas tanda. Larutan divortex selama 30 detik dan didiamkan selama operating time. Baca absorbansinya pada λ 517 nm. Aktivitas antioksidan dihitung
dengan rumus:
% aktivitas antioksidan = (absorbansi kontrol −absorbansi sampel )
absorbansi kontrol x 100%
5. Penetapan kadar fenolik dalam ekstrak a. Pembuatan larutan asam galat
Dibuat larutan asam galat dengan konsentrasi 500 μg/ml dalam aquades :
etanol p.a (1:1). Diambil sebanyak 1,0;1,5; 2,0; 2,5; 3,0 ml. Larutan tersebut kemudian ditambahkan aquades: metanol p.a (1:1) ad sampai 10 ml, sehingga diperoleh konsentrasi larutan baku asam galat 50; 75; 100; 125; dan 150 µg/ml.
b. Pembuatan kurva baku asam galat
Sebanyak 0,5 ml larutan asam galat konsentrasi 50; 75; 100; 125; dan 150 µg/ml ditambahan dengan 5 ml reagen Folin-Ciocalteu yang telah diencerkan dengan air (1:10 v/v). Larutan selanjutnya ditambahkan dengan 4,0 ml Na2CO3 1 M. Setelah 10 menit, baca absorbansi pada panjang gelombang 750 nm terhadap blangko yang terdiri dari aquades : etanol (1:1), reagen Folin-Ciocalteu, dan larutan Na2CO3 1 M.
c. Validasi metode penetapan kandungan fenolik total
Hasil dari prosedur 5.b. divalidasi berdasarkan parameter presisi (% CV), linearitas (nilai r), serta spesifitas (spektra kontrol).
d. Estimasi kandungan fenolik total larutan uji
24 BAB IV
HASIL DAN PEMBAHASAN A. Hasil Determinasi Tumbuhan
Langkah awal yang dilakukan pada penelitian ini adalah determinasi tanaman. Tujuan determinasi tanaman tersebut adalah untuk mengetahui kebenaran identitas tanaman yang digunakan dalam penelitian. Kebenaran identitas tanaman tersebut digunakan untuk menghindari adanya kemungkinan kesalahan dalam pengambilan sampel pada analisis fitokimia (Harborne, 1987).
Hasil determinasi menurut Bonivia (1888) sampel yang uji dalam penelitian ini telah dibuktikan, yaitu Citrus hystrix DC (lampiran 1).
B. Hasil Pengumpulan Bahan
Buah dipanen pada tanggal 23 Agustus 2012 di perkebunan salah satu warga (di Kabupaten Klaten, Dukuh Gandekan Maliman, desa Keden, kecamatan Pedan).
Buah tersebut dipanen dengan kriteria diameter buah ± 3 cm. Waktu pemanenan dilakukan pada musim kemarau dan dilakukan pada waktu pagi hari, yang bertujuan menghindari penguraian senyawa aktif pada kulit buah oleh mikroorganisme dan pekembang biakan mikroorganisme meningkat seiring meningkatnya kelembaban udara lingkungan. Dilakukan pada pagi hari bertujuan untuk menghindari senyawa metabolit sekunder telah mengalami perubahan pada tahap fotosintesis oleh pengaruh mtahari. Usaha pemanenan seperti kriteria diatas bertujuan untuk mengoptimalkan metabolit sekunder yang dihasilkan dalam ekstraksi.
C. Hasil Preparasi Sampel
Tujuan dalam preparasi sampel yaitu untuk mendapatkan fraksi etil asetal ekstrak kulit jeruk purut yang diduga dalam fraksi tersebut mengandung banyak senyawa metabolit sekunder yang berperan sebagai antioksidan. Kulit jeruk yang didapatkan kemudian dicuci dengan air mengalir kemudian dipotong kasar dan dikeringkan dalam oven pada suhu ± 50ºC selama 24 jam. Sampel kasar kemudian dihaluskan dengan cara di blender tujuanya adalah untuk memperkecil ukuran partikel permukaan kulit jeruk sehingga penyarian akan bertambah baik jika permukaan simplisia yang kontak dengan penyari semakin luas (Harborne, 1987).
26
Etanol 76% digunakan dalam proses ini karena peneliti ingin mengekstraksi senyawa fenolik dari kulit buah jeruk purut. Untuk mengekstraksi senyawa fenolik dalam bahan tumbuhan dapat dilakukan dengan pelarut polar seperti etanol, metanol, n-butanol, aseton, dimetilsulfoksida, dimetilformamida, dan air (Markham, 1988). Alasan tidak digunakan pelarut aseton, dimetilsulfoksida, dimetilformamida, dan air adalah senyawa fenolik lebih larut dalam campuran larutan alkohol dengan air daripada pelarut polar lainnya (Bruneton, 1999).
Tujuan penyaringan filtrat menggunakan corong Buchner yang diintegrasikan dengan pompa vacuum daripada dengan penyaringan biasa adalah untuk mempercepat proses penyaringan dan memperbanyak hasil penyaringan. Setelah itu, untuk menguapkan pelarut hasil penyaringan filtrat, digunakan alat vacuum rotary evaporator. Alat tersebut dapat menguapkan pelarut dibawah titik
didih (t.d.) pelarut , yaitu etanol. Etanol memiliki t.d. sebesar 78,5 0C . selain mempercepat penguapan juga menngunakan suhu dibawah titik didih dimaksudkan agar menjaga kestabilan senyawa fenolik pada filtrat (O'Neil, Smith, Heckelman, Obenchain Jr., Gallipeau, D'Arecca et al., 2001).
Setelah didapatkan ekstrak kental etanolik kulit jeruk purut, kemudian ekstrak tersebut dilarutkan dengan air hangat. Digunakan air hangat agar dapat lebih melarutkan ekstrak etanolik sampel. Fraksi air berada di bagian bawah, sedangkan fraksi wash bensin berada di bagian atas. Hal ini dikarenakan berat jenis (b.j.) air lebih besar daripada wash bensin. Air memiliki b.j. sebesar 0,996 sedangkan b.j. wash bensin sebesar 0,730 (Direktorat Jenderal Pengawasan Obat
dan Makanan RI, 1995; Laboratoire, 2009). Washbensin digunakan untuk menghilangkan senyawa-senyawa yang tidak diinginkan yg bersifat nonpolar seperti lipid, klorofil, dll. Setelah didapatkan fraksi air kemudian dilakukan ekstraksi cair menggunakan etil asetat, pada ekstraksi ini dilakukan pengulangan 3 kali yang bertujuan mengoptimalkan senyawa fenolik yang terekstraksi pada fase etil asetat. Setelah semua fraksi etil asetal di dapatkan kemudian diuapkan pelarut dengan vacum evaporator, setelah hampir menguap secara keseluruhan ekstrak ditampung dalam cawan porselen kemudian di oven hingga bobot konstan pada suhu 50ºC. Rendemen yang di dapat berupa ekstrak kental berwarna coklat kehitaman.
D. Hasil Uji Pendahuluan
28
Gambar 1. Hasil uji pendahuluan fenolik (A = kontrol negatif [blanko reagen fenol Folin-Ciocalteu], B = larutan uji [fraksi etil asetat ekstrak
etanol kulit buah jeruk purut] + reagen Folin-Ciocalteu, C = kontrol positif [asam galat] + reagen Folin-Ciocalteu)
Adanya senyawa fenolik dalam fraksi uji akan mengubah warna larutan menjadi biru. Perubahan warna tersebut terjadi karena oksidasi senyawa fenol dalam fraksi uji oleh pereaksi Folin-Ciocalteu. Hasil pengujian pada fraksi etil asetat ekstrak etanolik kulit buah jeruk menunjukkan positif terdapat kandungan fenolik karena terbentuk warna biru, hal tersebut terjadi pula pada senyawa pembanding asam galat.
Pada uji pendahuluan aktivitas antioksidan, baik senyawa uji maupun senyawa pembanding, yaitu rutin ditambahkan pada larutan DPPH dalam metanol. Adanya aktivitas antioksidan akan mengubah warna larutan DPPH yang semula berwarna ungu menjadi kekuningan. Hasil pengujian baik untuk senyawa
uji maupun senyawa pembanding semuanya positif karena terjadi perubahan warna pada larutan DPPH dalam metanol menjadi kekuningan, dibandingkan dengan kontrol berupa larutan DPPH dalam metanol yang berwarna ungu.
Gambar 2. Hasil uji pendahuluan aktivitas antioksidan (A = kontrol negatif [DPPH], B = kontrol positif [rutin], C = larutan uji [fraksi etil
asetat ekstrak etanol kulit buah jeruk purut] + DPPH)
E. Optimasi Metode
1. Penentuan operating time (OT)
30
a. Uji aktivitas antioksidan.
Penentuan operating time dilakukan dengan mengukur serapan larutan DPPH yang telah ditambahkan senyawa uji maupun senyawa pembanding rutin pada tiga konsentrasi berbeda (low, medium, dan high). Larutan divorteks dahulu selama 30 detik sebelum diukur untuk menghomogenkan campuran tersebut agar bereaksi optimal. Pembacaan absorbansi dilakukan menggunakan spektrofotometer visibel pada panjang gelombang teoritis dari DPPH yaitu 517 nm selama 1 jam. Pengukuran absorbansi dilakukan tiap 5 menit dikarenakan instrumen yang digunakan tidak dapat digunakan untuk mengukur OT secara otomatis.
Gambar 3. Kurva penentuan OT rutin
Operating time (OT) yang diperoleh untuk larutan pembanding rutin
adalah 35 menit, ditandai dengan nilai absorbansi yang tetap (gambar 3).
Gambar 4. Kurva penentuan OT sampel
Operating time (OT) yang diperoleh untuk larutan uji adalah 35 menit,
ditandai dengan nilai absorbansi yang tetap (gambar 4).
b. Penetapan kandungan fenolik total.
Penentuan operating time dilakukan dengan mengukur serapan kompleks molybdenum blue yang terbentuk oleh reaksi antara senyawa fenolik, yaitu asam galat dengan pereaksi Folin-Ciocalteu dalam suasana basa. Pembacaan absorbansi dilakukan menggunakan spektrofotometer visibel pada panjang gelombang teoritis kompleks molybdenum blue, yaitu 750 nm selama 30 menit. Pengukuran absorbansi dilakukan tiap 5 menit dikarenakan instrumen yang digunakan tidak dapat digunakan untuk mengukur OT secara otomatis.
32
Gambar 5. Penentuan OT fenolik sampel
Operating Time (OT) yang diperoleh untuk larutan asam galat adalah 30
menit, ditandai dengan nilai absorbansi yang tetap (gambar 5).
2. Penentuan panjang gelombang serapan maksimum a. Uji aktivitas antioksidan
Meskipun telah diketahui dari sejumlah literatur (Blois, 1958; Lu dan Foo, 2000; Zhu et al., 2002) bahwa panjang gelombang serapan maksimum DPPH yaitu pada λ 517 nm, tetapi tetap perlu untuk dilakukan penentuan dikarenakan panjang gelombang serapan maksimum dapat mengalami perubahan (pergeseran) dikarenakan perbedaan kondisi percobaan yang dilakukan. Perubahan tersebut dapat berupa perbedaan instrumen, waktu pengukuran, pelarut, iklim, maupun individu yang melakukan penelitian.
Penentuan panjang gelombang serapan maksimum dilakukan terhadap larutan DPPH dalam pelarut metanol pada tiga konsentrasi, setelah sebelumnya divorteks. Scanning dilakukan pada panjang gelombang 400-600 nm. Hasilnya
diperoleh panjang gelombang serapan maksimum untuk penelitian ini adalah 515,7 nm. Selisih panjang gelombang ini dengan panjang gelombang maksimum teoritis sebesar 1,3 nm, selisih nilai ini masih memenuhi selisih yang diperbolehkan dalam Farmakope Indonesia Edisi IV, yaitu kurang dari 2 nm. Karena hal diatas, panjang gelombang maksimum yang diperoleh dapat digunakan dalam penelitian.
b. Penetapan kandungan fenolik total
Dilakukan pula penentuan panjang gelombang serapan maksimum untuk pengujian kandungan fenolik total. Scanning dilakukan pada tiga seri konsentrasi asam galat (low, medium, dan high) pada panjang gelombang 600-800 nm. Dari hasil scanning diperoleh panjang gelombang maksimum untuk penentuan kandungan fenolik total adalah 750 nm. Hasil tersebut sesuai dengan panjang gelombang maksimum teoritis dari kompleks molybdenum blue, yaitu 750 nm.
34
panjang gelombang maksimum digunakan sebagai data sekunder dalam analisis kualitatif.
Dalam analisis kuantitatif, pengukuran absorbansi selalu dilakukan pada panjang gelombang serapan maksimum dikarenakan perubahan absorbansi untuk tiap perubahan konsentrasi adalah paling besar sehingga memberikan kepekaan analisis yang tinggi. Selain itu, bila dilakukan pengukuran pada panjang gelombang serapan maksimum maka untuk pengukuran berulang hasilnya lebih reprodusibel sehingga kesalahan yang terjadi makin kecil (Mulja dan Suharman,1995).
F. Validasi Metode Analisis Aktivitas Antioksidan
Validasi metode analisis adalah suatu penilaian terhadap parameter tertentu berdasarkan percobaan di laboratorium, untuk membuktikan bahwa parameter tersebut memenuhi persyaratan yang digunakan (Harmita, 2004). Validasi metode analisis perlu dilakukan baik untuk uji aktivitas antioksidan dengan metode DPPH maupun penetapan kandungan fenolik total dengan metode Folin-Ciocalteu. Parameter validasi yang dinilai meliputi presisi, linearitas serta spesifisitas pengukuran.
Tabel I. Hasil pengukuran absorbansi seri baku rutin yang direaksikan dengan DPPH
Dilihat dari data persamaan regresi linear seri baku rutin yang di atas, dipilih persamaan dari hasil replikasi, yaitu y =1,7697x + 5,8873-yang akan digunakan untuk menghitung nilai dan presisi (Coefficient of variation) dari rutin. Dipilih persamaan tersebut karena nilai r dari replikasi menghasilkan nilai yang paling mendekati 1 atau -1, yaitu r = 0,9965.
36
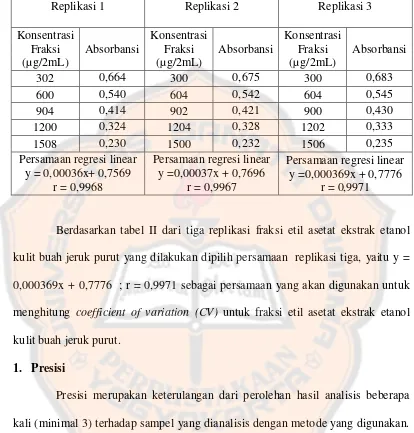
Tabel II. Hasil pengukuran absorbansi seri fraksi etil asetat ekstrak etanol kulit buah jeruk purut yang direaksikan dengan DPPH
Replikasi 1 Replikasi 2 Replikasi 3
Konsentrasi
Persamaan regresi linear y =0,000369x + 0,7776
r = 0,9971
Berdasarkan tabel II dari tiga replikasi fraksi etil asetat ekstrak etanol kulit buah jeruk purut yang dilakukan dipilih persamaan replikasi tiga, yaitu y = 0,000369x + 0,7776 ; r = 0,9971 sebagai persamaan yang akan digunakan untuk menghitung coefficient of variation (CV) untuk fraksi etil asetat ekstrak etanol kulit buah jeruk purut.
1. Presisi
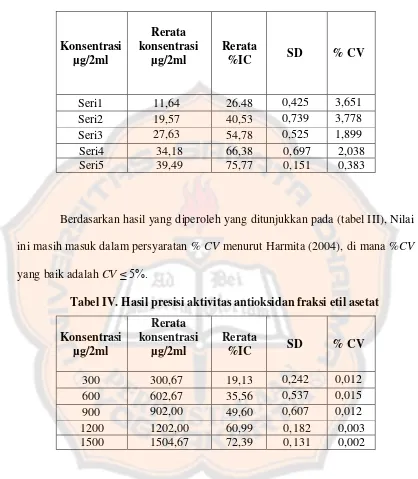
Presisi merupakan keterulangan dari perolehan hasil analisis beberapa kali (minimal 3) terhadap sampel yang dianalisis dengan metode yang digunakan. Presisi dari metode analisis dinyatakan dalam Coeffisien of Variant (CV). Persyaratan nilai % CV yang baik untuk bahan p.a pada konsentrasi sekitar 10 ppm adalah < 5% sedangkan nilai %CV yang baik untuk bahan alam < 15 % (Harmita, 2004).
Tabel III. Hasil presisi aktivitas antioksidan standar rutin
Berdasarkan hasil yang diperoleh yang ditunjukkan pada (tabel III), Nilai ini masih masuk dalam persyaratan % CV menurut Harmita (2004), di mana %CV yang baik adalah CV ≤ 5%.
Tabel IV. Hasil presisi aktivitas antioksidan fraksi etil asetat Konsentrasi
38
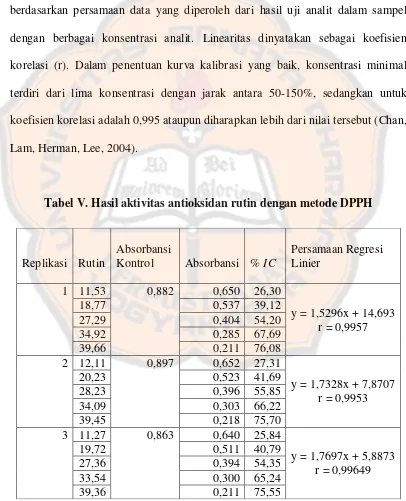
2. Linearitas
Linearitas pada suatu metode analisis dari suatu prosedur suatu analisis merupakan kemampuannya untuk mendapatkan hasil uji yang secara langsung proporsional dengan konsentrasi (jumlah) analit di dalam sampel. Linearitas biasanya dinyatakan dalam istilah variansi sekitar arah garis regresi yang dihitung berdasarkan persamaan data yang diperoleh dari hasil uji analit dalam sampel dengan berbagai konsentrasi analit. Linearitas dinyatakan sebagai koefisien korelasi (r). Dalam penentuan kurva kalibrasi yang baik, konsentrasi minimal terdiri dari lima konsentrasi dengan jarak antara 50-150%, sedangkan untuk koefisien korelasi adalah 0,995 ataupun diharapkan lebih dari nilai tersebut (Chan, Lam, Herman, Lee, 2004).
Tabel V. Hasil aktivitas antioksidan rutin dengan metode DPPH
Gambar 6. Kurva persamaan regresi linear antioksidan rutin
Berdasar tiga hasil replikasi yang ditunjukan pada (tabel V) untuk validasi metode analisis rutin, didapatkan persamaan regresi linear untuk replikasi satu y = 1,5296x + 14,693; replikasi dua y = 1,7328x + 7,8707 ; dan replikasi tiga y = 1,7697x + 5,8873. Dari tiga hasil tersebut nilai r yang dihasilkan masih memenuhi persyaratan linearitas menurut Chan et al. (2005), di mana koefisien korelasi linearitas yang baik minimal r = 0,995. Hal ini menunjukkan bahwa metode yang digunakan dalam analisis rutin mempunyai linearitas yang baik.
40
Tabel VI. Hasil aktivitas antioksidan fraksi etil asetat ekstrak etanol dengan metode DPPH
Gambar 7. Kurva persamaan regresi linear antioksidan fraksi etil asetat
Hasil dari persamaan regresi linier hasil dari tiga replikasi fraksi etil
kurva persamaan regresi linear aktivitas
antioksidan fraksi etil asetat
linear berturut-turut adalah replikasi satu r = 0,9966; r = 0,9969, dan r = 0,9972. Tiga hasil ini masih diatas nilai koefisien korelasi linearitas minimal menurut Chan, et al. (2005), yaitu r = 0,995. Dari hasil tersebut dapat disimpulkan metode ini memiliki linieritas yang baik untuk menganalisis fraksi etil asetat ekstrak kulit buah jeruk purut.
3. Spesifitas
Spesifitas suatu metode adalah kemampuannya yang hanya dapat mengukur senyawa tertentu saja secara cermat dan seksama dengan adanya komponen lain yang mungkin ada dalam matriks sampel (Harmita, 2004). Dalam metode analisis ini yang menggunakan spektrofotometri visibel pada pengukuran rutin dan fraksi etil asetat sampel uji, spesifikasi metode dapat dilihat dengan tidak adanya serapan dari sampel sebelum ditambah DPPH pada panjang gelombang pengukuran yang digunakan, yaitu 515,7 nm. Dari hasil spektra terlihat bahwa larutan rutin, larutan uji fraksi etil asetat ekstrak etanol kulit buah jeruk purut dan pelarut metanol tidak menunjukkan adanya gangguan berarti terhadap absorbansi DPPH hasil reaksi, dengan demikian dapat dikatakan metode ini memilki spesifitas yang baik.
42
G. Hasil Uji Aktivitas Antioksidan dengan Metode DPPH
Pada penelitian ini, pengujian aktivitas antioksidan dilakukan dengan metode DPPH. Metode ini menggunakan senyawa radikal bebas, yaitu (DPPH) karena terdapat elektron yang tidak berpasangan pada strukturnya sehingga dapat digunakan untuk pengujian aktivitas antioksidan suatu senyawa yang dapat mendonorkan elektronnya sehingga terjadi penurunan intensitas warna atau absorbansi larutan DPPH. Dalam uji ini, rutin akan mereduksi radikal DPPH menjadi senyawa 1,1 difenil-2-pikrilhidrazil sehingga terjadi penurunan intensitas warna pada larutan dari yang semula ungu menjadi kekuningan.
Gambar 8. Reaksi terbentuknya warna kuning dari DPPH oleh adanya antioksidan (Molyneux, 2004)
Pengurangan intensitas warna larutan DPPH tersebut dihasilkan oleh bereaksinya molekul radikal DPPH dengan satu atom hidrogen yang dilepaskan komponen bahan uji sehingga terbentuk senyawa 1,1 difenil-2 pikrilhidrazil yang berwarna kuning. Pengurangan intensitas warna ungu larutan DPPH karena
adanya penambahan senyawa penangkap radikal bebas dapat dihitung secara kuantitatif dari berkurangnya absorbansi larutan tersebut.
Pada dasarnya absorbansi yang diukur adalah absorbansi larutan DPPH yang tidak bereaksi dengan bahan uji atau DPPH yang masih tersisa dalam campuran larutan, sehingga dengan bertambahnya konsentrasi senyawa penangkap radikal bebas dalam larutan, maka absorbansi larutan akan berkurang. Hal ini berarti bahwa aktivitas penangkapan radikal bebasnya semakin meningkat. Menurut metode ini, aktivitas antioksidan dari senyawa uji dinyatakan dengan IC50. Nilai IC50 diperoleh dari persamaan regresi linier yang menyatakan hubungan antara konsentrasi senyawa uji dengan persen penangkapan radikal yang dimilikinya. Semakin kecil nilai IC50, maka semakin aktif suatu ekstrak tanaman sebagai senyawa antioksidan.
Rutin digunakan sebagai senyawa pembanding dalam uji aktivitas antioksidan fraksi etil asetat ekstrak etanolik kulit buah jeruk purut ini karena rutin merupakan senyawa antioksidan alami golongan flavonoid yang telah diketahui memiliki potensi penangkapan radikal yang poten.
44
Tabel VII.Hasil perhitungan IC50 rutin dan fraksi etil asetat ekstrak etanol kulit buah jeruk purut
Dari analisis regresi linier diperoleh nilai IC50 rata-rata rutin sebesar 24,108μg/mL. Hal ini berarti untuk menangkap radikal bebas sebesar 50% diperlukan konsentrasi rutin sebesar 24,108 μg/mL.
Aktivitas antioksidan fraksi etil asetat ekstrak etanolik kulit buah jeruk purut dengan metode DPPH disajikan pada tabel berikut.
Tabel VIII. Penggolongan Tingkat Kekuatan Antioksidan Rutin dan Fraksi Etil Asetat Ekstrak Etanol kulit buah jeruk purut (Aryanto, 2006)
Hasil kekuatan antioksidan tergolong sangat lemah dibanding baku rutin, karena lebih dari 150 µg/mL.
H. Hasil Validasi Metode Penetapan Kandungan Fenolik Total Untuk menguji validitas metode penetapan kandungan fenolik total ini digunakan beberapa parameter, antara lain analisis presisi, linearitas dan spesifitas. Dalam pengujian digunakan tiga replikasi sehingga didapatkan tiga persamaan regresi linier antara konsentrasi asam galat dengan absorbansi yang didapat. Dari ketiga persamaan tersebut dipilih persamaan dengan nilai linearitas (r) yang paling baik untuk menghitung konsentrasi terukur rutin dan juga larutan uji sehingga %CV dapat dihitung. Persamaan regresi linear yang paling baik yaitu, (Gambar 15) menunjukkan kurva baku asam galat.
Gambar 10. Kurva baku asam galat
46
1. Presisi
Presisi dinyatakan dengan nilai %CV. Persyaratan nilai %CV yang baik untuk bahan p.a pada konsentrasi sekitar 150 ppm adalah < 5%. Berdasarkan nilai %CV dari data hubungan antara konsentrasi asam galat dengan absorbansi
diperoleh nilai %CV asam galat berada dalam rentang dengan demikian asam galat memiliki %CV yang baik karena memenuhi persyaratan yang ditetapkan sehingga dapat dikatakan metode ini memiliki presisi yang baik.
Tabel IX. Hasil presisi asam galat dari beberapa parameter Seri konsentrasi
Linieritas pada suatu metode analisis dari suatu prosedur penelitian analisis merupakan kemampuannya untuk mendapatkan hasil uji yang secara langsung proporsional dengan konsentrasi (jumlah) analit di dalam sampel. Persyaratan data linieritas yang bisa diterima jika memenuhi nilai koefisien korelasi (r) > 0,999 (Mulja dan Hanwar, 2003). Metode ini memiliki linearitas yang baik karena pada replikasi ke diperoleh nilai r = 0,9999.
Tabel X. Hasil pengukuran absorbansi asam galat yang direaksikan dengan reagen folin-Ciocalteau
Asam galat
Replikasi 1 Replikasi 2 Replikasi 3
Konsentrasi
Spesifitas suatu metode adalah kemampuannya yang hanya mengukur zat tertentu saja secara cermat dan seksama dengan adanya komponen lain yang mungkin ada dalam matriks sampel (Harmita, 2004). Dari hasil spektra terlihat bahwa larutan asam galat, larutan uji fraksi etil asetat ekstrak etanol kulit buah jeruk purut, dan pelarut metanol tidak menunjukkan adanya gangguan berarti terhadap absorbansi senyawa biru yang dihasilkan, dengan demikian dapat dikatakan metode ini memilki spesifitas yang baik.
I. Hasil Estimasi Kandungan Fenolik Total
48
untuk mengetahui hubungan antara aktivitas antioksidan fraksi etil asetat ekstrak etanol kulit buah jeruk dengan kandungan fenolik totalnya. Prinsip dari metode Folin-Ciocalteu adalah oksidasi gugus fenolik hidroksil. Senyawa fenolik akan mengalami oksidasi sehingga menjadi bentuk keton sedangkan kompleks fosfotungstat-fosfomolibdat yang berasal dari pereaksi Folin-Ciocalteau ini akan mengalami reduksi, sehingga menghasilkan kompleks senyawa yang berwarna biru. Warna biru yang terbentuk akan semakin pekat setara dengan konsentrasi ion fenolik yang terbentuk, artinya semakin besar konsentrasi senyawa fenol maka semakin banyak ion fenolik yang akan mereduksi asam heteropoli sehingga warna biru yang dihasilkan semakin pekat (Singleton and Rossi, 1965).
Gambar 11. Struktur asam galat (Lopez et al., 2003)
Dasar penetapan kandungan fenolik total secara spektrofotometri ini adalah adanya oksidasi senyawa fenol dalam suasana basa oleh pereaksi Folin- Ciocalteu menghasilkan senyawa yang berwarna. Fenol dalam suasana basa akan berubah menjadi ion fenolat yang bersifat lebih reaktif sehingga lebih mudah bereaksi dengan pereaksi Folin-Ciocalteu (gambar 12). Suasana basa diakibatkan oleh adanya penambahan natrium karbonat.
Gambar 12. Oksidasi asam galat dalam suasana basa (Oliveira et al.,2009b)
Ion fenolat dioksidasi oleh asam dalam pereaksi Folin-Ciocalteu dan kompleks molybdenum-tungstat akan direduksi sebagian oleh sampel sehingga menghasilkan warna biru (molybdenum-blue) (gambar 13).
Gambar 13. Reaksi asam galat dengan pereaksi Folin-Ciocalteu (Oliveira et al.,2009b)
50
Kompleks molybdenum-blue yang terbentuk berupa koloid dan akan menjadi encer dengan adanya asam fosfat pada pereaksi Folin-Ciocalteu, sehingga dapat dibaca absorbansinya dengan spektrofotometer visibel.
Tabel XI. Hasil penentuan jumlah fenolik total fraksi etil asetat ekstrak etanol kulit buah jeruk purut
Sampel Kandungan
Dari hasil perhitungan didapatkan hasil kandungan fenolik total rata-rata pada sampel sebesar 417,33 ± 1,76 mg ekivalen asam galat per gram fraksi etil asetat ekstrak etanol kulit buah jeruk purut.
J. Hasil Analisa Statistik
Dari hasil uji aktivitas antioksidan fraksi etil asetat ekstrak etanolik kulit buah jeruk purut, dapat dilakukan analisis statistik untuk mengetahui apakah ada perbedaan signifikan antara aktivitas antioksidan yang dimiliki oleh fraksi uji dengan aktivitas antioksidan yang dimiliki senyawa pembanding rutin. Analisis statistik dilakukan menggunakan program R.14.1. Untuk mengetahui kenormalan distribusi data dilakukan analisis statistik deskriptif menggunakan perhitungan Saphiro-Wilk Normality Test, hasilnya diperoleh nilai normalitas untuk rutin
p-value = 0,6361 untuk sampel sebesar p-value = 0,2429. Jadi, data uji aktivitas
antioksidan mengikuti distribusi normal.
Gambar 14. Hasil uji normalitas rutin
Gambar 15. Hasil uji normalitas sampel
52
Gambar 16. Hasil uji variansi data
Karena distribusi datanya normal maka dapat dilanjutkan pengujian statistik induktif menggunakan uji parametrik, yaitu Independent Sample t Test. Alasan pemilihan uji ini karena tujuannya untuk mengetahui perbedaan antara dua sampel yang tidak saling berhubungan, yaitu rutin dan fraksi etil asetat. Uji ini digunakan untuk mengetahui apakah aktivitas antioksidan yang dimiliki oleh rutin lebih besar dibandingkan dengan fraksi uji.
Gambar 17. Hasil uji T-test tidak berpasangan
Hipotesis yang diujikan sebagai berikut.
Hi : Aktivitas antioksidan rutin lebih besar dibandingkan fraksi uji.
54 BAB V
KESIMPULAN DAN SARAN A. Kesimpulan
1. Kandungan fenolik total per gram fraksi etil asetat ekstrak etanol kulit buah jeruk purut yang dinyatakan dengan massa ekivalen asam galat sebesar (417,33 ± 1,76).
2. Nilai aktivitas antioksidan fraksi etil asetat ekstrak kulit buah jeruk purut dengan menggunakan radikal bebas DPPH yang dinyatakan sebagai IC50 sebesar (962.66 ± 4,34) μg/mL.
B. Saran
1. Perlu dilakukan penelitian aktivitas antioksidan dengan menggunakan metode yang lain.
2. Perlu dilakukan uji aktivitas antioksidan sari buah jeruk purut.