Toksisitas dan Toleransi Aluminium pada Tanaman
Toksisitas Al. Aluminium bukan unsur esensial bagi pertumbuhan tanaman. Pada saat kelarutan aluminium meningkat seiring dengan turunnya pH hingga di bawah 5, unsur ini penting untuk diperhatikan karena menjadi toksik bagi tanaman. Bentuk-bentuk aluminium di dalam tanah dapat berupa ion trivalen yaitu Al(H2O)63+
atau disebut Al3+, bentuk hidroksida seperti Al(OH)+2, Al(OH)2+, Al(OH)3,
Al(OH)4- atau berasosiasi dengan berbagai senyawa organik dan anorganik seperti
PO4-3, SO4-2,F-, asam-asam organik, protein dan lipid (Delhaize dan Ryan 1995).
Al3+ merupakan bentuk yang paling toksik dan mendominasi di lahan asam dengan pH di bawah 4.5 (Matsumoto 2000).
Tanah asam terjadi karena adanya pencucian kation-kation basa dari tanah yang dipicu oleh praktek-praktek pertanian dan adanya hujan asam (Kennedy 1992). Untuk melihat pengaruh fitotoksik Al sebaiknya digunakan Al dalam bentuk Al3+, pH media 4 dan kekuatan ioniknya rendah (Kinraide 1991)
Aluminium terlarut bereaksi dengan dinding dan membran sel akar serta membatasi perluasan dinding sel sehingga menghentikan pemanjangan akar. Terhentinya pemanjangan akar merupakan ciri utama dari toksisitas aluminium. Jaringan akar merupakan bagian pertama dari tanaman yang mengalami keracunan aluminium, terutama di ujung akar sehingga mengalami pemendekan dan menebal. Akar menjadi berwarna kecoklatan terutama pada akar utama serta terjadi pertumbuhan akar lateral yang gemuk dan pendek dengan percabangan yang tidak bagus (Sasaki et al. 1994; Ryan et al. 1995).
Selain itu Al3+ juga dapat masuk ke sel melalui simplas setelah merusak membran sel akar dan terkadang bereaksi dengan senyawa fosfor sehingga mengganggu metabolisme fosfor pada tanaman. Akumulasi Al dalam sitoplasma memberi asumsi bahwa toksisitas terjadi karena terbentuknya kompleks Al – ligan (Ryan et al. 1995). Toksisitas aluminium melalui simplas disebabkan karena Al
mengikat sangat kuat senyawa donor O2 seperti Pi, nukleotida RNA, DNA, protein,
asam karboksilat, fosfolipid, asam poligalakturonik, heteropolisakarida, lipopolisakarida, flavanoid, antosianin dan lain-lain (Haug 1984; Martin 1986). Konsentrasi Al yang kecil saja dalam simplas berpotensi menjadi fitotoksik. Sebagai contoh yaitu Al3+ mengikat 107 kali lebih kuat ATP daripada Mg2+. Jumlah Al3+ pada tingkat nanomolar sekalipun dapat menghambat Mg2+ pada situs P (Martin 1988). Aluminium juga diduga menghambat proses pembelahan sel dan menghalangi metabolisme asam nukleat (yaitu menghalangi reproduksi bahan genetik) pada tanaman (Helyar 1998). Menurut Matsumoto (1991) Al yang berada dalam bentuk polimer (Al3+) memiliki muatan positif yang besar serta memiliki banyak situs pengikatan. Polimer ini dapat mengikat fosfat pada kedua utas DNA sehingga mengakibatkan gagalnya pemisahan DNA utas ganda saat proses replikasi.
Toleransi Al. Pada prinsipnya ada dua mekanisme toleransi tanaman terhadap cekaman Al menurut Taylor (1991), yaitu : pertama mekanisme eksternal yakni dengan mencegah Al masuk ke dalam simplas dan mencapai daerah metabolik yang peka; dan yang kedua mekanisme internal yakni dengan imobilisasi, kompartementasi atau detoksifikasi saat Al masuk ke dalam simplas. Mekanisme toleransi Al pada tanaman bervariasi baik antar maupun intra spesies. Faktor genetik berperan penting dalam menentukan toleransi tersebut. Toleransi Al pada gandum (Triticum aestivum) dikendalikan oleh sejumlah kecil gen dominan mayor dan gen-gen ini telah dimanfaatkan dalam program pemuliaan untuk membuat kultivar yang toleransi terhadap cekaman Al (Johnson et al. 1997).
Percobaan tentang mekanisme toleransi Al yang dilakukan oleh beberapa peneliti mengindikasikan beberapa hal yaitu :
(a) Perbedaan akumulasi Al di dalam jaringan akar berhubungan dengan perbedaan sensitivitas tanaman terhadap Al. Tice et al. (1992), Ryan et al. (2001) dan Ma et al. (2001) membuktikan bahwa tanaman gandum yang toleran terhadap Al mengakumulasi Al lebih sedikit dalam sitoplasma dibanding tanaman yang sensitif.
(b) Peningkatan akumulasi ion nitrat yang lebih tinggi dibandingkan kation amonium dan induksi pH rizosfir lebih tinggi mendekati pH optimal untuk pertumbuhan tanaman berhubungan dengan sifat tanaman yang lebih toleran terhadap cekaman Al (Miyasaka et al. 1991)
(c) Kultivar toleran mencirikan suatu mekanisme menghilangkan aluminium dari daerah sekitar akar yang disebabkan pengeluaran senyawa-senyawa asam dikarboksilat atau pengeluaran asam organik seperti malat, oksalat, sitrat dan fulfat propanoat seperti kaffeat untuk mengkelat Al sehingga toksisitasnya menjadi rendah (Ojima et al. 1984; Ryan et al. 1995; Sopandie et al. 1996; de la Funte et al. 1997; Ma et al. 1998; Zheng 1998; Matsumoto 2000). Beberapa genotipe tanaman bersifat toleran terhadap cekaman Al karena mereka melepaskan asam organik dari ujung akar. Beberapa asam organik memiliki kemampuan untuk mengubah kompleks Al3+ menjadi bentuk yang tidak bersifat toksik bagi tanaman, seperti pengkelatan Al sehingga akar terlindung dari toksisitas Al (Hue et al. 1986)
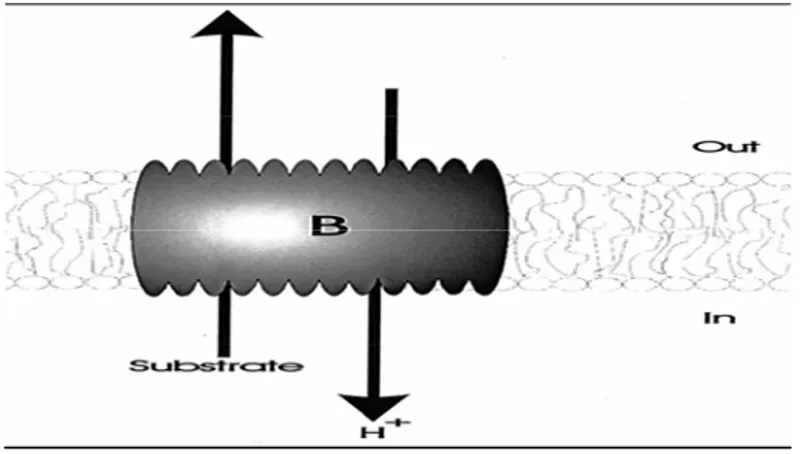
(d) Kultivar toleran mampu meningkatkan aktifitas H+-ATPase membran plasma yang mengatur keseimbangan ion proton antara di dalam dan luar membran plasma sel sehingga terjadi depolarisasi di membran plasma dan secara berantai mempengaruhi aktifitas metabolisme turunannya seperti aktifitas K-channel dan Ca-transporter yang masing-masing berperan dalam proses detoksifikasi Al (Kasai et al.1993; Kinraide et al. 1994; Sasaki et al. 1995; Kasai et al. 1995; Huang et al. 1996; Larsen et al. 1998; Delhaize 2004)
Ada tiga jenis asam organik yang sering ditemukan dalam tanaman yang toleran terhadap cekaman Al yaitu asam sitrat, asam oksalat dan asam malat. Sebagai contoh respon tanaman terhadap cekaman Al yaitu gandum mengeluarkan malat; snapbeans, jagung, Cassia toru dan kedelai melepas sitrat; buckwheat (Fagopyrum esculentum) mengeluarkan oksalat dan Triticale, rapeseed, lobak, oats dan rye mengeluarkan malat dan sitrat. Mekanisme toleransi terhadap cekaman Al dengan menggunakan asam organik ini dibagi ke dalam dua bentuk yaitu
detoksifikasi eksternal dan internal bahkan beberapa spesies tanaman menggunakan kedua bentuk mekanisme tersebut.
Beberapa tanaman dapat mengakumulasi Al pada daun dan akarnya tanpa menunjukkan gejala keracunan. Spesies tanaman toleran Al ini mempunyai mekanisme untuk mengubah Al dalam bentuk non toksik di dalam tanaman yaitu mekanisme yang membiarkan Al masuk ke dalam tanaman dan melewati membran kemudian baru mengubahnya menjadi bentuk non toksik. Teh dan hydrangea telah dikenal sebagai akumulator Al. Daun teh tua dapat mengakumulasi Al hingga 30000 mg kg-1 pada berat kering dan akumulasi Al di daun hydrangea mencapai di atas 3000 mg kg-1 (Ma et al. 1997). Beberapa tanaman seperti Melastoma malabathricum dan Vaccinium macrocarpon yang beradaptasi baik pada pH rendah mengakumulasi Al dalam level yang tinggi baik di daun maupun di akar (Osaki et al. 1997).
Pada tanah dengan keasaman yang sangat tinggi, Al3+ dapat melewati membran plasma baik melalui transpor protein yang secara normal berfungsi dalam adsorpsi ion-ion mineral lainnya ataupun melalui fase-fluida dan adsorpsi endositosis. Berdasarkan beberapa penelitian sebelumnya, Al3+menghentikan kanal ion yang terdapat pada membran plasma sel akar. Berdasarkan bukti-bukti di atas, mekanisme transpor Al3+ tidak hanya terjadi secara aktif melalui transporter aktif primer (primary active transporters) tetapi juga melalui transporter aktif sekunder (secondary active transporter) serta menunjukkan kemungkinan bahwa tanaman akumulator Al memiliki mekanisme detoksifikasi Al secara internal.
Walaupun banyak bukti yang menunjukkan keterkaitan asam organik dalam mekanisme toleransi Al pada tanaman, ada beberapa spesies yang menunjukkan mekanisme yang tidak berkaitan dengan asam organik. Bachiaria decumbans, salah satu jenis yang sangat toleran terhadap cekaman Al, tidak mengeluarkan asam organik dalam merespon Al sehingga diyakini bahwa spesies ini pasti memiliki mekanisme yang berbeda dalam menghadapi Al pada larutan tanah (Wenzl et al. 2001). Arabidopsis mutan (alr1) meningkatkan pH yang diinduksi oleh Al dengan segera disekitar ujung akar yang dapat menurunkan aktivitas Al3+ (Dengenhardt et
al. 1998). Kultivar gandum yang sangat toleran Al (Atlas) mempunyai mekanisme pelepasan fosfat sebagai mekanisme toleransi Al (Pellet et al. 1996). Berbeda dengan pelepasan malat, pelepasan fosfat bersifat konstitutif tanpa dipengaruhi adanya induksi Al untuk mengaktifkannya. Tanaman rumput-rumputan menghasilkan asam amino non protein yang disebut phytosiderophore yang mampu mengkelat Fe3+, komplek divalen, kation polyvalen dan Al3+ dengan sangat efektif sehingga tidak bersifat toksik lagi bagi tanaman saat terserap ke dalam sitoplasma (Kochian 1995). Pada bakteri ditemukan juga siderophore yang berfungsi dalam transpor Fe3+ yaitu enterobactin dan major facilitator superfamily (MFS) merupakan transporter enterobactin pada yeast (Heymann et al. 2000). Penemuan-penemuan ini semakin menguatkan adanya mekanisme peningkatan toleransi Al selain dari mekanisme pelepasan asam organik.
Major Facilitator Superfamily (MFS)
Major Facilitator Superfamily merupakan sistem transpor sekunder aktif berupa polipeptida tunggal dan berfungsi untuk mentranspor molekul-molekul atau solut berukuran kecil dengan menggunakan gradien ion kemiosmosis. MFS termasuk dalam kelompok pompa effluks (efflux pump) yaitu protein transporter yang berada pada membran sitoplasma sel dan bertanggung jawab dalam pengeluaran senyawa toksik dan antibiotik ke luar sel. MFS diketahui berperan dalam resistensi terhadap senyawa toksik alami dan senyawa xenobiotik lainnya (Hayashi et al. 2002). Anggota MFS bisa merupakan simporter, uniporter atau antiporter dan spesifisitasnya bisa luas maupun sempit, mulai dari antibiotik, molekul amphiphilik hingga gula, asam amino, ion logam dan molekul-molekul lainnya (Pao et al. 1998). MFS dicirikan dengan topologi protein yang mempunyai 12 domain transmembran (TM) meskipun beberapa MFS ditemukan memiliki 14 TM seperti yang disajikan pada Gambar 1 (Marger etal. 1993; Van Bambeke et al. 2000). Rubin et al. (1990) membuktikan bahwa MFS muncul akibat duplikasi
berulang intragenik 6 unit TM primordial sehingga dihasilkan 12 unit TM dalam bentuk polipeptida tunggal.
Gambar 1. Topologi MFS transporter dengan 12 dan 14 domain transmembran
Penelitian MFS pada organisme tingkat tinggi dan tanaman masih sedikit sehingga baru sebagian kecil MFS yang ditemukan. Sebagian besar MFS telah ditemukan pada mikroorganisme (organisme tingkat rendah) dan telah diketahui fungsinya. Beberapa fungsi MFS yang sudah diketahui adalah sebagai sistem transpor gula (Henderson et al. 1990), sistem transpor senyawa toksin, obat (drug efflux) dan senyawa metabolit pada siklus Kreb (Grifith et al. 1992; Paulsen et al. 1997), sistem transpor fosfat yaitu sebagai phosphate exchanger dan oligo sakarida (H+ simport permease) (Marger et al. 1993) serta sebagai permease asam aromatik pada bakteri (Goffeau at al. 1997).
Pao et al. (1998) telah mengelompokkan MFSke dalam 17 famili yaitu: (1) sugar porter family, (2) drug: H+ antiporter (14-spanner) (DHA14) drug efflux family, (3) drug: H+ antiporter (12-spanner) (DHA12) drug efflux family, (4) organophosphate: inorganic phosphate antiporter (OPA) family, (5) oligosaccharide: H+ symporter (MHS) family, (7) fructose-galactose-glucose: H+ symporter (FGHS) family, (8) nitrate-nitrite porter (NNP)family, (9) phosphate: H+ symporter (PHS) family, (10) nucleoside: H+symporter (NHS) family, (11) oxalate: formate antiporte (OFA) family, (12) sialate: H+ symporter (SHS) family, (13) monocarboxylate porter (MCP) family, (14) anion: cation symporter (ACS) family,
(15) aromatic acid: H+ symporter (AAHS) family, (16) unknown major facilitator superfamily (UMF) family, (17) cyanate permease (CP) family. Masing-masing famili mengenali dan mentranspor senyawa-senyawa yang strukturnya berbeda dan menunjukkan bahwa filogenetik dari famili MFS tersebut berhubungan erat dengan fungsinya.
Major Facilitator Superfamily merupakan transporter dengan kisaran substrat yang luas sehingga memiliki spesifisitas fungsi yang luas (Van Bambeke et al. 2000). Salah satu famili MFS yaitu MFS multidrug efflux transporter diketahui berperan didalam resistensi terhadap antibiotik seperti tetrasiklin, quinolone, methicilin dan phleomycin; obat anti HIV dan anti kanker seperti triazole derivative flucanazole (FLC), methotrexate (MTX) dan benomyl; fungisida seperti oxpaconazole (Kohli et al. 2001) dan logam berat seperti kadmium (Cd2+) (Li et al. 2001).
MFS multidrug efflux transporter menggunakan gradien elektrokimia transmembran dari proton atau ion sodium untuk mensekresi senyawa toksik dan xenobiotik dari dalam sel (Gambar 2). Meskipun demikian pada tanaman diduga detoksifikasi senyawa toksik dan xenobiotik dilakukan tidak dengan mensekresinya keluar sel tetapi mengirimnya ke dalam vakuola yang bertindak sebagai kompartemen bagi senyawa -senyawa toksik dan xenobiotik tersebut.
Gambar 2. MFS multidrug efflux transporter menggunakan gradien elektrokimia transmembran dari proton atau ion sodium untuk mensekresi senyawa toksik dan xenobiotik dari dalam sel
MFS multidrug efflux transporter pada tanaman pertama kali ditemukan pada jagung (Simmons et al. 2003). Simmons et al. (2003) mengindikasikan bahwa MFS multidrug efflux transporter pada jagung berperan di dalam resistensi terhadap patogen, eksport dan re-uptake K+, integritas membran dan viabilitas sel.
Beberapa penelitian membuktikan bahwa kultivar toleran Al mampu meningkatkan aktifitas H+-ATPase membran plasma yang mengatur keseimbangan ion proton antara di dalam dan di luar membran plasma sel, sehingga terjadi depolarisasi di membran plasma dan secara berantai mempengaruhi aktifitas metabolisme turunannya seperti aktifitas K-channel dan Ca-transporter yang masing-masing berperan dalam proses detoksifikasi Al (Kasai et al. 1993; Kinraide et al. 1994; Sasaki et al. 1995; Kasai et al. 1995;Huang et al. 1996; Larsen et al. 1998; Delhaize 2004)
Fluconazole resistance 1 (FLR1) yang menyandikan MFS transporter pada fungi Candida albicans terlibat di dalam induksi CAP1 dan YAP1 yang berperan dalam resistensi C. albicans dan S. cerevisiae terhadap senyawa toksik seperti cycloheximide (CYH), 4-nitroquinoline N-oxide (4-NQO), kadmium dan hidrogen peroksida sehingga hal ini mengindikasikan bahwa FLR1 merupakan regulator transkripsi CAP1 dan YAP1 (Alarco et al. 1997). Hidrogen peroksida merupakan salah satu oksida radikal (ROS, reactive oxigen species) yang dihasilkan pada sejumlah reaksi selular dan merupakan salah satu mekanisme yang muncul pertama kali pada tanaman untuk mengatasi stress oksidatif khususnya untuk reoksigenasi. Stress oksidatif disebabkan oleh berbagai faktor lingkungan diantaranya stress UV, serangan patogen (reaksi hipersensitif), herbisida dan kekurangan oksigen (Blokhina et al. 2002). Reaktifitas Al juga dapat menyebabkan terbentuknya oksida radikal (ROS, reactive oxigen species) yang beracun bagi sel.
Protein MFS yang terkonservasi terdiri dari 12 simpul/helik transmembran (TM) di semua transporter MFS. Meski demikian spesifisitas fungsinya ditentukan pada variasi asam amino pada bagian pengikatan substrat (Vardy et al. 2004). Bagian terkonservasi dari MFS yaitu pada domain TM 2 dan TM 3 yang menentukan fungsi transpor MFSsecara umum (Yamaguchi et al. 1992) dan domain
TM5 yang menentukan fungsi MFS sebagai antiporter. Bagian variasi diantaranya yaitu domain TM8 dan TM9 yang menentukan spesifisitas substrat (Ditty et al. 1999) dan pusat simpul yang panjang yang terletak di antara domain TM6 dan TM 7 berperan penting dalam menentukan fungsi protein (Weinglass etal. 2000).
Karakteristik Melastoma dan Toleransinya terhadap Aluminium
Melastoma affine D. Don atau disebut juga Melastoma malabathricum L. (Meyer 1999) (Gambar 3) merupakan tanaman yang termasuk dalam super divisi Spermatophyta (tanaman berbiji), divisi Magnoliophyta (tanaman berbunga), group dikotil, famili Melastomataceae dan merupakan tanaman perennial serta mempunyai kebiasaan tumbuh sebagai herba dengan tinggi mencapai 3 m dengan bunga berwarna ungu terang atau keunguan serta buah yang berisi biji-biji kecil berwarna ungu tua atau hitam yang secara alami digunakan sebagai sistem perbanyakannya (USDA 2004).
Gambar 3. Melastoma affine L.
Melastoma malabathricum L. merupakan tanaman pengakumulasi Al berkayu yang berkembang di Asia Tenggara pada tanah asam dengan tingkat konsentrasi Al tinggi dan miskin hara (Watanabe & Osaki 2002). Melastoma malabathricum L. dapat mengakumulasi Al lebih dari 10000 mg kg-1 di dalam daun-daun yang tua dan
lebih dari 7000 mg kg-1 di dalam daun-daun yang muda (Watanabe & Osaki 2001). Pada daun Melastoma, Al ditemukan berada di dalam sel epidermal atas dan juga didistribusikan di dalam sel mesofil sedangkan pada akar Al ditemukan pada semua jaringan akar terutama dalam epidermis dan endodermis. Selanjutnya Watanabe dan Osaki (2003) menemukan bahwa Al mampu menembus jaringan endodermis dan masuk ke pembuluh xilem yang kemudian ditimbun di daun Melastoma. Bukti-bukti ini menunjukkan bahwa Melastoma memiliki kemampuan menyerap Al, memobilisasi dan menimbunnya di daun tanpa menimbulkan masalah kelainan fisiologis. Bentuk Al terlarut yang ditemukan di dalam jaringan Melastoma diidentifikasikan sebagai Al monomerik, Al-oksalat, Al-(oksalat)2 dan Al-(oksalat)3
(Watanabe et al. 1998).
Selain tahan terhadap cekaman Al, pertumbuhan Melastoma juga dipacu oleh Al (Watanabe et al. 2001a). Mekanisme induksi pertumbuhan Melastoma oleh Al ini masih belum jelas. Cekaman Al pada tanaman toleran akan menginduksi sejumlah gen untuk menghindari pengaruh ion Al. Pada Melastoma, gen-gen ini diduga tidak hanya berperan dalam mendetoksifikasi Al, akan tetapi juga berperan dalam menginduksi hormon pertumbuhan. Sebagaimana telah diketahui pertumbuhan tanaman diatur oleh hormon pertumbuhan seperti auksin, sitokinin dan ABA (Wareing & Philips 1981).
Mekanisme translokasi dan akumulasi Al di dalam Melastoma mungkin sama dengan buckwheat. Ma dan Hiradate (2000) menunjukkan bahwa bentuk Al untuk translokasi dari akar ke tajuk di dalam buckwheat adalah kompleks Al-sitrat yang merupakan bentuk yang sama dalam Melastoma. Kelebihan oksalat membuat presipitasi dengan Ca di dalam sitoplasma akar dan xilem menghambat signal transduksi dan translokasi Ca, yang berarti bahwa bentuk Al untuk translokasi bukanlah Al-oksalat tetapi Al-sitrat di dalam spesies akumulator Al. Kandungan asam sitrat pada pembuluh xilem M. malabathricum mengalami peningkatan dengan adanya perlakuan Al sedangkan asam malat, asam suksinat, dan α-ketoglutarat menurun (Watanabe & Osaki 2002).