LABORATORIUM
DIAN INDRAWATIE
MAYOR TEKNOLOGI DAN MANAJEMEN PERIKANAN TANGKAP DEPARTEMEN PEMANFAATAN SUMBERDAYA PERIKANAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN INSTITUT PERTANIAN BOGOR
BOGOR 2010
Dengan ini saya menyatakan bahwa skripsi Pengujian Umpan Buatan (Arginin dan Leusin) terhadap Ikan Kerapu Macan pada Skala Laboratorium adalah karya saya sendiri dengan arahan dosen pembimbing dan belum pernah diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber data dan informasi yang berasal atau dikutip dari karya ilmiah yang diterbitkan sebelumnya maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Bogor, 21 Mei 2010 Dian Indrawatie
DIAN INDRAWATIE, C44051524. Pengujian Umpan Buatan (Arginin dan Leusin) terhadap Ikan Kerapu Macan pada Skala Laboratorium. Dibimbing oleh ARI PURBAYANTO dan MOCHAMMAD RIYANTO.
Ikan kerapu macan (Epinephelus fuscoguttatus) merupakan ikan karang ekonomis penting. Penangkapan ikan karang paling efektif dengan menggunakan bubu (perangkap) yang dalam pengoperasiannya dibutuhkan umpan. Syarat umpan yang baik harus disukai oleh ikan. Penelitian yang pernah dilakukan sebelumnya didapatkan arginin dan leusin dapat dijadikan rangsangan kimiawi. Penelitian ini ditujukan untuk mengetahui pola pergerakan ikan kerapu macan dalam merespons umpan buatan dan menguji respons ikan kerapu macan terhadap komposisi umpan buatan (arginin dan leusin) yang berbeda. Metode penelitian yang digunakan adalah metode eksperimental laboratorium. Berdasarkan hasil penelitian pola pergerakan ikan kerapu macan dalam merespons umpan buatan diidentifikasi menjadi tiga pola. Pada kondisi dengan pencahayaan ikan merespons umpan sampai dengan fase finding, sedangkan pada kondisi tanpa pencahayaan ikan hanya merespons sampai dengan fase searching. Berdasarkan penghitungan waktu rata-rata respons arousal dan searching didapatkan hasil waktu respons tercepat terdapat pada umpan A. Perbedaan umpan memberikan pengaruh nyata terhadap waktu respons arousal dan searching baik pada kondisi dengan pencahayaan maupun tanpa pencahayaan. Namun perbedaan umpan tidak memberikan pengaruh yang nyata terhadap waktu respons finding pada kondisi pencahayaan.
Kata kunci : arginin, kerapu macan (Epinephelus fuscoguttatus), leusin, respons, umpan buatan.
© Hak cipta IPB, Tahun 2010 Hak cipta dilindungi Undang-Undang
1) Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber:
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar IPB.
2) Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apapun tanpa seizin IPB.
DIAN INDRAWATIE
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Pemanfaatan Sumberdaya Perikanan
MAYOR TEKNOLOGI DAN MANAJEMEN PERIKANAN TANGKAP DEPARTEMEN PEMANFAATAN SUMBERDAYA PERIKANAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN INSTITUT PERTANIAN BOGOR
Nama Mahasiswa : Dian Indrawatie
NIM : C44051524
Mayor : Teknologi dan Manajemen Perikanan Tangkap
Disetujui:
Pembimbing I
Prof. Dr.Ir.Ari Purbayanto, M.Sc. NIP: 19660121 199002 1 001
Pembimbing II
Mochammad Riyanto,S.Pi., M.Si. NIP: 19821025 200701 1 001
Diketahui :
Ketua Departemen Pemanfaatan Sumberdaya Perikanan
Dr. Ir. Budy Wiryawan, M.Sc. NIP: 19621223 198703 1 001
Skripsi ditujukan untuk memenuhi syarat memperoleh gelar Sarjana Perikanan pada Mayor Teknologi dan Manajemen Perikanan Tangkap Departemen Pemanfaatan Sumberdaya Perikanan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Judul skripsi ini adalah Pengujian Umpan Buatan (Arginin dan Leusin) terhadap Ikan Kerapu Macan pada Skala Laboratorium. Penelitian dilaksanakan selama enam bulan. Penelitian ini dilakukan pada dua tempat, yaitu: di Laboratorium Teknologi Penangkapan Ikan (Flume Tank Room) dan di Laboratorium Pascapanen, Balai Besar Litbang Pascapanen Pertanian, Cimanggu-Bogor. Pada kesempatan ini penulis ingin mengucapkan terima kasih kepada :
1. Prof. Dr. Ir. Ari Purbayanto, M.Sc. dan Mochammad Riyanto, S.Pi., M.Si selaku dosen pembimbing atas segala saran dan arahan selama penelitian; 2. Ir. Ronny Irawan Wahyu, M.Phil. selaku dosen penguji tamu;
3. Dr. Ir. Mohammad Imron, M.Si. selaku Ketua Komisi Pendidikan;
4. Program Hibah Kompetensi tahun 2009, Direktorat Jenderal Perguruan Tinggi, Kementerian Pendidikan Nasional dengan judul kegiatan Pengembangan Umpan Buatan (Artificial Bait) untuk Meningkatkan Efektivitas Penangkapan Ikan yang telah memfasilitasi kegiatan penelitian; 5. Kedua orang tua yang tak henti-hentinya memberikan doa dan motivasi; 6. Bang Giri, Bang Panji, Leo, Novel dan Bapak Danu yang telah membantu
dalam proses pengambilan data dan pemeliharaan ikan;
7. Seluruh dosen dan staf Departemen PSP yang telah memberikan arahan dan dukungan hingga terselesaikannya penulisan skripsi ini; dan
8. Yosep Hadinata, S.Pi dan angkatan 42 untuk dukungan dan semangat.
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna sehingga diharapkan saran dan kritik yang bersifat membangun demi kesempurnaan skripsi ini. Semoga skripsi ini dapat bermanfaat bagi semua pihak yang membutuhkan.
Bogor, Mei 2010 Dian Indrawatie
Penulis dilahirkan di Surabaya pada tanggal 9 Juli 1987 dari pasangan Koestijono Djajusman dan Cicilia Endang Agustin. Penulis adalah anak ke tiga dari tiga bersaudara. Tahun 1992 penulis mengawali pendidikan di Taman Kanak-kanak Santo Markus II Jakarta Timur dan pada tahun 1993 penulis melanjutkan pendidikan di Sekolah Dasar Santo Markus II Jakarta Timur. Tahun 1999 penulis melanjutkan pendidikan ke Sekolah Menengah Pertama Santo Markus II Jakarta Timur dan pada tahun 2002 penulis melanjutkan pendidikan di Sekolah Menengah Umum Negeri 48 Jakarta Timur.
Penulis diterima di Institut Pertanian Bogor pada tahun 2005 melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB) dan terdaftar sebagai mahasiswa Fakultas Perikanan dan Ilmu Kelautan pada Departemen Pemanfaatan Sumberdaya Perikanan Mayor Teknologi dan Manajemen Perikanan Tangkap. Selama menjadi mahasiswa, penulis aktif dalam berbagai kegiatan organisasi. Penulis pernah menjabat sebagai anggota Departemen Eksternal HIMPATINDO periode 2006-2007 dan menjabat sebagai anggota Departemen Kewirausahaan HIMAFARIN periode 2007-2008. Selain itu, penulis juga menjadi asisten Mata Kuliah Manajemen Operasi Penangkapan Ikan (MOPI) tahun 2008-2009.
Tahun 2009, penulis melakukan penelitian dengan judul ” Pengujian Umpan Buatan (Arginin dan Leusin) terhadap Ikan Kerapu Macan pada Skala Laboratorium” sebagai salah satu syarat untuk memperoleh gelar sarjana perikanan pada Mayor Teknologi dan Manajemen Perikanan Tangkap, Departemen Pemanfaatan Sumberdaya Perikanan.
DAFTAR TABEL ... iii DAFTAR GAMBAR ... iv DAFTAR LAMPIRAN ... v 1 PENDAHULUAN 1.1 Latar Belakang ... 1 1.2 Tujuan ... 2 1.3 Manfaat ... 2 2 TINJAUAN PUSTAKA 2.1 Morfologi dan Klasifikasi Ikan Kerapu Macan (Epinephelus fuscoguttatus) ... 3
2.2 Tingkah Laku Makan Ikan Kerapu ... 4
2.3 Reaksi Penciuman Ikan terhadap Rangsangan Bau ... 5
2.4 Tingkah Laku Ikan Mendekati Umpan ... 6
2.5 Organ Penglihatan (Visual Organ) ... 8
2.6 Organ Penciuman(Olfactory Bulb) ... 10
2.7 Otak dan Bagian-bagiannya ... 11
2.8 Umpan ... 13
2.9 Arginin dan Leusin ... 14
2.10 Pengamatan Skala Laboratorium ... 14
3 METODOLOGI 3.1 Waktu dan Tempat Penelitian ... 16
3.2 Sarana, Bahan dan Alat Penelitian ... 16
3.2.1 Sarana penelitian... 16
3.2.2 Bahan penelitian dan alat penelitian ... 17
3.3 Metode Penelitian ... 18
3.4 Prosedur Percobaan ... 18
3.4.1 Pembuatan umpan buatan ... 18
3.4.2 Uji kimia umpan buatan ... 19
3.4.3 Uji respons tingkah laku ikan terhadap umpan ... 20
3.5 Analisis Data ... 23
4 HASIL DAN PEMBAHASAN 4.1 Hasil Penelitian ... 26
4.1.1 Kondisi bak penelitian... 26
4.1.2 Tingkah laku ikan kerapu macan selama pemeliharaan ... 28
4.1.3 Tingkah laku ikan mendekati umpan buatan ... 29
4.1.4 Respons ikan kerapu macan terhadap umpan buatan ... 32
4.1.5 Pengaruh perbedaan jenis umpan terhadap waktu respons penciuman ... 35
4.2 Pembahasan ... 39
4.2.1 Hubungan perbedaan umpan dan waktu respons ikan ... 39
4.2.2 Komposisi kimia umpan buatan ... 41
5 KESIMPULAN DAN SARAN 5.1 Kesimpulan ... 43
5.2 Saran ... 43
DAFTAR PUSTAKA ... 44
DAFTAR TABEL
Halaman
1. Bagian utama dan sub bagian otak ikan ... 11
2. Alat dan bahan yang digunakan ... 18
3. Rancangan komposisi arginin dan leusin berdasarkan penelitian sebelumnya ... 19
4. Rancangan perlakuan formulasi komposisi kimia umpan buatan (berat total umpan 8 gr) ... 19
5. Rancangan perlakuan perbedaan warna umpan buatan ... 19
6. Daftar analisis ragam Rancangan Acak Lengkap (RAL) ... 24
7. Kondisi lingkungan bak pemeliharaan selama penelitian ... 28
8. Uji ANOVA berdasarkan perbedaan waktu arousal kondisi dengan pencahayaan ... 35
9. Uji ANOVA berdasarkan perbedaan waktu arousal kondisi tanpa pencahayaan ... 35
10. Uji ANOVA berdasarkan perbedaan waktu searching kondisi dengan pencahayaan ... 36
11. Uji ANOVA berdasarkan perbedaan waktu searching kondisi tanpa pencahayaan ... 36
12. Uji ANOVA berdasarkan perbedaan waktu finding kondisi dengan pencahayaan ... 36
13. Kandungan asam amino umpan buatan dan pakan ... 37
14. Perbandingan nilai arginin dan leusin yang seharusnya dan hasil uji ... 38
15. Data waktu respons ikan kerapu macan terhadap umpan buatan pada kondisi dengan pencahayaan ... 52
16. Data waktu respons ikan kerapu macan terhadap umpan buatan pada kondisi tanpa pencahayaan... 53
DAFTAR GAMBAR
Halaman
1. Ikan kerapu macan ... 4
2. Bentuk hidung ikan dan bagiannya ... 10
3. Otak Epinephelus fuscoguttatus ... 12
4. Akuarium perlakuan ... 17
5. Pembagian fase respons ikan terhadap umpan ... 22
6a. Pola tingkah laku ikan (1) ... 29
6b. Pola tingkah laku ikan (2) ... 30
6c. Pola tingkah laku ikan (3) ... 30
7. Pola tingkah laku ikan ... 31
8a. Grafik data waktu arousal kondisi dengan pencahayaan ... 32
8b. Grafik data waktu arousal kondisi tanpa pencahayaan ... 33
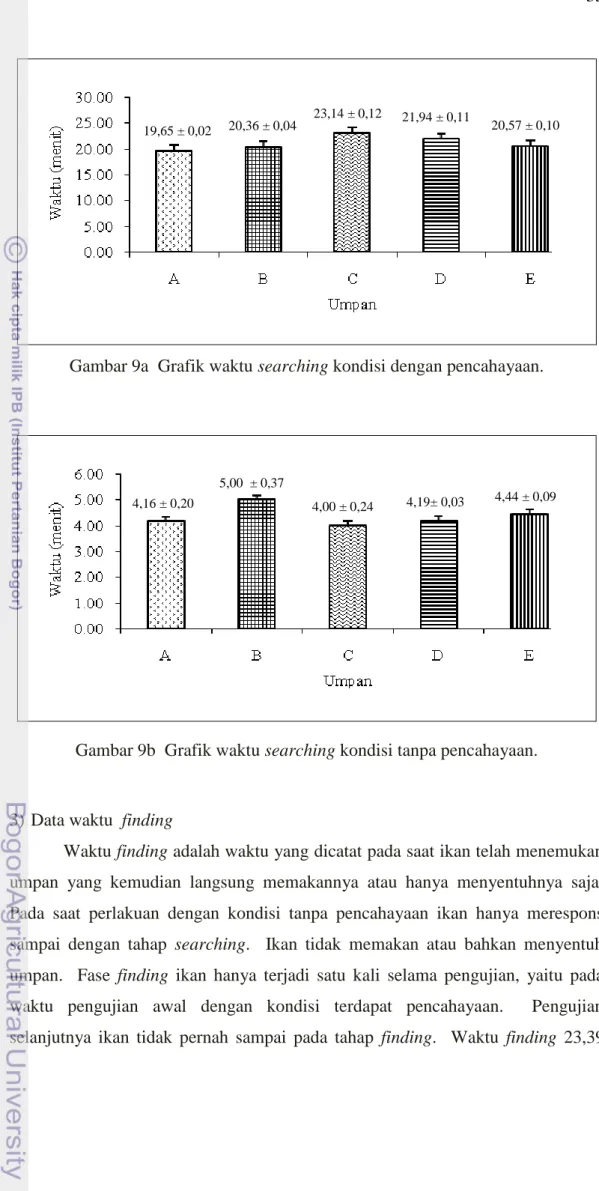
9a. Grafik waktu searching kondisi dengan pencahayaan ... 34
9b. Grafik waktu searching kondisi tanpa pencahayaan ... 34
10. Grafik nilai arginin sebenarnya dan hasil uji ... 38
DAFTAR LAMPIRAN
Halaman
1. Sarana penelitian ... 49
2. Bahan penelitian ... 50
3. Alat penelitian ... 51
4. Data waktu respons ikan kerapu macan terhadap umpan buatan ... 52
5. Uji one-way ANOVA berdasarkan perbedaan umpan dan waktu rata-rata arousal pada kondisi dengan pencahayaan ... 54
6. Uji one-way ANOVA berdasarkan perbedaan umpan dan waktu rata-rata arousal pada kondisi tanpa pencahayaan ... 55
7. Uji one-way ANOVA berdasarkan perbedaan umpan dan waktu rata-rata searching pada kondisi dengan pencahayaan ... 56
8. Uji one-way ANOVA berdasarkan perbedaan umpan dan waktu rata-rata searching pada kondisi tanpa pencahayaan ... 57
9. Uji one-way ANOVA berdasarkan perbedaan umpan dan waktu rata-rata finding pada kondisi dengan pencahayaan ... 58
1
PENDAHULUAN
1.1 Latar Belakang
Ikan kerapu macan (Epinephelus fuscoguttatus) merupakan ikan karang konsumsi yang banyak diminati oleh masyarakat terutama masyarakat manca negara. Menurut data Departemen Kelautan dan Perikanan (2006) volume ekspor kerapu tahun 2006 bisa mencapai 1.800 ton atau US$ 24 juta dari total produksi perikanan sebesar 12.000 ton. Menurut Soelaiman (2007) permintaan ekspor ikan kerapu dengan tujuan negara Hongkong bisa mencapai 2.868 kg dengan nilai US$ 5.736,36 juta. Selain Hongkong ikan kerapu juga cukup diminati oleh negara Singapura dengan jumlah ekspor sebesar 32,80 kg dengan nilai US$ 87,90 juta.
Tingginya tingkat permintaan ekspor ikan kerapu membuat para nelayan melakukan segala cara untuk mendapatkan komoditi ini. Kegiatan penangkapan ikan kerapu yang dilakukan oleh nelayan biasanya dengan menggunakan bubu, pancing, bahan peledak dan bius (potassium cyanide). Penggunaan bahan peledak dan bius dapat mengakibatkan kerusakan terumbu karang. Ikan yang didapatkan dengan menggunakan bahan peledak dalam kondisi tidak segar atau sudah mati, sehingga memiliki harga yang rendah dan tidak dapat diekspor.
Penggunaan bubu dan pancing dalam penangkapan ikan tidak merusak ekosistem terumbu karang dan sumber daya ikan lainnya, hal ini disebabkan karena bubu dan pancing merupakan alat tangkap pasif. Terdapat perbedaan kondisi hasil tangkapan dari kedua alat tangkap pasif ini, hasil tangkapan ikan dengan menggunakan pancing kondisinya segar tetapi terdapat luka yang diakibatkan oleh mata pancing yang tajam sedangkan hasil tangkapan dengan bubu kondisinya segar dan tidak terdapat luka.
Faktor penunjang keberhasilan penangkapan alat tangkap pasif adalah umpan. Umpan digunakan sebagai pemikat atau atraktan. Ikan karang yang sifatnya bersembunyi pada terumbu karang akan terstimulasi keluar dari terumbu karang karena terpikat bau dari umpan. Umpan yang digunakan dalam pengoperasian bubu dapat dibagi menjadi dua menurut asalnya yaitu umpan alami dan umpan buatan. Umpan alami adalah umpan yang didapatkan dari alam seperti
ikan segar. Sedangkan umpan buatan adalah umpan yang sengaja dibuat oleh manusia.
Penelitian mengenai umpan telah dilakukan oleh beberapa peneliti sebelumnya antara lain Uji Coba Beberapa Macam Umpan Tiruan pada Penangkapan Ikan dengan Huhate di Perairan Bone-Bone, Kota Bau-Bau Sulawesi Tenggara (Syafrie, 2008); Analisis Indera Penglihatan Ikan Kerapu Macan (Epinephelus fuscoguttatus) dan Hubungannya dalam Merespons Umpan (Natsir, 2008) dan Respons Penciuman Ikan Kerapu Macan (Epinephelus fuscoguttatus) terhadap Umpan (Sejati, 2008); Respons Penciuman Ikan Kerapu Macan terhadap Umpan Buatan (Riyanto, 2008) dan Respons Penglihatan dan Penciuman Ikan terhadap Umpan Terkait dengan Efektivitas Penangkapan (Fitri, 2008).
Berdasarkan penelitian sebelumnya didapatkan hasil komposisi umpan buatan asam amino arginin dan leusin dapat digunakan sebagai atraktan yang berperan pada respons penciuman ikan. Oleh karena itu perlu dilakukan penelitian lanjutan tentang pengaruh komposisi asam amino (arginin dan leusin) dan perbedaan warna umpan buatan terhadap respons tingkah laku ikan.
1.2 Tujuan
Tujuan penelitian ini adalah:
1) Mengetahui pola pergerakan ikan kerapu macan dalam merespons umpan buatan; dan
2) Menguji respons ikan kerapu macan terhadap umpan buatan yang berbeda.
1.3 Manfaat
Manfaat dari penelitian ini adalah:
1) Memberikan informasi tentang respons tingkah laku ikan kerapu macan terhadap umpan;
2) Memberikan informasi dalam pembuatan umpan buatan pada proses penangkapan ikan kerapu mengunakan bubu yang efektif dan efisien; dan 3) Sebagai acuan dalam mengembangkan teknik penangkapan ikan kerapu.
2.1 Morfologi dan Klasifikasi Ikan Kerapu Macan (Epinephelus fuscoguttatus)
Ikan kerapu (Epinephelus sp) atau dikenal dengan nama dagang groupers merupakan salah satu komoditas perikanan yang bernilai ekonomis tinggi dan berpeluang dipasarkan baik di domestik maupun internasional. Ada beberapa macam ikan kerapu di pasaran, diurut dari nilai ekonomis yang tertinggi, yaitu ikan kerapu lodi, kerapu macan, kerapu lumpur, kerapu tikus, kerapu bebek dan lainnya. Di pasaran ikan kerapu yang banyak dijumpai adalah jenis ikan kerapu macan (Epinephelus fuscoguttatus) (Bahar, 2006).
Ikan kerapu macan dalam perdagangan internasional, dikenal dengan nama carped cod. Ikan kerapu ini mirip dengan kerapu lumpur, namun ukuran tubuhnya lebih tinggi dengan noda-noda pada tubuhnya yang lebih rapat dan berwarna gelap. Seluruh tubuh berwarna cokelat kemerahan atau merah, termasuk sirip-siripnya (Murtidjo, 2001). Menurut Andreas dan Soeharmoko (1997), ciri-ciri morfologis dari ikan kerapu macan (Epinephelus fuscoguttatus) bentuknya agak bulat memanjang dan mempunyai ukuran badan lebih tinggi, sirip dada berwarna kemerahan dan sirip lainnya mempunyai tepi kecoklatan. Bentuk dari ikan kerapu macan dapat dilihat pada Gambar 1.
Menurut Heemstra dan Randall (1993) sistematika pengklasifikasian ikan kerapu macan adalah:
Filum : Chordata Subfilum : Vertebrata Kelas : Teleostei Subkelas : Actinopterygii Ordo : Perciformes Family : Serranidae Genus : Epinephelus
Sumber: www.fishyforum.com (2009)
Gambar 1 Ikan kerapu macan (Epinephelus fuscoguttatus).
2.2 Tingkah Laku Makan Ikan Kerapu
Kerapu merupakan ikan yang bersifat nokturnal. Pada malam hari aktif bergerak di kolom perairan untuk mencari makan sedangkan pada siang hari lebih banyak bersembunyi di liang-liang karang (Valenciennes, 1828). Kemudian Tampubolon dan Mulyadi (1989) yang dikutip oleh Maryati (2004) menyatakan ikan kerapu mempunyai kebiasaan makan pada siang hari dan malam hari, namun lebih aktif lagi pada waktu fajar dan senja hari. Menurut Indonesia Corel Reef Foundation (2004), kerapu termasuk ikan jenis crepuscular, yang merupakan ikan yang aktif di antara waktu siang dan malam hari.
Ikan kerapu termasuk jenis karnivora. Kerapu dewasa memangsa ikan-ikan kecil, kepiting dan udang-udangan, sedangkan pada saat larva memangsa larva moluska (trokofor), rotifera, mikro crustacea, copepoda dan zooplankton. Sebagai ikan karnivor, kerapu cenderung menangkap mangsa yang aktif bergerak di kolom air (Nybakken, 1988).
Ikan kerapu biasanya mencari makan dengan cara menyergap mangsa dari tempat persembunyiannya. Ikan kerapu juga bersifat kanibalisme jika kekurangan makanan. Kanibalisme biasanya mulai terjadi pada larva berumur 30 hari, dimana pada saat itu cenderung berkumpul di suatu tempat dengan kepadatan tinggi (Direktorat Jenderal Perikanan, 1999 yang dikutip oleh Maryati, 2004)
2.3 Reaksi Penciuman Ikan terhadap Rangsangan Bau
Menarik perhatian ikan dengan menggunakan umpan merupakan cara pertama yang dilakukan manusia untuk menangkap ikan (Gunarso, 1985). Jenis rangsangan untuk menarik perhatian ikan dibagi menjadi lima, yaitu:
1) Rangsangan kimiawi (chemical stimulating), yaitu rangsangan yang akan merangsang indera penciuman dan perasa;
2) Rangsangan berdasarkan penglihatan (optical stimulating), yaitu rangsangan yang diberikan atau ditimbulkan untuk merangsang penglihatan sebagai akibat dari gerak, bentuk maupun warna;
3) Rangsangan berdasarkan pendengaran (acoustic stimulating), yaitu rangsangan yang diberikan atau ditimbulkan untuk indera pendengaran dan indera peraba atau linea lateris;
4) Rangsangan listrik (electrical stimulating), yaitu memberikan rangsangan pada kemampuan merasakan arus listrik; dan
5) Rangsangan berupa tempat-tempat berlindung untuk mengumpulkan ikan. Dalam perikanan pancing, jenis rangsangan yang paling berpengaruh dalam keberhasilan penangkapan ikan adalah rangsangan kimia yang berasal dari umpan. Umpan yang baik adalah umpan yang dapat dideteksi oleh ikan pada jarak yang lebih jauh. Rangsangan penglihatan dapat membantu ikan menemukan lokasi umpan.
Umpan yang mengandung asam amino diidentifikasi dapat menjadi stimulus dan atraktor makan pada ikan dan crustacea (Engas dan Lokkerborg, 1994 dikutip oleh Fitri, 2008). Berdasarkan hasil beberapa analisis elektrofisiologi bahwa asam amino merupakan atraktan (stimuli) yang efektif untuk organ penciuman dan rasa pada ikan (Sola dan Tongiorgi, 1998 dikutip oleh Fitri, 2008). Asam amino yang sangat efektif sebagai stimulus pada sistem penciuman ikan atlantik salmon adalah glutamin dan alanin (Caprio, 1982 dikutip oleh Fitri, 2008). Lebih lanjut dijelaskan pula bahwa efektifitas relatif stimulus organ penciuman dari kandungan asam amino sebanyak 10-4 M adalah alanin, glutamin, lystein dan methionin. Kandungan alanin terdapat pada jaringan organisme cacing, moluska, crustacea dan ikan teleostei. Sedangkan untuk arginin terdapat pada jaringan organisme moluska dan crustacea. Pengetahuan yang mendasari bahwa untuk ikan catfish reseptor penciuman sangat besar responsnya pada kandungan lystein dan methionin dan pada reseptor rasa sangat besar reseptornya pada kandungan alanin dan arginine masih belum diketahui. Nukkleosid, nukleotid dan tiga jenis asam amino aromatik (phenylalanine, tryptophan dan tyrosan) dan histidin
diidentifikasi sebagai stimulan makanan (Lokkerberg, 1990 dikutip oleh Fitri, 2008).
Pada ikan cod asam amino yang dapat menstimuli ikan adalah Leusin, metionin, asparagin, glutamin, alanin dan threonin menurut Yacob et al (2004) Menurut Hara (2006) dikutip oleh Fitri (2008) yang asam amino yang dapat menstimuli ikan air tawar adalah sistein, arginin dan glutamin.
2.4 Tingkah Laku Ikan Mendekati Umpan
Tingkah laku ikan adalah suatu gerakan total secara menyeluruh baik gerakan dari dalam maupun dari luar tubuh yang diperagakan dalam bentuk tingkah laku untuk merespons perubahan lingkungannya. Menurut Mulyadi (2001) tingkah laku dapat diartikan sebagai reflek atau respons ikan terhadap segala bentuk stimulan yang datang dari luar maupun dari dalam dan diaktualisasikan dalam bentuk gerak berpola sesuai dengan jenis stimulan yang mempengaruhi.
Tingkah laku ikan biasanya didasarkan pada indera ikan, salah satunya adalah indera penciuman. Pada jenis tertentu indera ini lebih berkembang daripada mata dalam mencari mangsa, misalnya ikan hiu. Tingkah laku ini dimanfaatkan pada pengopersian alat tangkap dengan umpan misalnya bubu dan rawai. Secara umum ikan menggunakan saraf penciuman, penglihatan atau keduanya secara bersamaan dan pendengaran untuk mendeteksi makanan di sekitarnya. Oleh karena itu, dalam memilih umpan disesuaikan dengan kesukaan makanan ikan. Sasaran dan kecenderungan ikan dalam mendeteksi makanan (Wudianto et al., 1993).
Hal tersebut diperkuat oleh Zarochman (1996) yang mengatakan bahwa keberhasilan penggunaan umpan untuk penangkapan direkayasa sesuai dengan kebiasaan terpenting dalam kehidupan hewan melakukan perburuan mencari makanan. Oleh sebab itu pengetahuan mengenai kebiasaan makan akan membantu dalam memahami hubungan antara ikan sasaran dengan alat tangkap yang dipasangi umpan.
Menurut Ferno dan Olsen (1994) ada empat fase tingkah laku ikan terhadap umpan dan pancing:
1) Timbul selera (arousal)
Fase ini disebabkan oleh karena ikan dapat mendeteksi keberadaan umpan. Respons ikan akibat kehadiran umpan sebagai makanan merupakan salah satu yang penting dalam proses rangkaian aktivitas mencari makan bagi ikan. Pada umumnya ikan menggunakan organ olfactory bulb untuk mendeteksi jarak atau keberadaan makanan (umpan).
Ikan dapat mengetahui keberadaan makanan atau umpan akibat adanya organ chemosensory yang dapat mendeteksi jarak atau posisi dimana ikan itu berada. Dari hasil penelitian didapat adanya pengaruh lama perendaman pancing terhadap hasil tangkapan pancing dengan menggunakan umpan ikan segar.
Umpan mackerel yang digunakan dalam keadaan segar dan lama waktu perendaman selama 24 jam menghasilkan tangkapan 50% dari rata-rata hasil tangkapan. Hal tersebut membuktikan bahwa umpan ikan yang telah lama terendam akan kehilangan bau amisnya dan tidak dapat lagi menarik ikan-ikan yang menjadi target tangkapan (Lokkerberg, 1996 dikutip oleh Fitri, 2008).
2) Menentukan lokasi (location phase)
Setelah fase pertama, ikan-ikan akan berorientasi untuk dapat mencari lokasi umpan yang telah dideteksinya melalui organ chemoreceptor ataupun organ deteksi lainnya. Biasanya pada tahap ini ikan-ikan akan menggunakan organ penglihatannya untuk menemukan makanan atau umpan. Pada fase ini arus juga memegang peranan penting begi keberhasilan ikan dalam menemukan makanan atau umpan tersebut, karena arus merupakan media transfer bau yang baik di perairan.
Pengamatan di lapangan terhadap tingkah laku ikan Gadus meriangus (whitting) menuju umpan pada pancing dan diterangkan pula bahwa lebih banyak ikan yang tertarik menuju umpan dalam kondisi perairan berarus. Hal ini disebabkan rangsangan bau aroma dapat dibawa oleh arus pada jangkauan yang lebih jauh, sedangkan dalam kondisi air tenang atau berarus lemah daya hantar aroma dari umpan semakin lemah sehingga ikan yang tertarik kepada umpan jumlahnya sedikit. Sumber makanan dengan cepat lebih mudah ditemukan oleh ikan hiu dalam kondisi air berarus, sedangkan pada perairan yang berarus lemah
sampai tenang lokasi umpan hanya ditemukan secara alami (Ferno dan Olsen, 1994).
Jenis ikan catfish (Ictalarus sp) dan hiu (Sphyrna sp) akan berenang zig-zag dalam mencari makan atau umpan, kemungkinan pada jenis ikan-ikan ini pencarian makanan melalui adaptasi chemo-orientation memiliki konsentrasi yang berbeda.
3) Mengidentifikasikan umpan (up take)
Pada fase ini ikan akan berhasil menemukan umpan dan akan mencari tahu apakah umpan ini cocok untuk dimakan atau tidak. Berdasarkan hasil pengamatan di laboratorium ikan yang menemukan umpan akan berhenti sejenak sebelum mulai memakannya (Riyanto, 2008).
Menurut Ferno dan Olsen (1994) ikan-ikan akan menggunakan penglihatannya dan mechanoreceptor untuk mengidentifikasi dan memutuskan makanan yang layak atau tidak untuk dimakan. Hal yang sama juga diungkapkan oleh Lokkerborg (1996) yang mangatakan bahwa sosok atau wujud umpan yang tertampak oleh penglihatam merupakan fakor penting dalam penerimaan umpan. 4) Fase masuknya makanan (umpan) ke dalam mulut ikan (food ingestion)
Fase ini adalah dimana umpan mulai masuk ke dalam mulut ikan. Pada fase inilah kesempatan mata pancing mengait ikan. Hal yang sangat berpengaruh pada fase ini adalah ukuran dan bentuk umpan, dimana umpan yang terlalu besar tidak akan termakan oleh ikan yang berukuran kecil. Sedangkan umpan yang terlalu kecil akan sulit terdeteksi atau terlihat oleh ikan.
2.5 Organ Penglihatan (Visual Organ)
Mata (penglihatan) pada ikan merupakan salah satu indera yang sangat penting untuk mencari makan, menghindari predator/pemangsa atau dari kepungan suatu alat tangkap. Ketajaman pada mata ikan dapat dijadikan dasar untuk mengetahui area kekuatan pandang untuk melihat suatu objek benda melalui metode tingkah laku ikan (Muntz, 1974 yang dikutip oleh Purbayanto, 1999)
Sumbu penglihatan (visual axis) diidentifikasikan untuk mengetahui kebiasaan ikan dalam melihat makanan atau objek yang lain (Blaxter, 1980).
Sumbu penglihatan diperoleh setelah nilai kepadatan sel kon tiap bagian sel dari retina mata diketahui, dengan cara menarik garis lurus dari bagian retina yang memilki nilai kepadatan sel kon yang tertinggi menuju titik pusat lensa mata (Tamura, 1957). Kepadatan sel kon yang tinggi dimungkinkan untuk mengetahui ketajaman penglihatan dan sumbu penglihatan (Blaxter, 1980).
Menurut Natsir (2008) susunan sel reseptor dari retina mata ikan kerapu macan (Epinephelus fuscoguttatus) terdiri dari sel kon tunggal (single cone cell) dan sel kon ganda (twine cone cell) yang membentuk mozaik, sedangkan sel rod tidak terdapat pada susunan tersebut. Sel kon merupakan reseptor penglihatan untuk color vision dan ketajaman penglihatan (visual acuity). Ukuran diameter lensa akan meningkat sejalan dengan bertambahnya ukuran tubuh ikan.
Kepadatan sel kon berbanding terbalik dengan ukuran panjang tubuh. Semakin besar ukuran panjang tubuh Epinephelus fuscoguttatus maka kepadatan sel konnya akan semakin menurun. Hal ini dikarenakan ukuran sel sel kon akan tetap selama ikan hidup (Natsir, 2008). Menurut Purbayanto (1999) bahwa diameter lensa mata ikan akan meningkat dengan bertambahnya ukuran tubuh sementara itu kepadatan sel kon cenderung menurun dengan meningkatnya pertambahan panjang tubuh.
Berdasarkan hasil penelitian Natsir (2008) diketahui bahwa Epinephelus fuscoguttatus memiliki sumbu penglihatan yang mengarah ke depan-naik ( upper-fore). Hal ini dapat dilihat dari padatnya sel kon pada bagian ventro-temporal, dengan menarik garis lurus melalui lensa mata maka terlihatlah arah penglihatan ikan kerapu macan.
2.6 Organ Penciuman (Olfactory Bulb)
Menurut Hoar dan Randall (1971) “hidung” pada ikan teleost merupakan sepasang cekungan penciuman (olfactory) yang biasanya terletak di sisi dorsal bagian kepala dan sedikit agak jauh dari posisi mulut.
Secara umum olfactory serupa dengan organ nasal untuk penciuman manusia. Akan tetapi dari struktur bentuk dan sistematika fungsinya ada perbedaan antara manusia dan ikan. Lubang atau cuping hidung pada ikan jarang terbuka ke dalam rongga mulut. Dasar dari lubang hidung dibentuk oleh
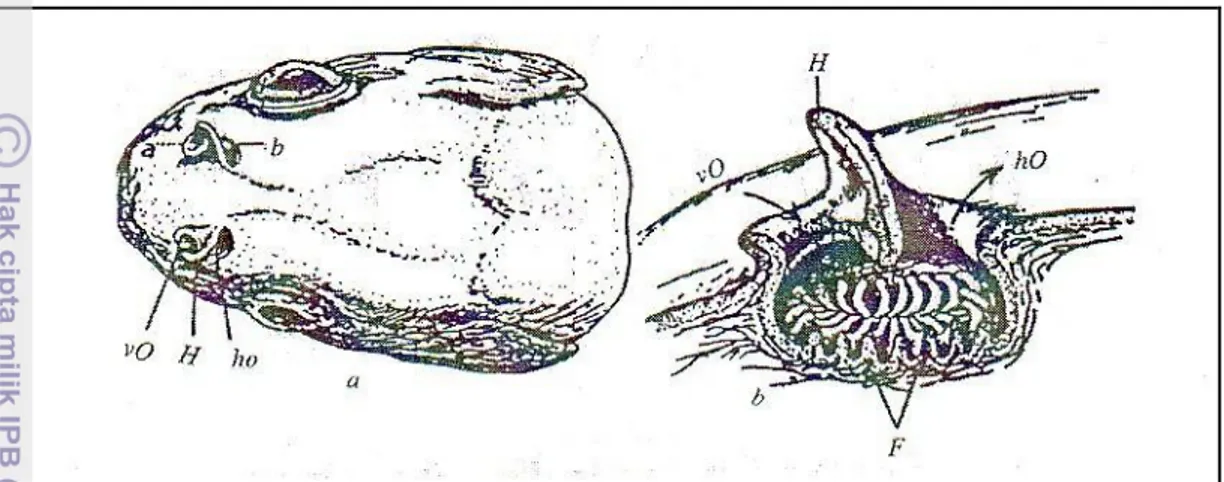
epithelium penciuman atau mukosa berupa lipatan/lamella berbentuk ros (Pitcher, 1993). Susunan bentuk dan lipatan perkembangan lamella sangat bervariasi pada setiap spesies. Bentuk hidung ikan dan bagian-bagiannya dapat dilihat pada Gambar 2.
Keterangan:
(a) Posisi cuping hidung teleostei, (b) epithelium olfactory; (vo) hidung depan; (ho) hidung belakang; (H) kulit yang menahan pergerakan air masuk ke dalam hidung depan; (F) lamella Sumber: Harder (1975) yang dikutip oleh Fujaya (2004)
Gambar 2 Bentuk hidung ikan dan bagiannya.
Reseptor pembau mendeteksi rangsangan kimia dalam bentuk sinyal elektrik yang berasal dari cilia, disebabkan oleh arus lemah yang melewati lamella, selanjutnya informasi tersebut diteruskan ke sistem saraf pusat. Sistem saraf olfactory yang menuju ke otak memiliki dua konfigurasi.
Ikan mendeteksi adanya reseptor pembau dalam bentuk stimuli kimia. Stimuli tersebut melalui lubang hidung (nostril) dan dirubah dalam bentuk signal elektrik yang berasal dari gerakan silia yang kemudian melewati olfactory lamella yang berbentuk rosette (bunga mawar). Sinyal yang dihasilkan pada olfactory lamella diteruskan pada olfactory bulb dan olfactory tract yang kemudian diterjemahkan pada otak telencephalon.
Penciuman ikan sangat sensitif terhadap bahan organik maupun anorganik yang dikenal melalui indera penciuman (Syandri, 1988). Selanjutnya dijelaskan pula bahwa ikan dapat mengenal bau mangsanya, predator dan spesies sendiri. Bau tersebut melarut dalam air dan merangsang reseptor pada organ penciuman (olfactory organ) ikan, sehingga menimbulkan reaksi terhadap ikan tersebut.
Organ penciuman sebagai alat bantu sensor untuk mengetahui banyaknya makanan yang tersedia di habitatnya (Wudianto et al., 1993). Lebih lanjut dijelaskan pula oleh Gunarso (1985), bahwa organ penciuman merupakan salah satu organ penting lainnya pada tubuh ikan yang berhubungan untuk mempelajari natural behavior.
2.7 Otak dan Bagian-bagiannya
Menurut Bone dan Marshall (1982) otak merupakan cerminan berkembang tidaknya fungsi organ-organ sensoris pada hewan. Otak ikan memiliki bagian-bagian yang menunjukan susunan yang berbeda pada kelompoknya. Secara umum, otak ikan dibagi ke dalam tiga bagian besar, yaitu otak depan (forebrain) disebut juga prosencephalon, otak tengah (mesencephalon) dan otak belakang (rhombencephalon). Pembagian otak ikan dapat dilihat pada Tabel 1.
Tabel 1 Bagian utama dan sub bagian otak ikan
No Bagian Utama Sub Bagian
1 Forebrain (prosencephalon)
Lobus olfactoris
Telencephalon (cerebral hemisphere) Diencephalon (between brain) 2 Midbrain (mesencephalon) Lobus opticus
3 Hindbrain (rhombencephalon) Metencephalon (cerebellum)
Myelencephalon (medulla oblongata)
Sumber: Bone dan Marshall (1982)
Telencephalon merupakan pusat penciuman pada bagian otak depan. Bagian ini disebut juga otak depan (forebrain). Pada ikan, telencephalon merupakan tempat penerimaan, elaborasi dan meneruskan impuls aroma (bau). Ukurannya bervariasi, sesuai dengan peranan relatif yang dimainkannya bagi kehidupan ikan yang diuji.
Mesencephalon merupakan otak tengah (midbrain), pada ikan relatif besar terdiri dari lobus opticus dorsal, di bagian dorsal terdapat dua lobus opticus dan ventral tegmentum. Lobus opticus merupakan bagian depan dari retina yang diteruskan proyeksinya ke dalam bagian belakang contra-lateral dari lobus opticus dari sisi yang lain pada ikan.
Perkembangan otak depan yang sangat besar dibandingkan dengan kelompok ikan bertulang sejati maupun hewan vertebrata lainnya, merupakan indikasi bahwa hewan predator seperti ikan cucut, buaya dan anjing sangat mengandalkan indera penciuman sebagai detektor mangsanya dari jarak yang cukup jauh (Razak, 2006).
Dari hasil penelitian Sejati (2008) dan Fitri (2008), otak Epinephelus fuscoguttatus bagian telencephalon berukuran besar, demikian juga pada bagian optic tectum. Cerebellum melengkung ke atas dan di belakang cerebellum ditemukan medulla oblongata. Otak ikan kerapu menunjukan bahwa telencephalon dan optic tectum berkembang. Gambar otak Epinephelus fuscoguttatus disajikan pada Gambar 3.
Keterangan: 1) Olfactory bulb (Ob); 2) telencephalon (Tel); 3) sulcus ypsiliformis; 4) optic tectum (Ot); 6) eminentia granularis (Eg); 7) spinal cord (Sc)
Sumber: Sejati (2008) dan Fitri (2008)
Gambar 3 Otak Epinephelus fuscoguttatus.
2.8 Umpan
Umpan merupakan salah satu bentuk rangsangan (stimulus) yang bersifat fisika dan kimia yang dapat memberikan respons bagi ikan-ikan tertentu pada proses penangkapan ikan. Umpan merupakan salah satu faktor yang memiliki pengaruh yang besar terhadap keberhasilan dalam usaha penangkapan, baik masalah jenis umpan, sifat dan cara pemasangan (Sadhori, 1985). Subani (1983) mengklasifikasikan jenis umpan yang digunakan dalam tujuan penangkapan ikan menjadi tiga, yaitu:
1) Umpan tipuan (artificial bait), yaitu jenis umpan yang dibuat asal saja, artinya tidak dibuat menyerupai umpan alami dan dibuat dari bahan tertentu misalnya: bulu ayam atau bulu domba;
2) Umpan tiruan (imitation bait), yaitu jenis umpan yang dibuat mnyerupai umpan alami (ada yang menyerupai ikan baik warna maupun bentuknya, ada yang menyerupai udang atau cumi-cumi). Misalnya: umpan dari plastic yang berbentuk mirip udang atau cumi-cumi yang digunakan untuk pancing dengan joran; dan
3) Umpan alami (natural bait), yaitu jenis umpan yang didapatkan dari alam (ikan segar, potongan daging ikan dan sebagainya).
Syarat umpan yang baik (Djatikusumo, 1975 yang dikutip oleh Piterurbinas, 2000)
1) Tahan lama artinya tidak mudah busuk; 2) Mempunyai ukuran yang memadai; 3) Harga terjangkau;
4) Mempunyai bau yang spesifik yang dapat merangsang; 5) Mempunyai warna yang mudah dilihat; dan
6) Disenangi oleh ikan yang menjadi tujuan penangkapan.
King (1991) menjelaskan bahwa umpan pada bubu dan perangkap digunakan untuk menangkap ikan dan crustacea. Prinsipnya ikan tertarik oleh umpan, lalu masuk ke dalam bubu melalui mulut bubu dan sulit untuk melarikan diri. Akan tetapi tidak semua jenis ikan akan merespons jenis ikan yang sama, dimana masing-masing spesies memiliki pilihan jenis umpan yang berbeda.
Umpan yang mengandung asam amino diidentifikasikan dapat menjadi stimulus dan atraktor makan pada ikan dan crustacea, dan hampir semua studi mengenai rangsangan kimia untuk tingkah laku makan menunjukan bahwa rangsangan makan pada ikan dan crustacea akan hilang seiring dengan hilangnya kandungan asam amino pada umpan (makanan) (Engas dan Lokkerborg, 1994 dikutip oleh Fitri, 2008). Menurut pendapat Hansen dan Reutter (2004) bahwa ikan predator (buas) yang memakan makanan yang tidak hidup (umpan) menggunakan sistem penciuman mereka untuk dapat merangsang makan dan dapat membedakan stimuli asam amino.
2.9 Arginin dan Leusin
Arginin (Arg atau disingkat R) adalah α-asam amino yang merupakan asam amino yang paling umum. Pada mamalia, arginin diklasifikasikan sebagai semiessensial atau asam amino esensial kondisional, tergantung pada tahap perkembangan dan status kesehatan individu. Rumus kimia dari arginin adalah C6H14N4O2 dengan massa molekul 174,2 g mol -1 (Wikipedia, 2009). Menurut Riyanto (2008) didapatkan hasil komposisi arginin yang dapat dijadikan atraktan ikan kerapu macan adalah 40 mg/g.
Leusin merupakan asam amino essensial yang paling umum dijumpai pada protein yang diperlukan dalam perkembangan atau pertumbuhan. Leusin berperan dalam menjaga perombakan dan pembentukan protein otot. Rumus kimia leusin adalah C6H13NO2 dengan massa molekul 131,18 g mol-1 (Wikipedia, 2009). Menurut Riyanto (2008) didapatkan hasil komposisi leusin yang dapat dijadikan atraktan ikan kerapu macan adalah 50 mg/g.
2.10 Pengamatan Skala Laboratorium
Untuk mengembangkan suatu alat tangkap agar lebih efektif dan efisien, perlu dilakukan percobaan-percobaan terhadap alat tangkap yang masih mempunyai kendala dalam pengoperasiannya serta mempelajari pola tingkah laku ikan target, dimana pengujian dilakukan terlebih dahulu dalam skala laboratorium. Gunarso (1985) menyatakan terdapat beberapa cara untuk mengamati tingkah laku ikan, antara lain:
1) Pengamatan langsung dengan bantuan penyelam pada waktu siang hari;
2) Pengamatan dilakukan melalui akuarium atau tangki percobaan. Hal ini dilakukan untuk mengamati tingkah laku ikan terhadap benda yang diam atau bergerak. Pengamatan ini bisa dibantu dengan kamera atau handycam; dan 3) Pengamatan secara tidak langsung dalam hubungannya dengan alat
penangkapan yang dioperasikan di laut dengan bantuan berbagai peralatan seperti sonar yang diatur dengan pengontrol jarak jauh.
Penelitian yang dilakukan dalam skala laboratorium, seoptimal mungkin kondisinya disesuaikan dengan kondisi alam yang sebenarnya. Parameter-parameter lingkungan, terutama dalam bak selalu dijaga agar tetap optimal. Hal ini berhubungan dengan kondisi ikan uji. Irawati (2002) menyatakan bahwa suhu
air optimum untuk pertumbuhan ikan kerapu berkisar 22-28°C, jika suhu air turun sampai di bawah 15°C akan menyebabkan metabolisme tubuh ikan menurun sehingga ikan tidak mau makan dan aktivitsnya berkurang, sedangkan jika suhu terlalu tinggi (panas) akan menyebabkan metabolisme respirasi berlangsung cepat dan proses metabolism terhenti. Untuk salinitas optimal berkisar 28-32 ppt.
Derajat keasaman (pH) perairan yang optimum untuk kehidupan ikan berkisar 5-8,7. Ikan kerapu macan dapat hidup pada derajat keasaman (pH) 6,5-8. Ikan dihindarkan dari perubahan pH perairan secara mendadak agar tidak stress dan dapat bertahan hidup (Fridudin, 2007).
Sebelum ikan diuji, dilakukan aklimatisasi ikan laut terhadap lingkungan yang baru diperlakukan waktu rata-rata empat hari agar ikan dapat beradaptasi. Pemberian makanan dua kali sehari selama aklimatisasi. Frekuensi pemberian makan yang tepat ditujukan agar pertumbuhan ikan baik, karena berkaitan dengan pencernaan dan pemakaian energi (Informasi Pelabuhan Perikanan DKP, 2006).
3.1 Waktu dan Tempat Penelitian
Penelitian dilaksanakan selama enam bulan dari bulan September 2009 sampai Pebruari 2010. Penelitian ini dilakukan pada dua tempat, untuk respons tingkah laku ikan terhadap umpan dilakukan di Laboratorium Teknologi Penangkapan Ikan (Flume Tank Room). Sedangkan untuk analisis kimia umpan dilakukan di Laboratorium Pascapanen, Balai Besar Litbang Pascapanen Pertanian, Cimanggu-Bogor.
3.2 Sarana, Bahan dan Alat Penelitian
3.2.1 Sarana penelitian 1) Bak pemeliharaan
Bak yang digunakan untuk pemeliharaan ikan kerapu terbuat dari fiber glass dengan ukuran 1,5 x 0,6 x 0,8 m (p x l x t) dan tinggi air 0,4 m. Bak ini dilengkapi dengan sistem filtrasi dan aerasi. Sistem filtrasi yang digunakan adalah sistem filtrasi eksternal. Sistem filtrasi membutuhkan wadah sendiri.
Selama penelitian ini sistem filtrasi yang digunakan akuarium bersekat berukuran 1 x 0,4 x 0,6 m (p x l x t). Sekat ini berfungsi untuk membagi sistem filtrasi menjadi tiga bagian yakni filtrasi fisik, kimia dan biologi. Pada bak pemeliharaan dipasangi pompa berselang untuk memompa air laut dari bak pemeliharaan ke akuarium filter. Sedangkan air dari akuarium filter dialirkan ke bak pemeliharaan dengan bantuan gaya gravitasi, akuarium filter dipasangi pipa paralon sehingga air akan keluar dan mengalir ke bak pemeliharaan. Pada bak pemeliharaan juga dipasang protein skimmer yang berfungsi sebagai pengurai protein. Gambar bak pemeliharaan dan akuarium filter dapat dilihat pada Lampiran 1a dan 1b.
2) Bak perlakuan
Bak yang digunakan untuk perlakuan adalah bak yang sama dengan bak yang digunakan untuk pemeliharaan. Pada saat memulai perlakuan bak dikondisikan tidak terdapat benda yang bisa menghalangi pergerakan ikan. Pompa dan protein skimmer diangkat dari bak perlakuan. Akuarium perlakuan
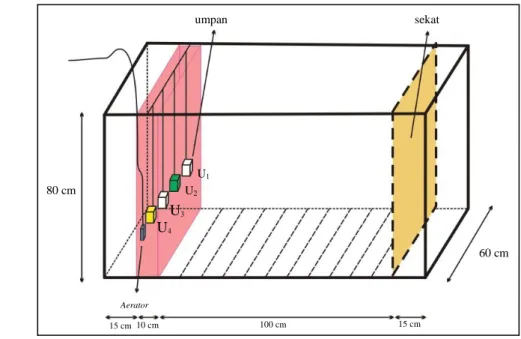
dibagi menjadi tiga area (Gambar 4), yaitu 15 cm pertama sebagai area start yang merupakan posisi awal ikan, kemudian 115 cm berikutnya merupakan area ikan untuk menentukan keberadaan umpan. Pada area start dipasangi sekat. Sekat dipasang setelah ikan digiring ke area start, kemudian sekat diangkat ketika memulai perlakuan.
Keterangan: U1 = umpan kontrol; U2 = umpan dengan pewarna hijau;
U3 = umpan tanpa pewarna; dan U4 = umpan dengan pewarna kuning
Gambar 4 Akuarium perlakuan.
3.2.2 Bahan penelitian dan alat penelitian 1) Bahan penelitian
Bahan yang digunakan dalam penelitian ini antara lain:
(1) Ikan kerapu macan (Epinephelus fuscogutatus) sebanyak lima ekor, dengan sebaran ukuran panjang total 25-30 cm dalam kondisi sehat; (2) Makanan ikan selama berada di bak pemeliharaan, berupa pakan ikan
(pelet) dari Pabrik Grobest tipe PG2;
(3) Umpan percobaan berupa umpan buatan dengan campuran arginin A5006-100G dan leusin L8000-A5006-100G (asam amino yang akan diujikan), pewarna makanan (warna biru dan hijau) dan tepung Cellulose Metil Carboxyl (CMC) yang berfungsi sebagai media perekat kedua asam amino yang diujikan; dan umpan sekat Aerator 80 cm 15 cm 10 cm 100 cm 60 cm 15 cm U1 U2 U3 U4
(4) Air laut yang didatangkan dari Ancol, Jakarta. Bahan penelitian pada Lampiran 2.
2) Alat penelitian
Alat-alat yang digunakan dalam penelitian dan kegunaanya ditunjukan pada Tabel 2. Gambar alat dan bahan yang digunakan pada saat penelitian dapat dilihat pada Lampiran 3.
Tabel 2 Alat dan bahan yang digunakan selama penelitian
No. Alat dan Bahan Kegunaan
1. Timbangan digital (ketelitian 0,1 gram)
Menimbang bahan-bahan yang digunakan untuk membuat umpan
2. Alat pencetak umpan Mencetak umpan
3. Termometer Mengukur suhu air
4. Refraktometer Mengukur kadar garam
5. pH paper Mengukur kadar asam
6. Test kadar amonia Mengukur kadar amonia
7. Sekat Menghalangi ikan bergerak maju sebelum perlakuan
dimulai
8 Kayu Media mengantungkan umpan
9. Benang jahit Mengantungkan umpan
10. Stopwatch Mengukur waktu perlakuan
11. Kamera Mendokumentasikan selama penelitian
12. Handycam Merekam selama pengambilan data
3.3 Metode Penelitian
Metode yang digunakan dalam penelitian ini adalah eksperimen murni (true experiment). Penelitian ini dilakukan dengan metode eksperimen di laboratorium (laboratory experiment). Penelitian laboratorium dilakukan untuk menentukan komposisi kandungan kimia umpan buatan (asam amino arginia dan leusina).
3.4 Prosedur Percobaan
3.4.1 Pembuatan umpan buatan
Pada penelitian ini akan dilakukan penyempurnaan formulasi umpan buatan dengan beberapa komposisi kimia asam amino dan warna umpan. Formulasi umpan buatan dilakukan dengan tujuan untuk menimbulkan daya tarik ikan melalui organ penciumannya, formulasi tersebut dilakukan dengan menguji beberapa komposisi asam amino jenis arginin dan leusin, mengacu pada penelitian sebelumnya. Selain itu akan dibuat tiga jenis warna umpan yang berbeda (tanpa
warna, biru dan hijau) untuk menimbulkan daya tarik ikan melalui organ penglihatannya. Kedua faktor penentu formulasi umpan (komposisi asam amino dan warna umpan) tersebut di atas merupakan perlakuan yang akan diuji dalam penelitian ini. Berdasarkan hasil penelitian sebelumnya nilai arginin dan leusin yang akan diujikan terhadap ikan kerapu macan dapat dilihat pada Tabel 3. Komposisi arginin dan leusin terhadap 100gr umpan. Namun dalam pengambilan data umpan yang diujikan 12% dari 100gr umpan. Rancangan formulasi umpan yang diujikan dapat dilihat pada Tabel 4 dan 5.
Tabel 3 Rancangan komposisi arginin dan leusin berdasarkan penelitian sebelumnya
Asam Amino Komposisi Kimia Umpan (mg/gr)
A B C D E
Arginin 45 45 60 60 60
Leusin 50 65 35 50 65
Tabel 4 Rancangan perlakuan formulasi komposisi kimia umpan buatan
Asam Amino Komposisi Kimia Umpan (gr)
A B C D E
Arginin 0,38 0,38 0.50 0,50 0,50
Leusin 0,42 0.54 0,29 0,42 0,54
Tabel 5 Rancangan perlakuan perbedaan warna umpan buatan
Umpan
A B C D E
Warna
Tanpa pewarna ATanpa warna BTanpa warna CTanpa warna DTanpa warna ETanpa warna
Biru ABiru BBiru CBiru DBiru EBiru
Hijau AHijau BHijau CHijau DHijau EHijau
3.4.2 Uji kimia umpan buatan
Analisis yang dilakukan selanjutnya adalah analisis kimia umpan yang dilakukan di Laboratorium Pascapanan, Balai Besar Litbang Pascapanen Pertanian, Cimanggu-Bogor untuk mengetahui kandungan kimia dari masing-masing umpan. Kandungan kimia yang dianalisis adalah analisis asam amino. Sebelum dilakukan analisis asam amino, terlebih dahulu perlu diketahui kadar
protein sampel. Metode yang digunakan untuk analisis tersebut menggunakan metode kjehdal (AOAC, 1999). Analisis asam amino menggunakan metode High Performance Liquid Chromatography (HPLC) dengan pereaksi ortoftaldelhida (OPA) untuk membentuk senyawa yang berflourensi. Senyawa tersebut dapat dideteksi oleh detektor flouresensi.
3.4.3 Uji respons tingkah laku ikan terhadap umpan
Tahap-tahap dalam pengujian respons tingkah laku ikan terhadap umpan adalah:
1) Persiapan bak fiber pemeliharaan dan perlakuan
Tahap persiapan dilakukan dengan mempersiapkan bak fiber untuk pemeliharaan ikan, akuarium filter dan bak fiber untuk perlakuan. Bak fiber yang digunakan untuk pemeliharaan ikan uji berukuran 1,5 x 0,6 x 0,8 m (p x l x t) dan tinggi air 0,4 m. Bak fiber yang digunakan untuk perlakuan berukuran sama dengan bak pemeliharaan hanya tinggi airnya yang berbeda ± 15 cm. Bak tersebut dibersihkan dengan air tawar untuk menghilangkan kotoran yang menempel. Alat-alat sirkulasi juga dibersihkan sebelum dipasang. Bak diisi dengan air laut dan dihubungkan dengan pipa ke akuarium filter dengan menggunakan pompa. Salinitas dan suhu air laut dalam bak setiap hari dikontrol agar tetap optimal. Bak pemeliharaan ikan disirkulasi selama dua minggu sebelum ikan dimasukan ke dalam bak.
2) Persiapan dan pemeliharaan ikan kerapu
Ikan kerapu macan yang digunakan dalam penelitian berasal dari keramba jaring apung. Ikan dibawa dalam kantung plastik yang telah berisi air laut dan diberi oksigen. Sebelum dimasukan ke dalam bak pemeliharaan, ikan kerapu terlebih dahulu diaklimatisasi. Aklimatisasi bertujuan untuk mengatasi ikan yang stress selama perjalanan, Aklimatisasi mengkondisikan ikan agar secara perlahan menyesuaikan diri dengan lingkungan baru. Aklimatisasi dilakukan sampai ikan mulai bisa menyesuaikan diri dengan lingkungannya.
Selama aklimatisasi ikan diberi makan dua kali sehari, yaitu pada pagi dan sore hari. Ukuran makanan disesuaikan dengan ukuran bukaan mulut ikan. Sisa-sisa makanan dan kotoran ikan diambil dengan menggunakan saringan.
Penyiponan bak dilakukan dua kali seminggu dan penggantian air laut sebanyak 25% dilakukan dua minggu sekali.
3) Pelaparan ikan uji
Pelaparan dilakukan sebelum perlakuan yang bertujuan untuk mengondisikan ikan dalam keadaan lapar sehingga ikan benar-benar memberikan respons terhadap umpan. Berdasarkan uji coba pendahuluan, ikan menunjukkan respons yang baik terhadap umpan setelah dilaparkan selama 3 x 24 jam.
4) Pengambilan data
Pengambilan data dilakukan dengan dua kondisi perlakuan pencahayaan, yakni: kondisi tanpa cahaya dan cahaya redup. Pada saat kondisi tanpa cahaya bak fiber perlakuan dikelilingi oleh plastik mulsa untuk menciptakan ruang gelap. Ruang gelap dimaksudkan agar pada saat uji coba ikan hanya mengandalkan organ penciuman dalam mendeteksi umpan. Sedangkan pada perlakuan dengan pencahayaan redup bak perlakuan tidak dipasangi dengan plastik mulsa. Pengambilan rekaman pada saat kondisi tanpa cahaya menggunakan mode night shoot.
Ikan yang akan diuji sudah dipindahkan dari bak pemeliharaan ke bak perlakuan dan ikan sudah dilaparkan selama 3 x 24 jam. Pengujian diawali dengan menggiring ikan ke ujung bak perlakuan dan sekat dipasang. Umpan yang dipasang selama satu kali perlakuan ada empat jenis umpan dengan komposisi arginin dan leusin yang sama dengan tiga warna umpan yang berbeda dan satu umpan sebagai kontrol. Umpan diletakkan pada jarak 105 cm dari sekat. Desain bak perlakuan dapat dilihat pada Gambar 4.
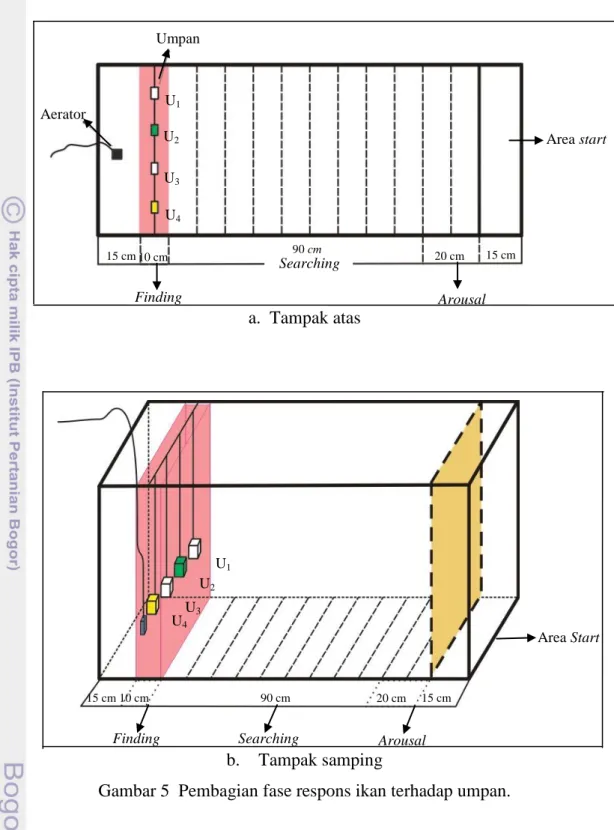
Sekat dibuka secara perlahan agar ikan tidak kaget dan stress. Waktu pengamatan dilakukan saat sekat mulai dibuka hingga ikan memberikan respons dengan bergerak mendekati umpan. Prosedur pengambilan data dari perlakuan dengan cahaya redup sama dengan perlakuan tanpa cahaya. Gambar bak perlakuan tampak atas dan tampak samping serta pembagian area fase respons ikan dapat dilihat pada Gambar 5a dan 5b.
a. Tampak atas
b. Tampak samping
Gambar 5 Pembagian fase respons ikan terhadap umpan.
3.5 Analisis Data
Untuk mengetahui respons indera penciuman ikan uji terhadap umpan buatan yang diujicobakan, maka akan dilakukan pengambilan data respons ikan terhadap setiap jenis umpan buatan dengan melakukan pengamatan tingkah laku ikan mendekati umpan. Data yang dikumpulkan adalah waktu ikan mendekati umpan yang dibedakan dalam tiga fase. Fase arousal adalah fase dimana ikan
Umpan
Aerator
Finding Arousal
Searching
Area start
Finding Searching Arousal
Area Start 15 cm 10 cm 90 cm 20 cm 15 cm 15 cm 10 cm 90 cm 20 cm 15 cm U1 U3 U2 U4 U1 U2 U3 U4
mulai bereaksi karena rangsangan bau atau melihat umpan. Fase searching adalah fase dimana ikan mulai mencari keberadaan umpan dan fase finding adalah ketika ikan telah menemukan umpan dan melakukan uptake (mengambil/memakan umpan). Analisis tingkah laku ikan mendekati umpan yang telah direkam dengan handycam dilakukan secara deskriptif dan analisis juga dilakukan terhadap tingkah laku ikan selama pemeliharaan.
Data mengenai waktu respons arousal, search dan finding merupakan nilai rataan yang ditampilkan dalam bentuk grafik secara sederhana sesuai dengan jenis umpan. Data tersebut selanjutnya dibandingkan untuk mengetahui besarnya pengaruh perbedaan umpan terhadap waktu respons penciuman ikan kerapu macan dengan analisis ragam satu arah (ANOVA). Dalam penelitian ini diasumsikan bahwa tidak ada pengaruh antara jenis umpan dan waktu respons ikan.
Untuk unit percobaan diasumsikan sebagai berikut:
1) Kondisi air dalam bak mendekati kondisi sebenarnya di alam;
2) Ikan di laboratorium dan ikan di perairan terbuka dalam merespon umpan memiliki peluang yang sama;
3) Keadaan ikan dianggap sama pada setiap perlakuan; dan 4) Kondisi umpan dianggap sama pada setiap perlakuan.
Model observasi yang digunakan adalah sebagai berikut: Yij= μ + τi + εij,
Dimana :
Yij : nilai pengamatan dari suatu percobaan pada perlakuan ke-i dan ulangan ke-j;
μ : nilai tengah umum;
τi : pengaruh perlakuan ke-i; dan
εij : sisa dari perlakuan ke-i dan satuan percobaan ke-j.
Langkah-langkah analisis ragam untuk rancangan acak lengkap adalah sebagai berikut:
1) Menghitung Faktor Koreksi (FK), Jumlah Kuadrat Total (JKT), Jumlah Kuadrat Perlakuan (JKP) dan Jumlah Kuadrat Sisa (JKS). Jika n dan p adalah banyaknya pengamatan, maka:
2) Menentukan derajat bebas masing-masing perlakuan, sisa dan total. db perlakuan = n - 1
db sisa = n.p – n db total = n.p – 1
3) Masing-masing Kuadrat Tengah (KT) ditentukan melalui pembagian antara JK dan derajat bebasnya, yaitu:
4) Menyusun daftar analisis ragam seperti terlihat pada Tabel 6. Tabel 6 Daftar analisis ragam Rancangan Acak Langkap (RAL)
Sumber Keragaman
db JK KT Fhitung
Perlakuan n – 1 JKP KTP KTP/KTS
Sisa n.p - n JKS KTS
Total n.p - 1 JKT
Hipotesis yang diuji melalui model analisis ini adalah:
H0 : τ1 = τ2 (tidak ada pengaruh perbedaan umpan terhadap waktu respons)
H1 : τ1 ≠ τ2 (terdapat pengaruh perbedaan umpan terhadap waktu respons)
Kaidah pengambilan keputusan hipotesis yaitu Fhitung > Ftabel maka tolak H0, yang berarti perbedaan jenis umpan berpengaruh nyata terhadap waktu respons ikan, tetapi apabila Fhitung < Ftabel maka gagal tolak H0 yang berarti perbedaan jenis umpan tidak berpengaruh nyata terhadap waktu respons ikan.
4.1 Hasil Penelitian
4.1.1 Kondisi bak penelitian
Kondisi bak yang digunakan selama penelitian dikontrol, sehingga keadaannya mendekati habitat asli ikan kerapu macan di alam. Menurut Indonesia Coral Reef Foundation (2004), kerapu termasuk ikan jenis crepuscular, yang merupakan ikan yang aktif di antara waktu siang dan malam hari, oleh karena itu selama pemeliharaan kondisi dari bak pemeliharaan dibuat redup. Bak pemeliharaan dilengkapi dengan sistem filtrasi. Sistem filtrasi yang digunakan merupakan sistem filtrasi eksternal karena menggunakan akuarium filter yang terpisah dari bak pemeliharaan. Akuarium filtrasi ini mencakup filtrasi fisik, biologi dan kimia. Pembuatan sistem filtrasi dibutuhkan waktu kurang lebih tiga minggu untuk menumbuhkan bakteri baik pengurai nitrat dan nitrit. Selama bakteri tersebut belum muncul maka sistem filtrasi dapat dikatakan belum siap digunakan untuk pemeliharaan.
Suhu merupakan salah satu parameter yang penting dalam mengontrol kondisi lingkungan pemeliharaan ikan. Suhu air selama pemeliharaan dijaga agar berkisar pada suhu 28-30°C. Suhu tersebut merupakan suhu optimum untuk kelangsungan hidup dari ikan kerapu macan. Apabila suhu lingkungan berada di bawah kisaran suhu optimum, maka ikan akan mengalami penurunan nafsu makan. Hal ini diperkuat dengan pernyataan dari Sudjiharno (1998) yang diacu dalam Irawati (2002) yang menyatakan jika suhu air turun sampai di bawah 15°C akan menyebabkan metabolisme tubuh ikan menurun sehingga aktivitasnya berkurang dan ikan tidak mau makan.
Salinitas air laut di bak pemeliharaan dikontrol sehingga berada pada kisaran 30-31 ppt. Selama pemeliharaan ikan, air laut mengalami sirkulasi dan terjadi penguapan sehingga terjadi perubahan salinitas. Apabila salinitas air laut meningkat maka perlu ditambahkan air tawar untuk mengembalikan air laut pada salinitas yang optimal.
pH atau kadar asam selama pemeliharaan dikontrol pada kisaran 7-8. Menurut Kuncoro (2004) pada umumnya pH dari air laut bersifat basa antara
8,1-8,4 oleh karena itu pH dari air laut selama pemeliharaan dikontrol sehingga tidak melibihi kisaran tersebut. Perubahan pH air laut ditandai dengan berubahnya warna dan bau air laut.
Selain suhu, salinitas dan pH parameter lain yang perlu dikontrol selama pemeliharaan adalah kadar amonia. Kadar amonia air laut dijaga pada kisaran 0-0,25 mg/l. Jika kadar ammonia melebihi angka tersebut, maka dapat membahayakan kelangsungan hidup ikan bahkan dapat menyebabkan kematian. Amonia yang tinggi diakibatkan oleh banyaknya sekresi ikan yang dikeluarkan namun bakteri pengurai yang berada pada filter air belum mencukupi. Dalam menjaga tingkat amoniak ini juga dapat dibantu dengan protein skimmer namun alat ini sebenarnya kurang banyak membantu karena yang dapat diurai hanya sebagian kecil.
Perubahan kondisi lingkungan yang drastis dapat menyababkan ikan menjadi stres dan tidak mau makan. Kondisi bak pemeliharaan sudah dibuat sedemikian rupa agar mendekati dengan kondisi habitat asli ikan namun masih terdapat perbedaan kondisi. Ikan yang biasanya dapat bergerak bebas di perairan selama pemeliharaan hanya dibatasi pada bak pemeliharaan yang sempit. Ikan yang mengalami stres mudah terjangkit penyakit baik bakteri, jamur ataupun parasit. Apabila pada tubuh ikan kerapu sudah mulai timbul jamur maka ikan tersebut membutuhkan perlakuan khusus, yaitu dilakukan perendaman dalam air tawar selama kurang lebih lima menit. Lama perendaman bisa lebih dari lima menit tergantung daya tahan ikan.
Ikan kerapu macan juga dihinggapi parasit. Parasit ikan kerapu macan berbentuk seperti cacing kecil yang pada bagian mulutnya terdapat alat penghisap. Biasanya cacing ini hidup pada insang dan sirip ikan. Parasit ini dapat diatasi secara manusal yaitu dengan mengambil satu persatu cacing tersebut. Jika jumlah parasit ini cukup banyak, maka ikan dapat direndam pada air laut yang telah diberi larutan formalin dengan takaran tertentu. Ikan mengalami stress selama pemindahan dari laut ke darat, penanggulangan dilakukan dengan cara pemberian larutan elbaju agar ikan bisa kembali tenang. Kondisi lingkungan dari bak pemeliharaan selama penelitian disajikan pada Tabel 7.
Tabel 7 Kondisi lingkungan bak pemeliharaan selama penelitian Parameter Nilai Suhu 28 - 30°C Salinitas 30 – 31 ppt pH 7 - 8 Amoniak 0 – 0,25 mg/l
4.1.2 Tingkah laku ikan kerapu macan selama pemeliharaan
Ikan kerapu macan merupakan ikan nokturnal. Pada malam hari aktif bergerak di kolom perairan untuk mencari makan sedangkan pada siang hari lebih banyak bersembunyi di liang-liang karang (Valenciennes, 1828). Selama pemeliharaan ikan kerapu macan bersifat pasif, cenderung bersembunyi dan tidak melakukan aktifitas, selalu berada pada sudut-sudut bak atau bersembunyi di bawah pompa dan protein skimmer. Dalam mencari tempat persembunyian, ikan harus saling bersaing untuk mendapatkan tempat persembunyian yang nyaman. Bak pemeliharaan tidak dipasang shelter (tempat persembunyian) sehingga tempat persembunyian yang nyaman adalah berada di bawah pompa dan protein skimmer. Ikan biasanya menggunakan bagian depan mulutnya untuk saling mendorong dengan ikan lainnya dalam memperebutkan tempat persembunyian.
Tingkah laku makan ikan kerapu sama seperti saat ikan saling memperebutkan tempat persembunyian. Ikan saling bersaing untuk lebih cepat mendapatkan pakan. Pada awal pemeliharaan biasanya ikan tidak langsung menyukai pakan yang diberikan. Pakan yang telah dilempar ditunggu sampai berada pada dasar bak. Ikan mulai mendekati pakan dan berhenti sejenak. Ikan mengidentifikasi benda yang berada di depannya. Bila ikan menyukainya maka tidak lama ikan akan memakan pakan tersebut. Setelah makan ikan akan kembali pada tempat persembunyian. Setelah dua hari dipuasakan ikan merasa lapar. Pola tingkah laku ikan adalah dengan berenang pada permukaan dengan posisi mulut dan mata menghadap ke atas mencari-cari makanan. Jika ada orang datang maka ikan akan mendekati dan mulai berenang meminta makanan. Jika hanya diberikan satu pakan saja ikan akan saling bersaing untuk mendapatkannya.
4.1.3 Tingkah laku ikan mendekati umpan buatan
Selama perlakuan dilakukan dengan dua kondisi pencahayaan, tanpa pencahayaan dan pencahayaan yang redup. Pada kondisi ada pencahayaan ikan mengunakan indera penglihatan dan penciuman dalam mendeteksi umpan. Sedangkan pada kondisi tanpa pencahayaan ikan diharapkan hanya mengunakan indera penciuman dalam mendeteksi umpan. Tingkah laku ikan dalam mendekati umpan dapat kita bagi menjadi dua, yakni:
1) Tingkah laku ikan mendekati umpan dalam kondisi pencahayaan redup
Perlakuan diawali dengan memasang sekat. Ikan digiring ke ujung bak kemudian dipasangi sekat. Pada ujung bak lain umpan yang akan diuji mulai dipasang. Setelah itu sekat mulai diangkat perlahan. Posisi awal ikan sebelum sekat dibuka berada di pojok dan sudut bak perlakuan. Setelah sekat dibuka, ikan masih tetap dalam kondisi diam di pojok. Ikan satu demi satu mulai berenang menyusuri sisi bak perlakuan kurang lebih tiga menit setelah sekat dibuka. Ikan berenang menyusuri sisi dari ujung bak satu ke ujung bak yang lain dan ada pula yang berenang menyilang. Hal ini bisa dikarenakan karena ikan mulai beraksi terhadap umpan atau ikan hanya mulai mengadaptasikan diri dengan lingkungannya setelah sekat dibuka. Tingkah laku ikan ini dapat kita lihat pada Gambar 6a, 6b, dan 6c.
Gambar 6a Pola tingkah laku ikan (1). umpan
aerator
arousal searching
identifikasi
searching searching searching U1
U2
U3
Gambar 6b Pola tingkah laku ikan (2).
Gambar 6c Pola tingkah laku ikan (3).
Pola gerak tingkah laku ikan yang pertama dapat dilihat pada Gambar 6a, yang digambarkan dengan anak panah, dimulai dengan melakukan pergerakan menyusuri dinding bak perlakuan hingga kembali ke tempat semula. Dalam pendataan waktu yang diperoleh dimasukan ke dalam fase arousal ketika ikan mulai melewati area start dan fase searching ketika ikan mulai berada di sekitar umpan.
Pada Gambar 6b pola tingkah laku ikan berbeda dengan pola tingkah laku ikan yang pertama. Ikan tidak sampai melewati umpan, hanya berenang maju tidak jauh dari area start lalu kembali lagi ke posisi awal. Pada pola tingkah laku ikan ini data waktu yang didapatkan hanya sampai dengan fase searching.
Pola tingkah laku ikan yang ke tiga juga berbeda dengan yang lainnya. Pada pola ini menunjukan ikan menyentuh namun tidak sampai memakan umpan buatan warna putih. Setelah menyentuh umpan ikan kembali ke ujung bak. Ikan merespon sampai dengan fase finding. Pola tingkah laku ikan ini hanya terjadi sekali pada pengambilan data awal.
umpan aerator umpan aerator arousal arousal searching searching identifikasi finding U1 U2 U3 U4 U1 U2 U3 U4
Pergerakan ikan mulai melewati area start disebut dengan fase arousal.
Fase ini dimulai pada saat ikan mulai bereaksi terhadap rangsangan bau atau melihat umpan (Ferno dan Olsen, 1994). Hampir selama pengujian dengan umpan buatan ikan hanya sampai pada tahap searching yakni fase dimana ikan mulai mencari keberadaan umpan. Hanya pada pengujian awal ikan menyentuh umpan tetapi tidak sampai memakannya atau bisa disebut dengan fase finding. Hal ini dimungkinkan karena ikan mengunakan organ penglihatanya dalam mendeteksi umpan. Untuk membuktikan hal di atas dilakukan pengujian dengan dengan kondisi tanpa pencahayaan.
2) Tingkah laku ikan mendekati umpan dalam kondisi tanpa pencahayaan
Persiapan yang dilakukan saat perlakuan tanpa pencahayaan hampir sama dengan perlakuan dengan pencahayaan redup. Pembeda dari kedua perlakuan ini adalah bila tanpa pencahayaan bak perlakuan dipasangi plastik mulsa untuk menciptakan kondisi yang gelap. Pada kondisi tanpa pencahayaan ikan berenang menyusuri dinding-dinding bak dari ujung yang satu ke ujung yang lain. Hal ini diduga untuk mempermudah ikan dalam mengorientasikan diri dalam kondisi gelap.
Selama perlakuan dengan kondisi tanpa pencahyaan ikan hanya maju dan mundur berenang menyusuri dinding. Ikan tidak pernah menyentuh umpan. Akan tetapi selama pendataan kegiatan ini tetap dimasukan sampai dengan fase
searching. Pada perlakuan kontrol, kondisi tanpa pencahayaan dan tanpa umpan setelah sekat dibuka ikan berenang maju dan mundur menyusuri dinding. Pergerakan ikan dalam kondisi tanpa pencahayaan dapat dilihat pada Gambar 7.
Gambar 7 Pola tingkah laku ikan. umpan
aerator
searching arousal
searching identifikasi
4.1.4 Respons ikan kerapu macan terhadap umpan buatan
Pendataan hasil pengujian respons ikan kerapu macan dibagi menjadi tiga bagian berdasarkan fase, yakni:
1) Waktu rata-rata arousal
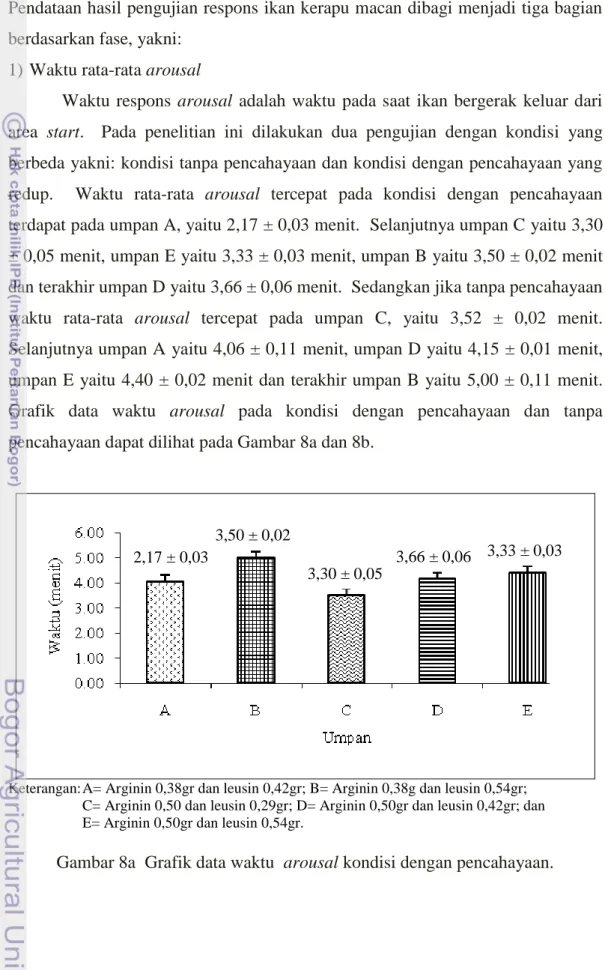
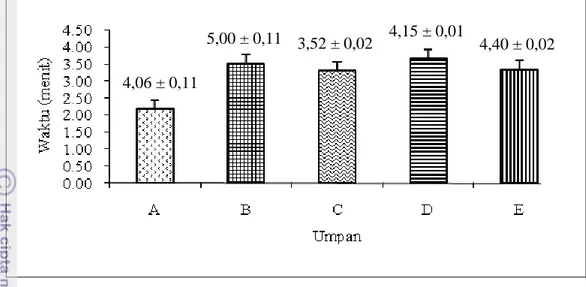
Waktu respons arousal adalah waktu pada saat ikan bergerak keluar dari area start. Pada penelitian ini dilakukan dua pengujian dengan kondisi yang berbeda yakni: kondisi tanpa pencahayaan dan kondisi dengan pencahayaan yang redup. Waktu rata-rata arousal tercepat pada kondisi dengan pencahayaan terdapat pada umpan A, yaitu 2,17 ± 0,03 menit. Selanjutnya umpan C yaitu 3,30 ± 0,05 menit, umpan E yaitu 3,33 ± 0,03 menit, umpan B yaitu 3,50 ± 0,02 menit dan terakhir umpan D yaitu 3,66 ± 0,06 menit. Sedangkan jika tanpa pencahayaan waktu rata-rata arousal tercepat pada umpan C, yaitu 3,52 ± 0,02 menit. Selanjutnya umpan A yaitu 4,06 ± 0,11 menit, umpan D yaitu 4,15 ± 0,01 menit, umpan E yaitu 4,40 ± 0,02 menit dan terakhir umpan B yaitu 5,00 ± 0,11 menit. Grafik data waktu arousal pada kondisi dengan pencahayaan dan tanpa pencahayaan dapat dilihat pada Gambar 8a dan 8b.
Keterangan: A= Arginin 0,38gr dan leusin 0,42gr; B= Arginin 0,38g dan leusin 0,54gr; C= Arginin 0,50 dan leusin 0,29gr; D= Arginin 0,50gr dan leusin 0,42gr; dan E= Arginin 0,50gr dan leusin 0,54gr.
Gambar 8a Grafik data waktu arousal kondisi dengan pencahayaan. 2,17 ± 0,03
3,50 ± 0,02
3,30 ± 0,05