IV. HASIL PENGAMATAN DAN PEMBAHASAN
Cara untuk mengetahui atau mengukur jumlah yang pasti dari suatu larutan lainnya yaitu menggunakan metode titrasi. Titrasi adalah proses penambahan larutan standar sampai reaksi tepat lengkap. Titik (saat) mana reaksi itu tepat lengkap, disebut titik ekuivalen (setara) atau titik akhir teoritis. Titrasi lazimnya harus terdeteksi oleh suatu perubahan yang dihasilkan oleh larutan standar (biasanya ditambahkan dari dalam sebuah buret) itu sendiri, atau lebih lazim lagi, oleh penambahan suatu reagen pembantu yang dikenal sebagai indikator (Basset dkk, 1994).
Pada praktikum kali ini dilakukan titrasi asam basa. Pada titrasi asam basa, larutan uji ditambahkan sedikit demi sedikit, biasanya dalam buret, dalam bentuk larutan yang sudah diketahui konsentrasinya. Penambahan ini diteruskan sampai mencapai kesetaraan dengan larutan yang diuji. Cara untuk mengetahui kapan penambahan larutan standar harus dihentikan, digunakan suatu zat yang disebut sebagai larutan indikator yang ditambahkan dalam larutan yang diuji sebelum penetesan larutan uji dilakukan. Larutan indikator ini menanggapi munculnya kelebihan larutan uji dengan perubahan warna. Perubahan warna dapat atau tidak dapat tepat pada titik ekuivalen. Titik dalam titrasi asam basa pada saat indikator berubah warna disebut titik akhir. Berbagai indikator mempunyai tetapan ionisasi yang berbeda dan akibatnya mereka menunjukkan warna pada range pH yang berbeda (Keenan dkk, 2002).
Titrasi asam basa bertujuan menetapkan kadar sampel asam dengan mentitrasinya dengan larutan baku (alkalimeteri) atau sampel basa dengan larutan baku asam (asidimetri). Reaksi didasarkan pada netralisasi proton, H+ atau H
3O+,
asam oleh ion hidroksi, asam oleh ion hidroksi, OH- (basa) atau sebaliknya. Titrasi
asam-basa bila titik ekivalen suatu titrasi telah tercapai, berlaku : Grek Asam = Grek Basa
( V.N ) Asam = ( V.N ) Basa
Langkah-langkah untuk melakukan titrasi asam-basa adalah pembuatan pereaksi, menyiapkan indikator dan menyusun peralatan titrasi yaitu buret, statif, dan klem. Pada praktikum kali ini larutan pereaksi yang digunakan adalah larutan asam klorida (HCl) 0,1 N dan larutan natrium karbonat (Na2CO3) anhidrous 0,1 N.
Pembuatan larutan HCl 0,1 N dilakukan dengan cara dipipet sebanyak x ml HCl pekat 12 N lalu dimasukkan ke dalam labu ukur 250 ml yang sudah diisi akuades 100 ml. Perlu diingat bahwa dalam mencampurkan asam dengan aquades tidak boleh ditambahkan air ke asam tetapi harus asam ke air. Setelah itu ditambahkan lagi akuades sampai tanda batas lalu dikocok larutan sampai homogen.
Pembuatan Na2CO3 anhidrous 0,1 N dilakukan dengan cara ditimbang Na2CO3
sebanyak 0,53 gram dalam beaker glass menggunakan neraca analitik. Setelah itu dipindahkan secara kuantitatif ke dalam labu ukur dengan cara melarutkan Na2CO3
dengan akuades di beaker glass lalu dipindahkan ke dalam labu ukur 100 ml. Jika langkah tersebut telah selesai dilanjutkan dengan menambahkan akuades sampai tanda batas lalu dikocok larutan sampai homogen.
metil orange mempunyai range pH dr 3,1-4,4, yang menunjukkan larutan tersebut bersifat asam.
Titrasi asam kuat dengan basa lemah yaitu HCl dengan Na2CO3, dilakukan
dengan cara dipipet 10 ml Na2CO 0,1 N ke dalam erlenmeyer lalu ditambahkan
kurang lebih tiga tetes indikator metil orange lalu diimasukkan HCl ke dalam buret sebanyak 50 ml dengan posisi keran buret tertutup. Erlenmeyer dibawah keran buret lalu dilakukan titrasi. Titrasi dilakukan sampai Na2CO3 yang telah ditetesi metil
orange berubah warna dari jingga menjadi merah. Reaksi yang terjadi : 2 HCl + Na2CO3 → 2 NaCl + H2O + CO2
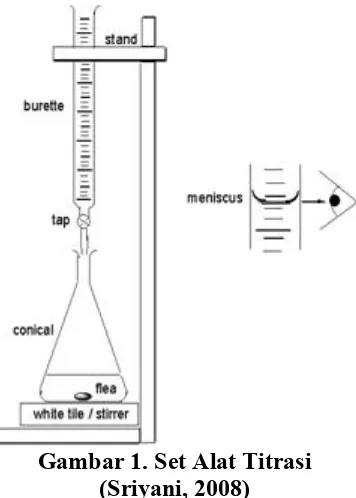
Rangkaian alat untuk titrasi dapat dijelaskan melalui gambar berikut.
Gambar 1. Set Alat Titrasi (Sriyani, 2008)
Berdasarkan hasil pengamatan dan perhitungan didapatkan data sebagai berikut.
Tabel 1. Hasil Pengamatan Perhitungan Berdasarkan Titrasi Asam-Basa Kel
. N Na2CO3 V HCl N HCl Rata-rata N HCl
6 0,1002 N 9,00 ml 0,1113 N
0,1105 N
7 0,1002 N 9,00 ml 0,1113 N
8 0,1006 N 9,05 ml 0,1111 N
9 0,1006 N 9,00 ml 0,1112 N
Sumber : Dokumentasi Pribadi, 2014
1. Perhitungan massa Na2CO3 yang digunakan
Massa = N x V (l) x BE = 0,1 x 0,1 x 1062 = 0,1 x 0,1 x 53 = 0,53 gram
2. Perhitungan normalitas Na2CO3
a. [Na2CO3] = Massa BE x 1000v (ml)
= 0 ,5335 53 x 1000100
= 0,1006 N
b. [Na2CO3] = Massa BE x 1000v (ml)
= 0 ,5311 53 x 1000100
= 0,1002 N
3. Perhitungan hasil standarisasi HCl 0,1 N
Kelompok 6
VHCl x NHCl = VNa₂CO₃ x NNa₂CO₃ 9,00 x NHCl = 10 x 0,1002
NHCl = 0,1113 N
Kelompok 7
VHCl x NHCl = VNa₂CO₃ x NNa₂CO₃ 9,00 x NHCl = 10 x 0,1002
NHCl = 0,1113 N
Kelompok 8
VHCl x NHCl = VNa₂CO₃ x NNa₂CO₃ 9,05 x NHCl = 10 x 0,1006
NHCl = 0,1111 N
VHCl x NHCl = VNa₂CO₃ x NNa₂CO₃ 9,00 x NHCl = 10 x 0,1006
NHCl = 0,1112 N
Kelompok 10
VHCl x NHCl = VNa₂CO₃ x NNa₂CO₃ 9,4 x NHCl = 10 x 0,1006
NHCl = 0,1070 N
Faktor yang paling sering menyebabkan ketidaktepatan data pada proses titrasi adalah dalam melihat larutan yang berada di erlenmeyer sudah mencapai titik ekivalen atau belum. Titik ekivalen pada percobaan ini dicapai ketika Na2CO3 sudah
mulai berwarna merah dan tidak kembali orange. Seringkali penetesan HCL kurang terkontrol dan kurang hati hati sehingga Na2CO3 menjadi berwarna sangat merah,
sedangkan titik ekivalen dicapai pada saat Na2CO3 tepat berwarna merah. Hal tersebut
menyebabkan volume HCl yang didapat akan berlebih dan menyebabkan hasil normalitas yang kurang dari seharusnya. Sebaliknya apabila volume HCl yang didapat terlalu kecil (kurang pas) maka akan mengakibatkan normalitas yang didapat lebih dari yang seharusnya. Perlu ditekankan kembali bahwa dalam pengamatan perubahan Na2CO3 menjadi merah haruslah hati-hati, karena apabila Na2CO3 tersebut
sudah berwarna merah dan setelah di kocok kembali lagi menjadi orange, maka belum mencapai titik ekivalen.
Titrasi atau titrimetri mengacu pada analisa kimia kuantitatif yang dilakukan dengan menetapkan volume suatu larutan yang konsentrasinya diketahui dengan tepat, yang diperlukan untuk bereaksi secara kuantitatif dengan larutan dari zat yang akan dianalisis. Larutan dengan konsentrasi yang diketahui tersebut disebut larutan standar. Bobot zat yang hendak dianalisis dihitung dari volume larutan standar yang digunakan serta hukum stoikiometri yang diketahui.
distandarisasi dan lebih lanjutnya akan digunakan untuk proses analisis sampel. Standarisasi perlu dilakukan, karena larutan standar sekunder biasanya bersifat tidak stabil jika disimpan dalam waktu yang lama. Sedangkan larutan standar primer yang dipilih biasanya memiliki sifat stabil jika disimpan dalam waktu yang lama, misalnya saja tidak higroskopis sehingga konsentrasinya tidak mudah berubah.
Syarat larutan baku primer yaitu : 1. Memiliki kemurnian 100%
2. Bersifat stabil pada suhu kamar dan stabil pada suhu pemanasan
(pengeringan) disebabkan standar primer biasanya dipanaskan dahulu sebelum ditimbang.
3. Mudah didapatkan (tersedia diaman-mana).
4. Memiliki berat molekul yang tinggi (MR), hal ini untuk menghindari
kesalahan relative pada saat menimbang. Menimbang dengan berat yang besar akan lebih mudah dan memiliki kesalahan yang kecil dibandingkan dengan menimbang sejumlah kecil zat tertentu.
5. Harus memenuhi kriteria syarat-syarat titrasi.
Contoh senyawa yang dapat dipakai untuk standar primer adalah :
Arsen trioksida (As2O3) dipakai untuk membuat larutan natrium arsenit
NaASO2 yang dipakai untuk menstandarisasi larutan natrium periodat NaIO4,
larutan iodin I2, dan cerium (IV) sulfat Ce(SO4)2.
Asam bensoat dipakai untuk menstandarisasi larutan natrium etanolat, isopropanol atau DMF.
Kalium bromat KBrO3 untuk menstandarisasi larutan natrium tiosulfat
Na2S2O3.
Kalium hydrogen phtalat (KHP) dipakai untuk menstandarisasi larutan asam perklorat dan asam asetat.
Natrium Karbonat dipakai untuk standarisasi larutan H2SO4, HCl dan HNO3.
Asam sulfanilik (4-aminobenzene sulfonic acid) dipakai untuk standarisasi larutan natrium nitrit.
Adapun syarat – syarat larutan baku sekunder :
1. Derajat kemurnian lebih rendah daripada larutan baku primer 2. Berat ekivalennya tinggi
3. Larutan relatif stabil di dalam penyimpanan
Setelah proses standarisasi, dilanjutkan dengan proses analisa larutan sampel. Larutan standar tersebut akan dialirkan dari buret ke larutan sampel yang biasanya berada di labu erlenmeyer. Syarat terjadinya reaksi titrasi dengan baik adalah :
1. Reaksinya berlangsung cepat, bila perlu dapat digunakan katalis untuk mempercepat reaksi
2. Reaksi berlangsung sederhana dan persamaan stoikiometrinya jelas
3. Tidak terjadi reaksi sampingan yang dapat mengganggu jalannya reaksi utama 4. Harus ada indikator yang dapat menunjukkan kapan titrasi dihentikan
Masalah kapan titrasi harus dihentikan, ada dua istilah yang lazim digunakan pada titrasi. Titik ekuivalen yaitu titik saat jumlah mol larutan standar tepat bereaksi dengan jumlah mol larutan sampel. Sehingga dengan persamaan N1.V1 = N2.V2
(keterangan: N = normalitas; V = volume), dapat ditentukan konsentrasi larutan sampel. Sedangkan titik akhir titrasi adalah titik saat indikator menunjukkan gejala yang menandai bahwa titik ekuivalen telah tercapai. Titik ekuivalen adalah hitungan teoritis, sedangkan yang dapat diamati oleh praktikan adalah titik akhir titrasi. Oleh karena itu pemilihan indikator hendaknya disesuaikan dengan kondisi titik ekuivalen agar perubahan atau gejala yang ditunjukkan indikator tersebut benar-benar merepresentasikan titik ekuivalen dengan error yang seminimal mungkin.
Menurut Sriyani (2008), ada dua cara umum untuk menentukan titik ekuivalen pada titrasi asam basa, antara lain :
2. Memakai indikator asam basa. Indikator ditambahkan dua hingga tiga tetes (sedikit mungkin) pada titran sebelum proses titrasi dilakukan. Indikator ini akan berubah warna ketika titik ekuivalen terjadi, pada saat inilah titrasi dihentikan. Indikator yang dipakai dalam titrasi asam basa adalah indikator yang perubahan warnanya dipengaruhi oleh pH.
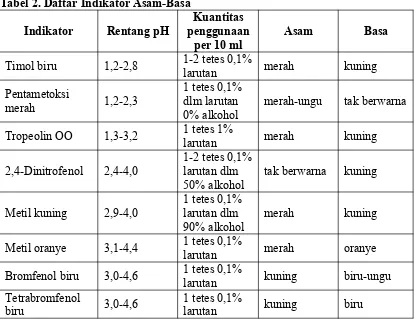
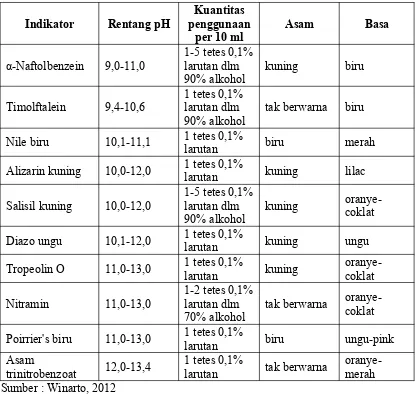
Indikator asam basa adalah senyawa khusus yang ditambahkan pada larutan, dengan tujuan mengetahui kisaran pH dalam larutan tersebut. Indikator asam basa biasanya adalah asam atau basa organik lemah. Senyawa indikator yang tak terdisosiasi akan mempunyai warna berbeda dibanding dengan indikator yang terionisasi. Sebuah indikator asam basa tidak mengubah warna dari larutan murni asam ke murni basa pada konsentrasi ion hidrogen yang spesifik, melainkan hanya pada kisaran konsentrasi ion hidrogen. Kisaran ini merupakan suatu interval perubahan warna, yang menandakan kisaran pH (Winarto, 2012). Indikator asam basa dijelaskan pada tabel 2.
Tabel 2. Daftar Indikator Asam-Basa
Indikator Rentang pH penggunaanKuantitas per 10 ml
Asam Basa
Timol biru 1,2-2,8 1-2 tetes 0,1%larutan merah kuning Pentametoksi Tropeolin OO 1,3-3,2 1 tetes 1% larutan merah kuning 2,4-Dinitrofenol 2,4-4,0 1-2 tetes 0,1%larutan dlm
50% alkohol
tak berwarna kuning
Metil kuning 2,9-4,0 1 tetes 0,1% larutan dlm 90% alkohol
merah kuning
Metil oranye 3,1-4,4 1 tetes 0,1% larutan merah oranye Bromfenol biru 3,0-4,6 1 tetes 0,1% larutan kuning biru-ungu Tetrabromfenol
Indikator Rentang pH
p-Etoksikrisoidin 3,5-5,5 1 tetes 0,1%
larutan merah kuning
Bromkresol hijau 4,0-5,6 1 tetes 0,1% larutan kuning biru Metil merah 4,4-6,2 1 tetes 0,1% larutan merah kuning Bromkresol ungu 5,2-6,8 1 tetes 0,1% larutan kuning ungu Klorfenol merah 5,4-6,8 1 tetes 0,1% larutan kuning merah Bromfenol biru 6,2-7,6 1 tetes 0,1%
larutan kuning biru
p-Nitrofenol 5,0-7,0 1-5 tetes 0,1%
larutan tak berwarna kuning Azolitmin 5,0-8,0 5 tetes 0,5% larutan merah biru Fenol merah 6,4-8,0 1 tetes 0,1% larutan kuning merah Neutral merah 6,8-8,0
Kresol merah 7,2-8,8 1 tetes 0,1% larutan kuning merah α-Naftolftalein 7,3-8,7
1-5 tetes 0,1% larutan dlm 70% alkohol
merah mawar hijau Tropeolin OOO 7,6-8,9 1 tetes 0,1% larutan kuning merah mawar Timol biru 8,0-9,6 1-5 tetes 0,1%larutan kuning biru Fenolftalein (pp) 8,0-10,0
1-5 tetes 0,1% larutan dlm 70% alkohol
Indikator Rentang pH Nile biru 10,1-11,1 1 tetes 0,1%
larutan biru merah
Alizarin kuning 10,0-12,0 1 tetes 0,1%
larutan kuning lilac Diazo ungu 10,1-12,0 1 tetes 0,1%
larutan kuning ungu
Tropeolin O 11,0-13,0 1 tetes 0,1%
larutan kuning Poirrier's biru 11,0-13,0 1 tetes 0,1%
larutan biru ungu-pink
Tabel 3. Daftar Indikator Asam-Basa Alami Warna
Bunga BungaNama Warna AirBunga
Warna Air
Merah Kembang sepatu Ungu muda Merah Hijau tua
Kuning Terompet Kuning keemasan Emas muda Emas tua
Ungu Anggrek Ungu tua Pink tua Hijau kemerahan
Merah Asoka Coklat muda Oranye muda Coklat
Kuning Kunyit Oranye Oranye cerah Coklat kehitaman
Pink Euphorbia Pink keputih-putihan Pink muda Hijau lumut Merah Kamboja Coklat tua Coklat oranye Coklat kehitaman Sumber : Winarto, 2012
Menurut Winarto (2012), senyawa alam banyak yang digunakan sebagai indikator asam basa alami. Beberapa tumbuhan yang bisa dijadikan sebagai bahan pembuatan indikator asam basa alami antara lain adalah kubis ungu, sirih, kunyit, dan bunga yang mempunyai warna (anggrek, kamboja jepang, bunga sepatu, asoka, bunga kertas). Cara membuat indikator asam basa alami adalah :
1. Menumbuk bagian bunga yang berwarna pada mortar.
2. Menambahkan sedikit akuades pada hasil tumbukan sehingga didapatkan ekstrak cair.
3. Ekstrak diambil dengan pipet tetes dan dan diteteskan dalam keramik. 4. Menguji dengan meneteskan larutan asam dan basa pada ekstrak, sehingga
V. KESIMPULAN
HCl merupakan larutan baku sekunder karena akan dicari konsentrasinya sedangkan Na2CO3 merupakan larutan baku primer karena
konsentrasinya sudah diketahui dengan tepat.
HCl dapat distandarisasi menggunakan larutan Na2CO3.
Titrasi HCl dengan Na2CO3 memerlukan indicator yaitu metil orange.
Indikator metil orange jika digunakan pada larutan basa maka warna larutan akan berubah warna menjadi kuning, namun jika digunakan pada larutan basa maka warna larutan akan berubah warna menjadi merah. Perubahan warna pada larutan yang dititrasi disebabkan oleh resonansi
DAFTAR PUSTAKA
Basset, J., R.C., Denney, G.H. Jeffery, dan J. Mendham. 1994. Buku Ajar Vogel : Kimia Analisis Kuantitatif Anorganik Edisi 4. EGC. Jakarta
Keenan, C.W., Kleinfelter, D.C., dan Wood, J.H. 2002. Ilmu Kimia untuk Universitas : Edisi Keenam. Erlangga. Jakarta
Sriyani. 2008. Materi titrasi asam basa. Terdapat di
http://kimia.upi.edu/utama/bahanajar/kuliah_web/2008/SRIYANI %28050679%29/materi_3.html (diakses pada 16 September 2014)
Winarto, Dwi. 2012. Indicator Asam Basa.