xvii INTISARI
Dalam pengobatan tradisional di Indonesia, daun dari tanaman dadap serep berkhasiat untuk mengobati sakit kepala, batuk serta untuk minuman bagi wanita sehabis melahirkan. Senyawa fenolik merupakan salah satu kandungan bioaktif dari daun dadap serep. Penelitian ini dilakukan untuk mengetahui aktivitas antioksidan fraksi etil asetat ekstrak etanol daun dadap serep secara in vitro yang didasarkan pada efek peredaman radikal bebas larutan 1,1-difenil-pikrilhidrazil (DPPH) yang dinyatakan dengan inhibition concentration 50 (IC50).
Kandungan fenolik total juga ditentukan menggunakan pereaksi Folin-Ciocalteu dengan baku standar asam galat yang dinyatakan dengan massa ekivalen asam galat. Prinsip metode ini adalah senyawa fenolik teroksidasi dalam suasana basa dan pereaksi Folin-Ciocalteu tereduksi menjadi larutan berwarna biru yang dapat diukur dengan spektrofotometer visibel pada panjang gelombang 750 nm. Hasil penelitian menunjukkan bahwa fraksi etil asetat ekstrak etanol daun dadap serep mempunyai aktivitas antioksidan dengan nilai IC50 sebesar 245,15 ± 4,26 µg/mL
dan kandungan fenolik total sebesar 8,51 ± 0,18 ekivalen asam galat per g fraksi etil asetat ekstrak etanol daun dadap serep dan metode yang digunakan belum tervalidasi.
xviii ABSTRACT
In Indonesian traditional medicine, the leaves of dadaps (Erythrina subumbrans (Hassk.) Merr.) are efficacious to cure headaches, cough and can also be used as a drink for women after childbirth. Phenolic compound is one of the bioactive contents in dadaps leaves. This research was conducted to determine the antioxidant activities of ethyl acetate fraction of ethanol extract of dadaps leaves in vitro based on the reducing effect of free radical of 1,1-diphenyl-pikrilhidrazil (DPPH) solution expressed by inhibition concentration 50 (IC50). The total
phenolic contents was also determined by using the Folin-Ciocalteu reagent with gallic acid standard expressed by the mass of gallic acid equivalents. The principle of this method is oxidized phenolic compounds in alkaline medium and Folin-Ciocalteu reagent is reduced to a blue solution that can be measured by the visible spectrophotometer at a wavelength of 750 nm. The results showed that the ethyl acetate fraction of ethanol extract of dadaps leaves had antioxidant activities with IC50 valued in the amount of 245.15 ± 4.26 µg/mL and the total phenolic content
of 8.51 ± 0.18 gallic acid equivalent per g of ethyl acetate fraction of ethanol extract of dadaps leaves and the method has not been validated.
i
UJIAKTIVITASANTIOKSIDANMENGGUNAKANMETODEDPPH
DANPENETAPANKANDUNGANFENOLIKTOTALFRAKSIETIL
ASETATEKSTRAKETANOLIKDAUNDADAPSEREP(Erythrina
subumbrans (Hassk.)Merr.)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh : Aldo Kristian NIM : 098114038
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA
YOGYAKARTA
iv
HALAMAN PERSEMBAHAN
Skripsi ini kupersembahkan untuk :
Tuhanku Yesus Kristus atas segala berkat dan penyertaan-Nya
Bapak, Ibu dan Kakak-kakakku atas kasih sayang
vii
KATA PENGANTAR
Puji dan syukur penulis kepada Tuhan atas segala rahmat, berkat, anugrah dan penyertaan-Nya kepada penulis sehingga penulis dapat menyelesaikan skripsi yang berjudul “UJI AKTIVITAS ANTIOKSIDAN MENGGUNAKAN
METODE DPPH DAN PENETAPAN KANDUNGAN FENOLIK TOTAL
FRAKSI ETIL ASETAT EKSTRAK ETANOLIK DAUN DADAP SEREP
(Erythrina subumbrans (Hassk.) Merr.)” ini dengan baik. Skripsi ini disusun untuk memenuhi salah satu persyaratan untuk memperoleh gelar Sarjana Farmasi (S.Farm) pada Fakultas Farmasi, Universitas Sanata Dharma, Yogyakarta.
Penulis ingin berterima kasih kepada segala pihak yang telah memberikan bantuan baik dukungan, bimbingan, sarana, materil maupun moril dalam penyusunan skripsi ini. Oleh karena itu, dalam kesempatan ini penulis mengucapkan terima kasih atas segala bantuan yang telah diberikan kepada: 1. Ipang Djunarko,M.Sc.,Apt., selaku Dekan Fakultas Farmasi Universitas Sanata
Dharma.
2. Prof.Dr.C.J. Soegihardjo,Apt., selaku Dosen Pembimbing yang telah memberikan perhatian, bimbingan dan arahan dari awal pengusulan skripsi sampai penulisan skripsi ini selesai.
3. Lucia Wiwid Wijayanti,M.Si., selaku Dosen Penguji atas ketersediaannya untuk menguji dan juga memberikan masukan dan saran dalam skripsi ini. 4. Yohanes Dwiatmaka,M.Si., selaku Dosen Penguji atas ketersediaannya untuk
viii
5. Rini Dwiastuti S.Far.,Apt, M.Sc., selaku Dosen Pembimbing Akademik yang telah membimbing dan memberi nasihat kepada penulis.
6. Sahabat seperjuangan skripsi DPPH, Anthony Felix, Mikhael Gustandy, Willigis Danu Patria yang selalu membantu dan bekerjasama dengan luar biasa. 7. Teman-teman FSM dan FST A 2009, atas kerjasama, dukungan dan bantuan
yang diberikan.
8. Segenap laboran Laboratorium Fakultas Farmasi Universitas Sanata Dharma atas segala bantuan selama penulis melakukan penelitian di laboratorium. 9. Pemerintah Kabupaten Bengkayang, Kal-Bar, atas bantuan dana yang
diberikan.
10.Semua pihak yang telah memberikan bantuan dan dukungan yang tidak dapat disebut satu per satu.
Penulis menyadari bahwa masih terdapat ketidaksempurnaan dalam penulisan skripsi ini. Dengan segala kerendahan hati penulis akan menerima segala kritik dan saran yang membangun dari semua pihak. Akhir kata, semoga skripsi ini dapat bermanfaat bagi ilmu pengetahuan dan banyak pihak.
Yogyakarta, 10 Maret 2013
ix
x
F. Metode DPPH dan Folin-Ciocalteu……….... 14
G. Validasi Metode………...…… 16
H. Landasan Teori………. 18
I. Hipotesis……….. 19
BAB III METODOLOGI PENELITIAN……… 20
A. Jenis dan Rancangan Penelitian……….. 20
B. Variabel……… 20
C. Definisi Operasional………..……….… 20
D. Bahan dan Alat Penelitian……… 21
1. Bahan penelitian……….. 21
2. Alat penelitian……….…… 21
E. Tatacara Penelitian……… 22
1. Determinasi tumbuhan……… 22
2. Pengumpulan bahan……….…… 22
xi
4. Pembuatan larutan pembanding dan uji……….… 23
5. Uji pendahuluan………..… 24
6. Optimasi metode uji aktivitas antioksidan………..…… 25
7. Uji aktivitas antioksidan……….…… 26
8. Optimasi metode penetapan kandungan fenolik total…………. 27
9. Penetapan kandungan fenolik total………. 27
F. Analisis Hasil……… 28
BAB IV HASIL DAN PEMBAHASAN……….… 31
A. Determinasi……….. 31
B. Hasil Pengumpulan Bahan……… 31
C. Hasil Preparasi Sampel……….…… 34
1. Ekstraksi sampel………..… 34
2. Fraksinasi ekstrak……….… 35
D. Hasil Uji Pendahuluan………... 37
1. Uji pendahuluan aktivitas antioksidan……….… 37
2. Uji pendahuluan senyawa fenolik……… 39
E. Hasil Optimasi Metode Uji Aktivitas Antioksidan………. 40
1. Penentuan panjang gelombang maksimun ( maks)……… 40
2. Penentuan Operating Time(OT)………... 41
F. Hasil Validasi Metode Uji Aktivitas Antioksidan………. 43
1. Presisi metode uji aktivitas antioksidan ……… 45
2. Linearitas metode uji antioksidan……….. 46
xii
G. Hasil Uji Aktivitas Antioksidan dengan Radikal DPPH……… 48
H. Hasil Optimasi Metode Penetapan Kandungan Fenolik Total……….. 55
1. Penentuan operating time(OT)……….. 55
2. Penentuan panjang gelombang maksimum……… 56
I. Hasil Validasi Metode Penetapan Kandungan Fenolik Total………… 57
1. Presisi metode penetapan kadar kandungan fenolik total……….. 57
2. Linieritas metode penetapan kandungan fenolik total……… 58
3. Spesifisitas metode penetapan kandungan fenolik total………. 59
J. Hasil Penetapan Kandungan Fenolik Total………. 59
BAB V KESIMPULAN DAN SARAN………. 62
A. Kesimpulan……….……. 62
B. Saran………... 62
DAFTAR PUSTAKA……….. 63
LAMPIRAN……….… 66
xiii
DAFTAR TABEL
Halaman Tabel I. Berbagai Reactive Oxygen Species (ROS) dan
antioksidan sebagai penetral………. 13
Tabel II. Kisaran recoveryhasil analisis yang diterima………….. 17 Tabel III. Kriteria nilai presisi yang masih dapat diterima………... 17 Tabel IV. Hasil Scanningpanjang gelombang maksimum DPPH… 40 Tabel V. Hasil pengukuran absorbansi seri baku kuersetin
yang direaksikan dengan radikal DPPH……… 43
Tabel VI. Hasil pengukuran absorbansi seri fraksi etil asetat ekstrak etanol daun dadap serep yang direaksikan
dengan DPPH……… 44
Tabel VII. Hasil presisi aktivitas antioksidan standar kuersetin……. 45 Tabel VIII. Hasil presisi aktivitas antioksidan fraksi etil asetat……… 45 Tabel IX. Hasil aktivitas antioksidan kuersetin dengan metode
DPPH………. 51
Tabel X. Hasil aktivitas antioksidan fraksi etil asetat ekstrak etanol daun dadap serep dengan metode DPPH…………. 52
Tabel XI. Hasil perhitungan IC50 kuersetin dan Fraksi etil asetat
ekstrak etanol daun dadap serep………. 53
Tabel XII. Penggolongan tingkat kekuatan antioksidan kuersetin
xiv
Tabel XIII. Hasil scanning panjang gelombang maksimum………….. 57
Tabel XIV. Hasil presisi asam galat dari beberapa parameter……… 58
Tabel XV. Hasil pengukuran absorbansi asam galat yang
direaksikan dengan Folin-Ciocalteu……… 58
Tabel XVI. Hasil penentuan jumlah fenolik total fraksi etil asetat
xv
DAFTAR GAMBAR
Halaman
Gambar 1. Beberapa struktur senyawa isoflavonoid……… 8
Gambar 2. Klasifikasi flavonoid produk alam………. 9
Gambar 3. Usulan mekanisme reaksi antara BHT dan DPPH……….. 12 Gambar 4. Reaksi antara radikal DPPH dengan senyawa antioksidan.. 15 Gambar 5. Skema jalannya penelitian……….. 30
Gambar 6. Blanko DPPH , Fraksi etil asetat, Kuersetin…………..…. 38 Gambar 7. Blanko reagen Folin-ciocalteau , Fraksi+reagen
Folin-ciocalteau, Asam galat+ragen Folin-ciocalteatu…… 39 Gambar 8. Grafik penentuan OT kuersetin (Replikasi 2)……….. 42 Gambar 9. Grafik Penetuan OT Fraksi Etil Asetat (Replikasi 1)……... 42 Gambar 10. Reaksi antara radikal DPPH dengan senyawa……….. 48
Gambar 11. Struktur senyawa kuersetin……….. 49 Gambar 12. Usulan mekanisme reaksi kuersetin dan radikal DPPH…… 49 Gambar 13. Kurva persamaan regresi linier aktivitas antioksidan
kuersetin……….. 51
Gambar 14. Kurva persamaan regresi linier aktivitas antioksidan
fraksi etil asetat……… 52
Gambar 15. Grafik penentuan OT asam galat (Replikasi 1)……… 56 Gambar 16. Reaksi pembentukan kompleks molybdenum-blue……….. 60
xvi
DAFTAR LAMPIRAN
Halaman Lampiran 1. Surat determinasi tanaman dadap serep………. 66
Lampiran 2. Gambar tanaman dadap serep……… 67
Lampiran 3. Perhitungan rendemen………...… 68
Lampiran 4. Data penimbangan untuk pengujian
aktivitas antioksidan……….. ... 69
Lampiran 5. Data perhitungan konsentrasi pengujian
aktivitas antioksidan………. 70
Lampiran 6. Scanning pengkoreksi………... 72
Lampiran 7. Optimasi metode uji aktivitas antioksidan………. 73
Lampiran 8. Uji aktivitas antioksidan menggunakan radikal DPPH.. 74
Lampiran 9. Perhitungan nilai IC50 kuersetin dan fraksi air
ekstrak metanol daun dadap serep………... 84
Lampiran 10. Penimbangan bahan pengujian kandungan fenolik total... 85 Lampiran 11. Perhitungan konsentrasi pengujian fenolik total………… 85
Lampiran 12. Scanning kontrol asam galat………. 88
Lampiran 13. Optimasi penentuan kandungan fenolik total……… 88 Lampiran 14. Perhitungan kandungan fenolik total……… 93
xvii
INTISARI
Dalam pengobatan tradisional di Indonesia, daun dari tanaman dadap serep berkhasiat untuk mengobati sakit kepala, batuk serta untuk minuman bagi wanita sehabis melahirkan. Senyawa fenolik merupakan salah satu kandungan bioaktif dari daun dadap serep. Penelitian ini dilakukan untuk mengetahui aktivitas antioksidan fraksi etil asetat ekstrak etanol daun dadap serep secara in vitro yang didasarkan pada efek peredaman radikal bebas larutan 1,1-difenil-pikrilhidrazil (DPPH) yang dinyatakan dengan inhibition concentration 50 (IC50).
Kandungan fenolik total juga ditentukan menggunakan pereaksi Folin-Ciocalteu dengan baku standar asam galat yang dinyatakan dengan massa ekivalen asam galat. Prinsip metode ini adalah senyawa fenolik teroksidasi dalam suasana basa dan pereaksi Folin-Ciocalteu tereduksi menjadi larutan berwarna biru yang dapat diukur dengan spektrofotometer visibel pada panjang gelombang 750 nm. Hasil penelitian menunjukkan bahwa fraksi etil asetat ekstrak etanol daun dadap serep mempunyai aktivitas antioksidan dengan nilai IC50 sebesar 245,15 ± 4,26 µg/mL
dan kandungan fenolik total sebesar 8,51 ± 0,18 ekivalen asam galat per g fraksi etil asetat ekstrak etanol daun dadap serep dan metode yang digunakan belum tervalidasi.
xviii
ABSTRACT
In Indonesian traditional medicine, the leaves of dadaps (Erythrina subumbrans (Hassk.) Merr.) are efficacious to cure headaches, cough and can also be used as a drink for women after childbirth. Phenolic compound is one of the bioactive contents in dadaps leaves. This research was conducted to determine the antioxidant activities of ethyl acetate fraction of ethanol extract of dadaps leaves in vitro based on the reducing effect of free radical of 1,1-diphenyl-pikrilhidrazil (DPPH) solution expressed by inhibition concentration 50 (IC50). The total
phenolic contents was also determined by using the Folin-Ciocalteu reagent with gallic acid standard expressed by the mass of gallic acid equivalents. The principle of this method is oxidized phenolic compounds in alkaline medium and Folin-Ciocalteu reagent is reduced to a blue solution that can be measured by the visible spectrophotometer at a wavelength of 750 nm. The results showed that the ethyl acetate fraction of ethanol extract of dadaps leaves had antioxidant activities with IC50 valued in the amount of 245.15 ± 4.26 µg/mL and the total phenolic content
of 8.51 ± 0.18 gallic acid equivalent per g of ethyl acetate fraction of ethanol extract of dadaps leaves and the method has not been validated.
1
BAB I
PENGANTAR
A. Latar Belakang
Paparan sistem biologis dari xenobiotik, polusi, radiasi pengion atau cahaya UV dan perkembangan kondisi patologis tertentu menyebabkan tekanan oksidatif, akibatnya meningkatkan produksi oksigen radikal. (Sapakal et al., 2008). Pembentukan radikal bebas dan reaksi oksidasi pada biomolekul akan berlangsung sepanjang hidup. Inilah penyebab utama dari proses penuaan dan berbagai penyakit degeneratif (Silalahi, 2006). Radikal oksigen terus dibentuk pada semua organisme hidup, dengan efek merusak yang menyebabkan cedera dan kematian sel (Sapakal et al., 2008). Jenis Reaktif Oksigen Spesies (ROS) termasuk radikal hidroksil, radikal anion superoksida, hidrogen peroksida, radikal nitrat oksida, radikal hipoklorit, dan berbagai lipid peroksida mampu bereaksi dengan membran lipid, asam nukleat, protein, enzim dan molekul kecil lainnya, yang mengakibatkan kerusakan sel (Sapakal et al., 2008).
tekanan oksidatif berlebih didalam tubuh, menyebabkan produksi radikal bebas menjadi meningkat didalam tubuh yang berakibat dibutuhkannya tambahan antioksidan yang cukup untuk menanggulangi tekanan oksidatif yang tinggi tersebut sehingga dapat mengurangi dampak kerusakan sel sebagai akibat dari reaksi radikal bebas.
Antioksidan sintetik seperti butylated hidroksitoluen (BHT), butylated hydroxyanisole (BHA), tert-butylhydroquinone (TBHQ) dan propil gallate (PG) telah digunakan selama bertahun-tahun, namun senyawa tersebut sedang diperiksa untuk kemungkinannya dalam menimbulkan toksisitas. Oleh karena itu, sekarang ini dilakukan penelitian intensif tentang antioksidan polifenol alami yang berasal dari tumbuhan untuk menggantikan antioksidan sintetis (Qader et al.,2011).
Senyawa fenolik merupakan senyawa bioaktif dari tumbuhan yang merupakan sumber antioksidan alami yang aman. Untuk melihat potensi antioksidan dari tanaman dadap serep, dalam penelitian ini dilakukan pemeriksaan aktivitas antioksidan fraksi etil asetat ekstrak etanolik daun dadap serep yang dilakukan dengan metode 1,1-difenil-2-pikrilhidrazil (DPPH) secara spektrofotometri. Metode DPPH dipilih karena sederhana, mudah, cepat dan peka serta hanya memerlukan sedikit sampel. Aktivitas diukur dengan menghitung jumlah pengurangan intensitas warna ungu DPPH yang sebanding dengan pengurangan konsentrasi larutan DPPH. Peredaman tersebut dihasilkan oleh bereaksinya molekul Difenil Pikril Hidrazil dengan atom hidrogen yang dilepaskan satu molekul komponen sampel sehingga terbentuk senyawa Difenil Pikril Hidrazin dan menyebabkan terjadinya peluruhan warna DPPH dari ungu ke kuning (Zuhra, Tarigan dan Sihotang, 2008). Penentuan kandungan fenolik total dari fraksi etil asetat ekstrak etanolik daun dadap serep dilakukan menggunakan metode Folin-Ciocalteu dimana merupakan salah satu metode yang cepat dan sederhana dalam menentukan kandungan fenolik total (Fu et al., 2011).
B. Permasalahan
1. Berapakah nilai aktivitas antioksidan fraksi etil asetat ekstrak etanolik daun dadap serep dengan menggunakan metode DPPH yang dinyatakan dengan IC50
?
C. Keaslian Penelitian
Sejauh pengamatan penulis, penelitian tentang uji aktivitas antioksidan daun dadap pernah dilakukan oleh :
Estrada, E.I., 2010, dengan judul “Actividad Antioxidante De Alcaloides De Erythrina Americana Miller”. Penelitian ini menggunakan daun dadap spesies Erythrina Americana Miller yang diperoleh di universitas nacional autonoma de Mexico (Mexico) dan uji aktivitas antioksidan dengan metode DPPH (2,2 -diphenyl-1-picrylhydrazyl).
Perbedaan antara penelitian ini dengan penelitian sebelumnya adalah bahwa dalam penelitian ini daun dadap serep spesies Erythrina subumbrans (Hassk.) Merr. yang digunakan dipanen dari dari kebun tanaman obat Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
D. Manfaat Penelitian
1. Manfaat teoritis
Penelitian ini diharapkan dapat memberikan pengetahuan tentang aktivitas antioksidan fraksi etil asetat ekstrak etanolik daun dadap serep dengan menggunakan metode DPPH yang dinyatakan dengan IC50.
2. Manfaat praktis
E. Tujuan Penelitian
1. Mengetahui aktivitas antioksidan menggunakan metode DPPH fraksi etil asetat ekstrak etanolik daun dadap serep.
2. Mengetahui nilai aktivitas antioksidan fraksi etil asetat ekstrak etanolik daun dadap serep dengan menggunakan metode DPPH yang dinyatakan dengan IC50
6
BAB II
PENELAAHAN PUSTAKA
A. Dadap Serep
1. Keterangan botani
Dadap serep termasuk tanaman legum pohon, berasal dari Asia Tenggara dan tersebar di seluruh kepulauan nusantara. Varietas tanaman ini dibedakan berdasarkan ada tidaknya duri pada kulitnya (Purwanto, 2007).
2. Nama tumbuhan
Nama latin : Erythrina subumbrans Hassk. (Anonim, 2007). Nama sinonim : Erythrina hypaphorus Boerl., Erythrina lithosperma
Miquel (Anonim, 2007).
Nama daerah : dadap minyak, dadap limit (sunda); dadap lengan, dadap lisah (jawa); dadap lenga, thetheuk oleng (Madura) (Purwanto, 2007).
3. Klasifikasi dadap serep menurut USDA (2011)
Kingdom : Plantae
Subkingdom : Tracheobionta Superdivisi : Spermatophyta Divisi : Magnoliophyta Kelas : Magnoliopsida Sub Kelas : Rosidae
Ordo : Fabales
Famili : Fabaceae Genus : Erythrina
4. Gambaran umum
Dadap serep merupakan tanaman legum pohon, tumbuh tinggi agak bengkok, ketinggian mencapai 15-22 m dengan diameter batang 40-100 cm, sistem perakaran dalam. Kulit batang berwarna hijau, batang yang tua bercampur garis-garis kecoklatan, cabang tumbuh lurus ke atas membentuk sudut 45o. Daunnya beranak tiga helai, berbentuk delta atau gemuk bundar ujung agak meruncing, bagian bawah daun membundar, bila diremas terasa lunak ditangan. Ukuran panjang tangkai daun 10-20,5 cm; panjang daun 9-19 cm; dan lebar daun 6-17 cm. Daun atas berukuran lebih besar daripada kedua daun penumpu. Bunganya tumbuh diantara ketiak daun, daun mahkota bunyanya berwarna merah kekuningan, berbentuk terompet. Polongnya berukuran kecil, berbentuk sabit, berisi 4-8 biji per polong (Purwanto, 2007).
Dalam penggunaannya, bagian kulit kayu dan daun dadap serep secara empiris digunakan untuk pengobatan tradisional sebagai campuran dengan tanaman obat lainnya. Di Indonesia ditemukan daun mudanya digunakan untuk minuman bagi wanita sehabis melahirkan dan untuk mengobati sakit kepala. Rebusan daunnya digunakan untuk mengobati batuk (Anonim, 2007).
5. Kandungan kimia dadap serep
baru, senyawa bioktif tersebut juga menunjukan potensi sebagai senyawa
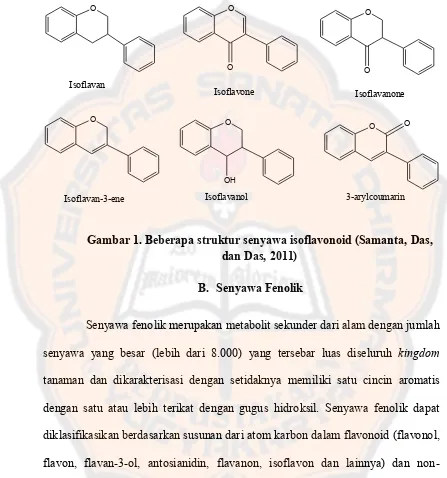
Gambar 1. Beberapa struktur senyawa isoflavonoid (Samanta, Das, dan Das, 2011)
B. Senyawa Fenolik
Flavonoid merupakan salah satu kelompok metabolit sekunder terbesar sebagai senyawa fenolik. Flavonoid melindungi tanaman terhadap berbagai ancaman biotik dan abiotik yang menunjukkan spektrum dengan beragam fungsi biologis dan memainkan peran penting dalam interaksi antara tanaman dan lingkungannya (Samanta et al., 2011). Senyawa fenolik mayoritas yang ada di alam berada sebagai glikosida. Adanya gula dan gugus hidroksil membuat senyawa fenolik larut dalam air sedangkan adanya gugus metil dan unit isopentil membuat flavonoid menjadi lipofilik (Samanta et al., 2011).
Sebagian besar koleksi metabolit dari produk alam disebut dengan istilah flavonoid yang mencakup senyawa dengan karbon berstruktur C6-C3-C6. Tergantung pada posisi keterkaitan dari cincin aromatik ke bagian benzopiren, kelompok produk alam ini dibagi menjadi tiga kelas: Flavonoid (2 - fenilbenzopiren), isoflavonoid (3-benzopiren) dan Neoflavonoid (Samata et al., 2011).
Gambar 2. Klasifikasi flavonoid produk alam (Samata et al., 2011)
C. Radikal Bebas
golongan radikal bebas. Jenis ROS termasuk radikal hidroksil, radikal anion superoksida, hidrogen peroksida, singlet oksigen, radikal nitrat oksida, radikal hipoklorit, dan berbagai lipid peroksida. Semua mampu bereaksi dengan membran lipid, asam nukleat, protein, enzim dan molekul kecil lainnya, yang mengakibatkan kerusakan sel (Sapakal et al, 2008).
D. Antioksidan
Antioksidan merupakan suatu senyawa yang mampu menunda, memperlambat atau menghambat reaksi oksidasi didalam tubuh. Antioksidan mampu menstabilkan, atau menonaktifkan radikal bebas sebelum menyerang sel dalam tubuh. Antioksidan merupakan senyawa yang penting untuk menjaga kesehatan seluler dan kesehatan sistemik tubuh (Sapakal et al., 2008).
jeruk, biji sesame, daun teh hijau, biji kakao, anggur, tomat, jeruk, apel, biji-bijian, zaitun, wortel (Sapakal et al.,2008).
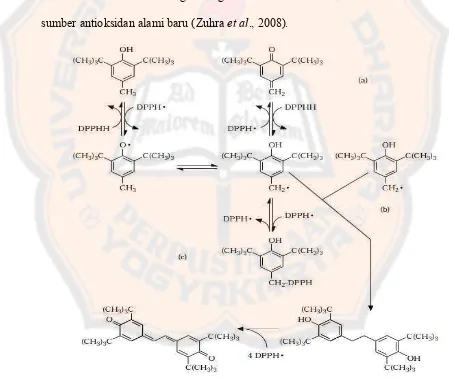
Sumber-sumber antioksidan dapat berupa antioksidan sintetik maupun antioksidan alami. Tetapi saat ini penggunaan antioksidan sintetik mulai dibatasi karena ternyata dari hasil penelitian yang telah dilakukan bahwa antioksidan sintetik seperti BHT (Butylated Hydroxy Toluena) ternyata dapat meracuni binatang percobaan dan bersifat karsinogenik. Oleh karena itu industri makanan dan obat-obatan beralih mengembangkan antioksidan alami dan mencari sumber-sumber antioksidan alami baru (Zuhra et al., 2008).
Gambar 3. Usulan mekanisme reaksi antara BHT dan DPPH ((a) donasi kedua atom hidrogen, (b) dimerisasi, (c) kompleksasi) (Bondet,
Tabel I. Berbagai Reactive Oxygen Species (ROS) dan antioksidan sebagai penetral (Sapakal et al., 2008)
Reactive Oxygen Species
(ROS) Senyawa antioksidan
Radikal hidroksil vitamin C, glutation, flavonoid, asam lipoid
Radikal superoksida vitamin C, glutation, flavonoid, SOD
Hidrogen peroksida
vitamin C, glutation, betakaroten, vitamin E, CoQ10, flavonoid, asam
lipoid
Lipid peroksida beta karoten, vitamin E, ubiquinon, flavonoid, glutation peroksidase
E. Penyarian
Penyarian adalah kegiatan penarikan zat atau metabolit aktif yang semula berada didalam sel yang kemudian ditarik oleh cairan penyari sehingga zat aktif tersebut larut dalam cairan penyari (Harborne, 1987). Secara umum, penyarian dapat dibedakan menjadi infudasi, maserasi, perkolasi dan penyarian berkesinambungan. Sebagai cairan penyari digunakan air, eter, atau campuran etanol air (Direktorat Jenderal Pengawasan Obat dan Makanan RI, 1986).
diendap tuangkan dan diperas, ampas dimaserasi lagi dengan cairan penyari yang kedua (Depkes, 1986). Alkohol didalam banyak penelitian merupakan pelarut yang cocok untuk berbagai tujuan ekstraksi sebagai pelarut awal yang digunakan dalam tahapan ekstraksi (Harborne, 1998).
Ekstraksi cair-cair digunakan sebagai cara untuk praperlakukan sampel untuk memisahkan analit-analit dari komponen-komponen matriks yang mungkin menganggu pada saat kuantifikasi atau deteksi analit. Ekstraksi cair-cair ditentukan oleh distribusi Nerst atau hukum partisi yang menyatakan “pada konsentrasi dan tekanan yang konstan, analit akan terdistribusi dalam proporsi yang selalu sama diantara dua pelarut yang saling tidak campur”. Perbandingan konsentrasi pada keadaan setimbang di dalam 2 fase disebut dengan koefisien distribusi atau koefisien partisi (Kd) dan digambarkan dengan rumus :
Kd = � �
Dimana [S]org dan [S]aq masing-masing merupakan konsentrasi analit
dalam fase organik dan dalam fase air; Kd merupakan koefisien partisi. Efiseiensi
proses ekstraksi tergantung pada nilai distribusinya dan juga tergantung pada volume relative kedua fase. Adanya ekstaksi berulang (bertingkat) akan meningkatkan efisiensi ekstraksi (Gandjar dan Rohman, 2007).
F. Metode DPPH dan Folin-Ciocalteu
ini dapat dicapai dengan cara mengintepretasikan data eksperimental dari metode tersebut (Molyneux, 2004).
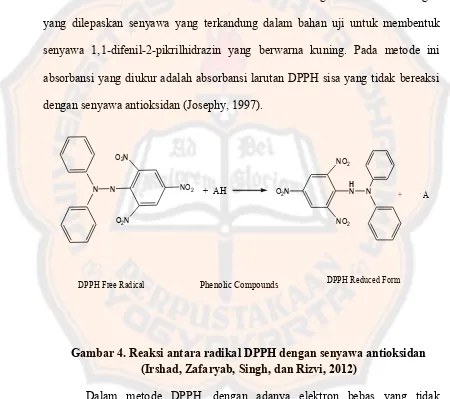
Uji kuantitatif daya antioksidan dilakukan dengan metode DPPH (1,1-difenil-2-pikrilhidrazil) secara spektrofotometri sinar tampak. Metode ini didasarkan pada perubahan warna radikal DPPH. Perubahan warna tersebut disebabkan oleh reaksi antara radikal bebas DPPH dengan satu atom hidrogen yang dilepaskan senyawa yang terkandung dalam bahan uji untuk membentuk senyawa 1,1-difenil-2-pikrilhidrazin yang berwarna kuning. Pada metode ini absorbansi yang diukur adalah absorbansi larutan DPPH sisa yang tidak bereaksi dengan senyawa antioksidan (Josephy, 1997).
NO2
DPPH Free Radical Phenolic Compounds DPPH Reduced Form
+ A
Gambar 4. Reaksi antara radikal DPPH dengan senyawa antioksidan (Irshad, Zafaryab, Singh, dan Rizvi, 2012)
absorptivitas molar radikal DPPH pada 517 nm dari 9660 ke 1640 ketika elektron bebas radikal DPPH dipasangkan dengan hidrogen dari senyawa antioksidan radikal bebas untuk membentuk senyawa DPPH-H. Dengan demikian hasil dekolorisasi yang terjadi memberikan nilai stoikiometri sehubungan dengan jumlah elektron yang ditangkap (Prakash, 2001).
Metode Folin-Ciocalteu (F-C) merupakan metode kolorimetri yang sering digunakan yang berdasarkan reaksi oksidasi yang cepat dari fenol dengan menggunakan senyawa alkali, umumnya menggunakan sodium karbonat, yang akan menghasilkan ion fenolat yang cukup besar. Senyawa fenolat yang terbentuk mereduksi warna kuning F-C menjadi berwarna biru, yang dapat diukur secara spektrofotometri ( Cicco dan Lattanzio, 2011).
G. Validasi Metode
Validasi metode dilakukan untuk menjamin bahwa metode analisis dapat memberikan hasil seperti yang diharapakan dengan akurat, spesifik, reprodusibel, dan tahan pada kisaran analit yang akan dianalisis (Gandjar dan Rohman, 2007).
Tabel II. Kisaran recovery hasil analisis yang diterima (APMVA, 2004)
% Senyawa
impuritis/aktif Rata-rata recovery yang diterima
≥ 10 98-102 %
≥ 1 90-110 %
0,1-1 80-120 %
< 1 75-125 %
Presisi merupakan ukuran keterulangan metode analisis dan biasanya diekspresikan sebagai simpangan baku relatif dari sejumlah sampel yang berbeda signifikan secara statistik (Gandjar dan Rohman, 2007).
Tabel III. Kriteria nilai presisi yang masih dapat diterima (APVMA, 2004)
Kadar zat aktif (%)
Nilai KVyang masih dapat diterima (%)
≥ 10 ≤ 2
1-10 ≤ 5
0,1-1 ≤ 10
<0,1 ≤ 20
tersebut dapat dikatakan selektif. Selektifitas suatu metode analisis dapat ditunjukan dengan menampilkan data yang menggambarkan tidak adanya interferensi dari hasil produk degradasi dan senyawa yang dapat menyebabkan interferensi lainnya dalam matriks (APVMA, 2004).
Linearitas merupakan kemampuan suatu metode untuk memperoleh hasil-hasil uji yang secara langsung proporsional dengan konsentrasi analit pada kisaran yang diberikan. Linearitas suatu metode merupakan ukuran seberapa baik kurva kalibrasi yang menghubungkan antara respon (y) dengan konsentrasi (x) (Gandjar dan Rohman, 2007).
H. Landasan Teori
Radikal bebas adalah atom atau molekul yang tidak stabil dan sangat reaktif yang merupakan salah satu faktor penyebab kerusakan sel dalam tubuh. Untuk mengurangi dampak kerusakan yang diakibatkan dari radikal bebas, dibutuhkan senyawa antioksidan yang merupakan suatu senyawa yang mampu menunda, memperlambat atau menghambat reaksi oksidasi didalam tubuh yang dapat berasal dari radikal bebas. Antioksidan mampu menstabilkan atau menonaktifkan radikal bebas sebelum menyerang sel dalam tubuh. Sumber-sumber antioksidan dapat berupa antioksidan sintetik maupun antioksidan alami yang berasal dari tanaman.
lektin. Adanya berbagai kandungan senyawa fenolik disamping saponin dan lektin dalam tanaman dadap serep tersebut memberikan kemungkinan besar bahwa tanaman ini memiliki aktivitas sebagai antioksidan.
Pengujian aktivitas antioksidan dari suatu sampel uji dapat dilakukan dengan menggunakan metode DPPH. Metode ini didasarkan pada perubahan warna radikal DPPH yang disebabkan oleh reaksi antara radikal bebas DPPH dengan senyawa antioksidan yang menyumbangkan satu atom hidrogen yang dilepaskan senyawa yang terkandung dalam bahan uji untuk membentuk senyawa 1,1-difenil-2-pikrilhidrazin yang berwarna kuning, sisa DPPH yang tidak bereaksi diukur secara spektrofotometri sinar tampak.
Kandungan senyawa fenolik dari suatu sampel dapat diukur dengan metode Folin-Ciocalteu (F-C). Metode ini berdasarkan reaksi oksidasi yang cepat dari fenol dengan menggunakan senyawa alkali, umumnya menggunakan sodium karbonat, yang akan menghasilkan ion fenolat yang cukup besar. Senyawa fenolat yang terbentuk mereduksi warna kuning F-C menjadi berwarna biru, yang dapat diukur secara spektrofotometri.
I.Hipotesis
Fraksi etil asetat ekstrak etanolik daun dadap serep mempunyai aktivitas antioksidan yang dapat diukur dengan metode DPPH yang dinyatakan dengan IC50. Kandungan fenolik total fraksi etil asetat ekstrak etanolik daun dadap serep
20
BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian eksperimental karena subjek uji diberi perlakuan.
B. Variabel
1. Variabel bebas berupa konsentrasi fraksi etil asetat ekstrak etanolik daun dadap serep.
2. Variabel tergantung berupa aktivitas antioksidan dan kandungan fenolik total fraksi etil asetat ekstrak etanolik daun dadap serep.
3. Variabel pengacau terkendali berupa tempat tumbuh tanaman, waktu pemanenan dan cara panen.
4. Variabel pengacau tidak terkendali berupa cahaya matahari, cuaca, kelembaban, curah hujan.
C. Definisi Operasional
1. Daun dadap serep adalah daun (folium) segar dari tanaman dadap serep yang dipanen dari Kebun Tanaman Obat Fakultas Farmasi Universitas Sanata Dharma (Yogyakarta) dengan bentuk daun belah ketupat, dengan lebar ± 10-17 cm, berwarna hijau.
2. Ekstrak etanolik daun dadap serep adalah sari hasil proses maserasi daun dadap serep dengan penyari etanol.
4. Persen inhibition concentration (%IC) adalah persen yang menyatakan kemampuan fraksi etil asetat ekstrak etanolik daun dadap serep untuk menangkap radikal DPPH.
5. Nilai inhibition concentration 50 (IC50) adalah nilai konsentrasi fraksi etil asetat ekstrak etanolik daun dadap serep yang menghasilkan penangkapan 50% radikal DPPH.
D. Bahan dan Alat Penelitian
1. Bahan penelitian
Bahan yang digunakan dalam penelitian ini adalah: daun dadap serep yang diambil dari kebun tanaman obat Fakultas Farmasi Universitas Sanata Dharma Yogyakarta, akuades (Laboratorium Kimia Analisis Instrumental Fakultas Farmasi Universitas Sanata Dharma); bahan kualitas p.a. E. Merck, yaitu: metanol, bahan kualitas p.a. Sigma Chem. Co., USA, yaitu: DPPH, reagen Folin-Ciocalteu, asam galat, dan kuersetin kualitas Sigma Chem. Co., USA; bahan kualitas teknis Brataco Chemica, yaitu: wasbensin dan etil asetat; bahan kualitas teknis CV. General Labora, yaitu: metanol; dan aluminium foil.
2. Alat penelitian
E. Tatacara Penelitian
1. Determinasi tumbuhan
Determinasi tanaman dadap serep dilakukan di Laboratorium Farmakognosi-Fitokimian, Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Pengumpulan bahan
Tanaman dadap serep diperoleh dari kebun tanaman obat Fakultas Farmasi Universitas Sanata Dharma di Yogyakarta. Pengumpulan pada musim kemarau bulan Agustus tahun 2012. Pemanenan dilakukan pada tanaman saat pagi hari.
3. Preparasi sampel
Ekstrak etanol daun dadap serep ditambah 300 mL air hangat dan diekstraksi cair-cair menggunakan wasbensin dengan perbandingan larutan ekstrak : wasbensin (1:1 v/v), kemudian didiamkan sampai terpisah sempurna. Fase air akan berada pada bagian bawah, sedangkan fase wasbensin berada pada bagian atas.
Dari hasil partisi diperoleh dua fraksi, yaitu fraksi wasbensin dan fraksi air. Selanjutnya fraksi air diekstraksi cair-cair lagi menggunakan etil asetat dengan perbandingan larutan fraksi air : etil asetat (1:1 v/v) sehingga didapatkan fraksi air dan etil asetat. Setelah dipisahkan fraksi etil asetat diuapkan pelarutnya dengan vacuum rotary evaporator. Hasil fraksi tersebut kemudian ditutup dengan plastik serta aluminium foil lalu disimpan dalam desikator. Lalu hasil fraksi tersebut digunakan untuk dianalisis lebih lanjut.
4. Pembuatan larutan pembanding dan uji
a. Pembuatan larutan DPPH
Sejumlah DPPH dilarutkan ke dalam metanol p.a sehingga diperoleh larutan DPPH dengan konsentrasi 0,4 mM. Larutan tersebut ditutup dengan alumunium foil dan harus selalu dibuat baru.
b. Pembuatan larutan stok kuersetin
Sebanyak 2,5 mg kuersetin dilarutkan dengan metanol p.a sampai 10,0 mL.
c. Pembuatan larutan pembanding
d. Pembuatan larutan uji
1. Larutan uji untuk aktivitas antioksidan
Sebanyak 12,5 mg hasil fraksi etil asetat ditimbang, lalu di add metanol p.a sampai 25,0 mL. Diambil sebanyak 1,5; 3; 4,5; 6; 7,5 mL larutan tersebut, kemudian ditambahkan metanol p.a sampai 10,0 mL, sehingga diperoleh konsentrasi larutan uji sebesar 75; 150; 225; 300; 375 g/mL.
2. Larutan uji untuk penentuan kandungan fenolik total
Sebanyak 5,0 mg hasil fraksi etil asetat ditimbang, lalu ditambahkan metanol p.a sampai diperoleh konsentrasi larutan uji sebesar 500,0 µg/mL.
e. Pembuatan larutan asam galat
Dibuat larutan asam galat dengan konsetrasi 500 µg/mL dalam akuades : methanol p.a (1:1). Diambil sebanyak 1,0; 1,5; 2,0; 2,5; dan 3,0 mL larutan tersebut, kemudian ditambahkan akuades : metanol p.a (1:1) sampai 10,0 mL, sehingga diperoleh konsentrasi larutan baku asam galat sebesar 50; 75; 100; 125; dan 150 µg/mL.
5. Uji pendahuluan
a. Uji fenolik
b. Uji pendahuluan aktivitas antioksidan
Sebanyak 1 mL larutan DPPH dimasukan ke dalam masing-masing tiga tabung reaksi. Ditambahkan masing-masing dengan 1 mL metanol p.a, larutan pembanding kuersetin 37,5 g/mL , dan larutan uji 200,0 g/mL. Selanjutnya, larutan tersebut ditambahkan dengan 3 mL metanol p.a. Larutan tersebut kemudian divortex selama 30 detik. Setelah 30 menit, amati warna pada larutan tersebut.
6. Optimasi metode uji aktivitas antioksidan
a. Penentuan panjang gelombang serapan maksimum
Pada 3 labu ukur 10 mL, dimasukan masing-masing 0,5; 1,0; 1,5 mL larutan DPPH. Ditambahkan larutan tersebut dengan metanol p.a hingga tanda batas sehingga konsentrasi DPPH menjadi 0,020; 0,040; dan 0,080. Larutan tersebut kemudian divortex selama 30 detik. Diamkan selama OT. Lalu dilakukan scanning panjang gelombang serapan maksimum dengan spektrofotometer visibel pada panjang gelombang 400-600 nm.
b. Penentuan operating time (OT)
7. Uji aktivitas antioksidan
Uji aktivitas antioksidan ditentukan dengan menggunakan metode spoktrofotometri sesuai dengan penelitian Rollando (2012).
a. Pengukuran absorbansi larutan DPPH (kontrol)
Pada labu ukur 10 mL, dimasukan sebanyak 2 mL larutan DPPH. Ditambahan larutan tersebut dengan metanol p.a hingga tanda batas. Kemudian larutan tersebut dibaca absorbansinya pada saat OT dan panjang gelombang maksimum. Pengerjaan dilakukan sebanyak 3 kali. Larutan ini digunakan sebagai kontrol untuk menguji larutan pembanding dan uji.
b. Pengukuran absorbansi larutan pembanding dan uji
Sebanyak 1 mL larutan DPPH dimasukkan ke dalam tabung reaksi bertutup kemudian ditambah dengan 1 mL larutan pembanding dan uji pada berbagai seri konsentrasi telah dibuat. Selanjutnya larutan tersebut ditambah dengan metanol p.a hingga tanda batas. Larutan tersebut kemudian divortex selama 30 detik dan diamkan selama OT. Larutan dibaca absorbansinya dengan spektrofotometer visibel pada panjang gelombang maksimum hasil optimasi. Pengujian dilakukan dengan 3 kali replikasi.
c. Validasi metode uji aktivitas antioksidan
Hasil dari prosedur 7 a dan b, divalidasi presisi (%CV), spesifisitas (spektra kontrol), dan linearitas (nilai r).
% CV = � � � � �� �
d. Estimasi aktivitas antioksidan
Hasil dari prosedur 7 a dan b, dihitung nilai % IC dan IC50 untuk
kuersetin dan fraksi etil asetat ekstrak etanolik daun dadap serep.
8. Optimasi metode penetapan kandungan fenolik total
Optimasi metode penetapan kandungan fenolik total ditentukan dengan menggunakan metode spektrofotometri.
a. Penentuan OT
Sebanyak 0,5 mL larutan asam galat 50; 100; dan 150 g/mL
ditambahkan dengan 5 mL reagen Folin-Ciocalteu yang telah diencerkan dengan air (1:10 v/v). Larutan selanjutnya ditambahkan dengan 4,0 mL natrium karbonat 1 M. Setelah itu, dibaca absorbansinya dengan spektrofotometer visibel pada panjang gelombang 750 nm selama 30 menit.
b. Penentuan panjang gelombang maksimum
Sebanyak 0,5 mL larutan asam galat 50; 100; dan 150 g/mL ditambahkan dengan 5 mL reagen Folin-Ciocalteu yang telah diencerkan dengan air (1:1 v/v). Larutan selanjutnya ditambahkan dengan 4,0 mL natrium karbonat 1 M. Diamkan selama OT, absorbansinya dibaca pada maksimum dengan spektrofotometer visibel pada panjang gelombang 600-800 nm.
9. Penetapan kandungan fenolik total
a. Pembuatan kurva baku asam galat
Sebanyak 0,5 mL larutan asam galat 50; 75; 100; 125; dan 150 g/mL
Setelah OT, absorbansinya dibaca pada maksimum terhadap blanko yang terdiri atas akuades : metanol p.a (1:1), reagen Folin-Ciocalteu dan larutan natrium karbonat 1 M. Pengerjaan dilakukan 3 kali.
b. Validasi metode penetapan kandungan fenolik total
Hasil dari prosedur 9 a , divalidasi presisi (%CV), spesifisitas (spektra kontrol), dan linearitas (nilai r).
% CV = � � � � �� �
− � x 100%
c. Estimasi kandungan fenolik total larutan uji
Diambil 0,5 mL larutan uji 500 g/mL, lalu masing-masing dimasukan ke dalam labu takar 10,0 mL dan dilanjutkan sebagaimana perlakuan pada pembuatan kurva baku asam galat . Kandungan fenolik total dinyatakan sebagai gram ekivalen asam galat (mg ekivalen asam galat per g fraksi etil asetat). Lakukan 3 kali replikasi.
F. Analisis Hasil
Aktivitas penangkapan radikal DPPH (%) dihitung dengan rumus :
Absorbansi (larutan kontrol) – Absorbansi sampel (larutan pembanding/uji) X 100%
Absorbansi larutan control
Data aktivitas tersebut dianalisis dan dihitung nilai IC50 mengunakan
untuk menentukan ada atau tidak adanya perbedaan bermakna antara IC50 larutan
pembanding dan larutan uji.
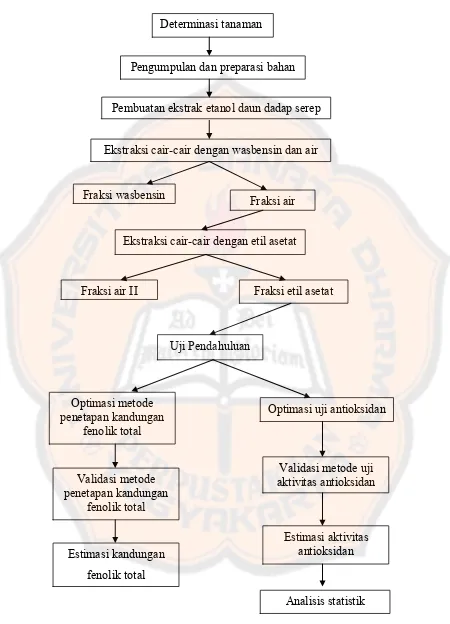
Gambar 5. Skema jalannya penelitian
Determinasi tanaman
Pengumpulan dan preparasi bahan
Pembuatan ekstrak etanol daun dadap serep
Ekstraksi cair-cair dengan wasbensin dan air
Fraksi wasbensin
Fraksi air
Ekstraksi cair-cair dengan etil asetat
31
BAB IV
HASIL DAN PEMBAHASAN
A. Determinasi
Dalam penelitian ini langkah pertama yang dilakukan adalah determinasi tanaman yang akan digunakan sebagai sampel uji. Tujuan dilakukannya determinasi adalah untuk mengetahui kebenaran identitas tanaman yang digunakan serta untuk menghindari kesalahan dalam penggunaan tanaman saat dilakukan penelitian. Determinasi tanaman dadap serep dilakukan di Laboratorium Farmakognosi-Fitokimia, Fakultas Farmasi Universitas Sanata Dharma dengan acuan buku Flora of Java (Backer and Bakhuizen van den Brink, 1965). Dari hasil determinasi (lampiran 1) yang dilakukan terbukti bahwa tanaman yang digunakan dalam penelitian ini adalah dadap serep (Erythrina subumbrans (Hassk.) Merr.).
B. Hasil Pengumpulan Bahan
(1987), senyawa fenol pada tanaman sangat peka terhadap adanya proses oksidasi enzim yang mungkin dapat berakibat hilangnya senyawa fenol. Berkurangnya senyawa fenolik pada daun maka dapat mengakibatkan pada berkurangnya aktivitas antioksidan. Seleksi ini dilakukan untuk menjaga kualitas daun yang akan digunakan sehingga kemungkinan terjadinya pengurangan mutu sampel daun akibat sudah terjadinya perubahan kandungan kimia daun dari proses perubahan metabolisme tumbuhan dapat dihindari. Daun kemudian dicuci, dibersihkan dengan air bersih yang mengalir untuk menghilangkan sisa-sisa partikel debu, pengotor lain serta kontaminan yang masih tertinggal di daun.
menginduksi tanaman untuk memproduksi senyawa fitoaleksin yang merupakan senyawa hasil metabolisme tanaman sebagai pertahanan atas serangan mikroba. Menurut Harborne (1987), senyawa fitoaleksin pada tanaman dapat berupa seskuiterpenoid, isoflavonoid, asetilena, atau senyawa fenol. Apabila senyawa fitoaleksin diproduksi berlebih pada tanaman sebagai tanggapan atas serangan mikroba, maka jumlah senyawa fenol yang dibutuhkan sebagai sumber fitoaleksin akan bertambah. Hal ini dapat menimbulkan kandungan senyawa fenol yang merupakan metabolit sekunder tanaman yang dapat berfungsi sebagai senyawa antioksidan akan berkurang akibat digunakannya senyawa fenol sebagai sumber fitoaleksin.
C. Hasil Preparasi Sampel
1. Ekstraksi sampel
Serbuk simplisia yang digunakan kemudian diekstraksi dengan cairan penyari etanol 76%. Menurut Harborne (1998), etanol didalam banyak penelitian merupakan pelarut yang cocok untuk berbagai tujuan ekstraksi sebagai pelarut awal yang digunakan dalam tahapan ekstraksi. Metode penyarian yang digunakan adalah dengan maserasi. Pemilihan metode ini karena dengan metode ini sampel yang digunakan tidak mengalami perlakuan pemanasan sehingga senyawa yang tidak cocok dengan pemanasan terjaga stabilitasnya. Maserasi dilakukan selama dua hari dan dilanjutkan remaserasi selama dua hari. Selama proses maserasi dilakukan, digunakan juga shaker sebagai alat untuk membantu penggojogan. Penggojogan dilakukan untuk meningkatkan kontak antara cairan penyari yang digunakan dengan sampel, sehingga proses ekstraksi metabolit yang terkandung dalam sampel dapat berjalan lebih efektif dan mendapatkan hasil penyarian yang maksimal. Remaserasi dalam penelitian ini dilakukan untuk memaksimalkan hasil perolehan penyarian dari senyawa yang belum tersari akibat sudah jenuhnya cairan penyari yang digunakan.
vakum, sehingga dapat memperkecil kemungkinan rusaknya senyawa yang terkandung didalamnya. Perolehan bobot ekstrak daun dadap serep adalah sebesar 14,235 g.
2. Fraksinasi ekstrak
Struktur senyawa aktif dalam tanaman sangat bervariasi. Perbedaaan ini dipengaruhi golongan dan substituen dari senyawa tersebut. Hal ini dapat menyebabkan perbedaan polaritas dari tiap-tiap senyawa tersebut sehingga untuk mengekstraksi senyawa aktifnya diperlukan pelarut dengan polaritas yang bertingkat. Menurut Snyder (1997), proses fraksinasi akan memisahkan komponen aktif dari ekstrak daun kedalam fraksi polar, semi polar dan fraksi non polar. Etanol merupakan salah satu pelarut universal yang dapat menyari banyak senyawa kimia seperti klorofil, minyak, vitamin dan mineral. Oleh sebab itu dalam penelitian ini dilakukan fraksinasi yang bertujuan untuk memisahkan senyawa didalam ekstrak sehingga yang didapat adalah senyawa-senyawa yang dituju yaitu senyawa-senyawa fenolik. Dalam melakukan fraksinasi dalam penelitian ini menggunakan prinsip ektraksi cair-cair dimana merupakan teknik ekstraksi yang menggunakan dua pelarut yang tidak tercampurkan yang menimbulkan perpindahan senyawa terlarut dari satu pelarut ke pelarut kedua.
menggunakan corong pisah. Dalam corong pisah, fraksi air akan berada dibagian bawah sedangkan fraksi wasbensin ada di bagian atas. Hal ini dikarenakan adanya perbedaan bobot jenis antara wasbensin dan air. Fraksi air yang mengandung senyawa polar seperti fenolik disimpan, sedangkan fraksi wasbensin yang mengandung klorofil, minyak, lemak dan vitamin tidak digunakan dalam penelitian ini.
Tahap selanjutnya melakukan fraksinasi kembali dari fraksi air yang diperoleh menggunakan pelarut etil asetat. Menurut Robinson (1995), pengekstraksian kembali fraksi air dengan pelarut organik yang tidak bercampur dengan air tetapi agak polar sering kali bermanfaat untuk memisahkan golongan fenolik seperti senyawa-senyawa flavonoid dari senyawa yang lebih polar seperti karbohidrat. Etil asetat merupakan pelarut yang baik untuk ini. Fraksi air akan berada dibagian bawah dan fraksi etil asetat yang berbobot jenis lebih kecil dari bobot jenis air akan berada diatas. Fraksi etil asetat akan mengkestraksi senyawa fenolik aglikon sedangkan senyawa seperti antosianin, glikosida flavonoid akan berada dalam fraksi air.
aglikonnya bersifat cenderung non polar, sehingga tidak menutup kemungkinan adanya senyawa tersebut larut dalam air maupun etil asetat.
Setelah didapat fraksi etil asetat, fraksi kemudian diuapkan menggunakan vaccum rotary evaporator untuk meminimalkan pemaparan pemanasan supaya stabilitas senyawa fenolik tetap terjaga. Sisa fraksi etil asetat kemudian dimasukkan kedalam oven dengan suhu 40 oC untuk menguapakan sisa pelarut sehingga didapatkan ekstrak kental. Fraksi kental etil asetat dalam cawan petri kemudian dibungkus dengan plastik dan ditutup dengan alumunium foil supaya tidak terkena udara dan tidak terpapar sinar UV yang dapat mendegradasi senyawa fenolik yang ada didalam fraksi etil asetat. Fraksi etil asetat yang sudah dibungkus dimasukan didalam desikator agar tidak terpapar lembab dan ditumbuhi jamur atau mikroba. Bobot fraksi etil asetat yang didapat sebesar 0,424 g dan rendemen fraksi etil asetat yang didapat adalah 0,424 %.
D. Hasil Uji Pendahuluan
1. Uji pendahuluan aktivitas antioksidan
Uji ini dilakukan menggunakan tabung reaksi dengan menambahkan sejumlah larutan kuersetin dan fraksi etil asetat ekstrak etanolik daun dadap serep ke larutan DPPH. Keberadaan senyawa antioksidan dapat menyebabkan terjadinya peluruhan warna larutan dari ungu ke kuning.
Gambar 6. Blanko DPPH (B), Fraksi etil asetat (A), Kuersetin (C)
1. Uji pendahuluan senyawa fenolik
Uji ini bertujuan untuk mengetahui adanya kandungan senyawa fenolik dalam fraksi etil asetat ekstrak etanolik daun dadap serep. Pengujian dilakukan dengan metode Folin-Ciocalteau yang didasarkan pada reaksi oksidasi-reduksi dalam suasana basa. Pengujian dilakukan dengan mencampurkan fraksi etil asetat ekstrak etanolik daun dadap serep dengan pereaksi Folin-Ciocalteau. Menurut Cicco dan Lattanzio (2011), reaksi yang terjadi yaitu adanya oksidasi senyawa fenol dalam suasana basa, yang pada umumnya menggunakan sodium karbonat, yang mana biasanya akan menghasilkan ion fenolik yang cukup banyak. Ion fenolat yang terbentuk akan mereduksi warna kuning dari reagen Folin-ciocalteau. Reaksi positif dari metode ini membentuk kompleks warna biru. Semakin tinggi kadar fenol pada sampel, semakin banyak produk molekul berwarna biru, akibatnya intensitas warna biru semakin tinggi.
Uji ini menggunakan kontrol negatif, yaitu pereaksi Folin-Ciocalteu untuk menunjukan warna larutan jika hasilnya negatif (Gambar 6). Kontrol positif dalam uji ini menggunakan pereaksi Folin-Ciocalteu yang ditambah asam galat untuk menunjukan warna larutan jika hasilnya positif (Gambar 6). Dari hasil penelitian yang dilakukan, fraksi etil asetat yang diberi reagen Folin-Ciocalteu menunjukan warna biru. Dapat disimpulkan fraksi etil asetat ekstrak etanolik daun dadap serep mengandung senyawa fenolik.
E. Hasil Optimasi Metode Uji Aktivitas Antioksidan
1. Penentuan panjang gelombang serapan maksimum ( maks)
Tujuan penentuan panjang gelombang maksimum adalah untuk menentukan panjang gelombang dimana larutan DPPH yang digunakan memberikan absorbansi yang paling optimum. Menurut Gandjar dan Rohman (2007), pada panjang gelombang maksimum, perubahan yang sedikit dari konsentrasi akan memberikan perubahan yang paling besar pada absorbansi yang dihasilkan. Dengan demikian diperoleh sensitivitas yang maksimum.
Panjang gelombang maksimum dilakukan dengan scanning tiga konsentrasi larutan DPPH. Scanning panjang gelombang dilakukan pada panjang gelombang 400-600 nm.
Tabel IV. Hasil Scanning panjang gelombang maksimum DPPH
Menurut Molyneux (2004), panjang gelombang teoritis untuk pengukuran DPPH berkisar antara 515 nm-520 nm. Hasil scanning tiga konsentrasi larutan DPPH didapatkan hasil panjang gelomabang maksimum rata-rata adalah 515,5 nm (Tabel IV). Panjang gelombang ini masih masuk dalam kisaran panjang gelombang teoritis DPPH, yaitu 515-520 nm.
2. Penentuan Operating Time (OT)
Gambar 8. Grafik penentuan OT kuersetin (Replikasi 2)
Gambar 9. Grafik Penetuan OT Fraksi Etil Asetat (Replikasi 1)
Dari hasil pengukuran OT yang terlihat pada gambar 7 dan gambar 8 menunjukan bahwa absorbansi stabil pada menit ke-30 hingga menit ke-60. Dengan demikian, secara teoritis dapat disimpulkan bahwa pada menit ke-30
seluruh senyawa yang memiliki aktivitas antioksidan pada larutan pembanding dan larutan uji sudah bereaksi dengan radikal DPPH, sehingga OT yang akan digunakan untuk reaksi radikal DPPH dengan larutan pembanding dan larutan uji adalah 30 menit.
F. Hasil Validasi Metode Uji Aktivitas Antioksidan
Validasi metode merupakan serangkaian prosedur yang digunakan untuk menjamin bahwa metode analisis dapat memberikan hasil seperti yang diharapakan dengan akurat, spesifik, reprodusibel, dan tahan pada kisaran analit yang akan dianalisis. Hasil dari suatu analisis dengan metode yang valid akan memberikan hasil yang dapat dipertanggung jawabkan. Parameter metode analisis yang dinilai dalam pengujian ini yaitu presisi, linearitas dan spesifisitas.
Tabel V. Hasil pengukuran absorbansi seri baku kuersetin yang direaksikan dengan radikal DPPH
Replikasi 1 Replikasi 2 Replikasi 3
Konsentrasi
Persamaan regresi linear y = -0,037x + 0,849
r = -0,9998
Persamaan regresi linear y = -0,028x + 0,82
Dari tiga replikasi yang dilakukan memberikan persamaan regresi linear yang berbeda tiap replikasinya. Berdasarkan nilai persamaan regresi linear seri baku kuersetin yang dihasilkan, dipilih persamaan dari hasil replikasi dua yaitu y = -0,037x + 0,849 yang akan digunakan untuk menghitung nilai presisi (Coefficient of variation) dari kuersetin. Persamaan tersebut dipilih karena nilai r dari replikasi dua menghasilkan nilai yang paling mendekati 1 atau 1, yaitu r = -0,9998.
Tabel VI. Hasil pengukuran absorbansi seri fraksi etil asetat ekstrak etanolik daun dadap serep yang direaksikan dengan DPPH
Replikasi 1 Replikasi 2 Replikasi 3
Konsentrasi
1. Presisi metode uji aktivitas antioksidan
Presisi merupakan keterulangan dan ketertiruan dari perolehan hasil analisis beberapa kali terhadap sampel yang dianalisis dengan metode yang digunakan. Presisi dari metode analisis dinyatakan dalam Coeffisien of Variant (CV). Menurut Kingstone (2004), CV yang baik adalah CV ≤ 20% untuk konsentrasi analit <0,1%b/v.
Tabel VII. Hasil presisi aktivitas antioksidan standar kuersetin
Konsentrasi
Berdasarkan hasil yang diperoleh yang ditunjukan pada tabel VII, didapat nilai % CV 0,0781 %, 0,757 %, 4,137 % untuk tiga konsentrasi standar kuersetin yang digunakan. Nilai ini masih masuk dalam persyaratan % CV menurut Kingstone (2004), dimana CV yang baik adalah CV ≤ 20% dengan konsentrasi analit <0,1%b/v.
Tabel VIII. Hasil presisi aktivitas antioksidan fraksi etil asetat
Konsentrasi
yaitu 1,162 %, 1,584 %, 2,857 %. Nilai ini juga masih masuk dalam persyaratan % CV menurut Kingstone (2004), dimana CV yang baik adalah CV≤ 20% dengan konsentrasi analit <0,1%b/v, sehingga dari hasil yang diperoleh dapat disimpulkan metode analisis yang digunakan memiliki presisi yang baik.
2. Lineritas metode uji antioksidan
Linearitas merupakan suatu gambaran mengenai kemampuan suatu prosedur analisis untuk menghasilkan hubungan yang proporsional antara konsentrasi analit dalam sampel dengan hasil yang diberikan, baik secara langsung atau dengan transformasi dari perhitungan matematik yang baik. Linearitas dinyatakan sebagai koefisien korelasi (r). Dalam penentuan kurva kalibrasi yang baik, konsentrasi minimal terdiri dari lima konsentrasi dengan jarak
antara 50-150%. Sedangkan menurut Chan et al., (2004), untuk koefisien korelasi
adalah 0,995 ataupun diharapkan lebih dari nilai tersebut.
Berdasarkan hasil tiga repikasi yang ditunjukan pada tabel V untuk validasi metode analisis kuersetin, didapatkan persamaan regresi linear untuk replikasi satu, replikasi dua dan replikasi tiga berturut-turut adalah 0,9997, 0,9998, dan 0,9995. Dari tiga hasil tersebut nilai r yang dihasilkan masih memenuhi persyaratan linearitas menurut Chan et al (2005), dimana minimal koefisien korelasi linearitas yang baik minimal r = 0,995. Hal ini menunjukkan bahwa metode yang digunakan dalam analisis kuersetin mempunyai linearitas yang baik.
= 0,9975, r = 0,9986, dan r = 0,9991. Tiga hasil ini masih diatas nilai koefisien korelasi linearitas minimal menurut Chan et al (2005), yaitu r = 0,995. Dari hasil tersebut dapat disimpulkan metode ini memiliki linieritas yang baik untuk menganalisis fraksi etil asetat ekstrak daun dadap serep.
3. Spesifisitas metode uji antioksidan
Spesifisitas merupakan kemampuan suatu metode analisis dalam mengukur dengan akurat respon analit dalam suatu matriks diantara komponen potensial lainnya didalam sampel. Dalam metode analisis ini yang menggunakan spektrofotometri visibel pada pengukuran kuersetin dan fraksi etil asetat sampel uji, spesifikasi metode dapat dilihat dengan tidak adanya serapan dari sampel sebelum ditambah DPPH pada panjang gelombang pengukuran yang digunakan yaitu 515,5 nm.
Berdasarkan hasil scanning pada larutan pembanding kuersetin (Lampiran 6c ) dan larutan uji fraksi etil asetat (Lampiran 6e ) pada panjang gelombang 515,5 nm tidak terdapat serapan, sehingga ketika kuersetin maupun larutan uji fraksi etil asetat direaksikan dengan radikal DPPH maka yang terbaca hanya absorbansi DPPH hasil reaksi. Dari hasil tersebut maka dapat disimpulkan metode uji aktivitas antioksidan untuk kuersetin dan fraksi etil asetat memiliki spesifitas yang baik.
G. Hasil Uji Aktivitas Antioksidan Dengan Radikal DPPH
Metode DPPH merupakan metode yang sering digunakan untuk menguji aktivitas antioksidan. Aktivitas diukur secara spektrofotometri dengan menghitung jumlah pengurangan intensitas warna ungu larutan DPPH yang sebanding dengan jumlah DPPH yang beraksi dengan senyawa antioksidan. Menurut Zuhra et al., (2008), peredaman tersebut dihasilkan oleh bereaksinya molekul Difenil Pikril Hidrazil dengan atom hidrogen yang dilepaskan satu molekul komponen sampel sehingga terbentuk senyawa Difenil Pikril Hidrazin dan menyebabkan terjadinya peluruhan warna DPPH dari ungu ke kuning. Dengan adanya penangkapan radikal DPPH menyebabkan terjadinya penurunan nilai absorbansi DPPH. Reaksi radikal DPPH terhadap senyawa fenolik adalah sebagai berikut :
DPPH Free Radical Phenolic Compounds DPPH Reduced Form
+ A
Gambar 10. Reaksi antara radikal DPPH dengan senyawa antioksidan (Irshad et al., 2012)
kuersetin sebagai pembanding karena kuersetin termasuk flavonoid yang telah diketahui memiliki aktivitas antioksidan.
Gambar 11. Struktur senyawa kuersetin (Cartea, 2010)
O
Pada gambar 12 menunjukan reaksi kuersetin dalam peredaman radikal DPPH yang dihasilkan oleh bereaksinya molekul DPPH dengan atom hidrogen yang dilepaskan molekul kuersetin sebagai standar sehingga terbentuk senyawa Difenil Pikril Hidrazin dan menyebabkan terjadinya peluruhan warna DPPH dari ungu ke kuning. Pengurangan radikal DPPH juga disebabkan reaksi terminasi antara radikal DPPH dengan radikal kuersetin yang terbentuk.
Metode DPPH dalam analisis ini bertujuan untuk mengetahui parameter konsentrasi yang ekivalen memberikan 50 % efek aktivitas antioksidan (IC50).
IC50 didefinisikan sebagai konsentrasi efektif larutan uji yang dapat menurunkan
50% intensitas serapan blanko dan dapat dihitung dari persamaan regresi linear pada kurva konsentrasi fraksi etil asetat ekstrak daun dadap serep terhadap persen peredaman. Semakin kecil harga IC50 yang dihasilkan menunjukan kemampuan
menangkap radikal bebas yang semakin kuat. Persamaan regresi linier dan hasil perhitungan % IC untuk standar kuersetin ditunjukan pada tabel IX dan gambar 13 persamaan regresi linier dan hasil perhitungan % IC untuk fraksi etil asetat ditunjukkan pada tabel X dan gambar 14, sedangkan hasil IC50 untuk kuersetin
Tabel IX. Hasil aktivitas antioksidan kuersetin dengan metode DPPH
Replikasi
Konsentrasi
(µg/mL) % IC Persamaan regresi linier
5,2 24,246
Gambar 13. Kurva persamaan regresi linier aktivitas antioksidan kuersetin
y = 4.326x + 1.210
Tabel X. Hasil aktivitas antioksidan fraksi etil asetat ekstrak etanolik daun dadap serep dengan metode DPPH
Replikasi Konsentrasi (µg/mL) % IC Persamaan regresi linier
75,6 26,176
Gambar 14. Kurva persamaan regresi linier aktivitas antioksidan fraksi etil
asetat
Tabel XI. Hasil perhitungan IC50 kuersetin dan Fraksi etil asetat ekstrak etanolik daun dadap serep
Bahan Uji dapat dikatakan bahwa CV yang dihasilkan menurut Kingstone (2004) memenuhi persyaratan analisis, yaitu ≤ 20%, hal ini berarti bahwa uji aktivitas antioksidan
yang dilakukan mempunyai presisi yang baik.
Berdasarkan hasil perhitungan yang ditunjukan pada tabel XI, rata-rata IC50 kuersetin adalah 11,438 ± 0,157 µg/mL dan rata-rata IC50 fraksi etil asetat
ekstrak etanolik daun dadap serep adalah 245,150 ± 4,425 µg/mL. Dari hasil nilai
IC50 tersebut diketahui bahwa kuersetin memiliki aktivitas antioksidan lebih besar
dibandingkan dengan fraksi etil asetat ekstrak etanolik daun dadap serep. Berdasarkan tingkat kekuatan aktivitas antioksidan menurut Aryanto (2006), kuersetin berada pada tingkat antioksidan sangat kuat (< 50 µg/mL), sedangkan
Tabel XII. Penggolongan tingkat kekuatan antioksidan kuersetin dan fraksi etil asetat ekstrak etanolik daun dadap serep (Aryanto, 2006)
Intensitas Nilai IC50 Kuersetin Fraksi etil asetat
ekstrak etanolik
Sangat kuat <50 µg/mL √
Kuat 50-100 µg/mL - -
Sedang 101-150 µg/mL - -
Lemah >150 µg/mL - √
Data hasil IC50 kuersetin dan fraksi etil asetat kemudian dianalisa secara
statistik untuk melihat signifikansi data dari kuersetin dan fraksi etil asetat. Dalam penelitian ini analisa data secara statistik menggunakan software R 2.14.1. Hal pertama yang dilakukan adalah melakukan pengujian distribusi normal data IC50
kuersetin dan fraksi etil asetat . Hal ini dilakukan untuk mengetahui langkah selanjutnya apakah akan menggunakan uji parametrik atau non-parametrik. Pengujian distribusi normal data dilakukan menggunakan uji normalitas Shapiro-wilk. Pemilihan uji normalitas Shapiro-Wilk karena menurut Dahlan (2012), jika data yang digunakan berjumlah kurang dari lima puluh maka uji normalitas data menggunakan uji normalitas Shapiro-wilk. Hipotesis null (Hnull) adalah data IC50
terdistribusi normal sedangkan hipotesis alternatif adalah data IC50 terdistribusi
tidak normal. Berdasarkan hasil yang diperoleh nilai P untuk IC50 kuersetin dan
fraksi etil asetat berturut-turut sebesar 0,9488 dan 0,6291. Nilai signifikansi yang diperoleh untuk kuersetin dan fraksi etil asetat lebih besar dari nilai signifikansi 0,05 (taraf kepercayaan 95%), oleh karena itu Hnull diterima. Dari hasil tersebut
dapat disimpulkan data IC50kuersetin dan fraksi etil asetat terdistribusi normal.
berpasangan. Hipotesis null (Hnull) adalah nilai IC50 kuersetin tidak lebih kecil
daripada fraksi etil asetat dan hipotesis alternatif yang digunakan adalah nilai IC50
kuersetin lebih kecil daripada fraksi etil asetat. Hasil pengujian statistik diperoleh nilai signifikansi sebesar 0,000 antara kuersetin dan fraksi etil asetat. Dari hasil yang diperoleh jika dibandingkan dengan nilai signifikansi yang ditentukan, yaitu 0,05 maka Hnull ditolak karena nilai signifikansi yang dihasilkan lebih kecil
daripada nilai signifikansi yang ditentukan. Dari hasil tersebut, dapat disimpulkan bahwa nilai IC50 kuersetin lebih kecil daripada fraksi etil asetat.
H. Hasil Optimasi Metode Penetapan Kandungan Fenolik Total
1. Penentuan operating time (OT)
Gambar 15. Grafik penentuan OT asam galat (Replikasi 1)
Berdasarkan hasil yang diperoleh yang ditunjukkan pada grafik penentuan OT asam galat menunjukan dari menit ke-10 sampai ke-30 absorbansi senyawa hasil reaksi asam galat dengan pereaksi Folin-Ciocalteu terbentuk secara stabil. Dari hasil tersebut dapat disimpulkan bahwa OT penetapan kandungan fenolik total adalah 10 menit.
2. Penentuan panjang gelombang maksimum
Panjang gelombang maksimum ditentukan untuk mendapatkan serapan maksimum dari hasil reaksi antara asam galat dengan pereaksi Folin-Ciocalteu. Menurut Gansch, Weber, dan Lee (2009), panjang gelombang maksimum untuk hasil reaksi Folin-Ciocalteu dengan senyawa fenolik adalah 750-765. Penentuan panjang gelombang maksimum dilakukan dengan melakukan scanning pada panjang gelombang 600-800 nm pada tiga konsentrasi larutan asam galat