INTISARI
Polusi udara saat ini sudah menjadi salah satu masalah yang serius yang diakibatkan oleh pencemaran udara yang berasal dari kegiatan industri. Pencemaran udara memunculkan radikal bebas yang berakibat buruk bagi kesehatan manusia. Radikal bebas merupakan senyawa yang bersifat sangat reaktif dan memiliki pasangan elektron bebas, oleh karena itu diperlukan antioksidan yang bertujuan untuk menangkal aktivitas radikal bebas.Salah satu tanaman yang berpotensi sebagai antioksidan adalah selada air (Nasturtium officinale R.Br) yang telah lama dikonsumsi oleh masyarakat. Aktivitas antioksidan dari herba selada air berasal dari senyawa fenolik yang dapat menangkal radikal bebas, oleh karena itu dilakukan juga penetapan kandungan fenolik totalnya. Metode aktvitas antioksidan yang digunakan adalah dengan metode DPPH dengan prinsipnya adalah terjadi reduksi warna dari ungu menjadi kuning karena terbentuk senyawa DPPH tereduksi yang berasal dari reaksi radikal bebas dengan senyawa antioksidan. Aktivitas antioksidan dinyatakan dengan IC50
yaitu kemampuan senyawa yang berpotensi sebagai antioksidan untuk menurunkan 50% aktivitas dari radikal bebas. Dari hasil penelitian diperoleh kandungan senyawa fenolik total adalah (6,463 ± 0,066) mg ekivalen asam galat per gram fraksi etil asetat dan IC50 dari herba selada air adalah ( 434,402 ± 5,945) µg/ml.
ABSTRACT
It is well known that air polution can be a serious problem to human health because it will produce a free radical. Free radical is a molecule that has a free electron chain and is so reactive that we will need antioxidants to reduce it.Watercress (Nastrutrium officinale R.Br) is one kind of plant that can inhibit free radical because its polyphenolic contents.We must exact contents of polyphenolic compunds. DPPH methods are used to determine antioxidant activity by reducing a colour from purple to yellow. Antioxidant activity is presented by IC50. IC50 is the ability of antioxidant that can reduce 50% of free radical activity. According to this research we know that the total phenolic compounds is (6.463 ± 0.066) mg eqivalent gallic acid each gram fraction and IC50 is (434.402 ±5.945)µg/ml.
PENETAPAN KANDUNGAN SENYAWA FENOLIK TOTAL dan UJI AKTIVITAS ANTIOKSIDAN FRAKSI ETIL ASETAT EKSTRAK ETANOLIK HERBA SELADA AIR (Nasturtium officinale R.Br.) DENGAN
MENGGUNAKAN METODE DPPH
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Diajukan oleh: Jap Yulius Billy Soegianto
NIM : 098114069
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv pihak yang telah membantuku.
vii PRAKATA
Puji syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas berkat-Nya sehingga penulis berhasil menyelesaikan karya tulis “Penetapan Kandungan
Senyawa Fenolik Total dan Uji Aktvitas Antioksidan Fraksi Etil Asetat Ekstrak Etanolik Herba Selada Air (Nastrurtium officinale R.Br.) Dengan Menggunakan Metode DPPH ”.
Dalam penulisan skripsi ini penulis banyak mendapatkan bantuan dan semangat dari berbagai pihak, maka pada kesempatan ini penulis menyampaikan rasa terima kasih kepada:
1. Bapak Ipang Djunarko, M.Si., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma
2. Bapak Prof.Dr.C.J.Soegihardjo, Apt selaku Dosen Pembimbing yang selalu mendampingi dan mengarahkan sehingga penulis dapat menyelesaikan skripsi dengan baik.
3. Bapak Yohanes Dwiatmaka, M.Si selaku Dosen Penguji yang memberikan masukkan dan arahan sehingga dapat menyelesaikan skripsi dengan baik. 4. Bapak Jeffry Julianus, M.Si selaku Dosen Penguji yang memberikan
pengarahan dalam penulisan skrpsi.
5. Semua dosen Fakultas Farmasi Sanata Dharma yang telah memberikan masukkan, ilmu dan dukungannya kepada penulis.
viii
7. Laboran Laboratorium Farmakognosi-Fitokimia, Biokimia–Anatomi Manusia Universitas Sanata Dharma,yaitu Mas Kayat dan Mas Wagiran yang telah membantu dalam penyelesian skripsi ini .
8. Semua pihak yang telah membantu dalam penyelesaian skripsi ini yang tidak dapat disebutkan satu-persatu
Penulis mengetahui bahwa penulisan skripsi ini masih belum sempurna, oleh karena itu masukkan, saran dan kritikannya sangat diperlukan untuk memperbaiki penulisan skripsi ini. Terima kasih.
ix
Halaman
HALAMAN JUDUL ... i
PERSETUJUAN PEMBIMBING ... iii
PENGESAHAN SKRIPSI ... iii
PERSEMBAHAN ... iv
PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... v
PERNYATAAN KEASLIAN KARYA ... vi
PRAKATA ... vii
DAFTAR ISI ... ix
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xivv
DAFTRA LAMPIRAN...xv
INTISARI ... xvii
ABSTRACT ... xvii
BAB I. PENGANTAR ... 1
A. Latar Belakang ... 1
1. Permasalahan... 5
2. Keaslian penelitian... 6
3. Manfaat penelitian... 6
B. Tujuan Penelitian ... 7
x
A. Selada Air ... 8
1. Nama lain selada air...8
2. Morfologi tanaman selada air...8
3. Kandungan kimia...9
4. Sistematika selada air...10
B. Senyawa Fenolik ... 10
1. Pengertian senyawa fenolik... 10
2. Senyawa fenolik dan antioksidan... 11
3. Senyawa fenolik pada tanaman... 11
4. Kandungan Senyawa Fenolik Total Selada Air...12
C. Metode Folin-Ciocalteu ... 13
D. Antioksidan...14
1. Pengertian antioksidan... 14
2. Sumber antioksidan...15
3. Penggolongan antioksidan...17
4. Metode uji aktivitas atioksidan...18
E. Radikal Bebas...20
1. Pengertian radikal bebas...20
2. Kerusakan sel akibat radikal bebas...20
3. Pembentukan radikal bebas...21
4. Radikal bebas dalam tubuh...22
F. Metode Ekstraksi...23
xi
H. Hipotesis...26
BAB III. METODE PENELITIAN... 27
A. Jenis dan Rancangan Penelitian ... 27
B. Variabel Penelitian ... 27
C. Definisi Operasional ... 28
D. Bahan dan Alat Penelitian ... 29
1. Alat... 29
2. Bahan...29
E. Tata Cara Penelitian ... 29
1. Determinasi tanaman... 29
2. Pengumpulan bahan... 29
3. Preparasi sampel...30
4. Penetapan kandungan fenolik total...30
5.Pembuatan larutan DPPH, pembanding dan uji aktivitas antioksidan...32
6.Penentuan OT dan panjang gelombang maksimum uji aktivitas antioksidan...33
7.Uji pendahuluan dan estimasi aktivitas antioksidan pada larutan uji dan pembanding...33
F. Analisis Hasil...34
BAB IV. HASIL DAN PEMBAHASAN ... 36
xii
C. Hasil Preparasi Sampel ... 37
1. Pengeringan...37
2. Ekstraksi...38
3. Fraksinasi...41
D. Hasil Uji Pendahuluan ... 43
1. Uji pendahuluan kandungan senyawa fenolik total...43
2. Uji pendahuluan aktivitas antioksidan...45
E. Hasil Optimasi Penetapan Knadungan Fenolik Total...46
1. Penetapan Operating Time(OT)...46
2. Pengukuran panjang gelombang maksimum...47
F. Hasil Penetapan Kandungan Fenolik Total...48
G. Hasil Optimasi Penentuan Aktivitas Antioksidan...52
1. Penentuan Operating Time (OT)...52
2. Penentuan panjang gelombang maksimum...54
H. Hasil Penentuan Aktivitas Antioksidan...55
BAB V KESIMPULAN dan SARAN...63
A. Kesimpulan ... 63
B. Saran ... 63
DAFTAR PUSTAKA ... 64
LAMPIRAN ... 68
xiii
Halaman Tabel I. Penentuan panjang gelombang maksimum asam galat ... 48 Tabel II. Persamaan regresi linier dari baku asam galat...50 Tabel III. Kandungan senyawa fenolik total fraksi etil asetat ekstrak etanolik
herba selada air ... 51 Tabel IV. Penentuan panjang gelombang maksimum DPPH ... 54 Tabel V. Persamaan regresi linier % IC dengan baku rutin...59 Tabel VI. Perhitungan persamaan regresi linier % IC dengan baku fraksi etil
asetat ekstrak etanolik herba selada air...59 Tabel VII. Nilai IC50 rutin dan fraksi etil asetat ekstrak etanolik herba selada
xiv
DAFTAR GAMBAR
Halaman
Gambar 1. Mekanisme penghambatan radikal bebas oleh senyawa fenolik...11
Gambar 2. Struktur rutin ... 13
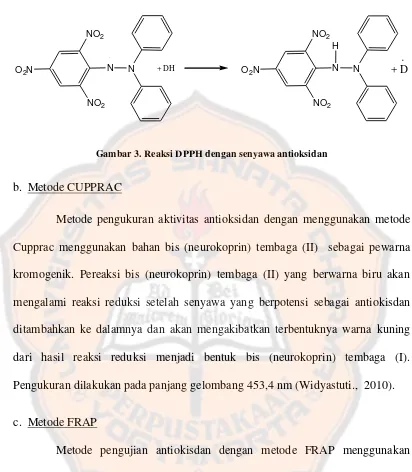
Gambar 3. Reaksi DPPH dengan senyawa antioksidan...19
Gambar 4. Uji pendahuluan kandungan senyawa fenolik total... 44
Gambar 5. Uji pendahuluan aktivitas antioksidan...46
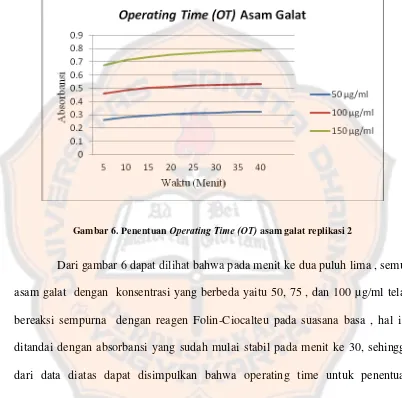
Gambar 6. Penentuan Operating Time (OT) asam galat replikasi 2 ... ...47
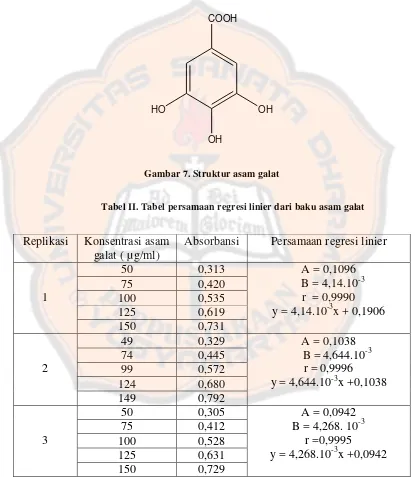
Gambar 7. Struktur asam galat . ... 50
Gambar 8. Operating Time (OT) rutin replikasi 1 ...53
Gambar 9. Operating Time (OT) fraksi etil asetat ekstrak etanolik herba selada air replikasi 3 ... 53
Gambar 10. Reaksi antara DPPH dengan antioksidan...55
Gambar 11. Struktur kimia rutin...56
Gambar 12. Mekanisme penghambatan DPPH oleh rutin...57
Gambar 13. Kurva aktivitas antioksidan rutin replikasi 3...58
xv
Halaman
Lampiran 1. Lampiran Surat Determinasi Tanaman...68
Lampiran 2. Gambar Selada Air...69
Lampiran 3. Perhitungan Rendemen Uji Aktivitas Antioksidan...70
Lampiran 4. Data Penimbangan Uji Aktivitas Antioksidan...71
Lampiran 5. Data Konsentrasi Uji Aktivitas Antioksidan...72
Lampiran 6. Penentuan Operating Time (OT) Rutin...74
Lampiran 7. Penentuan Operating Time (OT) Fraksi Etil Asetat...76
Lampiran 8. Panjang Gelombang Maksimum DPPH...78
Lampiran 9. Scanning Penentuan Aktivitas Antioksidan...81
Lampiran 10. Perhitungan Nilai % IC Dari Rutin...84
Lampiran 11. Perhitungan % IC Fraksi Etil Asetat...86
Lampiran 12. Perhitungan Nilai IC50 Rutin...88
Lampiran 13. Perhitungan Nilai IC50 Fraksi Etil Asetat...90
Lampiran 14. Penimbangan Untuk Uji Kandungan Fenolik Total...92
Lampiran 15. Optimasi Penetapan Kandungan Fenolik Total...93
Lampiran 16. Panjang Gelombang Maksimum Asam Galat...94
Lampiran 17. Scanning Penentuan Kandungan Fenolik Total...97
Lampiran 18. Penentuan Kandungan Senyawa Fenolik Total...100
xvi INTISARI
Polusi udara saat ini sudah menjadi salah satu masalah yang serius yang diakibatkan oleh pencemaran udara yang berasal dari kegiatan industri. Pencemaran udara memunculkan radikal bebas yang berakibat buruk bagi kesehatan manusia. Radikal bebas merupakan senyawa yang bersifat sangat reaktif dan memiliki pasangan elektron bebas, oleh karena itu diperlukan antioksidan yang bertujuan untuk menangkal aktivitas radikal bebas.Salah satu tanaman yang berpotensi sebagai antioksidan adalah selada air (Nasturtium officinale R.Br) yang telah lama dikonsumsi oleh masyarakat. Aktivitas antioksidan dari herba selada air berasal dari senyawa fenolik yang dapat menangkal radikal bebas, oleh karena itu dilakukan juga penetapan kandungan fenolik totalnya. Metode aktvitas antioksidan yang digunakan adalah dengan metode DPPH dengan prinsipnya adalah terjadi reduksi warna dari ungu menjadi kuning karena terbentuk senyawa DPPH tereduksi yang berasal dari reaksi radikal bebas dengan senyawa antioksidan. Aktivitas antioksidan dinyatakan dengan IC50
yaitu kemampuan senyawa yang berpotensi sebagai antioksidan untuk menurunkan 50% aktivitas dari radikal bebas. Dari hasil penelitian diperoleh kandungan senyawa fenolik total adalah (6,463 ± 0,066) mg ekivalen asam galat per gram fraksi etil asetat dan IC50 dari herba selada air adalah ( 434,402 ± 5,945) µg/ml.
xvii ABSTRACT
It is well known that air polution can be a serious problem to human health because it will produce a free radical. Free radical is a molecule that has a free electron chain and is so reactive that we will need antioxidants to reduce it.Watercress (Nastrutrium officinale R.Br) is one kind of plant that can inhibit free radical because its polyphenolic contents.We must exact contents of polyphenolic compunds. DPPH methods are used to determine antioxidant activity by reducing a colour from purple to yellow. Antioxidant activity is presented by IC50. IC50 is the ability of antioxidant that can reduce 50% of free radical activity. According to this research we know that the total phenolic compounds is (6.463 ± 0.066) mg eqivalent gallic acid each gram fraction and IC50 is (434.402 ±5.945)µg/ml.
1 BAB I PENGANTAR
A. Latar Belakang
Udara mempunyai arti yang sangat penting di dalam kehidupan makhluk hidup dan kelangsungan hidup makhluk lainnya,sehingga udara merupakan sumber daya alam yang harus dilindungi untuk hidup kehidupan manusia dan makhluk hidup lainnya. Pertumbuhan sektor industri pertahun masih merupakan sektor yang sangat potensial dalam memacu pertumbuhan ekonomi, namun disisi lain juga dapat memberikan dampak negatif berupa pencemaran udara baik yang di dalam ruangan maupun di luar ruangan yang dapat membahayakan manusia (Anonim, 2002).
0,26 ppm (Chandra,2006). Akibatnya adalah muncul radikal bebas di lingkungan yang tentunya berbahaya bagi kesehatan manusia.
Radikal bebas adalah suatu atom atau molekul yang sangat reaktif dengan elektron yang tidak memiliki pasangan. Radikal bebas mencari reaksi-reaksi agar dapat memperoleh kembali elektron pasangannya. Serangkaian reaksi-reaksi dapat terjadi, yang menghasilkan serangkaian radikal bebas. Setelah itu radikal bebas dapat mengalami tubrukan kaya energi dengan molekul lain yang merusak ikatan di dalam molekul, pada akhirnya radikal bebas dapat merusak membran sel, retikulum endoplasma, atau DNA sel yang rentan (Corwin, 2008). Radikal bebas merusak DNA yang dapat mengakibatkan sel kanker (Mazandarani et al, 2012).
Pada dasarnya tubuh manusia memiliki antioksidan untuk membatasi kerusakan akibat terpapar radikal bebas. Salah satu antioksidan alami yang paling efektif adalah vitamin E. Vitamin ini larut dalam lemak dan sangat penting karena sebagian besar kerusakan oleh radikal bebas terjadi pada membran sel dan lipoprotein berkepadatan rendah. Antioksidan alami tubuh lainnya mencakup senyawa seperti cystein, glutathion dan D-penicillamin, serta isi darah misalnya molekul transferin yang mengandung zat besi dan seruloplasmin protein ( Youngson, 2003).
oksidan tersebut bisa dihambat. Keseimbangan oksidan dan antioksidan sangat penting karena berkaitan dengan berfungsinya sistem imunitas tubuh. Kondisi seperti ini terutama untuk menjaga integritas dan berfungsinya membran lipid, protein sel, dan asam nukleat, serta mengontrol transduksi sinyal dan ekspresi gen dalam sel imun (Winarsih,2007).
Sumber antioksidan dapat dibagi menjadi dua kelompok,yaitu antioksidan sintetik, yaitu antioksidan yang diperoleh dari hasil sintesis reaksi kimia dan antioksidan alami, yaitu antioksidan yang berasal dar alam (Prabantini, 2010). Tumbuhan mengandung berbagai jenis senyawa kimia yang berpotensi sebagai antioksidan, namun yang paling penting adalah vitamin C, vitamin E, senyawa fenol, dan thiol. Senyawa fenol meliputi flavonoid (turunan inti flavan), cincin kroman (tokoferol), dan lignan. Sayur-sayuran kaya akan zat gizi (vitamin, mineral, dan serat pangan) serta berbagai kelompok zat bioaktif lain yang disebut zat fitokimia. Zat bioaktif ini bekerja secara sinergis, meliputi mekanisme enzim detoksifikasi, peningkatan sistem kekebalan dan antioksidan (Silalahi, 2006).
DNA pada manusia yang berujung pada timbulnya berbagai penyakit (Ozen., 2009). Salah satu tanaman tersebut adalah selada air ( Nasturtium officinale R.Br).
Selada air (Nasturtium officinale R.Br) merupakan tanaman dengan batang menjalar. Batang ini yang diambil untuk dijadikan sayuran. Selada air dimanfaatkan sebagai mengobati TBC dan rasa panas di paru-paru, mengobati gangguan dan iritasi pada kulit. Kandungan zat gizi dan fitonutrien yang terkandung di dalamnya adalah provitamin A (karotenoid) dan vitamin C, minyak atsiri berupa rapanol dan serat (Wirakusumah, 2004). Adanya kandungan vitamin C pada selada air dimungkinkan terdapat aktifitas antioksidan karena vitamin C dapat bertindak sebagai peningkatan sistem kekebalan di dalam tubuh, oleh karena itu diperlukan suatu keseimbangan antara pembentukan radikal bebas dan proteksi antioksidan (Silalahi, 2006). Selada air diduga dapat bertindak sebagai antikanker berdasarkan penelitian yang dilakukan oleh Selain itu, tanaman selada air juga banyak ditemui sehingga dapat dengan mudah untuk didapatkan dan diteliti aktivitas antioksidannya.
serta memiliki nilai aktifitas antioksidan yang dinyatakan sebagai IC50, Sebesar 1227,5 µg/ml dengan metode TAC .
Pada penelitian ini digunakan metode DPPH untuk menentukan aktivitas antioksidan fraksi etil asetat ekstrak etanolik karena dengan digunakannya radikal bebas DPPH dapat digunakan untuk menangkap aktivitas antioksidan dari sampel yang ditandai dengan nilai IC50. Nilai IC50 adalah nilai yang dibutuhkan oleh suatu sampel untuk menangkap radikal bebas sebanyak 50%. Pada uji aktivitas antioksidan dengan menggunakan metode DPPH telah dilakukan untuk mengukur aktivitas antioksidan telah digunakan untuk pengukuran antioksidan dari daun dewa dan hasilnya dinyatakan sebagai IC50 (Widyaningsih,2010). Penelitian ini juga menggunakan metode Folin-Ciocalteu dalam penetapan kadar senyawa fenolik total dengan prinsip adalah terjadinya reduksi ion fenolat oleh Folin-Ciocalteu yang kemudian dapat ditetapkan kadarnya dengan menggunakan spekrtoskopi, metode ini telah digunakan untuk menetapkan senyawa fenolik total pada sampel kulit buah pinang ( Ismail, Runtuwene, Fatimah, 2010). Oleh karena itu, penelitian ini menggunakan metode DPPH untuk mengukur aktivitas antioksidan dan metode Folin-Ciocalteu untuk pengukuran kandungan senyawa fenolik total.
1. Permasalahan
b. Berapakah kandungan senyawa fenolik total dari fraski etil asetat ekstrak etanolik herba selada air tersebut yang dinyatakan sebagai mg ekivalen asam galat per gram fraksi?
2. Keaslian penelitian
Sejauh pengamatan yang diketahui oleh peneliti, penelitian ini belum pernah dilakukan, adapun untuk penelitian serupa yang pernah dilakukan oleh (Mazandari, et al,2013) dengan judul Evaluation of Phytochemical and Antioxidant Activities From Different Parts of (Nasturtium officinale R. Br). Pada penelitian ini sampel herba selada air diambil dari provinsi Mazandaran dan dilakukan juga penetapan kadar senyawa flavonoid total dengan menggunakan metode aluminium klorida, dan penentuan aktivitas antioksidan dengan menggunakan metode TAC dengan pembanding BHA dan BHT ( Ozen, 2009) dengan judul Investigation Of Antioxidant Properties of (Nasturtium Officinale)
(Watercress) Leaf Extract. Pada penelitian ini sampel herba selada air diperoleh dari daerah Arhavi-Artvin, Turki, pada periode Juni-Juli (2006). Metode aktivitas antioksidan pada penelitian ini adalah dengan menggunakan metode besi tiosianat.
Perbedaan penelitian ini dengan penelitian yang pernah dilakukan sebelumnya adalah tempat diambilnya sampel selada air yang diambil dari daerah Kaliurang, Indonesia dan metode uji aktivitas antioksidan yang berbeda yaitu dengan menggunakan metode DPPH dengan pembanding rutin.
Penelitian ini diharapkan dapat memberikan informasi mengenai kandungan senyawa fenolik total dan mengetahui aktivitas antioksidan fraksi etil asetat ekstrak etanolik pada herba selada air (Nasturtium officinale R.Br ) menggunakan metode DPPH .
b. Manfaat praktis
Penelitian ini dapat memberikan informasi kepada masyarakat tentang penggunaan herba selada air sebagai sumber antioksidan alami yang dapat melawan radikal bebas.
c. Manfaat metodologis
Penelitian ini dapat memberikan informasi mengenai aplikasi penggunaan metode DPPH sebagai salah satu uji aktivitas antioksidan yang terdapat pada bahan alam.
B. Tujuan Penelitian
8 BAB II
PENELAAHAN PUSTAKA
A. Selada Air 1. Nama lain selada air
Tanaman selada air (Nasturtium officinale R. Br) termasuk dalam famili
Brasicacea .Tanaman ini memiliki berbagai nama lain sebagai berikut : Pani
(Hindi), selada air (Indonesia), nasturcio , agretto aquatico (Italia), berro de agua , berro de fuente ( Spanyol), wodjanoj kren, sherucha wodnaja, brunkress (Rusia),
Echte Brunnenkresse, Bachkresse, Waserkresse, Wassersenf, Wiesenkren
(Jerman), Xong (Vietnam).(Seidemann,2005). Nama sinonim dari tanaman ini adalah Caradaminum nasturtium Moench, Crucifera fontana E.H.L. Krause,
Nasturtium aquaticum Wahlenb, Nasturtium nasturtium Cockerell, Rorippa nasturtium –aquaticum (L.) Hayek, Sisymbrium nasturtium Thunb (Seidemann, 2005).
2. Morfologi tanaman selada air
3. Kandungan kimia
Senyawa yang terkandung dalam selada air (Nasturtium officinale) adalah adanya senyawa flavonoid yang terdapat di dalam selada air. Berdasarkan penelitian yang telah dilakukan oleh (Mazandarani, et al, 2010) menyebutkan bahwa kandungan flavonoid totalnya sebesar 26,5 mg ekivalen quarsetin pada fase vegetatif dan 36,89 mg ekivalen kuarsetin pada fase generatif. Kandungan senyawa lain yang berpotensi sebagai antioksidan dalam spesies Brassica adalah lutein dan β karoten. Vitamin E dalam bentuk α tokoferol dapat bertindak sebagai senyawa antioksidan dengan memberikan atom hidrogennya ke senyawa radikal bebas dan juga terdapat kandungan vitamin C yang dapat bertindak sebagai antioksidan dengan mekanisme penangkapan radikal hidroksil dan superoksida. (Pilar, Tamara, Pablo, and Maria, 2011).
4. Sistematika selada air
Tanaman selada air memiliki taksnomi sebagai berikut : Kingdom : Plantae
Famili : Brassicaceae Genus : Nasturtium
Spesies : Nasturtium officinale R. Br.
( Anonim, 2013) B. Senyawa Fenolik
1. Pengertian senyawa fenolik
Senyawa fenol mempunyai cincin aromatik yang mengandung bermacam gugus pengganti yang menempel, seperti gugus hidroksil , karboksil , metoksil (-O-CH3), dan sering juga berstruktur cincin bukan aromatik. Senyawa fenol berbeda dengan lipid, yaitu lebih larut dalam air dan kurang larut dalam pelarut organik tak-polar. Beberapa agak larut dalam eter, khususnya jika jika pH cukup rendah untuk mencegah ionisasi gugus karboksil dan hidroksil yang ada ( Frank., 1995).
2. Senyawa fenolik dan antioksidan
Dari sekian banyak senyawa fenolik di alam, flavonoid merupakan golongan terbesar, disusul fenolmonosiklik sederhana, fenilpropanoid, dan kuinon fenolik. Di alam, senyawa fenolik kerap dijumpai terikat pada protein, alkanoid, dan terdapat di antara terpenoid. Flavonoid berperan sebagai antioksidan karena dapat menangkap radikal bebas dengan melepaskan atom hidrogen dari gugus hidroksilnya. Pemberian atom hidrogen ini akan menyebabkan radikal bebas menjadi stabil dan berhenti melakukan perusakan terhadap lipida, protein dan DNA. Flavonoid dapat menghentikan tahap awal rekasi dengan melepaskan satu atom hidrogen kemudian berikatan dengan satu radikal bebas. Selanjutnya, dengan mekanisme seperti itu, radikal peroksi dapat dihancurkan atau distabilkan oleh resonansi dari gugus hidroksil yang membuat energi aktivasinya berkurang ( Ide., 2008).
OH
RH +
O
+ R
O
H
O
H
(Silalahi, 2006).
Gambar 1. Mekanisme penghambatan radikal bebas oleh senyawa fenolik
3.Senyawa fenolik pada tanaman
tanaman dan merupakan hasil dari metabolit sekunder. Fungsi senyawa fenolik pada tanaman adalah sebagai pelindung terhadap sinar UV, parasit, atau terhadap agen patogen. Senyawa fenolik yang terdapat di dalam tanaman meliputi asam fenolat, flavonoid dan tanin. Senyawa flavonoid terbagi menjadi 6 sub bagian tersendiri, yaitu: flavons, flavonols, flavanols, flavanones, isoflavones dan antosianin ( Dai and Mumper, 2010).
Senyawa fenolik terdapat secara luas di dalam tanaman salah satu tanaman yang memiliki senyawa polifenol adalah teh hijau (Camellia sinensis) adalah sebagai berikut epicatechin, epigallocatechin, epicatechin-3-gallate dan
epigallo-catechin-3-gallate.Senyawa fenolik ini terdapat pada daun teh yang masih segar (Anesini, Ferarro,and Filip, 2008). Senyawa fenolik dapat ditemukan pada tanaman berkayu. Senyawa fenolik menyebabkan eksplan cepat berubah warna menjadi coklat dan mengering bahkan sesudah terbentuk kalus. Senyawa fenol tersebut akan teroksidasi membentuk quinon yang bersifat racun terhadap sel-sel tanaman ( Hendaryono, dan Wijayani,1994).
4.Kandungan senyawa fenolik pada tanaman selada air (Nasturtium officinale R.Br).
mengoksidasi dari reaksi radikal bebas. Pada penelitian ini digunakan standard antiokisdan rutin karena efek penghambatan flavonoid rutin dan quersetin terhadap peroksidasi lipid bergantung pada ion Fe dalam lesitin liposom. Senyawa flavonoid tersebut bekerja dengan cara mengkelat logam, serta menangkap aktivitas radikal bebas. Dalam hal ini terjadi interaksi rutin dengan ion superoksida. Rutin secara signifikan lebih efektif menghambat sistem peroksidasi lipid yang tergantung ion Fe. Pengkelatan ion Fe menyebabkan kompleks ion inert dan tidak dapat mengawali terjadinya peroksidasi lipid,mekanisme pengkelatan rutin lebih kuat dibandingkan dengan vitamin C. (Winarsih., 2007).
O
O
O OH
HO
OH
OH
[image:32.595.102.502.271.604.2]Rhamoglikosida
Gambar 2. Struktur rutin
C. Metode Folin-Ciocalteu
Reaksi antara senyawa fenolik dengan Folin–Ciocalteu berjalan lambat pada suasana asam, sehingga perlu penambahan natrium bikarbonat agar terbentuk suasana basa dan reaksi dapat berjalan lebih cepat. Penggunaan metode ini telah digunakan oleh (Agustiningsih, Wildan, dan Mindaningsih, 2010) dalam menetapkan kandungan senyawa fenolik pada ekstrak daun pandan wangi ( Pandanus amaryllifous Roxb ).
Pengukuran dengan Folin-Ciocalteu digunakan untuk pengukuran senyawa fenolik total. Prinsipnya berdasarkan pada rekasi oksidasi dari senyawa fenolik dan reduksi dari senyawa yang memiliki kromofor. Jika dalam sampel tersebut t terdapat agen pereduksi seperti asam askorbat, asam amino, xantin dan protein akan mengganggu pada pengukuran ini ( Makar., 2003). Reagen ini terdiri dari campuran polimer anionik yang akan tereduksi menjadi warna biru. Struktur dari bentuk kromofor ini tergantung dari sifat fenolik dan panjang gelombang maksimum pada 760 nm ( Hemingway and Laks,1992).
D. Antioksidan 1. Pengertian antioksidan
2. Sumber antioksidan a. Antioksidan alami
Tumbuhan mengandung berbagai jenis antioksidan , namun yang paling penting adalah vitamin C, vitamin E, senyawa fenol (meliputi flavonoid, tokoferol dan lignin). Khasiat antioksidan untuk mencegah bahaya radikal bebas terdapat pada tanaman dan buah-buahan yang kaya akan antioksidan. Mekanisme kerja dari zat tersebut sebagai antiokisdan adalah sebagai berikut.
1) Vitamin E
Vitamin E atau tokoferol adalah inhibitor terhadap lipida peroksidasi. Terdapat delapan jenis tokoferol alam yang mempunyai aktivitas sebagai vitamin E, tetapi alfa tokoferol yang paling aktif secara biologis. Tokoferol suatu antiokisdan yang sangat efektif, yang dengan mudah menyumbangkan atom hidrogen pada gugus hidroksil (OH) dari struktur cincin ke radikal bebas sehingga radikal bebas menjadi tidak reaktif. Dengan menyumbangkan hidrogen, vitamin E sendiri menajdi suatu radikal , tetapi lebih stabil karena elektron yang tidak berpasangan pada atom oksigen mengalami delokalisasi ke dalam struktur cincin aromatik(Silalahi, 2006).
2) Vitamin C
sitosol, vitamin C dapat melindungi membran biologis dari kerusakan peroksidatif. Sifat penting dari vitamin C sebagai antioksidan pertama, karena mempunyai potensial reduksi yang rendah sehingga radikal askorbil mampu bereaksi dengan radikal biologis dan mereduksi oksidan-oksidan. Stabilitas dan reaktivitas yang rendah dari radikal askorbil, yang terbentuk ketika askorbat yang menangkap SOR dan senyawa nitrogen yang reaktif (Silalahi, 2006).
3) β karoten
Senyawa karotenoid bekerja sebagai antioksidan, yakni penangkap radikal bebas, terutama radikal peroksil dan hidroksil maupun oksigen singlet. Sebagai antioksidan, beta karoten memperlambat fase inisiasi. Senyawa ini lebih efektif sebagai antiokisdan biologis terutama pada bagian yang memiliki tekanan partial oksigen rendah ( Silalahi, 2006).
b. Antioksidan sintetik
3. Penggolongan antioksidan
Berdasarkan mekanisme kerjanya , antioksidan digolongkan menjadi tiga kelompok, yaitu antioksidan primer, sekunder, dan tersier.
a. Antioksidan primer
Antioksidan primer meliputi enzim superoksida dismutase (SOD) , katalase, dan glutation peroksidase (GSH-Px). Suatu senyawa dikatakan sebagai antioksidan primer, apabila dapat memberikan atom hydrogen secara tepat kepada senyawa radikal, kemudian radikal antioksidan yang terbentuk segera berubah menjadi senyawa yang lebih stabil.sebagai antioksidan, enzim-enzim tersebut menghambat pembentukan radikal bebas, dengan cara memutus rekasi berantai polimerisasi), kemudian mengubahnya menjadi produk yang lebih stabil (Winarsi, 2007).
b. Antioksidan sekunder
c. Antioksidan tersier
Kelompok antioksidan tersier meliputi enzim DNA repair dan metionin sulfoksida reduktase. Enzim-enzim ini berfungsi sebagai perbaikan biomolekuler yang rusak akibat reaktivitas radikal bebas. Kerusakan DNA yang terinduksi senyawa radikal bebas dicirikan dengan rusaknya single dan double strand, baik gugus non-basa maupun basa ( Winarsi, 2007).
4. Metode uji aktivitas antiokisdan a. Metode DPPH
Salah satu metode yang digunakan untuk pengujian aktivitas antioksidan suatu bahan adalah dengan menggunakan radikal bebas DPPH. DPPH adalah radikal bebas yang bersifat stabil dan beraktivitas dengan cara mendelokasi elektron bebas pada suatu molekul, sehingga molekul tersebut tidak aktif sebagaimana radikal bebas yang lain. Proses delokalisasi ini ditunjukkan dengan adanya warna ungu (violet) pekat yang dapat dikaraterisasi pada absorbansi (Molyneux, 2004).
O2N
NO2 NO2
N N + DH O
2N
NO2 NO2
N N + D
[image:38.595.100.512.100.572.2]H
Gambar 3. Reaksi DPPH dengan senyawa antioksidan
b. Metode CUPPRAC
Metode pengukuran aktivitas antioksidan dengan menggunakan metode Cupprac menggunakan bahan bis (neurokoprin) tembaga (II) sebagai pewarna kromogenik. Pereaksi bis (neurokoprin) tembaga (II) yang berwarna biru akan mengalami reaksi reduksi setelah senyawa yang berpotensi sebagai antiokisdan ditambahkan ke dalamnya dan akan mengakibatkan terbentuknya warna kuning dari hasil reaksi reduksi menjadi bentuk bis (neurokoprin) tembaga (I). Pengukuran dilakukan pada panjang gelombang 453,4 nm (Widyastuti., 2010).
c. Metode FRAP
kondisi reaksi secara termodinamika dan memiliki laju reaksi yang cukup cepat ( Widyastuti, 2010).
Dari ketiga metode pengujian antioksidan yang ada, peneliti memilih menggunakan pengujian dengan metode DPPH karena metode ini lebih praktis dibandingkan dengan menggunakan pengujian aktivitas antioksidan dengan menggunakan metode yang lain.
E. Radikal Bebas 1. Pengertian radikal bebas
Radikal bebas merupakan suatu atom ataupun gugus yang memiliki satu ataupun lebih elektron yang tak berpasangan. Karena jumlah elektron ganjil, sehingga tidak semua elektron dapat berpasangan. Meskipun suatu radikal bebas tidak bermuatan positif atau negatif, spesi ini sangat reaktif karena adanya elektron tidak berpasangan. Suatu radikal bebas biasanya dijumpai sebagai zat antara yang tak dapat diisolasi usia pendek, sangat reaktif, dan berenergi tinggi ( Fessenden and Fessenden, 1992).
2. Kerusakan sel akibat radikal bebas
asam amino prolin, hisitidin, arginin, sistein, dan metionin rentan terhadap serangan radikal hidroksil dan kerusakan oksidatif. Oksidasi asam amino dalam protein menimbulkan fragmentasi protein, pembentukan ikatan silang dan agregrasi ( Marks, Momeji, and Moghaddam, 1996).
3. Pembentukan radikal bebas
Proses oksidasi merupakan proses yang meyebabkan atom mengalami peningkatan jumlah ikatan dengan oksigen atau penurunan jumlah ikatan dengan hidrogen atau kehilangan elektron. Oksigen merupakan molekul unsur memiliki konfigurasi elektron dwiradikal. Reaksi terbentuknya radikal bebas terdiri dari 3 tahap yaitu inisiasi, propagasi, dan terminasi(Cairns, 2004).
a. Inisiasi
Pada tahap ini terjadi pembelahan (fisi) homolitik ikatan kovalen di dalam molekul obat dan menghasilkan radikal bebas. Sumber energi pada proses ini berasal dari cahaya, baik cahaya ultraviolet maupun cahaya tampak yang mengenai sampel. Cahaya dengan panjang gelombang ini cukup energetik untuk memecah pasangan elektron dalam suatu ikatan kovalen dan menghasilkan dua radikal (Cairns, 2004).
b. Propagasi
lebih lanjut dan menghasilkan aldehid serta keton yang memiliki berat molekul kecil (Cairns, 2004).
c. Terminasi
Radikal bebas reaktif bergabung bersama membentuk ikatan kovalen, dan secara efektif proses reaksi rantai dan mengahsilkan senyawa yang stabil (Cairns, 2004).
4. Radikal bebas dalam tubuh
F. Metode Ekstraksi
Ekstraksi merupakan proses pemisahan senyawa kimia yang terdapat pada tanaman atau hewan ataupun komponen lain dengan menggunakan pelarut yang sesuai. Senyawa kimia yang didapatkan dari proses ekstraksi merupakan campuran dari hasil metabolit ataupun senyawa lain yang terdapat pada tanaman. Pada tanaman merupakan sumber senyawa fenolik yang cukup banyak, proses ekstraksi untuk mendapatkan senyawa fenolik ini tergantung dari berat molekul, polaritas konsentrasi, jumlah gugus hidroksil dan cincin aromatik. Di dalam sampel terdapat berbagai variasi struktur dari senyawa fenolik itu sendiri, misalnya terdapat flavonoid, asam fenolat, antosianin dan proantosianin, oleh karena itu diperlukan metode ekstraksi yang tepat (Khoddami, Wilkes,and Roberts,2013).
Pada penelitian ini metode ekstraksi yang digunakan adalah dengan menggunakan metode maserasi karena tidak dilakukan pemanasan dengan maserasi sehingga dapat digunakan untuk mengestraksi senyawa yang bersifat termostabil. Metode maserasi dilakuakn dengan cara mencampurkan serbuk dengan pelarut yang sesuai sampai pada waktu beberapa hari dan kemudian sampai semua senyawa yang dituju dalam sampel dapat terekstraksi. Metode maserasi yang dilakukan pada penelitian ini menggunakan pelarut etanol 70% karena dengan konsentrasi etanol 70% dapat mendapatkan senyawa aktif bioflavonoid yang tinggi dibandingkan dengan menggunakan etanol yang murni. Hal ini disebabkan karena etanol 70% terdiri dari 30% kandungan air sehingga mengakibatkan kepolaran dari pelarut akan meningkat sehingga akan mempermudah dalam proses ekstraksi, etanol 70% akan mengakibatkan penetrasi ke dalam membran seluler untuk mengekstraksi bahan material intraseluler. Alasan lain digunakan pelarut etanol adalah tidak toksik dan lebih aman dibandingkan dengan pelarut metanol ( Tiwari, et al, 2011) .
banyak cairan pelarut yang digunakan dibandingkan dengan menggunakan metode maserasi karena pelarut tersebut terus-menerus akan dimasukkan ke dalam perkolator sampai semua bahan metabolit sekunder tersebut sudah tersari semua dan juga harus selalu diguankan pelarut yang baru sehingga dirasakan kurang efisien dibandingkan dengan metode maserasi ( Tiwari,et al, 2011).
G. Landasan Teori
Penelitian ini bertujuan untuk mengetahui aktivitas antioksidan dan kandungan senyawa fenolik total dari herba selada air (Nasturtium officinale R. Br). Senyawa fenolik total merupakan senyawa golongan flavonoid yang berpotensi sebagai penangkap radikal bebas dengan melepaskan satu atom hidrogennya ke molekul radikal bebas sehingga akan mengalami reaksi reduksi. Radikal bebas merupakan senyawa yang bersifat tidak stabil dan akan berbahaya bagi kesehatan jika masuk ke dalam tubuh dalam kurun waktu yang cukup lama. Oleh karena itu, dilakukan penelitian tentang sumber antioksidan yang berasal dari alam.
kemudian untuk hasil senyawa fenolik total dinyatakan sebagai mg ekivalen asam galat per gram fraksi.
H. Hipotesis
27 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk jenis penelitian eksperimental karena subjek uji diberi perlakuan selama proses penelitian .
B. Variabel Penelitian 1. Variabel bebas
Variabel bebas pada penelitian ini adalah konsentrasi dari rutin dan fraksi etil asetat ekstrak etanolik herba selada air .
2. Variabel terikat
Varibel terikat pada penelitian ini adalah nilai % IC.
3. Variabel pengacau terkendali
Varibel pengacau terkendali pada penelitian ini adalah tempat tumbuh tanaman selada air.
4. Variabel pengacau tak terkendali
C. Definsi Operasional 1. Herba selada air
Herba selada air diperoleh dari perkebunan di Kaliurang, Yogyakarta. Sayuran didapatkan dari pemasok sayuran segar yaitu dari depo sayur segar. Herba selada air yang diguankan dalam penelitian ini adalah keseluruhan herba selada air yang meliputi daun dan batang kecuali akar.
2. Ekstrak etanolik herba selada air
Ekstrak etanolik herba selada air adalah ekstrak kental yang diperoleh dari serbuk selada air dengan menggunakan pelarut etanol teknis 70% dengan metode maserasi. Ekstrak kental didapatkan dengan menggunakan vaccum rotary evaporator.
3. Fraksi etil asetat dari herba selada air.
Fraksi etil asetat herba selada air adalah ekstrak kental yang diperoleh dari ekstrak kental etanolik yang sudah melalui proses farksinasi. Ekstrak kental dari fraksi etil asetat dipekatkan dengan vaccum rotary evaporator .
4. Persen IC.
Persen IC merupakan kemampuan penangkapan fraksi etil asetat untuk menangkap radikal bebas yang diperoleh dari nilai absorbansi.
5. IC50
D. Alat dan Bahan
Pada penelitian ini alat dan bahan yang digunakan adalah sebagai berikut:
1. Alat
Alat –alat yang digunakan adalah spektrofotometer UV-1240, Seperangkat alat –alat gelas dari pyrex, kuvet, vaccum rotary evaporator ( Junke & Kunkle), neraca analitik (Scaltec SBC 22, BP 160P), waterbath ( labo- tech
,Heraeus), blender, oven, printer.
2. Bahan
Bahan-bahan yang diguankan adalah serbuk herba selada air, etanol 70% kualitas farmasetis, wasbensin, etil asetat dari P.T Brataco, rutin, DPPH, reagen Folin-Ciocalteu diperoleh dari Sigma.Chem, metanol p.a. diperoleh dari E. Merck, natrium karbonat, aquadest yang didapat dari laboratorium Farmakognosi-Fitokimia.
E. Tata Cara Penelitian
1. Determinasi tanaman
Determinasi tanaman pada penelitian ini dilakukan di Laboratorium Farmakognosi-Fitokimia, Universitas Sanata Dharma, Yogyakarta.
2. Pengumpulan bahan
jika terlalu lama akan terjadi browning. Pemanenan dilakukan pada bulan Februari 2013.
3. Preparasi sampel
Sampel segar berupa herba selada air sebanyak 4,3 kg dikeringkan dengan menggunakan oven pada suhu 400C selama 2 hari. Setelah itu herba yang sudah kering digiling dengan blender sampai terbentuk serbuk yang halus. Serbuk kemudian dimaserasi dengan menggunakan pelarut etanol 70% selama dua hari . Setelah itu memisahkan ampas dengan pelarut menggunakan corong Buchner. Ampas sisa kemudian diremaserasi selama dua hari. Setelah itu dipisahkan antara pelarut dan ampas dengan menggunakan corong Buchner, kemudian mencampurkan antara pelarut satu dan dua yang diperoleh dari hasil maserasi yang pertama dan hasil remasearsi dan dipekatkan menggunakan vaccum rotary evaporator sampai diperoleh ekstrak kental etanolik. Ekstrak kental etanolik yang diperoleh kemudian dilarutkan dengan menggunakan aquades hangat sebanyak 300 ml, kemudian dipartisi dengan menggunakan wasbensin, fase wasbensin
dibuang dan diambil fase air. Setelah itu fase air dipartisi lagi dengan menggunakan etil asetat, sehingga didapatkan fraksi etil asetat. Fraksi etil asetat yang diperoleh kemudian dipekatkan dengan menggunakan vacum rotary evaporator sampai diperoleh ekstrak kental fraksi etil asetat. Fraksi inilah yang akan digunakan untuk penelitian lebih lanjut.
4. Penetapan kandungan fenolik total
a. Pembuatan kurva baku asam galat
Sebanyak 0,5 ml larutan asam galat 50, 75, 100, 125 dan 150 µg/ml ditambahkan dengan 5 ml larutan reagen Folin- Ciocalteu yang telah diencerkan dengan menggunakan aquadest dengan perbandingan (1:10) kemudian ditambahkan dengan 4,0 ml larutan Na2CO3 1M. Setelah 30 menit, absorbansinya dibaca pada panjang gelombang 760 nm.
b. Optimasi penetapan kandungan fenolik total 1 ) Penentuan OT (Operating Time)
Sebanyak 0,5 ml larutan induk asam galat 50, 100 dan 150 µg/ml ditambahkan dengan 5,0 ml reagen Folin-Ciocalteu yang telah diencerkan dengan aquadest (1:10) dan kemudian ditambahkan dengan 4,0 ml larutan Na2CO3 1M. Absorbansi diukur setiap 5 menit pada panjang gelombang 760 nm selama 40 menit.
2 ) Penentuan panjang gelombang maksimum
Sebanyak 0,5 ml larutan asam galat 50, 100 dan 150 µg/ml ditambahkan dengan 5,0 ml larutan reagen Folin-Ciocalteu yang telah diencerkan dengan aquadest dengan perbandingan (1:10) kemudian ditambahkan dengan 4,0 ml larutan Na2CO3 1 M selanjutnya dilakukan scanning pada panjang gelombang 600- 800 nm.
c. Estimasi penetapan kadar senyawa fenolik total sampel
4,0 ml larutan Na2CO3 1M , diamkan selama 30 menit dan dibaca absorbansinya pada panjang gelombang maksimum 448,6 nm. Kandungan fenolik total dinyatakan sebagai massa ekivalen asam galat ( mg ekivalen asam galat per g fraksi etil asetat).
5. Pembuatan larutan DPPH, pembanding dan uji aktivitas antioksidan a. Pembuatan larutan DPPH
Sejumlah tertentu DPPH dilarutkan dengan menggunakan metanol p.a.
pada labu ukur 10 ml sehingga didapatkan konsentrasi larutan DPPH sebesar 0,4 mM.
b. Pembuatan larutan pembanding 1) Pembuatan larutan induk rutin
Sebanyak 2,5 mg rutin ditimbang dan kemudian dilarutkan metanol p.a
pada labu ukur 10 ml, sehingga didapatkan konsentrasi larutan induk sebesar 250 µg/ml.
2) Pembuatan larutan stok
Dari larutan induk diambil sebanyak 0,6 ml, 0,7 ml, 0,8 ml, 0,9 ml dan 1,0 ml dan kemudian dilarutkan dengan metanol p.a. sehingga diperoleh kadar sebesar 15 µg/ml, 17,5 µg/ml, 20 µg/ml, 22,5 µg/ml dan 25 µg/ml. c. Pembuatan larutan uji
sehingga didapatkan kadar seri larutan uji sebesar 350 µg/ml, 375 µg/ml , 400 µg/ml, 425 µg/ml, 450 µg/ml.
6. Penentuan Operating Time(OT) dan panjang gelombang maksimum uji aktivitas antioksidan
a. Penentuan Operating Time(OT)
Penentuan OT dilakukan untuk melihat waktu yang diperlukan oleh larutin uji dengan DPPH untuk berekasi secara sempurna. Pada penentuan OT ini untuk larutan pembanding dilakukan pada konsentrasi 15 µg/ml, 20 µg/ml , dan 25 µg/ml. Dilakukan pengukuran absorbansi dari menit ke 5 sampai menit ke 60, pembacaan absorbansi dilakukan setiap 5 menit. OT ditandai dengan penurunan absorbansi yang relatif lebih stabil. Dilakukan juga untuk larutan uji sebesar 350 µg/ml, 400 µg/ml dan 450 µg/ml. Dilakukan replikasi sebanyak 3 kali.
b. Pengukuran panjang gelombang maksimum
Pengukuran panjang gelombang maksimum dilakukan pada konsentrasi DPPH sebesar 0,02 mM, 0,04 mM dan 0,08 mM. Dilakukan scanning pada panjang gelombang 400-600 nm, kemudian penentuan panjang gelombang maksimum didapatkan dari hasil ketiga rata-rata pengukuran DPPH dengan tiga konsentrasi yang berbeda.
7. Uji pendahuluan dan estimasi aktivitas antioksidan pada larutan uji dan pembanding
a. Uji pendahuluan
tabung ketiga dengan 1 ml larutan uji sebesar 400 µg/ml dan 1 ml larutan DPPH , setelah itu diamkan selama 30 detik dan amati perubahan warna yang terjadi.
b. Estimasi pengukuran aktivitas antioksidan larutan pembanding
Estimasi pengukuran aktivitas antioksidan dari senyawa pembanding yaitu rutin dilakukan pada seri larutan baku 15 µg/ml, 17,5 µg/ml, 20 µg/ml, 22,5µg/ml dan 25 µg/ml. Setelah itu, direkasikan dengan larutan DPPH 0,4 mM dan diamkan selama OT, yaitu 30 menit dan pengukuran dilakukan pada panjang gelombang maksimum, yaitu 515,5 nm. Pengukuran dilakukan dengan replikasi sebayak 3 kali.
c. Estimasi pengukuran aktivitas antioksidan larutan uji
Estimasi pengukuran aktivitas antioksidan dilakukan pada seri larutan baku sampel 350 µg/ml, 375 µg/ml, 400 µg/ml, 425 µg/ml dan 450 µg/ml. Setelah itu direaksikan dengan larutan DPPH 0,4 mM dan diamkan selama OT, yaitu 30 menit dan pengukuran dilakkukan pada panjang gelombang maksimum yaitu 515,5 nm. Pengukuran dilakukan dengan replikasi sebanyak 3 kali.
F. Analisis Hasil
Analsis hasil untuk pengukuran aktivitas antioksidan yang dinyatakan sebagai % IC dapat dilakukan dengan rumus :
AbsorbansiDPPH– Absorbansi sampel x 100% Absorbansi DPPH
Kemudian dari data itu dianalisis dan dihitung nilai IC50 yang didapatkan
sumbu y adalah nilai % IC dan kemudian dibandingkan terdapat perbedaan yang bermakna antara nilai IC50dari sampel dan pembanding.
36 BAB IV
HASIL dan PEMBAHASAN A.Determinasi Tanaman
Pada percobaan kali ini, peneliti menggunakan sumber acuan yang sesuai dan kemudian dicocokkan dan hasilnya menunjukkan bahwa tanaman yang dimaksud adalah selada air (Nasturtium officinale R. Br) yang digunakan pada penelitian ini.
B.Pengumpulan Bahan
Pengumpulan bahan dilakukan di Kaliurang, Yogyakarta. Pemanenan dilakukan pada pagi hari sebelum matahari terbit dan kemudian sesegera mungkin dibawa ke laboratorium untuk dicuci dan segera dilakukan pengeringan. Pada penelitian ini sampel tanaman herba selada air diperoleh dari pemasok sayuran segar di Yogyakarta yaitu Depo Sayur Segar yang berada di Jalan Monjali. Sampel segar yang diperoleh dipanen pada pagi hari sebelum matahari terbit, tujuannya adalah supaya tidak terjadinya peristiwa browning. Peristiwa Browning
Pemilihan sayur herba selada air yang digunakan tidak boleh ada yang berwarna kuning pada daun ataupun batangnya, karena jika sudah terjadi kekuningan terjadi peristiwa browning yang akan mengakibatkan rusaknya senyawa fenolik di dalam tanaman karena aktivitas enzim polifenol oksidase sehingga tidak dipilih sayuran yang sudah berwarna kekuningan, jadi dipilih sayuran segar yang berwarna hijau. Pemanenan tanaman selada air dilakukan 2 jam setelah matahari terbit karena senyawa polifenol merupakan senyawa yang bersifat termolabil sehingga bila dilakukan pemanenan pada siang hari akan mengakibatkan rusaknya senyawa fenolik yang terdapat di dalam tanaman yang akan dipanen.
C.Hasil Preparasi Sampel 1. Pengeringan
Setelah itu sampel yang sudah dipotong-potong dimasukkan ke dalam oven dengan suhu 400 C selama 2 hari. Penggunaan suhu 40 0C dilakukan supaya tidak merusak senyawa fenolik yang berpotensi sebagai antioksidan karena senyawa fenolik mudah rusak oleh adanya panas.
Tujuan dilakukan pengeringan adalah supaya kandungan air yang terdapat di dalam sampel dapat diuapkan sehingga mengurangi resiko terjadinya kontaminasi dari pertumbuhan bakteri, jamur ataupun organisme lain karena air merupakan salah satu media yang baik untuk pertumbuhan bakteri ataupun organisme hidup lainnya dan lebih mudah untuk dibuat dalam proses penyerbukan. Setelah kering herba yang sudah kering kemudian digiling dan kemudian dijadikan serbuk dan hasil yang didapatkan setelah penyerbukan adalah 151,1 g serbuk kering, jadi rendemennya sebesar 3,513 %.
2. Ekstraksi
senyawa polifenol akan keluar. Penggunaan pelarut etanol 70% yang digunakan dalam proses ekstraksi dengan menggunakan metode maserasi dikarenakan pelarut etanol 70% memiliki polaritas yang lebih tinggi dibandingkan dengan etanol murni yaitu 99- 100 % sehingga senyawa aktif bioflavonoid akan lebih banyak tertangkap pada konsetrasi etanol 70%. Etanol mudah memasuki ke dalam membran sel untuk mengekstraksi bahan-bahan intraseluler dari dalam sel seperti senyawa fenolik dan komponen organik lainnya ( Tiwari,et al, 2007).
Pada penelitian ini metode ekstraksi yang digunakan adalah maserasi tidak menggunakan metode ekstraksi lain yang menggunakan proses pemanasan seperti yang dilakukan dengan penyarian dengan alat Sokletasi, karena senyawa polifenol merupakan senyawa yang bersifat termolabil sehingga bila digunakan dengan penyarian menggunakan alat Sokletasi akan mengakibatkan rusaknya senyawa polifenol yang akan didapatkan. Begitu juga dengan menggunakan metode ekstrkasi dengan cara refluks, dan infundasi karena metode ini juga menggunakan proses pemanasan. Metode perkolasi tidak digunakan dalam penelitian ini karena metode ini memerlukan waktu yang cukup lama dan digunakan cukup banyak pelarut yang akan digunakan, selain itu metode ini juga hanya mendapatkan komponen yang diinginkan tidak terlalu banyak sehingga dipilih dengan metode maserasi.
terdapat gaya tekanan putar sehingga menyebabkan senyawa aktif bioflavonoid yang merupakan metabolit sekunder dapat keluar dari dalam sel menuju ke cairan pelarut. Pelarut etanol yang digunakan menyebabkan perbedaan tekanan osmotik di dalam dan diluar sel sehingga air masuk ke dalam sel tumbuhan dan menyebabkan zat aktif yang berada di dalam sel tumbuhan akan keluar, peristiwa tersebut akan terus berulang hingga terjadi keseimbangan antara larutan didalam sel dan didalam sel. Setelah dua hari perendaman kemudian untuk memisahkan antara ampas dengan pelarut dengan menggunakan corong Buchner dengan tujuan untuk memisahkan antara pelarut dengan serbuk, digunakan juga dengan bantuan pompa vakum untuk mempermudah proses ekstraksi
Sampel diremaserasi kembali dengan menggunakan pelarut etanol 70% selama dua hari dengan tujuan supaya jika masih ada metabolit sekunder yang masih belum tersari saat dilakukan maserasi yang pertama diharapakan dapat tersari pada maserasi yang kedua, kemudian setelah dua hari dipisahkan kembali antara pelarut dan serbuk dan kemudian dicampur dengan hasil masearsi yang pertama, selanjutnya untuk mendapatkan ekstrak etanolik yang kental digunakan
dari hasil itu didapatkan berat ekstrak etanolik kental sebesar 30,8629 g dengan rendemen sebesar 20,425% dihitung dari serbuk kering yang diperoleh.
3. Fraksinasi
Setelah didapatkan ekstrak etanolik yang kental, dilanjutkan dengan fraksinasi adapun tujuan dilkukannya fraksinasi adalah untuk mendapatkan komponen senyawa spesifik yang akan dicari. Pada penelitian ini senyawa yang dicari adalah senyawa fenolik yang terkandung dalam sel tanaman. Pelarut etanol yang digunakan dalam proses maserasi selain melarutkan senyawa fenolik tetapi selain itu juga dapat melarutkan senyawa organik lainnya yang tidak dikehendaki seperti lipid, klorofil dan senyawa organik lainnya, oleh karena itu untuk mendapatkan senyawa fenolik yang dituju perlu dilakukan fraksinasi.
Proses fraksinasi pada penelitian ini dilakukan dengan melarutkan sampel dari hasil ekstraksi yang menghasilkan ekstrak kental etanolik dengan menggunakan 300 ml air hangat dengan tujuan untuk melarutkan ekstrak etanolik yang sudah didapatkan supaya dapat dilakukan ekstraksi cair-cair. Pada ekstraksi cair-cair pada prinsipnya menggunakan dua macam pelarut yang berbeda yang nantinya akan digojog sehingga diharapkan senyawa yang dituju dapat terambil pada salah satu pelarut yang digunakan selama proses fraksinasi.
dalam sel tanaman ( Dai, et al, 2010). Selanjutnya campuran antara air dan wasbensin tersebut digojog dengan menggunakan corong pisah dengan tujuan supaya senyawa nonpolar dapat tertarik dari ke dalam fase wasbensin. Fraksi wasbensin berada di atas air hal tersebut disebabkan karena adanya perbedaan dari berat jenis antara kedua pelarut yang digunakan dalam fraksinasi itu. Adapun berat jenis untuk air 0,996 sedangkan berat jenis untuk wasbnesin adalah 0,730 (Anonim,1995). Fraksi air yang didapatkan kemudian digunakan kembali untuk dilakukan fraksinasi lagi dengan menggunakan etil asetat sedangkan fase wasbenin dibuang.
Proses fraksinasi pada penelitian dilakukan dengan 3 kali pemisahan yaitu masing-masing 100 ml untuk setiap kali melakukan fraksinasi, hal ini bertujuan supaya didapatkan hasil fraksinasi yang optimal karena menurut hukum Nerst koefisen distribusi (KD) merupakan perbandingan antara zat terlarut di dalam kedua pelarut yang tidak saling campur yang nantinya akan berpindah karena terjadi kejenuhan dan berdistribusi ke salah satu pelarut karena perbedaan kepolarannya, sehingga untuk mendapatkan hasil yang baik diperlukan beberapa kali proses fraksinasi.
memiliki sifat semi-polar. Salah satu senyawa fenolik yang dapat tertarik masuk ke dalam fraksi etil asetat adalah flavonoid.
Fraksinasi dengan menggunakan fraksi etil asetat juga untuk memisahkan bentuk glikon (terikat dengan gula) dan aglikonnya (bentuk tidak terikat dengan gula), sedangkan senyawa lain yang masuk ke dalam fraksi air adalah senyawa fenolik yang bersifat polar dan dalam bentuk aglikon. Pada penelitian ini yang diambil adalah fraksi dari etil asetat, dalam corong pisah fraksi etil asetat akan berada di bagian bawah sedangkan fraksi air akan berada di bagian atas hal ini disebabkan karena perbedaan dari berat jenis. Berat jenis untuk air adalah 0,996 sedangkan berat jenis untuk etil asetat adalah 0,898 (Anonim, 1995).
Setelah dilakukan pemisahan dengan menggunakan corong pisah didapatkan fraksi etil asetat ekstrak etanolik herba selada air kemudian dipekatkan dengan menggunakan vaccum rotary evaporator, setelah didapatkan ekstrak kental fraksi etil asetat ekstrak etanolik setelah bobot tetap adalah 1,3043 g, kemudian ekstrak kental disimpan di dalam desikator dengan ditutup aluminium foil dengan tujuan supaya terhindar dari cahaya matahari secara langsung yang dikhawatirkan dapat merusak senyawa fenolik yang berpotensi sebagai antioksidan sehingga mempengaruhi hasil dalam penelitian.
D.Hasil Uji Pendahuluan 1. Uji pendahuluan kandungan senyawa fenolik total
dari herba selada air. Uji pendahuluan yang digunakan pada penelitian ini menggunakan metode yang digunakan adalah dengan metode Folin-Ciocalteu. Metode ini akan mengakibatkan terjadinya reduksi dari ion fenolat dan senyawa lain yang bisa tereduksi, sehingga akan terjadi perubahan warna menjadi biru pada susana yang basa.
Pada uji pendahuluan ini untuk melihat adanya kandungan senyawa fenolik yang terdapatr pada sampel, dilakukan tiga tabung yang berisi kontrol positif, kontrol negatif dan sampel. Kontrol positif yang berisi reagen Folin-Ciocalteu, larutan natrium karbonat 1M dan larutan pembanding asam galat dengan konsentrasi 100 µg/ml, sedangkan kontrol negatif yang berisi reagen Folin-Ciocalteu dan larutan natrium karbonat dan sampel yang berisi larutan sampel dengan konsentrasi 500 µg/ml, selanjutnya ditambahkan dengan reagen kontrol negatif yang berisi reagen Folin-Ciocalteu, larutan Na2CO3 dan larutan metanol p.a. : air (1:1). Kemudian didiamkan selama 30 detik dan diamati perubahan warna yang terjadi.
[image:63.595.100.514.166.684.2]
Gambar 4. Uji pendahuluan kandungan senyawa fenolik total
Keterangan : tabung A ( fraksi etil asetat + Folin-Ciocalteu + Na2CO3), tabung B (asam
Setelah dilakukan pengamatan dapat dilihat bahwa terjadi perubahan warna menjadi biru tua pada kontrol positif dan terjadi pula perubahan warna menajdi biru yang terdapat pada larutan uji, tetapi tidak terjadi perubahan warna pada kontrol negatif. Hal ini dapat disimpulkan bahwa sampel uji mengandung senyawa fenolik yang dibuktikan dengan terajdinya perubahan warna menjadi biru karena terjadi proses reduksi oleh reagen Folin-Ciocalteu pada suasana yang basa.
2.Uji pendahuluan aktivitas antioksidan
Uji pendahuluan ini bertujuan untuk melihat ada atau tidaknya aktivitas antioksidan yang terdapat pada fraksi etil asetat ekstrak etanolik dari herba selada air . Metode uji pendahuluan yang dilakukan pada penelitian ini termasuk ke dalam metode kualitatif karena hanya dilakukan pengamatan. Uji pendahuluan antioksidan akan memberika hasil positif yang ditandai dengan berubahnya warna DPPH dari ungu tua menjadi kekuningan hal ini dapat disebabkan karena terjadi penguarangan aktivitas dari radikal DPPH karena ditangkap oleh senyawa yang berpotensi sebagai antioksidan sehingga terbentuk senyawa DPPH yang tereduksi.
Gambar 5. Uji pendahuluan aktivitas antioksidan
Keterangan : tabung A ( DPPH + metanol p.a.), tabung B ( fraksi etil asetat
ekstrak etanolik + DPPH + metanol p.a. dan tabung C ( rutin + DPPH + metanol
p.a.)
Dari ketiga perlakuan tersebut dibandingkan warna ketiga larutan tersebut setelah didiamkan selama 30 detik. Dari hasil percobaan didapatkan bahwa terjadi perubahan warna untuk kontrol positif yaitu dari warna ungu menjadi kuning begitu juga dengan larutan uji yang berisi sampel dan DPPH akan tetapi tidak terjadi perubahan warna pada kontrol negatif yang berisi larutan DPPH dan metanol p.a. kemudian dapat disimpulkan bahwa terdapat aktivitas antioksidan yang terdapat dalam sampel yang ditunjukkan dengan terjadinya perubahan warna menjadi kuning seperti yang terjadi pula pada kontrol positif.
E.Hasil Optimasi Penetapan Kandungan Fenolik Total 1. Penetapan Operating Time(OT)
besar yang digunakan untuk menentukan OT. Pengukuran dilakukan pada panjang gelombang maksimum,yaitu 760 nm.
Gambar 6. Penentuan Operating Time(OT) asam galat replikasi 2
Dari gambar 6 dapat dilihat bahwa pada menit ke dua puluh lima , semua asam galat dengan konsentrasi yang berbeda yaitu 50, 75 , dan 100 µg/ml telah bereaksi sempurna dengan reagen Folin-Ciocalteu pada suasana basa , hal ini ditandai dengan absorbansi yang sudah mulai stabil pada menit ke 30, sehingga dari data diatas dapat disimpulkan bahwa operating time untuk penentuan kandungan asam galat dengan Folin-Ciocalteu adalah 30 menit.
2. Pengukuran panjang gelombang maksimum
Dilakukan pada tiga konsentrasi dari asam galat yang berbeda yaitu konsentrasi kecil, sedang dan tinggi. Pengukuran panjang gelombang maksimum dilakukan setelah Operating Time (OT) supaya didapatkan serapan yang maksimal.
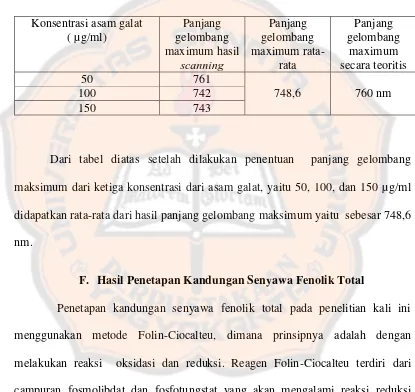
Tabel I. Penentuan panjang gelombang maksimum asam galat
Konsentrasi asam galat ( µg/ml) Panjang gelombang maximum hasil scanning Panjang gelombang maximum rata-rata Panjang gelombang maximum secara teoritis
50 761
748,6 760 nm
100 742
150 743
Dari tabel diatas setelah dilakukan penentuan panjang gelombang maksimum dari ketiga konsentrasi dari asam galat, yaitu 50, 100, dan 150 µg/ml didapatkan rata-rata dari hasil panjang gelombang maksimum yaitu sebesar 748,6 nm.
F. Hasil Penetapan Kandungan Senyawa Fenolik Total
yang akan diukur sebagai senyawa fenol yang dapat diukur pada panjang gelombang maksimum yang telah didapatkan, yaitu 748,6 nm.
Penelitian ini dilakukan penetapan kandungan fenolik total pada fraksi etil asetat ekstrak etanolik karena peneliti ingin mengetahui hubungan aktivitas antiokisdan dengan kandungan fenolik totalnya. Senyawa fenolik yang terdapat di dalam tumbuhan termasuk salah satu senyawa golongan flavonoid yang berpotensi sebagai antioksidan dengan mendonorkan ion hidrogennya pada gugus hidroksilnya ketika berekasi dengan senyawa radikal melalui mekanisme transfer elektron sehingga proses oksidasi dapat dihambat dan menyebabkan aktivitas radikal bebas menjadi menurun.
Penentuan kandungan fenolik total pada sampel fraksi etil asetat ekstrak etanolik herba selada air dengan metode Folin-Ciocalteu ditujukkan untuk mengetahui kandungan kandungan fenolik total yang terdapat dalam sampel. Kandungan fenolik total memiliki korelasi dengan aktivitas antioksidan, semakin tinggi kandunagn fenolik total maka aktivitas antioksidannya akan semakin meningkat sedangkan bila kandungan fenolik total dalam sampel rendah maka aktivitas antiokisdannya akan semakin rendah pula ( Anesini, Ferarro, and Filip, 2008), Oleh karena itu dilakukan penelitian mengenai kandungan fenolik total dalam sampel fraksi etil asetat ekstrak etanolik herba selada air.
merupakan senyawa fenolik yang biasa dipakai sebagai penetapan kandungan fenolik total dengan metode Folin-Ciocalteu, selain itu asam galat mudah didapatkan dan memiliki harga yang cukup murah .
COOH
OH
[image:69.595.100.515.194.671.2]OH HO
Gambar 7. Struktur asam galat
Tabel II. Tabel persamaan regresi linier dari baku asam galat
Replikasi Konsentrasi asam galat ( µg/ml)
Absorbansi Persamaan regresi linier
1
50 0,313 A = 0,1096
B = 4,14.10-3 r = 0,9990 y = 4,14.10-3x + 0,1906
75 0,420
100 0,535
125 0,619
150 0,731
2
49 0,329 A = 0,1038
B = 4,644.10-3 r = 0,9996 y = 4,644.10-3x +0,1038
74 0,445
99 0,572
124 0,680
149 0,792
3
50 0,305 A = 0,0942
B = 4,268. 10-3 r =0,9995
y = 4,268.10-3x +0,0942
75 0,412
100 0,528
125 0,631
150 0,729
regresi linier dengan nilai r yang tertinggi yaitu pada replikasi 2 dengan nilai r 0,9996 dan persamaan regresi linier yang didapatkan adalah y = 4,644.10-3x + 0,1038.
Tabel III. Tabel kandungan senyawa fenolik total fraksi etil asetat ekstrak etanolik herba selada air
Sampel (µg/ml)
Absorbansi Kandungan fenolik (µg/ml) Kandungan fenolik total (mg ekivalen asam galat per gram fraksi) Rata-rata ( mg ekivalen asam galat per gram fraksi ) SD (%) ( mg ekivalen asam galat per gram fraksi)
500 0,401 63,996 6,390
6,463 0,066
500 0,407 65,288 6,520
510 0,411 66,149 6,480
[image:70.595.101.517.231.565.2]G. Hasil Optimasi Penentuan Aktivitas Antioksidan 1. Penentuan Operating Time (OT).
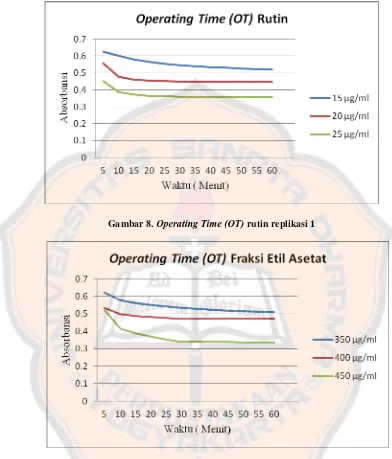
Penentuan Operating Time (OT) bertujuan untuk mengetahui waktu dimana sudah terjadi reaksi yang optimal antara DPPH dengan rutin ataupun dengan fraksi etil asetat ekstrak etanolik herba selada air sehingga dapat mengurangi kesalahan bias dalam penelitian ini pada saat pembuatan kurva baku . Penentuan Operating Time (OT) pada penelitian ini ditandai dengan penurunan absorbansi setiap satuan waktu yang menandakan jumlah DPPH yang tertangkap oleh senyawa yang berpotensi sebagai antioksidan, jika penurunan dari absorbansi sudah menunjukkan absorbansi yang cukup stabil menunjukkan bahwa waktu itu sudah menunjukkan Operating Time (OT).
Gambar 8. Operating Time (OT) rutin replikasi 1
Gambar 9. Operating Time fraksi etil asetat ekstrak etanolik herba selada air
replikasi 3
sehingga dapat disimpulkan bahwa pada menit ke 30 merupakan Operating Time
untuk penentuan aktivitas antioksidan rutin dan fraksi etil asetat ekstrak etanolik herba selada air.
2.Penentuan panjang gelombang maksimum
Penentuan panjang gelombang maksimum bertujuan untuk melihat panjang gelombang dari larutan DPPH yang dapat memberikan hasil pengukuran yang maksimal. Hasil dari penentuan panjang gelombang maksimum digunakan untuk melakukan pengukuran terhadap kurva baku rutin dan sampel dalam penentuan aktivitas antioksidan .
[image:73.595.105.516.212.699.2]Pengukuran panjang gelombang maksimum dilakukan terhadap tiga konsentrasi larutan DPPH yang berbeda, kemudian untuk menentukan panjang gelombang maksimum dimabil rata-rata dari ketiga konsentrasi larutan DPPH teresebut. Pengkuran dilakukan dengan melakukan scanning dari panjang gelombang 400- 600 nm, adapun panjang gelombang maksimum DPPH secara teoritis adalah 517 nm.
Tabel IV. Penentuan panjang gelombang maksimum DPPH
Konsentrasi larutan DPPH Hasil scannning pengukuran panjang gelombang max larutan DPPH
Rata –rata panjang gelombang
Panjang gelombang secara teoritis
0,02 Mm 515,5 nm
515,5 nm 517 nm
0,04 Mm 515,5 nm
0,08 Mm 515,5 nm
Dari hasil pengkuran ketiga konsentarsi larutan DPPH diperoleh bahwa rata-rata panjang gelombang maksimum yang diperoleh adalah 515,5 nm.