(Carica papaya L.)
IRMA HERAWATI
PROGRAM STUDI BIOLOGI FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA
2020 M / 1441 H
i SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Pada Program Studi Biologi Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
IRMA HERAWATI 11160950000071
PROGRAM STUDI BIOLOGI FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA
2020 M / 1441 H
ii SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Pada Program Studi Biologi Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
IRMA HERAWATI 11160950000071
Menyetujui:
Mengetahui, Pembimbing I,
Dr. Megga Ratnasari Pikoli, M.Si NIP. 19720322 200212 2 002
Ketua Program Studi Biologi Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
Dr. Priyanti, M.Si.
NIP. 19750526 200012 2 001
Pembimbing II,
Aerma Hastuty, M.Si NIP. 19780320 200604 2 033
iii dari Daun Tanaman Pepaya (Carica papaya L.)” yang ditulis oleh Irma Herawati, NIM. 11160950000071 telah diuji dan dinyatakan LULUS dalam sidang Munaqosyah Fakultas Sains dan Teknologi Universitas Islam Negeri Syarif Hidayatullah Jakarta pada tanggal 10 Agustus 2020. Skripsi ini telah diterima sebagai salah satu syarat untuk memperoleh gelar Sarjana Strata Satu (S1) Program Studi Biologi.
Menyetujui:
Mengetahui, Penguji I,
Dr. Dasumiati, M.Si NIP. 19730923 199903 2 002
Penguji II,
Etyn Yunita, M.Si NIP. 19700628 201411 2 002
Pembimbing I,
Dr. Megga Ratnasari Pikoli, M.Si NIP. 19720322 200212 2 002
Pembimbing II,
Aerma Hastuty, M.Si NIP. 19780320 200604 2 033
Dekan Fakultas Sains dan Teknologi
Prof. Dr. Lily Surayya Eka Putri, M.Env.Stud.
NIP. 19690404 200501 2 005
Ketua Program Studi Biologi
Dr. Priyanti, M.Si NIP. 19750526 200012 2 001
iv DENGAN INI SAYA MENYATAKAN BAHWA SKRIPSI INI ADALAH BENAR HASIL KARYA SENDIRI YANG BELUM PERNAH DIAJUKAN SEBAGAI SKRIPSI ATAU KARYA ILMIAH PADA PERGURUAN TINGGI ATAU LEMBAGA MANAPUN.
Jakarta, Agustus 2020
Irma Herawati 11160950000071
v KATA PENGANTAR
Bismillahirrahmanirrahim
Puji syukur kehadirat Allah subhanahu wa ta‟ala karena atas rahmat dan karunia-Nya yang senantiasa dilimpahkan kepada semua makhluknya. Shalawat serta salam dicurahkan kepada Nabi Muhammad shallallahu „alaihi wa sallam yang telah memimpin manusia menuju jalan yang diridhoi Allah subhanahu wa ta‟ala. Berkat rahmat Allah subhanahu wa ta‟ala, penulis dapat menyelesaikan skripsi yang berjudul “Aktivitas Enzim Protease Kapang Endofit yang diisolasi dari Daun Tanaman Pepaya (Carica papaya L.)” dalam rangka Tugas Akhir sebagai syarat untuk memperoleh gelar Sarjana Sains pada Program Studi Biologi di Fakultas Sains dan Teknologi Universitas Islam Negeri Syarif Hidayatullah Jakarta.
Penulis ingin mengucapkan terima kasih karena adanya dukungan dari banyak pihak yang terkait, untuk itu penulis berterima kasih kepada:
1. Prof. Dr. Lily Surayya Eka Putri, Env.Stud. selaku Dekan Fakultas Sains dan Teknologi Universitas Islam Negeri Syarif Hidayatullah Jakarta.
2. Dr. Priyanti, M.Si. selaku Ketua Program Studi Biologi, Fakultas Sains dan Teknologi, Universitas Islam Negeri Syarif Hidayatullah Jakarta dan selaku Dosen penguji seminar proposal dan seminar hasil penelitian.
3. Dr. Megga Ratnasari Pikoli, M. Si. selaku Dosen pembimbing I.
4. Aerma Hastuty, M.Si. selaku Dosen pembimbing II.
5. Arina Findo Sari, M.Si. selaku Dosen penguji seminar proposal dan seminar hasil penelitian.
6. Dr. Novik Nurhidayat selaku Kepala Laboratorium Mikrobiologi Kesehatan.
7. Kepala Pusat Penelitian Biologi dan Kepala InaCC-LIPI.
8. Semua pihak yang telah membantu penulis dalam menyelesaikan penulisan skripsi yang tidak dapat disebutkan satu persatu.
Jakarta, Agustus 2020
Penulis
vi ABSTRAK
Irma Herawati. Aktivitas Enzim Protease Kapang Endofit yang diisolasi dari Daun Tanaman Pepaya (Carica papaya L.). Skripsi. Program Studi Biologi.
Fakultas Sains dan Teknologi. Universitas Islam Negeri Syarif Hidayatullah Jakarta. 2020. Dibimbing oleh Megga Ratnasari Pikoli dan Aerma Hastuty.
Tanaman pepaya merupakan salah satu tanaman yang mengandung enzim protease. Kapang endofit menghasilkan senyawa bioaktif yang dapat menjadi sumber produk alami terbarukan, salah satunya enzim protease. Isolat kapang endofit daun pepaya yang digunakan adalah JE-DP4, JE-BP1, dan JE-BP3.
Penelitian ini bertujuan untuk menganalisis potensi kapang endofit daun pepaya sebagai penghasil enzim protease. Pengukuran aktivitas enzim protease menggunakan metode Chow dan Peticolas. Kadar protein diukur menggunakan metode Bradford. Aktivitas enzim protease diukur pada λ280 nm dan kadar protein pada λ595 nm menggunakan Spektrofotometer UV-Vis. Aktivitas enzim protease diukur pada ketiga suhu diantaranya 30°C, 37°C, dan 44°C; waktu inkubasi selama 7 hari, substrat media produksi enzim berupa kasein dan susu skim, serta diukur pH pertumbuhannya. Hasil penelitian menunjukkan aktivitas enzim protease tertinggi menggunakan substrat kasein sebesar 46,72 U/mL sedangkan menggunakan substrat susu skim sebesar 11,30 U/mL. Kadar protein tertinggi menggunakan substrat kasein sebesar 0,107 mg/mL sedangkan menggunakan substrat susu skim sebesar 0,068 mg/mL. Isolat kapang endofit JE- DP4 memiliki kemampuan terbaik menghasilkan enzim protease dibandingkan JE-BP1 dan JE-BP3. Rata-rata aktivitas enzim protease tertinggi isolat JE-DP4 pada suhu 37°C sebesar 22,64 U/mL, waktu inkubasi hari ke-7, dan pH pertumbuhan sebesar 6 menggunakan substrat kasein.
Kata kunci: Endofit; Kapang; Protease; Protein; Tanaman pepaya
vii ABSTRACT
Irma Herawati. Protease Enzyme Activity of Endophytic Fungi Isolated from the Leaves of Papaya Plant (Carica papaya L.). Undergraduate Thesis.
Department of Biology. Faculty of Science and Technology. State Islamic University Syarif Hidayatullah Jakarta. 2020. Advised by Megga Ratnasari Pikoli and Aerma Hastuty.
Papaya plant is a plant that contains protease enzymes. Endophytic fungi produce bioactive compounds that can be a source renewable natural product, one of which is protease enzymes. The papaya leaf endophytic fungi isolates used were JE- DP4, JE-BP1, and JE-BP3. This research aimed to analyze the potential of papaya leaf endophytic fungi as a protease enzyme producer. The protease enzyme activity was measured using the Chow and Peticolas method. Protein content was measured using the Bradford method. Protease enzyme activity was measured at λ280 nm and protein content at λ595 nm using a UV-Vis Spectrophotometer. The protease enzyme activity was measured at three temperatures including 30°C, 37°C, 44°C; incubation times for 7 days, enzyme production media substrates in the form of casein and skim milk and the pH of the growth was measured. The results showed the highest protease enzyme activity using casein substrate was 46,72 U/mL while using skim milk substrate was 11,30 U/mL. The highest protein content using a casein substrat of 0,107 mg/mL while using a skim milk substrate of 0,068 mg/mL. JE-DP4 endophytic fungi isolate had the best ability to produce protease enzymes compared to JE-BP1 and JE-BP3. The highest average protease enzyme activity of JE-DP4 isolate at 37°C was 22,64 U/mL minutes, incubation time was 7th days, and growth pH was 6 using casein substrate.
Keywords: Endophytic; Fungi; Papaya plant; Protease; Protein
viii DAFTAR ISI
Halaman
KATA PENGANTAR ... v
ABSTRAK ... vi
DAFTAR ISI ... viii
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
BAB I. PENDAHULUAN 1.1. Latar Belakang ... 1
1.2. Rumusan Masalah ... 3
1.3. Tujuan Penelitian ... 3
1.4. Manfaat Penelitian ... 3
1.5. Kerangka Berpikir Penelitian ... 4
BAB II. TINJAUAN PUSTAKA 2.1. Tanaman Pepaya ... 5
2.1.1. Klasifikasi Tanaman Pepaya ... 5
2.1.2. Kandungan Kimiawi Tanaman Pepaya ... 6
2.2. Mikroorganisme Endofit ... 7
2.2.1. Kapang Endofit ... 9
2.3. Enzim Protease ... 11
2.3.1. Mekanisme Kerja Enzim ... 12
2.3.2. Manfaat Enzim Protease ... 14
2.4. Protein ... 14
2.4.1. Asam Amino Penyusun Protein ... 15
2.4.2. Tingkatan Struktur Protein ... 16
BAB III. METODE PENELITIAN 3.1. Waktu dan Tempat ... 17
3.2. Alat dan Bahan ... 17
3.3. Rancangan Penelitian... 17
3.4. Cara Kerja ... 18
3.4.1. Pembuatan Media Potato Dextrose Agar (PDA) ... 18
3.4.2. Pembuatan Media Skim Milk Agar (SMA) ... 18
3.4.3. Pembuatan Media Czapek Dox Broth (CZA) ... 18
3.4.4. Peremajaan Kapang Endofit ... 19
3.4.5. Skrining Aktivitas Enzim Protease ... 19
3.4.6. Pembuatan Kurva Standar Bovine Serum Albumin (BSA) ... 19
3.4.7. Pembuatan Kurva Standar Tirosin ... 20
3.4.8. Produksi Enzim Protease ... 20
3.4.9. Pengukuran Aktivitas Enzim Protease ... 21
3.4.10. Pengukuran Kadar Protein ... 21
3.5. Analisis Data ... 22
ix BAB IV. HASIL DAN PEMBAHASAN
4.1. Skrining Aktivitas Enzim Protease Kapang Endofit ... 23
4.2. pH Pertumbuhan Kultur pada Media Produksi Enzim Protease ... 25
4.3. Pengaruh Suhu dan Waktu Inkubasi terhadap Aktivitas Protease .... 28
4.4. Pengaruh Substrat Media Produksi terhadap Aktivitas Protease ... 36
4.5. Kadar Protein ... 38
BAB V. KESIMPULAN DAN SARAN 5.1. Kesimpulan ... 41
5.2. Saran ... 41
DAFTAR PUSTAKA ... 42
LAMPIRAN ... 51
x DAFTAR TABEL
Halaman Tabel 1. Kandungan kimiawi bagian tanaman pepaya... 6 Tabel 2. Hasil skrining aktivitas enzim protease kapang endofit... 23
xi DAFTAR GAMBAR
Halaman
Gambar 1. Kerangka berpikir penelitian ... 4
Gambar 2. Morfologi tanaman pepaya... 5
Gambar 3. Isolat kapang endofit daun tanaman pepaya ... 11
Gambar 4. Fase reaksi enzimatik ... 14
Gambar 5. Pembentukan ikatan peptida... 15
Gambar 6. Asam amino penyusun protein ... 16
Gambar 7. Nilai pH pertumbuhan kapang endofit JE-DP4... 26
Gambar 8. Nilai aktivitas enzim protease kapang endofit JE-DP4 ... 29
Gambar 9. Nilai aktivitas enzim protease kapang endofit JE-DP4 ... 33
Gambar 10. Nilai kadar protein enzim protease kapang endofit JE-DP4 ... 39
xii DAFTAR LAMPIRAN
Halaman
Lampiran 1. Komposisi reagen ... 51
Lampiran 2. Hasil pengukuran larutan dan kurva standar tirosin ... 52
Lampiran 3. Hasil pengukuran larutan dan kurva standar BSA ... 53
Lampiran 4. Nilai pH pertumbuhan kapang endofit JE-DP4 ... 54
Lampiran 5. Konsentrasi tirosin yang dilepaskan hasil hidrolisis protein ... 55
Lampiran 6. Peremajaan kapang endofit daun pepaya... 56
Lampiran 7. Skrining aktivitas enzim protease kapang endofit ... 57
Lampiran 8. Hasil uji statistik normalitas data substrat kasein ... 61
Lampiran 9. Hasil uji statistik homogenitas data substrat kasein ... 61
Lampiran 10. Hasil uji statistik Kruskal-Wallis data substrat kasein ... 62
Lampiran 11. Hasil uji statistik normalitas data substrat susu skim ... 64
Lampiran 12. Hasil uji statistik homogenitas data substrat susu skim ... 64
Lampiran 13. Hasil uji statistik anova satu jalur data substrat susu skim ... 65
Lampiran 14. Dokumentasi penelitian ... 66
1 BAB I
PENDAHULUAN 1.1. Latar Belakang
Perkembangan ilmu bioteknologi menjadikan enzim sebagai salah satu alternatif untuk memenuhi keperluan industri dan pengobatan. Salah satu enzim yang banyak digunakan adalah enzim protease (Noviyanti, Ardiningsih, &
Rahmalia, 2013). Enzim protease merupakan kelompok besar enzim yang mengkatalisis hidrolisis ikatan peptida pada protein. Pembelahan ikatan peptida menyebabkan degradasi substrat protein menjadi asam amino penyusunnya (de Souza et al., 2015). Enzim protease mewakili salah satu dari 3 kelompok enzim industri terbesar yang menyumbang sekitar 59% dari total penjualan enzim global (Mahajan & Badgujar, 2010).
Enzim protease tersebar luas hampir di seluruh tanaman, hewan, dan mikroorganisme. Sumber enzim protease terbesar berasal dari tanaman yang menempati peringkat teratas sebesar 43,85%; diikuti oleh bakteri 18,09%; kapang 15,08%; hewan 11,15%; alga 7,42%; dan virus 4,41% (Mahajan & Badgujar, 2010). Tanaman sebagai sumber enzim protease dibatasi oleh tersedianya lahan dan kondisi pertumbuhan yang cocok. Produksi enzim protease dari tanaman dan hewan juga tidak mudah serta sangat memakan waktu (Susanti, 2003). Sumber enzim protease dari mikroorganisme lebih disukai karena pertumbuhannya yang cepat, mudah dimanipulasi secara genetik sehingga lebih banyak dikembangkan, dan memiliki karakteristik yang diinginkan dalam aplikasi bioteknologi (Pratush, Gupta, & Bhalla, 2013).
Tanaman menjadi inang bagi komunitas mikroorganisme endofit yang dapat menghasilkan sejumlah besar senyawa biologis. Endofit adalah mikroorganisme bakteri atau kapang yang berkoloni di jaringan tanaman sehat secara interseluler atau intraseluler tanpa menimbulkan gejala penyakit yang jelas (Nair &
Padmavathy, 2014). Senyawa bioaktif yang dihasilkan dapat menjadi sumber produk alami yang terbarukan (Eze et al., 2018). Tanaman pepaya merupakan salah satu tanaman yang mengandung enzim protease (Amazu et al., 2010).
Kapang endofit banyak terdapat di daun karena daun memiliki stomata dan
pembuluh vaskular yang menjadi jalur masuk mikroorganisme endofit (Eze et al., 2019; Khan, Shahzad, Choudhary, Khan, & Ahmad, 2010).
Hasil penelitian sebelumnya mengenai isolasi dan skrining kapang endofit daun tanaman pepaya telah dilaporkan oleh Puspitarini (2019), sebanyak 13 isolat kapang endofit berhasil diisolasi dari daun pepaya. Tujuh isolat dari 13 isolat kapang endofit berpotensi menghasilkan enzim protease. Ketiga isolat kapang endofit dari 7 isolat yang digunakan belum diukur aktivitas enzim proteasenya, yaitu JE-DP4, JE-BP1, dan JE-BP3. Ketiga isolat kapang endofit tersebut belum diketahui identitasnya. Identifikasi dilakukan untuk membandingkan aktivitas enzim protease termasuk tinggi atau rendah dan mengetahui kapang endofit tidak bersifat patogen. Penelitian lain terkait enzim protease tanaman pepaya telah dilaporkan oleh Konno et al. (2004), papain termasuk ke dalam protease sistein yang terdapat pada getah daun pepaya bersifat toksik terhadap serangga herbivora ulat sutra. Aktivitas enzim protease pada getah pepaya sebesar 257,621 U/mg.
Keragaman enzim protease telah menarik perhatian dunia untuk mengeksploitasi aplikasi fisiologis dan bioteknologinya (Rani, Rana, & Datt, 2012). Pemanfaatan kapang endofit sebagai salah satu sumber penghasil enzim protease perlu ditingkatkan untuk memenuhi kebutuhan industri pangan dan kesehatan karena kapang memiliki enzim yang lebih luas daripada bakteri.
Kapang mampu menghasilkan enzim protease asam, netral, atau basa sedangkan bakteri hanya mampu menghasilkan enzim protease netral atau basa (Pratush et al., 2013). Enzim protease kapang yang banyak digunakan dalam aplikasi industri adalah protease aspartat untuk pembuatan keju, sebagai produk memperlancar pencernaan, penjernihan bir, pengubah protein makanan, dan hidrolisat protein (Vishwanatha, Rao, & Singh, 2010). Berdasarkan latar belakang tersebut, penelitian ilmiah mengenai enzim protease yang dihasilkan oleh kapang endofit daun tanaman pepaya untuk menganalisis potensi kapang endofit dalam menghasilkan enzim protease.
Aktivitas enzim protease dipengaruhi oleh faktor lingkungan seperti suhu, pH pertumbuhan, waktu inkubasi, dan substrat protein (Saranraj, Jayaprakash, &
Bhavani, 2017). Suhu berpengaruh terhadap aktivitas enzim untuk mengetahui kondisi yang sesuai dalam mendegradasi substrat (Baehaki & Rinto, 2012). Waktu
inkubasi pertumbuhan kapang memengaruhi jumlah biomassa kapang dan produksi enzim protease (Indarmawan, Mustopa, Budiarto, & Tarman, 2016). pH kultur memengaruhi proses enzimatik dan transportasi berbagai komponen melintasi membran sel untuk mendukung pertumbuhan sel dan produksi enzim (K. M. Sharma, Kumar, Panwar, & Kumar, 2017). Produksi enzim protease membutuhkan substrat protein yang bertindak sebagai induser bagi enzim protease (Yuniati, Nugroho, & Puspita, 2015). Substrat protein yang digunakan dalam media produksi enzim protease berupa kasein dan susu skim. Kasein dan susu skim termasuk substrat spesifik alami yang sering digunakan untuk pengukuran enzim protease (Dhillon, Sharma, Rajulapati, & Goyal, 2016).
Pengukuran pH media pertumbuhan untuk menentukan aktivitas enzim tertinggi pada pH yang sesuai. Pengujian aktivitas enzim protease kapang endofit daun pepaya pada beberapa suhu, waktu inkubasi, dan penggunaan 2 jenis substrat untuk meningkatkan aktivitas enzim sehingga menjadi efektif dan layak secara ekonomi.
1.2. Rumusan Masalah
Rumusan masalah dari penelitian ini antara lain:
1. Isolat kapang endofit mana yang memiliki kemampuan terbaik menghasilkan enzim protease?
2. Substrat protein mana yang menghasilkan enzim protease lebih tinggi?
3. Berapakah suhu, waktu inkubasi, dan pH pertumbuhan yang paling sesuai untuk menghasilkan aktivitas enzim protease tertinggi?
1.3. Tujuan Penelitian
Tujuan dari penelitian ini adalah menganalisis potensi kapang endofit yang diisolasi dari daun tanaman pepaya sebagai penghasil enzim protease.
1.4. Manfaat Penelitian
Manfaat penelitian ini diharapkan enzim protease yang dihasilkan oleh kapang endofit daun tanaman pepaya dapat digunakan untuk memenuhi keperluan berbagai bidang industri kesehatan misalnya antimikroba dan industri pangan misalnya pangan fungsional dan suplemen.
1.5. Kerangka Berpikir Penelitian
Kerangka berpikir yang menjadi landasan dilakukannya penelitian ini adalah sebagai berikut (Gambar 1).
Gambar 1. Kerangka berpikir penelitian aktivitas enzim protease kapang endofit yang diisolasi dari daun tanaman pepaya
Tanaman menjadi inang bagi kapang endofit yang dapat menghasilkan
senyawa bioaktif
Protease bermanfaat dalam industri kesehatan dan pangan Salah satu senyawa bioaktif yang dihasilkan adalah enzim protease
Pengujian aktivitas enzim protease kapang endofit yang diisolasi dari daun
tanaman pepaya
Enzim protease mewakili kelompok enzim industri terbesar yang menyumbang sekitar 59% dari total
penjualan enzim di dunia
Antimikroba Hidrolisat protein
Pangan fungsional
Tanaman pepaya Kapang memiliki protease yang lebih
luas dari bakteri, yaitu dapat menghasilkan protease asam, netral,
dan basa.
5 BAB II
TINJAUAN PUSTAKA 2.1. Tanaman Pepaya
3.1.1. Klasifikasi Tanaman Pepaya
Taksonomi tanaman pepaya termasuk ke dalam divisi Magnoliophyta, kelas Magnoliopsida, ordo Brassicaless, famili Caricaceae, genus Carica, spesies C. papaya L. (Adachukwu, Ann, & Faith, 2013). Tanaman pepaya merupakan tanaman herba yang tumbuh dengan batang setinggi 5 hingga 10 m. Pohon pepaya biasanya tidak bercabang. Daunnya tersusun secara spiral berbatas pada bagian atas batang. Daun yang berukuran besar memiliki diameter 50-70 cm. Buahnya matang ketika kulitnya sudah berwarna kuning hingga oranye dan tekstur buahnya lunak. Bunga-bunga muncul di aksil daun (Gambar 2.) (Aravind, Debjit, Duraivel,
& Harish, 2013).
Gambar 2. Morfologi tanaman pepaya; a. Perawakan tanaman pepaya; b. Daun berukuran besar yang tersusun secara spiral berbatas; c. Bunga-bunga muncul diaksil daun.
Tanaman pepaya termasuk ke dalam tumbuhan dikotil yang berasal dari famili Caricaceae. Tanaman ini tersebar di sebagian besar daerah tropis di dunia, berasal dari Amerika Tengah dan meksiko (Abonyi et al., 2019; Saeed et al., 2014). Tanaman pepaya terdiri dari 31 spesies dalam 4 genera. Tiga genera berasal dari Amerika, yaitu Carica, Jacaratia, dan Jarilla serta 1 genera berasal dari Afrika, yaitu Cylicomorpha (Pinnamaneni, 2017). Tanaman digunakan secara
a
b
c
tradisional untuk pengobatan berbagai penyakit termasuk luka, borok, luka bakar, diare, pendarahan, wasir, batuk, disentri, dan penyakit kulit. Daun pepaya mengandung senyawa bioaktif untuk menyembuhkan kanker dan demam berdarah (Sushma, Jayashankar, Vinu, & Saeed, 2018; Abonyi et al., 2019).
2.1.2. Kandungan Kimiawi Tanaman Pepaya
Tanaman pepaya menjadi sumber nutrisi yang tersedia sepanjang tahun.
Tanaman pepaya digunakan sebagai sumber pangan dan obat tradisional (Aravind et al., 2013). Pepaya memiliki nilai gizi yang tinggi karena kaya akan vitamin alami, mineral, dan rendah kalori. Kandungan kalori pada buah matang sebesar 32 Kkal/100 g. Setiap bagian organ tanaman pepaya, seperti daun, buah, biji, akar, dan getah memiliki senyawa bioaktif yang dapat digunakan sebagai obat (Tabel 1.) (Pinnamaneni, 2017).
Tabel 1. Kandungan kimiawi berbagai bagian tanaman pepaya No. Bagian
tanaman Konstituen
1. Buah Protein, lemak, serat, karbohidrat, mineral, kalsium, fosfor, zat besi, vitamin C, tiamin, riboflavin, niasin, dan karoksen; asam amino, asam sitrat, dan asam malat (buah hijau); senyawa volatil: linalol, benzil isotiosianat, cis dan trans 2,6-dimetil-3,6 expoxy-7 octen-2-ol; alkaloid, α karpain, benzil-β-d glukosida, 2- feniletil-β-D-glukosida, 4-hidroksil-fenil-2 etil-B-D glukosida, dan 4 isomer benzil-β-D-glukosida.
2. Biji Asam lemak, protein kasar, serat kasar, minyak pepaya, karpain, benzil isotiosianat, benzil glukosinolat, glukotropaeolin, benzoiltiourea, hentriakontan, β- sistosterol, karisin, dan enzim nirosin.
3. Akar Karposid dan enzim nirosin.
4. Daun Alkaloid karpain, pseudokarpain, dehidrokarpain I dan II, kolin, karposid, vitamin C, dan E.
5. Getah Enzim protease: papain; glutamin siklotransferase;
chymopapain A, B, dan C; peptidase A dan B; lisozim.
Tanaman pepaya mengandung enzim protease misalnya papain dan chymopapain. Enzim papain mirip dengan enzim pencernaan di dalam tubuh kita, yaitu pepsin (Aravind et al., 2013). Konsentrasi enzim yang tinggi ditemukan pada bagian tanaman yang lebih muda dibandingkan yang lebih tua (Amazu et al., 2010). Tanaman pepaya kaya akan antioksidan, misalnya vitamin C, vitamin A,
dan vitamin E; magnesium, potassium, vitamin B (asam pantotenat), folat, dan serat. Semua nutrisi tersebut dapat meningkatkan sistem kardiovaskular, melindungi dari serangan jantung, stroke, dan mencegah kanker usus besar. Buah pepaya merupakan sumber beta-karoten yang mencegah kerusakan akibat radikal bebas penyebab kanker. Pepaya juga menurunkan kadar kolesterol karena mengandung sumber serat yang tinggi (Aravind et al., 2013). Tanaman pepaya telah dilaporkan memiliki aktivitas antiinflamasi, antihelmintik, antikanker, penyembuhan luka, anti kesuburan, abortifasein, diuretik, imunomodulator, anti hipertensi, dan antimalaria (Amazu et al., 2010; Abonyi et al., 2019).
2.2. Mikroorganisme Endofit
Istilah endofit pertama kali diciptakan oleh de Barry pada tahun 1886.
Endofit berasal dari bahasa Yunani, yaitu “endon” berarti di dalam dan “phyton”
berarti tanaman (Sudha, Govindaraj, Baskar, Al-Dhabi, & Duraipandiyan, 2016).
Mikroorganisme endofit merupakan mikroorganisme yang menempati jaringan dalam tanaman untuk seluruh atau sebagian dari siklus hidupnya. Mikroorganisme endofit termasuk ke dalam bakteri dan fungi. Mikroorganisme endofit memiliki kemampuan untuk mengolonisasi di dalam jaringan tanaman sehat seperti daun, tangkai, ranting, batang, kulit, kayu, akar, buah, bunga, dan biji-bijian tanpa menyebabkan kerusakan atau infeksi patogen pada tanaman inangnya (Fouda, Hassan, Eid, & Ewais, 2015; Yadav, 2018). Mikroorganisme endofit dapat berasosiasi secara obligat atau fakultatif dan tidak membahayakan tanaman inang.
Mikroorganisme endofit berinteraksi dengan inang yang melibatkan mutualisme dan antagonisme (Nair & Padmavathy, 2014). Mikroorganisme menghasilkan beberapa senyawa yang mendorong pertumbuhan tanaman dan membantu tanaman inang beradaptasi lebih baik dengan lingkungan (A. Das & A. Varma, 2009).
Semua tanaman vaskular memiliki mikroorganisme endofit (Khan et al., 2010). Mekanisme invasi mikroorganisme endofit ke dalam jaringan tumbuhan dapat dilakukan dengan beberapa cara. Mikroorganisme dapat masuk melalui stomata, lentisel, luka alami, titik tumbuh akar lateral, radikula yang sedang tumbuh, dan jaringan akar meristematik yang tidak terdiferensiasi. Serangan enzimatik pada dinding sel rambut akar juga dapat menjadi jalan masuknya
mikroba ke dalam tanaman (Putri, Fifendy, & Putri, 2018). Mikroorganisme endofit dapat masuk ke dalam jaringan tanaman pada bagian tanaman yang terpapar udara langsung seperti bunga, batang, daun (melalui stomata) dan kotiledon. Mikroorganisme masuk ke dalam jaringan tanaman kemudian berkoloni di titik tempatnya masuk atau menyebar ke seluruh bagian tumbuhan melalui pembuluh vaskular (Purwanto, Pasaribu, & Bintang, 2014).
Mikroorganisme endofit berkoloni dan menyebar ke seluruh bagian tanaman yang mempunyai pembuluh vaskular seperti xilem pada batang. Mikrooorganisme umumnya dapat masuk melalui akar kemudian disebarkan oleh pembuluh vaskular ke bagian tanaman. Kekayaan spesies dan frekuensi kolonisasi mikroorganisme endofit lebih tinggi pada daun (25,57%) dibandingkan dengan batang (5,26%) karena di daun terdapat stomata dan pembuluh angkut yang menjadi jalur masuk mikroorganisme (Khan et al., 2010). Mikroorganisme endofit yang terdapat pada daun muda lebih banyak dibandingkan daun tua karena metabolit sekunder lebih tinggi dihasilkan pada daun muda (Putri et al., 2018).
Hal ini sesuai dengan penelitian Achakzai, Achakzai, Masood, Kayani, & Tareen (2009), metabolit sekunder berupa alkaloid dan saponin yang dihasilkan lebih tinggi pada daun muda dan senyawa-senyawa tersebut cenderung berkurang seiring bertambahnya usia daun.
Tanaman yang memiliki plasma nutfah tinggi juga memiliki keanekaragaman mikroorganisme endofit yang tinggi (Tenguria, Khan, &
Quereshi, 2011). Mikroorganisme endofit berpotensi sebagai sumber produk alami baru dan metabolit bioaktif. Senyawa bioaktif ini memiliki aplikasi dalam bidang kedokteran, pertanian, dan industri. Mikroorganisme endofit dalam bidang pertanian banyak digunakan sebagai penghasil fitohormon untuk meningkatkan pertumbuhan tanaman, biofertilizer, biokontrol untuk melindungi tanaman terhadap fitopatogen, pelarut fosfat, dan pengikat nitrogen (Joseph & Priya, 2011;
Shen, Yen, Liao, Chen, & Chao, 2019; Fadiji & Babalola, 2020). Mikroba endofit dalam bidang kedokteran digunakan sebagai penghasil antibiotik yang berspektrum luas, antivirus, antikanker, antidiabetes, zat antimalaria, produksi antioksidan alami, dan senyawa imunosupresif untuk transplantasi organ (Radji, 2005; Yadav, 2018).
Mikroorganisme sebagai sumber protease lebih disukai karena dapat dibudidayakan dalam jumlah besar dengan waktu yang relatif singkat melalui metode fermentasi dan menghasilkan produk yang berlimpah. Protease mikroba bersifat ekstraseluler. Mikroorganisme secara langsung mensekresikan protease dalam media fermentasi, sehingga proses hilir enzim mikroba lebih sederhana dibandingkan dengan protease yang diperoleh dari tanaman dan hewan (Sharma, Kumar, Panwar, & Kumar, 2017). Mikroorganisme endofit banyak ditemukan di dalam tanaman karena mempunyai kapasitas untuk menghasilkan banyak metabolit bioaktif dan enzim yang relevan secara bioteknologi (Rajamanikyam, Vadlapudi, Amanchy, & Upadhyayula, 2017).
2.2.1. Kapang Endofit
Jaringan tanaman hampir semuanya dikolonisasi oleh kapang endofit.
Kapang endofit membantu tanaman inangnya untuk beradaptasi dengan lingkungan, melindungi dari tekanan biotik atau abiotik, meningkatkan ketahanan terhadap penyakit, mendukung pertumbuhan tanaman, dan penyerapan unsur hara dari tanah (Maciá-Vicente, Jansson, & Lopez-Llorca, 2009; Akinyemi, 2017).
Kapang endofit sebagian besar termasuk ke dalam kelas Ascomycetes, Deuteromycetes, dan Basidiomycetes. Kapang endofit yang sama dari berbagai bagian tanaman memiliki kemampuan yang berbeda (Sandhu & Gupta, 2015).
Kemampuan kapang endofit dalam memproduksi metabolit sekunder dari tanaman inangnya diduga karena kapang mengalami rekombinasi genetik atau menyimpan beberapa info genetik dari inangnya melalui suatu proses evolusi di dalam jaringan tanaman inang (Irawati et al., 2017).
Kapang endofit menempati kedudukan ekologis yang sama dengan sebagian besar patogen. Oleh karena itu, kapang endofit menggunakan cara yang sama seperti patogen untuk masuk ke dalam jaringan inang tanaman. Proses awal kolonisasi kapang endofit harus mencapai sebagian dari degradasi dinding sel.
Enzim ekstraseluler, yaitu protein yang mengkatalisasi berbagai reaksi kimia berperan dalam proses degradasi dinding sel tersebut. Protein-protein tersebut terbagi menjadi 6 kelompok utama diantaranya, yaitu oksidoreduktase, lyase, hidrolase, transferase, ligase, dan isomerase. Kapang endofit mengeluarkan enzim tambahan seperti esterase, lakase, peroksidase, dan protease sebagai perlindungan
tanaman intraseluler (Agrawal, Rajput, & Chanyal, 2016). Produksi protease ekstraseluler oleh jenis kapang yang berbeda sangat dipengaruhi oleh kondisi kultur, metabolisme dari kultur, dan pertumbuhan miselium. Berbagai faktor fisik dan kimia memengaruhi produksi protease seperti suhu, pH, sumber karbon yang masing-masing berperan dalam menginduksi enzim dan sumber nitrogen (Jenitta, Priya, & Gnanadoss, 2015; Ramya & Bharathi, 2015).
Kemampuan kapang endofit dalam menghasilkan enzim ekstraseluler, seperti enzim protease sudah ada dalam Al-Qur’an surah Al-An’am: [6:95].
Artinya:
“Sesungguhnya Allah menumbuhkan butir tumbuh-tumbuhan dan biji buah- buahan. Dia mengeluarkan yang hidup dari yang mati dan mengeluarkan yang mati dari yang hidup (yang memiliki sifat-sifat) demikian ialah Allah, maka mengapa kamu masih berpaling?”. (QS. Al-An’am: [6:95]).
Kata “dan mengeluarkan dari yang mati dari yang hidup” yang dimaksud dalam ayat tersebut adalah senyawa bioaktif atau enzim ekstraseluler yang dihasilkan dari kapang endofit. Kapang memiliki kapasitas yang luas untuk menghasilkan senyawa bioaktif yang memiliki aktivitas antimikroba dan berpotensi sebagai obat (Suryanarayanan et al., 2009). Kebutuhan untuk mengisolasi, menyintesis antibiotik, agen terapeutik, dan agrokimia dari kapang endofit sangat efektif, rendah toksik, dan memiliki dampak lingkungan yang kecil (Tenguria, Khan, & Quereshi, 2011).
Kapang menghasilkan sejumlah besar protease baik intraseluler atau ekstraseluler (Vishwanatha et al., 2010). Kapang endofit memiliki kemampuan untuk menghasilkan berbagai enzim ekstraseluler seperti pektinase, selulase, lipase, amilase, lakase, dan protease. Enzim ekstraseluler ini berperan dalam proses biodegradasi, hidrolisis terhadap infeksi patogen, dan memenuhi kebutuhan nutrisi kapang dari tanaman inang (Sunitha, Devi, & Srinivas, 2013). Sebagian besar kapang mempunyai kisaran suhu optimal 28-30°C untuk produksi protease (K. M. Sharma et al., 2017).
Kapang endofit mempunyai aktivitas antimikroba terhadap bakteri patogen pada manusia. Kapang juga dapat melindungi tanaman inangnya dari patogen dan hama dengan cara memproduksi alkaloid beracun bagi serangga, misalnya Acremonium coenophialum menunjukkan aktivitas insektisida terhadap kutu daun Rhopalosiphum padi. Kapang endofit dapat secara aktif atau pasif meningkatkan pertumbuhan tanaman melalui berbagai mekanisme (Sudha et al., 2016). Salah satunya dengan memproduksi hormon pertumbuhan Indole Acetic Acid (IAA).
IAA berperan dalam mempercepat pertumbuhan tanaman dan pemanjangan sel (Hanafi, Purwantisari, & Raharjo, 2017). Metabolit bioaktif endofit dapat meningkatkan ketahanan tanaman terhadap tekanan biotik dan abiotik serta meningkatkan pertumbuhan (Sudha et al., 2016).
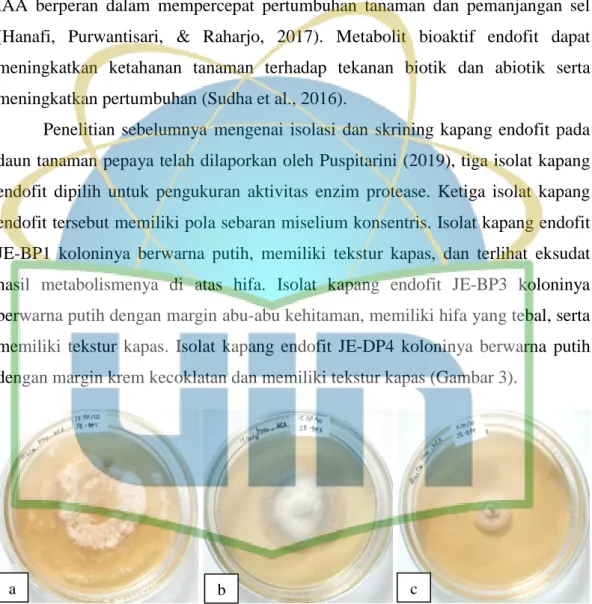
Penelitian sebelumnya mengenai isolasi dan skrining kapang endofit pada daun tanaman pepaya telah dilaporkan oleh Puspitarini (2019), tiga isolat kapang endofit dipilih untuk pengukuran aktivitas enzim protease. Ketiga isolat kapang endofit tersebut memiliki pola sebaran miselium konsentris. Isolat kapang endofit JE-BP1 koloninya berwarna putih, memiliki tekstur kapas, dan terlihat eksudat hasil metabolismenya di atas hifa. Isolat kapang endofit JE-BP3 koloninya berwarna putih dengan margin abu-abu kehitaman, memiliki hifa yang tebal, serta memiliki tekstur kapas. Isolat kapang endofit JE-DP4 koloninya berwarna putih dengan margin krem kecoklatan dan memiliki tekstur kapas (Gambar 3).
Gambar 3. Isolat kapang endofit daun tanaman pepaya; a. JE-BP1; b. JE-BP3; c.
JE-DP4 2.3. Enzim Protease
Enzim protease merupakan enzim yang berfungsi untuk menghidrolisis ikatan peptida protein. Enzim ini juga disebut enzim proteinase atau proteolitik (de Souza et al., 2015). Enzim protease diklasifikasikan menurut kisaran pH, yaitu
a
A
b c
asam (pH 2,0-6,0); netral (pH 6,0-8,0); alkali (pH 8,0-13) (de Souza et al., 2015).
Menurut klasifikasi enzyme commission (EC), enzim protease termasuk ke dalam kelas 3, yaitu hidrolase dan sub-kelompok 4 yang menghidrolisis ikatan peptida (K. M. Sharma et al., 2017). Enzim protease diklasifikasikan berdasarkan posisi pemutusan ikatan peptida dibedakan menjadi 2 kelompok besar, yaitu eksopeptidase dan endopeptidase (de Souza et al., 2015).
Eksopeptidase menghidrolisis ikatan peptida protein pada ujung rantai polipeptida baik dari ujung amino (terminal N) atau karboksil (terminal C) pada substrat. Berdasarkan sisi aktif, eksopeptidase diklasifikasikan menjadi aminopeptidase dan karboksipeptidase. Aminopeptidase dapat membebaskan residu asam amino tunggal, dipeptida (dipeptidyl peptidase), atau tripeptida (tripeptydil peptidase) dari ujung terminal N pada substratnya (Mótyán, Tóth, &
Tőzsér, 2013). Karboksipeptidase bekerja dari ujung terminal C dari rantai polipeptida dan membebaskan asam amino tunggal atau dipeptida (de Souza et al., 2015).
Endopeptidase memutus ikatan peptida yang berada di bagian dalam rantai polipeptida (Sabotič & Kos, 2012). Endopeptidase terbagi menjadi 4 kelompok utama, yaitu protease serin, protease aspartat, protease sistein, dan metalloprotease. Protease serin ditandai dengan adanya residu serin di sisi aktif enzim (Laskar & Chatterjee, 2009). Protease serin umumnya aktif pada pH netral dan alkali. Protease aspartat umumnya mempunyai aktivitas katalitik optimal pada pH asam. Protease sistein terbagi menjadi protease tanaman seperti papain, bromelain, dan aktinidin. Protease sistein memiliki pH optimal netral meskipun ada beberapa yang aktif pada pH optimal asam. Metalloprotease mengandung ion logam esensial, salah satunya Zn yang mempunyai aktivitas optimal pada pH netral (Mahajan & Badgujar, 2010). Protease alkali memiliki pusat serin atau metallo-type dan merupakan kelompok enzim yang penggunaannya luas dalam industri detergen, makanan, farmasi, dan kulit (K. M. Sharma et al., 2017).
2.3.1. Mekanisme Kerja Enzim
Enzim berfungsi sebagai katalis suatu reaksi yang dapat meningkatkan laju reaksi melalui penurunan energi aktivasi. Penurunan energi aktivasi dilakukan dengan cara membentuk kompleks enzim dengan substrat. Kompleks enzim-
substrat akan terurai menjadi produk. Enzim dilepaskan untuk membentuk kompleks baru dengan substrat lain setelah produk dihasilkan. Enzim memiliki bagian sisi aktif yang berfungsi sebagai tempat terikatnya substrat untuk membentuk kompleks enzim-substrat, dan selanjutnya membentuk produk akhir (Lehninger, 2004).
Enzim memiliki dua komponen penyusun yang terdiri atas protein dan non- protein. Komponen penyusun enzim berupa protein yang sifatnya tidak tahan panas disebut apoenzim. Komponen penyusun enzim non-protein disebut gugus prostetik yang terdiri atas ion-ion anorganik atau ion-ion organik. Ion anorganik disebut kofaktor yang mampu meningkatkan kerja enzim. Ion organik disebut koenzim yang berfungsi untuk memindahkan zat kimia dari satu enzim ke enzim lain (Lehninger, 2004). Enzim akan aktif jika ada kofaktor sedangkan inhibitor akan menghambat enzim dengan cara menempel pada bagian enzim atau dengan cara berikatan langsung pada sisi aktif enzim sehingga menyebabkan sisi aktif enzim berubah (Sajuthi, Suparto, Yanti, & Praira, 2010).
Faktor-faktor yang memengaruhi aktivitas enzim adalah suhu, pH, konsentrasi enzim, konsentrasi substrat, inhibitor, dan aktivator. Enzim adalah suatu protein sehingga kenaikan suhu dapat menyebabkan denaturasi enzim dan bagian aktif enzim akan terganggu sehingga konsentasi dan kecepatan enzim berkurang. Kecepatan reaksi bertambah dengan bertambahnya konsentrasi enzim.
Konsentrasi substrat akan menaikkan kecepatan reaksi (Risnawati &
Cahyaningrum, 2013).
Reaksi enzimatik dapat dibagi dalam 3 fase (Gambar 4). Selama fase I, kompleks enzim-substrat (ES) terakumulasi tanpa pembentukan produk dan konsumsi substrat (S) yang signifikan. Fase II dimulai ketika konsentrasi enzim- substrat mencapai nilai tertinggi yang tetap, tidak berubah untuk satu periode.
Durasi kondisi stabil konsentrasi enzim-substrat tergantung pada konsentrasi relatif antara enzim (E) dan substrat (S). Selama fase II, substrat digunakan dan produk (P) terakumulasi dalam media reaksi. Selama fase III, ketika konsentrasi enzim-substrat tidak lagi konstan, penggunaan substrat dan pembentukan produk terjadi secara perlahan (Vitolo, 2015).
Gambar 4. Fase reaksi enzimatik (Vitolo, 2015) 2.3.2. Manfaat Enzim Protease
Enzim protease dapat digunakan dalam pengobatan karena bermanfaat dalam onkologi, inflamasi, kontrol reologi darah, dan regulasi sistem imun. Enzim protease diproduksi secara komersial dalam kondisi aseptik untuk suplemen makanan dan terapi enzim sistemik (Rakte & Nanjwade, 2014). Enzim protease banyak digunakan dalam aplikasi klinis terutama dalam perawatan penyakit diabetes (Abdennabi, Triki, Salah, & Gharsallah, 2017). Enzim protease memiliki sifat anti-inflamasi dan anti-edema (penumpukan cairan dalam ruang di antara sel tubuh). Enzim protease membantu memecah metabolit toksik, produk inflamasi, dan berkontribusi dalam detoksifikasi tubuh manusia. Enzim protease memengaruhi sistem kekebalan tubuh sebagai pengubah respon biologis. Enzim protease mengaktifkan atau merangsang makrofag dan sel-sel pembunuh alami yang berperan dalam pertahanan imunobiologis tubuh. Enzim protease dapat menjadi agen kemoterapi yang dapat menghancurkan sel-sel tumor ganas (Rakte
& Nanjwade, 2014).
2.4. Protein
Kata protein berasal dari kata Yunani, “proteios” yang berarti primer.
Protein sangat penting untuk sistem biologis. Protein mengandung karbon, hidrogen, oksigen, dan nitrogen sebagai komponen utama, serta sulfur dan fosfor sebagai komponen unsur minor. Semua protein adalah polimer asam amino.
Protein disintesis oleh polimerisasi asam amino melalui ikatan peptida. Kelompok
alfa karboksil dari satu asam amino bereaksi dengan gugus alfa amino dari asam amino lain untuk membentuk ikatan peptida atau jembatan CO-NH (Gambar 5) (Vasudevan, Vaidyanathan, & Sreekumari, 2017).
Gambar 5. Pembentukan ikatan peptida (Vasudevan et al., 2017)
Protein adalah makromolekul yang terdiri dari satu atau lebih rantai residu asam amino yang panjang. Protein melakukan beragam fungsi dalam organisme hidup, termasuk mengkatalisasi reaksi metabolik, mereplikasi DNA, merespon rangsangan, dan mengangkut molekul dari satu lokasi ke lokasi lain. Protein berbeda satu sama lain terutama dalam urutan asam aminonya yang ditentukan oleh urutan nukleotida. Rantai linier residu asam amino disebut polipeptida.
Protein mengandung setidaknya satu polipeptida panjang. Polipeptida pendek umumnya dikenal sebagai peptida atau oligopeptida. Residu amino terikat bersama oleh ikatan peptida dengan residu asam amino yang berdekatan (Van Goudoever, Vlaardingerbroek, Van Den Akker, De Groof, & Van Der Schoor, 2014; Omotayo, El-ishaq, Tijjani, & Segun, 2016).
2.4.1. Asam Amino Penyusun Protein
Asam amino adalah unit dasar protein yang digunakan dalam pembentukan protein. Sintesis protein tidak terjadi jika asam amino kurang (Akram et al., 2011).
Rantai asam amino terbentuk dari beberapa asam amino (di-, tri-, atau oligopeptida) hingga ribuan unit asam amino (polipeptida). Dua asam amino bergabung membentuk dipeptida, 3 asam amino bergabung membentuk tripeptida, 4 asam amino bergabung membentuk tetrapeptida, beberapa asam amino bergabung akan membentuk oligopeptida, dan kombinasi 1050 asam amino membentuk polipeptida. Rantai polipeptida panjang yang mengandung lebih dari 50 asam amino disebut protein (Vasudevan et al., 2017). Asam amino memiliki
gugus amina (NH2), gugus karboksil (COOH), dan rantai samping yang terikat pada satu atom karbon pusat (Gambar 6). Perbedaan fungsional antara asam amino terletak pada struktur rantai sampingnya atau gugus R (Van Goudoever et al., 2014).
Gambar 6. Asam amino penyusun protein (Van Goudoever et al., 2014) 2.4.2. Tingkatan Struktur Protein
Struktur fisik protein memiliki ciri kompleksitas. Rantai polipeptida tidak berbentuk rantai panjang tetapi terlipat dalam struktur 3 dimensi. Struktur primer protein menggambarkan urutan linear residu asam amino dalam rantai polipeptida dan lokasi ikatan disulfida, jika ada. Struktur sekunder protein menggambarkan hubungan konfigurasi antara residu asam amino yang dekat satu sama lain cenderung membentuk heliks. Struktur tersier protein menggambarkan pengaturan keseluruhan dan antar hubungan dari berbagai daerah atau domain rantai polipeptida tunggal. Struktur kuartener protein dihasilkan ketika protein terdiri dari dua atau lebih rantai polipeptida yang disatukan oleh kekuatan non kovalen.
Bentuk protein tergantung pada fungsi dan interaksinya dengan molekul lain (Van Goudoever et al., 2014; Vasudevan et al., 2017).
17 BAB III
METODE PENELITIAN 3.1. Waktu dan Tempat
Penelitian ini dilakukan pada Januari-Maret 2020 di Laboratorium Mikrobiologi Kesehatan, Bidang Mikrobiologi, Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI), Cibinong, Bogor.
3.2. Alat dan Bahan
Alat yang digunakan dalam penelitian ini antara lain cawan petri, tabung reaksi 14 mL, inkubator suzu seisakusho Co., Ltd., mikropipet, mikrotip (biru, kuning, putih), centrifuge 5415 R, vortex, spektrofotometer UV-Vis biospec- 1601, kuvet, bunsen, labu erlenmeyer 250 mL, inkubator shaker, magnetic stirrer, hot plate sibata MGH-320, pH meter HM-25G, microwave, autoklaf hirayama, laminar air flow (LAF), timbangan analitik sonic electronic balance model SS-A 200, gelas ukur, labu ukur, pipet volumetrik, sedotan, tusuk gigi, penggaris, spatula, corong, gelas beker, dan cool box.
Bahan yang digunakan dalam penelitian ini antara lain tiga isolat kapang endofit yang telah diisolasi dari daun tanaman pepaya daerah Kedunghalang, Bogor, yaitu isolat JE-DP4, JE-BP1, dan JE-BP3, Potato Dextrose Agar (PDA) Merck, Skim Milk Agar (SMA) Merck, Czapek Dox Broth (CZA) Merck, substrat kasein dan susu skim, akuades, akuabides, alkohol 70%, kasein hidrolisat 1%, bufer Tris-HCl 0,2 M pH 7,5 Merck, ekstrak kasar enzim, asam trikloroasetat (TCA) 5% Merck, Bovine Serum Albumin (BSA) HiMedia, HCl pekat Merck, L- tyrosine HiMedia, HCl 0,1 M, Coomassie Brilliant Blue-G250 Merck, metanol Merck, asam fosfat (H3PO4) 85%, kain kasa, dan kertas saring.
3.3. Rancangan Penelitian
Penelitian ini termasuk ke dalam penelitian eksperimen yang menggunakan rancangan acak lengkap (RAL). Pengujian aktivitas enzim protease dilakukan menggunakan 3 suhu yang berbeda, yaitu 30°C, 37°C, dan 44°C pada masing- masing substrat kasein dan susu skim dengan waktu inkubasi 7 hari. Produksi enzim protease dan pengukuran aktivitas enzim protease dilakukan dengan 2 kali
pengulangan dan 1 kontrol pada masing-masing substrat kasein dan susu skim.
Kontrol terdiri atas media produksi enzim protease beserta masing-masing substrat berupa kasein dan susu skim tanpa penambahan isolat kapang endofit.
3.4. Cara Kerja
3.4.1. Pembuatan Media Potato Dextrose Agar (PDA)
Kentang sebanyak 250 g ditimbang lalu dibersihkan dan dipotong dadu.
Kentang direbus hingga mendidih dengan akuades sebanyak 1 L, akuades ditambahkan jika airnya berkurang. Air rebusan kentang yang diperoleh kemudian disaring menggunakan kain kasa dan ditera hingga 1 L menggunakan akuades. Air rebusan kentang dituang ke dalam gelas beker berisi sukrosa 20 g dan kloramfenikol 100 mg lalu dihomogenkan. Air rebusan kentang sebanyak 200 mL dimasukkan ke dalam labu erlenmeyer 250 mL berisi agar 4 g. Media dihomogenkan dan disterilisasi dalam autoklaf pada suhu 121°C dengan tekanan 15 Psi selama 15-20 menit. Media yang sudah steril dituang ke dalam cawan petri di dalam LAF dan ditunggu hingga memadat (Arifah, 2019).
3.4.2. Pembuatan Media Skim Milk Agar (SMA)
Yeast extract sebanyak 0,5 g; D-glucose 0,2 g; kasein 1 g; skim milk powder 5,6 g; dan agar 3 g ditimbang. Media dimasukkan ke dalam labu erlenmeyer 300 mL dan dilarutkan dalam akuades sebanyak 200 mL. Media dihomogenkan menggunakan magnetic stirrer dan diukur pH nya menggunakan pH meter. Media disterilisasi dalam autoklaf pada suhu 121°C dengan tekanan 15 Psi selama 15-20 menit. Media yang sudah steril dituang ke dalam cawan petri di dalam LAF dan ditunggu hingga memadat (A. K. Sharma et al., 2015).
3.4.3. Pembuatan Media Czapek Dox Broth (CZA)
Media czapek dox broth (CZA) dibuat dengan sukrosa (C12H22O11) sebanyak 3 g; sodium nitrat (NaNO3) sebanyak 0,3 g; dipotassium fosfat (K2HPO4) sebanyak 0,1 g; magnesium sulfat-heptahidrat (MgSO4.7H2O) sebanyak 0,05 g; potassium klorida (KCl) sebanyak 0,05 g; ferrous sulfat-heptahidrat (FeSO4.7 H2O) sebanyak 0,001 g. Media dimasukkan ke dalam labu erlenmeyer 250 mL kemudian dilarutkan dalam 100 mL akuades. Media CZA masing-masing
ditambahkan substrat kasein dan susu skim sebanyak 1 g/100 mL. Media dihomogenkan menggunakan magnetic stirrer dan diukur pH nya. Media disterilisasi dalam autoklaf pada suhu 121°C dengan tekanan 15 Psi selama 15-20 menit (Yusriah & Kuswytasari, 2013).
3.4.4. Peremajaan Kapang Endofit
Isolat kapang endofit yang telah diisolasi dari daun tanaman pepaya, yaitu JE-BP1, JE-BP3, dan JE-DP4 diremajakan. Peremajaan kapang endofit ditanam masing-masing dibuat duplo. Kapang endofit diinokulasikan ke dalam media PDA dengan cara memotong ujung miselium kapang menggunakan sedotan steril.
Miselium dipindahkan menggunakan tusuk gigi steril ke dalam media PDA.
Kultur diinkubasi pada suhu 30°C di dalam inkubator selama 7 hari (Benmrad et al., 2019).
3.4.5. Skrining Aktivitas Enzim Protease
Skrining enzim protease dilakukan menggunakan media skim milk agar (SMA) pH 7,4. Potongan miselium diinokulasikan ke dalam media SMA, lalu diinkubasi pada suhu 30°C selama 7 hari. Aktivitas enzim protease pada media SMA ditunjukkan dengan terlihatnya zona bening yang muncul di sekitar koloni (Benmrad et al., 2019). Indeks hidrolisis protein (IHP) dihitung dengan cara mengukur perbandingan diameter zona bening dengan diameter koloni mikroba (Hastuti, Nugraheni, & Asna, 2017).
3.4.6. Pembuatan Kurva Standar Bovine Serum Albumin (BSA)
Kurva standar BSA dibuat menggunakan larutan stok 50 µg/mL (w/v). BSA sebanyak 0,25 mg dilarutkan dalam 5 mL akuabides. Larutan tersebut menjadi larutan stok standar yang selanjutnya dilakukan pengenceran bertingkat dengan penambahan akuabides sehingga diperoleh variasi konsentrasi dari larutan stok BSA. Variasi konsentrasi yang dibuat adalah 2, 4, 6, 8, 10, 12, 14, 16, 18, 20 µg/mL. Larutan BSA masing- masing konsentrasi diambil 100 µL, ditambahkan 5 mL reagen Bradford, lalu divortex hingga homogen. Larutan diinkubasi pada suhu 30°C selama 30 menit. Kompleks yang terbentuk diukur absorbansinya pada λ595
nm. Akuabides sebanyak 100 µL ditambahkan 5 mL reagen Bradford digunakan sebagai blanko (Jain, Aggarwal, Sharma, & Pundir, 2012).
3.4.7. Pembuatan Kurva Standar Tirosin
Pembuatan kurva dilakukan dengan menggunakan metode dari Yusriah &
Kuswytasari (2013) yang telah dimodifikasi. Kurva standar tirosin dibuat menggunakan larutan stok 3 mg/mL yang diencerkan menjadi 1 mg/mL, sehingga larutan stok yang digunakan adalah 1 mg/mL. L-tyrosine sebanyak 120 mg dilarutkan dalam 20 mL akuades. L-tyrosine dilarutkan perlahan dalam kondisi hangat pada suhu 37°C hingga homogen menggunakan hotplate. L-tyrosine dibuat dengan variasi konsentrasi 0,01; 0,02; 0,03; 0,04; 0,05; 0,06; 0,07; 0,08; 0,09; 0,1 mg/mL. Larutan masing-masing konsentrasi diencerkan dengan HCl 0,1 M hingga 1 mL kemudian dihomogenkan. Nilai absorbansinya diukur pada λ280 nm menggunakan Spektrofotometer UV-Vis.
3.4.8. Produksi Enzim Protease
Produksi enzim dilakukan menggunakan metode Yusriah & Kuswytasari (2013) yang telah dimodifikasi. Koloni kapang berumur 7 hari diinokulasikan ke dalam media produksi enzim protease. Media produksi enzim protease yang digunakan adalah czapek dox broth (CZA) masing-masing ditambahkan substrat kasein dan susu skim. Produksi enzim protease dibuat 2 kali ulangan dan 1 kontrol pada masing-masing penambahan substrat protein. Miselium kapang sebanyak 10 bulatan diinokulasikan ke dalam 100 mL media produksi enzim protease. Kultur diinkubasi pada suhu 30°C, kecepatan agitasi 120 rpm selama 7 hari di inkubator shaker. Kecepatan agitasi membantu dalam pencampuran nutrisi yang tepat dan penambahan oksigen untuk pertumbuhan kapang (Kamath, Subrahmanyam, Rao,
& Raj, 2010). Aktivitas enzim diukur secara berkala setiap harinya. Selanjutnya enzim yang telah diproduksi dipisahkan antara filtrat dan supernatannya dengan disentrifugasi pada kecepatan 8000 rpm selama 15 menit. Supernatan yang terbentuk merupakan ekstrak kasar enzim yang digunakan dalam pengukuran aktivitas enzim protease.
3.4.9. Pengukuran Aktivitas Enzim Protease
Pengukuran dilakukan menggunakan metode dari Chow & Peticolas (1948) yang telah dimodifikasi. Substrat kasein 1% (w/v) sebanyak 2 mL ditambahkan bufer Tris-HCl 0,2 M pH 7,5 sebanyak 0,5 mL dimasukkan ke dalam tabung reaksi. Selanjutnya campuran di pre-inkubasi masing-masing pada suhu 30°C, 37°C, dan 44°C selama 10 menit. Ekstrak enzim ditambahkan sebanyak 0,5 mL kemudian diinkubasi masing-masing pada suhu 30°C, 37°C, dan 44°C selama 30 menit. Setelah itu, reaksi dihentikan dengan penambahan 2,5 mL asam trikloroasetat (TCA) 5% dan diinkubasi selama 20 menit dalam ice bath agar enzim tidak terdenaturasi. Sentrifugasi selama 5 menit dengan kecepatan 8000 rpm. Setelah itu, diukur aktivitas enzimnya dengan dibaca serapannya pada λ280 nm menggunakan Spektrofotometer UV-Vis.
Aktivitas protease dihitung dalam satuan U (unit) per mL ekstrak enzim.
Satu unit aktivitas protease didefinisikan sebagai jumlah enzim yang menghidrolisis kasein untuk menghasilkan 1 µg tirosin tiap menit (Guangrong, Tiejing, Po, & Jiaxing, 2006). Aktivitas enzim protease (unit/mL) dihitung dengan cara konsentrasi tirosin (C) (µg/mL) dikali volume total sampel tiap tabung (Ves) (mL) dibagi volume enzim (Ve) (mL) dikali waktu reaksi (t) (menit) (Rahayu &
Susanti, 2017).
3.4.10. Pengukuran Kadar Protein
Pengukuran kadar protein menggunakan metode Bradford (1976), modifikasi Masri (2013). Metode Bradford digunakan untuk mengukur kadar protein total secara kalorimetri dalam suatu larutan. Larutan enzim sebanyak 100 µL ditambahkan 5 mL reagen Bradford kemudian larutan dihomogenkan menggunakan vortex. Larutan diinkubasi pada suhu 30°C selama 30 menit.
Setelah diinkubasi, larutan divortex kembali. Nilai absorbansinya diukur pada λ595 nm menggunakan Spektrofotometer UV-Vis. Nilai absorbansi dibuat dalam bentuk kurva standar dengan persamaan y = ax+b, dimana y adalah nilai absorbansi dan x adalah nilai kadar protein. Kadar protein enzim dapat ditentukan berdasarkan persamaan kurva standar BSA yang telah dibuat (Karima, Nurhatika,
& Prasetyo, 2016).
3.5. Analisis Data
Isolat kapang endofit yang mampu menghasilkan enzim protease dilakukan pengukuran aktivitas enzim, jika tidak mampu menghasilkan enzim protease maka tidak dilanjutkan pengukuran aktivitas enzim. Data aktivitas enzim protease diuji normalitas dan homogenitas untuk menentukan uji rata-rata aktivitas enzim menggunakan analisis statistik parametrik atau nonparametrik. Data aktivitas enzim protease isolat kapang endofit yang dipengaruhi ketiga suhu terhadap waktu inkubasi selama 7 hari pada media produksi enzim substrat susu skim dianalisis menggunakan statistik parametrik analisis variansi satu jalur. Data aktivitas enzim protease menggunakan substrat susu skim kemudian diuji lanjut post-hoc Duncan untuk melihat perbedaan nyata antara variabel independen.
Data aktivitas enzim protease isolat kapang endofit yang dipengaruhi ketiga suhu terhadap waktu inkubasi selama 7 hari pada media produksi enzim substrat kasein dianalisis menggunakan statistik nonparametrik Kruskal-Wallis. Data aktivitas enzim protease menggunakan substrat kasein kemudian diuji lanjut stepwise step-down untuk melihat perbedaan nyata antara variabel independen.
Analisis statistik ini menggunakan software IBM SPSS statistik 20.0 dengan tingkat kepercayaan 95%. Data pengukuran kadar protein dianalisis secara deskriptif menggunakan Microsoft Excel 2016 disajikan dalam bentuk grafik.
23 BAB IV
HASIL DAN PEMBAHASAN 4.1. Skrining Aktivitas Enzim Protease Kapang Endofit
Skrining aktivitas enzim protease dilakukan untuk mengetahui sifat proteolitik pada kapang endofit daun pepaya. Hasil skrining aktivitas enzim protease kapang endofit daun pepaya menunjukkan bahwa dari ketiga isolat yang memiliki kemampuan terbaik dalam menghasilkan enzim protease adalah isolat kapang endofit JE-DP4 karena menghasilkan zona bening sebesar 38,5 mm dengan diameter koloni sebesar 26,5 mm (Tabel 2). Hal ini menunjukkan bahwa isolat JE-DP4 merupakan kapang endofit proteolitik karena mampu menghasilkan enzim protease ekstraseluler yang mendegradasi protein susu dalam media skim milk agar sehingga membentuk zona bening. Enzim protease yang dihasilkan oleh isolat kapang endofit JE-DP4 digunakan untuk mempertahankan hidupnya di dalam jaringan tanaman inang (Safitri, Muchlissin, Mukaromah, Darmawati, &
Ethica, 2018; Pavithra, Sathish, & Ananda, 2012).
Tabel 2. Hasil skrining aktivitas enzim protease kapang endofit daun tanaman pepaya
No. Kode Isolat
Aktivitas Protease
Diameter Zona Bening (mm)
Diameter Koloni (mm)
Indeks Hidrolisis Protein (IHP)
1 JE-DP4 + 38,5 26,5 1,45
2 JE-BP1 - - 90 -
3 JE-BP3 - - 64 -
Susu skim sebagai substrat enzim media skim milk agar memperlihatkan adanya aktivitas hidrolitik enzim protease yang dilepaskan oleh miselium kapang.
Abdennabi, Triki, Salah, & Gharsallah (2017), melaporkan dalam penelitiannya aktivitas enzim protease kapang endofit Fusarium sp. ditunjukkan dengan zona bening yang terbentuk disekitar koloni sebesar 36 mm. Hal ini menunjukkan bahwa aktivitas enzim protease kapang dapat terlihat dari zona bening yang terbentuk.
Kapang endofit JE-DP4 bersifat proteolitik karena mampu memproduksi enzim protease ekstraseluler. Enzim protease ekstraseluler, yaitu enzim pemecah protein yang diproduksi di dalam sel untuk dilepaskan keluar dari sel. Enzim
protease ekstraseluler penting untuk hidrolisis protein di lingkungan bebas sel dan memungkinkan sel untuk menyerap serta memanfaatkan produk hidrolitik tersebut (Hamza, 2017). Identifikasi isolat kapang endofit JE-DP4 perlu dilakukan untuk membandingkan aktivitas enzim protease yang dihasilkan oleh jenis kapang yang sama termasuk tinggi atau rendah. Identifikasi kapang juga dapat mengetahui kapang endofit bersifat patogen atau tidak patogen, sehingga kapang endofit aman digunakan untuk memenuhi kebutuhan industri pangan atau kesehatan. Kapang endofit umumnya bersifat menguntungkan bagi tanaman inangnya, beberapa kapang endofit ada yang bersifat patogen (Rodriguez et al., 2009).
Isolat kapang endofit JE-DP4, JE-BP1, dan JE-BP3 sebelumnya disimpan dalam media malt extract agar. Isolat kapang endofit JE-DP4 masih mampu menghasilkan zona bening sedangkan JE-BP1 dan JE-BP3 tidak menghasilkan zona bening. Hal ini dapat disebabkan oleh perbedaan jumlah induktor masing- masing jenis dan strain kapang (Choliq, 2008). Isolat kapang endofit JE-BP1 dan JE-BP3 tidak menghasilkan zona bening juga dapat disebabkan karena kehilangan kemampuan aktivitas enzimnya akibat terlalu lama disimpan di media malt extract agar. Media malt extract agar memiliki kandungan protein yang sedikit. Hal ini menyebabkan tidak adanya yang menginduksi kemampuan kapang endofit tersebut untuk menghasilkan enzim protease sehingga tidak dapat menyintesis enzim protease ekstraseluler. Enzim protease ekstraseluler merupakan enzim induktif yang sintesisnya dipengaruhi oleh induktor (Peterson, Grinyer, &
Nevalainen, 2011).
Indeks hidrolisis protein menunjukkan aktivitas enzim protease. Aktivitas relatif protease isolat kapang endofit JE-DP4 mempunyai nilai indeks hidrolisis protein >1, yaitu sebesar 1,45 pada hari ke-7 inkubasi (Tabel 2). Hasil pengukuran indeks hidrolisis protein tersebut termasuk ke dalam kategori rendah karena nilai aktivitas relatif proteasenya <2. Soeka & Sulistiani (2014), melaporkan dalam penelitiannya nilai indeks hidrolisis protein sebesar 1,50 termasuk kategori rendah. Nilai indeks hidrolisis protein >2 menunjukkan aktivitas enzim yang tinggi. Nilai indeks hidrolisis protein yang dihasilkan oleh kapang endofit semakin tinggi maka zona bening yang terbentuk akan semakin besar (Hastuti et al., 2017). Maitig, Alhoot, & Tiwari (2018), melaporkan dalam penelitiannya
bahwa Aspergillus sp. memiliki nilai indeks hidrolisis protein sebesar 2,09 setelah 96 jam inkubasi. Nilai indeks hidrolisis protein kapang endofit tersebut sebesar 2,09 lebih besar dibandingkan nilai indeks hidrolisis protein yang dihasilkan isolat kapang endofit JE-DP4 sebesar 1,45.
Isolat kapang endofit yang mampu menghasilkan enzim protease adalah JE- DP4, sehingga yang akan diukur aktivitas enzim protease isolat tersebut. Isolat kapang endofit JE-DP4, JE-BP1, dan JE-BP3 sebelumnya telah di skrining aktivitas enzim protease setelah berhasil diisolasi dari daun pepaya. Pengujian ulang aktivitas enzim protease perlu dilakukan ketika ingin mengukur aktivitas enzim untuk memastikan aktivitas enzim protease masih aktif. Enzim dari kapang endofit memiliki peran penting dalam pertanian, industri, dan kesehatan karena stabilitasnya pada suhu tinggi dan pH yang ekstrim dibandingkan sumber enzim dari tanaman dan hewan (Jalgaonwala & Mahajan, 2011; Sathish et al., 2012).
Kapang endofit memiliki fleksibilitas metabolisme yang baik dalam kelangsungan hidupnya sehingga menjadikannya mikroorganisme terpilih untuk produksi enzim tertentu (Zaferanloo, Virkar, Mahon, & Palombo, 2013).
4.2. pH Pertumbuhan Kultur pada Media Produksi Enzim Protease
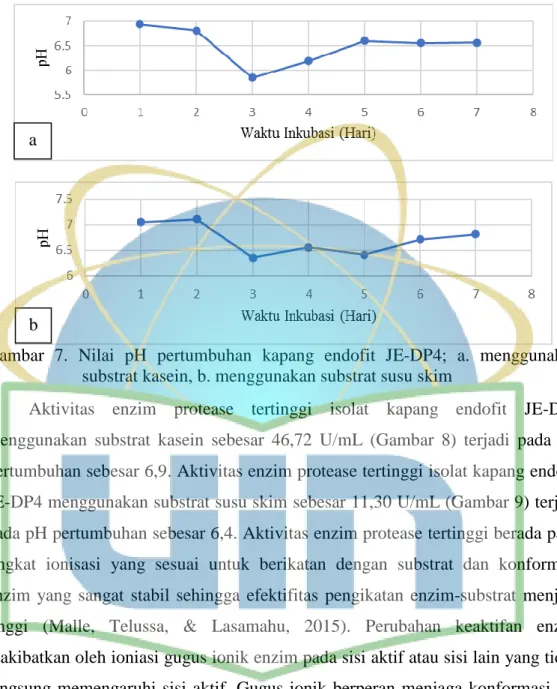
pH pertumbuhan isolat kapang endofit JE-DP4 pada media produksi enzim protease menggunakan substrat kasein pada hari ke-1 inkubasi sebesar 6,9 kemudian mengalami penurunan hingga hari ke-3 menjadi sebesar 5,8. Setelah mengalami penurunan, pH mengalami kenaikan pada waktu inkubasi berikutnya hingga hari ke-7 sebesar 6,5 (Gambar 7a). pH pertumbuhan isolat kapang endofit JE-DP4 pada media produksi enzim protease menggunakan substrat susu skim pada hari ke-1 inkubasi sebesar 7,0 kemudian mengalami penurunan hingga hari ke-3 menjadi 6,3. Setelah mengalami penurunan, pH mengalami kenaikan pada waktu inkubasi berikutnya hingga hari ke-7 sebesar 6,8 (Gambar 7b). pH pertumbuhan pada awal produksi enzim cenderung mengalami penurunan karena terjadi proses pemecahan karbohidrat menjadi asam-asam organik. pH pertumbuhan mengalami kenaikan karena media tertutup oleh amonia dari pemecahan senyawa-senyawa yang mengandung nitrogen (Sumarlin, 2008).
Enzim mempunyai konformasi sisi aktif yang sesuai dengan substrat untuk membentuk kompleks enzim-substrat yang tinggi. Hal ini karena gugus pemberi
dan penerima proton di sisi katalitik enzim berada pada tingkat ionisasi yang diinginkan, sehingga dapat menghasilkan produk yang tinggi (Fathimah &
Wardani, 2014).
Gambar 7. Nilai pH pertumbuhan kapang endofit JE-DP4; a. menggunakan substrat kasein, b. menggunakan substrat susu skim
Aktivitas enzim protease tertinggi isolat kapang endofit JE-DP4 menggunakan substrat kasein sebesar 46,72 U/mL (Gambar 8) terjadi pada pH pertumbuhan sebesar 6,9. Aktivitas enzim protease tertinggi isolat kapang endofit JE-DP4 menggunakan substrat susu skim sebesar 11,30 U/mL (Gambar 9) terjadi pada pH pertumbuhan sebesar 6,4. Aktivitas enzim protease tertinggi berada pada tingkat ionisasi yang sesuai untuk berikatan dengan substrat dan konformasi enzim yang sangat stabil sehingga efektifitas pengikatan enzim-substrat menjadi tinggi (Malle, Telussa, & Lasamahu, 2015). Perubahan keaktifan enzim diakibatkan oleh ioniasi gugus ionik enzim pada sisi aktif atau sisi lain yang tidak langsung memengaruhi sisi aktif. Gugus ionik berperan menjaga konformasi sisi aktif dalam mengikat dan mengubah substrat menjadi produk (Baehaki, Rinto, &
Budiman, 2011). Perubahan muatan ion oleh asam amino penyusun enzim atau substrat karena pH dapat menyebabkan aktivitas enzim menurun (Yusriah &
Kuswytasari, 2013).
Aktivitas enzim protease tertinggi yang dihasilkan oleh isolat kapang endofit JE-DP4 aktif pada kisaran pH 6. Hal ini menunjukkan bahwa enzim
a
b
protease yang dihasilkan dapat dikelompokkan ke dalam protease asam. Menurut de Souza et al. (2015), enzim protease yang dihasilkan pada kisaran pH 2,0-6,0 dapat dikelompokkan ke dalam protease asam. pH enzim protease kapang dapat diklasifikasikan sebagai protease asam, alkalin, dan netral (Yusriah &
Kuswytasari, 2013). Muthulakshmi et al. (2011), melaporkan bahwa enzim protease yang dihasilkan oleh Aspergillus flavus menunjukkan aktivitas tertingginya pada pH 4. Ramadhani, Rukmi, & Pujiyanto (2015), melaporkan bahwa aktivitas enzim protease tertinggi oleh Aspergillus niger PAM18A aktif pada pH 9. Kapang endofit yang berbeda strain menunjukkan aktivitas enzim protease tertinggi pada pH yang berbeda (Siala et al., 2009).
pH pertumbuhan kultur pada media produksi enzim protease menggunakan substrat kasein dan susu skim mengalami kenaikan dan penurunan pH yang stabil dari hari ke-1 hingga hari ke-7 inkubasi berkisar antara 5,8-7,1. Hal ini menunjukkan bahwa enzim protease isolat kapang endofit JE-DP4 mampu bekerja aktif pada kisaran pH asam hingga netral. Zaferanloo et al. (2014), melaporkan dalam penelitiannya bahwa enzim protease kapang endofit aktif dalam kisaran pH yang luas, yaitu 3,0-9,0. Agrawal et al. (2016), juga melaporkan dalam penelitiannya kapang endofit Alternaria alternata mampu menghasilkan enzim protease dalam kisaran pH 3,0-12. Mikroorganisme memiliki kondisi yang sesuai untuk pertumbuhan, reproduksi, dan aktivitas fisiologis lainnya. Produktivitas enzim oleh kultur kapang sangat tergantung pH media fermentasi. pH media pertumbuhan memengaruhi permebilitas kapang dalam mensekresikan enzim protease. Suhu dan kondisi pH dalam produksi enzim protease cenderung mencerminkan kondisi iklim yang ditemukan di lingkungan tempat tanaman tumbuh (Zaferanloo et al., 2013).
4.3. Pengaruh Suhu dan Waktu Inkubasi terhadap Aktivitas Protease
Hasil analisis kurva standar tirosin diperoleh persamaan regresi linier y = 9,738x + 0,056 dengan koefisien regresi linier (R2) = 0,9934 (Lampiran 2). Kurva standar tirosin digunakan untuk mengukur konsentrasi tirosin. Pembuatan kurva standar menggunakan larutan standar tirosin karena tirosin merupakan salah satu asam amino hasil produk hidrolisis protein. Menurut Yusriah & Kuswytasari (2013), larutan standar tirosin digunakan untuk mengukur aktivitas enzim protease dalam memecah protein menjadi asam amino penyusunnya.
Konsentrasi tirosin yang dilepaskan pada hidrolisis protein menggunakan substrat media produksi berupa kasein dan susu skim terus meningkat seiring bertambahnya waktu inkubasi (Lampiran 5). Hal ini menunjukkan bahwa aktivitas enzim protease terus meningkat hingga tercapai aktivitas tertinggi pada waktu inkubasi yang paling sesuai. Menurut Ratnayani, Nazib, Sibarani, & Laksmiwati (2018), konsentrasi tirosin yang semakin besar menunjukkan semakin tinggi aktivitas enzim protease yang dihasilkan dan semakin banyak molekul protein yang dipecah menjadi monomer penyusunnya.
Aktivitas enzim protease isolat kapang endofit JE-DP4 diuji pada ketiga suhu, yaitu suhu 30°C, 37°C, dan 44°C pada pH konstan 7,5. Suhu 30°C merupakan suhu optimal untuk pertumbuhan kapang (K. M. Sharma et al., 2017).
Suhu 37°C menjadi suhu yang optimal untuk menghasilkan enzim protease (Ramya & Bharathi, 2015). Suhu 44°C digunakan untuk mengukur aktivitas enzim yang dihasilkan pada suhu tinggi. pH 7,5 diperoleh dari bufer Tris-HCl.
Kisaran pH 7,0-7,5 menjadi kondisi yang baik untuk menjaga kestabilan enzim (Pasaribu, Nurhayati, & Nurilmala, 2018). Menurut K. M. Sharma et al. (2017), pH yang sesuai untuk menghasilkan enzim protease kapang adalah 7,0-7,5. pH memengaruhi kecepatan aktivitas enzim dalam mengkatalisis suatu reaksi (Yusriah & Kuswytasari, 2013). Pengujian aktivitas enzim protease pada ketiga suhu, waktu inkubasi, dan substrat dilakukan untuk meningkatkan produktivitas enzim. Pengaruh ketiga suhu terhadap aktivitas enzim protease isolat kapang endofit JE-DP4 menggunakan substrat kasein dan susu skim selama 7 hari inkubasi dapat dilihat (Gambar 8) dan (Gambar 9).