BAB III
METODOLOGI PENELITIAN
Metode penelitian yang dilakukan adalah penelitian eksperimental. Penelitian meliputi pengumpulan dan penyiapan bahan tumbuhan, identifikasi sampel, pengolahan sampel, karakterisasi simplisia, skrining fitokimia, pembuatan ekstrak, penyiapan hewan percobaan, pengujian aktivitas antidiare ekstrak etanol temu mangga (Curcuma mangga Val) secara oral pada mencit jantan, dan pengolahan data. Data hasil penelitian dianalisis secara anova (analisis variansi) menggunakan program SPSS versi 17 dan uji Post Hoc Tukey HSD .
3.1 Alat dan Bahan
3.1.1 Alat
Alat-alat yang digunakan terdiri dari lemari pengering, oven, tanur, rotary evaporator, seperangkat alat destilasi, freeze dryer, seperangkat alat penetapan kadar air, desikator, kurs porselin, mikroskop, neraca hewan, neraca listrik, blender, seperangkat alat bedah hewan, meja bedah, alat-alat gelas laboratorium, mortir dan stamfer, aluminium foil, kaca objek (object glass), kaca penutup (deck glass), cawan porselen, kertas saring, kandang hewan, oral sonde, pipet tetes, dan spuit.
3.1.2 Bahan
dinyatakan lain adalah kloralhidrat, etanol 70%, etanol 96%, pereaksi Bouchardat, pereaksi Dragendorff, pereaksi Mayer, besi (III) klorida, pereaksi Molisch, timbal (II) asetat, asam sulfat, asam klorida, amil alkohol, methanol, kloroform-isopropanol, Liebermann-Burchard, n-heksan, toluen, kloroform, serbuk magnesium, serbuk sengdan akuades.
3.2 Pengumpulan dan Pengolahan Sampel
3.2.1 Pengumpulan Sampel
Pengambilan sampel dilakukan secara purposif yaitu tanpa membandingkan dengan tumbuhan yang sama dari daerah lain. Sampel didapatkan dari Pasar yang berasal dari daerah Brastagi.
3.2.2 Identifikasi Sampel
Determinasi bahan tumbuhan temu mangga (Curcuma mangga Val) dilakukan di Herbarium Medanense (MEDA) Universitas Sumatera Utara.
3.2.3 Pengolahan Sampel
3.3 Pemeriksaan Karakteristik Simplisia
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik, mikroskopik, penetapan kadar air, penetapan kadar sari larut dalam air, penetapan kadar sari larut dalam etanol, penetapan kadar abu total, dan penetapan kadar abu tidak larut asam (Ditjen POM, 1995; WHO, 1992).
3.3.1 Pemeriksaan Makroskopik dan Organoleptik
Pemeriksaan makroskopik dan organoleptik dilakukan dengan mengamati bentuk, bau, rasa dan warna dari serbuk simplisia temu mangga (Curcuma mangga Val).
3.3.2 Pemeriksaan Mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia temu mangga (Curcuma mangga Val). Serbuk simplisia temu mangga (Curcuma mangga Val) diletakkan di atas kaca objek yang telah ditetesi dengan larutan kloralhidrat dan ditutup dengan kaca penutup, selanjutnya diamati di bawah mikroskop.
3.3.3 Penetapan Kadar Air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluena). Alat terdiri dari labu alas bulat 500 mL, alat penampung, pendingin, tabung penyambung, dan tabung penerima.
Cara kerja:
ditimbang seksama, labu dipanaskan hati-hati selama 15 menit. Setelah toluena mendidih, kecepatan tetesan diatur lebih kurang 2 tetes tiap detik sampai sebagian besar air terdestilasi, kemudian kecepatan tetesan dinaikkan hingga 4 tetes tiap detik. Setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluena. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin pada suhu kamar. Setelah air dan toluena memisah sempurna, volume air dibaca dengan ketelitian 0,05 mL. Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen (WHO, 1992).
3.3.4 Penetapan Kadar Sari Larut dalam Air
Sebanyak 5 gram serbuk simplisia dikeringkan dimaserasi selama 24 jam dalam 100 mL campuran air dan kloroform (2,5 kloroform dalam air sampai 1000 mL) dalam labu bersumbat sambil sesekali dikocok selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Disaring, sejumlah 20 mL filtrat diuapkan sampai kering dalam cawan dangkal berdasar rata dan telah ditara, sisanya dipanaskan pada suhu 105oC sampai bobot tetap. Kadar sari larut dalam air dihitung terhadap bahan yang telah dikeringkan di udara (Ditjen POM, 1995). 3.3.5 Penetapan Kadar Sari Larut dalam Etanol
Kadar sari larut dalam etanol dihitung terhadap bahan yang telah dikeringkan (Ditjen POM, 1995).
3.3.6 Penetapan Kadar Abu Total
Sebanyak 2 gram serbuk simplisia yang telah digerus dan ditimbang seksama dimasukkan dalam kurs porselin yang telah dipijar dan ditara, kemudian diratakan. Kurs dipijar perlahan-lahan, kemudian naikkan suhu secara bertahap hingga 600oC sampai arang habis, jika arang masih tidak dapat dihilangkan, ditambahkan air panas, saring melalui kertas saring bebas abu. Pijarkan sisa dan kertas saring dalam kurs yang sama. Masukkan filtrat ke dalam kurs, uapkan, pijarkan hingga bobot tetap, timbang. Kadar abu dihitung terhadap bahan yang telah dikeringkan (Ditjen POM, 1995).
3.3.7 Penetapan Kadar Abu Tidak Larut Asam
Abu yang diperoleh dalam penetapan kadar abu total dididihkan dalam 25 mL asam klorida 2N selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan, disaring melalui kertas saring bebas abu dan dicuci dengan air panas, dipijarkan kemudian didinginkan dan ditimbang sampai bobot tetap. Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang telah dikeringkan (Ditjen POM, 1995).
3.4 Skrining Fitokimia Simplisia
3.4.1 Pemeriksaan Flavonoid
Sebanyak 10 gram serbuk simplisia ditambah 100 mL air panas, dididihkan selama 5 menit dan disaring dalam keadaan panas. Filtrat yang diperoleh kemudian diambil 5 mL lalu ditambahkan 0,1 gram serbuk Mg dan 1 mL HCl pekat dan 2 mL amil alkohol, dikocok, dan dibiarkan memisah. Flavonoid positif jika terjadi warna merah kekuningan atau jingga pada lapisan amil alkohol (Farnsworth, 1966).
3.4.2 Pemeriksaan Alkaloid
Serbuk simplisia ditimbang sebanyak 0,5 gram kemudian ditambahkan 1 mL asam klorida 2 N dan 9 mL air suling, dipanaskan di atas penangas air selama 2 menit, didinginkan dan disaring. Filtrat yang diperoleh dipakai untuk uji alkaloida:
1. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi Mayer akan terbentuk endapan menggumpal berwarna putih atau kuning.
2. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi Bouchardat akan terbentuk endapan berwarna coklat sampai hitam.
3. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi Dragendorff akan terbentuk warna merah atau jingga.
Alkaloida positif jika terjadi endapan atau kekeruhan pada paling sedikit dua dari tiga percobaan di atas (Ditjen POM, 1995).
3.4.3 Pemeriksaan Saponin
kurang dari 10 menit dan tidak hilang dengan penambahan 1 tetes asam klorida 2N menunjukkan adanya saponin (Ditjen POM, 1995).
3.4.4 Pemeriksaan Tanin
Sebanyak 0,5 gram serbuk simplisia disari dengan 10 mL air suling lalu disaring, filtratnya diencerkan sampai tidak berwarna. Larutan diambil sebanyak 2 mL dan ditambahkan 1-2 tetes pereaksi besi (III) klorida 1%. Jika terjadi warna biru kehitaman atau hijau kehitaman menunjukkan adanya tanin (Harborne, 1987). 3.4.5 Pemeriksaan Glikosida
Serbuk simplisia ditimbang sebanyak 3 gram, lalu disari dengan 30 mL campuran etanol 95% dengan air suling (7:3) dan 10 mL asam sulfat 2N, direfluks selama 1 jam, didinginkan dan disaring. Diambil 20 mL filtrat ditambahkan 25 mL air suling dan 25 mL timbal (II) asetat 0,4 M, dikocok, didiamkan 5 menit lalu disaring. Filtrat disari dengan 20 mL campuran isopropanol dan kloroform (2:3), dilakukan berulang kali sebanyak 3 kali. Sari air dikumpulkan dan diuapkan pada temperatur tidak lebih dari 500C. Sisanya dilarutkan dalam 2 mL metanol. Larutan sisa dimasukkan dalam tabung reaksi dan diuapkan di atas penangas air.Pada sisa ditambahkan 2 mL air dan 5 tetes pereaksi Molisch. Kemudian secara perlahan-lahan ditambahkan 2 mL asam sulfat pekat melalui dinding tabung, terbentuknya cincin berwarna ungu pada batas kedua cairan menunjukkan glikosida (Ditjen POM, 1995).
3.4.6 Pemeriksaan Steroid/Triterpenoid
Lieberman-Bourchard), diteteskan pada saat akan mereaksikan sampel uji. Apabila terbentuk warna biru atau biru hijau menunjukkan adanya steroida sedangkan warna merah, merah muda atau ungu menunjukkan adanya triterpenoid (Harborne, 1987).
3.5 Pembuatan Ekstrak Etanol Temu Mangga (EETM)
Pembuatan ekstrak etanol temu mangga dilakukan secara maserasi dengan pelarut etanol 96%. Sebanyak 500 g serbuk simpisia temu mangga dimasukkan ke dalam wadah kaca, ditambahkan etanol 96% sebanyak 3,75 L, tutup, biarkan selama 5 hari terlindung dari cahaya sambil sering diaduk, serkai, peras, cuci ampas dengan cairan penyari secukupnya hingga diperoleh 4 L. Pindahkan ke dalam bejana tertutup, biarkan di tempat sejuk, terlindung dari cahaya selama 2 hari. Dienaptuangkan atau disaring. Hasil yang diperoleh dipekatkan dengan rotary evaporator sampai sebagian besar pelarutnya menguap dan dilanjutkan proses penguapan di atas penangas air sampai diperoleh ekstrak kental (Depkes, RI., 1979).
3.6 Pengujian Efek Nefroprotektif EETM
Pengujian efek nefroprotektif meliputi penyiapan hewan percobaan, penyiapan bahan uji, kontrol, obat pembanding, induksi kerusakan ginjal, dan pengujian efek nefroprotektif.
3.6.1 Penyiapan Hewan Percobaan
Sebelum digunakan, mencit diaklimatisasi selama 7 hari dengan kondisi lingkungan percobaan.
3.6.2 Penyiapan Bahan
Bahan yang digunakan meliputi suspensi CMC Na sebagai kontrol, suspensi Curcuma® sebagai pembanding, suspensi ekstrak etanol temu mangga sebagai bahan uji, parasetamol sebagai penginduksi kerusakan ginjal.
3.6.2.1 Pembuatan Suspensi CMC Na 0,5% b/v
Sebanyak 500 mg Na-CMC ditaburkan dalam lumpang yang berisi air suling panas. Didiamkan selama 15 menit lalu digerus hingga diperoleh massa yang transparan, lalu digerus sampai homogen, diencerkan dengan air suling, dihomogenkan dan dimasukkan ke labu tentukur, dicukupkan volumenya dengan air suling hingga 100 mL (Anief, 1995).
3.6.2.2 Pembuatan Suspensi Curcuma®
Satu tablet Curcuma® mengandung 20 mg Curcuma xanthorrhiza. Sebanyak 10 tablet Curcuma® ditimbang, digerus halus dalam lumpang, kemudian timbang serbuk setara 20 mg Curcuma xanthorrhiza. Serbuk yang ditimbang dimasukkan kedalam lumpang kemudian ditambah suspensi CMC Na 0,5% sedikit demi sedikit sambil digerus homogen, kemudian diencerkan dengan suspensi CMC Na 0,5% hingga 10 mL.
3.6.3 Uji Aktivitas Nefroprotektif EETM pada Mencit Jantan yang Diinduksi
oleh Parasetamol
a. Kelompok I: kontrol normal, hewan uji diberikan makanan dan minuman diberikan secara ad libitum.
b. Kelompok II: kontrol negatif, hewan uji diberikan suspensi Na CMC 0,5% sekali sehari selama 7 hari berturut-turut diikuti pemberian parasetamol dosis tunggal 1,05 g/kg bb (Sathishkumar, 2014) 1 jam setelah pemberian suspensi Na CMC 0,5% pada hari ke-7. Makanan dan minuman diberikan secara ad libitum.
c. Kelompok III: kontrol positif, hewan uji diberikan suspensi Curcuma 58 mg/kg bb sekali sehari selama 7 hari berturut-turut diikuti pemberian parasetamol dosis tunggal 1,05 g/kg bb 1 jam setelah pemberian suspensi Na CMC 0,5% pada hari ke-7. Makanan dan minuman diberikan secara ad libitum.
d. Kelompok IV: hewan uji diberikan EETM dosis 100 mg/kg bb sekali sehari selama 7 hari berturut-turut diikuti pemberian parasetamol dosis tunggal 1,05 g/kg bb 1 jam setelah pemberian ekstrak pada hari ke-7. Makanan dan minuman diberikan secara ad libitum.
e. Kelompok V: hewan uji diberikan EETM dosis 200 mg/kg bb sekali sehari selama 7 hari berturut-turut diikuti pemberian parasetamol dosis tunggal 1,05 g/kg bb 1 jam setelah pemberian ekstrak pada hari ke-7. Makanan dan minuman diberikan secara ad libitum.
3.6.3.1 Penyiapan Serum Darah dan Organ Ginjal
Pengambilan darah dilakukan 24 jam setelah pemberian parasetamol. Mencit didislokasi di leher kemudian dibedah dan darah diambil menggunakan jarum suntik langsung dari jantung mencit sebanyak 1mL, dimasukkan ke dalam microtube dan didiamkan ± 20 menit. Darah disentrifuge dengan kecepatan 3000 rpm selama 20 menit untuk mendapatkan serum darah mencit. Pemeriksaan kreatinin dilakukan di Laboratorium Kesehatan Dinas Kesehatan Provinsi Sumatera Utara. Histologi ginjal dilakukan di Laboratorium Histopatologi di Rumah Sakit Murni Teguh.
3.7 Analisis Data
BAB IV
HASIL DAN PEMBAHASAN
4.1 Skrining dan Karakterisasi Simplisia
Tumbuhan yang digunakan telah diidentifikasi di Herbarium Medanense (MEDA), Universitas Sumatera Utara adalah tumbuhan temu mangga (Curcuma mangga Val. & Zijp) kingdom Plantae (kerajaan Tumbuhan), divisi Spermatophyta (tumbuhan berbiji), kelas Monocotyledonae (kelas tumbuhan biji berkeping satu), ordo Zingiberales, famili Zingiberaceae, dan genus Curcuma. Hasil identifikasi tumbuhan dapat dilihat pada Lampiran 2.
Hasil pemeriksaan makroskopik dari rimpang temu mangga (Lampiran 3), adalah sebagai berikut: rimpang berwarna coklat muda berbentuk bulat, rapuh, dan mudah dipatahkan, diameter 1-3 cm, panjang 10-13 cm, bagian dalam isinya berwarna putih kekuningan di bagian luar dan kekuning-kuningan di bagian tengah, bagian tepi berombak atau berkeriput bau khas seperti mangga kweni, rasa pahit, agak pedas, lama-kelamaan menimbulkan rasa tebal. Hasil pemeriksaan mikroskopik serbuk simplisia (Lampiran 4) terlihat fragmen parenkim, rambut penutup, fragmen pembuluh kayu, fragmen gabus. fragmen butir pati, dan tetes minyak atsiri.
belum tertera pada monografi buku Materia Medika Indonesia, sehingga diharapkan untuk hasil karakterisasi temu mangga ini dapat digunakan sebagai pembanding dalam pembuatan simplisia. Hasil skrining dan karakterisasi simplisia temu mangga dapat dilihat pada Tabel 3.1 dan Tabel 3.2 berikut:
Tabel 4.1 Hasil Skrining Fitokimia Simplisia Rimpang Temu Mangga
No. Skrining Hasil
1. Flavonoid +
2. Alkaloid -
3. Saponin +
4. Tanin -
5. Glikosida +
6. Steroid/Triterpenoid +
Keterangan : + = Mengandung golongan senyawa - = Tidak Mengandung golongan senyawa Tabel 4.2 Hasil Karakterisasi Simplisia Rimpang Temu Mangga
No. Skrining Hasil
1. Penetapan kadar air 7,42 %
2. Penetapan kadar sari larut air 15,47 % 3. Penetapan kadar sari larut etanol 13,35 %
4. Penetapan kadar abu total 7,63 %
5. Penetapan kadar abu tidak larut dalam asam 1,71 %
4.2 Kadar Serum Kreatinin
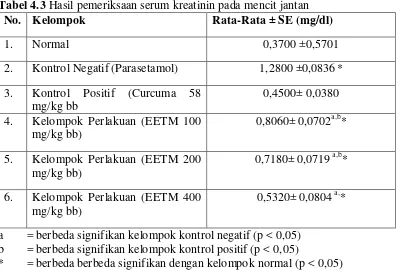
Tabel 4.3 Hasil pemeriksaan serum kreatinin pada mencit jantan
No. Kelompok Rata-Rata ± SE (mg/dl)
1. Normal 0,3700 ±0,5701
2. Kontrol Negatif (Parasetamol) 1,2800 ±0,0836* 3. Kontrol Positif (Curcuma 58
a = berbeda signifikan kelompok kontrol negatif (p < 0,05) b = berbeda signifikan kelompok kontrol positif (p < 0,05)
* = berbeda berbeda signifikan dengan kelompok normal (p < 0,05)
Berdasarkan Tabel 4.3 diketahui bahwa rata-rata nilai serum kreatinin untuk kelompok normal adalah sebesar 0,3700 mg/dl. Kadar pada Kelompok normal masih berada dalam rentang normal serum kreatinin mencit, yaitu antara 0,3 – 1,0 mg/dl (Mitruka, 1981).
Kelompok kontrol negatif memiliki rata-rata serum kreatinin sebesar 1,2800 mg/dl. Kelompok kontrol positifmemiliki rata-rata serum kreatinin sebesar 0,4500 mg/dl sedangkan kelompok perlakuan EETM 100 mg/kg bb memiliki rata-rata nilai serum kreatinin sebesar 0,8060 mg/dl. Kelompok perlakuan EETM 200 mg/kg bb memilki rata nilai serum kreatinin sebesar 0,7180 mg/dl, serta rata-rata nilai serum kreatinin untuk kelompok kelompok perlakuan EETM 400 mg/kg bb sebesar 0,5320 mg/dl.
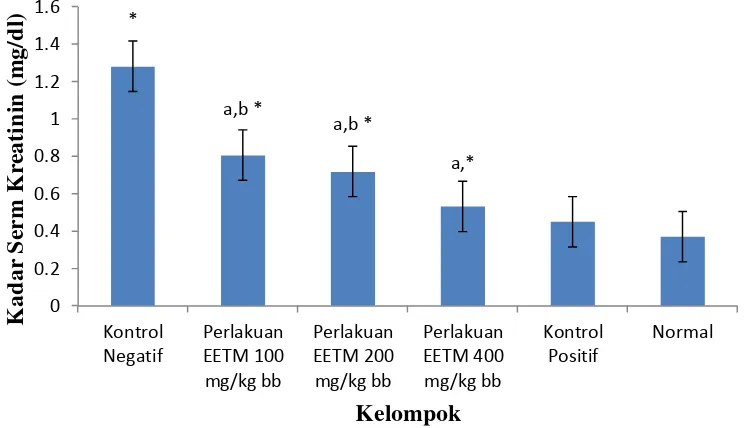
mg/kg bb dan rata-rata serum kreatinin terkecil pada pemberian EETM 400 mg/kg bb. Selain itu, dapat dilihat bahwa terjadi penurunan kadar serum kreatinin seiring dengan meningkatnya dosis EETM. Diagram batang rata-rata hasil pengukuran serum kreatinin pada mencit jantan dapat dilihat pada gambar 4.1 berikut ini:
Gambar 4.1 Diagram Batang Hasil Serum Kreatinin
a = berbeda signifikan kelompok kontrol negatif (p < 0,05) b = berbeda signifikan kelompok kontrol positif (p < 0,05)
* = berbeda berbeda signifikan dengan kelompok normal (p < 0,05)
EETM 200 mg/kg bb memiliki perbedaan yang signifikan (p < 0,05) terhadap kelompok perlakuan EETM 400 mg/kg bb. Kadar serum kreatinin kelompok perlakuan EETM 100 mg/kg bb dan EETM 200 mg/kg bb memiliki perbedaan yang signifikan (p < 0,05) dengan kelompok kontrol normal dan kontrol positif. Kadar serum kreatinin kelompok perlakuan EETM 400 mg/kg bb memiliki perbedaan yang signifikan (p < 0,05) terhadap normal, dan tidak berbeda signifikan (p > 0,05) terhadap kelompok kontrol positif.
Penelitian ini dilakukan untuk mengetahui pengaruh pemberian EETM terhadap kadar serum kreatinin dan histologi organ ginjal pada mencit jantan akibat parasetamol dosis toksik. EETM diberikan dalam berbagai dosis dengan tujuan untuk mengetahui EETM dapat menetralisir kerusakan ginjal akibat parasetamol dosis toksik dengan indikator kadar serum kreatinin yang menurun dan histologi organ ginjal mencit.
Penggunaan parasetamol dosis toksik menimbulkan kerusakan jaringan yang berhubungan dengan deplesi glutation secara signifikan dan terjadi peroksidasi lipid sehingga terbentuk akumulasi intrasel dan pengikatan metabolit reaktif yang tinggi (NAPQI), kerusakan sel hati dan sering berakhir dengan kematian. Pengaruh serupa juga terjadi pada jaringan ginjal (Adeneye, dkk., 2008). Hal ini menimbulkan akumulasi parasetamol yang berakibat terjadi reaksi rantai biokimia dan memuncak pada nefropati akut maupun kronik (Schnellman, 2001). Selain itu, parasetamol juga memicu terjadinya apoptosis pada sel hati dan ginjal (Ray dan Jena; Boulares, dkk., 2002).
dan serum kreatinin (Adeneye, dkk., 2008). Kreatinin berasal dari endogen akibat pemecahan keratin jaringan (Palani, dkk., 2009). BUN dan serum kreatinin mencerminkan kecepatan laju filtrasi glomerulus (LFG) sehingga bila terjadi penurunan LFG sebesar 50%, kadar BUN dan serum kreatinin akan meningkat dua kali lipat (Noer, 2006).
Berdasarkan analisis data kadar serum kreatinin yang dilakukan terhadap kelompok kontrol, dapat diketahui bahwa pemberian parasetamol dosis toksik pada kelompok kontrol negatif menyebabkan kadar serum kreatinin yang meningkat serta memiliki perbedaan yang signifikan terhadap kelompok normal. Penelitian serupa juga dilakukan oleh Gosh dan Shil (2007), Adeneye, dkk., (2008), dan Palani, dkk., (2009) yang menunjukkan peningkatan signifikan serum kreatinin pada pemberian parasetamol dosis toksik.
Kreatinin merupakan produk penguraian otot yang mengindikasikan adanya gangguan fungsi ginjal apabila kadarnya melebihi batas normal. Kreatinin serum merupakan indikator kuat bagi fungsi ginjal dan konsentrasinya relatif konstan dari hari ke hari (Corwin, 2009).
dan temulawak dapat mengurangi kerusakan ginjal mencit yang telah diinduksi parasetamol.
Rimpang temu mangga yang digunakan dalam penelitian ini mengandung antioksidan alami berupa kurkuminoid (Hutapea, 1993; Sudewo, 2004). Penelitian telah menunjukkan bahwa gugus fenolik kurkumin sangat berperan sebagai penangkal radikal (antioksidan). Kurkumin sebagai inhibitor sitokrom p-450 kemungkinan diperantarai oleh kehadiran gugus hidroksi (Hakim, 2003).
Reaksi radikal hidroksil (OH) dengan kurkumin menyebabkan hidrogen fenolik ditarik, kemudian radikal fenolik yang dihasilkan dimantapkan dan bereaksi kembali dengan radikal fenolik tersebut. Dengan cara ini OH dinetralkan, sehingga mencegah terjadinya peroksidasi lipid pada membrane mitokondria. Kemudian kurkumin akan terurai membentuk asam ferulat dan fenilbutenon (Suyatna, 2012).
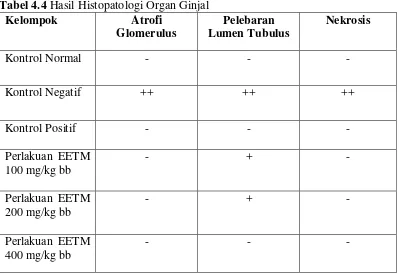
4.3 Hasil Histopatologi Organ Ginjal
Tabel 4.4 Hasil Histopatologi Organ Ginjal
Gambar 4.2 Jaringan ginjal kelompok kontrol normal
Gambar 4.3 Jaringan ginjal kelompok kontrol negatif
Gambar 4.4 Jaringan ginjal kelompok kontrol positif
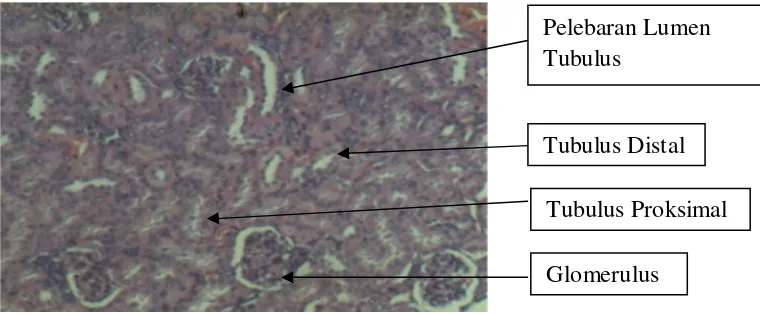
Glomerulus
Tubulus Proksimal
Tubulus Distal
Tubulus Distal
Pelebaran Lumen Tubulus
Atrofi Glomerulus Glomerulus
Tubulus Proksimal
Nekrosis
Glomerulus
Tubulus Distal
Tubulus Proksimal Tubulus Proksimal
Gambar 4.6 Jaringan ginjal kelompok perlakuan EETM 200 mg/kg bb
Gambar 4.7 Jaringan ginjal kelompok perlakuan EETM 400 mg/kg bb
Nefrotoksisitas seperti akibat parasetamol dapat menyatukan beberapa jalur molekuler apoptosis, termasuk menghilangkan molekul protektif intraseluler dan aktivasi kaspase. Meskipun parasetamol tidak merubah ekspresi mRNA (messenger-Ribose Nucleid Acid) pada gen antiapoptosis Bcl-xL, tetapi dapat menurunkan kadar protein Bcl-xL, yang berarti dapat meningkatkan aktivitas apoptosis (Lorz, dkk., 2005). Parasetamol juga menginduksi stres retikulum endoplasma pada glomerulus ginjal, yang menyebabkan stres oksidatif dan inflamasi pada sel-sel podosit serta mesangial glomerulus (Inagi, 2009). Senyawa ROS, yang merupakan hasil metabolisme parasetamol, juga dapat menyebabkan kerusakan glomerulus yang diawali dengan inflitrasi leukosit (Singh, dkk., 2006).
Glomerulus
Tubulus Proksimal Tubulus Distal Pelebaran Lumen Tubulus
Glomerulus Tubulus Distal
Salah satu efek merugikan overdosis parasetamol adalah nekrosis tubulus ginjal (Goodman dan Gilman, 2008). Pelebaran ruang Bowman diakibatkan atrofi glomerulus, yaitu menurunnya ukuran jaringan yang disebabkan oleh berkurangnya jumlah sel atau berkurangnya ukuran sel (Spector, 1993). Kerusakan ini mengakibatkan terganggunya proses filtrasi darah. Jika kemampuan menyaring darah berkurang, maka sel darah dan protein dapat keluar bersama urin atau malah tertimbun pada tubulus karena dapat lolos pada proses filtrasi (Hasnisa, dkk., 2014).
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
a. EETM dosis 100 mg/kg bb, 200 mg/kg bb dan 400 mg/kg bb memiliki aktivitas nefroprotektif terhadap mencit jantan yang diinduksi parasetamol. Dosis efektif dari EETM sebagai neproprotektif adalah pada dosis 400 mg/kg bb dengan kadar serum kreatinin 0,5320 ± 0,0804 mg/dl yang menunjukkan perbedaan yang signifikan (p < 0,05) dari kontrol negatif dan tidak berbeda signifikan (p > 0,05) dari kontrol positif dan tidak menunjukkan adanya kerusakan jaringan ginjal pada pemeriksaan histopatologi jaringan.
b. Peningkatan dosis EETM dari dosis 100 mg/kg bb, 200 mg/kg bb, dan 400 mg/kg bb menunjukkan peningkatan aktivitas neproprotektif.
5.2 Saran