Pengertian Industri Kimia
Saturday August 02nd 2008, 8:39 am
Filed under: Teknik Kimia
Industri adalah suatu kelompok usaha yang menghasilkan produk yang serupa atau sejenis. Sedangkan produk adalah barang atau jasa yang ditawarkan oleh suatu usaha.
Yang merupakan kelompok utama dari industri adalah :
Industri budidaya: Merupakan industri yang mengolah sumber daya alam yang dapat terbarukan, antara lain meliputi pertanian, perkebunan, kehutanan, peternakan, perikanan
Industri ekstraktif: Merupakan industri yang mengolah sumber daya alam yang tak terbarukan, antara lain meliputi pertambangan mineral logam, non logam, batu bara, minyak bumi dan gas.
Industri fabrikasi: Merupakan industri yang menghasilkan produk dengan mengolah dan memprosesnya dalam suatu sarana fisik atau bengkel. Yang termasuk dengan industri fabrikasi adalah industri manufaktur dan industri proses kimia.
Industri konstruksi: Merupakan industri yang berhubungan dengan penyediaan bangunan-bangunan fisik yang dimanfaatkan untuk kepentingan publik maupun sosial, antara lain : pengecoran beton, konstruksi, arsitek.
Industri jasa: Merupakan industri yang menyediakan pelayanan jasa kepada yang membutuhkan, antara lain meliputi perbankan, asuransi, bursa efek, perdagangan, transportasi, pemerintahan, pariwisata, pendidikan, hiburan, kesehatan.
INDUSTRI PROSES KIMIA
Industri proses kimia adalah industri yang mengolah bahan baku / bahan mentah menjadi suatu hasil / produk dengan memanfaatkan proses-proses kimia. Proses-proses kimia yang dilakukan dalam industri proses kimia adalah reaksi kimia dan peristiwa kimia fisik.
Peristiwa kimia fisik antara lain :
Pencampuran molekuler bahan-bahan dengan rumus dan struktur molekul yang berlainan.
Pengubahan fase, antara lain : penguapan, pengembunan, pengkristalan Pemisahan campuran menjadi zat-zat penyusunnya yang lebih murni Yang termasuk ke dalam industri proses kimia adalah :
Industri pengolahan minyak bumi atau petroleum refinery:Pada industri ini biasanya dihasilkan komponen-komponen bahan bakar minyak (BBM), seperti : bensin, kerosene, bahan bakar penerbangan, solar, minyak diesel. Di samping itu dihasilkan juga produk-produk selain komponen bahan bakar minyak (non BBM), seperti, pelumas, wax, aspal, solvent maupun produk petrokimia.
Industri petrokimia:yaitu industri yang mengolah zat atau bahan yang berasal dari fraksi minyak bumi, seperti : Etilen (C2H4) dan Propilen (C3H6).
Industri pengolahan logam
Industri oleokimia:yaitu industri yang mengolah zat atau bahan yang berasal dari fraksi minyak atau lemak nabati atau hewani, seperti pabrik CPO (Crude Palm Oil). Industri agrokimia: yaitu industri yang memproduksi aneka pupuk dan bahan kimia
untuk budidaya pertanian, seperti pestisida, urea, ammonium sulfat. Industri makanan dan minuman, seperti : susu, gula, garam.
Industri bahan pewarna dan pencelup. Industri bahan peledak
Industri pulp dan kertas Industri semen dan keramik Industri karet, kulit dan plastik
Industri kimia adalah suatu bagian dari kimia terapan yang berhubungan dengan optimasi, pengembangan dan pengetahuan kimia dasar proses yang digunakan dalam industri untuk memproduksi bahan kimia atau produk kimia.
Ciri-ciri industri kimia
1. Reaksi kimia antara bahan organic dan anorganik atau keduanya.
2. Ekstraksi, separasi atau purifikasi dari produk alam atau tanpa bantuan reaksi-reaksi kimia.
3. Pemisahan dari material yang memiliki rumus spesifikasi. Apakah dari bahan alam maupun buatan.
Klasifikasi kimia industri 1. Industri kimia dasar
3. Aneka industri 4. Industri kecil 5. Industri pariwisata Sumber-sumber energi
1. Sumber energi matahari 2. Sumber energi biomassa 3. Sumber energi bioenergi 4. Sumber energi panas bumi 5. Sumber energi pasang surut 6. Sumber energi plasma 7. Sumber energi nuklir 8. Sumber energi angin
Referensi : Materi Pembelajaran Dosen Pengajar Mata Kuliah Kimia Industri.
PENGERTIAN INDUSTRI KIMIA
Jan 21
kerjasama sejumlah individu, rencana tujuan, spesialisasi aktivitas, penggunaan alat-alat dan mesin
Tujuan pokok industri : Menghasilkan barang dan jasa Jenis-jenis industri
Industri manufaktur : otomotif Industri proses : kimia Industri jasa : perbankan Peran industri kimia
Industri pangan
Industri pakaian : tekstil,benang Kesehatan
Shelter : cat, perekat, lantai, plastik Komunikasi : parts
Transportasi : parts Apa saja yang termasuk industri kimia?
Industri kimia hulu
Asam, Basa, Garam, Zat Organik, Zat Anorganik, Pelarut, Bahan Petrokimiadsb. Industri kimia lain
Plastik, Pupuk, Pestisida, Semen, Gula, Alkohol, Pulp & Kertas dsb. Industri lain
Industri hulu langsung kepemakai Kesehatan, Laboratorium, Penelitian Penggolongan produk industri kimia (berdasarkan sifat produk)
1. Produk tak terdiferensiasi (undifferentiated) A. Dijual atas dasar komposisi
B. Tidak berbeda dengan produsen-produsen lain C. Penggunaan : untuk beberapa keperluan Dibagi menjadi 2 :
a. bahan kimia komoditas sejati Volume produksi besar
Dijual atas dasar komposisi sesuai dengan keinginan konsumen/industri
Misalnya : soda api, asam sulfat, metanol, gas-gas industri (CO2,O2), pupuk kimia (urea, TSP) dsb.
b. Bahan kimia adi (fine chemicals) Volume produksi tidak besar
Dijual menngikuti standar tertentu (misalnya US Pharmacopeia, Food Chemicals Codex)
Misalnya : bahan kimia obat (aspirin), bahan kimia aroma 2. Produk Terdiferensiasi (differentiated)
Dijual berdasarkan fungsi Berbeda antar produsen
Digunakan untuk 1 atau 2 keperluan Dibagi menjadi 2 :
Konsumen : membeli dalam jumlah besar/ industri lain misalnya : plastik & resin, serat sintetik
B. Bahan kimia khusus Volume produksi kecil Bahan mentah dari pasar Konsumen luas
Misalnya : pestisida ramuan, bahan anti korosi, bahan anti oksidasi, bahan campuran pelumas Ditulis dalam Bahan Kuliah, Kimia Industri, Proses Manufaktur
1 Komentar
Tag: Bahan kuliah, Kimia Industri
Proses Kimia Gas Alam (NATURAL
GAS)
Des 12
Posted by Mechanical Blog Asal
Merupakan hasil proses alam seperti minyak bumi Keberadaan di bumi :
– Bersama-sama dengan minyak bumi – Tanpa minyak bumi
Gas Alam di Indonesia :
– Jumlah cekungan ada 60 (darat dan laut) – Yang sudah dibor 36
Bahan bakar, LNG (Liquified Natural Gas), natural gasoline, carbon black, helium, hidrogen, gas sintetis dan beberapa petrokimia
Karena bentuknya gas, sehingga sulit transportasi gas dicairkan sebagai LNG
Dengan pencairan terjadi pengurangan volume 1/600 kali volume asal Komposisi
Campuran hidrokarbon C1,C2,C3,C4,C5 dengan CO2,N2, He (kadang-kadang) Pengotor : Hg, Sulfur dan air
Komposisi gas alam yang bisa digunakan : – Fraksi C1 maksimum 85,2 % mol
– Fraksi C4+ maksimum 1,9 % mol – Fraksi C5+ maksimum 0,09 % mol – Fraksi H2S maksimum 6,0 mg/m3 – Total Sulfur maksimum 314 mg/m3 Proses Pencairan
Melalui 2 proses :
1. pemurnian : penghilangan CO2, air,mercuri, fraksi berat 2. pencairan
Penghilangan CO2
Kadar CO2 dalam gas alam cukup tinggi Dapat membeku pada suhu -1550C akan menyumbat pipa
Cara : dengan absorbsi
Absorben yang dapat digunakan : 1. Larutan K2CO3
Penghilangan Air
Air dapat menyebabkan : o Terbentuknya es
o Membentuk hidrat dengan hidrokarbon dapat menyebabkan penyumbatan pipa Cara :
o Absorbsi : ethylen glikol
o Adsorbsi : silika gel, silika per alumin, molecular sieve Penghilangan Mercuri (Hg)
Dapat merusak pipa yang terbuat dari aluminium Cara : reaksikan dengan sulfur – HgS
Penghilangan Fraksi Berat
Dapat menyebabkan pembakaran tidak sempurna Pada pembakaran menghasilkan asap hitam (C) Pencairan
Dengan proses refrijerasi Suhu operasi -1600C
Refrijeran : ammoniak (-140C), freon (-500C)C
3, MCR (multi componen refrigerant)
Kriteria pemilihan refrijeran : o Entalpi penguapan tinggi o Suhu (titik) gelembung rendah o Ekonomis
Penyimpanan dan Pengangkutan 1. Penyimpanan
o Bentuk cair, suhu maksimum – 160oC
o Bahan penyimpan harus tahan terhadap tekanan tinggi(misalnya Al, 8% Nikel & beton tertentu)
o Tangki diberi isolasi (perlite, busa poliuretan) Jenis-jenis tangki penyimpan :
o Tangki berupa gua dalam tanah
o Tangki berupa lubang dalam tanah dilengkapi dengan penutup khusus o Tangki beton pratekan dengan isolasi
o Tangki dinding baja dua lapis dengan isolasi antara dua dinding Variabel untuk perancangan tangki:
o Kapasitas tangki
o Tekanan operasi maksimal o Temperatur operasi
o Densitas cairan
o Kebocoran panas yang diperbolehkan 2. Pengangkutan
o Pipa (piping)
o Angkutan laut dengan tanker khusus, antara lain :
Sistem membran, tangki berbentuk kotak dengan dinding membran dilengkapi insulasi panas
Ditulis dalam Bahan Kuliah, Kimia Industri, Proses Manufaktur 1 Komentar
Tag: Bahan kuliah, Kimia Industri, Proses Manufaktur
Proses Kimia Pulp dan
Kertas
Nov 2
Posted by Mechanical Blog
Bahan Baku
Selulosa (terdapat dalam tumbuhan berupa serat) Jenis-jenis selulosa :
1. a-selulosa → untuk pembuatan kertas 2. b-selulosa disebut dengan hemi selulosa 3. g-selulosa —→ menjadi pengotor Sifat Selulosa
1. gugus aktif alkohol (dapat mengalami oksidasi) 2. derajat polimerisasi (serat menjadi panjang)
Makin panjang serat, kertas makin kuat dan tahan terhadap degradasi (panas, kimia dn biologi), download disini bahan kuliah tentang industri pulp dan kertas :industri pulp dan kertas
Ditulis dalam Bahan Kuliah, Kimia Industri 1 Komentar
Tag: Bahan kuliah, Kimia Industri
Proses Kimia Minyak
Nabati
Nov 1
Posted by Mechanical Blog Kegunaan :
Sebagai bahan makanan: minyak goreng, bahan baku margarin, kue dsb. kandungan terbesar adalah lemak, yang berfungsi untuk:
1) sumber energi
2) pembawa vitamin A,D,E,K
3) mengandung asam lemak esensial terutama asam lemak tak jenuh Bahan baku industri lain :
– sabun – cat – vernish
– kosmetik (sampo. Lipstik dll) – pelumas BAHAN BAKU
Biji-bijian atau buah-buahan, yang memiliki nilai ekonomis : – kelapa
– jarak
– olive (zaitun) – kacang tanah – biji kapuk – biji kapas
PENGGOLONGAN MINYAK Golongan jenuh
– tidak memiliki ikatan rangkap – misal asam stearat (C17H35COOH) Golongan monoolefinik
– memiliki 1 ikatan rangkap
– misal asam oleat (C17H33COOH) Golongan poliolefinik
– memiliki 2 ikatan rangkap
– misal asam linoleat (C17H31COOH), – asam linolenat (C17H29COOH)
Minyak alamiah mengandung campuran asam lemak yang tersusun tidak hanya oleh satu macam asam lemak, tetapi oleh 2 atau 3 macam asam lemak
Perbedaan ANTARA MINYAK DAN LEMAK Minyak :
Pada suhu kamar berbentuk cair
Banyak mengandung asam lemak tak jenuh Lemak :
Pada suhu kamar berbentuk padat
Produksi Minyak Nabati Di Indonesia Bahan baku : kelapa atau kelapa sawit
Perbedaan kandungan beberapa bahan baku minyak nabati Nilai Ekonomis
Kelapa :
– banyak terdapat di Indonesia – kandungan : * sabut 35% * batok 12 %
* daging 28 % * air 25 %
– kandungan minyak :
* daging segar 35 – 50 % lemak * kopra 63 – 65 % lemak Nilai Ekonomis
Kelapa sawit
– banyak di Indonesia
– kandungan : * sabut 35 -60 % * biji sawit 6 – 13 %
– kandungan minyak : sabut 50 – 55 % PROSES PRODUKSI MINYAK NABATI Minyak kasar (minyak mentah = crude oil) Perbaikan kualitas
Cara memperoleh minyak kasar Ada 2 cara :
1. press hidrolik : sisa minyak 5 – 7 % screw press : sisa minyak 4–6%
2. ekstraksi : sisa minyak ± 1 % dengan pelarut : – hexan
– trichloro ethylene – benzene
Hasil minyak kasar (crude oil) harus diolah lagi untuk mendapatkan kualitas minyak yang lebih baik
RAFINASI Tujuan :
untuk menghilangkan kotoran dan bau yang tidak enak Macam-macam proses :
a. Degumming b. Netralisasi c. Bleaching d. Deodorisasi
Proses-proses dalam Rafinasi
Degumming
– Tujuan : untuk menghilangkan zat-zat terlarut/ koloid (resin gum, protein, fosfatida dalam minyak)
Cara :
Netralisasi
– Tujuan : Untuk menghilangkan asam lemak bebas (FFA) yang dapat menimbulkan bau tengik
Cara :
– dengan menambah soda kaustik (proses penyabunan), juga untuk decolorisasi – dengan destilasi uap dapat mereduksi FFA sampai tersisa 0,01 – 0,03 %
Proses-proses dalam Rafinasi Bleaching
– Tujuan : untuk menghilangkan zat warna yang terlarut/terdispersi – warna berasal bawaan bahan baku
a. Caratinoid (merah dan kuning) b. Klorofil dan peptin (hijau) – Cara :
a. Absorbsi dengan norit atau tanah pemucat b. Secara kimia dengan prinsip reaksi oksidasi c. Hidrogenasi & pemanasan
Proses-proses dalam Rafinasi Deodorisasi
– Tujuan : untuk menghilangkan rasa dan bau yang tidak dikehendaki (0,001 – 0,1%), yang
berasal dari karbohidrat tak jenuh, FFA dengan MR rendah, atau senyawa- senyawa aldehid dan keton
Tujuan : untuk memisahkan fraksi cair (minyak) dan fraksi padat (lemak) Fraksi cair mengandung olein
padat mengandung stearin Cara :
a. Tanpa pelarut (fraksionasi kering) b. Dengan pelarut (fraksionasi basah)
c. Dengan larutan deterjen (sodium lauryl sulfat) Cara-cara Fraksionasi
Fraksionasi tanpa pelarut
Minyak dipanaskan sampai 700 C kemudian didinginkan dan suhu dipertahankan pada 500 C selama 24 jam
Fraksionasi dengan pelarut
Cara : dengan ditambahkan pelarut ke dalam minyak, kemudian diaduk perlahan-lahan sampai diperoleh fasa cair dan fasa padat
Bag atas : Fasa cair (campuran antara olein & pelarut) dipisahkan dengan destilasi
Bag bawah : fasa padat (stearin) Fraksionasi dengan larutan deterjen
* secara prinsip = fraksionasi kering, hanya ditambahkan deterjen untuk aksi pembasahan (wtting action)
* waktu pendinginan lebih cepat dan hasil pemisahan lebih baik INTERESTERIFIKASI
jika lemak dipanaskan dengan adanya suatu katalisator (biasabya Natrium Ethoxida atau Natrium Methoxida) sampai temperatur 110 – 1600C, maka gugusan asam lemak dapat berubah posisi
Proses Kimia Pembakaran Batubara
by Hendra Yudisaputro on September 16, 2015 Proses Kimia Pembakaran Batubara2015-10-13T07:38:56+00:00 - Batu Bara - No Comment
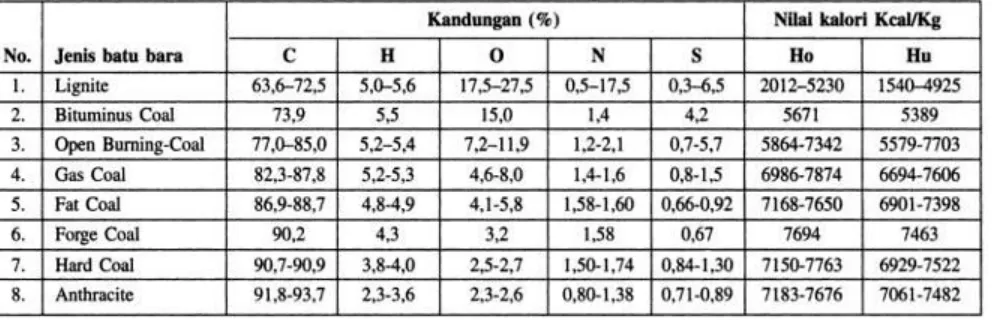
Batubara adalah bahan bakar utama pembangkit listrik tenaga uap yang terkandung energi secara kimia melalui ikatan-ikatan kimia antara karbon, hidrogen, oksigen, nitrogen, dan sulfur. Batubara tidak memiliki struktur kimia yang baku karena merupakan campuran dari beberapa ikatan hidrokarbon yang kompleks, dan apabila ikatan tersebut terputus melalui proses pembakaran maka akan menghasilkan energi panas.
Nilai kalor batubara yang merupakan indikator dari kualitas batubara dibagi menjadi dua jenis, yaitu High Heating Value (HHV) dan Low Heating Value (LHV). High Heating Value
(HHV) atau nilai kalori atas didapat dengan cara membakar batubara sebanyak satu kilogram
dan mengukur kalori yang didapat dengan menggunakan kalorimeter pada suhu 15 C ᵒ sehingga uap air yang dihasilkan dari pembakaran ini mengembun dan melepaskan kalori pengembunannya. Sedangkan Low Heating Value (LHV) atau nilai kalori rendah didapat dengan cara mengurangi nilai kalori atas dengan kalori pengembunan air yang dikandungnya.
Proses pembakaran batubara yang umumnya terjadi di dalam boiler pada pembangkit listrik tenaga uap, dan merupakan reaksi kimia yang dilakukan dengan menambah oksigen O2 dari udara pembakaran dengan reaksi kimia sebagai berikut.
Proses pembakaran batubara yang umumnya terjadi di dalam boiler pada pembangkit listrik tenaga uap, dan merupakan reaksi kimia yang dilakukan dengan menambah oksigen O2 dari udara pembakaran dengan reaksi kimia sebagai berikut.
C + O2 –> CO2 + energi panas
Karena di dalam batubara terdapat ikatan-ikatan kimia antara karbon, hidrogen, oksigen, nitrogen, dan sulfur maka pada proses pembakaran batubara juga akan timbul reaksi kimia antara ikatan-ikatan kimia tersebut dengan oksigen yang terdapat di udara yang ditunjukkan pada reaksi kimia beikut.
2H2 + O2 –> 2H2O N2 + O2 –> NOX
Kemudian dengan udara H2O yang terdapat di udara, maka reaksi kimia di atas dapat bereaksi menjadi bermacam-macam asam nitrat HNOX, dengan rantai kimia sebegai berikut.
S + O2 –> SO2
Selanjutnya SO2 bersamaan dengan H2O dan O2 yang berada di dalam boiler bereaksi dan membentuk rantai kimia sebagai berikut.
2SO2 + 2H2O + O2 –> 2H2SO4
Timbulnya asam nitrat HNOX dan asam sulfat sebagai hasil pembakaran unsur Nitrogen (N) dan Sulfur (S) yang terbawa oleh batubara dapat mengakibatkan pencemaran lingkungan dan jumlahnya harus dibatasi. Unsur-unsur tersebut di atas dapat terbakar dan bereaksi dengan O2 sehingga menghasilkan energi panas, kecuali beberapa unsur seperti air dan abu. Kandungan air yang berada batubara lignite secara umum lebih dari 60%, sedangkan pada batu bara
antrachite kandungan airnya lebih rendah sebanyak 2-5%, sedangkan kandungan abu
batubara bervariasi antara 0,8-20,8%.
kalor yang relatif tinggi karena jumlah kilogram batubara yang harus dibakar persatuan waktu menjadi lebih banyak untuk mencapai daya pembangkitan yangg sama.
Penyediaan batubara untuk pembangkitan listrik tenaga uap juga harus memperhatikan ada tidaknya unsur yang dapat merusak boiler, seperti halnya silika yang dapat menyebabkan korosi suhu tinggi. Disamping itu, kandungan unsur Sulfur (S) juga dapat menimbulkan asam sulfat 2H2SO4 seperti pada reaksi di atas. Pada unit pembangkitan listrik yang suhunya relatif dingin (dibawah 180oC) yaitu pada sistem pemanasan udara (air preheater) asam sulfat dapat mengembun dan menimbulkan korosi suhu rendah.
Batu bara adalah salah satu bahan bakar fosil. Pengertian umumnya adalah batuan sedimen yang dapat terbakar, terbentuk dari endapan organik, utamanya adalah sisa-sisa tumbuhan dan terbentuk melalui proses pembatubaraan. Unsur-unsur utamanya terdiri dari karbon,
hidrogen dan oksigen.
Batu bara juga adalah batuan organik yang memiliki sifat-sifat fisika dan kimia yang kompleks yang dapat ditemui dalam berbagai bentuk.
Analisis unsur memberikan rumus formula empiris seperti C137H97O9NS untuk bituminus dan C240H90O4NS untuk antrasit.
Daftar isi
1 Batu bara secara umum
o 1.1 Umur batu bara
o 1.2 Materi pembentuk batu bara
o 1.3 Penambangan
o 1.4 Kelas dan jenis batu bara
o 1.5 Pembentukan batu bara
2 Batu bara di Indonesia
o 2.1 Endapan batu bara Eosen
o 2.3 Sumberdaya batu bara
Pembentukan batu bara memerlukan kondisi-kondisi tertentu dan hanya terjadi pada era-era tertentu sepanjang sejarah geologi. Zaman Karbon, kira-kira 340 juta tahun yang lalu (jtl), adalah masa pembentukan batu bara yang paling produktif di mana hampir seluruh deposit batu bara (black coal) yang ekonomis di belahan bumi bagian utara terbentuk.
Pada Zaman Permian, kira-kira 270 jtl, juga terbentuk endapan-endapan batu bara yang ekonomis di belahan bumi bagian selatan, seperti Australia, dan berlangsung terus hingga ke Zaman Tersier (70 - 13 jtl) di berbagai belahan bumi lain.
Materi pembentuk batu bara
Hampir seluruh pembentuk batu bara berasal dari tumbuhan. Jenis-jenis tumbuhan pembentuk batu bara dan umurnya menurut Diessel (1981) adalah sebagai berikut:
Alga, dari Zaman Pre-kambrium hingga Ordovisium dan bersel tunggal.
Sangat sedikit endapan batu bara dari periode ini.
Silofita, dari Zaman Silur hingga Devon Tengah, merupakan turunan dari
alga. Sedikit endapan batu bara dari periode ini.
Pteridofita, umur Devon Atas hingga Karbon Atas. Materi utama
pembentuk batu bara berumur Karbon di Eropa dan Amerika Utara. Tetumbuhan tanpa bunga dan biji, berkembang biak dengan spora dan tumbuh di iklim hangat.
Gimnospermae, kurun waktu mulai dari Zaman Permian hingga Kapur
seperti gangamopteris dan glossopteris adalah penyusun utama batu bara Permian seperti di Australia, India dan Afrika.
Angiospermae, dari Zaman Kapur Atas hingga kini. Jenis tumbuhan
modern, buah yang menutupi biji, jantan dan betina dalam satu bunga, kurang bergetah dibanding gimnospermae sehingga, secara umum, kurang dapat terawetkan.
Penambangan
Tambang batu bara di Bihar, India.
Penambangan batu bara adalah penambangan batu bara dari bumi. Batu bara digunakan sebagai bahan bakar. Batu bara juga dapat digunakan untuk membuat coke untuk pembuatan baja.[1]
Tambang batu bara tertua terletak di Tower Colliery di Inggris.
Kelas dan jenis batu bara
Berdasarkan tingkat proses pembentukannya yang dikontrol oleh tekanan, panas dan waktu, batu bara umumnya dibagi dalam lima kelas: antrasit, bituminus, sub-bituminus, lignit dan gambut.
Antrasit adalah kelas batu bara tertinggi, dengan warna hitam berkilauan
(luster) metalik, mengandung antara 86% - 98% unsur karbon (C) dengan kadar air kurang dari 8%.
Bituminus mengandung 68 - 86% unsur karbon (C) dan berkadar air
8-10% dari beratnya. Kelas batu bara yang paling banyak ditambang di Australia.
Sub-bituminus mengandung sedikit karbon dan banyak air, dan oleh
karenanya menjadi sumber panas yang kurang efisien dibandingkan dengan bituminus.
Lignit atau batu bara coklat adalah batu bara yang sangat lunak yang
mengandung air 35-75% dari beratnya.
Gambut, berpori dan memiliki kadar air di atas 75% serta nilai kalori yang
Pembentukan batu bara
Proses perubahan sisa-sisa tanaman menjadi gambut hingga batu bara disebut dengan istilah pembatu baraan (coalification). Secara ringkas ada 2 tahap proses yang terjadi, yakni:
Tahap Diagenetik atau Biokimia, dimulai pada saat material tanaman
terdeposisi hingga lignit terbentuk. Agen utama yang berperan dalam proses perubahan ini adalah kadar air, tingkat oksidasi dan gangguan biologis yang dapat menyebabkan proses pembusukan (dekomposisi) dan kompaksi material organik serta membentuk gambut.
Tahap Malihan atau Geokimia, meliputi proses perubahan dari lignit
menjadi bituminus dan akhirnya antrasit.
Batu bara di Indonesia
Di Indonesia, endapan batu bara yang bernilai ekonomis terdapat di cekungan Tersier, yang terletak di bagian barat Paparan Sunda (termasuk Pulau Sumatera dan Kalimantan), pada umumnya endapan batu bara ekonomis tersebut dapat dikelompokkan sebagai batu bara berumur Eosen atau sekitar Tersier Bawah, kira-kira 45 juta tahun yang lalu dan Miosen atau sekitar Tersier Atas, kira-kira 20 juta tahun yang lalu menurut Skala waktu geologi.
Batu bara ini terbentuk dari endapan gambut pada iklim purba sekitar khatulistiwa yang mirip dengan kondisi kini. Beberapa di antaranya tegolong kubah gambut yang terbentuk di atas muka air tanah rata-rata pada iklim basah sepanjang tahun. Dengan kata lain, kubah gambut ini terbentuk pada kondisi di mana mineral-mineral anorganik yang terbawa air dapat masuk ke dalam sistem dan membentuk lapisan batu bara yang berkadar abu dan sulfur rendah dan menebal secara lokal. Hal ini sangat umum dijumpai pada batu bara Miosen. Sebaliknya, endapan batu bara Eosen umumnya lebih tipis, berkadar abu dan sulfur tinggi. Kedua umur endapan batu bara ini terbentuk pada lingkungan lakustrin, dataran pantai atau delta, mirip dengan daerah pembentukan gambut yang terjadi saat ini di daerah timur Sumatera dan sebagian besar Kalimantan.[2]
Endapan batu bara Eosen
Endapan ini terbentuk pada tatanan tektonik ekstensional yang dimulai sekitar Tersier Bawah atau Paleogen pada cekungan-cekungan sedimen di Sumatera dan Kalimantan.
Ekstensi berumur Eosen ini terjadi sepanjang tepian Paparan Sunda, dari sebelah barat Sulawesi, Kalimantan bagian timur, Laut Jawa hingga Sumatera. Dari batuan sedimen yang pernah ditemukan dapat diketahui bahwa pengendapan berlangsung mulai terjadi pada Eosen Tengah. Pemekaran Tersier Bawah yang terjadi pada Paparan Sunda ini ditafsirkan berada pada tatanan busur dalam, yang disebabkan terutama oleh gerak penunjaman Lempeng Indo-Australia.[3] Lingkungan pengendapan mula-mula pada saat Paleogen itu non-marin, terutama fluviatil, kipas aluvial dan endapan danau yang dangkal.
mana endapan fluvial kemudian ditutupi oleh lapisan batu bara yang terjadi pada dataran pantai yang kemudian ditutupi di atasnya secara transgresif oleh sedimen marin berumur Eosen Atas.[4]
Endapan batu bara Eosen yang telah umum dikenal terjadi pada cekungan berikut: Pasir dan Asam-asam (Kalimantan Selatan dan Timur), Barito (Kalimantan Selatan), Kutai Atas (Kalimantan Tengah dan Timur), Melawi dan Ketungau (Kalimantan Barat), Tarakan (Kalimantan Timur), Ombilin (Sumatera Barat) dan Sumatera Tengah (Riau).
Dibawah ini adalah kualitas rata-rata dari beberapa endapan batu bara Eosen di Indonesia.
Tambang Cekung
10.00 7.00 8.00 41.50 0.80 6800
Senakin Pasir
PT Arutmin Indonesia
9.00 4.00 15.00 39.50 0.70 6400
Petangis Pasir
PT BHP Kendilo Coal
11.00 4.40 12.00 40.50 0.80 6700
Ombilin Ombilin PT Bukit
(ar) - as received, (ad) - air dried, Sumber: Indonesian Coal Mining Association, 1998
Endapan batu bara Miosen
Pada Miosen Awal, pemekaran regional Tersier Bawah - Tengah pada Paparan Sunda telah berakhir. Pada Kala Oligosen hingga Awal Miosen ini terjadi transgresi marin pada kawasan yang luas di mana terendapkan sedimen marin klastik yang tebal dan perselingan sekuen batugamping. Pengangkatan dan kompresi adalah ketampakan yang umum pada tektonik Neogen di Kalimantan maupun Sumatera. Endapan batu bara Miosen yang ekonomis terutama terdapat di Cekungan Kutai bagian bawah (Kalimantan Timur), Cekungan Barito (Kalimantan Selatan) dan Cekungan Sumatera bagian selatan. Batu bara Miosen juga secara ekonomis ditambang di Cekungan Bengkulu.
lainnya adalah kadar abu dan belerang yang rendah. Namun kebanyakan sumberdaya batu bara Miosen ini tergolong sub-bituminus atau lignit sehingga kurang ekonomis kecuali jika sangat tebal (PT Adaro) atau lokasi geografisnya menguntungkan. Namun batu bara Miosen di beberapa lokasi juga tergolong kelas yang tinggi seperti pada Cebakan Pinang dan Prima (PT KPC), endapan batu bara di sekitar hilir Sungai Mahakam, Kalimantan Timur dan beberapa lokasi di dekat Tanjungenim, Cekungan Sumatera bagian selatan.
Tabel dibawah ini menunjukan kualitas rata-rata dari beberapa endapan batu bara Miosen di Indonesia.
Prima Coal9.00 - 4.00 39.00 0.50 6800 (ar)
Pinang Kutai PT Kaltim
Prima Coal13.00 - 7.00 37.50 0.40 6200 (ar) Roto
Coal 18.00 14.00 4.20 40.10 0.50 6100 (ad) Lati Tarakan PT Berau
Coal 24.60 16.00 4.30 37.80 0.90 5800 (ad)
Air Laya
Sumatera bagian selatan
PT Bukit
Asam 24.00 - 5.30 34.60 0.49 5300 (ad)
Paringin Barito PT Adaro 24.00 18.00 4.00 40.00 0.10 5950 (ad)
(ar) - as received, (ad) - air dried, Sumber: Indonesian Coal Mining Association, 1998
Pengisian batu bara ke dalam kapal tongkang.
Potensi sumberdaya batu bara di Indonesia sangat melimpah, terutama di Pulau Kalimantan dan Pulau Sumatera, sedangkan di daerah lainnya dapat dijumpai batu bara walaupun dalam jumlah kecil dan belum dapat ditentukan keekonomisannya, seperti di Jawa Barat, Jawa Tengah, Papua, dan Sulawesi.
Badan Geologi Nasional memperkirakan Indonesia masih memiliki 160 miliar ton cadangan batu bara yang belum dieksplorasi. Cadangan tersebut sebagian besar berada di Kalimantan Timur dan Sumatera Selatan. Namun upaya eksplorasi batu bara kerap terkendala status lahan tambang. Daerah-daerah tempat cadangan batu bara sebagian besar berada di kawasan hutan konservasi.[5] Rata-rata produksi pertambangan batu bara di Indonesia mencapai 300 juta ton per tahun. Dari jumlah itu, sekitar 10 persen digunakan untuk kebutuhan energi dalam negeri, dan sebagian besar sisanya (90 persen lebih) diekspor ke luar.
Di Indonesia, batu bara merupakan bahan bakar utama selain solar (diesel fuel) yang telah umum digunakan pada banyak industri, dari segi ekonomis batu bara jauh lebih hemat dibandingkan solar, dengan perbandingan sebagai berikut: Solar Rp 0,74/kilokalori sedangkan batu bara hanya Rp 0,09/kilokalori, (berdasarkan harga solar industri Rp. 6.200/liter).
Dari segi kuantitas batu bara termasuk cadangan energi fosil terpenting bagi Indonesia. Jumlahnya sangat berlimpah, mencapai puluhan miliar ton. Jumlah ini sebenarnya cukup untuk memasok kebutuhan energi listrik hingga ratusan tahun ke depan. Sayangnya,
Indonesia tidak mungkin membakar habis batu bara dan mengubahnya menjadi energis listrik melalui PLTU. Selain mengotori lingkungan melalui polutan CO2, SO2, NOx dan CxHy cara ini dinilai kurang efisien dan kurang memberi nilai tambah tinggi.
Batu bara sebaiknya tidak langsung dibakar, akan lebih bermakna dan efisien jika dikonversi menjadi migas sintetis, atau bahan petrokimia lain yang bernilai ekonomi tinggi. Dua cara yang dipertimbangkan dalam hal ini adalah likuifikasi (pencairan) dan gasifikasi
(penyubliman) batu bara.
Membakar batu bara secara langsung (direct burning) telah dikembangkan teknologinya secara continue, yang bertujuan untuk mencapai efisiensi pembakaran yang maksimum, cara-cara pembakaran langsung seperti: fixed grate, chain grate, fluidized bed, pulverized, dan lain-lain, masing-masing mempunyai kelebihan dan kelemahannya.
Gasifikasi batu bara
Tetapi, batu bara bukanlah bahan bakar yang sempurna. Terikat di dalamnya adalah sulfur dan nitrogen, bila batu bara ini terbakar kotoran-kotoran ini akan dilepaskan ke udara, bila mengapung di udara zat kimia ini dapat menggabung dengan uap air (seperti contoh kabut) dan tetesan yang jatuh ke tanah seburuk bentuk asam sulfurik dan nitrit, disebut sebagai "hujan asam" “acid rain”. Disini juga ada noda mineral kecil, termasuk kotoran yang umum tercampur dengan batu bara, partikel kecil ini tidak terbakar dan membuat debu yang tertinggal di coal combustor, beberapa partikel kecil ini juga tertangkap di putaran combustion gases bersama dengan uap air, dari asap yang keluar dari cerobong beberapa partikel kecil ini adalah sangat kecil setara dengan rambut manusia.
Bagaimana membuat batu bara bersih
Ada beberapa cara untuk membersihkan batu bara. Contoh sulfur, sulfur adalah zat kimia kekuningan yang ada sedikit di batu bara, pada beberapa batu bara yang ditemukan di Ohio, Pennsylvania, West Virginia dan eastern states lainnya, sulfur terdiri dari 3 sampai 10 % dari berat batu bara, beberapa batu bara yang ditemukan di Wyoming, Montana dan negara-negara bagian sebelah barat lainnya sulfur hanya sekitar 1/100ths (lebih kecil dari 1%) dari berat batu bara. Penting bahwa sebagian besar sulfur ini dibuang sebelum mencapai cerobong asap. Satu cara untuk membersihkan batu bara adalah dengan cara mudah memecah batu bara ke bongkahan yang lebih kecil dan mencucinya. Beberapa sulfur yang ada sebagai bintik kecil di batu bara disebut sebagai "pyritic sulfur " karena ini dikombinasikan dengan besi menjadi bentuk iron pyrite, selain itu dikenal sebagai "fool's gold” dapat dipisahkan dari batu bara. Secara khusus pada proses satu kali, bongkahan batu bara dimasukkan ke dalam tangki besar yang terisi air , batu bara mengambang ke permukaan ketika kotoran sulfur tenggelam. Fasilitas pencucian ini dinamakan "coal preparation plants" yang membersihkan batu bara dari pengotor-pengotornya.
Tidak semua sulfur bisa dibersihkan dengan cara ini, bagaimanapun sulfur pada batu bara adalah secara kimia benar-benar terikat dengan molekul karbonnya, tipe sulfur ini disebut "organic sulfur," dan pencucian tak akan menghilangkannya. Beberapa proses telah dicoba untuk mencampur batu bara dengan bahan kimia yang membebaskan sulfur pergi dari molekul batu bara, tetapi kebanyakan proses ini sudah terbukti terlalu mahal, ilmuan masih bekerja untuk mengurangi biaya dari prose pencucian kimia ini.
Kebanyakan pembangkit tenaga listrik modern dan semua fasilitas yang dibangun setelah 1978 — telah diwajibkan untuk mempunyai alat khusus yang dipasang untuk membuang sulfur dari gas hasil pembakaran batu bara sebelum gas ini naik menuju cerobong asap. Alat ini sebenarnya adalah "flue gas desulfurization units," tetapi banyak orang menyebutnya "scrubbers" — karena mereka men-scrub (menggosok) sulfur keluar dari asap yang dikeluarkan oleh tungku pembakar batu bara.
Membuang NOx dari batu bara
Nitrogen secara umum adalah bagian yang besar daripada udara yang dihirup, pada kenyataannya 80% dari udara adalah nitrogen, secara normal atom-atom nitrogen
oksigen, bentuk ini sebagai nitrogen oksida atau kadang kala itu disebut sebagai NOx. NOx juga dapat dibentuk dari atom nitrogen yang terjebak di dalam batu bara.
Di udara, NOx adalah polutan yang dapat menyebabkan kabut coklat yang kabur yang kadang kala terlihat di seputar kota besar, juga sebagai polusi yang membentuk “acid rain” (hujan asam), dan dapat membantu terbentuknya sesuatu yang disebut “ground level ozone”, tipe lain daripada polusi yang dapat membuat kotornya udara.
Salah satu cara terbaik untuk mengurangi NOx adalah menghindari dari bentukan asalnya, beberapa cara telah ditemukan untuk membakar batu bara di pemabakar di mana ada lebih banyak bahan bakar daripada udara di ruang pembakaran yang terpanas. Di bawah kondisi ini kebanyakan oksigen terkombinasikan dengan bahan bakar daripada dengan nitrogen.
Campuran pembakaran kemudian dikirim ke ruang pembakaran yang kedua di mana terdapat proses yang mirip berulang-ulang sampai semua bahan bakar habis terbakar. Konsep ini disebut "staged combustion" karena batu bara dibakar secara bertahap. Kadang disebut juga sebagai "low-NOx burners" dan telah dikembangkan sehingga dapat mengurangi kangdungan Nox yang terlepas di uadara lebih dari separuh. Ada juga teknologi baru yang bekerja seperti "scubbers" yang membersihkan NOX dari flue gases (asap) dari boiler batu bara. Beberapa dari alat ini menggunakan bahan kimia khusus yang disebut katalis yang mengurai bagian NOx menjadi gas yang tidak berpolusi, walaupun alat ini lebih mahal dari "low-NOx burners," namun dapat menekan lebih dari 90% polusi Nox.
Cadangan batu bara dunia
Daerah batu bara di Amerika Serikat
Pada tahun 1996 diestimasikan terdapat sekitar satu exagram (1 × 1015 kg atau 1 trilyun ton) total batu bara yang dapat ditambang menggunakan teknologi tambang saat ini, diperkirakan setengahnya merupakan batu bara keras. Nilai energi dari semua batu bara dunia adalah 290 zettajoules.[6] Dengan konsumsi global saat ini adalah 15 terawatt,[7] terdapat cukup batu bara untuk menyediakan energi bagi seluruh dunia untuk 600 tahun.
Departemen Energi Amerika Serikat memperkirakan cadangan batu bara di Amerika Serikat sekitar 1.081.279 juta ton (9,81 × 1014 kg), yang setara dengan 4.786 BBOE (billion barrels of oil equivalent).[8]
Yunani 2.874 2.874
Bulgaria 13 233 2.465 2.711
Pakistan 2.265 2.265
Iran 1.710 1.710
Britania Raya 1.000 500 1.500
Rumania 1 35 1.421 1.457
Thailand 1.268 1.268
Meksiko 860 300 51 1.211
Chili 31 1.150 1.181
Hongaria 80 1.017 1.097
Peru 960 100 1060
Kirgizstan 812 812
Jepang 773 773
Spanyol 200 400 60 660
Korea Utara 300 300 600
Selandia Baru 33 206 333 572
Zimbabwe 502 502
Belanda 497 497
Venezuela 479 479
Argentina 430 430
Filipina 232 100 332
Slovenia 40 235 275
Mozambik 212 212
Swaziland 208 208
Tanzania 200 200
Greenland 183 183
Slowakia 172 172
Vietnam 150 150
Republik Kongo 88 88
Korea Selatan 78 78
Niger 70 70
Afganistan 66 66
Aljazair 40 40
Kroasia 6 33 39
Portugal 3 33 36
Perancis 22 14 36
Italia 27 7 34
Austria 25 25
Ekuador 24 24
Mesir 22 22
Irlandia 14 14
Zambia 10 10
Malaysia 4 4
Afrika Tengah 3 3
Myanmar 2 2
Malawi 2 2
Kaledonia Baru 2 2
Nepal 2 2
Bolivia 1 1
Norwegia 1 1
Swedia 1 1
Negara pengekspor batu bara utama
Pengekspor batu bara berdasarkan negara dan tahun
(dalam juta ton)[13]
Negara 2003 2004
Australia 238,1 247,6
Amerika Serikat 43,0 48,0
Afrika Selatan 78,7 74,9
Uni Soviet 41,0 55,7
Polandia 16,4 16,3
Kanada 27,7 28,8
Republik Rakyat
Tiongkok 103,4 95,5
Amerika Selatan 57,8 65,9
Indonesia 200,8 131,4
Total 713, 9
764, 0
Lihat pula
Daftar perusahaan batu bara Indonesia
Skala waktu geologi
Yayasan Batu Bara Duniaen
BAB II
PEMBAHASAN
Belerang atau sulfur didapatkan dalam 2 bentuk yaitu sebagai senyawa sufida dan sebagai belerang alam. Sebagai senyawa sufida didapatkan dalam bentuk gelena-PbS, chalkopirit-CuFeS2 dan Pirit FeS. Kesemuanya terbentuk akibat proses hidrotermal, kecuali
yang tersebut terakhir dapat pula terbentuk akibat proses sedimentasi dalam kondisi tertentu. Sedang belerang alam unsur tersebut berbentuk kristal bercampur lumpur atau merupakan hasil sublimasi.
Endapan belerang ini terbentuk oleh kegiatan solfatara, fumarola,atau sebagai akibat dari gas dan larutan yang mengandung belerang keluar dari dalam bumi melalui rekahan-rekahan, serta selalu berkaitan dengan rangkaian gunung api akrif. Dengan demikian belerang alam dikelompokkan menjadi tife sublimasi dan tife lumpur.
Asam sulfat mempunyai rumus kimia H2S O4, merupakan asam mineral (anorganik) yang kuat. Zat ini larut dalam air pada semua perbandingan.
Asam sulfat mempunyai banyak kegunaan, termasuk dalam kebanyakan reaksi kimia. Kegunaan utama termasuk pemrosesan bijih mineral, sintesis kimia, pemrosesan air limbah dan pengilangan minyak.
Reaksi hidrasi (pelarutan dalam air) dari asam sulfat adalah reaksi eksoterm yang kuat. Jika air ditambah kepada asam sulfat pekat, terjadi pendidihan. Senantiasa tambah asam kepada air dan bukan sebaliknya. Sebagian dari masalah ini disebabkan perbedaan isipadu kedua cairan. Air kurang padu dibanding asam sulfat dan cenderung untuk terapung di atas asam. Reaksi tersebut membentuk ion hidronium:
H2SO4 + H2O → H3O+ + HSO4-.
Disebabkan asam sulfat bersifat mengeringkan, asam sulfat merupakan agen pengering yang baik, dan digunakan dalam pengolahan kebanyakan buah-buahan kering.
Apabila gas SO3 pekat ditambah kepada asam sulfat, ia membentuk H2S2O7. Ini dikenali sebagai asam sulfat fuming atau oleum atau, jarang-jarang sekali, asam Nordhausen.
perkembangan pemakaiannya dapat merupakan indikator bagi perkembangan perindustrian di suatu negara.
Bahan baku utama pembuatan asam sulfat adalah sulfur atau belerang, yang berwarna kuning. Biasanya ditambang dari pegunungan, seperti di tangkuban perahu, dieng, atau bromo (ini lokasi - lokasi yang orang awam biasanya tahu. masih banyak lainnya)
Asam sulfat merupakan komoditas kimia yang sangat penting, dan sebenarnya pula, produksi asam sulfat suatu negara merupakan indikator yang baik terhadap kekuatan industri negara tersebut. Kegunaan utama (60% dari total produksi di seluruh dunia) asam sulfat adalah dalam "metode basah" produksi asam fosfat, yang digunakan untuk membuat pupuk fosfat dan juga trinatrium fosfat untuk deterjen. Pada metode ini, batuan fosfat digunakan dan diproses lebih dari 100 juta ton setiap tahunnya.
Bahan-bahan baku yang ditunjukkan pada persamaan di bawah ini merupakan fluorapatit, walaupun komposisinya dapat bervariasi. Bahan baku ini kemudian diberi 93% asam suflat untuk menghasilkan kalsium sulfat, hidrogen fluorida (HF), dan asam fosfat. HF dipisahan sebagai asam fluorida. Proses keseluruhannya dapat ditulis:
Ca5F(PO4)3 + 5H2SO4 + 10H2O → 5 CaSO4•2H2O + HF + 3H3PO4
Asam sulfat digunakan dalam jumlah yang besar oleh industri besi dan baja untuk menghilangkan oksidasi, karat, dan kerak air sebelum dijual ke industri otomobil. Asam yang telah digunakan sering kali didaur ulang dalam kilang regenerasi asam bekas (Spent Acid Regeneration (SAR) plant).
Kilang ini membakar asam bekas dengan gas alam, gas kilang, bahan bakar minyak, ataupun sumber bahan bakar lainnya. Proses pembakaran ini akan menghasilkan gas sulfur dioksida (SO2) dan sulfur trioksida (SO3) yang kemudian digunakan untuk membuat asam sulfat yang "baru".
Amonium sulfat, yang merupakan pupuk nitrogen yang penting, umumnya diproduksi sebagai produk sampingan dari kilang pemroses kokas untuk produksi besi dan baja. Mereaksikan amonia yang dihasilkan pada dekomposisi termal batu bara dengan asam sulfat bekas mengijinkan amonia dikristalkan keluar sebagai garam (sering kali berwarna coklat karena kontaminasi besi) dan dijual kepada industri agrokimia.
sulfat lainnya (19%), dan dari gas buangan industri minyak bumi / batu bara (H2S, SO2) (25%). 70 – 85% dari produksi sulfur tersebut digunakan untuk pembuatan asam sulfat.
Isotop
Belerang memiliki sebelas isotop. Dari empat isotop yang ada di alam, tidak satupun yang bersifat radioaktif. Belerang dengan bentuk yang sangat halus, dikenal sebagai bunga belerang, dan diperoleh dengan cara sublimasi.
Senyawa-Senyawa
Senyawa organik yang mengandung belerang sangat penting. Kalsium sulfur, ammonium sulfat, karbon disulfida, belerang dioksida dan asam sulfida adalah beberapa senyawa di antara banyak senyawa belerang yang sangat penting
Bentuk-Bentuk dari Belerang :
belerang alam dalam bentuk kristal
belerang dalam bentuk senyawa dengan logam lainnya (pyrite, marcasite, pyrhotite)
Sifat Fisik dan Kimia
Belerang atau sulfur adalah mineral yang dihasilkan oleh proses vulkanisme, sifat-sifat fisik dan kimia belerang adalah :
Kristal belerang berwarna kuning kegelapan dan kehitam-hitaman karena pengaruh unsur pengotornya
Berat jenis : 2,05 - 2,09
Kekerasan : 1,5 - 2,5 (skala Mohs)
Ketahanan : getas/mudah hancur (brittle)
pecahan :berbentuk konkoidal dan tidak rata
Kilap : damar Gores : berwarna putih
Titik lebur 129°C dan titik didihnya 446°C. Mudah larut dalam CS2, CC14, minyak bumi, minyak tanah, dan anilin, penghantar panas dan listrik yang buruk
Apabila dibakar apinya berwarna biru dan menghasilkan gas-gas SO2 yang berbau busuk
tidak larut dalam air (bisulfida, tetrachloride)
Daya hantar listrik buruk
berbau tidak enak
Teori Terbentuknya Belerang
Teori Bischof
Sulfur berasal dari H2S, dimana H2S berasal dari proses reduksi terhadap CaSO4 oleh karbon methan
CaSO4 + C + CaS + 2CO2
CaSO4 + CH4 + CaS + CO2 + 2H2O CaS + CO2 + H2 + CaCO3 + H2S 2H2S + O2 + 2H2O + 2S
atau
2H2S + CaSO4 + 4S + Ca(OH)2 + H2O
Belerang berasal dari suatu dome dibentuk dari suatu bakteri De Sulfovibri de Sulfurcanc. Sulfat diubah oleh bakteri menjadi sulfit dan akhirnya menghasilkan sulfur
Belerang terdapat pada gypsum yang diendapkan langsung dari poly sulfit
Belerang erat kaitannya dengan kegiatan gunung berapi, merupakan hasil sublimasi sulfatara atau fumarol, juga akibat dari gas-gas/ larutan yang mengandung belerang dari dalam bumi
Tipe Lumpur terdapat dekat kawah dengan kadar 40-60%S
Tipe kerak terdapat disekitar kawah dengan kadar 20-50% S
Macam-Macam Belerang dalam Perdagangan
Sublime flower/ flower of sulfur
diperoleh dari hasil sublimasi, digunakan untuk industri karet
Sulfur Flour
sulfur berputir halus seperti tepung, dilakukan grinding bebas oksigen sampai ukuran mesh – 325 mesh, sebagai Galian pembasmi hama penyakit tanaman/hewan
Precipitated Sulfur
diperoleh dari reaksi antara HCl pada larutan poli sulfit kemudian dicuci untuk menghilangkan CaS, digunakan dalam farmasi
Lac Sulfur
diperoleh dari larutan polisulfit yangg diberi H2SO4, masih mengandung 45% CaSO4
Colloidal Sulfur
pertikel halus masih dalam larutan berbentuk colloid, diperoleh hasil cleaning coke oven gas. B.
Teknik Penambangan
Penambangan endapan belerang dapat dikerjakan dengan cara tambang terbuka. Penggalian belerangnya dapat dilakukan dengan alat-alat sederhana atau dapat pula dengan tambang semprot. Apabila jumlah endapan belerang sedikit maka penambangannya dapat dilakukan secara manual dengan menggunakan peralatan antara lain: cangkul, linggis, ganco dan keranjang dan dilaksanakan dengan tenaga manusia.
Untuk endapan belerang yang ditutupi oleh lapisan penutup yang cukup tebal, cara penambangannya dapat dilakukan dengan cara Frash Process, yaitu dengan pemboran kemudian dimasukan air panas (suhu 335º F) kedalam endapan belerang. Melalui pipa-pipa kondensasi dipompakan keluar dan ditampung dan diendapkan. Tahap berikutnya disublimasi untuk mendapatkan belerang yang bersih.
Tambang terbuka : shovel
Tambang semprot
Frasch proses dimasukan air panas 335 F ke dalam endapan belerang lewat pipa-pipa. ada 3 pipa dengan ukuran :
Diameter 1” = mengalirkan udara
Diameter 3” = mengalirkan Lumpur sulfur Diameter 6” = mengalirkan air panas Tekanan udara = 500 psi
Beberapa penambang mengambil belerang dengan cara melinggis bongkahan belerang di kaldera Gunung Ijen di Desa Ampelgading, Kecamatan Licin, Banyuwangi, Jawa Timur, Selasa (20/10). Berdasar data di Dinas Energi Sumber Daya Mineral (ESDM) Provinsi Jatim, kapasitas produksi belerang Gunung Ijen mencapai 1.736,318 ton.
Belerang ini muncul dari perut bumi karena aktivitas magma yang mendorong air dari sumber mata air keluar ke permukaan bumi dengan membawa belerang.
C.
Cara Pengolahan Belerang dan Asam Sulfat
Cara pengolahan belerang tergantung dari jenis endapannya dan hasil yang diinginkan. Untuk belerang yang berbentuk kristal dapat langsung dimasukkan kedalam autiklat dimasukkan/ditambahkan solar, air dan NaOH, kemudian dipanaskan dengan memasukkan uap air panas dengan tekanan 3 atmosfer selama 30-60 menit. Pemisahan akan terjadi karena belerang mempunyai titik lebur yang lebih rendah dibandingkan dengan mineral-mineral pengotornya. Hasilnya yang berupa belerang cair dialirkan melalui filter dan kemudian dicetak.
Pengolahan
Ada beberapa cara yang dilakukan dalam pengolahan belerang, diantaranya
Cara lain pelarutan dan penghabluran (solvent extraction and Crystalization) digunakan pelarut: karbon disulfida, dimethyl disulphide atau larutan hidrokarbon berat lainnya.
Belerang kristal dapat langsung dimasukan dalam autoclave, lalu ditambah solar, air NaOH kemudian dipanaskan dengan memasukan uap air panas dengan tekanan 3 atm selama 30-60 menit. Pemisahan tanur terjadi karena titik lebur belerang < min pengotor. Belerang disaring kemudian dicetak.
Belerang kadar tinggi diolah dengan sublimasi dan distilasi
Pengolahan sederhana dilakukan dengan wajan besi/alumunium dengan diameter 80-100 cm, dipanaskan dalam tungku/kompor minyak. Belerang mencair, disaring kemudian dicetak dalam tabung bamboo.
Dalam pengambilan sulfur, terdapat beberapa proses yang lazim digunakan, yakni :
1. Proses Frasch
Diagram skema proses frasch
Dasar pengambilan sulfur menurut proses ini adalah pencairan sulfur di bawah tanah / laut dengan air panas, lalu mamompanya ke atas permukaan bumi. Untuk maksud itu digunakan 3 pipa konsentris 6”, 3”, dan 1”. Air panas (325oC) dipompakan ke dalam batuan S melalui bagian pipa 6”, sehingga S akan meleleh (235oF). Lelehan S yang lebih berat dari air akan masuk ke bagian bawah antara pipa 3” dan 1”, dan dengan tekanan udara yang dipompakan melalui pipa 1”, air yang bercampur dengan S akan naik ke atas sebagai “crude S”, untuk kemudian diolah menjadi “crude bright” atau “refined S”.
2. Pengambilan S dari batuan sulfida / sulfat
S dapat pula diambil dari batuan sulfida atau sulfat, seperti pyrite FeS2, chalcopyrite CuFeS2, covelita CuS, galena PbS, Zn blende ZnS, gips CaSO4, barire BaSO4, anglesite PbSO4, dan lain – lain.
Deposit S di gunung berapi dapat berupa batuan, lumpur sedimen atau lumpur sublimasi, kadarnya tidak begitu tinggi (30 – 60 %) dan jumlahnya tidak begitu banyak (600 – 1000 juta ton, total).
Di gunung Talaga Bodas di dapat dalam bentuk lumpur dengan kadar S (30 – 70 %) dan jumlah deposit 300 juta ton. Tempat – tempat lainnya adalah : kawah Ijen, Gunung Welirang, Gunung Dieng dan Gunung Tangkuban Perahu. Untuk pemanfaatan sumber alam ini diperlukan peningkatan kadar S terlebih dahulu, antara lain dengan cara flotasi dan benefication.
Dalam flotasi dilakukan penambahan air dan ‘frother’ sehingga S akan terapung dan dapat dipisahkan. Sedangkan dalam ‘benefication proses’ S setelah ditambahkan air dan reagen – reagen dipanaskan dalam autoclave selama ½ - ¾ jam pada 3 atm, setiap partikel – partikel kecil S terkumpul, kemudian dilakukan pencucian dengan air untuk menghilangkan tanah, lalu dipanaskan kembali dalam autoclave sehingga S terpisah sebagai lapisan S dengan kadar 80 – 90 %.
4. Pengambilan S dari gas buang
S diperoleh dari flue gas asal pembakaran batu bara atau penyilangan minyak bumi, yang tidak boleh dibuang ke udara karena dapat menimbulkan pencemaran. Gas – gas tersebut terlebih dahulu di absorpsi dengan menggunakan etanolamin dan sebagainya, kemudian dipanaskan kembali untuk mendapatkan gasnya kembali untuk diproses lebih lanjut.
Reaksi utama yang digunakan (proses claus)
i. 2 H2S(g) + 3 O2(g) → 2 SO2(g) + 2H2O(l) ΔHo = - 247,89 KJ ii. 4 H2S(g) + 2SO2(g) → S6(g) + 4H2O(l) ΔHo = - 42,24 KJ
Proses pembuatan asam sulfat
Ada 2 macam proses untuk membuat Asam Sulfat :
Pembuatan H2SO4 dengan proses timbale
Proses tersebut menggunakan ruang reaktor yang dindingnya dilapisi timbal ( Pb ) oleh sebab itu dinamakan proses kamar timbal / bilik timbal.
Reaksi yang terjadi:
2 SO2(g) + 2 NO2(g) → 2 SO3(g) + 2 NO(g)
Gas NO dialirkan ke suatu tempat reaksi ( reactor ) dan dioksidasi kembali menjadi NO2
2 NO(g) + O2(g) → 2NO2(g)
Gas SO3 di kamar timbal direaksikan dengan air yang disemprotkan SO3(g) + H2O(l) → H2SO4(l)
Kepekatan H2SO4 yang dihasilkan kira-kira 62,5 % dan dipekatkan lagi hingga 77,6 %
Pembuatan H2SO4dengan proses kontak
Pada tahun 1831 seorang ahli kimia berkebangsaan Inggris, Philips telah berhasil mensintesis belerang menjadi H2SO4 sebagai katalis digunakan V2O5 Reaksi yang terjadi :
S(s) + O2(g) → SO2(g)
2 SO2(g) + O2(g) → 2SO3(g) ΔH = - 98,3 KJ
Sulfur trioksida diserap ke dalam 97-98% H2SO4 menjadi oleum (H2S2O7), juga dikenal sebagai asam sulfat berasap. Oleum kemudian diencerkan ke dalam air menjadi asam sulfat pekat.
H2SO4 (l) + SO3(g) → H2S2O7 (l) H2S2O7 (l) + H2O (l) → 2 H2SO4 (l)
Asam Sulfat yang dihasilkan dari proses tersebut , mempunyai massa jenis 1,84 dan bersifat higroskopis. Apabila H2SO4 pekat dicampur dengan air , akan bersifat eksoterm dan bebbahaya. H2SO4 25 % banyak dijual di pasaran dengan nama accu zuur untuk mengisi aki. Sebenarnya, asam sulfat dapat dibuat dengan cara melarutkan gas SO3. Namun, perhatikan bahwa pelarutan langsung SO3 ke dalam air tidaklah praktis karena reaksi sulfur trioksida dengan air yang bersifat eksotermik. Reaksi ini akan membentuk aerosol korosif yang akan sulit dipisahkan.
SO3(g) + H2O (l) → H2SO4(l)
Proses kontak masih digunakan sampai sekarang walaupun katalisnya bukan platina, tetapi campuran termasuk vanadium oksida V2O5. Dari proses kontak ini lalu akan terbentuk asam sulfat pekat dgn kadar 98% .
Pada proses kontak digunakan suhu sekitar 500 C dengan katalisator V2O5 ,sebenarnya tekanan besar akan menguntungkan produksi SO3, tetapi penambahan tekanan ternyata tidak diimbangi penambahan hasil yang memadai. Oleh karena itu, pada proses kontak tidak digunakan tekanan besar melainkan tekanan normal, 1 atm.
Lokasi
Potensi dan penyebaran endapan belerang Indonesia saat ini baru diketahui di enam propinsi, dengan total cadangan sekitar 5,4 juta. Untuk tipe sublimasi, karena proses terjadinya didasarkan kepada aktivitas gunung berapi, maka selama gunung berapi aktif, belerang tipe ini dapat diproduksi. Dengan demikian sumber daya belerang sublimasi dapat dianggap tidak terbatas.
1. Jabar : Gunung Tangkuban perahu, Danau Putri, Galunggung, Ceremai, Telaga bodas 2. Jateng : Gunung Dieng
3. Jatim : Gunung Arjuno, welirang
4. Sumut : Gunung Namora
5. Sulut : Gunung Mahawu, Soputan
6. Maluku : Pulau Damar
D.
Pemanfaatan Belerang dan Asam Sulfat
Digunakan untuk membuat asam belerang (H2SO4), untuk pupuk, penghalus minyak, bahan kimia, metallurgi. Di samping itu dapat digunakan untuk cat, ebonite (camp dengan karet), tekstil, cairan sulfida, C2S, debu anti serangga, pengawet kayu, pabrik kertas, korek api, obat-obatan
Kegunaan
Belerang merupakan bahan hasil tambang yang baunya sangat menyengat,bahan tersebut memiliki khasiat bagi tubuh manusia, antara lain;
mengobati dari luka bekas gigitan binatang berbisa. Boleh juga belerang yang sudah dibuat korek api tumbuk sampai halus dan masukan ke lubang bekas gigitan, lalu bakarlah.
obat gatal-gatal pada kulit. ambil belerang sebesar ibu jari, lalu gerus bersama 3 butir merica dan setengah buah pala. Setelah halus, aduklah dengan sesendok makan minyak tanah dan air. Oleskan pada bagian tubuh yang diserang gatal-gatal
Menghilangkan panu/kurap yang menghiasi kulit. Setelah belerang dihaluskan, campurlah dengan minyak goring lalu aduklah sampai rata. Oleskan pada bagian kulit yang berpanu atau kurap. Lakukan sesering mungkin
Belerang sangat penting untuk kehidupan. Belerang adalah penyusun lemak, cairan tubuh dan mineral tulang, dalam kadar yang sedikit.
Untuk membuat asam sulfat
Untuk membuat gas SO2 yang biasa dipakai untuk mencuci bahan yang terbuat dari wool dan sutera.
Pada industri ban , belerang untuk vulkanisasi karet yang berkaitan agar ban bertambah ketegangannya serta kekuatannya.
Belerang juga digunakan pada industri obat-obatan, bahan peledak, dan industri korek api yang menggunakan Sb2S3
Al2O3 + 3 H2SO4 → Al2(SO4)3 + 3 H2O
Asam sulfat juga memiliki berbagai kegunaan di industri kimia. Sebagai contoh, asam sulfat merupakan katalis asam yang umumnya digunakan untuk mengubah sikloheksanonoksim menjadi kaprolaktam, yang digunakan untuk membuat nilon. Ia juga digunakan untuk membuat asam klorida dari garam melalui proses Mannheim. Banyak H2SO4 digunakan dalam pengilangan minyak bumi, contohnya sebagai katalis untuk reaksi isobutana dengan isobutilena yang menghasilkan isooktana.
Walaupun asam sulfat tidak mudah terbakar, kontak dengan logam dalam kasus tumpahan asam dapat menyebabkan pelepasan gas hidrogen. Penyebaran aerosol asam dan gas sulfur dioksida menambah bahaya kebakaran yang melibatkan asam sulfat.
Asam sulfat dianggap tidak beracun selain bahaya korosifnya. Resiko utama asam sulfat adalah kontak dengan kulit yang menyebabkan luka bakar dan penghirupan aerosol asap. Paparan dengan aerosol asam pada konsentrasi tinggi akan menyebabkan iritasi mata, saluran pernafasan, dan membran mukosa yang parah.
Iritasi akan mereda dengan cepat setelah paparan, walaupun terdapat risiko edema paru apabila kerusakan jaringan lebih parah. Pada konsentrasi rendah, simtom-simtom akibat paparan kronis aerosol asam sulfat yang paling umumnya dilaporkan adalah pengikisan gigi.
Indikasi kerusakan kronis saluran pernafasan masih belum jelas. Di Amerika Serikat, batasan paparan yang diperbolehkan ditetapkan sebagai 1 mg/m³. Terdapat pula laporan bahwa penelanan asam sulfat menyebabkan defisiensi vitamin B12 dengan degenarasi gabungan sub akut.
Belerang juga digunakan untuk pembuatan kertas sulfit dan kertas lainnya, untuk mensterilkan alat pengasap, dan untuk memutihkan buah kering. Belerang merupakan insultor yang baik.
E.
Fakta Mengenai Belerang
Salah satu aplikasi populer belerang sebagai bahan dalam mandi lumpur, yang sebenarnya mungkin lebih menguntungkan dari yang mereka munculkan. Ada bukti bahwa mandi lumpur memberikan banyak manfaat kesehatan pada kulit, dan manfaat berbagai masalah kulit terkait
Manfaat kesehatan dari belerang yang telah dipelajari pada tingkat yang terbatas adalah yang menggunakan pengobatan arthritis .
Penelitian telah menunjukkan bahwa jenis terapi yang disebut Balneotherapy, yang dapat mencakup mandi lumpur belerang, menawarkan manfaat kesehatan untuk mereka yang menderita dari berbagai bentuk radang sendi, termasuk psoriasis arthritis, osteoarthritis, dan rheumatoid arthritis . Ada juga studi yang menunjukkan bahwa ketika belerang diterapkan pada kulit sebagai pengobatan topikal, meningkatkan banyak gejala radang sendi seperti sendi bengkak dan nyeri.
Ada juga beberapa bukti terbatas yang menunjukkan bahwa belerang topikal mungkin berguna dalam mengobati lebih umum nyeri sendi . Studi dilakukan pada proses ini telah menemukan bahwa ketika belerang dioleskan ada peningkatan dalam kisaran bersama tentang gerak bersama dengan penurunan nominal rasa sakit. Bukti untuk ini adalah campuran, bagaimanapun, dan penelitian tambahan perlu dilakukan sebelum sesuatu yang meyakinkan dapat dikatakan. Bagi mereka yang ingin menambah asupan belerang mereka, ada banyak sumber makanan yang sangat baik dari belerang termasuk telur, bawang putih, bawang, daging, kacang-kacangan, dan s
Sulfur semakin banyak digunakan sebagai komponen pupuk . Bentuk yang paling penting dari sulfur untuk pupuk adalah mineral kalsium sulfat . Elemen sulfur adalah hidrofobik (yaitu, tidak larut dalam air) dan, karenanya, tidak dapat langsung dimanfaatkan oleh tanaman. Seiring waktu, bakteri tanah dapat dikonversi ke turunan larut, yang kemudian dapat dimanfaatkan oleh tanaman. Sulfur meningkatkan efisiensi penggunaan lain nutrisi tanaman penting, terutama nitrogen dan fosfor. partikel sulfur biologis yang dihasilkan secara alami hidrofilik karena lapisan biopolimer. Belerang ini, oleh karena itu, lebih mudah untuk membubarkan atas tanah (melalui penyemprotan sebagai bubur encer), dan hasil dalam rilis lebih cepat.
F. Efek dari Belerang
terhadap 7 sukarelawan hanya 1 orang yang mengalami efek tidak baik pada 1 ppm. Jika selama 10 hingga 30 menit kedapatan konsentrasi mencapai 5 ppm akan mengakibatkan sesak napas pada cabang tenggorokan kita.
Bila kedapatan selama 20 menit mencapai konsentrasi 8 ppm akan memerahkan tenggorokan, gangguan pada hidung, dan iritasi pada tenggorokan. Sekitar 20 ppm merupakan titik kritis dari iritasi konsentrasi SO2, meskipun ada beberapa laporan bahwa ada orang-orang yang bekerja pada konsentrasi melampaui 20 ppm. Konsentrasi sebesar 500 ppm sangat tidak dianjurkan untuk dihirup oleh manusia.
Pada beberapa kasus dimana terdapat konsentrasi SO2 yang sangat tinggi pada ruangan tertutup, dapat mengakibatkan gangguan saluran udara, hypoxemia (kekurangan oksigen pada darah), dan kematian dalam hitungan menit. Efek dari pulmonary edema(gangguan pada paru-paru) meliputi batuk dan napas pendek yang dialami selama berjam-jam atau berhari-hari setelah kedapatan menghirup konsentrasi SO2. Gejala-gejala ini menyakitkan hati dan menguras tenaga. Hasil dari kedapatan menghirup konsentrasi dalam waktu yang sering, akan melukai paru-paru secara permanen. Selain itu, Belerang dioksida adalah zat berbahaya di atmosfer, sebagai pencemar udara.
BAB III
PENUTUP
A.
KESIMPULAN
Belerang atau sulfur didapatkan dalam 2 bentuk yaitu sebagai senyawa sufida dan sebagai belerang alam. Bahan baku utama pembuatan asam sulfat adalah sulfur atau belerang, yang berwarna kuning. Kristal belerang berwarna kuning kegelapan dan kehitam-hitaman karena pengaruh unsur pengotornya.
Garam (kimia)
Wajam Ads
Get exclusive offers now
www.wjoffers.com
WJ Offers brings you today’s best deals.
x
Dari Wikipedia bahasa Indonesia, ensiklopedia bebas
Natrium klorida (NaCl) adalah bahan utama garam dapur
Dalam ilmu kimia, garam adalah senyawaionik yang terdiri dari ion positif (kation) dan ion negatif (anion), sehingga membentuk senyawa netral (tanpa bermuatan). Garam terbentuk dari hasil reaksiasam dan basa. Komponen kation dan anion ini dapat berupa senyawa anorganik seperti klorida (Cl−), dan bisa juga berupa senyawa organik seperti asetat (CH3COO−) dan ion monoatomik seperti fluorida (F−), serta ion poliatomik seperti sulfat (SO42−). Natrium klorida (NaCl), bahan utama garam dapur adalah suatu garam.
Ada banyak macam-macam garam. Garam yang terhidrolisa dan membentuk ion hidroksida ketika dilarutkan dalam air maka dinamakan garam basa. Garam yang terhidrolisa dan membentuk ion hidronium di air disebut sebagai garam asam. Garam netral adalah garam yang bukan garam asam maupun garam basa. Larutan Zwitterion mempunyai sebuah anionik dan kationik di tengah di molekul yang sama, tapi tidak disebut sebagai garam. Contohnya adalah asam amino, metabolit, peptida, dan protein.
Larutan garam dalam air (Misalnya natrium klorida dalam air) merupakan larutan elektrolit, yaitu larutan yang dapat menghantarkan arus listrik. Cairan dalam tubuh makhluk hidup mengandung larutan garam, misalnya sitoplasma dan darah. Tapi, karena cairan dalam tubuh ini juga mengandung banyak ion-ion lainnya, maka tidak akan membentuk garam setelah airnya diuapkan.
Daftar isi
1 Ciri-ciri
o 1.1 Warna
o 1.2 Rasa
o 1.3 Bau
3 Pembentukan garam
4 Lihat juga
5 Referensi
Ciri-ciri
Warna
Kalium dikromat, garam berwarna jingga yang digunakan sebagai pigmen
Mangan dioksida, garam yang berwarna hitam
Garam dapat berwarna cerah dan transparan (contohnya natrium klorida), Buram, dan kadang juga berwarna metalik dan berkilau (Besi disulfida).
Garam dapat berwarna macam-macam, seperti misalnya di bawah ini:
kuning (natrium kromat), jingga (kalium dikromat), merah (kalium ferisianida),
mauve (kobalt klorida heksahidrat),
hijau (nikel klorida heksahidrat), putih (natrium klorida/garam dapur),
tidak berwarna (Magnesium Sulfate Heptahidrat) dan hitam (mangan dioksida).
Rasa
Di semua garam, ada 5 rasa berbeda, yaitu: asin (natrium klorida), manis (timbal (II) asetat, beracun kalau sampai tertelan), asam (kalium bitartrat), pahit (magnesium sulfat), dan gurih (monosodium glutamat).
Bau
Garam yang berasal dari asam kuat dan basa kuat ("garam kuat") biasanya stabil dan tidak berbau, sedangkan garam yang terbentuk dari asam lemah maupun basa lemah ("garam lemah") lebih berbau karena disebabkan oleh asam konjugasinya (contohnya asetat (asam asetat) pada (cuka) dan sianida seperti hidrogen sianida) atau bisa juga karena basa konjugasinya (contohnya garam amonium seperti amonia). Dekomposisi parsial ini bisa dipercepat dengan penambahan air, karena hidrolisis merupakan setengah bagian lain dari reaksi reversibel yang membentuk garam lemah.
Ion
Nama-nama garam diawali dengan nama ion kation (contohnya, natrium atau amonium) diikuti dengan nama ion anion (contohnya, klorida atau asetat).
Ion yang termasuk kation diantaranya:
Besi (III) oksida (Fe2O3)
Amonium NH4+
Kalsium Ca2+ Besi Fe2+ and Fe3+ Magnesium Mg2+ Kalium K+
Pyridinium C5H5NH+
Quaternary ammonium NR4+
Natrium Na+
Ion yang termasuk anion termasuk:
Asetat CH3COO− (asam asetat)
Karbonat CO32− (asam karbonat)
Klorida Cl− (asam klorida)
Sitrat HOC(COO−)(CH2COO−)2 (asam sitrat)
Sianida C≡N− (asam sianida) Hidroksida OH− (air)
Nitrat NO3− (asam nitrat)
Nitrit NO2− (asam nitrit)
Oksida O2− (air)
Sulfat SO42− (asam sulfat)
Pembentukan garam
Timbal(II) sulfat (PbSO4)
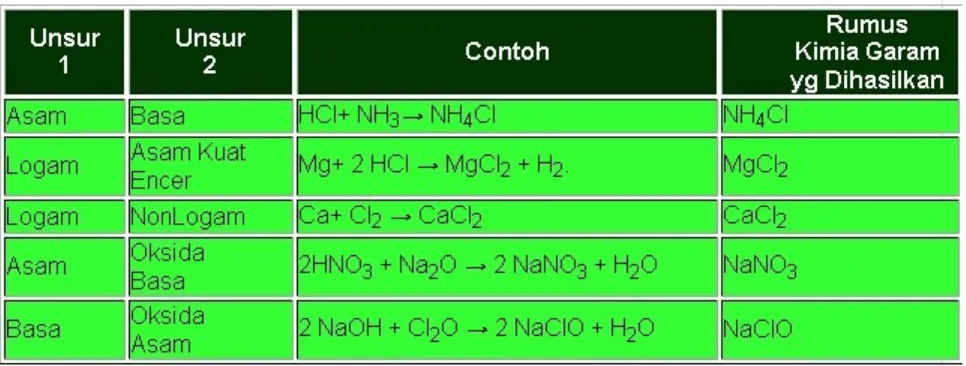
Reaksi kimia untuk menghasilkan garam antara lain:
1. Reaksi antara asam dan basa, misalnya asam klorida (HCl) + amoniak
(NH3) → amonium klorida (NH4Cl).
2. Reaksi antara logam dan asam kuat encer, misalnya Mg + 2 HCl → MgCl2
+ H2. Keterangan: logam mulia umumnya tidak bereaksi dengan cara ini.
3. Reaksi antara logam dan nonlogam, misalnya, Ca + Cl2 → CaCl2
4. Reaksi antara basa dan oksida asam, misalnya, 2 NaOH + Cl2O → 2 NaClO
+ H2O
5. Reaksi antara asam dengan oksida basa, misalnya, 2 HNO3 + Na2O → 2
NaNO3 + H2O
6. Garam juga dapat dibentuk apabila 2 garam yang berbeda dicampur. Ion-ion mereka akan membentuk campuran baru, misalnya:
Perbedaan Asam Lemah dan asam Kuat
Home / Perbedaan Asam Lemah dan asam KuatDiperbaharui: 20 February, 2016
Kekuatan asam adalah kemampuannya untuk mengionisasi atau menyumbangkan ion hidrogen dalam larutan air yang bereaksi dengan air.
Hal ini bukan konsentrasi asam yang banyak dalam larutan. Semakin banyak asam yang mengionisasi, semakin kuat dan semakin kurang produksi ion hidrogen menunjukkan asam lemah. Ini adalah perbedaan antara asam yang kuat dan lemah. Mari kita lihat lebih dekat.
Konsentrasi ion dalam larutan asam menceritakan bagaimana kuat atau lemah nya asam itu. Jadi, Anda dapat memiliki larutan pekat dari asam lemah dan sangat mungkin untuk memiliki larutan encer asam kuat.
Ketika asam ditambahkan ke dalam air, larut, mentransfer ion hidrogen (proton) ke molekul air menghasilkan ion hidroksonium dan ion negatif yang tergantung pada dimana asam yang kita mulai. Secara umum, persamaan direpresentasikan sebagai berikut.
HA + H2O ↔ H3O + + A–
Umumnya reaksi ini tidak dapat diubah tetapi beberapa asam yang begitu kuat sehingga hampir 100% dari asam akan terionisasi dengan hasil bahwa anda hanya punya ion
sebagai asam yang sangat kuat dan larut 100% dalam air. Jadi larutanyya yang dihasilkan hanya berisi ion hidroksonium dan ion klorida. Atas dasar kemampuannya untuk
menghasilkan ion, HCl dianggap asam kuat. Beberapa asam lain yang mengionisasi dengan besar adalah asam sulfat dan asam nitrat.
HCl [aq] → H [aq] + Cl + [aq]–
[ ]Ingat bahwa itu adalah air yang terlibat dalam reaksi dan dengan demikian H + sebenarnya adalah ion hidroksonium, ditulis sebagai H3O.
Ini menjadi jelas kemudian bahwa asam lemah adalah salah satu yang tidak sepenuhnya mengalami ionisasi dalam larutan air. Sebagai contoh, asam etanoat adalah asam lemah yang menunjukkan bahwa hal itu menghasilkan ion hidroksonium dan ion etanoat, tetapi reaksi maju lebih kecil daripada reaksi kembali dan ion yang dihasilkan kembali ke molekul asam dan molekul air dengan mudah sehingga pada akhirnya, ada sedikit ion hidroksonium dalam larutan. Dalam hal ini, hanya sekitar 1% dari ion hidroksonium yang ditemukan dalam larutan dibanding dengan ion H + yang 100% dalam kasus asam klorida. Ini berarti bahwa asam etanoat adalah asam yang sangat lemah dibandingkan dengan asam klorida.
Secara singkat : Perbedaan Antara asam Lemah dan asam Kuat
Tidak semua asam larut dalam air pada tingkat yang sama dengan hasil
bahwa beberapa mengionisasi hampir 100%, sementara beberapa yang lain mengalami ionisasi sangat sedikit.
Kemampuan asam yang mengionisasi lebih besar dalam air berarti itu
adalah asam kuat sementara ketidakmampuannya untuk mengionisasi menunjukkan kelemahannya.
Asam kuat menghasilkan lebih banyak ion H + sementara asam lemah