BAB III
METODE PENELITIAN
Penelitian ini dilakukan secara eksperimental yang meliputi identifikasi tumbuhan, pengumpulan dan pengolahan bahan tumbuhan, pemeriksaan karakterisasi simplisia dan ekstrak, pembuatan ekstrak, kultur sel, analisis viabilitas sel, analisis apoptosis secara flowsitometri dan analisis ekspresi ROS secara imuositokimia. Penelitian ini dilakukan di Laboratorium Farmakognosi Fakultas Farmasi Universitas Sumatera Utara dan Laboratorium Parasitologi Fakultas Kedokteran Universitas Gadjah Mada.
3.1 Alat dan Bahan
3.3.1 Alat
Alat-alat yang digunakan pada penelitian ini adalah alat-alat gelas laboratorium, alumunium foli, autoclave (Hirayama), blender (Philips), cawan porselen alas rata, conical tube, coverslip, cover glass, deksikator, elisa reader (BenMark Biorad), FACScan flowcytometer, hemositometer, hand counter, inkubator CO2 (Heraceus), inverted microscope (Olympus), krus porselin bertutup, laminar air flow (Labconco), mikropipet, neraca kasar (Home Line), neraca listrik (Vibra AJ), oven (Memmert), penangas air (Yenaco), rotary
evaporator (Haake D1), sentrifugator, seperangkat alat penetapan kadar
air,seperangkat alat destilasi, vortex, dan 6-well plate, 24-well plate,96-well plate. 3.1.2 Bahan
digunakan kecuali dinyatakan lain adalah berkualitas pro analsis, yaitu; α-naftol, 3,3’-diaminobenzidin (Sigma), air suling, annexin V, antibodi ROS, amonium hidroksida, asam asetat anhidrida, asam klorida pekat, asam nitrat pekat, asam sulfat pekat, besi (III) klorida, biotinilated universal secondary antibody, bismut (III) nitrat, dimethyl sulfoxide (DMSO) (Sigma), entellan, etanol, etilasetat, Fetal Bovine Serum (FBS) 10% (v/v) (Gibco), formaldehid 3,7%, Fungizone (amfoterisin B) 0,5 % (Gibco), hepes (Sigma), hidrogen peroksida 30%, iodium, isopropanol, kalium iodida, kloroform, M199, mayer-haematoksilin, metanol, natrium bikarbonat (Macalai tesque), natrium dodesil sulfat dalam 0,01 N HCl, natrium hidroksida, n-heksana, PBS (Gibco), raksa (II) klorida, serbuk magnesium, serbuk zinkum, sodium hidrogen karbonat (Macalai tesque),
streptavidin enzim horse radish peroxidase, dan toluena. Sel vero merupakan
koleksi Laboratorium Parasitologi Fakultas Kedokteran UGM.
3.2 Pengumpulan dan Pengolahan Sampel 3.2.1 Pengambilan sampel
Pengambilan sampel dilakukan secara purposif tanpa membandingkan dengan daun bangun-bangun dari daerah lain. Sampel diambil dari desa Kubuan, Tanjung Pura, Langkat, Provinsi Sumatera Utara.
3.2.2 Identifikasi tanaman daun bangun bangun
Identifikasi tanaman daun bangun-bangun dilakukan di Herbarium Medanense, Medan, Sumatera Utara.
3.2.3 Pembuatan simplisia
selanjutnya dikeringkan dilemari pengering (± 50oC). Setelah kering, daun bangun-bangun ditimbang kembali lalu diserbuk hingga halus. Serbuk simplisia dimasukkan ke dalam wadah plastik bertutup, dan disimpan pada suhu kamar.
3.3 Pemeriksaan Karakteristik Simplisia
Pemeriksaan karakterisasi simplisia dan ekstrak meliputi pemeriksaan penetapan kadar air, penetapan kadar abu total, dan penetapan kadar abu tidak larut asam, (Depkes RI, 1986; WHO, 1998).
3.3.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan pada simplisia meliputi pemeriksaan bentuk, warna, diameter dan ketebalan.
3.3.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik terhadap serbuk simplisia dilakukan dengan cara meneteskan larutan kloralhidrat di atas kaca objek, ditaburkan serbuk simplisia, kemudian ditutup dengan kaca penutup dan dilihat dibawah mikroskop. 3.3.3 Penetapan kadar air
mendidih, kecepatan tetesan diatur 2 tetes untuk tiap detik sampai sebagian besar air terdestilasi, kemudian kecepatan destilasi dinaikkan sampai 4 tetes tiap detik. Setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluen. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin pada suhu kamar. Setelah air dan toluen memisah sempurna, volume air dibaca dengan ketelitian 0,05 mL. Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen dengan rumus sebagai berikut: (WHO, 1992).
% Kadar air simplisia/ekstrak = x 100%
3.3.4 Penetapan kadar sari larut dalam air
Sebanyak 5 g serbuk yang telah dikeringkan dimaserasi selama 24 jam dengan 100 mL air-kloroform (2,5 mL kloroform dalam air sampai 1 liter) menggunakan labu bersumbat sambil sesekali dikocok selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Saring, 20 mL filtrat dipipet, diuapkan sampai kering dalam cawan penguap berdasar rata yang telah ditara dan dipanaskan pada suhu 105ºC sampai bobot tetap.Kadar sari yang larut dalam air dihitung dalam persen (Depkes RI, 2008).
3.3.5 Penetapan kadar sari larut dalam etanol
3.3.6 Penetapan kadar abu total
Sebanyak 2 g serbuk yang telah digerus dan ditimbang seksama dimasukkan dalam krus porselin yang telah dipijar dan ditara, kemudian diratakan. Krus dipijar perlahan-lahan sampai arang habis, pemijaran dilakukan pada suhu 600oC selama 3 jam kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu total dihitung dalam persen (Depkes RI, 1995). 3.3.7 Penetapan kadar abu tidak larut dalam asam
Abu yang diperoleh dalam penetapan kadar abu total dididihkan dalam 25 mL asam klorida 2 N selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan, disaring melalui kertas saring bebas abu kemudian dicuci denganair panas dalam kurs porselen. Residu dan kertas saring dipijarkan pada suhu 60oC sampai bobot tetap, kemudian didinginkan dan ditimbang.Kadar abu tidak larut dalam asam d ihitung terhadap bahan yang dikeringkan di udara (Depkes RI, 1995).
3.4 Pembuatan Ekstrak
Pembuatan ekstrak dilakukan secara maserasi bertingkat (re-maserasi), yaitu serbuk simplisia dengan perbandingan tertentu direndam dengan cairan penyari berturut-turut n-heksan, etil asetat dan etanol (Rosidah dan Hasibuan, 2014).
sebanyak 100 bagian. Maserasi selanjutnya dilakukan dengan pelarut etil asetat dan etanol. Maserat dipindahkan ke dalam bejana bertutup, diiarkan di tempat sejuk terlindung dari cahaya selama 2 hari. Enap tuangkan atau disaring. Pemekatan ekstrak dilakukan dengan alat rotary evaporator pada suhu 40o C (Depkes RI, 1979). Kemudian ekstrak dikeringkan di atas water bath hingga diperoleh ekstrak kental. Maserasi dilanjutkan dengan pelarut etilasetat dan etanol
3.5 Pembuatan Pereaksi
Pereaksi yang digunakan adalah FeCl3, HCl, Mayer, Molish, Dragendorff, kloralhidrat, H2SO4, Bouchardat, dan Liebermann-Burchard. Cara pembuatan pereaksi berdasarkan Farmakope Indonesia Edisi Ketiga dan Materia Medika Indonesia Jilid IV, kecuali pereaksi Liebermann-Burchard berdasarkan buku
Dyeing Reagents for Thin Layer and Paper Chromatography (Merck, 1978).
Larutan besi (III) klorida 1% b/v (FeCl3) dibuat dengan melarutkan 1 g besi (III) klorida dalam air suling sampai 100 mL. Larutan asam klorida 2 N dibuat dengan mengencerkan 17 mL asam klorida pekat dengan air suling sampai 100 mL. Larutan Molish dibuat dengan melarutkan 3 g α-naftol dalam asam nitrat 0,5 N hingga 100 mL. Larutan kloralhidrat dibuat dengan melarutkan 70 g kristal kloralhidrat dalam 30 mL air suling. Larutan asam sulfat 2 N dibuat dengan mengencerkan 5,5 mL asam sulfat pekat dengan air suling hingga diperoleh 100 mL.
Liebermann-Burchard dibuat dengan mencampur secara perlahan 5 mL asam asetat anhidrida dengan 5 mL asam sulfat pekat tambahkan etanol hingga 50 mL.
Larutan Mayer dibuat dengan melarutkan 1,36 g raksa (II) klorida dalam air suling hingga 60 mL. Pada wadah lain ditimbang sebanyak 5 g kalium iodida lalu dilarutkan dalam 20 mL air suling. Kedua larutan dicampurkan dan ditambahkan air suling hingga diperoleh larutan 100 mL.
Larutan Dragendorff dibuat dengan melarutkan 0,8 g bismut (III) nitrat dalam asam nitrat pekat 20 mL kemudian dicampurkan dengan larutan kalium iodida sebanyak 27,2 g dalam 50 mL air suling. Campuran didiamkan sampai memisah sempurna. Larutan jernih diambil dan diencerkan dengan air suling secukupnya hingga 100 mL.
3.6 Skrining Fitokimia Simplisia dan Ekstrak
Penentuan golongan senyawa kimia skrining fitokimia dilakukan pemeriksaan senyawa golongan alkaloid, flavonoid, glikosida (Depkes RI, 1995), saponin, tanin (Farnsworth, 1966), dan steroid/triterpenoid (Harborne, 1987). 3.6.1 Pemeriksaan alkaloid
Simplisia dan masing-masing ekstrak ditimbang kemudian ditambahkan 1 mL asam klorida 2 N dan 9 mL air suling, dipanaskan di atas penangas air selama 2 menit, didinginkan dan disaring. Filtrat yang diperoleh dipakai untuk uji alkaloid: diambil 3 tabung reaksi, lalu kedalamnya dimasukkan 0,5 mL filtrat. Pada masing-masing tabung reaksi:
Alkaloida positif jika terjadi endapan atau kekeruhan pada paling sedikit dua dari tiga percobaan di atas (Depkes RI, 1995).
3.6.2 Pemeriksaan flavonoida
Simplisia dan masing-masing ekstrak ditimbang lalu ditambahkan 10 mL air panas, dididihkan selama 5 menit dan disaring dalam keadaan panas, ke dalam 5 mL filtrat ditambahkan 0,1 g serbuk magnesium dan 1 mL asam klorida pekat dan 2 mL amil alkohol, dikocok dan dibiarkan memisah. Flavonoid positif jika terjadi warna merah, kuning atau jingga pada lapisan amil alkohol (Farnsworth, 1966).
3.6.3 Pemeriksaan glikosida
3.6.4 Pemeriksaan saponin
Simplisia dan masing-masing ekstrak ditimbang dan dimasukkan ke dalam tabung reaksi, lalu ditambahkan 10 mL air panas, dinginkan kemudian dikocok kuat-kuat selama 10 detik. Jika terbentuk busa setinggi 1-10 cm yang stabil tidak kurang dari 10 menit dan tidak hilang dengan penambahan 1 tetes asam klorida 2 N menunjukkan adanya saponin (Depkes RI, 1995).
3.6.5 Pemeriksaan tanin
Simplisia dan masing-masing ekstrak ditimbang kemudian dididihkan selama 3 menit dalam 100 mL air suling lalu didinginkan dan disaring. Pada filtrat ditambahkan 1-2 tetes pereaksi besi (III) klorida 1%. Jika terjadi warna biru kehitaman atau hijau kehitaman menunjukkan adanya tanin (Fransworth, 1966). 3.6.6 Pemeriksaan triterpenoida/steroida
Simplisia dan masing-masing ekstrak ditimbang, dimaserasi dengan 20 mL
n-heksana selama 2 jam, disaring, filtrat diuapkan dalam cawan penguap, dan
pada sisanya ditambahkan pereaksi Liebermann-Burchard. Timbulnya warna biru atau biru hijau menunjukan adanya steroid, sedangkan warna merah, merah muda atau ungu menunjukkan adanya triterpenoid (Harborne, 1996).
3.7 Sterilisasi Alat dan Bahan
3.8 Pembuatan Media
3.8.1 Pembuatan media M199
Komposisi:M199 sachet, spesifikasi:Gibco Lot No. 819942, dengan Earle’s salt, dengan L-glutamine, tanpa NaHCO3, netto 9,5 gram
Akuabidest 1 liter
NaHCO3 2,2 gram
Hepes 2 gram
HCl 1 N NaOH 1 N
Cara pembuatan: Sebanyak 1 sachet M199 sachet, 2,2 gram NaHCO3, 2 gram Hepes dimasukkan ke dalam tabung erlenmeyer. Ditambahkan 800 mL aquabidest steril dan dihomogenkan menggunakan stirer magnet. Diatur pH 7,2 – 7,4 dengan menggunakan pH meter. Penyesuaikan pH dilakukan dengan menambahkan HCL 1 N (bila larutan basa) atau NaOH 1 N (bila larutan asam). Ditambahkan aquabidest hingga volume 1 L dan dilakukan sterilisasi dengan filter vaccum di dalam LAF (Laminar Air Flow). Dipasang filter aparatus steril pada botol duran 1 L steril. Lakukan proses penyaringan dengan menggunakan filter, aliquot media ditampung dalam botol duran 500 mL, diberi identitas pada botol media (nama media, tanggal pembuatan, expire date, nama pembuat). Media disimpan pada suhu 2-8oC (Handayani, et al., 2001).
3.8.2 Pembuatan media MK-M199
Komposisi : Foetal BovineSerum (FBS) 10 % Penisilin-streptomisin 3 %
Fungison 1 %
M199 ad 100 mL
pembuatan, expire date, dan nama pembuat), simpan pada suhu 2-8oC (Handayani, et al., 2001).
3.9 Penumbuhan Sel Vero
Persiapkan alat dan kondisikan bahan pada suhu ruangan, ambil 10 mL media M199 pada tabung konikel, ambil ampul dari freezer -80oC (sel Vero) atau tangki nitrogen dan cairkan pada suhu kamar, ambil suspensi sel dalam ampul, masukkan tetes demi tetes ke dalam media M199 yang telah disiapkan, sentrifuge pada 600 rpm selama 5 menit, buang supernatan dan tambahkan 4 mL MK-M199 dan resuspensi hingga homogen. Transfer masing-masing 2 mL ke dalam flask kultur baru. Tambahkan 5 mL MK-M199 ke dalam masing-masing flask kultur, dan homogenkan. Amati kondisi sel dengan menggunakan inverted microscope. Pastikan sel homogen pada seluruh permukaan flask kultur (tidak menggerombol pada bagian tertentu). Beri identitas pada flask kultur, kemudian simpan dalam inkubator CO2 (Handayani, et al., 2001).
3.9.1 Subkultur selVero
Persiapkan alat dan kondisikan bahan pada suhu ruangan, lakukan pengerjaan pada LAF. Lakukan proses panen selVero dengan cara mengambil 500 µ L panenan selVero dan masukkan ke dalam flask kultur. Tambahkan 6 mL MK-M199, homogenkan. Inkubasi sel pada inkubator CO2, amati kondisi sel pada keesokan harinya (Handayani, et al., 2001).
3.9.2 Panen selVero
mikropipet atau pipet pasteur, cuci sel 2 kali dengan 5 mL PBS (Phosphate Buffer
Saline), tambahkan 400 µL Tripsin-EDTA 0,25% secara merata, kemudian
inkubasi di dalam inkubator CO2 selama ± 5 menit, dan tambahkan 4 mL MK untuk menginaktifkan tripsin. Resuspensi sel dengan mikropipet agar sel terlepas satu-satu (tidak menggerombol). Amati keadaan sel di inverted microscope. Resuspensi sel kembali jika masih ada sel yang menggerombol. Transfer sel ke dalam tabung konikel (Handayani, et al., 2001).
3.9.3 Penghitungan sel Vero
Persiapkan alat dan kondisikan bahan pada suhu ruangan, ambil 10 µL panenan sel dan pipetkan ke dalam hemositometer. Hitung jumlah sel di bawah mikroskop dengan menggunakan counter. Hemositometer terdiri dari 4 kamar hitung (A, B, C, dan D), setiap kamar hitung terdiri dari 16 kotak (Gambar 3.1).
Gambar 3.1 Hemositometer
Hitung sel pada 4 kamar hemositometer, sel yang gelap (mati) dan sel yang berada di batas luar di sebelah kiri dan atas tidak ikut dihitung. Sel di batas kanan dan bawah ikut dihitung. Hitung jumlah sel per mL dengan rumus:
4
1x104/sumuran x 100 sumuran (dibuat lebih) = 1x106 sel. Hitung volume panenan sel yang diperlukan (dalam mL) dengan rumus:
Jumlah total sel yang diperlukan Volume panenan sel =
Jumlah sel terhitung /mL
Ambil volume panenan sel, transfer ke tabung konikel baru kemudian tambahkan MK sampai total volume yang diperlukan (CCRC a, 2009).
3.10 Pembuatan Larutan Uji
Masing-masing ekstrak n-heksana (ENDBB), ekstrak etil asetat (EEADBB), ekstrak etanol (EEDBB) ditimbang sebanyak 50 mg dalam mikrotube, kemudian dilarutkan dalam dimetilsulfoksida (DMSO) sebanyak 1000 µ L, divortex agar sampel terlarut sempurna kemudian dicukupkan dengan MK-M199, kemudian dibuat pengenceran selanjutnya sampai diperoleh larutan uji konsentrasi 200 µg/mL, 100 µg/mL, 50 µg/mL, 25 µg/mL dan 12,5 µg/mL, semua pengenceran dilakukan dengan menggunakan MK-M199 (CCRCe, 2008).
3.11 Analisis Viabilitas Sel dengan Metode MTT
CO2 5%, 37 oC. Reaksi MTT dihentikan dengan reagen stopper (SDS 10% dalam HCl 0,01 N), plate dibungkus agar tidak tembus cahaya dan dibiarkan selama satu malam. Serapan dibaca dengan ELISA reader (Benchmark Bio Rad) pada panjang gelombang 595 nm (Ueda, et al., 2002, Park, et al., 2014).
Data absorbansi yang diperoleh dikonversi kedalam persen sel hidup. Persen sel hidup dihitung menggunakan rumus (Merloo, et al., 2011):
%viabilitas =absorbansi sel dengan perlakuan−absorbansi kontrol media
absorbansi kontrol media sel−absorbansi kontrol media x 100%
Perbedaan viabilitas sel pada perlakuan ekstrak uji dengan berbagai seri konsentrasi terhadap kontrol sel dianalisis menggunakan program SPSS 17 dengan uji ANOVA satu arah, taraf kepercayaan 95% kemudian dilanjutkan dengan uji Duncan. Perbedaan yang signifikan ditunjukkan dengan nilai signifikansi < 0,05.
3.12 Pengujian Apoptosis dengan Flow Sitometri
media kultur lalu media ditampung pada tabung konikel 15 mL. Disentrifugasi dengan kecepatan 600 rpm selama 5 menit dan supernatannya dibuang. Kemudian ditambahkan sebanyak 1 mL PBS kemudian media dipindahkan ke dalam mikrotube dan disentrifugasi dengan kecepatan 2000 rpm selama 3 menit, supernatannya dibuang. Ditambahkan Annexin V dan propidium iodida. Lalu diukur dengan alat flow sitometer (Hostanska, et al., 2004).
3.13 Analisis Ekspresi ROS dengan Imunositokimia
Sel sebanyak 5x104/sumuran ditanamkan ke dalam plat 24 sumuran yang telah dilapisi dengan coverslip pada bagian dasarnya, kemudian diinkubasi selama 24 jam. Sel diberi perlakuan dengan sampel uji kemudian diinkubasi selama 24 jam. Pada masing-masing sumuran diikuti dengan atau tanpa penambahan 1000 µ L 0,8 mM H2O2 diinkubasi selama 3 jam. Pada akhir waktu inkubasi, sel dicuci dengan PBS kemudian ditambahkan metanol dingin, diinkubasi dalam lemari pendingin dengan suhu 4oC selama 10 menit. Setelah itu, metanol dibuang dan
coverslip yang memuat sel diletakkan pada dish bersih. Sel yang telah difiksasi
dengan metanol kemudian dicuci dengan PBS dan akuades 3 kali dan diinkubasi dengan larutan hidrogen peroksida selama 10 menit pada temperatur kamar kemudian dibuang dan dicuci dengan PBS. Sel tersebut kemudian diinkubasi dengan prediluted blocking serum selama 10 menit pada suhu kamar, kemudian dibuang. Setelah inkubasi, antibodi monoklonal ROS ditambahkan pada sel kemudian diinkubasi selama 1 jam pada suhu kamar. Coverslip kemudian dicuci dengan PBS dan ditetesi antibodi sekunder (biotinylated universal secondary
antibody) dan kemudian diinkubasi selama 10 menit. Sel dicuci kembali
peroxidase dan diinkubasi selama 10 menit. Sel dicuci kemudian ditambahkan
3,3’-diaminobenzidin serta diinkubasi selama 5 menit (sampai warna coklat). Sel dicuci lagi dengan PBS dan akuades kemudian dengan larutan
Mayer-Haematoksilin dan diinkubasi selama 5 menit, selanjutnya sel dicuci kembali
menggunakan akuades sampai bersih, ditambahkan etanol 70% inkubasi selama 2 menit, bersihkan, diteteskan larutan xylol dan keringkan. Setelah kering, coverslip diletakkan diatas kaca obyek dan ditetesi mounting media serta ditutup dengan
cover glass. Pengamatan dilakukan dengan mikroskop yang dilengkapi dengan
BAB IV
HASIL DAN PEMBAHASAN
4.1 Identifikasi Tumbuhan
Identifikasi tumbuhan dilakukan di Herbarium Medanense, Fakultas MIPA Universitas Sumatera Utara.Hasil identifikasi menunjukkan bahwa sampel termasuk keluarga Lamiaceace, jenis Coleus amboinicus Lour.Hasil identifikasi tumbuhan dapat dilihat pada Lampiran 1 halaman 79.
4.2 Karakteristik Simplisia 4.2.1 Pemeriksaan makroskopik
Hasil pemeriksaan makroskopik daun Bangun-bangun segar menunjukkan daun berwarna hijau, helaian daun berbentuk bundar telur, kadang-kadang agak membundar, panjang helaian daun 3,5-7 cm, lebar 4-7 cm, pinggir daun agak bergerigi atau berombak. Pada keadaan segar helaian daun tebal, sangat berdaging dan berair, tulang daun bercabang-cabang, permukaan atas dan bawah berambut halus berwarna putih, bila dimakan berasa getir. Pada keadaan kering helaian daun tipis dan sangat berkerut, permukaan atas kasar, warna coklat sampai coklat tua, permukaan bawah berwarna lebih muda dari permukaan atas, pada kedua permukaan terdapat rambut halus berwarna putih. Gambar makroskopik dapat dilihat pada Lampiran 3 halaman 81.
4.2.2 Pemeriksaan mikroskopik
berbentuk prisma. Gambar mikroskopik serbuk simplisia daun Bangun-bangun dapat dilihat pada Lampiran 4 halaman 82.
4.2.3 Karakterisasi Simplisia
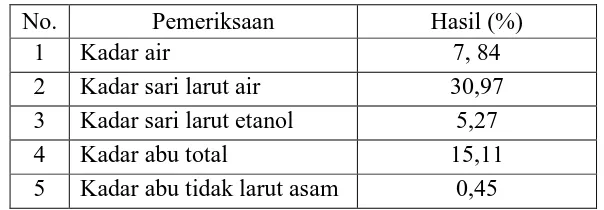
Hasil pemeriksaan karakteristik simplisia daun Bangun-bangun terlihat pada Tabel 4.1.
Tabel 4.1 Hasil karakteristik simplisia daun Bangun-bangun
No. Pemeriksaan Hasil (%)
Medika Indonesia. Tingginya kadar abu total menunjukkan bahwa kandungan senyawa anorganik semakin tinggi. Kadar abu tidak larut asam diperoleh 0,45%, kadar ini memenuhi persyaratan simplisia daun Bangun-bangun yang tertera di Materia Medika Indonesia yaitu tidak lebih dari 1%. Perhitungan karakteristik simplisia dapat dilihat pada Lampiran 7 halaman 85.
4.3 Skrining Fitokimia Simplisia dan Ekstrak Daun Bangun-bangun
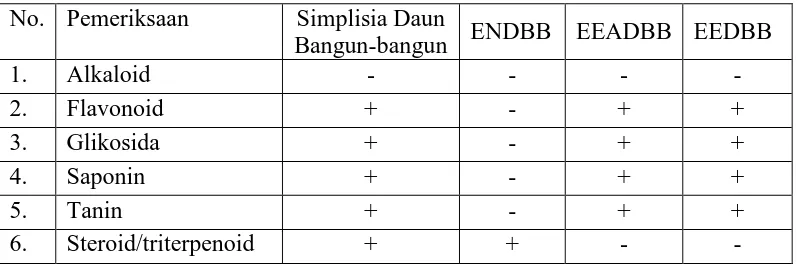
Penentuan golongan senyawa kimia terhadap simplisia dilakukan untuk mendapatkan informasi golongan senyawa metabolit sekunder yang terdapat di dalamnya.Hasil skrining fitokimia serbuk simplisia menunjukkan adanya kandungan saponin, flavonoid, glikosida dan steroid/triterpenoid.Hasil pemeriksaan skrining fitokimia dapat dilihat dari Tabel 4.2.
Tabel 4.2 Hasil skrining fitokimia simplisia dan ekstrak
No. Pemeriksaan Simplisia Daun
Bangun-bangun ENDBB EEADBB EEDBB
1. Alkaloid - - - -
Keterangan: + = mengandung golongan senyawa - = tidak mengandung golongan senyawa
Hasil skrining fitokimia yang dilakukan terhadap simplisia daun Bangun-bangun memberikan informasi bahwa daun Bangun-Bangun-bangun mengandung flavonoid, glikosida, saponin, tanin dan steroid/triterpenoid.
antara oksidan dengan antioksidan di dalam tubuh (Koncazak, et al., 2004). Senyawa-senyawa seperti flavonoid dan galat dapat meghambat reaksi oksidasi dengan mekanisme penangkapan radikal (radical scavenging) dengan menyumbangkan satu elektron pada elektron yang tidak berpasangan pada radikal bebas sehingga dapat mengurangi jumlah radikal bebas (Rohman dan Riyanto, 2005).
Ekstraksi serbuk simplisia dilakukan secara maserasi bertingkat dimulai dari pelarut nonpolar hingga pelarut polar (n-heksana-etilasetat-etanol). Penyarian 500 gram simplisia daun Bangun-bangun menggunakann-heksana, etilasetat dan etanol 96% menghasilkan ekstrak berturut-turut 19,796 g, 6,326 g, dan 36,307 g, dengan persentase rendemen masing-masing sebesar 3,96%, 1,26 %, 7,26%. Pelarut n-heksana digunakan untuk menarik senyawa kimia non polar seperti triteterpenoid dan steroid bebas. Pelarut etilasetat digunakan agar senyawa kimia yang bersifat semipolar dan agak polar seperti alkaloid, flavonoid, glikosida, saponin, dan tanin dapat tersari di dalamnya. Pelarut etanol digunakan untuk menarik sempurna senyawa yang bersifat polar seperti glikosida, flavonoid, tanin, dan alkaloid (Syamsuni, 2006).
n-Heksana merupakan pelarut yang bersifat nonpolar diantara pelarut lain
memiliki aktivitas sangat kuat (Dia, et al., 2015). Etanol merupakan pelarut yang bersifat polar. Komponen yang banyak terdapat pada tumbuh-tumbuhan dan bersifat polar antara lain senyawa dari golongan fenolik (Nuraini, 2007). Pelarut etanol dapat mengekstrak lebih banyak senyawa biokatif yang bersifat polar dari daun Bangun-bangun dibandingkan dengan pelarut n-heksan maupun etilasetat (Dia, et al., 2015)
4.4 Aktivitas Sitoprotektif
Pengujian sitoprotektif dilakukan untuk mengetahui proteksi terhadap sel yang telah diinduksi dengan hidrogen peroksida (H2O2).
4.4.1 Analisis viabilitas sel dengan metode MTT
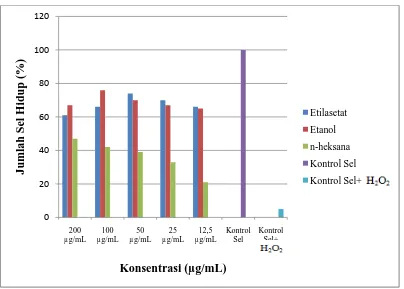
Sel vero diberi perlakuan dengan ENDBB, EEADBB, dan EEDBB dengan seri konsentrasi 200 µ g/mL, 100 µg/mL, 50 µ g/mL, 25 µg/mL, 12,5 µg/mL menunjukkan adanya aktivitas sitoprotektif pada sel vero yang diinduksi dengan H2O2 0,8 mM.
dengan konsentrasi larutan uji lebih besar dari nilai IC50 sitotoksik menunjukkan penurunan jumlah sel hidup. EEDBB memiliki aktiivitas sitoprotektif yang lebih besar pada konsentrasi larutan uji 100 µ g/mL dengan persen viabilitas mencapai 76,08 ± 0,91 %. Konsentrasi larutan uji lebih besar dari 100 µg/mL dan lebih kecil dari nilai tersebut maka terjadi penurunan nilai viabilitas sel. ENDBB memiliki aktivitas sitoprotektif yang paling kecil, karena memiliki nilai antioksidannya yang kecil (Hasibuan, et al., 2013). Hasil analisis viabilitas sel dengan metode MTT dapat dilihat pada Gambar 4.1 .
Gambar 4.1 Hasil analisis viabilitas sel pada masing- masing perlakuan
Radikal bebas di dalam tubuh merupakan bahan yang sangat berbahaya, karena merupakan senyawa atau molekul yang mengandung satu atau lebih elektron yang tidak berpasangan pada bagian orbital luarnya. Elektron yang tidak berpasangan inilah yang dapat mengakibatkan senyawa tersebut sangat reaktif untuk mencari pasangannya dengan cara mengikat atau menyerang elektron molekul yang berada disekitarnya. Yang dapat diikat oleh radikal bebas pada umumnya adalah molekul besar seperti lipid, protein, maupun DNA (pembawa sifat). Jika terjadi maka akan mengakibatkan kerusakan sel atau pertumbuhan sel yang tidak bisa dikendalikan (Sayuti dan Yenrina, 2015).
Daun Bangun-bangun memiliki kandungan flavonoid, baik pada simplisia maupun ekstrak. Flavonoid adalah antioksidan eksogen yang telah dibuktikan bermanfaat dalam mencegah kerusakan sel akibat stres oksidatif. Mekanisme kerja dari flavonoid sebagai antioksidan bisa secara langsung maupun secara tidak langsung. Flavonoid sebagai antioksidan secara langsung adalah dengan mendonorkan ion hidrogen sehingga dapat menetralisir efek toksik dari radikal bebas. Flavonoid sebagai antioksidan secara tidak langsung yaitu dengan meningkatkan ekspresi gen antioksidan endogen melalui beberapa mekanisme. Salah satu mekanisme peningkatan ekspresi gen antioksidan adalah melalui aktivasi nuclear factor erythoid 2 related factor 2 (Nrf2) sehingga terjadi peningkatangen yang berperan dalam sintesisenzim antioksidan endogen sepertimisalnya gen SOD (superoxide dismutase) (Sumardika dan Jawi, 2012).
Flavonoid memberikan kontribusi pada aktivitas antioksidannya secara in
apabila bereaksi dengan logam transisi seperti Fe2+ dan Cu2+ dalam reaksi Fenton, oleh karena itu dengan adanya flavonoid dapat mengikat Fe2+ dan Cu2+ sehingga tidak terbentuk radikal bebas. Kebanyakan efek protektif dalam sistem biologis berasal dari kemampuannya sebagai antioksidan, kemampuan untuk mentransfer elektron, menangkap radikal bebas, mengkhelat logam, mengaktifkan
enzim-enzim antioksidan, mereduksi radikal α-tokoferol, dan menghambat enzim-enzim
oksidase (Rohman, 2016).
Aktivitas antioksidan pada EEADBB, dan EEDBB dengan nilai IC50 sebesar 281,26 µg/mL, 350,74 µg/mL sedangkan ENDBB tidak menunjukkan adanya aktivitas antioksidan dengan metode DPPH (Hasibuan, et al., 2013). Antioksidan sangat diperlukan tubuh untuk mencegah stress oksidatif. Antioksidan bersifat sangat mudah dioksidasi, sehingga radikal bebas akan mengoksidasi antioksidan dan melindungi molekul lain dalam sel dari kerusakan akibat oksidasi oleh radikal bebas atau oksigen reaktif (Werdhasari, 2014).
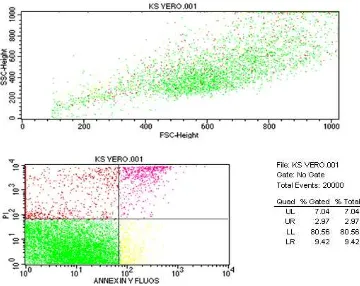
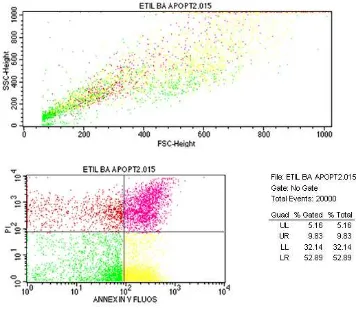
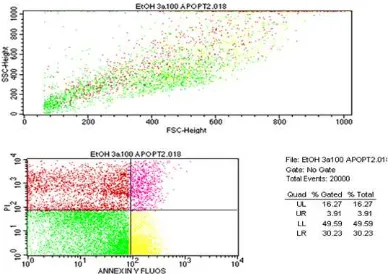
4.4.2 Pengujian apotosis dengan flow sitometri
hidup, kuning menunjukkan apoptosis awal, merah muda menunjukkan apoptosis akhir, dan merah menunjukkan nekrosis. Warna-warna itu dapat terbentuk oleh sel yang memancarkan epi-fluoresensi oleh ikatan Annexin V atau PI kemudian ditangkap oleh sinar UV. Panjang gelombang untuk warna hijau pada 488-525nm, absorbansi maksimal berada pada 490 nm. Pada apoptosis awal akan berfluoresensi kuning dengan intensitas yang lemah pada panjang gelombang 536-617nm. Sel yang mengalami nekrosis atau apoptosis akhir akan berfluoresensi merah pada panjang gelombang 650-700nm (Azizah, 2015). Hasil pengujian dapat dilihat pada Gambar 4.2 a, b, c, dan d.
Gambar 4.2 b Apoptosis sel Vero + H2O2
Gambar 4.2 d Apoptosis EEDBB
Prinsip dari Annexin V-FITC adalah menggunakan Annexin V yang berkonjugasi dengan FITC untuk mengikat fosfatidilserinpada permukaan sel yang mengalami apoptosis. Dari hasil flow sitometri diperoleh persentase kematian sel secara apoptosis maupun nekrosis, serta jumlah sel yang tetap hidup. Pada sel hidup yang normal fosfatidilserin(PS) terletak pada permukaan sitoplasmik pada membran sel (Wikanta, et al., 2012).
dapat berikatan dengan sel yang mengalami nekrosis. Kombinasi Annexin V-FITC dan PI telah digunakan secara umum untuk membedakan sel hidup, apoptosis, dan nekrosis berdasarkan permeabilitas membran. Propium Iodida tidak dapat menembus membran sel yang hidup. Namun ketika sel mengalami apoptosis akhir dan nekrosis, terjadi perubahan permeabilitas membran sehingga propium iodida dapat masuk ke dalam sel dan berikatan dengan DNA sehingga menyebabkan fluoresensi merah pada sel tersebut (Chantika, 2012). Data hasil pengujian flowsitometri ekstrak daun Bangun-bangun dapat dilihat pada Tabel 4.3.
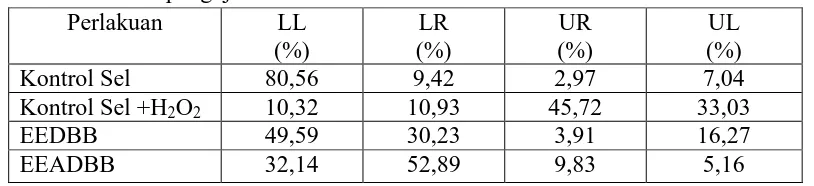
Tabel 4.3 Hasil pengujian flow sitometri EEDBB dan EEADBB
Perlakuan LL
LL (Lower Left) : menunjukkan persentase sel yang hidup
LR (Lower Right) : menunjukkan persentase sel yang mengalami apoptosis awal
UR (Upper Right) : menunjukkan persentase sel yang mengalami apoptosis akhir/necrosis awal
nekrosis. Apoptosis dan nekrosis akan meningkat seiring dengan menurunnya persentase jumlah sel hidup.
Persentase jumlah sel yang mengalami apoptosis awal (LR) untuk kontrol sel sebesar 9,42%, kontrol sel+ H2O2 sebesar 10,93%, EEDBB sebesar 30,23%, EEADBB sebesar 52,89%. Persentase jumlah sel yang mengalami apoptosis akhir atau nekrosis awal (UL) untuk kontrol sebesar 2, 97%, kontrol sel+ H2O2 sebesar 45,72%, EEDBB sebesar 3,91%, EEADBB sebesar 9,83%. Apoptosis akhir menandakan sel telah mengalami fragmentasi DNA dan mengalami proses fagositosis. Persentase jumlah sel yang mengalami nekrosis akhir (UR) untuk kontrol sel sebesar 7,04%, kontrol sel+ H2O2 sebesar 33,03%, EEDBB sebesar 16,27%, EEADBB sebesar 5,16%. Penurunan sel nekrosis menunjukkan bahwa EEADBB dan EEDBB tidak mempunyai kemampuan sitotoksik.
Pada penelitian ini menunjukkan bahwa sel Vero yang diberi perlakuan dengan prekursor ROS yaitu H2O2 yang menghasilkan radikal hidroksil yang sangat reaktif dan menyebabkan kematian sel melalui proses apoptosis. Agen yang dapat menghambat produksi ROS atau meningkatkan pertahanan antioksidan seluler dapat mencegah apoptosis dan melindungi sel dari kerusakan akibat radikal oksigen. Choi, et al., 2002 melakukan penelitian menggunakan flavonol khususnya epigallocatechin gallate dan quercetin, yang memiliki aktivitas antiapoptosis pada sel endotel vaskular manusia yang diberi perlakuan dengan H2O2. Flavonoid jenis flavon, luteolin dan apigenin tidak memiliki efek antiapoptosis. Dari hasil penelitian tersebut menunjukkan bahwa flavonoid memiliki aktivitas antiapoptosis yang berbeda. Aktivitas antiapoptosis dapat dimediasi Bcl-2 dan Bax di mitokondria. Bcl-2 yang merupakan antiapoptosis memiliki kapasitas antooksidan yang dapat menekan sinyal stress oksidatif. H2O2 dapat mengaktifkan kaspase 3 dan aktivitas itu sebagian diblokir oleh
epigallocatechin gallate dan quercetin. Epigallocatechin gallate dan quercetin,
menonaktifkan kaskade kematian apoptosis dengan menghambat aktivasi kaspase 3. Mekanisme perlindungan sel dari apoptosis yang disebabkan induksi oksidan mungkin dimediasi setidaknya oleh mekanisme terkait dengan blokade proapoptosis Bax dan aktivasi antiapoptosis Bcl-2 (Choi, et al., 2002).
meredam reaktivitas radikal bebas, sehingga mengarahkan molekul tersebut menjadi lebih stabil.Flavonoid juga bekerja mendonorkan ion hidrogen atau elektron kepada anion superoksida sehingga melindungi lipoprotein, protein, dan DNA dari oksidasi (Rahmawati, et al., 2014).
4.4.3 Analisis ekspresi ROS dengan imunositokimia
Analisis ekspresi ROS dilakukan dengan menggunakan metode imunositokima dengan prinsip pengikatan antibodi spesifik. Metode imunositokimia menggunakan kromogen DAB yang akan berikatan dengan
streptavidin enzim horse radish peroksidase (HRP) - biotinilated universal
antibodi-(antibodi sekunder) - antibodi ROS (antibodi primer) terhadap sel vero.
Terbentuk kompleks antara streptavidin enzim horse radish peroksidase dengan antibodi sekunder. Substrat DAB membentuk kompleks denngan peroksidase pada streptavidin enzim horse radish peroksidase membentuk kromogen yang tervisualisasi sebagai warna coklat.
Pada pengerjaan imunositokimia, penambahan antibodi sekunder berfungsi sebagai penghubung antara antibodi primer dengan konjugat
streptavidin-peroxidase. Konjugat streptavidin-peroxidase ditambahkan untuk
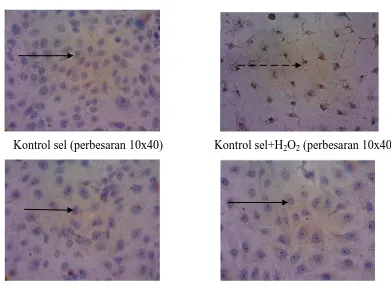
Ekspresi ROS pada sel vero dengan berbagai perlakuan dapat dilihat pada Gambar 4.3.
Kontrol sel (perbesaran 10x40) Kontrol sel+H2O2 (perbesaran 10x40)
EEDBB 100 µg/mL (perbesaran 10x40) EEADBB 50 µg/mL (perbesaran 10x40) Gambar 4.3 Imunositokimia ekstrak daun Bangun-bangun
Keterangan:
= ekspresi negatif = ekspresi positif
Flavonoid menghambat enzim yang bertanggung jawab pada produksi anion superoksida, seperti xantin oksidase dan protein kinase C. Flavonoid juga terbukti menghambat siklooksogenase, lipooxigenase, mikrosomal monooxigenase, glutathion S-transferase, mitokondria suksinoxidase, dan NADH oksidase, semua yang terlibat dalam ROS. Sejumlah flavonoid efisien mengkhelat logam yang memainkan peran penting dalam metabolisme oksigen. Besi dan tembaga bebas dapat meningkatkan potensi pembentukan ROS, seperti yang ditunjukkan pada reaksi dibawah ini.
H2O2 + Fe2+(Cu+) •OH + OH- + Fe3+(Cu2+)
Namun demikian perlu diingat bahwa ion logam ini sangat penting pada fungsi fisiologis, seperti konstituen dari hemoprotein dan kofaktor dari berbagai enzim, termasuk yang terlibat pada antioksidan pertahanan seperti besi untuk katalase, tembaga untuk ceruloplasmin dan Cu-Zn-superoxide dismutase (Pietta, et al., 2000).
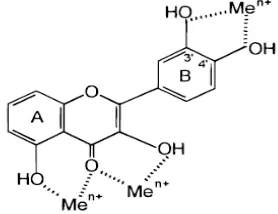
Tapak yang diusulkan bertindak sebagai pengkhelat logam pada flavonoid adalah bagian katekol, 3-hidroksil, 4-okso yang merupakan bagian dari cincin heterosiklik pada cincin B, dan 4-okso, 5-hidroksil pada kelompok cincin heterosiklik antara cincin A dan C seperti yang terlihat pada Gambar 4.7 (Pietta, et al., 2000).
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan pengamatan selama penelitian dan pembahasan dapat disimpulkan bahwa:
a. EEADBB, EEDBB dan ENDBB memiliki efek sitoprotektif terhadap sel vero yang diinduksi dengan hidrogen peroksida. Dengan variasi konsentrasi 12,5-200 µg/mL menunjukkan nilai viabilitas sel yang meningkat dibandingkan dengan nilai viabilitas sel vero yang diberikan H2O2. EEADBB dan EEDBB pada uji MTT menunjukkan persen viabilitas masing-masing sebesar 74,42 ± 0,28% dan 76,08 ± 0,91 %dengan konsentrasi 50 µg/mL untuk EEADBB dan 100 µg/mL EEDBB. ENDBB tidak menunjukkan hasil yang baik dibandingkan dengan EEADBB dan EEDBB.
b. EEADBB dan EEDBB menurunkan apoptosis pada sel vero, hal ini terlihat pada uji apoptosis dengan flowsitometri. Terjadi peningkatan jumlah sel hidup setelah perlakuan dengan EEADBB dan EEDBB sebesar 32,14% dan 49,59% dibandingkan dengan H2O2 sebesar 10,32%.
5.2 Saran