SKRIPSI
NUR FADILLAH HERMAN O 111 12 005
PROGRAM STUDI KEDOKTERAN HEWAN
FAKULTAS KEDOKTERAN
UNIVERSITAS HASANUDDIN
MAKASSAR
IDENTIFIKASI JAMUR PADA PENYU ABU- ABU
(Lepidochelys olivacea Eschscholtz) DI KABUPATEN
KEPULAUAN SELAYAR
NUR FADILLAH HERMAN O 111 12 005
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Program Studi Kedokteran Hewan Fakultas Kedokteran
PROGRAM STUDI KEDOKTERAN HEWAN FAKULTAS KEDOKTERAN
UNIVERSITAS HASANUDDIN MAKASSAR
1. Yang bertanda tangan di bawah ini:
Nama : Nur Fadillah Herman
NIM : O111 12 005
Menyatakan dengan sebenarnya bahwa: a. Karya skripsi saya adalah asli.
b. Apabila sebagian atau seluruhnya dari skripsi ini, terutama dalam bab hasil dan pembahasan, tidak asli atau plagiasi, maka saya bersedia dibatalkan dan dikenakan sanksi akademik yang berlaku.
2. Demikian pernyataan keaslian ini dibuat untuk dapat digunakan seperlunya.
Makassar, Februari 2017
NUR FADILLAH HERMAN. O11112005. Identifikasi Jamur pada Penyu Abu- Abu (Lepidochelys Olivacea Eschscholtz) Di Kabupaten Kepulauan Selayar.
Dibimbing oleh Prof. Dr. Drh. Lucia Muslimin, M.Sc dan Dr. Ir. Hilal
Anshary, M.Sc.
Penangkaran penyu Desa Barugaiya Kabupaten Kepulauan Selayar sampai saat ini masih menghadapi banyak kendala, yang mengakibatkan tingkat kematian penyu dan kegagalan menetas pada telur penyu tinggi. Salah satu penyebabnya adalah jamur. Tujuan utama penelitian ini adalah mengidentifikasi jamur pada penyu dan cangkang telur penyu gagal menetas. Jenis penelitian yang digunakan dalam penelitian ini adalah penelitian deskriptif. Penelitian ini dilakukan pada 20 ekor penyu abu- abu (Lepidochelys Olivacea Eschscholtz) dan 10 butir telur gagal
menetas, pemilihan sampel menggunakan metode Purposive Sampling dengan
memperhatikan kriteria- kriteria yang telah ditentukan, lalu dilakukan pengujian pada sampel di laboratorium dengan penanaman pada medium Potato Dextrose Agar (PDA). Kesimpulan dari penelitian ini adalah dari hasil identifikasi pada penyu abu- abu (Lepidochelys Olivacea Eschscholtz) dan telur penyu gagal menetas ditemukan adanya jamur Aspergillus sp. dan Fusarium sp. Pada penyu abu- abu (Lepidochelys Olivacea Eschscholtz) jenis jamur yang teridentifikasi
adalah Aspergillus sp. sedangkan pada cangkang telur penyu gagal menetas jenis
jamur yang teridentifikasi adalah Aspergillus sp.dan Fusarium sp.
ABSTRACT
NUR FADILLAH HERMAN. O11112005. Identification of fungi on Olive Ridley turtle (Lepidochelys Olivacea Eschscholtz) in Selayar Islands District. Supervised by Prof. Dr. Drh. Lucia Muslimin, M.Sc and Dr. Ir. Hilal Anshary, M.Sc.
Captive breeding of sea turtles in Barugaiya village, Selayar Islands district have faced numerous obstacles, which led to high rate of death sea turtles and failures of hatching eggs. One of the causes was fungi. The main aim of this study was identifying fungi on sea turtles body part and the eggshell. The method of this research was descriptive method. This study had been done for 20 Olive Ridley turtle(Lepidochelys Olivacea Eschscholtz ) and 10 eggs failed to hatch, choosing
sample used Purposive Sampling method with concentrated on certain
characteristics, then it was examined on sample in laboratory by planting in medium Potato Dextrose Agar (PDA) medium. In conclusion, result of sample identification on Olive Ridley turtle (Lepidochelys Olivacea Eschscholtz) body and the eggs failed to hatch were found Aspergillus sp. and Fusarium sp. In the
Olive Ridley turtle (Lepidochelys Olivacea Eschscholtz) was identified
Aspergillus sp. while in the failed hatch eggs was found Aspergillus sp. and Fusarium sp.
Segala Puja dan Puji kehadirat Allah Swt, Tuhan dengan berbagai macam sebutan, Yang di sembah dengan berbagai macam cara, Yang Maha Pemurah lagi Maha Penyayang atas segala limpahan rahmat, taufik, serta hidayah-Nya sehingga penulis di beri kesehatan dan kesempatan. Shalawat dan salam penulis sampaikan kepada baginda Rasulullah Saw dan Keluarganya, Sahabat Nabi, para Syuhada dan tabi'in yang telah menunjukkan jalan dan ilmu-Nya sehingga penulis dapat
menyelesaikan skripsi yang berjudul “Identifikasi Jamur pada Penyu Abu-
Abu (Lepidochelys Olivacea Eschscholtz) Di Kabupaten Kepulauan Selayar ”. Skripsi ini menjadi salah satu syarat untuk mencapai gelar sarjana kedokteran hewan pada Program Studi Kedokteran Hewan Universitas Hasanuddin Makassar. Dalam penelitian dan penulisan skripsi ini dapat terlaksana dengan baik karena bantuan dan peran serta berbagai pihak. Oleh karena itu, penulis mengucapkan terima kasih kepada dosen pembimbing utama Prof. Dr. Drh. Lucia Muslimin, M.Sc dan dosen pembimbing anggota Dr. Ir. Hilal Anshary, M.Sc yang telah banyak memberikan bimbingan, nasehat dan arahan kepada penulis sehingga skripsi ini dapat diselesaikan. Ucapan terima kasih juga penulis sampaikan kepada:
1. Prof. Dr. dr. Andi Asadul Islam, Sp.BS selaku Dekan Fakultas Kedokteran Universitas Hasanuddin.
2. Dosen penguji Prof. Dr. Ir. Sharifuddin Bin Andy Omar M.Sc., Drh. Dini Marmansari , Ibu Dr. Arniaty dan Drh. Farida N Yuliati, M.Si atas ilmu, kritik dan saran kepada penulis.
3. Kepala penangkaran penyu Dusun Tulang Desa Barugaiyya Kecamatan
Bontomanai Kabupaten Kepulauan Selayar Bapak Datu yang telah memberikan kesempatan kepada penulis untuk melakukan penelitian ditempat beliau.
4. Seluruh dosen dan pegawai tata usaha di Program Studi Kedokteran Hewan Universitas Hasanuddin yang telah memberikan bantuan dan dukungan selama proses pendidikan.
5. Bapak Markus yang senantiasa memberikan bimbingan serta ilmunya selama
penelitian ini.
6. Secara khusus penulis ingin mengucapkan terima kasih kepada yang tercinta
Ibunda Hj. Patimasang, S. Sos., Ayahanda Herman Tayyeb dan kakakku Fitri Ahyuni Herman yang telah banyak memberikan dukungan dan pengorbanan sehingga penulis dapat menyelesaikan studi tepat waktu.
7. Keluarga Besar Scuba Ces terkhusus kepada Kanda Mudasir, S.Si yang telah
banyak membantu penulis dari proposal sampai saat ini.
8. Para sahabat seperjuangan selama menempuh pendidikan di Program Studi
Suci Nurfitriani, Khaidir Umar, dan Andi Hismal Gifari.
9. Saudara-saudaraku angakatan 2012 (Akestor Anwelf) Mahasiswa Program
Studi Kedokteran Hewan Universitas Hasanuddin yang telah memberi dukungan penulis dalam penyusunan skripsi ini.
10. Sahabat terbaik penulis di SEPATUH terkhusus kepada Nuraini Yusuf, S.Pd.,
yang telah banyak membantu penulis. Serta sahabat KKN Gel. 93 Desa Pitue
11. Mereka yang tak terlupakan yang sangat berjasa atas bantuan serta
pergolakan pemikiran dalam menempuh studi, penelitian dan penulisan skripsi ini.
Skripsi ini masih jauh dari kesempurnaan meski telah menerima banyak bantuan dari berbagai pihak. Apabila terdapat kekurangan dalam skripsi ini, sepenuhnya menjadi tanggung jawab penulis. Kritik dan saran akan lebih menyempurnakan kehadiran skripsi ini.
Makassar, Februari 2017
Halaman
HALAMAN SAMPUL i
HALAMAN JUDUL ii
PERNYATAAN KEASLIAN iii
ABSTRAK iv
ABSTRACT v
HALAMAN PENGESAHAN vi
KATA PENGANTAR vii
DAFTAR ISI ix DAFTAR TABEL xi DAFTAR GAMBAR xi DAFTAR LAMPIRAN xi 1 PENDAHULUAN 1 1.1 Latar Belakang 1 1.2 Rumusan Masalah 2 1.3 Tujuan Penelitian 2 1.4 Manfaat Penelitian 2 1.5 Hipotesis 3 1.6 Keaslian Penelitian 3 2 TINJAUAN PUSTAKA 4 2.1 Penyu 4 2.1.1 Penyu Hijau 4 2.1.2 Penyu Sisik 5 2.1.3 Penyu Lekang 6 2.1.4 Penyu Tempayan 6
2.2Jenis- Jenis Jamur Pada Penyu 6
2.2.1 Fusarium sp. 7
2.2.2 Aspergillus sp. 8
2.5.1 Penicillium sp. 9
2.3 Pengobatan dan Pencegahan 11
3 METODOLOGI PENELITIAN 12
3.1 Desain Penelitian 12
3.2 Waktu dan Tempat Penelitian 12
3.3 Metode Sampling 12
3.4 Pengambilan sampel 12
3.5 Materi Penelitian 13
3.5.1 Alat dan Bahan 13
3.5.1.1 Alat 13
3.5.1.2 Bahan 13
3.5.2 Prosedur Kerja 13
3.5.2.1 Sampel Swab Bagian Tubuh Penyu 13
3.5.2.2 Sampel Cangkang Telur 13
3.5.2.3 Identifikasi Jamur 13
4 HASIL DAN PEMBAHASAN 15
5 PENUTUP 22
DAFTAR PUSTAKA 23
1 Pengamatan Gejala Klinis dan Hasil Isolasi pada Media PDA 16
2 Pengamatan Ciri- Ciri Cangkang Telur dan Hasil Isolasi pada
Media PDA 17
3 Identifikasi pada Bagian Tubuh Penyu dan Telur Penyu Gagal Menetas 17
DAFTAR GAMBAR
1 Penyu Hijau 5
2 Penyu Sisik 6
3 Penyu Lekang 6
4 Penyu Tempayan 6
5 Koloni dan Mikroskopis Fusarium sp. 8
6 Mikroskopis Aspergillus sp. 9
7 Mikroskopis Penicillium sp. 10
8 Sampel Penyu 15
9 Sampel Telur Penyu 15
10 Koloni Aspergillus sp. pada media PDA berdasarkan hasil penelitian 18
11 Hasil pengamatan mikroskopis Aspergillus sp. 18
12 Mikromorfologi Aspergillus sp.pada pembesaran 40x 18
13 Koloni Fusarium sp.pada media PDA berdasarkan hasil penelitian 20
14 Hasil pengamatan mikroskopis Fusarium sp. 20
DAFTAR LAMPIRAN
1 Hasil Penelitian pada Bagian Tubuh Penyu 29
2 Hasil Penelitian pada Cangkang Telur Gagal Menetas 32
1
PENDAHULUAN
1.1 Latar Belakang
Indonesia merupakan negara kepulauan yang terdiri atas sekitar 17.508 pulau dengan total panjang garis pantai kurang lebih 81.000 Km2. Luas wilayah perairan Indonesia mencapai sekitar 62% dari luas teritorialnya, serta memiliki potensi dan keanekaragaman jenis hayati yang sangat besar, sehingga merupakan wilayah produktif (Supriharyono, 2000).
Dengan luas wilayah yang besar dan garis pantai yang panjang, Indonesia kaya akan berbagai jenis satwa, salah satunya adalah penyu. Penyu memanfaatkan kawasan pantai berpasir sebagai tempat persinggahan dan melakukan aktivitas biologi seperti bersarang dan bertelur serta merupakan habitat yang baik bagi kelangsungan hidup penyu (Indra, 2010).
Kabupaten Kepulauan Selayar merupakan daerah yang menjadi habitat penyu. Hal ini didukung dengan keadaan topografi Kabupaten Kepulauan Selayar yang memiliki panjang garis pantai kurang lebih 670 Km2 dan luas wilayah 1356,03 Km2 (Badan Pusat Statistik Selayar, 2014).
Penyu telah lama terancam, baik dari alam maupun kegiatan manusia yang membahayakan populasinya secara langsung maupun tidak langsung (DKP, 2009). Ada tujuh jenis penyu di dunia oleh CITES (Convention Internasional Trade in Endanger of Wild Flora and Fauna) dimasukkan dalam sebagai hewan yang terancam punah, dilindungi serta tidak dieksploitasi dalam bentuk apapun (Dermawan dan Adnyana, 2003). Dari tujuh jenis penyu di dunia, tercatat enam jenis penyu yang hidup di perairan Indonesia yaitu penyu hijau (Chelonia mydas), penyu sisik (Eretmochelys imbricata), penyu abu- abu (Lepidochelys olivacea), penyu pipih (Natator depressus), penyu belimbing (Dermochelys coricea), serta penyu tempayan (Caretta caretta) (Charuchinda, dkk., 2002). Dari enam penyu yang terdapat di perairan Indonesia empat diantaranya terdapat di penangkaran penyu Desa Barugaiya Kabupaten Kepulaun Selayar yaitu penyu sisik (Eretmochelys imbricate), penyu hijau (Chelonia mydas), penyu lekang (Lepidochelys olivacea) dan penyu tempayan (Caretta caretta)
Data dari berbagai sumber menunjukkan bahwa populasi penyu di Indonesia menurun drastis terutama sejak dua dekade terakhir. Hasil pengamatan beberapa peneliti di beberapa lokasi menunjukan penurunan populasi bisa mencapai 80 (rata-rata 72%) dibandingkan dengan jumlah populasi pada 15 tahun terakhir (Hamid, 2005).
Jumlah populasi penyu yang terus menurun disebabkan oleh berbagai faktor, diantaranya kerusakan habitat alami, pencemaran laut, serangan predator dan perburuan daging maupun telurnya untuk kepentingan komersial. Selain itu, menurunnya jumlah populasi penyu juga disebabkan dari kematian penyu diantaranya ektoparasit (lintah) dan endoparasit (nematoda dan trematoda) (Greiner, 2003), penyakit virus (seperti fibropapilloma yaitu penyakit melemahkan atau mematikan bagi hewan ini) (Higgins, 2003) penyakit pernapasan, dan infeksi jamur (Phillott dan Parmenter, 2001; Higgins, 2003; Sarmiento-Ramirez, dkk., 2010).
Beberapa penelitian sebelumnya tentang jamur pada penyu telah dilakukan oleh Anwar, dkk. (2014) yang melaporkan bahwa jamur menginfeksi pada penyu lekang (Lepidochelys olivacea L.) di penangkaran Pariaman, Sumatera Barat, jenis jamur yang menginfeksi penyu lekang di penangkaran tersebut yaitu Fusarium sp., Aspergillus sp., dan Trichoderma sp. Leong, dkk. (1989) juga melaporkan Fusarium sp. menginfeksi bagian kepala, leher dan kulit penyu Lepidochelys kempii L. Selain itu jamur juga menginfeksi pada penyu sisik, Fusarium sp. merupakan jamur patogen, jamur ini menyebabkan penyakit dan mengganggu fungsi sel normal oleh racun serta memproduksi enzim yang dapat mengganggu atau merusak sel-sel dalam telur.
Adanya jamur yang menginfeksi penyu juga menjadi masalah di penangkaran penyu Desa Barugaiya Kabupaten Kepulauan Selayar. Kurangnya informasi mengenai jenis jamur yang menginfeksi penyu sehingga menyebabkan tingginya tingkat kematian penyu. Dengan mengetahui jenis jamur yang menginfeksi penyu, maka dapat dilakukan pengobatan dan pencegahan sesuai dengan jenis jamur yang menginfeksi penyu tersebut. Hal inilah yang mendasari peneliti untuk melakukan penelitian mengenai jenis- jenis jamur pada penyu dan cangkang telur penyu gagal menetas.
1.2 Rumusan Masalah
Berdasarkan latar belakang yang telah diuraikan di atas bahwa jamur menjadi salah satu penyebab kematian pada penyu sehingga dapat menurunkan populasi penyu, maka rumusan masalah yang akan dibahas pada penelitian ini adalah jenis-jenis jamur apakah yang terdapat pada penyu abu- abu dan cangkang telur penyu gagal menetas di Kabupaten Kepulauan Selayar Sulawesi Selatan.
1.3 Tujuan Penelitian
Mengidentifikasi jamur pada penyu abu- abu dan cangkang telur penyu gagal menetas.
1.4 Manfaat Penelitian
Penelitian ini diharapkan dapat menambah kepustakaan untuk
pengembangan ilmu pengetahuan mengenai jenis jamur pada penyu abu- abu dan cangkang telur penyu gagal menetas. Informasi ini diharapkan dapat digunakan sebagai dasar dalam menyusun program pencegahan dan pengendalian jamur pada penyu laut di Kabupaten Kepulauan Selayar Sulawesi Selatan, sehingga kerugian akibat jamur ini bisa ditangani lebih lanjut oleh instansi yang berwenang.
1.5 Hipotesis
Berdasarkan uraian tersebut, dapat diajukan bahwa terdapat beberapa jenis jamur pada penyu abu- abu dan cangkang telur penyu gagal menetas di Kabupaten Kepulauan Selayar Sulawesi Selatan.
1.6 Keaslian Penelitian
Penelitian mengenai identifikasi jamur pada penyu abu- abu dan cangkang telur penyu gagal menetas di Kabupaten Kepulauan Selayar Sulawesi Selatan belum pernah dilakukan. Penelitian terhadap identifikasi jamur pada penyu dan cangkang telur penyu telah dilakukan, namun pada lokasinya berbeda, seperti halnya Identifikasi Koleksi Jamur dari Cangkang dan Pasir Sarang Telur Penyu Lekang (Lepidochelys olivacea L.) di Penangkaran Pariaman Sumatera Barat (Anwar, dkk., 2014).
2
TINJAUAN PUSTAKA
2.1 Penyu
Penyu merupakan reptil yang hidup di laut serta mampu bermigrasi dalam jarak yang jauh sepanjang kawasan Samudra Hindia, Samudra Pasifik dan Asia Tenggara. Penyu berbeda dengan kura-kura, ciri yang paling khas yang membedakan penyu dengan kura- kura yaitu penyu tidak dapat menarik kepalanya ke dalam apabila merasa terancam. Meskipun hidup di laut, penyu tidak memiliki insang seperti halnya ikan untuk bernapas, karena itu penyu laut muncul sekali-sekali ke permukaan untuk bernapas (Fitriyanto, 2006).
Taksonomi penyu digolongkan dalam :
Kingdom : Animalia Phylum : Chordata Class : Reptilia Ordo : Testudines Subordo : Cryptodira Family : Cheloniidae Subfamily : Cheloniinea
Genus : Caretta Rafinesque, 1814
Spesies : Caretta caretta (Linnaeus, 1758)
Genus : Chelonia Brongniart, 1800
Spesies : Chelonia agassizii (Bocourt, 1868)
Chelonia mydas (Linnaeus, 1758)
Genus : Eretmochelys Fitzinger, 1843
Spesies : Eretmochelys imbricata (Linnaues, 1766)
Genus : Lepidochelys Fitzinger, 1843
Spesies : Lepidochelys kempi (Garman, 1880)
Lepidochelys olivacea (Eschscholtz, 1829)
Genus : Natator McCulloch, 1908
Spesies : Natator depressus (Garman, 1880)
Family : Dermochelydae Fitzinger, 1843
Genus : Dermochelys (Blainville, 1816)
Spesies : Dermochelys coriacea (Vandelli, 1761)
2.1.1 Penyu Hijau
Penyu hijau merupakan penyu laut berukuran pertengahan sampai besar. Penyu hijau betina yang siap bertelur (nesting female) memiliki ukuran karapas (carapace) 3 kaki dengan bobot lebih dari 400 pon. Tukiknya berukuran kecil, dengan ukuran panjang karapas 2 inch dan bobot kurang dari 1 ons. Karapas penyu dewasa licin sepanjang marjin (edges) lateral dan posterior dengan sisik yang tidak bersusun (non-overlapping scales). Tukiknya memiliki karapas yang bundar. Warna penyu hijau bervariasi dari hijau keabuabu kecoklatan, dan karapas seringkali ditandai dengan titiktitik yang lebih gelap atau lorengloreng (Coles dan Toller, 2002).
Chelonia mydas merupakan nama ilmiah yang paling umum dipergunakan bagi penyu hijau. Prihanta (2007) dalam dunia internasional spesies ini lebih dikenal sebagai green turtle berdasarkan warna lemak pada jaringan tubuhnya.
Hampir seluruh spesies ini hidup di perairan tropis dan subtropis terutama di Samudera Pasifik. Penyu hijau sering ditemukan di daerah laut tropis dengan ciri yang mudah dikenali yaitu bentuk paruh yang kecil serta tumpul (Jansen, 2003). Tubuh penyu terbungkus oleh tempurung atau karapas keras berbentuk pipih yang dilapisi zat tanduk. Panjang karapas penyu hijau dewasa berkisar antara 80-122 cm, dan memiliki berat antara 65-204 kg. Karapasnya berwarna coklat kehitaman dengan bintik hijau tua dan garis hitam maupun coklat hingga kuning-putih pada plastronnya (Wyneken, 2001).
Pada penyu hijau dewasa memiliki ciri khusus yaitu terdapat lemak di bawah sisiknya yang berwarna kehijauan. Hal ini disebabkan oleh jenis makanan yang dikonsumsinya berupa lamun (McKenzie, 2008). Berbeda dengan penyu hijau dewasa, saat masih kecil (tukik) penyu hijau bersifat omnivora (Spotila, 2004), tubuhnya berwarna hijau kehitaman (Belinda, 2005). Tukik penyu hijau yang baru menetas memiliki berat kurang dari 28 gram (Spotila, 2004).
Gambar 1. Penyu Hijau (Chelonia mydas) (Direktorat Konservasi dan Taman
Nasional Laut, 2009)
2.1.2 Penyu Sisik
Penyu sisik merupakan penyu yang bersifat karnifora, dengan makanan utama sponge, karang lunak, dan kerang-kerangan. Penyu sisik mudah dibedakan dengan penyu lain dengan melihat skutnya yang tebal dan tumpang tindih yang menutupi karapasnya. Karakterikstik skutnya yang tumpang tindih pada penyu sisik yang indah menyabakan penyu ini dieksploitasi secara besar-besaran untuk ornament (Dermawan, 2003).
Menurut Nuitja (1992) penyu sisik berukuran paling kecil diantara semua jenis penyu yang ada. Penyu sisik akan kembali ke pantai asal ia dilahirkan untuk bertelur pada setiap 3-4 tahun sekali setelah mencapai tingkat untuk bertelur. Penyu sisik biasanya mulai bertelur di waktu malam karena suhu lebih dingin dan sedikit pemangsa, dan akan menghasilkan sekitar 90-185 butir sekali pendaratan.
Penyu sisik mempunyai ukuran sedang, sempit dengan bentuk paruh yang lancip, panjangnya 21-33% dari panjang lurus karapas. Kepalanya mempunyai dua pasang sisik yang berjumlah tiga sampai empat sisik pada bagian samping dan juga pada bagian belakang mata yang disebut Post Orbital Scale (Yusuf, 2000).
Gambar 2. Penyu Sisik (Eretmochelys kempi)(Direktorat Konservasi dan Taman Nasional Laut, 2009)
2.1.3 Penyu Lekang
Penyu lekang atau disebut juga dengan penyu abu-abu memiliki karapas berbentuk kubah tinggi, terdiri atas 5 pasang coastal scutes dimana setiap sisiknya terdiri atas 6-9 bagian, bagian pinggir karapasnya lembut. Penyu lekang ini serupa dengan penyu hijau, namun kepalanya lebih besar dan bentuk karapasnya lebih langsing dan bersudut. Penyu lekang merupakan penyu karnivor, makannya berupa kepiting, kerang, udang,kerang remis (Safrizal, 2009).
Schulz (1975) menyatakan bahwa ukuran penyu abu-abu paling kecil, beratnya jarang mencapai 45 kg, rata-rata beratnya hanya 35 kg. Namun, berdasarkan penemuan Nuitja (1992) bahwa ukuran penyu laut terkecil adalah penyu sisik, sedangkan ukuran terberat dari penyu abu-abu mencapai 75 kg.
Gambar 3. Penyu Lekang atau Abu-abu (Lepidochelys olivacea)(Direktorat
Konservasi dan Taman Nasional Laut, 2009) 2.1.4 Penyu Tempayan
Penyu tempayan juga mempunyai nama lokal, seperti penyu bromo dan penyu karet. Nama kater (si karet) adalah ucapan pintas dari nama ilmiahnya, Caretta caretta. Nama penyu tempayang merupakan nama yang tertulis pada SK Menteri kehutanan No. 301 tahun 1991, yang merupakan penegas dari SK Menteri Pertanian No. 716/Kpts/Um/10/1980, yang juga melarang perdagangan penyu tempayang dan hasil-hasilnya.
Nuitja (1992), memperkirakan penyu tempayang bersama penyu punggung rata, penyu tempayang (Chelonia depressa) hanya terdapat di perairan laut Indonesia.
Gambar 4. Penyu Tempayan (Caretta caretta)(Direktorat Konservasi dan Taman
2.2 Jenis Jamur Pada Penyu Laut
Jamur atau fungi adalah organisme eukariotik yang memiliki inti, memiliki dinding sel yang tersusus atas kitin, bersifat heterotrof, reproduksi secara seksual (spora) ataupan aseksual (miselium), serta tidak berklorofil (Maier, dkk. 2000).
Bagian multiseluler dari jamur yaitu filamen atau dikenal sebagai hifa. Berdasarkan morfologinya, jamur dapat dibedakan menjadi tiga kelompok, yaitu khamir (yeast), kapang (mold), dan cendawan (mushroom). Khamir merupakan
fungi uniseluler yang dikelompokkan kedalam filum Ascomycota dan
Basidiomycota. Kapang dan cendawan merupakan fungi multiseluler. Kapang
memiliki bentuk berupa filamen sedangkan cendawan memiliki tubuh buah (Madigan, dkk., 2012).
Berdasarkan alat reproduksi seksual, jamur diklasifikasikan dalam 5 phylum, yaitu Chytridiomycota, Glomeromycota, Zygomycota, Ascomycota, dan Basidiomycota (Glazer dan Nikaido, 2007). Chytridiomycotadisebut juga dengan “chytrid” menghasilkan zoospora yaitu spora yang berflagel dan bersifat motil
(Webster dan Weber, 2007). Glomeromycota atau dikenal dengan Arbuscular
Mycorrhizal adalah kelompok jamur yang belum diketahui reproduksi seksual.
Zygomycota bereproduksi seksual dengan menghasilkan askospora di dalam
askus (Madigan, dkk., 2012). Basidiomycota bereproduksi secara seksual dengan membentuk basidium yang menghasilakn basidiospora (Solomon, dkk., 2008).
Jamur merupakan kelompok organisme yang terdapat di daerah tropik, subtropik, kutub utara, maupun antartika. Jamur dapat ditemukan di darat, perairan tawar, laut, mangrove, dan di bawah permukaan tanah (Hyde, dkk., 2000). Jamur dapat hidup secara saprofit, parasit dan dekomposer. Jamur saprofit hidup dan makan dari bahan organik tersebut. Jamur sebagai parasit tumbuh pada organisme hidup lain. Jamur dapat pula bersimbion atau berasosiasi dengan tumbuhan (Gandjar, dkk., 2006).
Penyakit kulit akibat jamur pada penyu di penangkaran diyakini lebih sering ditemukan dibandingkan penyu laut liar. Misalnya dermatomikosis merupakan infeksi jamur yang normal mempengaruhi shell, kaki, dan kulit serta semua penyu rentan terhadap ini.
Isolasi dari lesi penyu laut diantaranya Fusarium solani (Austwick dan Baxter, 1983), Aspergillus sp. (George, 1997), Penicillium sp.(Sison, dkk., 1990).
2.2.1 Fusarium sp
Klasifikasi dari Cendawan Fusarium sp. adalah sebagai berikut
(Djaenuddin, 2011). : Kingdom : Mycetae Divisi : Mycota SubDivisi : Deuteromycotina Kelas : Hypomycetes Ordo : Moniliales Famili : Tuberculariaaceae Genus : Fusarium Spesies : Fusarium sp.
Golongan Fusarium sp. dicirikan dengan struktur tubuh berupa miselium bercabang, hialin, dan bersekat (bersepta) dengan diameter 2-4 µm. Jamur Fusarium sp. mempunyai 3 alat reproduksi, yaitu mikrokonidia (terdiri dari 1-2 septa), makrokonidia (3-5 septa), dan klamidospora (pembengkakan pada hifa). Reproduksi aseksual cendawan ini menggunakan mikrokonidia yang terletak pada konidiospora bercabang dan tak bercabang. Makrokonidia dibentuk dari fialid, memiliki struktur halus serta bentuk silinder dan terdiri dari 2 atau lebih sel yang memiliki dinding sel tebal. Mikrokonidia yang dihasilkan umumnya terdiri dari 1-3 sel, berbentuk bulat atau silinder, dan tersusun menjadi rantai atau gumpalan (Semangun, 2004).
Ciri-ciri dari cendawan ini adalah konidia hialin terdiri dari dua jenis yaitu makrokonidia berbentuk sabit, umumnya bersekat tiga, berukuran 30-40 × 4,5-5,5 µm, mikrokonidia bersel satu, berbentuk bulat telur atau lonjong, terbentuk secara tunggal atau berangkai-rangkai, membentuk massa yang berwarna putih, atau merah jambu (Syahiruddin, 2008).
Jamur Fusarium sp. secara makroskopis memiliki koloni melingkar dan menyebar ke segala arah. Pada awal pertumbuhan dimedium PDA koloni berwarna putih seperti kapas, kemudian berubah menjadi putih agak kekuningan atau krem.
Gambar 5. (a) Koloni jamur Fusarium sp. (b). Mikroskopis jamur Fusarium sp.
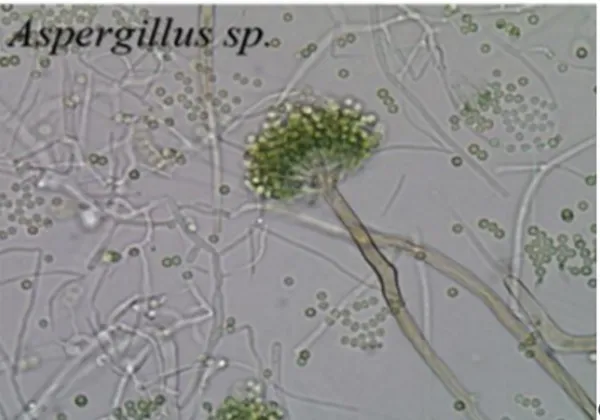
2.2.2 Aspergillus sp.
Aspergillus merupakan organisme multiseluller yang berbentuk benang
(hifa) dengan hifa bercabang-cabang membentuk miselium. Aspergillus hidup
sebagai saprofit di dalam tanah, dikotoran hewan dan sebagai parasit pada tumbuhan. Aspergillus pada umumnya hidup di lingkungan terestrial, tetapi ada pula yang hidup di lingkungan air laut (Jarotrustono, 2009).
Klasifikasi jamur Aspergillus adalah sebagai berikut (Lud W, 2005):
Kingdom : Fungi Phylum : Ascomycota Subphylum : Pezizomycotina Class : Eurotiomycetes Order : Eurotiales Family : Trichocomaceae Genus : Aspergillus Spesies : Aspergillus sp.
Aspergillus yang hidup di lingkungan air laut termasuk ke dalam golongan kapang laut. Kapang laut merupakan kapang yang berasal dari lingkungan darat atau air tawar yang dapat tumbuh dan bersporulasi di lingkungan laut. Kapang laut memiliki kemampuan untuk mensintesis senyawa bioaktif sebagai bentuk adaptasi terhadap kondisi lingkungan yang ekstrim (Nursid, dkk., 2010).
Aspergillus dicirikan dengan konidiospor yang khas, dasar konidiofor berbentuk “T” atau “L” yang disebut foot cell. Vesikel memiliki bentuk yang bervariasi dimana fialid dapat tumbuh langsung dari vesikel, bentuk tersebut disebut uniseriate. Pada beberapa spesies, terdapat sel yang tumbuh diantara fialid dan vesikel, lapisan tersebut disebut metula dan Aspergillus yang memiliki metula disebut biseriate. Kepala konidia berbentuk bulat, dinding konidiofor tipis berwarna putih atau berwarna kecoklatan. Vesikula berbentuk bulat hingga semi bulat dan berdiameter 50-100 µm. Fialid terbentuk pada metula dan berukuran 7-9,5 x 3-4 µm. Metula berwarna putih hingga coklat. Konidia berbentuk bulat hingga semibulat, berukuran 3,5-5 µm, dan berwarna coklat (Klich, 2002).
Koloni pada medium PDA diameternya mencapai 4-5 cm dalam 7 hari, dan terdiri dari suatu lapisan basal yang kompak berwarna putih hingga kuning. Lapisan konidia yang lebat berwarna coklat tua hingga hitam. Kepala konidia berbentuk bulat, dinding konidiofor tipis berwarna putih dapat juga berwarna kecoklatan. Vesikula berbentuk bulat hingga semibulat dan berdiameter 50-100 µm. Fialid terbentuk pada metula dan berukuran ( 7-9,5 ) x ( 3-4 ) µm. Metula berwarna putih hingga coklat. Konidia berbentuk bulat hingga semi bulat, berukuran 3,5-5 µm, berwarna coklat. Banyak ditemukan di daerah beriklim tropis dan subtropis, dan mudah diisolasi dari tanah, udara, sampah, serasah dedaunan dan lain-lain (Gandjar, dkk., 1999). Berikut gambar Aspergillus sp. secara mikroskopis:
Gambar 6. Aspergillus sp. secara mikroskopis (Seidl, 2006).
2.2.3 Penicillium sp
Penicillium sp. tergolong jamur jenis kapang. Penicillium sp. mempunyai ciri- ciri spesifik yaitu; 1) hifa septat, miselium biasanya tidak berwarna; 2) konidiofora septat dan muncul di atas permukaan, berasal dari hifa di bawah permukaan, bercabang atau tidak bercabang; 3) kepala yang membawa spora berbentuk seperti sapu, dengan sterigmata atau fialida muncul dalam kelompok; 4) konidia membentuk rantai karena muncul satu persatu dari sterigmata; 5) konidia
pada waktu masih muda berwarna hijau, kemudian berubah menjadi kebiruan atau kecoklatan (Fardiaz, 1992).
Kapang Penicillium sp. diklasifikasikan menurut sistem nama binomial
yaitu sebagai berikut (Kuraesin, dkk., 2009):
Kingdom : Fungi Filum : Ascomycota Class : Eurotiomycetes Ordo : Eurotiales Famili : Trichomaceae Genus : Penicillium Spesies : Penicillium sp.
Ada dua macam bentuk Penicillium sp. yang diamati, yaitu secara
makroskopis dan mikroskopis. Secara makroskopis, ciri-ciri yang dapat dilihat adalah koloni tumbuh sekitar 4 hari pada suhu 25oC pada medium sobouraud dextrose agar dan koloni mula-mula berwarna putih kemudian akan berwarna kehijauan, sedangkan secara mikroskopis dengan ciri- ciri yang dapat dilihat yaitu hifa bersepta dan konidiofor yang bercabang disebut dengan metula, di metula terdapat fialid (Pohan, 2009).
Konidia Penicillium sp. menyerupai manik-manik kaca jika dilihat dengan mikroskop. Banyaknya konidia yang berwarna hijau, biru, atau kuning sangat berpengaruh pada warna dari berbagai spesies Penicillium. Berikut gambaran penicillium sp.(Dube, 1990) :
Gambar 7. Penicillium sp(Dube, 1990).
Faktor- faktor yang mempengaruhi pertumbuhan kapang Penicillium sp. yaitu; substrat, kelembaban, suhu dan pH (serajat keasaman). Substrat menjadi sumber nutrien utama yang dimanfaat sesudah jamur mengekskresikan enzim-enzim ekstraselular, yang dapat mengurai senyawa- senyawa kompleks menjadi
senyawa yang sederhana. Suhu optimum bagi pertumbuhan Penicillium sp.
sekitar 25oC. pH yang umumnya disukai oleh jamur dibawah 7,0 atau sekitar 2-8,5 (Gandjar, dkk., 2006).
2.3 Pengobatan dan Pencegahan
Pengobatan pada infeksi jamur dapat menggunakan hexidine chlor (misalnya, Nolvasan atau youdium povidone). Namun penggunaan youdium povidone harus dengan hati-hati karena dapat membahayakan jaringan sehat dan menghambat penyembuhan dalam konsentrasi tinggi. Yodium dapat bersifat toksik pada jaringan lunak sehingga dokter hewan dapat merekomendasikan antibakteri (misalnya Neosporin ®, Silvadene ®) atau antijamur (misalnya Miconazoley ®) (Sandy, 2003).
Pencegahan terhadap infeksi jamur dapat dilakukan dengan memperbaiki kualitas air yang buruk. Kualitas air yang buruk dapat meningkatkan terjadi infeksi jamur. Kebersihan air sangat penting untuk kesehatan penyu. Cara terbaik yang dapat dilakukan yaitu sering mengganti air dan sistem filtrasi yang baik. Beberapa faktor yang menentukan seberapa sering air harus dibersihkan yaitu sebagi berikut (1) Volume air dalam bak, (2) ukuran dan efisiensi sistem filtrasi, (3) jenis makanan dan frekuensi makan (beberapa makanan pada air cepat membusuk) serta apakah makanan tersebut diberikan di dalam bak atau wadah terpisah, jika penyu diberi makan di dalam bak maka air harus diganti dalam beberapa jam setelah makan, dengan meninggalkan makanan di dalam bak yang berisi air maka akan menyediakan lingkungan yang ideal untuk perkembangan jamur maupun bakteri. Bak akan tetap bersih lebih lama jika pemberian pakan dilakukan pada wadah terpisah (Sandy, 2003).
3
MATERI DAN METODE PENELITIAN
3.1. Desain Penelitian
Desain penelitian atau rancangan penelitian yang digunakan dalam penelitian ini adalah penelitian deskriptif yaitu suatu jenis penelitian yang memberikan gambaran atau uraian mengenai jenis- jenis jamur pada penyu abu- abu dan cangkang telur penyu yang gagal menetas.
3.2. Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan September sampai November tahun 2016. Lokasi pengambilan sampel bertempat di penangkaran penyu Dusun Tulang, Desa Barugaiya, Kecamatan Bontomanai, Kabupaten Kepulauan Selayar Sulawesi Selatan. Sampel kemudian diuji di Laboratorium Mikrobiologi Program Studi Kedokteran Hewan Fakultas Kedokteran Universitas Hasanuddin.
3.3. Metode Sampling
Penelitian ini menggunakan metode sampling Purposive Sampling,
penentuan sampel mempertimbangkan kriteria-kriteria tertentu yang telah dibuat terhadap obyek yang sesuai dengan tujuan penelitian. Kriteria pemilihan sampel pada penyu adalah
a. Terdapat beberapa bercak putih hingga kekuningan antara lain, pada kaki, pangkal kaki, pangkal ekor, leher, dan bagian wajah penyu.
b. Penyu menunjukkan gejala seperti malas bergerak dan kurang merespon
makanan yang diberikan.
Kriteria terhadap pemilihan cangkang telur gagal menetas antara lain, terdapat bercak kuning hingga kecoklatan pada cangkang telur, telur gagal berkembang dengan ciri – ciri terdapat kuning telur namun tidak terlihat bentuk embrio.
3.4. Pengambilan Sampel
Pengambilan sampel yaitu swab pada bagian tubuh penyu yang dicurigai terinfeksi jamur, dan cangkang telur penyu yang gagal menetas. Pengambilan sampel sebanyak 20 untuk swab pada bagian tubuh penyu menggunakan cotton
swab steril yang sebelumnya di celupkan ke larutan Nacl, kemudian dimasukkan
ke kantong klip plastik. Pengambilan cangkang telur gagal menetas sebanyak 10 butir lalu dimasukkan ke kantong klip plastik.
3.5. Materi Penelitian 3.5.1 Alat dan Bahan 3.5.1.1Alat
Peralatan yang digunakan kantong klip plastik, cotton swab, autoclaf, erlenmeyer, cawan petri, deckglass, lampu spirtus, spidol, mortar dan alu.
3.5.1.2Bahan
Bahan penelitian yang digunakan adalah 20 ekor penyu abu-abu (lekang) yang berjamur, 10 cangkang telur gagal menetas, alkohol 70% untuk sterilisasi alat, medium Potato Dextrose Agar (PDA), aquades, kertas saring, kertas label dan Nacl.
3.5.2 Prosedur Kerja 3.5.2.1Sampel Swab Bagian Tubuh Penyu
Pengambilan sampel dilakukan dengan swab menggunakan cotton swab
steril dari setiap penyu yang diambil dari beberapa bagian tubuh penyu dan dimasukkan ke dalam kantong klip plastik. Kemudian cotton swab yang berisi spora digoreskan di medium PDA dan diinkubasi pada suhu 25o C selama 7 hari. 3.5.2.2Sampel Cangkang Telur
Pengambilan sampel cangkang telur gagal menetas 10 butir dan dipisahkan dari pasir yang menempel pada cangkang. Kemudian sampel dimasukkan ke dalam kantong klip plastik. Pengisolasian jamur pada cangkang dilakukan dengan teknik penanaman pada media PDA. Fragmen cangkang telur terlebih dahulu di haluskan, kemudian diencerkan pada konsentrasi 20% dan 30%. Untuk membuat konsentrasi 20% fragmen cangkang telur yang telah di haluskan ditimbang dengan berat 10g dan dicampurkan aquades sebanyak 50 ml. Sedangkan untuk konsentrasi 30% fragmen telur ditimbang sebanyak 3 g dan dicampurkan dengan aquades sebanyak 10ml. Setelah itu dengan menggunakan cotton swab masing-masing konsentrasi digores pada media PDA sebanyak 10 media dengan menggunakan teknik duplo.
3.5.2.3Identifikasi Jamur
Identifikasi jamur dilakukan melalui dua tahap. Tahap pertama yaitu pengamatan secara makroskopis yang meliputi pengamatan terhadap warna dan bentuk koloni. Tahap kedua yaitu pengamatan secara mikroskopis yang dilakukan dengan membuat slide culture yang meliputi pengamatan terhadap bentuk hifa, bentuk dan ukuruan konidia. Tahap pembuatan slide culture yaitu sebagai berikut:
1. Disiapkan cawan petri steril yang didalamnya diberi kertas saring steril yang
dipotong bundar dan telah dilembabkan dengan menggunakan aquades steril untuk menjaga kelembaban kultur dalam cawan petri. Pada cawan petri tersebut disimpan batang penahan berbentuk segitiga.
2. Diletakkan sebuah object glass steril diatas penahan segitiga. Diatas object glass tersebut diletakkan sejumlah kecil koloni jamur yang diambil pada medium PDA (ukuran kurang lebih 0,3 cm2) dan ditutup dengan cover glass. Setelah diinkubasi selama 24-72 jam pada suhu kamar, slide culture
dapat dilihat menggunakan mikroskop pada pembesaran rendah sampai tinggi lalu di identifikasi.
Identifikasi jamur memakai buku acuan dari RobertA. Samson dan Ellen S.V Reenan-Hockstra (1988)
4 HASIL DAN PEMBAHASAN
Penelitian untuk mengidentifikasi jamur pada penyu abu- abu dan cangkang telur penyu yang gagal menetas di penangkaran penyu Dusun Tulang Desa Barugaiya Kecamatan Bontomanai Kabupaten Kepulauan Selayar telah dilakukan pada bulan September – November 2016. Sebanyak 20 sampel penyu abu- abu (lekang) dikumpulkan sesuai dengan kriteria yang telah ditentukan, begitupun dengan cangkang telur penyu yang gagal menetas telah dikumpulkan sebanyak 10 sampel.
Pemilihan sampel dilakukan dengan memperhatikan kriteria. Sampel penyu yang terpilih memiliki kriteria sebagai berikut :
a. Terdapat beberapa bercak putih hingga kekuningan antara lain, pada kaki, pangkal kaki, pangkal ekor, leher, dan bagian wajah penyu.
b. Penyu menunjukkan gejala seperti malas bergerak dan kurang merespon
makanan yang diberikan.
Gambar 8. Sampel penyu yang terpilih.
Cangkang telur penyu gagal menetes menunjukkan tanda- tanda antara lain terdapat bercak kuning hingga kecoklatan pada cangkang telur, telur gagal berkembang dengan ciri – ciri terdapat kuning telur namun tidak nampak bentuk embrio.
Berikut tabel pengamatan gejala klinis terhadap sampel yang terpilih dan hasil isolasi pada media PDA.
Tabel 1. Pengamatan Gejala Klinis dan Hasil Isolasi Pada Media PDA
Sampel Gejala Klinis Hasil Isolasi
1 Bercak kuning pada leher Tumbuh koloni berupa kapas,
namun tidak teridentifikasi
2 Bercak kuning pada leher Tumbuh koloni berupa kapas,
namun tidak teridentifikasi
3 Bercak kuning pada leher Tumbuh koloni berupa kapas,
namun tidak teridentifikasi
4 Bercak kuning pada leher Tumbuh koloni berupa kapas,
namun tidak teridentifikasi
5 Bercak kuning pada leher Tumbuh koloni berupa kapas,
namun tidak teridentifikasi
6 Bercak kuning pada leher Tumbuh koloni berwarna hijau
7 Bercak kuning pada leher Tumbuh koloni berupa kapas,
namun tidak teridentifikasi
8 Bercak kuning pada leher Tumbuh koloni berupa kapas,
namun tidak teridentifikasi
9 Bercak kuning pada kaki Tumbuh koloni berupa kapas,
namun tidak teridentifikasi
10 Bercak kuning pada leher Tumbuh koloni berupa kapas,
namun tidak teridentifikasi
11 Bercak kuning pada kaki Tumbuh koloni berupa kapas,
namun tidak teridentifikasi
12 Bercak kuning pada leher Koloni berwarna hijau
13 Bercak kuning pada leher Tidak tumbuh
14 Bercak kuning pada leher Tidak tumbuh
15 Bercak kuning pada kaki Koloni berwarna hijau
16 Bercak kuning pada kaki Tidak tumbuh
17 Bercak kuning pada mata Tumbuh koloni berupa kapas,
namun tidak teridentifikasi
18 Bercak kuning pada leher Tidak tumbuh
19 Bercak kuning pada leher Koloni berwarna hijau
Berikut tabel pengamatan gejala klinis terhadap sampel yang terpilih dan hasil isolasi pada media PDA.
Tabel 2. Pengamatan Ciri- Ciri Cangkang Telur dan Hasil Isolasi Pada Media PDA
Sampel Ciri- Ciri Cangkang Telur Hasil Isolasi
1 Bercak kuning pada cangkang
telur dan terdapat kuning telur yang tidak berembrio
Koloni berupa kapas dan
terdapat koloni berwarna hijau
2 Cangkang telur lunak Tidak tumbuh
3 Cangkang telur lunak Koloni berbentuk kapas
4 Cangkang telur lunak Koloni berupa kapas dan
terdapat koloni berwarna hijau
5 Cangkang telur lunak Koloni berwarna kuning
6 Cangkang telur lunak Koloni berwarna kuning dan
hijau
7 Bercak kuning pada cangkang
telur
Koloni berwarna hijau
8 Bercak kuning pada cangkang
telur
Koloni berwarna hijau
9 Bercak kuning pada cangkang
telur dan terdapat kuning telur yang tidak berembrio
Koloni berupa kapas dan tidak teridentifikasi
10 Bercak kuning pada cangkang
telur
Koloni berwarna hijau dan kuning
Hasil identifikasi jamur pada bagian tubuh penyu dan cangkang telur penyu gagal menetas ditemukan jamur Aspergillus sp. dan Fusarium sp. (Tabel 3). Berikut hasil identifikasi jamur pada bagian tubuh penyu dan telur penyu gagal menetas.
Tabel 3. Hasil Identifikasi Jamur Pada Bagian Tubuh Penyu dan Telur Penyu Gagal Menetas
No Jenis Jamur
Jumlah Sampel Teridentifikasi
Tingkat Kejadian Infeksi (%) Bagian Tubuh Penyu Telur gagal menetas Bagian Tubuh Penyu Telur gagal menetas 1. Aspergillus sp. 5 7 25% 70% 2. Fusarium sp. - 1 - 10% Aspergillus sp.
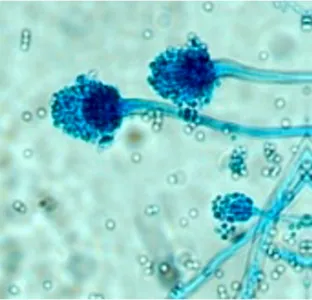
Dari hasil pengamatan secara makroskopis pada medium PDA dalam 7 hari masa inkubasi, terlihat bahwa koloni jamur umumnya berwarna hijau. Warna koloni yang didapatkan telah sesuai dengan identifikasi jamur Aspergillus sp. menurut penelitian Robert A. Samson dan Ellen S. van Reenen-Hockstra (1988) dimana koloninya terdiri atas beberapa warna seperti putih, kuning, coklat
kekuningan, coklat atau hitam, dan hijau. Warna koloni dari Aspergillus sp. ini secara keseluruhan merupakan warna dari konidianya.
Gambar 10. A. Koloni Aspergillus sp. pada media PDA berdasarkan hasil
penelitian.
B. Koloni Aspergillus sp(Rahmi dan Isma, 2013).
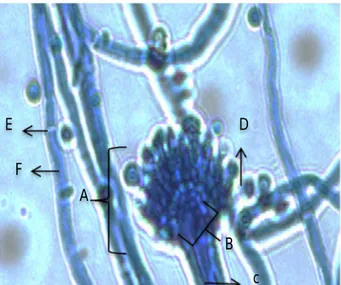
Hasil pengamatan secara mikroskopis dengan pembesaran 40x mendapatkan
gambaran jamur Aspergillus sp. yang memperlihatkan kepala konidia, hifa
bersepta, konidiofor. Hal ini sesuai dengan identifiksi menurut RobertA. Samson dan Ellen S.V Reenan-Hockstra (1988) , yaitu terdiri atas kepala konidia, konidia, fialid, vesikel dan konidiofor. Hal ini dapat dilihat pada gambar 11 di bawah ini :
Gambar 11. Hasil pengamatan mikroskop Aspergillus sp. pada pembesaran 40X
Keterangan (A) Kepala konidia (B) Vesikel (C) Konidiofor (D) Konidia (E) Sekat (F) Hifa
A B c D E F
A
B
Gambar 12. Mikromorfologi Aspergillus sp. pada pembesarn 40X (Beatrice, 2015)
Kepala konodia adalah struktur yang terletak di bagian terminal konidiofor, berbentuk bulat (globose) atau semibulat (subglobose) tersusun atas vesikel, metula (jika ada), fialid dan konidia. Vesikel adalah pembesaran konidiofor pada bagian apeksnya membentuk suatu struktur berbentuk globose, hemisferis, elips atau clavate. konidiofor merupakan suatu struktur tegak lurus yang muncul dari sel kaki dan pada ujungnya menghasilkan kepala konidia. Sebagian besar dari spesies Aspergillus sp. memiliki konidiofor tidak bercabang yang masing-masing menghasilkan kepala konidia tunggal (Muzayyin, 2003).
Mallo, dkk (2002) ,melaporkan bahwa Aspergillus sp. telah diisolasi dari lesi kulit dan mikosis superfisial dari penyu tempayan. Spesies Aspergillus terutama A. flavus, A. niger, A. terreus, A. nidulas, A. fumigatus, dan A. ochraceus juga terisolasi dari telur gagal menetas pada penyu hijau, dan jamur tersebut memproduksi mikotoksin pada telur dan penyu yang akan mempengaruhi embrio dan berkontribusi terhadap kematian penyu (Elshafie, dkk., 2007).
Mikotoksin ini menjadi salah satu faktor virulensi Aspergillus untuk menekan sistem kekebalan host. Mikotoksin ini diproduksi dari beberapa produk metabolisme yaitu asetat, mevalonates, malonite dan beberapa asam amino. Aspergillus menghasilkan beberapa mikotoksin yang paling signifikan dan dikenal termasuk aflatoksin, gliotoxin dan ochratoxin (Keller, dkk., 2005).
Menurut Wiles dan Rand (1987), mikosis kulit lebih sering di antara penyu di penangkaran dari dalam lingkungan alam mereka.
Fusarium sp.
Dari hasil pengamatan secara makroskopis pada medium PDA dalam 7 hari masa inkubasi, terlihat bahwa koloni jamur umumnya berwarna putih serta memiliki tekstur seperti kapas. Hal ini sesuai dengan identifikasi menurut Koneman dan Roberts (1988) bahwa secara makroskopik koloni Fusarium sp.
secara umum berwarna putih, krem, kekuningan, kecokelatan, atau kemerahan. Tekstur dari koloni fusarium sp. seperti kapas (wooly atau cottony). Sedangkan
menurut Samson, dkk (2004), koloni Fusarium sp. pada medium PDA berstruktur
seperti kapas berwarna putih, krem, kekuningan, kecokelatan, atau kemerahan.
Gambar 13. A. Koloni Fusarium sp .pada media PDA berdasarkan hasil
penelitian.
B. Koloni Fusarium sp.(Suciatmih, dkk., 2014).
Hasil pengamatan secara mikroskopis dengan pembesaran 40x mendapatkan
gambaran jamur Fusarium sp. yang memperlihatkan mikrokonidia dan konidiofor.
Hal ini sesuai dengan deskripsi Samson dan Van Reenan (1988) bahwa Fusarium
sp. terdiri atas makrokonidia yang dibentuk pada cabang lateral dari hifa, makrokonidia tersebut berbentuk sabit dengan kedua ujung meruncing.
Gambar 14. A Hasil pengamatan mikroskop Fusarium sp. pada pembesaran 40X
Keterangan (A)Mikrokonidia (B) Konidiofor B. Mikromorfologi Fusarium sp.(Gandjar, dkk., 1999)
Keterangan (A) Mikrokonidia (B) Konidiofor
Shanker, dkk (2003) melaporkan telur- telur yang gagal menetas terkontaminasi oleh jamur Fusarium sp. jamur tersebut berasal dari dalam pasir dan menginfeksi kulit telur serta menginfeksi telur yang sehat selama proses
A B
A
A
B
B
inkubasi. Selain itu, Phillot, dkk (2001) menemukan Fusarium saloni yang merupakan spesies dari Fusarium sp. yang telah diisolasi dari cangkang telur
gagal menetas pada sarang penyu tempayan. Fusarium saloni merupakan
mycobiota umum pada tanah. Diantara jenis jamur yang diisolasi dari telur penyu
tempayan di pantai Yaniklar, Fusarium sp. paling sering terlihat dengan
presentase 53,71%.
Fusarium sp. dan Aspergillus sp. merupakan jamur yang menghasilkan
senyawa mycotoxic yang mengganggu perkembangan embrio sehingga
berkontribusi terhadap kegagalan telur penyu menetas. Jamur yang berkembang pada telur penyu mempengaruhi embrio dengan tiga cara antara lain : (1) menghambat pertukaran gas pada embrio, (2) Penipisan kalsium pada kulit telur sehingga mempengaruhi perkembangan embrio, (3) Transfer spora jamur dari allantois ke jaringan embrio (Elshafie, dkk., 2007).
Penghambatan pertukaran gas oleh jamur dilakukan dengan menutup pori- pori kulit telur sehingga menyebabkan kematian. Namun, hal tersebut tergantung dari presentase kulit telur yang tertutupi dengan jamur (Phillot dan Parmenter, 2001). Sedangkan penipisan kalsium terhadap kulit telur mengakibatkan terganggunya perkembangan embrio, embrio mengambil 43% dari kalsium kulit telur untuk osteogenesis (Bilinski, dkk., 2001).
Faktor munculnya jamur pada telur dapat disebabkan oleh suhu, kelembaban lingkungan dan nutrisi yang terdapat pada lingkungan sarang. Selain kontak dengan sarang, adapun faktor lain adanya jamur pada telur penyu yaitu saluran reproduksi induk penyu yang terinfeksi jamur (Rafferty dan Reina, 2012).
6 PENUTUP
5.1 Kesimpulan
Berdasarkan dari hasil penelitian dapat diperoleh kesimpulan sebagai berikut:
1. Hasil identifikasi pada penyu abu- abu dan cangkang telur penyu gagal menetasditemukan adanya jamur Aspergillus sp.dan Fusarium sp. 2. Pada penyu abu- abu jenis jamur yang teridentifikasi adalah Aspergillus
sp. sedangkan pada cangkang telur penyu gagal menetas jenis jamur yang teridentifikasi adalah Aspergillus sp.dan Fusarium sp.
5.2 Saran
Berdasarkan hasil penelitian, saran yang dapat diberikan sebagai berikut:
1. Penelitian lebih lanjut mengenai pengobatan terhadap jamur pada penyu,
dikarenakan selama ini di penangkaran tersebut menggunakan antijamur tanaman untuk mengobati jamur pada penyu.
2. Penelitian lebih lanjut mengenai spesies dari jamur yang telah didapatkan dengan pengujian PCR. Dikarenakan pada penelitian ini identifikasi hanya sampai pada genus dari jamur sehingga diperlukan identifikasi lebih lanjut dengan PCR
DAFTAR PUSTAKA
Anwar S, Febria FA dan Nasir N. 2014. Identifikasi Koleksi Jamur dari Cangkamg dan Pasir Sarang Telur Penyu Lekang (Lepidochyles olivaceal) di Penangkaran Pariaman [jurnal]. Biologi Universitas Andalas. 3(1):46-50.
Austwick PKC, dan Baxter M. 1983. Some Mycoses Of Reptiles. In: proceeding of
the 8th Congress Internasional Society for Human and Animal Mycology
1982. Massey University, New Zealand.
Badan Pusat Statistik Selayar (BPS). 2014. Data Sensus Luas Wilayah dan Jumlah Pulau di Kabupaten Selayar Tahun 1997-2014. Selayar.
Beatrice WN, Sheila O, dan Vincent A. 2015. Identification Key For Aspergillus
Species Isolated From Maize and Soil of Nandi County, Kenya. Advances in Microbiology 5: 205-229.
Belinda D. 2005. Pro Tempore Secretariat Of The Inter American Convention For
The Protection And Conservation of Sea Turtles (IAC). San Josc. Costa Rica.
Bilinski JJ, Reina RD, Spotila, JR dan Paladino FV. 2001. The effects of nest environment on calcium mobilization by leatherback turtle embryos (Dermochelys coriacea) during development. Comparative Biochemistry and Physiology Part A: Physiology. 130:151-162.
Charuchinda, Monanunsap MS dan Chantrapornsyl S. 2002. Status of sea turtle
conservation in Thailand. In I. Kinan, ed. Proc. Western Pacific Sea Turtle Cooperative Research and Management Workshop. Western Pacific Regional Fishery Management Council, Honolulu, Hawaii, pp. 179–184. Coles dan Toller W. 2002. Green Sea Turtle (Chelonia mydas). Department of
Planning and Natural Resources Division of Fish and Wildlife, U.S.V.I.
Departemen Kelautan dan Perikanan (DKP). 2009. Pedoman Teknis Pengelolaan
Konservasi Penyu. Diterbitkan oleh Direktorat Konservasi dan Taman Nasional Laut, Direktorat Jenderal Kelautan, Pesisir dan Jurnal Pesisir dan Laut Tropis Volume 1 Nomor 2 Tahun 2017 25 Pulau-Pulau Kecil, Departemen Kelautan dan Perikanan RI.
Dermawan A dan Adnyana IBW. 2003. Pedoman Pengelolaan Konservasi Penyu
dan Habitatnya. Departemen Kelautan Dan Perikanan. Jakarta.
Direktorat Konservasi dan Taman Nasional Laut. 2009. Pedoman Teknis
Pengelolaan Konservasi Penyu. Direktorat Jenderal Kelautan, Pesisir dan Pulau - Pulau Kecil. Jakarta.
Djaenuddin N. 2011. Bioekologi Penyakit Layu Fusarium Fusarium oxysporum. Seminar dan Pertemuan Tahunan XXI PEI, PFI Komda Sulawesi Selatan Dan Dinas Perkebunan Pemerintah Sulawesi Selatan, Balai Penelitian Tanaman Serealia. Maros.
Dube H C. 1990. An Introduction to Fungi 2"d Edition. Delhi. Vikas Publishing House PVT LTD.
E. Gomes dan EFB Miclot. 2001. Sea Turtles The Living Marine Resources Of The Western Center Pacific. Vol. 6
Elshafie A, Al-Bahry SN, Alkindi AY, Ba-Omar T, Mahmoud I. 2007. Mycoflora
and Aflatoxins in Soil, Eggshells, and Failed Eggs of Chelonia mydas at Ras Al-Jinz, Oman. Chelonian Conserv. Biol. 6(2):267-270.
Fardiaz S. 1992. Mikrobiologi Pangan 1. PT Gramedia Pustaka Umum. Jakarta.
Fitriyanto. 2006. Studi Pola Tingkah Laku Penyu Sisik Bertelur dan Upaya Pelestariannya di Pulau Kima Bangka Belitung. KIPA. Sekolah Tinggi Perikanan. Jakarta.
Gandjar I, Sjamsuridzal W dan Oetari A. 2006. Mikologi. Yayasan Obor
Indonesia. Jakarta.
George RH. 1997. Health Problems and Diseases of Sea Turtles. In: Lutz, P.L., Musick, J.A. (Eds.), The Biology Of Sea Turtle. CRC Press. Boca Raron. Glazer AN dan Nikkaido H. 2007. Microbial Biotechnology; Fundamentals of
applied microbiology. 2nded. Cambridge University Press.
Greiner EC. 2003. Coccidiosis In Reptiles. Seminar In Avian And Exotic Pet Medicine.
Hamid M. 2005. Database Keanekaragaman hayati Taman Nasional
Takabonerate. Kepala Balai Taman Nasional. Benteng.
Higgins. 2003. Sea Turtle Husbandry. In Lutz, P.L., J.A. Musick., J. Wyneken. The biology of sea turtles Vol II. CRC Press. 411 - 440
Hyde KD, Taylor JE dan Frohlich J. 2000. General of Ascomycetes of palms. Hongkong.
Indra SR. 2010. Analisis Populasi Penyu Hijau (Chelonia Mydas) untuk
Pengembangan Ekowisata di Pantai Pengumbahan [Skripsi]. Sekolah Tinggi Perikanan. Jakarta.
Jansen. 2003. Green Sea Turtle. University of San Francisco Library. Jarotrustono. 2009. Jamur. Jakarta.
Keller NP, Turner G, dan Bennett JW. 2005. Fungal Secondary Metabolis. Biochemistry To Genomics. Nat Rev Microbiol 3(12): 937–947.
Klich, M.A. 2002. Identification of Common Aspergillus species. CBS, Utecht. Netherlands
Komalasari Dessy. 2012. Isolasi, Identifikasi dan Pengujian Kemampuan Kapang
Selulolitik dari Naskah Kuno Kertas Eropa Asal Keraton Kasepuhan Cirebon [Skripsi]. Fakultas MIPA. Universitas Indonesia. Depok.
Koneman EW dan Roberts GD. 1985. Practical laboratory mycology. 3rd ed. Williams and Wilkins Publisher, Baltimore: vii + 211 hlm.
Kuraesin T, Sugoro I, Pikoli MR, Hermanto S, dan Aditiawati P. 2009. Isolasi dan Seleksi Fungo Pelaku Solubilisasi Batubara Subbituminus [Jurnal Biologi Lingkungan]. 3(2):75-87.
Leong JK, Smith DL Revara, Clary DB, Lewis JC, Scott DH, Di Nuzzo JL. 1989. Health Care And Diseases Of Captive-Reared Loggerhead And Kemp’s Ridley Sea Turtles. In: Cailouet, C.W. (Eds.), Proceedings of the1st Internasional Symposium on Kemp’s Ridley Sea Turtle, Conservation and Management. Texas.
Lud, Waluyo. 2007. Mikrobiologi Umum Edisi Revisi. Malang.
Madigan MT, Martinko JM, Stalhl DA, dan Clark DP. 2012. Biology Of
Microorganism. 13 th ed. Pearson Education Inc. San Fransisco.
Maier RM, Pepper IL dan Gerba CP. 2000. Enviromental microbiology.
Academic Pess. California.
Mallo K, Craig AH, Gregory AL, Mark GP. 2002. Pharmacokinetics of
fluconazole in loggerhead sea turtles (caretta caretta) after single intravenous and subcutaneous injections, and multiple subcutaneous injections. J. Zool. Wildlife Med. 33(1): 29-35.
Mckenzie M. 2008. Enviromental Education Research: To What End Invited
Opening Panelist, North American Association For Enviromental Education Research Symposium. Wichita. Kansas.
Muzayyin Y. 2013. Isolasi dan Karakterisasi Kapang Aspergillus dari Roti Tawar
[skripsi]. Fakultas MIPA Universitas Diponegoro . Semarang.
Nuitja INS. 1992. Biologi dan Ekologi Pelestarian Penyu Laut. Institut Pertanian Bogor. Bogor
Nursid M , Pratitis A dan Chasanah E . 2010. Kultivasi Kapang MFW-01-08 yang
Diisolasi dari Ascidia Aplidium longithorax dan Uji Aktivitas Sitotoksiknya terhadap Sel Kanker Payudara T47D [Jurnal]. Pascapanen dan Bioteknologi Kelautan dan Perikanan. 5(2): 103-110.
Phillot AD dan Parmenter CJ. 2001. The Distribution of Failed Egg In Green (Chelonia Mydas) and Loggerhand (Caretta Caretta) Sea Turtle Nests and The Subsequent Appearance Of Fung. Australian Journal Of Zoology. Phillot AD, Phillott AD, dan Parmenter CJ. 2001. Mycoflora Identified From
Failed Green (Ceratta ceratta) Sea Tyrtle Eggs At Heron Island Eastern Australia. Chelonian Conservation and Biologi. 4:170-172.
Pohan A. 2009. Kapang Penicillium sp. www. arthur@fk. Unai.ac.id, 28 Maret 2016.
Prihanta W. 2007. Problematika Kegiatan Konservasi Penyu di Taman Nasional
Meru Beriti. Laporan Penelitian Pengembangan IPTEK Fakultas Keguruan san Ilmu Pendidikan. Universitas Muhammadiyah. Malang.
Rafferty AR., dan Reina RD. 2012. Arrested embryonic development: a review of
strategies to delay hatching in egg-laying reptiles. Procedings of the Royal Society B: Biological Sciences. 279: 2299-2308.
Rahmi Anggita dan Isma Asterina. 2013. Isolasi dan Identifikasi Kapang Endofit
dari Tanaman Obat Surian (Toona sinesis). Edisi Agustus 2013. 7(2): 170-172.
Rene Marquez M. 1980. Sea Turtle Of The World. FAO Spesies Catalogue Vol.II.
An annotated and Ilustrated catalogue of sea turtle spesies denown to date. 81 P.
Safrizal, R. 2009.Jenis dan Morfologi Penyu. Pontianak.
Samson AR dan Reenen Hoekstra ES van. 1988. Introduction to Food Borne Fungi. Centralbureau Voor Schimmelcultures. Baarn. Delpt.
Samson G, Oetari A dan Santosa I. 1999. Pengenalan Kapang Tropik Umum. Yayasan Obor Indonesia. Jakarta.
Samson RA, Hoekstra ES, dan Frisvad JC. 2004. Introduction to Food and Airbone Fungi 7th ed. Centralbureau voor Schimmelcultures.
Sandy B. 2003. Shell Infections When There Are Chinks In The Armor. MATTS.
Sarmiento-Ramirez, Abella E , Mart n MP, Teller a Mı ı T, lopez Jurado LF, Marco
A, dan Dieguezuribeondo J. 2010. Fusarium Saloni Is Reponsible For Mass
Mortalities in Nest Of Longgerhead Sea Turtle Caretta Caretta in Boavista. Cape Verde. Departement de Micologia. Madrid.
Scuhulz JP. 1975. Sea Turtles Nesting in Suriman Zoologisctic Verhandelingen. 143:1-143.
Seidl V. 2006. Initial and Bulk Extraction, dalam Sarker, Latif SD, Gray Z, (Eds.). Natural Products Isolation, 2nd Ed., 27-46. Totowa. New Jersey.
Semangun H. 2000. Penyakit – Penyakit Tanaman Perkebunan di Indonesia. Gadjah Mada University -Press, Yogyakarta.
Shanker K, Pandav B, dan Choudhury BC. 2003. An assessment of the olive ridley
turtle (Lepidochelys olivacea) nesting population in Orissa, India. Biological Conservation. 115: 149-160.
Sison TM, Padilla MA, Vizmanos MZ, Follosco M. 1990. Isolation And
Identification Of Fungi In Necrotic Skin Lesions Of Captive Marine Turtles (Eretmochelys Imbricata). Philippine Journal of Veterinary Medicine. 27:35–36
Solomon EP, Berg LR dan Martin DW. 2008. Biology. 8th Eight edition. Thompson Corporation. USA.
Spotila J. 2004. Sea Turtles A Complete Guide Of Their Biology, Behavior, and Conservation. Johns Hopkins University Press.
Suciatmih, Antonius S, Hidayat I, dan Sulistiyani TR. 2014. Isolasi, identifikasi dan Evaluasi Antagonisme terhadap Fusarium oxysporum f. Sp Cubense (FOC) Secara In Vitro dari Jamur Endofit Tanaman Pisang. LIPI. Bogor. 13(1).
Supriharyono. 2000. Pelestarian dan Pengelolahan Sumberdaya Alam di Wilayah
Pesisir Tropis. Gramedia Pustaka Utama. Jakarta.
Syahiruddin S. 2013. Isolasi Dan Identifikasi Cendawan Entomopatogen Yang Terdapat Pada Rhizosper Pertanaman Kakao Di Kabupaten Mamuju, Sulawesi Barat. Universitas Hasanuddin. Makassar
Webster J dan Weber RWS. 2007. Introduction to fungi. 3nded. Cambridge University Press.
Wiles M dan Rand TG. 1987. Integumental ulceratine disease in a loggerhead turtle Caretta caretta at the Bermuda Aquarium: microbiology and histopathology. Dis. Aquat. Organ. 3:85-90.
Wyneken J. 2001. The Anatomy Of Sea Turtles. U.S. Departement Of Commerce
NOAA Technical Memorandum.
Lampiran 1
Kontrol Negatif pada media
Hasil Penelitian Pada Bagian Tubuh Penyu
Foto Sampel Foto Hasil Isolasi Pada
Media PDA Foto Hasil Pengamatan Mikroskopis Sampel 1 Pembesaran 40X Sampel 2 Pembesaran 40X
Sampel 3 Pembesaran 40X Sampel 4 Pembesaran 40X Sampel 5 Pembesaran 40X Sampel 6 Pembesaran 40X
Sampel 7 Pembesaran 40X Sampel 8 Pembesaran 40X Sampel 9 Pembesaran 40X Sampel 10 Pembesaran 40X
Lampiran 2
Hasil Penelitian Pada Cangkang Telur Gagal Menetas
Foto Sampel Foto Hasil Isolasi Pada
Media PDA Foto Hasil Pengamatan Mikroskopis Pembesaran 40X Pembesaran 40X
Pembesaran 40X
Pembesaran 40X
Pembesaran 40X Pembesaran 40X Pembesaran 40X Pembesaran 40X
Foto Penelitian
Media Potato Dextrose Agar
Pewarnaan Jamur
RIWAYAT HIDUP
Penulis bernama lengkap Nur Fadillah Herman
Lahir di Kota Watampone, Kabupaten Bone, Sulawesi
Selatan pada tanggal 06 Juli 1994 dari pasangan Herman
Tayyeb dan Hj. Patimasang, S.Sos yang merupakan anak dua dari dua bersaudara. Penulis sekarang bertempat tinggal di Perumahan Bumi Permata Sudiang 4 Blok H No. 7, Kelurahan Sudiang, Kecamatan Biringkanayya, Kota Makassar. Jenjang pendidikan yang telah ditempuh penulis adalah SD Inpres 12/79 Macanang lulus tahun 2006, MTsN 400 Watampone lulus pada tahun 2009, SMA Negeri 1 Watampone lulus tahun 2012 dan pada tahun 2012 penulis diterima sebagai Mahasiswa Fakultas Kedokteran, Program Studi Kedokteran Hewan Universitas Hasanuddin.
Selama perkuliahan penulis aktif dalam organisasi kemahasiswaan, dan kepemudaan antara lain : Ketua Devisi Pengabdian Masyarakat Himpunan Mahasiswa Kedokteran Hewan (HIMAKAHA) periode 2014-2015, Bendahara Umum Himpunan Mahasiswa Islam (HMI) Komisariat Kedokteran Hewan Cabang Makassar Timur periode 2016-2017.