JURNAL PRAKTIKUM
KIMIA ANALISIS FARMASI
PERCOBAAN
TITRASI ASAM BASA
O L E H
KELOMPOK : VI GOLONGAN : I
ASISTEN : MUH.FIRDAUS, S. Farm
LABORATORIUM KIMIA FARMASI JURUSAN FARMASI
FAKULTAS ILMU KESEHATAN
UNIVERSITAS ISLAM NEGERI ALAUDDIN MAKASSAR
SAMATA – GOWA 2011
BAB I PENDAHULUAN A. Latar Belakang
Salah satu cara dalam penentuan kadar larutan asam basa adalah dengan melalui proses titrasi asidimetri dan alkalimetri. Cara ini cukup menguntungkan karena pelaksanaannya mudah dan cepat, ketelitian dan ketepatannya juga cukup tinggi.
Asidimetri dan alkalimetri adalah proses penentuan banyaknya suatu larutan dengan konsentrasi yang diketahui dan diperlukan untuk bereaksi secara lengkap dengan jumlah tertentu yang akan dianalisis. Proses analisis yang melibatkan pengukuran yang seksama volume-volume suatu asam dan basa yang saling menetralkan. ( Keenan, 1998 ; 442 )
Titrasi asidimetri dan alkalimetri dibagi menjadi dua bagian besar yaitu asidimetri dan alkalimetri. Asidimetri adalah titrasi dengan menggunakan larutan standar asam untuk menentukan basa. Asam-asam yang biasanya dipergunakan adalah asam klorida, asam asetat, asam oksalat. Sedangkan alkalimetri merupakan kebalikan dari asidimetri yaitu titrasi yang menggunakan larutan standar basa untuk menentukan asam. (Khopkar, 1990 ; 121 )
Titrasi asam basa dapat memberikan titik akhir yang cukup tajam dan untuk itu digunakan pengamatan dengan indikator bila pH pada titik ekuivalen 4-10. Demikian juga titik akhir titrasi akan tajam pada titirasi asam atau basa lemah, jika penitrasian adalah basa atau asam kuat dengan perbandingan tetapan disosiasi asam lebih besar dari 104. .pH berubah secara drastis bila volume titrannya. Pada reaksi asam basa, proton ditransfer dari satu molekul ke molekul lain. Dalam air proton biasnya tersolvasi sebagai H3O. Reaksi asam basa bersifat reversibel. Temperatur mempengaruhi titrasi asam basa, pH dan perubahan warna indikator tergantung secara tidak langsung pada temperatur.( Susanti dan Wunas ,1995 ; 103 ).
Pada percobaan ini adalah penentuan kadar dengan metode asidimetri dan alkalimetri menggunakan indikator fenolftalein dan metil jingga, hal ini
dilakukan karena jika menggunakan indikator yang lain adanya kemungkinan trayek pH-nya jauh dari titik ekuivalen.
Dalam bidang farmasi, asidimetri dan alkalimetri dapat digunakan untuk menentukan kadar suatu obat dengan teliti karena dengan titrasi ini penyimpangan titik equivalen lebih kecil sehingga lebih mudah untuk mengetahui titik akhir titrasinya yang ditandai dengan suatu perubahan warna, begitu pula dengan waktu yang digunakan seefisien mungkin.
B. Maksud dan Tujuan 1. Maksud Percobaan
Mengetahui dan memahami cara penetapan kadar suatu senyawa dengan menggunakan metode volumetri atau titrimetri
2. Tujuan Percobaan
a. Menentukan kadar natrium bikarbonat dengan menggunakan metode asidimetri
b. Menetukan kadar asam salisilat dengan menggunakan metode alkalimetri
C. Prinsip Percobaan
1. Penentuan kadar natrium bikarbonat dengan menggunakan metode asidimetri berdasarkan reaksi netralisasi dimana sampel yang bersifat basa dititrasi dengan larutan baku HCL 0,1 N dengan penambahan indikator metil merah dan titik akhir titrasi ditandai dengan perubahan warna dari merah ke bening.
2. Penentuan kadar asam salisilat dengan menggunakan metode alkalimetri berdasarkan reaksi netralisasi dimana sampel yang bersifat asam dititrasi dengan larutan baku NaOH 0,1 N dengan penambahan indikator fenolftalein dan ditandai dengan perubahan warna bening ke merah muda.
BAB II
TINJAUAN PUSTAKA A. Teori Umum
Titrasi adalah suatu metode untuk menetukan konsentrasi zat didalam larutan. Titrasi dilakukan dengan mereaksikan larutan tersebut dengan larutan yang diketahui konsentrasinya. Reaksi di lakukan secara bertahap ( tetes demi tete) hingga tepat mencapai titik stokiometri atau titik setara. ( Sunarya, 2007; 168 )
Asidimetri dan alkalimetri adalah proses penentuan banyaknya suatu larutan dengan konsentrasi yang diketahui dan diperlukan untuk bereaksi secara lengkap dengan jumlah contoh tertentu yang akan dianalisis.Contoh sesuatu yang dianalisis dirujuk sebagai (tak diketahui). Proses analisis yang melibatkan pengukuran yang seksama volume-volume suatu asam dan basa yang saling menetralkan. ( Keenan, 1998 ; 442 )
Dalam pengertian Bronsted, asam adalah segala zat yang dapat memberikan proton, dan basa adalah zat yang dapat menerima proton. Ion hidroksida, pastinya adalah suatu akseptor proton dan karena itu merupakan basa Bronsted tetapi ion itu tidak unik. Ion tersebut adalah satu dari banyak spesies yang dapat mempertunjukkan perilaku dasar. Ketika suatu asam menghasilkan proton, spesies yang kekurangan harus memiliki sedikit afinitas proton sehingga merupakan suatu basa. Jadi dalam perlakuan Bronsted kita menemui pasangan asam basa konjugat :
HB H+ + B
Asam Basa
Asam HB secara listrik dapat bersifat netral, anion atau kation (misalnya : HCL, , ) sehingga kita tidak bisa menyebutkan muatan pada HB maupun B. ( Day & Underwood, 2002; 127 )
Pada proses titrasi ini digunakan suatu indikator yaitu suatu zat yang ditambahkan sampai seluruh reaksi selesai yang menyetarakan dengan perubahan warna. Perubahan warna menandakan telah tercapainya titik akhir titrasi. ( Brady, 1999; 217 )
Dalam memilih suatu asam digunakan dalam larutan standar hendaknya di perhatikan faktor-faktor berikut :
1. Asam itu harus kuat, yakni sangat terdisosiasi 2. Asam tersebut tidak menguap
3. Larutan asam harus stabil
4. Garam dari asam tersebut harus mudah larut
5. Asam tersebut bukan pengoksidasi yang kuat untuk menghancurkan senyawa-senyawa organik yang digunakan sebagai indikator.
Asam sulfat dan asam klorida paling banyak digunakan untuk larutan standar walaupun waupun tidak satupun dari keduanya yang memenuhi syarat tersebut. Asidimetri merupakan metode titrimetri atau volumetri yang didasarkan pada pengukuran seksama jumlah volume asam yang digunakan baik untuk zat-zat organik maupun anorganik. ( Haeria, 2011; 5 )
NaOH merupakan basa yang paling lazim digunakan untuk titrasi asam basa. NaOH selalu terkontaminasi oleh sejumlah kecil pengotor yang paling serius diantaranya adalah Na2CO3. Ketika CO2 diserap oleh larutan NaOH, reaksi berlaku dan terjadi :
CO2 + 2OH- + H2O
Alkalimetri merupakan metode titrimetri yang didasarkan pada pengukuran seksama jumlah jumlah volume basa yang digunakan. ( Haeria, 2011 ; 6 )
Dalam praktik laboratorium adalah biasa untuk membuat larutan dari asam dan basa dengan konsentrasi yang diinginkan dan kemudian menstandarisasi larutan terhadap standar utama. Membuat larutan standar dari asam klorida bisa dilakukan dengan langsung menimbang sebagian HCL yang diketahui densitasnya diikuti dengan pengenceran dalam labu volumetri. Namun, lebih sering larutan asam tersebut di standarisasi dengan cara yang biasa terhadap standar utama.
Reaksi antara zat yang terpilih sebagai standar utama dan asam atau basa harus memenuhi syarat-syarat untuk analisis titrimetrik. Selain itu, standar utama harus memenuhi karakteristik berikut ini:
1. Harus langsung tersedia dalam bentuk murni atau dalam keadaan yang diketahui kemurniannya. Secara umum, jumlah total pengotor harus
tidak melebihi 0,01 sampai 0,02 % dan seharusnya kita bisa menguji adanya pengotor dengan adanya penguji kualitatif yang diketahui kepekaannya.
2. Zat tersebut harus mudah mengering dan tidak boleh terlalu higroskopis karena hal itu dapat mengakibatkan air terikut pada saat penimbangan. Zat tersebut tidak boleh kehilangan berat saat terpapar udara.
3. Standar utama itu diinginkan memiliki berat ekuivalen yang tinggi untuk meminimalkan akibat-akibat dari kesalahan saat penimbangan. 4. Asam atau tersebut lebih disukai yang kuat, yakni, sangat terdisosiasi.
Namun demikian, asam atau basa lemah dapat digunakan sebagai standar utama. (Day and Underwood. 2002 ; 155)
Titrasi asam basa dapat memberikan titik akhir yang cukup tajam dan untuk itu digunakan pengamatan dengan indikator bila pH pada titik ekuivalen 4-10. Demikian juga titik akhir titrasi akan tajam pada titirasi asam atau basa lemah jika penitrasian adalah basa atau asam kuat dengan perbandingan tetapan disosiasi asam lebih besar dari 104 pH berubah secara drastis bila volume titrannya. Pada reaksi asam basa, proton ditransfer dari satu molekul ke molekul lain. Dalam air proton biasnya tersolvasi sebagai H30. Reaksi asam basa bersifat reversibel. Temperatur mempengaruhi titrasi asam basa, pH dan
perubahan warna indikator tergantung secara tidak langsung pada temperatur. ( Susanti dan Wunas, 1995; 96 )
Dalam penetuan titrasi , larutan yang dititrasi disebut titrat. Sedangkan larutan pentitrasi disebut titran. Titran dituangkan dari buret tetes tetes demi tetes kedalam larutan titrat sampai titik stokiometri tercapai. Titrasi asam basa pada dasarnya adalah reaksi penetralan asam oleh basa atau sebaliknya. Persamaan ion bersihnya adalah :
H+(aq) + OH-(aq) H2O( l) Dalam sebuah kurva titrasi asam basa memiliki ciri : 1. Bentuk kurva selalu berupa sigmoid
2. Ketika mendekati titik ekuivalen bentuk kurva tajam 3. Pada titik setara pH sama dengan 7. ( Sunarya, 2002; 171 )
Larutan basa yang akan diteteskan ( titran ) di masukkan ke dalam buret (pipa panjang berskala) dan jumlah yang terpakai dapat diketahui dari tinggi sebelum dan sesudah titrasi. Larutan asam yang dititrasi dimasukkan kedalam gelas kimia dengan mengukur volumenya terlebih dahulu dengan memakai pipet gondok. Untuk mengamati titik ekuivalen, di akai indikator yang warnanya di sekitar titik ekuivalen. Data titrasi yang di amati adalah titik akhir bukan titik ekuivalen.( Sukri, 1999 ; 428 )
Suatu proses didalam laboratorium untuk mengukur jumlah suatu reaktan yang bereaksi sempurna dengan sejumlah reaktan lainnya, dimana reaktan pertama ditambahkan secara kontinu ke reaktan kedua di sebut titrasi reaktan yang ditambahkan tadi disebut sebagai titran dan reaktan yang ditambahkan titran disebut titer. Sala satu masalah teknis dalam titrasi adalah titik dimana suatu perubahan dapat diamati, terjadi yang dapat mengidentifikasi pendekatan yang paling baik dititik equivalen. Secara ideal titik equivalen dan titik akhir seharusnya identik, tetapi dalam prakteknya jarang sekali ada orang yang mempu membuat kedua titik tersebut tepat sama, meskipun ada beberapa hal dari mana perbedaan antara kedua hal tersebut dapat diabaikan.( Snyder, 1996 ; 597 )
Kadang-kadang kita perlu mengetahui tidak hanya atau sekedar pH akan tetapi kita perlu ketahui juga berperan banyak asam atau basa yang terdapat di dalam sampel. Sebagai contoh seorang ahli kimia lingkungan mempelajari suatu danau di mana ikan-ikannya mati. Dia harus mengetahui secara pasti seberapa banyak asam yang terkandung dalam sampel air danau tersebut. Titrasi melibatkan suatu proses penambahan suatu larutan yang di sebut titran dari buret ke suatu flask yang berisi sampel dan disebut analit. Berhasilnya titrasi asam basa tergantung pada seberapa akurat kita dapat mendeteksi titik stokiometri. Pada titik tersebut, jumlah mol dari H3O+ dan OH- yang ditambahkan sebagai titran adalah sama dengan jumlahmol dari OH -yang ditambahkan sebagai titran adalah sama dengan jumlah mol dari OH- atau H3O+ yagn terdapat dalam analit. Pada titik stokiometri, larutan terdiri dari garam dan air. Larutan tersebut adalah asam apabila ion asam yang terkandung
di dalamnya, dan basa apabila ion basa yang terkandung didalamnya. (Atkins, 1997 ; 550)
Misalkan kita ingin menetukan molaritas dari suatu larutan HCL yang tidak diketahui konsentrasinya. Kita bisa menentukan konsentrasi HCL tersebut melalui suatu prosedur yang di sebut titrasi. Dimana kita menetralisasi suatu asam dengan suatu basayang telah diketahui konsentrasinya. Pada titrasi, pertama-tama kita menempatkansuatu asam yang volumenya telah ditentukan kedalam suatu flask.dan tambahkan beberapa indikator seperti fenolftalein, kedalam larutan asam. Dalam larutan asam, fenolftalein tidak berwarna. Kemudian buret kita isi dengan NaOH yang konsentrasinya telah diketahui, dan dengan hati-hati NaOH di tambahkan ke asam pada flask. Kita bisa mengetahui bahwa netralisasi telah berlangsung ketika fenolftalein dalam larutan berubah warna menjadi merah muda. ini disebut titik akhir netralisasi. ( Timberlake, 2004; 354 )
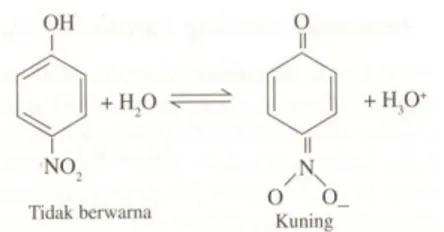
Analisis mendapat keuntungan dari perubahan pH yang besar yang terjadi dalam titrasi untuk penetuan saat kapan titik ekuivalen dicapai. Ada banyak asam dan basa organik lemah yang bentuk tak terurainya dan bentuk ioniknya memiliki warna yang berbeda. Molekul tersebut bisa digunakan untuk menentukan kapan penambahan titran telah mencukupi dan dinamakan indikator visual. Sebuah contoh sederhana adalah p-nitro fenol pada Gambar 6.0 yang merupakan asam lemah yang terurai sebagai berikut:
Gambar 6.0 p-nitrofenol
Bentuk tak terurai p-nitrofenol tidak berwarna ,tetapi ionnya, yang mempun yai suatu sistem pengubah ikatan tunggal dan ganda, berwarna kuning.
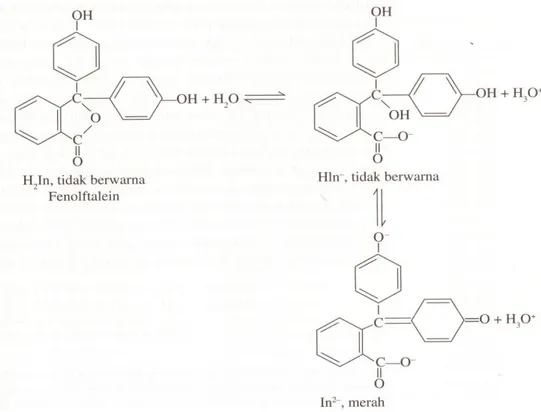
Indikator fenolftalein yang ditunjukkan dalam Gambar 6.1 merupakan asam diprotik dan tidak berwarna. Indikator ini terurai dahulu menjadi bentuk
tidak berwananya dan kemudian dengan hilangnya proton kedua menjadi ion dengan sistem terkunjat , menghasilkan warna merah.
Gambar 6.1. Fenolftalein
Metil oranye, indikator lainnya yang banyak digunakan, merupakan basa dan berwarna kuning dalam bentuk molekulnya. Penambahan proton menghasilkan kation yang berwarna merah muda.( Day&Underwood, 2002; 141-142 ).
Yang menyebabkan indikator asam – basa berubah warnanya bila pH lingkungannya berubah adalah :
a. Indikator asam basa ialah organik lemah, atau basa organik lemah. Jadi dalam larutan mengalami kesetimbangan pengionan.
b. Molekul – molekul indikator tersebut mempunyai warna yang berbeda dengan warna ion-ionnya
c. Letak trayek pH pada pH tinggi atau rendah atau tengah tergantung dari besar kecilnya Ka atau Kb undikator yang bersangkutan.
d. Terjadi trayek merupakan akibat kesetimbangan dan karena kemampuan mata untuk membedakan campuran warna-warna.
Perubahan warna indikator terjadi, karena pengionannya membawa perubahan struktur yaitu struktur molekul dan ionnya berbeda. Perbedaan struktur bentuk asam dan bentuk basa,itu karenanya mengakibatkan perbedaan warna. Hal ini terjadi karena bentuk yang mempunyai ikatan rangkap terkonjugasi umumnya bentuk yang berwarna. Konjugasi menyebabkan energi yang diperlukan untuk meningkatkan elektron lebih rendah, sehingga cukup dipenuhi oleh sinar tampak. Maka sebagian dari sinar putih diserap dan zat menjadi berwarna. Zat yang tak berwarna menyerap energi yang lebih besar dan hanya tercukupi oleh sinar uv, sehingga sinar putih tidak dipengaruhi dan tidak timbul warna. (http:ripani musyaffalab.com).
Perubahan warna suatu indikator tergantung konsentrasi ion hidrogen (H+) yang ada dalam larutan dan tidak menunjukkan kesempurnaan reaksi atau ketetapan netralisasi. Indikator pH asam basa adalah suatu indikator atau zat yang dapat berubah warna apabila pH lingkungan berubah. Misalnya biru brometil (BB), dilarutkan asam menjadi warna kuning, tetapi dalam larutan basa menjadi biru. Tabel 6.3 mendaftarkan beberapa indikator asam basa bersama dengan rentang pH meraka .
INDIKATOR DAERAH pH
WARNA
ASAM BASA
Kuning metil Biru brom fenol Metil jingga Hijaubrom kresol Metil merah Ungubrom timol Biru brom timol Merah fenol Merah kresol Fenolftalein Timolftalein Alizarin kuning R 1,3,5-trinitrobenzena 2,9 - 4,0 3,0 – 4,6 3,2 – 4,4 4,0 – 5,4 4,2 - 6,2 5,2 – 6,8 6,0 – 7,6 6,8 – 8,2 7,2 – 8,9 8,0 – 10,0 8,6 – 10,0 10,1- 12,0 12,0 – 14,0 Merah Kuning Merah muda Kuning Merah Kuning Kuning Kuning Kuning Tidak berwarna Tidak berwarna Kuning Tidak berwarna Kuning Biru Kuning Biru Kuning Ungu Biru Merah Merah Merah Biru Violet Oranye
Seperti yang diketahui sebelumnya, dalam stokiometri titrasi titik ekuivalen dari reaksi netralisasi adalah titik pada reaksi dimana asam dan basa keduanya setara, yaitu dimana keduanya tidak ada yang berlebihan. Dalam titrasi suatu larutan yang akan di netralkan, misalkan asam di tempatkan dalam flask. Bersamaan dengan beberapa tetes indikator asam basa. Kemudian larutan lainnya ( misalnya basa ) yang terdapat di dalam buret, di tambahkan ke asam. Pertama-tama ditambahkan cukup banyak kemudian dengan tetesan hingga titik ekuivalen. Titik ekuivalen terjadi pada saat terjadi perubahan warna pada indikator. Titik pada titrasi dimana indikator warnanya berubah di sebut titik akhir titrasi. ( Petrucci, 1997 ; 636 )
Asam dan basa kuat terurai sempurna dalam larutan berair. Oleh karena itu, pH pada berbagai titik selama titrasi dapat di hitung langsung dari jumlah stokiometri asam dan basa yang di biarkan beraksi. Pada titik ekuivalen, pH ditentukan oleh tingkat terurainya air. Pada 25 % pH air murni adalah 7,00.
Contoh kurva titrasi asam kuat-basa kuat: 50 ml HCL 0,10 M dititrasi dengan NaOH 0,10 M yang ditunjukkan dalam gambar 6.4. Daerah yang diarsir merupakan rentang dimana ketiga indikator visual berubah warna. Nampaknya saat asam kuat di titrasi, penambahan pH yang besar pada titik ekuivalen cukup untuk melebarkan rentang dari ketiga indikator. Oleh karena itu, tiap tiap indikator ini akan berubah warna dengan satu atau dua tetes pada titik ekuivalen.
Gambar 6.4 Kurva titrasi asam kuat-basa kuat: 50 ml HCl 0,10 M dititrasi dengan NaOH 0,10 M
Kurva titrasi untuk basa kuat yang dititrasi dengan asam kuat. Misalnya NaOH dengan HCL, akan sama persis dengan kurva pada Gambar 6.4. jika pOH diplot vs volume HCL. Jika pH di plot, kurva dalam Gambar 6.4 hanya dibalik, dimulai pada nilai yang tinggi dan menurun hingga pH yang rendah setelah titik ekuivalen. ( Day and Underwood. 2002 ; 129-133)
Titrasi asam-basa merupakan cara yang tepat dan mudah untuk menentukan jumlah senyawa-senyawa yang bersifat asam dan basa. Kebanyakan asam dan basa organik dan organik dapat dititrasi dalam larutan berair, tetapi sebagian senyawa itu terutama senyawa organik tidak larut dalam air. Namun demikian umumnya senyawa organik dapat larut dalam pelarut organik, karena itu senyawa organik itu dapat ditentukan dengan titrasi asam basa dalam pelarut inert. Untuk menentukan asam digunakan larutan baku asam kuat misalnya HCl, sedangkan untuk menentuan basa digunakan larutan basakuat misalnya NaOH. Tiik akhir titrasi biasanya ditetapkan dengan bantuan perubahan indikator asam basa yang sesuai atau dengan bantuan peralatan seperti potensiometri, spektrofotometer, konduktometer. ( Khopkar, 1990 ; 128 )
Titrasi asam basa dapat memberikan titik akhir yang cukup tajam dan untuk itu digunakan pengamatan dengan indikator bila pH pada titik ekuivalen 4-10. Demikian juga titik akhir titrasi akan tajam pada titirasi asam atau basa lemah, jika penitrasian adalah basa atau asam kuat dengan perbandingan tetapan disosiasi asam lebih besar dari 104 .pH berubah secara drastis bila volume titrannya. Pada reaksi asam basa, proton ditransfer dari satu molekul ke molekul lain. Dalam air proton biasnya tersolvasi sebagai H3O. Reaksi asam basa bersifat reversibel. Temperatur mempengaruhi titrasi asam basa, pH dan perubahan warna indikator tergantung secara tidak langsung pada temperatur.( Susanti dan Wunas ,1995 ; 103 )
Titrasi asam basa sering disebut asidimetri dan alkalimetri, sedang untuk titrasi pengukuran lain-lain sering dipakai akhiran-ometri mengggantikan-imetri. Kata metri berasal dari bahasa Yunani yang berarti ilmu proses seni mengukur. I dan O dalam hubungan mengukur sama saja, yaitu dengan atau
dari (with atau off). Akhiran I berasal dari kata latin dan O berasal dari kata Yunani. Jadi asidimetri dapat diartikan pengukuran jumlah asam ataupun pengukuran dengan asam (yang diukur dalam jumlah basa atau garam). (Khopkar,1990 ;124)
Dalam teori ionisasi, suatu larutan netral mengandung jumlah ion hidrogen dan ion hidroksida (H+ dan CH-) Reaksi netralisasi mempunyai nilai yang berarti untuk analisa kuantitatif harus berjalan sedemikian sempurna, reaksi ini dapat disimpulkan dengan cara-cara seperti misalnya : dengan pembentukan suatu zat dengan derajat disosiasi yang kecil, dengan membebaskan gas dari suatu reaksi dengan pembentukan endapan dari suatu reaksi dengan membebaskan suatu ion kompleks dengan menambah suatu pereaksi yang berlebihan.
Pada reaksi netralisasi terjadi reaksi yang sempurna seperti ditunjukkan pada reaksi berikut :
H+ Cl- + Na+CH- Na+Cl- + H2O
Dalam hal titrasi asam klorida dengan larutan natrium hidroksida terdapat ion hidrogen yang berlebihan dalam larutan asam klorida sampai tepat pada waktu penambahan larutan NaOH dalam jumlah yang setara. Pada titik stelkiometri atau titik akhir, ion hidrogen yang ada dalam larutan hanya berasal dari disosiasi molekul air.
Asidimetri dan alkalimetri termasuk penetapan titri metri dengan reaksi netralisasi.
H+ + OH- H2O
Asidimetri merupakan metode titrimetri yang didasarkan pada pengukuran seksama jumlah volume asam yang digunakan, baik untuk zat-zat organik maupun zat anorganik. Alkalimetri merupakan metode titrimetri yang didasarkan pada pengukuran seksama jumlah volume basa yang digunakan indikator untuk metode netralisasi ini biasanya digunakan senyawa organik yang kompleks. Penambahan warna indikator pada titrasi tergantung pada ion H+. Senyawa organik ini dapat berupa senyawa suatu asam atau basa yang sempurna mempunyai warna berbeda pada pH tertentu.( Sukri, 1990; 425 ).
B. Uraian Bahan
1. Air suling ( Dirjen POM, 1979 ; 96 )
Nama resmi : AQUA DESTILLATA Nama lain : Air suling, aquadest Rumus molekul : H2O
Berat molekul : 18,02
Pemerian : Cairan jernih, tidak berwarna, tidak berbau, tidak mempunyai rasa.
Penyimpanan : Dalam wadah tertutup baik Kegunaan : Sebagai pelarut
2. Asam klorida ( Dirjen POM, 1979 ; 49 )
Nama resmi : ACIDUM HYDROCHLORIDUM Nama lain : Asam klorida
Rumus molekul : HCl Rumus molekul : 36,46
Pemerian : Cairan tidak berwarna, berasap, bau merangsang, jika diencerkan bau dan asap menghilang.
Penyimpanan : Dalam wadah tertutup rapat. Kegunaan : Sebagai zat tambahan
3. Asam Salisilat ( Dirjen POM, 1979 ; 56 )
Nama resmi : ACIDUM SALICYLICUM Nama lain : asam salisilat
Rumus molekul : C7H6O3
Berat molekul : 138,12
Pemerian : hablur ringan tidak berwarna atau serbuk berwarna putih, rasa agak manis, tajam
Kelarutan : Larut dalam 550 bagian air dan dalam 4 bagian etanol (95%) P. Mudah larut dalam kloroform dan eter.
Berat setara : 1 ml natrium hidroksida 0,5 N setara dengan 69,06 mg C7H6O3
Rumus bangun :
Persyaratan kadar : Mengandung tidak kurang dari 99,5 % C7H6O3 Penyimpanan : dalam wadah tertutup rapat
Kegunaan : sebagai sampel
4. Alkohol ( Dirjen POM, 1979; 65 )
Nama resmi : AETHANOLUM Nama lain : Alkohol
Rumus molekul : C2H6O
Berat molekul : 46,07
Pemerian : Cairan tidak berwarna, jernih, mudah menguap, bau khas, rasa panas
Kelarutan : sangan mudah larut dalam air, dalam kloroform P dan dalam eter P
Penyimpanan : dalam wadah tertutup rapat Kegunaan : sebagai pelarut
5. Fenolftalein ( Dirjen POM, 1979 ; 675) Nama resmi : PHENOLFTALEIN
Nama lain : Fenolftalein Rumus molekul : C20H14O4 Berat molekul : 318,32
Trayek pH : 8,3 sampai 10,0 Rumus bangun :
Pemerian : Serbuk hablur putih, putih atau kekuningan, larut dalam etanol, agak sukar larut dalam eter
Kelarutan : Sukar larut dalam air, larut dalam etanol (95%) P Penyimpanan : Dalam wadah tertutup baik.
Kegunaan : Sebagai larutan indikator.
6. Metil merah ( Dirjen POM, 1979 ; 1124 ) Nama resmi : METHYL RED Nama lain : Metil merah Rumus molekul : C14H14N3NaO3S Berat molekul : 327,33
Pemerian : Serbuk merah gelap atau hablur lembayung Kelarutan : Mudah larut dalam air panas, sukar larut dalam air
dingin, sangat sukar larut dalam etanol
Rumus bangun :
Penyimpanan : Dalam wadah tertutup baik Kegunaan : Sebagai indikator asam basa
7. Natrium hidroksida ( Dirjen POM, 1979 ; 412) Nama resmi : NATRII HYDROXYDUM Nama lain : Natrium hidroksida
Rumus molekul : NaOH Berat molekul : 40,00
Pemerian : Bentuk batang, butiran, massa hablur atau keping, kering, rapuh dan mudah meleleh basah. Sangat alkalis dan korosif. Segera menyerap CO2 Kelarutan : Sangat mudah larut dalam air dan etanol (95%) . Penyimpanan : Dalam wadah tertutup baik
Kegunaan : Sebagai zat tambahan
8. Natrium bikarbonat ( Dirjen POM, 1979 ; 424) Nama resmi : NATRII SUBCARBONAS Nama lain : Natrium bikarbonat
Rumus molekul : NaHCO3 Berat molekul : 84,01
Pemerian : serbuk putih,buram, rasa asin dan tidak berbau Kelarutan : larut dalam 11 bagian air.
Penetapan kadar : larutkan 1 g yang ditimbang seksama dalam 20 ml air. Titrasi dengan asam klorida 0.5 N menggunakan indikator larutan jingga metil P Berat setara : 1 ml asam klorida 0,1 N setara dengan 8,40 mg
NaHCO3
Penyimpanan : Dalam wadah tertutup baik Kegunaan : Sebagai zat tambahan
C. Prosedur Kerja ( Haeria, 2011; 6 ) 1. Pembuatan dan standarisasi larutan
a. Pembuatan larutan HCL 0,1 N
Masukkan kedalam labu terukur tersumbat kaca 1000 ml air suling. Tambahkan sekitar 8,5 ml asam klorida pekat kedalam air suling. Sumbat labu, homogenkan larutan dengan mengguncang dan membalikkan labu. Cukupkan volumenya hinga 1000 ml. Pindahkan ke dalam botol yang bersih, bubuhkan label.
b. Standarisasi larutan HCL 0,1 N dengan Na2CO3
Timbang sekitar 150 mg sampel Na2CO3 murni yang telah di keringkan sebelumnya pada suhu 270o C selama 1 jam. Larutkan dalam 50 ml air suling dan tambahkan 2 tetes merah metil. Titrasi pelan-pelan dengan HCL sambil di kocok teratur sampai timbul merah muda. Panaskan larutan hingga mendidih dan titrasi dilanjutkan
sampai warna merah tidak hilang dengan pemanasan. Perlakuan diulang 2 kali. Hitung normalitasnya.
1 ml HCL 0,1N setara dengan 5,299 mg NA2CO3
c. Pembuatan larutan NaOH 0,1 N
Larutkan 4,5 mg NaOH dalam 950 ml air suling bebas CO2. Tambahkan larutan jenuh BaCl2 yang baru dibuat sampai tidak terbentuk endapan lagi.kocok baik-baik dan biarkan dalam botol tertutup selama 1 malam, enap tuangkan cairan bening dan saring. d. Standarisasi larutan NaOH 0,1 N
Timbang 500 mg Kalium Biftalat yang telah dikeringkan pada suhu 105o C selama 3 jam. Larutkan dalam 15 ml H2O bebas CO2. Tambahkan 2 tetes indikator fenolftalein dan titrasi dengan larutan NaOH hingga terbentuk warna merah tetap. Pelakuan di ulangi 2 kali lagi. Hitung Normalitasnya.
( tiap ml larutan NaOH 0,1 N sama dengan 20,42 mg C8H5KO4 ) 2. Penetapan sampel
a. Penetapan Natrium Bikarbonat
Timbang seksama kurang lebih 300 mg NaHCO3, campur dengan 25 ml air.Tambahkan merah metil dan titrasi dengan Asam Klorida 0,1 N b. Penetapan kadar Asam Salisilat
Timbang 400 mg sampel , larutkan dalam 10 ml etanol netral. Tambahkan 15 ml air suling dan titrasi dengan NaOH 0,1 N menggunakan indikator fenolftalein.
BAB III METODE KERJA A. Alat dan Bahan
Alat yang digunakan antara lain : buret, botol semprot, corong, erlenmeyer, gelas ukur, klem, karet penghisap, pipet volum, statif, sendok tanduk, dan timbangan analitik.
Bahan yang digunakan antara lain : aquadest, asam salisilat,asam klorida, etanol, fenolftalein, metil merah, natrium hidroksida 0,1086 N, natrium bikarbonat.
B. Cara Kerja
1. Pembuatan larutan baku a. Larutan baku HCL 0,1 N
Disiapkan alat dan bahan. Dimasukkan 1000 ml air suling kedalam labu terukur tersumbat kaca. Ditambahkan sekitar 8,5 ml asam klorida pekat kedalam air suling. Disumbat labu, lalu dihomogenkan larutan dengan mengguncang dan membalikkan labu. Dicukupkan volumenya hinga 1000 ml. Dipindahkan ke dalam botol yang bersih. Dibubuhkan label.
b. Larutan baku NaOH 0,1 N
Disiapkan alat dan bahan. Dilarutkan 4,5 mg natrium hidroksida dalam 950 ml air suling bebas CO2. Ditambahkan larutan jenuh barium klorida sampai tidak terbentuk endapan. Dikocok baik-baik dan dibiarkan dalam botol tertutup selama 1 malam, enap tuangkan cairan bening dan saring.
2. Standarisasi larutan baku
a. Standarisasi larutan HCl 0,1 N dengan Na2CO3
Disiapkan alat dan bahan. Ditimbang sekitar 150 mg sampel Natrium Bikarbonat murni yang telah di keringkan sebelumnya pada suhu 270o C selama 1 jam. Dilarutkan dalam 50 ml air suling dan ditambahkan 2 tetes merah metil. Kemudian dititrasi pelan-pelan dengan Asam
Klorida sambil di kocok teratur sampai timbul merah muda. Dipanaskan larutan hingga mendidih dan titrasi dilanjutkan sampai warna merah tidak hilang dengan pemanasan. Perlakuan diulang 2 kali. Dihitung normalitasnya.
1ml HCl 0,1N setara dengan 5,299 mg NA2CO3
b. Standarisasi larutan NaOH 0,1 N
Disiapkan alat dan bahan. Ditimbang 500 mg Kalium Biftalat yang telah dikeringkan pada suhu 105o C selama 3 jam. Dilarutkan dalam 15 ml H2O bebas CO2. Ditambahkan 2 tetes indikator fenolftalein dan dititrasi dengan larutan Natrium Hidroksida hingga terbentuk warna merah tetap. Diulangi perlakuan 2 kali lagi. Dihitung normalitasnya.
Tiap ml larutan NaOH 0,1 N sama dengan 20,42 mg C8H5KO4
3. Pembuatan indikator metil merah dan fenolftalein a. Pembuatan indikator metil merah
Disiapkan alat dan bahan. Dihangatkan 25 mg merah metil P dengan 0,95 ml larutan natrium hidroksida 0,05 N dan 5 ml etanol (95%) P . Setelah larut sempurna, ditambahkan etanol (50%) P secukupnya hingga 250,0 ml
b. Pembuatan indikator fenolftalein
Disiapkan alat dan bahan. Dilarutkan 200 mg fenolftalein P dalam 60 ml etanol ( 90% ) P. Ditambahkan air secukupnya hingga 100,0 ml. 4. Penetapan sampel
a. Penetapan sampel Natrium Bikarbonat ( Asidimetri )
Disiapkan alat dan bahan yang akan digunakan. Ditimbang Natrium Bikarbonat 300 mg diatas neraca analitik. Kemudian dimasukkan kedalam erlenmeyer. Lalu ditambahkan aquadest sebanyak 25 ml. Ditambahkan 2-3 tetes metil merah. Dititrasi dengan Asam Klorida 0,1 N hingga berubah warna menjadi kuning. Dicatat volume titran yang digunakan. Dihitung persen kadar. Diulangi perlakuan 1 kali.
Disiapkan alat dan bahan yang akan digunakan. Ditimbang Asam Salisilat 400 mg diatas neraca analitik. Kemudian dimasukkan kedalam erlenmeyer. Lalu ditambahkan etanol netral 10 ml kocok hingga larut. Ditambahkan 15 ml aquadest. Ditambahkan 2-3 tetes indikator fenolftalein. Dititrasi dengan larutan baku NaOH 0,1 N hingga terjadi perubahan warna dari bening ke merah muda. Dicatat volume titran yang digunakan. Dihitung persen kadar. Diulangi perlakuan 1 kali.
BAB IV
HASIL PENGAMATAN
A. Tabel Pengamatan 1. Asidimetri
No Sampel Berat Sampel Volume Titran
Perubahan Warna 1 Asam salisilat 0,4010 g 32 ml Kuning-merah
muda 2 Asam salisilat 0,4013 g 31,5 ml Kuning–
merah muda
2. Alkalimetri
No Sampel Berat Sampel Volume Titran Perubahan Warna 1 Natrium bikarbonat 0,3045 g 43,0 ml Bening-merahmuda 2 Natrium bikarbonat 0,3039 g 41,5 ml Bening-merahmuda B. Perhitungan 1. Asidimetri
a. Mgrek NaHCO3 Mgrek HCL = N x V = 0,098 N x 43 ml mg = 354,018 mg = 0,3540 g % kadar NaHCO3 = x 100 % = x 100 % = 116,26 % b. Mgrek NaHCO3 Mgrek HCL
= N x V
mg = 341,668 mg = 0,34167 g % kadar NaHCO3 = x 100 % = x 100 % = 112,43 % c. % kadar rata-rata = = 72,43 % 2. Alkalimetri
a. Mgrek Asam salisilat Mgrek NaOH = N x V = 0,1086 N x 32 ml mg = 479,99 mg = 0,479 g % kadar asam salisilat =
x 100 % = x 100 % = 119,45 %
b. Mgrek Asam salisilat Mgrek NaOH = N x V = 0,1086 N x 31,5 ml mg = 472,494 mg = 0,4725 g
c. % kadar asam salisilat =
COOH COOH COOH OH COONa OH = x 100 % = 117,74 % d. % kadar rata-rata = = 178,32 % C. Reaksi 1. Asidimetri a. Reaksi dengan HCL NaHCO3 + HCL NaCL + H2O + CO2 b. Reaksi dengan indikator Metil Merah
( CH3 )2 N N= N + HCL
(NH3)2 N=N + H2O
2. Alkalimetri
a. Reaksi dengan NaOH
+ NaOH + H2O
b. Reaksi dengan indikator
+ 2NaOH + H2O OH OH ONa ONa
BAB V PEMBAHASAN
Asidimetri adalah metode volumetri dan titrimetri yang didasarkan pada pengukuran seksama jumlah volume asam yang digunakan. Baik untuk zat-zat organik maupun untuk zat-zat anorganik. Sedangkan alkalimetri adalah metode titrimetri yang didasarkan pada pengukuran seksama jumlah volume basa yang digunakan. Asidimetri dan alkalimetri adalah proses penentuan banyaknya suatu larutan dengan konsentrasi yang di ketahui dan diperlukan untuk bereaksi secara lengkap dengan jumlah contoh tertentu yang akan dianalisis. Prosedur analisis yang melibatkan pengukuran yang seksama, volume-volume suatu asam dan suatu basa yang tepat saling menetralkan.
Dalam percobaan ini digunakan dua metode yaitu metode asidimetri dan metode alkalimetri. Untuk metode asidimetri mula-mula ditimbang NaHCO3 sebanyak 300 mg. Kemudian dilarutkan dengan 25 ml aquadest . Ditambah 2-3 tetes indikator metil merah dan dititrasi dengan NaOH 0,098 N. Diamati perubahan warnanya hingga tetap dan dicatat volume titrasinya dihitung kadar dan persentase kadarnya. Sedangkan pada metode alkalimetri digunakan 400 mg sampe asam salisilat . kemudian ditambahkan 10 ml etanol netral yang dibuat dengan mencampur etanol dengan indikator fenolftalein hingga warnanya tetap. Lalu ditambah 15 ml H20 dan dititrasi dengan NaOH 0,1086 N hingga larutan berwarna jingga dan dicatat volume titrannya kemudian dihitung kadar dan persentasenya. Diulangi perlakuan satu kali.
Adapun hasil dari percobaan yang telah di peroleh adalah persen kadar rata-rata untuk percobaan asidimetri NaHCO3 ialah 116,26 %. Hal ini tidak sesuai dengan literatur yang menyatakan bahwa % kadar NaHCO3 tidak kurang dari 99% dan tak lebih dari 101,0%. Sedangkan untuk percobaan alkalimetri, persen kadar rata-rata asam salisilat ialah 178,329 % hal ini tidak sesuai dengan literatur yang menyatakan persen kadar asam salisilat tidak kurang dari 99,5 % dan tidak lebih dari 101 %.
Dalam metode asidimetri natrium bikarbonat merupakan dititrasi dengan asam untuk menetralkan garamnya. Karena natrium bikarbonat merupakan garam yang bersifat basa sehingga dalam penetapan kadarnya ditentukan secara asidimetri. Penggunaan indikator metil merah yang merupakan garam natrium dimana dalam larutan baku banyak terionisasi dan dalam lingkungan alkalin ionnya memberikan warna bening sehingga apabila bereaksi dengan HCL sebagai titran akan mengalami perubahan warna dari bening menjadi jingga. Sedangkan pada asam salisilat di gunakan untuk menetralkan asamnya karena sifatnya yang asam maka digunakan metode alkalimetri. Penambahan etanol netral pada alkalimetri di gunakan sebagai pelarut untuk asam salisilat yang tidak larut dalam aquadest. Dan dalam penentuan kadar asam salisilat digunakan indikator PP karena titik akhir akan terbentuk garam yang netral dari asam lemah dan basa kuat. Dimana garam berupa asam salisilat dalam air akan terhidrolisissehingga larutan akan lebih banyak mengandung OH- dan pada pH 7, maka indikator yang digunakan adalah yang mempunyai interval pH 8 – 9,5. Titik akhir titrasi ditandai dengan adanya perubahan warna yang ditandai dengan adanya perubahan warna dari bening ke merah muda.
Larutan basa yang akan diteteskan ( titran ) dimasukkan ke dalam buret dan jumlah yang di pakai diketahui dari tinggi sebelum da sesudah di titrasi . larutan asam yang di titrasi di masukkan ke dalam erlenmeyer dengan mengukur volume terlebih dahulu dengan memakai pipet gondok. Untuk mengamati titik equivalen, dipakai indikator yang warnanyadi sekitar titik equivalen. Titik ekuivalen terjadi pada saat terjadi perubahan indikator. Pada titrasi yang diamati adalah titik akhir bukan titik equivalen.
Adapun alasan menggunaan alat yaitu, untuk buret sebagai media penampung titran( larutan baku) dan mengetahui volume titrasi , bola hisap digunakan untuk menyedot sampel atau pereaksi kedalam suatu pipet volume secara saksama, pipet tetes untuk meneteskan / menambahkan larutan indikator dengan volume yang sedikit dan tidak seksama., erlenmeyer sebagai wadah larutan titer, neraca analitik untuk menimbang berat sampel yang di tentukan, statif dan klem sebagai penegak berdirinya buret.
Pada percobaan alkalimetri digunakan indikator Fenolftalein yang merupakan indikator yang dibuat dengan cara kondensasi anhidrida ftalein (asam ftalat) dengan fenol. Trayek pH 8,2 – 10,0 dengan warna asam yang tidak berwarna dan berwarna merah muda dalam larutan basa. Penggunaan PP dalam titrasi yaitu :
1. Tidak dapat digunakan dalam titrasi asam kuat oleh basa kuat. Karena pada titik equivalen tidak tepat memotong pada bagian curam dari kurva titrasi hal ini disebabkan karena titrasi saling menetralkan sehingga akan berhenti pada pH 7, sedangkan warna berubah pada pH 8
2. Titrasi asam lemah oleh basa kuat karena pada pH 9 untuk konsentrasi 0,1 M
3. Titrasi basa lemah eleh asam kuat,tidak dapat dipakai.
4. Titrasi garam oleh asam lemah oleh asam kuat. Fenolftalein tidak dapat di pakai. Prayek pH tidak sesuai dengan titik equivalen.
Sedangkan pada percobaan asidimetri digunakan indikator metil merah yang merupakan indikator asam basa yang memiliki trayek pH 4,2 – 6,3 dengan warna merah dalam suasana asam dan berwarna kuning dalam suasana basa. Penggunaan metil merah dalam titrasi:
1. Asam kuat dengan basa kuat tidak dapat di pakai karena pada pH 6,3 sudah terjadi perubahan belum mencapai pH 7
2. Asam lemah dengan basa kuat tidak disarankan untuk di pakai karena titik equivalen pada pH 7 sedangkan indikator berubah pada pH 9
3. Basa kuat dan asam kuat. Tidak disarankan untuk dipakai karena titik equivalen pada pH 7 sedangkan indikator baru berubah pada pH 6,3. 4. Garam asam lemah dan asam kuat. Tidak baik karena sebelum pada pH 5
indikator sudah berubah warnanya
Penggunaan NaOH pada metode alkalimetri karena merupakan metode titrimetri dan volumetri yang didasarkan pada pengukuran seksama jumlah volume basa ( NaOH ) begitupun sebaliknya asidimetri merupakan metode titrimetri berdasarkan pengukuran seksama jumlah volume asam (HCL) sebagai larutan baku. NaOH dan HCL juga merupakan basa kuat dan asam kuat.
Adapun faktor-faktor yang mempengaruhi sehingga hasil yang didapatkan tidak sesuai dengan literatur ialah kurang telitinya praktikan melihat volume titran dan menimbang bahan, bahan yang tdak steril dan kurang teliti pada saat mengamati perubahan warna pada saat mentitrasi larutan.
Dan adapun hubungan antara titrasi asam basa dalam dunia farmasi yaitu sebagian sediaan obat dapat bersifat asam atau basa sehingaa metode ini sangat penting sehingga dapat disesuaikan dengan metabolisme obat di dalam tubuh, dan untuk menentukan konsentrasi atau kadar dari suatu sedian obat yang akan di buat.
BAB VI PENUTUP A. Kesimpulan
Berdasarkan percobaan yang telah dilakukan dapat disimpulkan bahwa: 1. Kadar NaHCO3 pada metode asidimetri yaitu 116,26 %, hal ini tidak
sesuai dengan literatur yang menyatakan % kadar dari NaCO3 tidak kurang dari 99,0 % dan tidak lebih dari101,0 %
2. Kadar asam salisilat dari metode alkalimetri yaitu 178,75 %, hal ini berbeda dengan farmakopeyang menyatakan % kadar asam salisilat tidak kurang dari 99,5 % dan tidak lebih dari 101,0 %.
B. Saran
1. Untuk laboratorium
Alat dan bahan sebaiknya dilengkapi dan jumlah di perbnyak agar praktikum dapat berjalan dengan baik
2. Untuk asisten
Pertahankan keakraban dan keramahan terhadap praktikan . Tetap semangat.
DAFTAR PUSTAKA
Atkins,Peter and Lorette. Chemistry Molekul and Changes. New York; Freeman and Company. 1997
Brady,James. Kimia Universitas Asas Dan Struktur. Jakarta ; Binarupa Aksara. 1999
Dirjen POM. Farmakope Indonesia, Edisi Ke-III. Jakarta : Departemen Kesehatan RI. 1979
Day,R.A dan A.L.Underwood. Analisis Kimia Kuantitatif. Jakarta; Erlangga. 2002
Haeria. Penuntun Kimia Analitik. Makassar ; UIN Press. 2011
Keenan,C.W. Kimia Untuk Universitas. Jakarta; Erlangga. 1998
Khopkar, S.M., (1990), Konsep Dasar Kimia Analitik.Jakarta: UI press.
Petrucci, Ralph. and Wilias.S. Harwood. General Chemistry. New Jersey; Prentice Hall.1997
Sukri.Kimia Dasar 2. Bandung; ITB. 1999
Susanti, S dan Yeanny Wunas. Analisis Kimia Farmasi Kuantitatif. Makassar : LEMBAGA PENERBITAN UNHAS.1995
Snyder, Milton.K. Chemistry Structure and Reaction. New York; Holt.1996
Sunarya, Yayan. Mudah dan Aktif Belajar Kimia. Bandung; Invers.2007
Timberlake,Keren.C. General, Organik and Biological Chemistry. San Fransisco; Pearson Benjamin Cummings. 2004
SKEMA KERJA A. Metode Asidimetri 300 mg NaHCO3 Erlenmeyer + H2O 25 ml
+ 2-3 tetes metil merah
HCL 0,1 N
Titrasi hingga warna berubah dari merah ke bening
Catat volume titrasi
Hitung % kadar
B. Alkalimetri 400 mg Asam Salisilat Erlenmeyer + etanol netral + 15 ml aquadest
+ 2-3 tetes indikator Fenolftalein
Titrasi dengan NaOH 0,1 N hingga warna berubah menjadi pink
Catat volume titrasi
Hitung % kadar