UNDANG-UNDANG DASAR
NEGARA REPUBLIK INDONESIA
TAHUN 1945
PEMBUKAAN
(Preambule)
Bahwa sesungguhnya kemerdekaan itu ialah hak segala bangsa dan oleh sebab itu maka penjajahan di atas dunia harus di hapuskan karena tidak sesuai dengan peri kemanusiaan dan peri keadilan.
Dan perjuangan kemerdekaan Indonesia telah sampailah kepada saat yang berbahagia dengan selamat sentosa menghantarkan rakyat Indonesia ke depan pintu gerbang kemerdekaan Indonesia,yang merdeka bersuatu berdaulat adil dan makmur.
Atas berkat rhmat allah yang maha kuasa an dengan di dorongkan oleh keinginan luhur supaya kehodupan kebangsaan yang bebas ,maka rakyat Indonesia dengan ini menyatakan kemerdekaannya.
Kemudian dari pada itu untuk membentuk suatu pemerintahan Negara Indonesia yang melindungi segenap bangsa Indonesia dan seluruh tumpah darah Indonesia dan untuk memajukan kesejahteraan umum ,mencerdaskan kehidupan bangsa dan ikut melaksanakan ketertiban dunia yang berdasarkan kemerdekaan,perdamaian abadi dan keadaan sosial,maka disusunlah kemerdekaan kebangsaan Indonesia itu dalam suatu susunan Negara Republik Indonesia yang berkedaulatan rakyat dangan berdasarkan kepada Ketuhanan yang Maha Esa,Kemanusian yang adil dan beradap,Persatuan Indonesia dan Kerakyatan yang dipimpin oleh hikmat Kebijaksanaan dalam permusyawaratan/perwakilan,serta dengan mewujudkan suatu keadilan sosial bagi seluruh rakyat Indonesia.
1. BENTUK MOLEKUL
1. Bentuk Molekul Berdasarkan Teori VSEPR
Teori VSEPR adalah teori yang menggambarkan bentuk molekul berdasarkan kepada tolakan
pasangan electron disekitar atom pusat. Teori talakan pasangan electron ini dikenal dengan
istilah VSEPR (Valence Shell Electron Pair of Repulsion).Bentuk molekul didasarkan kepada jumlah electron yang saling tolak-menolak disekitar atom pusat yang akan menempati tempat sejauh munkin untuk meminimumkan tolak electron.Kelompok pasangan elektron dapat berupa ikatan tunggal, ikatan rangkap
dua, dan ikatan rangkap tiga. Perhatikan Gambar
Gambar Pasangan elektron di sekeliling atom pusat
Di dalam klasifikasi VSEPR ada beberapa huruf yang melambangkan atom pusat, atom yang mengelilingi atom pusat, dan pasangan elektron bebas, yaitu: A = atom pusat
X = atom yang mengelilingi atom pusat E = pasangan elektron bebas
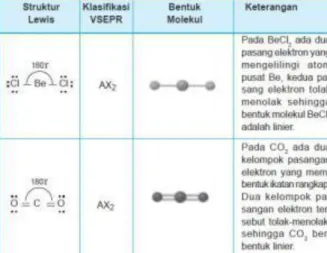
Berbagai bentuk molekul berdasarkan teori tolakan pasangan electron dijelaskan sebagai berikut. 1. Bentuk Molekul dengan Dua Pasangan Elektron di
Sekitar Atom Pusat
Dua pasangan elektron yang berada di sekitar atom pusat akan tolak-menolak membentuk susunan elektron yang linier.
Catatan:
Pasangan elektron bebas pada Cl dan O tidak mempengaruhi bentuk molekul, karena hanya pasangan elektron yang mengelilingi atom pusat saja yang terlibat dalam pembentukan molekul
2. Bentuk Molekul dengan Tiga Pasangan Elektron di Sekitar Atom Pusat
Tabel Contoh bentuk molekul dengan tiga pasangan elektron di sekitar atom pusat
Molekul atau ion yang memiliki 3 pasang elektron di sekitar atom pusat baik pasangan yang membentuk ikatan tunggal atau rangkap membentuk segitiga planar 3. Bentuk Molekul dengan Empat Pasangan Elektron di
Sekitar Atom Pusat
Tabel Contoh bentuk molekul dengan empat pasangan elektron di sekitar atom pusat
semua molekul atau ion yang memiliki empat pasangan elektron di sekitar atom pusatnya akan membentuk struktur ruang elektron tetrahedral.
Catatan:
Jika ada 4 kelompok elektron yang mengelilingi atom pusat, maka gaya tolak: PEB – PEB > PEI – PEB > PEI – PEI.
Bentuk Molekul dengan Lima Pasangan Elektron di Sekitar Atom Pusat
Semua molekul atau ion yang atom pusatnya dikelilingi lima atau enam
pasangan elektron biasanya atom pusat tersebut berasal dari unsur periode ke-3 atau lebih dari 3.
Bentuk-bentuk molekul dengan 5 pasangan elektron yang terdiri dari PEB dan PEI yang berbeda dapat dilihat pada Tabel
Jika lima pasangan elektron mengelilingi atom pusat maka akan membentuk struktur ruang elektron bipiramidal trigonal.
5. Bentuk Molekul dengan Enam Pasangan Elektron di Sekitar Atom Pusat
Enam pasangan elektron yang mengelilingi atom pusat akan membentuk struktur ruang elektron oktahedral.
Bentuk-bentuk molekul yang terjadi dari 6 pasangan elektron yang terdiri dari PEI dan PEB yang berbeda dapat dilihat pada Tabel
Bentuk molekul dapat diramalkan dengan teori jumlah pasangan elektron di sekitar atom pusat dan VSEPR. Langkah-langkahnya:
1. Menentukan struktur Lewis dari rumus molekul.
2. Menentukan jumlah pasangan elektron di sekeliling atom pusat, pasangan elektron ikatan, dan pasangan elektron bebas.
3. Memprediksi sudut-sudut ikatan yang mungkin berdasarkan jumlah kelompok elektron dan arah-arah yang mungkin akibat tolakan pasangan elektron bebas. 4. Menggambarkan dan memberi nama bentuk molekul berdasarkan jumlah PEI dan PEB.
Langkah-langkah tersebut diilustrasikan sebagai berikut
B. Bentuk Molekul Berdasarkan Teori Hibridisasi
Teori jumlah pasangan elektron di sekitar atom pusat dapat menjelaskan
berbagai bentuk-bentuk molekul sesuai dengan eksperimen. Ada lagi teori yang dapat menjelaskan bentuk molekul yaitu berdasarkan bentuk orbital kulit terluarnya
Pada pembentukan molekul ini terjadi penggabungan beberapa orbital suatu atommembentuk orbital baru yang tingkat energinya sama atau orbital hibrid. Prosesini dikenal dengan istilah hibridisasi
1. Bentuk Molekul BeF2
Konfigurasi elekron atom 4Be: 1s2 2s2. Atom Be mempunyai dua elektron pada orbital 2s. Agar terdapat dua elektron yang tidak berpasangan untuk mengikat
dua atom F maka satu elektron dari 2s pindah ke 2p atau tereksitasi. Orbital s danp tersebut mengalami hibridisasi membentuk orbital hibrid sp yang berbentuk linierKonfigurasi elektron
terluar Be :
Konfigurasi elektron Be terhibridisasi : Konfigurasi elektron Be pada BeF2 :
Dua elektron tidak berpasangan pada orbital ini akan menerima elektron dari
F membentuk ikatan kovalen sehingga BeF2 berbentuk linier.
Bentuk Orbital
Bentuk orbital ditentukan oleh subkulit dari elektron atau ditentukan bilangan kuantum azimutnya. Jadi, apabila suatu elektron memiliki bilangan kuantum azimut sama, maka bentuk orbitalnya juga sama, sehingga yang membedakan hanyalah tingkat energinya. Dengan memahami uraian berikut, akan diketahui bentuk orbital s, p, d, dan f.
a. Orbital s
Orbital yang paling sederhana adalah orbital s. Setiap subkulit s terdiri atas 1 buah orbital yang berisi 2 elektron. Orbital s berbentuk bola simetri yang menunjukkan bahwa electron memiliki kerapatan yang sama, jika jarak dari inti atom juga sama. Semakin jauh letak elektron dari inti atom, kerapatannya semakin rendah. Nilai bilangan kuantum utama suatu orbital memengaruhi ukuran orbital. Semakin besar nilai bilangan kuantum utama, ukuran orbitalnya juga semakin besar.
b. Orbital p
Bentuk orbital p seperti balon terpilin. Kepadatan elektron tidak tersebar merata, melainkan terkonsentrasi dalam dua daerah yang terbagi sama besar dan terletak pada dua sisi berhadapan dari inti yang terletak di tengah.
Subkulit p terdiri atas 3 orbital, tiap orbital mempunyai bentuk yang sama. Perbedaan ketiga orbital terletak pada arah, di mana terkonsentrasinya kepadatan elektron. Biasanya orbital p digambarkan menggunakan satu kumpulan sumbu x, y, dan z, sehingga diberi tanda px, py dan pz.
c. Orbital d dan f
Setiap subkulit d terdiri atas 5 orbital dengan bentuk kelima orbital yang tidak sama. Orientasi
orbital d dilambangkan dengan dxy, dxz, dyz, dx2-y2 dan dz2.
Empat orbital mempunyai bentuk yang sama dan setiap orbital mempunyai 4 “lobe” kepadatan elektron. Adapun perbedaannya terletak pada arah berkumpulnya kepadatan elektron. Sementara itu, satu orbital lagi mempunyai bentuk berbeda, tetapi memiliki energi yang sama dengan keempat orbital d lainnya.
Orbital f mempunyai bentuk orbital yang lebih rumit dan lebih kompleks daripada orbital d.
Setiap subkulit f mempunyai 7 orbital dengan energi yang setara. Orbital ini hanya digunakan untuk unsur-unsur transisi yang letaknya lebih dalam.
Jenis – jenis baterai
Posted by Ed Us ⋅ February 15, 2012 ⋅ Leave a Comment
Filed Under baterai, kelas XI, materi
1. Alkaline
Adalah jenis batere yang paling umum ditemukan. Batere yang harganya murah dan dayanya habis dalam sekali pakai ini bisa mendayai Game Boy Anda selama 20 menit (atau 2,5 menit pada Sega Nomad).
Kerapatan energi, jumlah daya yang dikandung batere Alkaline tidak buruk, tetapi pada gadget yang haus energi seperti MP3 player atau kamera digital, daya batere ini cepat terkuras habis. Namun untuk gadget yang tidak tinggi tuntutan dayanya, batere Alkaline bisa bertahan lama, bahkan bisa bertahun-tahun. Sayangnya batere ini tidak bisa diisi ulang.
2. Silver oxide atau batere silver-zinc
menyediakan cukup banyak daya dan tahan lama. Batere tipe ini dipakai dalam jam tangan dan juga mainan anak-anak, maupun di torpedo dan kapal selam, atau perangkat lain yang
mementingkan kinerja, bukan harga.
Kelemahannya, perak yang digunakannya mahal jika ukuran batere lebih besar daripada kancing yang dipakai pada gadget. Selain itu, di akhir masa pakainya batere ini seringkali bocor dan lelehan merkuri-nya berbahaya.
3. Batere Lead-acid
terdiri dari dua tipe besar: batere pemicu seperti yang ada di mobil Anda dan dirancang untuk lonjakan daya singkat; dan batere bersiklus panjang yang memberikan daya yang lebih rendah, lebih ajek dan digunakan di kapal, mobil golf, dan sebagai daya cadangan di berbagai gadget.
4. Batere Alkaline Isi Ulang (rechargeable):
Mirip batere Alkaline biasa, tetapi dibuat agar bisa diisi ulang – artinya membuat elektron-elektron dipompa masuk kembali ke dalam batere. Tidak sepeti batere Nickel metal hydride, batere ini tidak habis dayanya bila tidak dipakai, tetapi kapasitasnya berkurang setiap kali diisi ulang dan tidak setinggi batere Alkaline biasa.
5. Nickel Cadmium, alias NiCad,
Baterai ini merupakan jenis tertua, paling tahan banting, namun berat dan volumenya paling besar. Baterai jenis ini sudah tidak lagi banyak digunakan pada gadget karena dianggap tidak praktis. Baterai NiCad sangat rentan efek memori. Maksudnya, baterai hanya mengisi ke tingkat dimana baterai terakhir di-discharge, akibat proses akumulasi gas yang terperangkap dalam plat sel baterai. Jika baterai di-discharge hingga 30 persen dan di recharge, maka baterai hanya akan mengisi energi yang terpakai tadi (30 persen) yang dilanjutkan dengan penyusutan volume “gas” yang terperangkap. Cara terbaik untuk menghilangkan efek memori dan membuang sisa gas terperangkap adalah dengan melakukan “burping”, atau mengkondisikannya. Maksudnya, menghabiskan seluruh isi baterai pada gadget hingga benar-benar kamerea mati dan melakukan
re-charging. Selain itu kendati tidak dipakai, batere akan kehabisan seluruh dayanya setelah sekitar 90 hari
6. Nickel metal hydride, alias NiMH,
menggantikan kadmium dalam NiCad dengan campuran yang membuatnya mampu menahan lebih banyak energi (40%) pada ruang yang sama dibandingkan NiCad. NiMH merupakan pengembangan dari NiCd, dibanding NiCd dengan volume sama, kapasitasnya jauh lebih besar. Namun, seperti halnya NiCd, NiMH juga rawan terhadap memory effect meski tidak sebesar NiCd. Beberapa produsen baterai bahkan menyatakan NiMH produknya bebas memory effect. Seperti Sanyo eneloop, daya yang ada perlahan-lahan akan habis walaupun batere tidak
dipakai.Fenomena ini muncul saat baterai yang belum habis dipakai sudah di-charge ulang. Bila dilakukan berkali-kali baterai dapat kehilangan kapasitasnya dan hanya mampu menampung sedikit daya saja sebelum dengan cepat habis. Memory effect dapat dihilangkan dengan mengosongkan baterai sampai habis sebelum mengisi ulang.
Setiap 10-15 kali siklus isi ulang baterai NiMH, kosongkanlah baterai hingga habis sama sekali sebelum mengisi ulang. Hal ini dilakukan untuk menghilangkan “bibit-bibit” memory effect yang mungkin timbul.
Jangan sekali-kali mengosongkan baterai dengan bola lampu dan kabel hingga lampu mati. Ini akan dapat merusak sel baterai yang paling lemah (reversal effect), dan pada gilirannya merusak semua sel. Sisakan setidaknya 1V per sel baterai, pantaulah terus-menerus karena voltase baterai akan turun dengan tiba-tiba. Bila Anda tidak memiliki alat untuk itu, lebih baik jangan lakukan. Mengosongkan dengan gadget adalah cara terbaik, karena ambang batas aman pasti tidak kelebihan.
Beberapa produsen baterai NiMH menyatakan bahwa baterainya bisa di recharge lebih dari 500 kali, namun bila baterai NiMH telah mencapai 400 kali siklus isi ulang, perlu dipersiapkan untuk penggantian baterai tersebut, karena walaupun masih bisa digunakan, biasanya kapasitasnya sudah menurun dan berarti masa pakai sebelum diisi ulang sudah berkurang.. Baterai Li-ion dapat rusak dengan mendadak jika rangkaian di dalamnya rusak.
Untuk membuang baterai yang sudah tidak digunakan, sebaiknya berhati-hati karena kandungan kadmiumnya bisa mencemari tanah
7. Lithium ion alias Li-ion
menjadi batere standar pada gadget masa kini. Dibandingkan batere dengan bahan nikel, Li-Ion lebih efisien energi dan tidak memiliki efek memori, tetapi juga lebih mahal harganya. Namun batere tipe ini tidak boleh dibuang sembarangan karena bisa meledak (walaupun hanya terjadi beberapa kali per satu juta batere). Dibandingkan NiMH, siklus isi ulang batere Li-ion lebih pendek setengahnya ( 1000 vs. 500 kali).
Ada kelemahan lain. Jika daya batere benar-benar habis dan voltase-nya turun di bawah ambang tertentu, kapasitas energi batere Li-ion akan menciut secara permanen. Karena itulah batere dirancang untuk mati jika dipasang setelah waktu tertentu. Biasanya, jika Anda punya gadget dengan batere bertipe isi ulang, tipe Li-Ion-lah yang dipakai. Jika tidak, mungkin baterenya berjenis Li-Poly.
8. Lithium ion poly atau lithium poly atau li-poly (Li-Po),
berasal dari lithium ion tetapi menggunakan elektrolit berbasis polimer gel. Karena itu namanya menjadi lithium ion poly. Batere tipe ini lebih bandel (tidak mudah meledak) dibandingkan Li-ion standar, lebih ringan dan bisa dibentuk sesuka hati. Anda akan semakin sering menjumpainya sebagai pengganti lithium-ion di laptop dan gadget lain. Kelemahannya, batere ini lebih cepat habis dibandingkan Li-ion biasa.
9. Lithium iron phosphate (Li-Fe)
merupakan perkembangan dari lithium ion yang menggantikan campuran oksida kobalt dalam li-ion. Tipe ini lebih kecil kemungkinannya meledak dan dapat melepaskan kapasitas dan terisi ulang sangat cepat. Namun sampai saat ini lithium iron phosphate masih mahal dan rumit pembuatannya. Mau tahu di mana batere ini ada? Antara lain di laptop OLPC XO dan mobil hibrida.