10
Model Matematika Mekanisme Laju Korosi Logam Baja Karbon
dengan Penambahan Inhibitor
Deana Wahyuningrum1),Nuning Nuraini2) danNovriana Sumarti2)
1)
Program Studi Kimia, KK Kimia Organik
2)
Program Studi Matematika, KK Matematika Industri dan Keuangan Fakultas Matematika dan Ilmu Pengetahuan Alam,
Institut Teknologi Bandung, Bandung e-mail: deana@chem.itb.ac.id
Diterima 1 April 2011, disetujui untuk dipublikasikan 20 April 2012 Abstrak
Korosi pada logam, yang disebabkan reaksi dengan lingkungannya, merupakan proses pelarutan logam membentuk senyawanya dalam lingkungan korosif seperti adanya air, gas oksigen dan karbondioksida. Korosi tidak dapat dihilangkan, namun dapat dikendalikan atau dicegah. Salah satu cara untuk mengatasi korosi, terutama yang terjadi pada permukaan bagian dalam suatu pipa logam, adalah dengan penambahan suatu inhibitor korosi. Dengan melihat proses terjadinya korosi dari sudut pandang berkurangnya logam persatuan waktu, diturunkanlah suatu model matematika yang memperlihatkan pengaruh senyawa inhibitor korosi terhadap logam, khususnya baja karbon dalam larutan NaCl 1%. Model yang diperoleh, yang merupakan pengembangan dari model sebelumnya, menggambarkan penambahan senyawa inhibitor dengan 2 cara, yaitu pada saat awal saja dan cara penambahan secara kontinu. Hasil yang didapat menunjukkan beberapa nilai konsentrasi dari inhibitor memberikan pengaruh pada mekanisme laju korosi secara efisien untuk menghentikan proses korosi.
Kata kunci: Baja karbon, Inhibitor korosi, Laju korosi, Model matematika.
Mathematical Model of Corrosion Rate Mechanism of Carbon Steel
by Inhibitor Addition
Abstract
Corrosion on metal, due to interaction with its environment, is the dissolution process of metal in which metallic atoms are oxidized to form its compound, in the presence of water and gases, such as oxygen and carbon dioxide. Even though this corrosion cannot be eliminated, it can be controlled or prevented. One way to control corrosion, especially corrosion that occurred at the inner parts of metallic pipelines, is by addition of corrosion inhibitor. If the corrosion process was assumed as the rate of decaying process of metal per times unit, then the mathematic model can be derived to describe the effect of addition of inhibitor towards corrosion rate of metal, especially carbon steel in 1% NaCl solution. The result show that several concentrations of inhibitor provide the efficient effect on the corrosion rate mechanism to stop the corrosion process.
Keywords: Carbon steel, Corrosion inhibitor, Corrosion rate, Mathematical model.
1. Pendahuluan
Korosi merupakan interaksi fisikokimia antara logam dengan lingkungan yang menyebabkan perubahan sifat logam, selanjutnya akan mengakibatkan kerusakan pada logam, lingkungan, atau bagian sistem yang terkait (ISO 8044-1986) (Jones, 1992; Kuznetsov, 2002). Korosi merupakan reaksi irreversibel antara permukaan bahan (logam, keramik, dan polimer) dengan lingkungan, yang mengakibatkan terlarutnya bahan (logam, keramik, dan polimer) dalam komponen lingkungan (IUPAC) (Perez, 2004). Korosi merupakan salah satu masalah pelik dalam pengolahan, produksi, dan distribusi minyak dan gas bumi di seluruh dunia, yang secara ekonomi maupun dampak lingkungannya merugikan. Sistem perpipaan yang digunakan di pertambangan minyak dan gas bumi merupakan sistem transportasi
produk minyak dan gas bumi yang biaya operasionalnya lebih murah dan efisien dibandingkan dengan sistem transportasi lain, namun rentan korosi karena biasanya bahannya terbuat dari komponen logam. Korosi pipa logam dapat dianggap terjadi pada beberapa kondisi, di antaranya: (1) reaksi spontan, (2) lingkungan yang korosif, seperti elektrolit cair dengan pH cukup rendah yang dapat mengkorosi baja, dan (3) kontak elektronik, seperti persambungan dua logam (Hong dan Jepson, 2001; Cruz dkk., 2005). Kerugian yang pernah muncul akibat korosi diantaranya adalah adanya efek samping terhadap lingkungan dikarenakan kurang optimalnya pengontrolan korosi. Biaya untuk mengatasi masalah korosi setiap tahunnya tidaklah sedikit, misalnya di Amerika dan Cina bisa mencapai 1,4 % dari GDP (Gross Domestic Production)
(Veawab dkk., 1997; Zhao dkk., 2004), sedangkan di Indonesia diperkirakan mencapai 1 - 1,5 % dari PDB (Produksi Domestik Brutto) atau mencapai angka triliun rupiah (Supardi 2002). Oleh karena itu, kajian mengenai penanggulangan korosi telah banyak menarik perhatian berbagai kalangan dan telah dimulai sejak tahun 1940-an. Korosi yang terjadi pada bagian dalam pipa tidak dapat diatasi dengan dengan cara pengecatan, perlindungan katoda maupun pelepasan anoda, sehingga untuk mengatasinya digunakan senyawa inhibitor korosi (Kadirgan dan Suzer, 2001; Stupnisek-Lisac dkk., 2002; Kalman dkk., 2004).
Inhibitor korosi adalah zat kimia, baik senyawa anorganik maupun organik, yang bereaksi dengan permukaan logam, atau dengan lingkungan tempat permukaan logam berinteraksi, dan kemudian memberikan perlindungan yang cukup pada permukaan logam terhadap proses korosi (Bentiss dkk., 2004; Lopez dkk., 2004). Dalam perkembangannya, penelitian korosi diarahkan pada penggunaan senyawa organik sebagai inhibitor korosi, karena murah, lebih ramah lingkungan, dan daya inhibisi korosinya lebih efektif daripada senyawa anorganik (Srhiri dkk., 1996; Heeg dkk., 1998; Rajendran dkk., 2001; Stupnisek-Lisac dkk., 2002). Di antara senyawa inhibitor korosi yang potensial adalah senyawa turunan imidazol yang telah diuji efisiensi inhibisinya di laboratorium, bahkan beberapa di antaranya ada yang sudah diaplikasikan di lapangan (Stupnisek-Lisac dkk., 2002; Migahed dkk., 2003; Zhao dkk., 2004). Dalam beberapa kasus, data hasil uji korosi yang dilakukan di laboratorium belum cukup untuk menunjukkan bahwa senyawa turunan imidazol merupakan inhibitor korosi yang layak pakai di lapangan, karena beberapa hasil uji daya inhibisi korosi di lapangan menunjukkan adanya perbedaan dengan data hasil uji di laboratorium. Hal ini disebabkan oleh banyaknya parameter di lapangan yang disederhanakan pada saat percobaan di laboratorium. Berdasarkan hal-hal tersebut di atas, maka perlu dirumuskan suatu model matematika yang dapat menggambarkan proses terjadinya korosi pada logam untuk membantu memahami mekanisme korosi yang terjadi pada permukaan bagian dalam pipa, khususnya pipa dari besi/baja karbon. Dengan menerapkan Teori Keadaan Peralihan dan menggunakan persamaan Michaelis-Menten (yang biasanya digunakan untuk menggambarkan proses katalisis oleh enzim) (Jirstrand dkk., 2004) untuk mendefinisikan laju reaksi yang terjadi, diharapkan dapat menjawab permasalahan korosi, yakni dengan cara menurunkan suatu persamaan dinamis yang meninjau hubungan antara penambahan inhibitor korosi dengan laju korosi.
2. Eksperimental
2.1 Sintesis dan uji Inhibisi korosi senyawa turunan imidazol
Senyawa turunan imidazol yang dipilih untuk disintesis dan diuji daya inhibisi korosinya pada baja karbon dalam larutan NaCl 1% menggunakan metode ekstrapolasi Tafel dan weight loss adalah senyawa turunan 4,5-difenil-1-vinilimidazol, imidazolin rantai panjang (imidazolin oleat dan stearat) dan turunan benzimidazol, sebagaimana ditunjukkan pada Gambar 1. Senyawa-senyawa tersebut adalah: 2-heksil-4,5-difenil-1-vinil-1H-imidazol (1), 2,4,5-trifenil-1-vinil-1H-imidazol (2), 2-(4-metoksifenil)-4,5-difenil-1-vinil-1H-imidazol (3) (Wahyuningrum dkk., 2008a); ((Z)-2-(2-(heptadek-8-enil)-4,5-dihidroimidazol-1-il)etanamina) (4) dan (2-(2-heptadesil-4,5-dihidroimidazol-1-il)etanamina) (5) (Wahyuningrum dkk., 2008b); disebut sebagai senyawa benzimidazol (6), 1-benzil-2-fenil-1H-1,3-benzimidazol (7), dan 2-fenil-1H-1,3-1-benzil-2-fenil-1H-1,3-benzimidazol (8) (Wahyuningrum dkk., 2008a).
Gambar 1. Senyawa turunan imidazol yang dipilih
untuk dijadikan model penentuan mekanisme inhibisi korosi pada baja karbon dalam larutan NaCl 1%.
Alasan pemilihan senyawa-senyawa tersebut untuk dijadikan acuan dalam pembuatan model matematika pada mekanisme inhibisi korosi pada baja karbon dalam larutan NaCl 1% adalah karena senyawa-senyawa tersebut mewakili kelompok senyawa imidazol, imidazolin dan benzimidazol yang lazim diujikan sebagai inhibitor korosi pada baja karbon. Dengan demikian diharapkan model yang dihasilkan akan dapat mewakili ketiga kelompok senyawa tersebut secara umum dan dapat bersesuaian dengan hasil percobaan, karena pembuatan model ini didasarkan pada hasil percobaan.
2.2 Penentuan daya inhibisi korosi
Penentuan daya inhibisi korosi dilakukan dengan dua metode yaitu metode Tafel dan metode
weight loss. Metode Tafel diuraikan sebagai berikut:
setelah diperoleh produk sintesis murni, sekitar 2 mg sampel masing-masing senyawa dilarutkan dalam 250 mL larutan NaCl 1% (w/v) menggunakan labu takar 250 mL. Setiap larutan sampel diukur menggunakan alat VoltaLab® di laboratorium korosi, Laboratorium Kimia Fisik Material, Program Studi Kimia, ITB. Tiga buah elektroda, yaitu elektroda kerja (baja karbon), elektroda pembanding (kalomel), dan elektroda bantu (Pt), dicelupkan ke dalam larutan
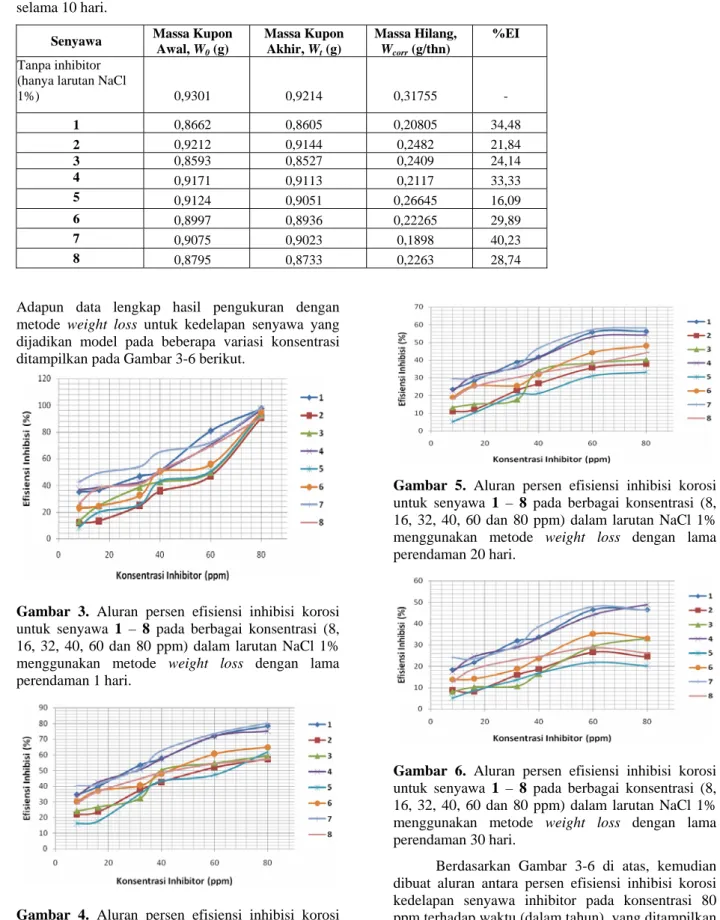
sampel. Setiap pengukuran diawali dengan pengukuran larutan blanko, yaitu larutan NaCl 1% (w/v) tanpa adanya senyawa inhibitor korosi. Dalam metode Tafel, grafik yang diperoleh merupakan aluran atau plot antara logaritma arus (log icor) dalam satuan mA/cm2 dengan potensial (Ecor) dalam satuan milivolt (mV). Penentuan daya inhibisi korosi dengan metode weight loss adalah sebagai berikut: kupon baja karbon dengan ukuran panjang 2 cm, lebar 1 cm, dan ketebalan 0,075 cm dengan komposisi (%w): 0,23% Mn, 0,06% C, 0,05% Al, dan 99,56% Fe direndam dalam 50 mL larutan NaCl 1% yang tanpa dan dengan inhibitor bervariasi konsentrasi selama 10, 20 dan 30 hari pada 27oC. Efisiensi inhibisi korosi dihitung dari selisih hilangnya bobot kupon baja karbon dalam larutan tanpa dan dengan inhibitor.
Tabel 1 dan 2 menampilkan perwakilan sebagian data inhibisi korosi senyawa-senyawa yang telah disintesis (senyawa 1 – 8) berdasarkan metode Tafel dan metode weight loss. Secara umum data lainnya ditampilkan dalam format grafik untuk lebih jelas melihat kecenderungan pola perilaku masing-masing senyawa sebagai inhibitor korosi terhadap baja karbon dalam larutan NaCl 1% berdasarkan metode Tafel (Gambar 2) maupun weight loss (Gambar 3-5). Data-data yang telah terhimpun lengkap kemudian dijadikan acuan untuk membangun model matematika yang bersesuaian dengan data tersebut.
Tabel 1. Data daya inhibisi korosi senyawa turunan
imidazol dan imidazolin terhadap logam baja karbon menggunakan metode Tafel pada konsentrasi 8 ppm dalam larutan elektrolit NaCl 1% pada suhu 27 oC.
Senyawa icor NaCl 1%
(mA/cm2) icor Sampel (mA/cm2) Efisiensi Inhibisi Korosi (%) 1 0,1298 0,0867 33,20 2 0,1298 0,1058 18,49 3 0,1262 0,0969 23,22 4 0,1768 0,1199 32,18 5 0,1768 0,1543 12,73 6 0,1309 0,0955 27,04 7 0,1309 0,0807 38,35 8 0,1235 0,0918 25,67
Besarnya % efisiensi inhibisi ditentukan menggunakan persamaan berikut (Kuznetsov, 2002; Wahyuningrum dkk., 2008a):
Efisiensi Inhibisi (% EI)
( - )
= 100 x cor tak -terinhibisi cor terinhibisi
cor tak -terinhibisi
i i
i
(1)
dengan icor tak-terinhibisi = laju korosi sistem tak terinhibisi = icor, kerapatan arus korosi dalam sistem tak terinhibisi (larutan blanko) (dalam mA/cm2); dan
icor terinhibisi
= laju korosi sistem terinhibisi = icor, kerapatan arus korosi dalam sistem terinhibisi (yang mengandung inhibitor) (dalam mA/cm2).Adapun data lengkap hasil pengukuran dengan metode Tafel untuk kedelapan senyawa yang dijadikan model pada beberapa variasi konsentrasi ditampilkan pada Gambar 2 berikut.
Gambar 2. Aluran persen efisiensi inhibisi korosi
untuk senyawa 1 – 8 pada berbagai konsentrasi (8, 16, 32, 40, 60 dan 80 ppm) dalam larutan NaCl 1% menggunakan metode Tafel.
Sedangkan hasil-hasil data inhibisi korosi senyawa 1 – 8 berdasarkan metode weight loss ditampilkan pada Tabel 2. Metode weight loss merupakan metode yang paling umum digunakan dalam menentukan laju korosi, yaitu menentukan perubahan berat suatu logam sebelum dan sesudah terjadi korosi lalu dikonversikan ke suatu persamaan untuk menghitung laju korosinya dan dapat dihitung menggunakan persamaan berikut (Rafiquee dkk., 2008):
0
hari dalam 1 tahun ( / )
hari percobaan
corr t
W g th W W x
(2)dengan Wcorr adalah perubahan berat sebelum dan sesudah terjadi korosi (g/th) setelah dilakukan percobaan. Efisiensi inhibisi korosi dari data metode pengurangan berat dapat ditentukan menggunakan persamaan berikut:
Efisiensi Inhibisi (% EI)
( - )
= 100 x corr tak-terinhibisi corr terinhibisi
corr tak-terinhibisi
W W
W
Tabel 2. Data daya inhibisi korosi senyawa turunan imidazol dan imidazolin terhadap logam baja karbon
menggunakan metode Weight Loss pada konsentrasi 8 ppm dalam larutan elektrolit NaCl 1% pada suhu 27 oC selama 10 hari.
Senyawa Massa Kupon Awal, W0 (g) Massa Kupon Akhir, Wt (g) Massa Hilang, Wcorr (g/thn) %EI Tanpa inhibitor (hanya larutan NaCl
1%) 0,9301 0,9214 0,31755 - 1 0,8662 0,8605 0,20805 34,48 2 0,9212 0,9144 0,2482 21,84 3 0,8593 0,8527 0,2409 24,14 4 0,9171 0,9113 0,2117 33,33 5 0,9124 0,9051 0,26645 16,09 6 0,8997 0,8936 0,22265 29,89 7 0,9075 0,9023 0,1898 40,23 8 0,8795 0,8733 0,2263 28,74
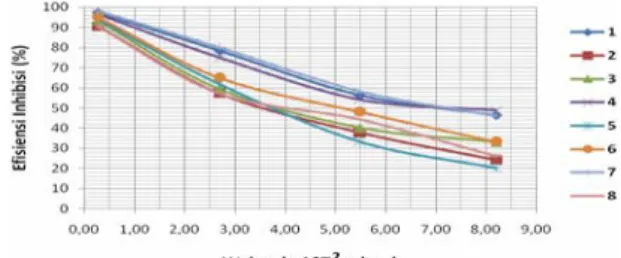
Adapun data lengkap hasil pengukuran dengan metode weight loss untuk kedelapan senyawa yang dijadikan model pada beberapa variasi konsentrasi ditampilkan pada Gambar 3-6 berikut.
Gambar 3. Aluran persen efisiensi inhibisi korosi
untuk senyawa 1 – 8 pada berbagai konsentrasi (8, 16, 32, 40, 60 dan 80 ppm) dalam larutan NaCl 1% menggunakan metode weight loss dengan lama perendaman 1 hari.
Gambar 4. Aluran persen efisiensi inhibisi korosi
untuk senyawa 1 – 8 pada berbagai konsentrasi (8, 16, 32, 40, 60 dan 80 ppm) dalam larutan NaCl 1% menggunakan metode weight loss dengan lama perendaman 10 hari.
Gambar 5. Aluran persen efisiensi inhibisi korosi
untuk senyawa 1 – 8 pada berbagai konsentrasi (8, 16, 32, 40, 60 dan 80 ppm) dalam larutan NaCl 1% menggunakan metode weight loss dengan lama perendaman 20 hari.
Gambar 6. Aluran persen efisiensi inhibisi korosi
untuk senyawa 1 – 8 pada berbagai konsentrasi (8, 16, 32, 40, 60 dan 80 ppm) dalam larutan NaCl 1% menggunakan metode weight loss dengan lama perendaman 30 hari.
Berdasarkan Gambar 3-6 di atas, kemudian dibuat aluran antara persen efisiensi inhibisi korosi kedelapan senyawa inhibitor pada konsentrasi 80 ppm terhadap waktu (dalam tahun), yang ditampilkan pada Gambar 7 berikut. Berdasarkan data dan aluran inilah kemudian pemodelan matematika untuk laju inhibisi korosi pada waktu yang lebih lama dilakukan.
Gambar 7. Aluran persen efisiensi inhibisi korosi
untuk senyawa 1 – 8 pada konsentrasi 80 ppm dalam larutan NaCl 1% terhadap waktu (dalam tahun) berdasarkan data dari metode weight loss.
3. Analisis Data dan Pemodelan Matematika
3.1 Model matematika tanpa inhibitor
Penelitian menggunakan model Matematika mengenai efektivitas inhibisi korosi pada logam baja belum banyak berkembang. Dalam berbagai literatur sudah banyak rumus Matematika yang menyatakan laju korosi tapi bukan berupa sistem dinamik yang dapat diamati perubahannya berdasarkan waktu. Penelitian ini bertujuan mengembangkan model laju korosi pada logam baja untuk memahami perubahannya apabila inhibitor korosi ditambahkan, dan mendapatkan parameter-parameter dalam model yang menentukan keefektifan inhibisi korosi pada logam baja, karena penambahan volume bahan penghambat tanpa perhitungan yang tepat terbukti tidak menghambat korusi secara signifikan. Model matematika yang dibangun dalam paper ini merupakan pengembangan dari model awal sebelumnya (Wahyuningrum dkk., 2009) yang didasarkan pada data hasil percobaan di laboratorium sebagaimana ditampilkan pada sub-bagian 2 di atas, terutama Gambar 7. Pada model dasar ini sudah dapat ditentukan parameter-parameter dari konsentrasi inhibitor yang berpengaruh dalam perubahan laju korosi namun validasi dari laboratorium menunjukkan perlunya model ini dikembangkan.
Dalam menentukan efektivitas inhibisi suatu bahan organik dalam menghambat laju korosi logam baja, maka dikembangkan model laju korosi berdasarkan Teori Keadaan Peralihan, sehingga model ini ditinjau empat kompartemen utama dalam sistem, yaitu logam, ion-ion logam atau logam dalam ‘keadaan peralihan’, produk terkorosi, dan inhibitor korosi, sehingga perubahan yang terjadi dapat lebih terlihat. Dalam penelitian ini fungsi input dalam penambahan inhibitor korosi pada sistem ini diamati berdasarkan pengamatan laboratorium kimia, sehingga fungsi input yang tepat dapat menentukan keefektifan inhibisi pada laju korosi. Dari model dasar yang sudah diperoleh maka dapat dilakukan modifikasi berupa sistem yang hybrid antara sistem dinamis tanpa inhibitor dan dengan inhibitor sehingga perilaku solusinya pada dunia nyata dapat didekati lebih baik daripada sebelumnya. Model matematika dari mekanisme korosi tersebut
berdasarkan pada Teori Keadaan Peralihan (Braun dan Martin, 1993), dimana logam terlebih dahulu berubah menjadi ion-ion logam (keadaan peralihan) sebelum menjadi hasil reaksi (produk terkorosi), seperti pada skema berikut ini:
a c
b
L
N
K
(4)dimana L mewakili logam yang akan terkorosi, N mewakili ion-ion logam yang merupakan logam dalam ‘keadaan peralihan’, dan K mewakili hasil reaksi (produk terkorosi). Konsentrasi dari ketiga komponen di atas menjadi kompartemen dalam model matematika dari mekanisme laju korosi sebelum penambahan inhibitor. Untuk melihat pengaruh penambahan inhibitor pada model ini ditambahkan satu kompartemen baru yaitu konsentrasi dari inhibitor korosi, yang disebut I.
Persamaan Michaelis-Menten (Jirstrand dkk., 2004) digunakan untuk menjelaskan besarnya laju reaksi yang terjadi dalam sistem. Pemilihan persamaan Michaelis-Menten untuk mendekati mekanisme proses korosi pada sistem yang diteliti adalah karena banyak literatur menunjukkan bahwa adanya keadaan intermediet logam yang terkorosi sebelum menjadi produk terkorosinya (Stupnisek-Lisac dkk., 2002; Migahed dkk., 2003; Zhao dkk., 2004, Wahyuningrum dkk., 2008a), sebagaimana halnya intermediet substrat-enzim (ES) dalam persamaan Michaelis-Menten (Wahyuningrum dkk., 2009).
Beberapa asumsi digunakan dalam mengkonstruksi model (Wahyuningrum dkk., 2009), diantaranya adalah perubahan konsentrasi persatuan waktu dari masing-masing faktor dianggap linier, laju pembentukan ion-ion logam (logam dalam ‘keadaan peralihan’) sama dengan laju penguraian ion-ion logam kembali menjadi logam. Dengan asumsi tersebut, diperoleh model mekanisme laju korosi berdasarkan Persamaan (4) tanpa penambahan inhibitor, seperti di bawah ini:
aL bN dt dL (5) L r pL bN aL dt dN (6) L r pL dt dK (7)
dengan kondisi awal:
0 0 0 (0) (0) ) 0 ( L N N K K L (8)
Persamaan (6) menunjukkan perubahan banyaknya logam per satuan waktu yang penambahannya dipengaruhi oleh laju perubahan ion-ion logam kembali menjadi logam (ditunjukkan oleh perkalian bN) dan pengurangannya dipengaruhi oleh laju perubahan logam menjadi ion-ion logam (ditunjukkan oleh perkalian aL). Persamaan (7) menunjukkan perubahan konsentrasi ion-ion logam (logam dalam ‘keadaan peralihan’) per satuan waktu
yang penambahannya dipengaruhi oleh laju perubahan logam menjadi ion-ion logam dan pengurangannya dipengaruhi oleh laju perubahan ion-ion logam kembali menjadi logam, serta laju perubahan ion-ion logam menjadi produk terkorosi yang dijelaskan oleh Persamaan (4). Persamaan (8) menjelaskan penambahan konsentrasi produk terkorosi per satuan waktu yang hanya dipengaruhi oleh laju perubahan ion-ion logam (logam dalam ‘keadaan peralihan’) menjadi produk terkorosi yang dijelaskan oleh Persamaan (4).
Analisis sensivitas model dilakukan dengan melihat perubahan laju korosi akibat perubahan nilai dari 2 parameter yang ada, yaitu laju perubahan logam menjadi ion-ion logam (a) dan laju reaksi maksimum p pada persamaan Michaelis-Menten. Pemilihan nilai parameter ini harus menunjukkan kesesuaian dengan keadaan nyata, misal konsentrasi senyawa logam tidak dapat bertambah selama proses korosi berlangsung dan konsentrasi senyawa korosi tidak pernah melebihi konsentrasi awal dari logam. Hasil analisis menunjukkan bahwa nilai parameter a yang memungkinkan adalah lebih besar daripada 0,45. Nilai parameter yang mungkin untuk p bergantung pada nilai dari a, karena semakin besar nilai a maka semakin besar nilai p yang mungkin. Contohnya untuk a = 0,838, nilai p yang mungkin adalah lebih kecil dari 1,4. Sedangkan untuk a = 0,5 , p <= 1 dan untuk a = 1, p < = 1,6.
3.2 Modifikasi model matematika dengan inhibitor Pada sistem berikut ini, penambahan senyawa inhibitor yang memberikan model matematika sebagai berikut: aL bN dt dL (9) I r pI L r pL bN aL dt dL (10) I r pI L r pL dt dK (11) s I r Pi dt dI (12)
dengan kondisi awal:
0 0 0 0 (0) (0) (0) ) 0 ( L N N K K I I L (13) Adanya penambahan inhibitor ditunjukkan
adanya suku baru dalam Persamaan (10) dan (12). Disamping itu, muncul satu persamaan baru yang menjelaskan perubahan konsentrasi senyawa inhibitor per satuan waktu. Persamaan (9) yang menjelaskan perubahan banyaknya logam per satuan waktu tidak terpengaruh oleh penambahan inhibitor dan persamaannya sama dengan Persamaan (5). Sedangkan untuk persamaan yang menjelaskan perubahan konsentrasi ion-ion logam dalam larutan, yaitu Persamaan (10), faktor yang mempengaruhinya
bertambah dengan adanya reaksi atau interaksi antara inhibitor dengan logam dan lingkungan, menggantikan reaksi logam dengan lingkungan. Di sini pengaruh inhibitor bertanda positif yang menjelaskan bahwa inhibitor fungsinya menghambat pembentukan ion-ion logam dan bukan mempercepat. Persamaan (11) menjelaskan perubahan konsentrasi produk terkorosi per satuan waktu yang dipengaruhi oleh reaksi logam dengan lingkungan, serta reaksi atau interaksi antara inhibitor dengan logam dan lingkungan. Faktor inhibitor bernilai negatif karena konsentrasi produk terkorosi berkurang seiring penambahan inhibitor ke dalam sistem. Terakhir, Persamaan (12) menjelaskan perubahan konsentrasi senyawa inhibitor per satuan waktu, dimana konsentrasi senyawa inhibitor akan berkurang dengan laju yang dijelaskan oleh Persamaan (4) dan bertambah dengan penambahan inhibitor secara konstan sebesar s pada sistem. Pada subbab selanjutnya akan dibahas mengenai perubahan yang terjadi karena penambahan inhibitor tersebut.
4. Simulasi Numerik
4.1 Penambahan inhibitor hanya pada saat awal
Seperti yang disebutkan pada subbab sebelumnya, pengambilan nilai parameter a, b, c, p perlu dicermati dengan baik karena hasil grafik harus sesuai dengan keadaan nyata. Seperti pada model sebelumnya (Wahyuningrum dkk., 2009), nilai
parameter a dan b sama sesuai dengan asumsi yang dipakai, parameter r yang ekivalen dengan tetapan Michaelis-Menten didapatkan dari (b+c)/a. Nilai parameter c didapat dari data laboratorium yaitu sebesar 0,15. Pada simulasi subbab ini dan subbab selanjutnya ditentukan nilai a = 0,5 dan p = 1.
Penambahan inhibitor pada saat awal saja ditunjukkan oleh model (3.6) – (3.9) dengan s = 0. Pada Gambar 8, nilai awal I0 menghasilkan perubahan kemiringan pada kurva logam. Semula untuk I0 = 0, kurva konsentrasi logam ditunjukkan pada garis hitam paling bawah yang sudah bernilai 0,05 saat t = 5 tahun. Parameter waktu yang digunakan adalah dalam satuan tahun, karena ini bersesuaian dengan parameter laju korosi dalam satuan mm per tahun (mmpy). Laju korosi maksimum yang diizinkan dalam pipeline (pipa
penyalur) adalah 5 mpy (mils per year, 1 mpy =
0,001 in/year), sedangkan normalnya adalah 1 mpy
atau kurang, dengan 1 Mpy = 0.0254 mmpy (Perez, 2004). Dengan bertambahnya nilai I0, kurva yang terbentuk semakin landai, ditandai dengan lebih besarnya nilai L saat t = 5 tahun. Contohnya untuk
I0 = 0,4 (garis hijau), konsentrasi logam sebesar 0,16 atau 3,2 kali lipat dari nilai semula saat yang sama. Akan tetapi perubahan laju logam yang terkorosi tidak menghentikan proses korosi karena pada saat akhir (t = 15 tahun) konsentrasi logam berakhir dengan nilai nol.
Gambar 8. Perubahan konsentrasi logam dengan
nilai awal inhibitor seiring waktu. Keterangan: I(0) = jumlah inhibitor korosi yang ditambahkan.
Gambar 9. Perubahan konsentrasi produk terkorosi
dengan nilai awal inhibitor seiring waktu. Keterangan: I(0) = jumlah inhibitor korosi yang ditambahkan pada saat awal.
Pada Gambar 9, penambahan inhibitor menunjukkan perlambatan pertambahan konsentrasi produk terkorosi namun tidak menghentikannya. Dengan mempertimbangkan keadaan yang nyata, dimana produk terkorosi mempunyai konsentrasi maksimum 1, yaitu sesuai dengan konsentrasi maksimum logam pada model ini, maka penambahan inhibitor dapat dilakukan saat awal dengan konsentrasi lebih dari 0,3. Pada nilai di bawahnya, produk terkorosi mencapai nilai lebih besar dari 1 sebelum kembali menjadi 1, dan ini tidak sesuai dengan keadaan sebenarnya.
Gambar 10. Penurunan nilai konsentrasi produk
terkorosi saat t = 5 tahun.
Gambar 10 menunjukkan salah satu contoh keadaan di mana nilai konsentrasi senyawa produk terkorosi mengalami penurunan bila diukur saat t = 5 tahun. Saat nilai I0 (jumlah inhibitor yang
ditambahkan pada saat awal) dari 0,2 sampai 0,9 maka penurunan nilai konsentrasinya berlangsung
linier dengan laju penurunan 0,48. Akan tetapi hal ini tidak berlaku untuk I0 > 0,9 hingga menuju 1, yaitu
mengalami penurunan yang lebih tajam. Hal ini menunjukkan bahwa sampai konsentrasi tertentu penambahan inhibitor korosi ke dalam sistem dapat menghambat proses korosi yang ditunjukkan dengan menurunnya jumlah produk terkorosi yang terbentuk. 4.2 Penambahan inhibitor secara kontinu
Pada sub-bab sebelumnya, penambahan inhibitor sekali saja pada saat awal tidak efektif menghentikan proses korosi. Oleh karena itu model diperbaiki dengan memasukkan faktor penambahan inhibitor secara kontinu. Model matematika (9) – (12) dengan s > 0 menunjukkan perubahan laju korosi dengan adanya penambahan inhibitor secara kontinu dengan laju konstan s. Pada Gambar 8, laju konsentrasi logam terlihat mengalami perlambatan dan terhenti pada sekitar t > 7 tahun, sehingga saat t = 15 tahun terdapat konsentrasi logam yang tidak mengalami korosi.
Gambar 11. Perubahan konsentrasi logam dengan
penambahan inhibitor kontinu seiring waktu. Keterangan: s = laju penambahan inhibitor secara konstan.
Pada keadaan nyata, logam tidak akan bertambah karena penambahan inhibitor. Oleh karena itu laju penambahan inhibitor yang mungkin menurut Gambar 11 paling maksimum adalah 0,08, dan logam yang tersisa saat t = 15 tahun adalah 0,08267. Sedangkan perubahan konsentrasi senyawa produk terkorosi pada Gambar 12 menunjukkan bahwa saat laju penambahan inhibitor 0,08 mengakibatkan proses korosi berhenti dengan produk terkorosi yang terbentuk saat t = 15 tahun adalah 0,8341.
Gambar 12. Perubahan konsentrasi produk terkorosi
dengan penambahan inhibitor kontinu seiring waktu. Keterangan: s = laju penambahan inhibitor secara konstan.
Berdasarkan kedua model yang dikembangkan, yaitu model penambahan inhibitor pada saat awal maupun model penambahan inhibitor secara kontinu (lihat Gambar 8 dan Gambar 11), ternyata terdapat kesesuaian antara hasil pemodelan matematika dengan data percobaan yang ditampilkan pada Gambar 7, dimana seiring waktu, penambahan inhibitor korosi memang memperlambat proses korosi, namun semakin lama efisiensi inhibisi korosinya semakin berkurang. Hal ini menunjukkan bahwa inhibitor korosi hanya berfungsi untuk memperlambat laju korosi pada baja karbon saja yang pada konsentrasi optimum tertentu menunjukkan efisiensi inhibisi korosi cukup signifikan.
5. Kesimpulan
Berdasarkan konstruksi model dengan penambahan senyawa inhibitor pada saat awal, konsentrasi produk terkorosi mengalami penurunan, misalnya pada saat t = 5 tahun laju penurunannya adalah 0,48 untuk setiap kenaikan nilai penambahan inhibitor sebesar 0,1, namun belum dapat menghentikan laju korosi secara signifikan. Sedangkan pada model penambahan inhibitor secara kontinu dengan laju konstan, dapat ditunjukkan terjadi penghentian proses korosi karena adanya logam yang tersisa saat t = 15 tahun. Akan tetapi model di atas masih perlu pengembangan dengan memastikan keadaan di mana proses korosi akan terhenti pada saat waktu yang sangat lama. Secara umum model matematika dengan penambahan inhibitor secara kontinu bersesuaian dengan data daya inhibisi korosi secara eksperimen untuk senyawa 1-8 yang telah disintesis, yaitu bahwa penambahan konsentrasi senyawa-senyawa tersebut ke dalam larutan NaCl 1% cenderung menaikkan efisiensi inhibisi korosinya. Hal ini berarti bahwa peningkatan konsentrasi inhibitor korosi berpotensi untuk dapat menghambat laju korosi secara signifikan.
6. Ucapan Terima Kasih
Penulis mengucapkan terima kasih kepada semua pihak yang terlibat. Penelitian ini didanai oleh Riset KK ITB 2009 dengan Surat Perjanjian Pelaksanaan Riset No. 246/K01.7/PL/2009. Penulis mengucapkan terima kasih kepada FMIPA- ITB, LPPM – ITB atas fasilitas di laboratorium kimia organik sintesis dan laboratorium korosi Kimia Fisik Material FMIPA – ITB.
Daftar Pustaka
Bentiss, F., M. Traisnel, H. Vezin, H. F. Hildebrand and M. Lagrenée, 2004, 2,5-Bis(4-dimethylaminophenyl)-1,3,4-oxadiazole and 2,5-bis(4-dimethylaminophenyl)-1,3,4-thiadiazole as corrosion inhibitors for mild steel in acidic media, Corrosion Sci., 46,
2781-2792.
Braun and Martin, 1993, Ordinary Differential Equation and Their Application, New York,
Springer-Verlag.
Cruz, J., T. Pandiyan and E. Garcı´a-Ochoa, 2005, A new inhibitor for mild carbon steel: Electrochemical and DFT studies, J. Electroanal. Chem., 583, 8-16.
Heeg, B., D. Klenerman and T. Moros, 1998, Persistency of corrosion inhibitor films on C-steel under multiphase flow conditions: Part I: The jet-cylinder arrangement,
Corrosion Sci., 40:8, 1303-1311.
Hong, T. and W. P. Jepson, 2001, Corrosion inhibitor studies in large flow loop at high temperature and high pressure, Corrosion Sci., 43, 1839-1849.
Jirstrand, M., D. Wolters-Pratzel, J. L. Almquist, J.W. Deitmer, 2004, Systems Biology - Mathematical Modelling of Cellular Processes, Gothenberg, Germany.
Jones, D. A., 1992, Principles and Prevention of Corrosion. Singapore, Macmillan Publishing
Company.
Kadirgan, F. and S. Suzer, 2001, Electrochemical and XPS studies of corrosion behavior of a low carbon steel in the presence ofFT2000 inhibitor, J. Electron. Spectrosc., 114,
597-601.
Kalman, E., J. Telegdi and T. Rigo, 2004, Nanolayer barriers for inhibition of copper corrosion.
Corrosion Engineering, Sci. Tech., 39:1,
65-70.
Kuznetsov, Y. I. (2002). Current State of the Theory of Metal Corrosion Inhibition, Prot. Met+.,
38:2, 103-111.
Lopez, D. A., W. H. Schreiner, S. R. de Sanchez and S. N. Simison, 2004, The influence of inhibitors molecular structure and steel microstructure on corrosion layers in CO2 corrosion: An XPS and SEM characterization, Appl. Surf. Sci., 236, 77-97.
Migahed, M. A., H. M. Mohamed and A. M. Alsabagh, 2003, Corrosion inhibition of H-11 type carbon steel in 1 M hydrochloric acid solution by N-propyl amino lauryl amide and its ethoxylated derivatives,
Mater. Chem. Phys., 80, 169-175.
Perez, N., 2004, Electrochemistry and Corrosion Science. New York, Boston, Dordrecht,
London, Moscow, Kluwer Academic Publishers.
Rafiquee, M.Z.A, N. Saxena, S. Khan, and M. A. Quraishi, 2008, Influence of Surfactans on The Corrosion Inhibition Behavior of 2-aminophenyl-5-mercapto-1-oxa-3,4-diazole (AMOD) on Mild Steel, Mater. Chem. Phys., 107, 528 – 533.
Rajendran, S., B. V. Apparao, N. Palaniswamy, V. Periasamy and G. Karthikeyan, 2001,
Corrosion inhibition by strainless complexes. Corrosion Sci., 43, 1345-1354.
Srhiri, A., M. Etman and F. Dabosi, 1996, Electro and Physicochemical Study of Corrosion Inhibition of Carbon Steel in 3% NaCl y Alkylimidazoles, Electrochimica Acta, 41:3,
429 - 437.
Stupnisek-Lisac, E., A. Gazivoda and M. Madzarac, 2002, Evaluation of non-toxic corrosion inhibitors for copper in sulphuric acid,
Electrochimica Acta, 47, 4189-4194.
Supardi, R., 2002, Korosi dan Kegagalan yang Terjadi Pada Pengecatan Otomotif. Bandung, Balai Besar Penelitian dan Pengembangan Industri Logam dan Mesin; Departemen Perindustrian dan Perdagangan. Veawab, A., P. Tontiwachwuthikul and S. D. Bhole,
1997, Studies of Corrosion and Corrosion Control in a CO2--2-Amino-2-methyl-1-propanol (AMP) Environment, Ind. Eng. Chem. Res., 36, 264-269.
Wahyuningrum, D., S. Achmad, Y. M. Syah, Buchari and B. Ariwahjoedi, 2008a. The Correlation between Structure and Corrosion Inhibition Activity of 4,5-Diphenyl-1-vinylimidazole Derivative Compounds towards Mild Steel
in 1% NaCl Solution, Int. J. Electrochem. Sci., 3, 154 – 166, ISSN 1452-3981.
Wahyuningrum, D., S. Achmad, Y. M. Syah, Buchari and B. Ariwahjoedi, 2008b, The Microwave Assisted Organic Synthesis of Imidazoline Derivative Compounds and The Investigation of Their Corrosion Inhibition Activity towards Carbon Steel in 1% NaCl Solution, ITB J. Sci., 40 A, 1, 33-48, ISSN
1978-3043.
Wahyuningrum, D., N. Nuraini, N. Sumarti, and A. Yusuf, 2009, Mathematical Model in Study of Corrosion Inhibition Mechanism of Imidazole Derivative Compounds towards Carbon Steel in 1% NaCl Solution.
Proceedings of The 5th Asian Mathematics Conference, June 2009, Kuala Lumpur,
Malaysia.
Zhao, L., H. K. Teng, Y. S. Yang and X. Tan, 2004, Corrosion inhibition approach of oil production systems in offshore oilfield.