SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh :
Ermin Setya Ningsih
NIM : 058114127
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
ii
OPTIMASI KONSENTRASI MOLASE DAN PH TERHADAP PRODUKSI ETANOL HASIL FERMENTASI PADA SUHU 280C
OLEHSaccharomyces cerevisiae
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Ilmu Farmasi
Oleh :
Ermin Setya Ningsih
NIM : 058114127
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
v
Kupersembahkan kepada:
vii
Yang bertandatangan di bawah ini, saya mahasiswa Universitas Sanata Dharma :
Nama : Ermin Setya Ningsih
Nomor Mahasiswa : 058114127
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan
Universitas Sanata Dharma karya ilmiah saya yang berjudul:
OPTIMASI KONSENTRASI MOLASE DAN PH TERHADAP PRODUKSI ETANOL HASIL FERMENTASI PADA SUHU 280C
OLEHSaccharomyces cerevisiae
beserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan
kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan,
mengalihkan dalam bentuk media lain, mengelolanya dalam bentuk pangkalan
data, mendistribusikan secara terbatas, dan mempublikasikannya di internet atau
media lain untuk kepentingan akademis tanpa perlu meminta ijin dari saya
maupun memberikan royalti kepada saya selama tetap mencantumkan nama saya
sebagai penulis.
Demikian pernyataan ini saya buat dengan sebenarnya.
Dibuat di Yogyakarta,
Pada tanggal: 30 Januari 2009
Yang menyatakan
viii
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas
berkat dan rahmat-Nya sehingga penulis dapat menyelesaikan tugas akhir berjudul
Optimasi Konsentrasi Molase dan pH terhadap Produksi Etanol Hasil Fermentasi
pada Suhu 280C olehSaccharomyces cerevisiae.Tugas akhir ini merupakan salah
satu syarat untuk memperoleh gelar Sarjana Strata Satu Program Studi Ilmu
Farmasi (S.Farm) Universitas Sanata Dharma Yogyakarta.
Penulisan tugas akhir ini tidak lepas dari bantuan berbagai pihak. Untuk
itu, penulis mengucapkan terima kasih kepada:
1. Rita Suhadi, M.Si., Apt., selaku Dekan Fakultas Farmasi Universitas Sanata
Dharma Yogyakarta
2. Ibu Christine Patramurti, M.Si., Apt. selaku dosen pembimbing yang telah
meluangkan waktu, tenaga dan pikirannya untuk membimbing penulis.
3. Ibu Maria Dwi Budi Jumpowati, S.Si. selaku ketua penelitian yang telah
meluangkan waktu, tenaga dan pikirannya untuk membimbing penulis.
4. Bapak Ignatius Yulius Kristio Budiasmoro, M.Si. selaku dosen penelitian
yang telah meluangkan waktu, tenaga dan pikirannya untuk membimbing
penulis.
5. Mas Sarwanto, Mas Bimo, Mas Bima, Mas Wagiran, Mas Sigit, Mas Kunto,
Pak Parlan, dan semua laboran yang selalu memberikan perhatian pada setiap
penelitian yang dilakukan oleh penulis.
ix menyelesaikan penelitian ini.
9. Mas Rian yang selalu meluangkan waktu untuk membantu dan memberi
dukungan pada penelitian yang dilakukan penulis.
10. Ceci sebagai sahabat yang selalu mendukung dan membantu penulis dalam
menyelesaikan penelitian ini.
11. Teman-teman Shoufang (Linna, Dewi, Mia, Widia, dll) atas dukungannya
kepada penulis.
12. Teman-teman kelompok C (Yokhe, Ester, Hendra, Uli, dll) atas kerja sama
dan dukungannya dalam menyelesaikan penelitian ini.
13. Teman-teman angkatan 2005 khususnya kelas C.
14. Semua pihak yang tidak dapat disebutkan satu per satu.
Penulis mengakui bahwa karya tulis ini masih jauh dari sempurna. Oleh
karena itu, segala kritik dan saran yang membangun akan penulis terima dengan
senang hati. Akhir kata, semoga tugas akhir ini berguna bagi semua pihak dan
dapat menjadikan bahan kajian lebih lanjut.
Yogyakarta, Januari 2009
x INTISARI
Etanol merupakan salah satu produk fermentasi. Bahan baku yang digunakan adalah molase (tetes tebu) sebagai media yang digunakan untuk fermentasi etanol. Mikrobia yang digunakan adalah Saccharomyces cerevisiae
yang akan menghasilkan enzim invertase dan zymase. Enzim invertase akan mengubah sukrosa menjadi glukosa dan fruktosa sedangkan enzim zymase akan mengubah glukosa dan fruktosa menjadi etanol.
Faktor-faktor lingkungan yang mempengaruhi fermentasi adalah suhu, konsentrasi molase dan pH. Pada penelitian ini dilakukan optimasi proses fermentasi dengan 3 variasi konsentrasi molase dan pH. Konsentrasi molase yang digunakan adalah 80Brix, 160Brix dan 240Brix sedangkan pH yang digunakan adalah 4, 4.5, dan 5. Dari variasi konsentrasi molase dan pH tersebut didapatkan 9 macam perlakuan fermentasi. Penelitian ini termasuk jenis penelitian kuasi eksperimental yang bertujuan untuk mengetahui faktor yang berpengaruh paling dominan antara konsentrasi molase, pH dan interaksi keduanya dalam menentukan kadar etanol hasil fermentasi dan mengetahui ada tidaknya area optimum kondisi fermentasi (konsentrasi molase dan pH) pada contour plotyang diprediksikan menghasilkan kadar etanol yang optimum. Pada penetapan kadar etanol perlu dilakukan distilasi hasil fermentasi untuk memisahkan etanol dari komponen-komponen lain, kemudian etanol hasil distilasi ditetapkan kadarnya menggunakan kromatografi gas.
Hasil penelitian ini menunjukkan bahwa konsentrasi molase berpengaruh paling dominan dalam menentukan kadar etanol hasil fermentasi. Dari contour plotdiperoleh area optimum yaitu pada konsentrasi molase 22,3220Brix - 240Brix dan pH 4-5 yang diprediksi sebagai kondisi optimum (konsentrasi molase dan pH) fermentasi yang menghasilkan kadar etanol optimum.
xi
the fermentation medium. Microbial being used is Saccharomyces cerevisiae
which produce invertase and zymase enzyme. Invertase enzyme changes sucrose to be glucose and fructose. Zymase enzyme changes glucose and fructose to be ethanol.
Factors that influence the fermentation are temperature, pH and molasses concentrations. The aim of this research was fermentation optimization process with 3 concentrations molasses and pH variations. Molasses concentrations used were 80Brix, 160Brix, and 240Brix. The pH used were 4; 4.5; and 5. The aim of this quasi experimental research were to determine the dominant factor among molasses concentration, pH and its interactions on ethanol concentration from fermentation process and to determine optimum area on the fermentation condition (molasses concentrations and pH) at the contour plot. In determining the ethanol concentration, had to distillate the yield fermentation to separate ethanol from another component than the distillated ethanol can be determined by gas chromatography.
The result showed that the molasses concentrations influence the ethanol concentration from fermentation process. The contour plot showed the optimum area (molasses concentration 22,3220Brix – 240Brix and pH 4-5) that estimated as the optimum condition (molasses concentrations and pH) fermentation that optimum ethanol concentration.
xii
DAFTAR ISI
HALAMAN SAMPUL... i
HALAMAN JUDUL... ii
HALAMAN PERSETUJUAN PEMBIMBING... iii
HALAMAN PENGESAHAN... iv
HALAMAN PERSEMBAHAN... v
PERNYATAAN KEASLIAN KARYA... vi
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI... vii
KATA PENGANTAR... viii
INTISARI... x
ABSTRACT... xi
DAFTAR ISI... xii
DAFTAR TABEL... xvi
DAFTAR GAMBAR... xvii
DAFTAR LAMPIRAN... xviii
BAB I. PENGANTAR... 1
A. Latar Belakang... 1
1. Perumusan masalah... 2
2. Keaslian karya... 2
3. Manfaat penelitian... 3
B. Tujuan Penelitian... 3
xiii
B.Fermentasi………. 5
1. Tinjauan umum……… 5
2. Faktor-faktor yang mempengaruhi fermentasi………... 9
3. Media fermentasi……… 10
4. Yeast………... 11
C. Distilasi………. 13
D. Kromatografi Gas………. 15
1. Tinjauan umum………... 15
2. Komponen-komponen kromatografi gas……… 15
E. Metode Desain Faktorial... 19
1. Tinjauan umum... 19
2. Desain faktorial tiga level (3k)... 20
F. Landasan Teori... 21
G. Hipotesis... 22
BAB III. METODOLOGI PENELITIAN... 23
A. Jenis Rancangan Penelitian... 23
B. Variabel Penelitian dan Definisi Operasional... 23
1. Variabel Penelitian... 23
2. Definisi Operasional... 23
xiv
D. Alat Penelitian... 24
E. Tata Cara Penelitian... 25
1. Pengambilan sampel... 25
2. Pembuatan larutan media... 25
3. Tahap produksi etanol olehS. Cerevisiae... 26
4. Penetapan konsentrasi etanol hasil fermentasi………... 28
F. Analisis Hasil……… 30
1. Uji ANOVA... 30
2. Desain Faktorial... 30
BAB IV. HASIL DAN PEMBAHASAN……… 31
A. Pemilihan Sampel………. 31
B. Fermentasi………. 31
C. Distilasi………. 35
D. Optimasi Kromatografi Gas……….. 36
E. Validasi Metode Kromatografi Gas... 40
1. Pembuatan kurva baku... 40
2. Penentuan akurasi dan presisi... 41
F. Penetapan Konsentrasi Etanol Hasil Fermentasi... 42
G. Optimasi Kondisi Fermentasi... 46
BAB V KESIMPULAN DAN SARAN………... 49
A. Kesimpulan………... 49
B. Saran………. 49
xvi
DAFTAR TABEL
Tabel I. Komposisi molase (%) ... 11
Tabel II. Rancangan percobaan desain faktorial dengan dua faktor dan tiga level ... 20
Tabel III. Pembuatan larutan molase ... 26
Tabel IV. Variasi pH dan konsentrasi molase ... 27
Tabel V. Pembuatan seri larutan baku etanol ... 29
Tabel VI. Pembuatan larutan untuk penentuan akurasi dan presisi ... 29
Tabel VII. Kurva baku etanol dengan standar internal n-butanol ... 40
Tabel VIII. Hasil penentuan akurasi dan presisi ... 42
Tabel IX. Hasil penetapan konsentrasi etanol hasil fermentasi ... 43
Tabel X. Efek konsentrasi molase, pH dan interaksi keduanya dalam menentukan konsentrasi etanol ... 44
xvii
Gambar 2 Saccharomyces cerevisiae... 12
Gambar 3 Kromatografi gas ... 15
Gambar 4 Fermentor ... 27
Gambar 5 Grafik waktu fermentasi terhadap konsentrasi etanol ... 34
Gambar 6 Hasil optimasi kromatografi gas ... 36
Gambar 7 Interaksi fase diam dengan etanol dan butanol ... 38
Gambar 8 Hasil pemisahan heksan, etanol dan butanol ... 39
Gambar 9 Hubungan antara konsentrasi etanol dan AUC etanol/AUC butanol ... 41
Gambar 10 Hasil penetapan konsentrasi etanol hasil fermentasi ... 43
Gambar 11 Hubungan konsentrasi molase (a) dan pH (b) terhadap konsentrasi etanol ... 44
xviii
DAFTAR LAMPIRAN
Lampiran 1. Kromatogram optimasi kromatografi gas ... 52
Lampiran 2. Kromatogram seri kurva baku ... 52
Lampiran 3. Hasil perhitungan kurva baku ... 55
Lampiran 4. Hasil perhitungan akurasi dan presisi ... 56
Lampiran 5. Perhitungan pembuatan larutan molase ... 56
Lampiran 6. Hasil perhitungan konsentrasi etanol hasil fermentasi dengan waktu inkubasi yang berbeda ... 57
Lampiran 7. Kromatogram konsentrasi etanol hasil fermentasi pada konsentrasi 80Brix dan pH 4 ... 58
Lampiran 8. Hasil penetapan konsentrasi etanol hasil fermentasi pada konsentrasi 80Brix dan pH 4 ... 59
Lampiran 9. Kromatogram konsentrasi etanol hasil fermentasi pada konsentrasi 80Brix dan pH 4,5 ... 59
Lampiran 10. Hasil penetapan konsentrasi etanol hasil fermentasi pada konsentrasi 80Brix dan pH 4,5 ... 60
xix
konsentrasi 160Brix dan pH 4 ... 61
Lampiran 14. Hasil penetapan konsentrasi etanol hasil fermentasi pada
konsentrasi 80Brix dan pH 5 ... 62
Lampiran 15. Kromatogram konsentrasi etanol hasil fermentasi pada
konsentrasi 160Brix dan pH 4,5 ... 62
Lampiran 16. Hasil penetapan konsentrasi etanol hasil fermentasi pada
konsentrasi 160Brix dan pH 4,5 ... 63
Lampiran 17. Kromatogram konsentrasi etanol hasil fermentasi pada
konsentrasi 160Brix dan pH 5 ... 63
Lampiran 18. Hasil penetapan konsentrasi etanol hasil fermentasi pada
konsentrasi 160Brix dan pH 5 ... 64
Lampiran 19. Kromatogram konsentrasi etanol hasil fermentasi pada
konsentrasi 240Brix dan pH 4 ... 64
Lampiran 20. Hasil penetapan konsentrasi etanol hasil fermentasi pada
konsentrasi 240Brix dan pH 4 ... 65
Lampiran 21. Kromatogram konsentrasi etanol hasil fermentasi pada
xx
Lampiran 22. Hasil penetapan konsentrasi etanol hasil fermentasi pada
konsentrasi 240Brix dan pH 4,5 ... 66
Lampiran 23. Kromatogram konsentrasi etanol hasil fermentasi pada
konsentrasi 240Brix dan pH 5 ... 66
Lampiran 24. Hasil penetapan konsentrasi etanol hasil fermentasi pada
konsentrasi 240Brix dan pH 5 ... 67
Lampiran 25. Hasil perhitungan konsentrasi etanol (ml/100 ml) hasil
fermentasi ... 67
Lampiran 26. Hasil perhitunagn rata-rata konsentrasi etanol hasil fermentasi ... 68
Lampiran 27. Hasil perhitungan ANOVA ... 68
Lampiran 28. Hasil perhitungan optimasi kondisi fermentasi dengan metode
1
A. Latar Belakang
Fermentasi merupakan proses pemecahan karbohidrat dan asam amino
secara anaerob, yaitu tanpa memerlukan oksigen. Salah satu produk yang dapat
dihasilkan dari proses fermentasi adalah etanol (Fardiaz, 1992).
Di Indonesia banyak industri yang menghasilkan etanol dari proses
fermentasi, salah satunya Pabrik Gula dan Alkohol / Spiritus Madukismo (PG-PS
Madukismo). Bahan baku yang digunakan oleh PG-PS Madukismo adalah tetes
tebu (molase), yang merupakan hasil samping dari PG Madukismo. Molase
tersebut difermentasi menjadi etanol dengan bantuanS. cerevisiae. Proses ini telah
dilakukan sejak tahun 1955. Kadar etanol yang dihasilkan dari proses fermentasi
di PG-PS Madukismo dikatakan belum optimum karena produk yang dihasilkan
70% berupa alkohol murni (konsentrasi 95%) dan 30% berupa alkohol teknis
(konsentrasi 94%). Oleh karena itu perlu dilakukan suatu upaya untuk mencapai
kondisi fermentasi yang optimal, yaitu kondisi fermentasi yang dapat
menghasilkan etanol dengan kadar yang lebih tinggi.
Menurut Stark dalam Alico (1982), proses fermentasi dipengaruhi oleh
berbagai faktor antara lain konsentrasi molase dan kondisi lingkungan selama
proses fermentasi berlangsung (pH) sehingga perlu dilakukan optimasi
2
Penelitian mengenai optimasi konsentrasi molase dan pH terhadap
produksi alkohol hasil fermentasi dilakukan pada 3 variasi suhu (280C, 310C dan
350C) yang dilakukan oleh 3 peneliti. Pada penelitian ini dilakukan optimasi
konsentrasi molase dan pH terhadap produksi alkohol hasil fermentasi pada suhu
280C oleh S. cerevisiae menggunakan molase dan S. cerevisiae dari PG-PS
Madukismo. Fermentasi dilakukan pada suhu 280C, 310C dan 350C karena
menurut Gaur (2006) fermentasi menggunakan S. cerevisiae dan molase
dilakukan pada suhu lingkungan antara 25-350C. Optimasi konsentrasi molase dan
pH dilakukan dengan menggunakan metode desain faktorial. Dari penelitian ini
diharapkan pada kondisi fermentasi (konsentrasi molase dan pH) yang optimum
diperoleh kadar etanol yang optimum.
1. Perumusan masalah
a. Manakah faktor yang berperan dominan antara konsentrasi molase, pH dan
interaksi keduanya dalam menentukan kadar etanol hasil fermentasi?
b. Apakah dapat ditemukan area optimum kondisi fermentasi (konsentrasi
molase dan pH) padacontour plotyang diprediksikan menghasilkan kadar
etanol yang optimum?
2. Keaslian karya
Sejauh penelusuran pustaka yang dilakukan oleh penulis, penelitian
tentang optimasi konsentrasi molase dan pH terhadap produksi etanol hasil
3. Manfaat penelitian
a. Manfaat teoritis. Menambah khasanah ilmu pengetahuan mengenai
optimasi konsentrasi molase dan pH terhadap produksi etanol hasil fermentasi
pada suhu 28ºC olehS. cerevisiae.
b. Manfaat metodologis. Penelitian ini dapat menjadi acuan jika
dilakukan penelitian mengenai optimasi konsentrasi molase dan pH terhadap
produksi etanol hasil fermentasi oleh S. cerevisiae dengan menggunakan metode
faktorial desain.
c. Manfaat praktis. Memberi informasi kepada PG-PS Madukismo
mengenai kondisi fermentasi (konsentrasi molase dan pH) pada suhu 28ºC yang
dapat menghasilkan kadar etanol yang optimum.
B. Tujuan Penelitian 1. Tujuan umum
Mengetahui pengaruh konsentrasi molase dan pH terhadap produksi
alkohol hasil fermentasi pada suhu 280C olehS. cerevisiae.
2. Tujuan khusus
a. Mengetahui faktor yang berperan dominan antara konsentrasi molase, pH
dan interaksi keduanya dalam menentukan kadar etanol hasil fermentasi.
b. Mengetahui ada tidaknya area optimum kondisi fermentasi (konsentrasi
molase dan pH) pada contour plot yang diprediksikan menghasilkan
4 BAB II
PENELAAHAN PUSTAKA
A. Etanol (C2H5OH)
Etanol merupakan cairan yang bening, tidak berwarna, mudah mengalir,
mudah menguap, cairan higroskopis dengan karakteristik bau spiritus dan rasa
membakar, mudah terbakar, terbakar dengan api biru tanpa asap. Titik didih
etanol tercapai pada suhu 78⁰C. Etanol bersifat larut dalam air, dalam kloroform,
dalam eter, dalam gliserol, dan dalam hampir semua pelarut organik yang lain.
Penyimpanan dilakukan pada suhu 8⁰C sampai 15⁰C jauh dari api dalam wadah
kedap udara dan terlindung dari cahaya (Anonim, 1999).
Etanol dapat digunakan untuk berbagai keperluan. Setelah dicampurkan
dalam gasoline, digunakan sebagai bahan bakar. Pada masa Perang Dunia I dan II
industri alkohol berkembang pesat, dengan tujuan utama sebagai bahan bakar.
Selain itu etanol banyak digunakan juga dalam industri minuman, kosmetik dan
industri pharmasi seperti deterjen, desinfektan dan lain-lain (Maiorella dalam Ega,
2006).
Etanol untuk kebutuhan industri dapat dibuat secara fermentasi dari
karbohidrat, yang produknya disebut sebagai bioetanol; atau hasil reaksi kimia
dengan cara hidrasi etilen, memakai katalis asam fosfat. Etanol dari hidrasi gas
ethylene yang merupakan hasil samping pemurnian minyak bumi, dikenal sebagai
Penerapan teknologi fermentasi etanol dalam skala industri, sejak Perang
Dunia II belum ada perubahan yang mendasar. Proses fermentasinya
menggunakan system bacth dengan masa inkubasi berkisar 50 jam dan
semata-mata mengandalkanstrain yeast yang telah terpilih secara nyata berproduktivitas
tinggi. Yeast mempunyai sifat selektivitas sangat tinggi untuk membentuk etanol
(metabolit lain sebagai hasil samping sangat kecil) dan sangat tahan terhadap
perubahan kondisi pertumbuhan atau gangguan kontaminasi (Maiorella dalam
Ega, 2006).
B. Fermentasi 1. Tinjauan umum
Menurut Fardiaz (1992), fermentasi merupakan proses pemecahan
karbohidrat dan asam amino secara anaerob, yaitu tanpa memerlukan oksigen.
Senyawa yang dapat dipecah dalam proses fermentasi terutama adalah karbohidrat
sedangkan asam amino hanya dapat difermentasi oleh beberapa jenis bakteri
tertentu.
Menurut Campbell (2002), fermentasi merupakan proses katabolik yang
membuat sejumlah tertentu ATP dari glukosa tanpa rantai transport elektron dan
yang menghasilkan produk akhir yang khas, seperti etil alkohol atau asam laktat.
Fermentasi dibedakan atas 2 macam yaitu fermentasi “solid state” dan
“sub-merged”. Fermentasi “solid state” adalah metode menumbuhkan mikrobia di
kondisi yang kandungan airnya terbatas tanpa memiliki aliran air yang mengalir
6
mikrobia dan substrat berada menjadi satu dalam media cair dalam jumlah yang
besar (Riadi, 2007).
Empat jalur fermentasi pada mikrobia, yaitu :
a. jalur Embden-Meyerhoff-Parnas (EMP) atau glikolisis ditemukan pada fungi
dan kebanyakan bakteri, serta pada hewan dan manusia,
b. jalur Entner-Doudoroff (ED) hanya ditemukan pada beberapa bakteri,
c. jalur Heksosamonofosfat (HMF) ditemukan pada berbagai organism,
d. jalur Fosfoketolase (FK) hanya ditemukan pada bakteri yang tergolong
laktobasili heterofermentatif (Fardiaz,1992).
Fermentasi glukosa (jalur EMP) pada prinsipnya terdiri dari dua tahap:
a. pemecahan rantai karbon dari glukosa dan pelepasan paling sedikit dua pasang
atom hidrogen menghasilkan senyawa karbon lainnya yang lebih teroksidasi
daripada glukosa,
b. senyawa yang teroksidasi tersebut direduksi kembali oleh atom hidrogen yang
dilepaskan dalam tahap pertama membentuk senyawa-senyawa lain sebagai
hasil fermentasi. Reaksi oksidasi tidak dapat berlangsung tanpa reaksi reduksi
yang seimbang. Oleh karena itu, jumlah atom hidrogen yang dilepaskan dalam
tahap pertama fermentasi selalu seimbang dengan jumlah yang digunakan
Proses fermentasi glukosa melalui jalur glikolisis adalah sebagai berikut :
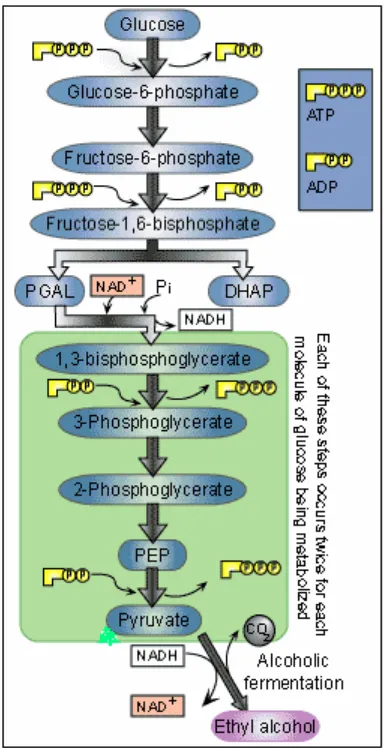
Gambar 1. Fermentasi glukosa (Anonim, 2008)
Reaksi dalam fermentasi berbeda-beda tergantung pada jenis gula yang
digunakan dan produk yang dihasilkan. Secara singkat, glukosa (C6H12O6) yang
merupakan gula paling sederhana, melalui fermentasi akan menghasilkan etanol
(2C2H5OH). Reaksi fermentasi ini dilakukan oleh yeast, dan digunakan pada
produksi makanan. Persamaan reaksi fermentasi adalah
C6H12O6→ 2C2H5OH + 2CO2+ 2 ATP (Energi yang dilepaskan:118 kJ per mol)
Gula (glukosa, fruktosa, atau sukrosa) → Alkohol (etanol) + Karbondioksida +
8
Jalur biokimia yang terjadi, sebenarnya bervariasi tergantung jenis gula yang
terlibat, tetapi umumnya melibatkan jalur glikolisis, yang merupakan bagian dari
tahap awal respirasi aerobik pada sebagian besar organisme. Jalur terakhir akan
bervariasi tergantung produk akhir yang dihasilkan (Anonim, 2008).
Proses fermentasi dilakukan dalam sebuah bejana yang disebut dengan
bioreaktor atau fermentor. Umpan yang masuk ke fermentor disebut substrat.
Substrat utama adalah sumber karbon yang digunakan oleh mikrobia untuk
memberikan energi untuk pertumbuhan dan produksi produk akhir. Mikrobia juga
membutuhkan nutrisi lainnya. Nutrisi yang umum adalah sulfur, fosfor,
potassium, magnesium, nitrogen dan mineral-mineral lainnya tergantung pada
spesifik organisme. Nutrisi ini ditambahkan ke dalam fermentor dalam bentuk
garam mineral yang dilarutkan dalam air, nitrogen ditambahkan dalam bentuk
ammonia. Sel yang hidup membutuhkan oksigen untuk fermentasi menggunakan
mikrobiaaerobdisuplai gelembung udara ke dalam fermentor. Fermentasi dengan
menggunakan mikrobia anaerob dilakukan dengan tidak adanya udara (Riadi,
2007).
Proses fermentasi mempunyai enam komponen dasar, yaitu :
a. susunan medium yang digunakan selama pengembangan inokulum dan di
dalam fermentor,
b. sterilisasi medium, fermentor dan peralatan lain,
c. aktivitas produksi, pemanfaatan kultur murni, jumlah inokulum untuk
d. pertumbuhan mikrobia dalam fermentor produksi pada kondisi optimum untuk
pembentukan hasil,
e. ekstraksi produk dan pemurnian, dan
f. penanganan limbah yang dihasilkan selama proses (Hidayat dkk, 2006).
Metabolit hasil fermentasi selain diambil produk metabolitnya, secara
tradisional telah dikonsumsi atau dimanfaatkan oleh manusia bersama-sama
dengan substratnya yang disebut biomassa mikrobia, misalnya pada gari, growol,
kecap, tapai, tauco, tempe, terasi (Hidayat dkk, 2006).
2. Faktor-faktor yang mempengaruhi fermentasi
a. Nutrisi (zat gizi). Dalam kenyataannya yeast memerlukan
penambahan nutrisi untuk pertumbuhan dan perkembangbiakan, misalnya: unsur
karbon (terdapat pada karbohidrat), unsur nitrogen (dengan penambahan pupuk
yang mengandung nitrogen, urea, ammonia, pepton, dan sebagainya), unsur
phosphor (dengan penambahan pupuk phosphat dari NPK, TSP), mineral-mineral,
vitamin-vitamin (Harahap, 2003).
b. Keasaman (pH). Untuk fermentasi alkohol, yeast memerlukan
media suasana asam, yaitu antara pH 4,8-5,0. pH sangat berpengaruh dalam
proses fermentasi. Fermentasi di luar range pH tersebut dapat menghambat
pertumbuhan yeast dan cocok untuk pertumbuhan bakteri kontaminan (Harahap,
2003).
c. Suhu. Suhu optimum untuk pengembangbiakan mikrobia adalah pada
suhu 28-300C (Harahap, 2003). Di India dan negara-negara berkembang
10
lingkungan yaitu 25-350C. Suhu berpengaruh pada pertumbuhan, metabolisme,
kelangsungan organisme pemfermentasi dan proses fermentasi. Suhu
berpengaruh pada parameter kinetik fermentasi etanol melalui pengendapanyeast.
Suhu yang terlalu tinggi mengakibatkan penurunan jumlah etanol danyeast(Gaur,
2006). Pada waktu fermentasi, terjadi kenaikan panas. Oleh karena itu perlu
pendinginan supaya suhu dipertahankan tetap (Harahap, 2003).
d. Udara. Fermentasi alkohol berlangsung secara anaerob(tanpa udara).
Namun demikian udara diperlukan pada proses pembibitan sebelum fermentasi,
untuk pengembangbiakanyeast(Harahap, 2003).
3. Media fermentasi
Media yang digunakan untuk fermentasi harus dapat digunakan oleh sel
untuk pertumbuhan optimal sel dan pembentukan produk. Selain itu juga harus
dapat digunakan untuk pemeliharaan sel, dan untuk biosintesa. Oleh sebab itu
dalam formulasi media, komponen-komponen yang harus dipenuhi antara lain air
(sumber utama), sumber energi (sinar matahari), sumber karbon (glukosa, laktosa,
molase), sumber nitrogen (inorganik: NH3, garam ammonia (NH4Cl) atau nitrat
dan organik: asam amino, protein, urea), mineral (magnesium (Mg), phospor (P),
kalium (K), sulfur (S), kalsium (Ca)), vitamin, dan prekursor yang berfungsi
mempercepat terbentuknya produk (Hidayat dkk, 2006).
Syarat-syarat media fermentasi yang digunakan harus mudah didapat,
jumlahnya besar, harganya murah, bila diperlukan ada penggantinya. Media
fermentasi yang umum digunakan adalah molase, jerami, dedak, kulit kopi, kulit
Molase sebagai media fermentasi merupakan hasil samping industri gula.
Molase tebu kaya akan biotin, asam pantotenat, tiamin, fosfor, dan sulfur.
Mengandung 62% gula yang terdiri dari sukrosa 32%, glukosa 14%, dan fruktosa
16% (Hidayat dkk, 2006). Komposisi molase adalah sebagai berikut:
Tabel I. Komposisi molase (%)
Komponen Persentase (%)
Air 17-25
Sukrosa 30-40
Dekstrosa 4-9
Fruktosa 5-12
Gula reduksi lain 1-5
Karbohidrat lain 2-5
Abu 7-15
Senyawa nitrogen 2-6
Asam-asam non-nitrogen 2-8 Lilin, sterol, dan fosfolipid 0,1-1
Molase berbeda dengan bahan baku yang umum digunakan dalam
produksi alkohol seperti jagung dan kentang. Jagung dan kentang mengandung
karbohidrat yang disimpan sebagai pati sehingga harus mengalami perlakuan awal
dengan memasakkan dan kerja enzim untuk menghidrolisis pati menjadi gula
yang dapat difermentasi, sebaliknya karbohidrat dalam molase telah siap untuk
difermentasi tanpa perlakuan pendahuluan karena berbentuk gula (Hidayat dkk,
2006).
4. Yeast
Yeast termasuk fungi, tetapi dibedakan dari kapang karena bentuknya
uniseluler. Reproduksi vegetatif pada yeast terutama dengan cara pertunasan.
Yeastmemiliki ukuran yang bervariasi, yaitu dengan panjang 1-5 µm sampai
12
oval, silinder, ogival yaitu bulat panjang dengan salah satu ujung runcing
(Fardiaz,1992).
Gambar 2.Saccharomyces cerevisiae(Anonim, 2007)
Saccharomyces cerevisiaetermasuk jenis Saccharomycesyang berbentuk
bulat, oval, atau memanjang, dan mungkin membentuk pseudomiselium
(Fardiaz,1992). Saccharomyces cerevisiae merupakan salah satu sel yeast jenis
Saccharomyces yang paling popular dalam pengolahan makanan. Yeast ini telah
lama digunakan dalam industri wine dan bir. Yeast ini melakukan reproduksi
vegetatif dengan membentuk tunas. Sel berbentuk ellipsoid atau silinder. Dapat
membentuk pseudohifa tetapi hifa tidak bersepta. Yeast ini tidak mampu tumbuh
pada nitrat sebagai satu-satunya sumber nitrogen (Hidayat dkk, 2006).
Dalam industri fermentasi, mikrobia merupakan faktor utama, sehingga
harus memenuhi beberapa persyaratan.
a. Murni. Proses-proses tertentu harus menggunakan biakan murni (dari
satu strain tertentu) yang telah diketahui sifat-sifatnya. Untuk menjaga agar
biakan tetap murni dalam proses, maka kondisi lingkungan dijaga tetap steril.
b. Unggul. Pada kondisi fermentasi yang diberikan, mikrobia harus
dengan hasil yang besar. Sifat unggul yang ada harus dapat dipertahankan. Hal ini
berkaitan dengan kondisi proses yang diharapkan.
c. Stabil. Pada kondisi yang diberikan mikrobia harus memiliki
sifat-sifat yang tetap, tidak mengalami perubahan karena mutasi atau lingkungan.
d. Bukan pathogen. Mikrobia yang digunakan haruslah yang bukan
patogen bagi manusia maupun hewan, terkecuali untuk bahan kimia tertentu. Jika
digunakan, mikrobia patogen harus dijaga agar tidak menimbulkan akibat
samping pada lingkungan (Hidayat dkk, 2006).
C. Distilasi
Distilasi merupakan metode pemisahan zat-zat cair dari campurannya
berdasarkan perbedaan titik didih (Yazid, 2005). Terdapat beberapa macam
distilasi.
a. Distilasi sederhana. Distilasi sederhana digunakan untuk memisahkan
zat cair yang titik didihnya rendah, atau memisahkan zat cair dengan zat padat
atau minyak. Proses ini dilakukan dengan mengalirkan uap zat cair tersebut
melalui kondensor lalu hasilnya ditampung dalam suatu wadah (Anonim, 2008).
Pada proses distilasi sederhana, suatu campuran dapat dipisahkan bila zat-zat
penyusunnya memiliki perbedaan titik didih yang cukup tinggi (Yazid, 2005).
Distilasi campuran etanol-air akan menghasilkan distilat berupa campuran
azeotrop 95% alkohol-5% air. Suatu azeotrop ialah suatu campuran yang
mendidih pada suatu titik didih konstan, seakan-akan itu suatu senyawa murni
14
b. Distilasi bertingkat (fraksionasi). Proses ini digunakan untuk
komponen yang memiliki titik didih yang berdekatan. Pada dasarnya sama dengan
distilasi sederhana, hanya saja memiliki kondensor yang lebih banyak sehingga
mampu memisahkan dua komponen yang memiliki perbedaan titik didih. Pada
proses ini akan didapatkan substansi kimia yang lebih murni, kerena melewati
kondensor yang banyak (Anonim, 2008).
c. Distilasi azeotrop. Digunakan dalam memisahkan campuran
azeotrop (campuran campuran dua atau lebih komponen yang sulit di pisahkan),
biasanya dalam prosesnya digunakan senyawa lain yang dapat memecah ikatan
azeotroptsb, atau dengan menggunakan tekanan tinggi (Anonim, 2008).
d. Distilasi vakum (distilasi tekanan rendah). Distilasi ini digunakan
untuk zat yang tak tahan suhu tinggi atau rusak pada pemansan yang tinggi.
Sehingga dengan menurunkan tekanan maka titik didih juga akan menurun, maka
distilasi yang tadinya harus dilakukan pada suhu tinggi tetap dapat dilakukan pada
suhu rendah dengan menurunkan tekanan (Anonim, 2008).
e. Refluks / destruksi. Refluks / destruksi ini bisa dimasukkan dalam
macam-macam distilasi walau pada prinsipnya agak berlainan. Refluks dilakukan
untuk mempercepat reaksi dengan jalan pemanasan tetapi tidak akan mengurangi
jumlah zat yang ada. Dimana pada umumnya reaksi-reaksi senyawa organik
adalah “lambat” maka campuran reaksi perlu dipanaskan tetapi biasanya
pemanasan akan menyebabkan penguapan baik pereaksi maupun hasil reaksi.
Karena itu agar campuran tersebut reaksinya dapat cepat, dengan jalan pemanasan
D. Kromatografi Gas 1. Tinjuan umum
Kromatografi gas adalah suatu cara untuk memisahkan senyawa atsiri
dengan meneruskan arus gas melalui fase diam. Bila fase diam merupakan zat
padat disebut kromatografi gas-padat (KGP) sedangkan apabila fase diam berupa
zat cair disebut sebagai kromatografi gas-cair (KGC) (Nair, 1988).
2. Komponen-komponen kromatografi gas
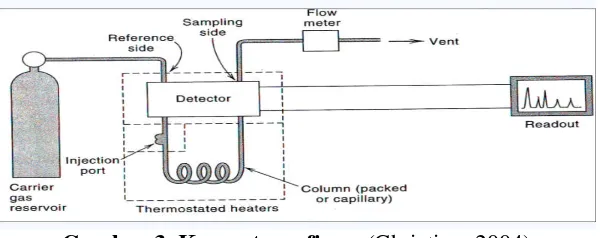
Komponen dasar kromatografi gas adalah suplai gas pembawa dengan
pengatur tekanan dan pengendali aliran, tempat atau katup injeksi dan
kemungkinan didukung dengan splitter, kolom pemisahan, detektor, oven yang
diatur secara termostatis yang juga dapat diprogram untuk berbagai tingkat
pemanasan, recorder atau alat pencatat yang lain (Dean, 1995).
Di bawah ini merupakan skema kromatografi gas:
Gambar 3. Kromatografi gas(Christian, 2004)
a. Gas pembawa. Syarat pemilihan gas pembawa adalah harus memiliki
sifat inert. Tujuan penggunaan gas pembawa adalah untuk membawa uap analit
melalui sistem kromatografi tanpa berinteraksi dengan komponen-komponen
sampel. Gas terdapat dalam silinder gas bertekanan tinggi dan harus bebas dari
16
adalah helium tetapi gas ini mahal. Sedangkan hidrogen merupakan salah satu gas
pembawa yang semakin banyak digunakan. Hidrogen dan helium memungkinkan
analisis yang lebih cepat dibandingkan gas pembawa pekat seperti nitrogen atau
argon. Kadang-kadang pemilihan gas pembawa ditentukan oleh detektor yang
digunakan (Dean, 1995).
b. Sistem injeksi sampel. Fungsi dari port injeksi adalah untuk
menyediakan jalan masuk untuksyringedan sampel ke dalam aliran gas pembawa
dan untuk menyediakan panas yang cukup untuk menguapkan sampel (Dean,
1995). Memasukkan sampel ke dalam tempat injeksi dengan menggunakan
microsyringemelaluiseptum plastic siliconyang elastis (Dean, 1995).
Dalam kromatografi gas, biasanya sampel cair diinjeksikan melalui blok
yang dipanaskan yang berfungsi untuk mengubah sampel cair menjadi fase gas
secara cepat (flash vaporization) tanpa mengalami dekomposisi atau fraksinasi.
Ruang flash vaporization dari port injeksi harus sekecil mungkin untuk
meningkatkan efisiensi. Dibutuhkan volume yang cukup untuk mendapatkan
penguapan dan pemuaian tiba-tiba dari sampel setelah penginjeksian (1µL
metanol menghasilkan 0,31 ml uap pada suhu 2000C dan 30 lb.in-1) (Dean, 1995).
c. Kolom. Pemisahan komponen sampel terjadi dalam packed atau
tubular column yang dilalui gas pembawa secara terus-menerus. Kolom
pemisahan terletak setelah tempat penginjeksian dan splitter sampel. Kolom
pemisahan berisi fase diam yang dapat berupa adsorben (GSC) atau cairan yang
didistribusikan pada permukaan partikel-partikel berdiameter kecil atau interior
alumunium), gelas atau fused silica (Dean,1995). Selektivitas dan efisiensi
merupakan faktor-faktor yang harus dipertimbangkan ketika memilih kolom
(Dean, 1995).
Kolom GC dapat dibagi dalam 3 kategori, yaitu Packed column,
Open-tubular column, Mikropacked column.
d. Fase diam. Pemilihan fase diam berdasarkan pada polaritasnya, sesuai
dengan prinsip “like dissolve like” yaitu fase diam polar akan berinteraksi dengan
senyawa polar dan juga sebaliknya (Christian, 2004).
Resolusi akan didapatkan jika komponen dalam sampel dapat ditahan
oleh fase diam. Retensi yang lebih lama dan selektif akan menghasilkan resolusi
yang baik. Pada kromatografi gas, gas pembawa yang inert tidak berperan dalam
selektivitas solute meskipun mempengaruhi resolusi. Selektivitas dapat divariasi
hanya dengan mengubah polaritas fase diam atau mengubah suhu kolom (Dean,
1995).
e. Detektor. Setelah melalui kolom, komponen sampel masuk dalam
detektor. Detektor harus memiliki karakteristik sebagai berikut : sensitivitas
tinggi, tingkat kebisingan rendah, respon linier pada rentang dinamik yang luas,
respon yang baik untuk semua kelas komponen organic, tidak sensitif pada variasi
aliran dan perubahan temperature, stabil dan kuat, operasi yang sederhana (Dean,
1995).
Terdapat berbagai jenis detektor yaitu: Thermal Conductivity Detector
(TCD), Flame-Ionization Detector (FID), Thermionic Ionization (NP) Detector,
18
Photoionization Detector, Electrolytic Conductivity Detector, dan
Chemiluminescence-Redox Detector(Dean, 1995).
Flame-Ionization Detector (FID) adalah detektor yang paling popular
karena memiliki sensitivitas yang tinggi (0,02 coulomb (C) per g hidrokarbon).
Respon Flame-Ionization Detector proposional terhadap gugus –CH2- yang
memasuki nyala. Respon terhadap karbon yang terikat pada gugus hidroksil dan
amin lebih rendah. Respon tidak terjadi untuk karbon teroksidasi penuh seperti
gugus karbonil atau karboksil dan gugus ether. Detektor ini tidak sensitif terhadap
kelembaban dan gas-gas permanen. Hal ini memberi keuntungan untuk analisis
sampel organik yang lembab dan polusi udara. Perubahan yang tidak begitu besar
pada aliran, tekanan, atau temperatur hanya berefek kecil terhadap karakteristik
respon yang dihasilkan. Suhu kolom yang digunakan dapat bervariasi 100-4200C,
hal ini menguntungkan bagi analisis dengan suhu terprogram (Dean, 1995).
f. Pengaturan suhu. Suhu harus dimonitor, disesuaikan dan diatur pada
tempat injeksi, di dalam oven mengelilingi kolom dan pada detektor (Dean, 1995).
Suhu injeksi harus relatif tinggi, konsisten dengan stabilitas suhu sampel, untuk
memberikan kecepatan penguapan yang cepat agar sampel masuk kolom dalam
volume kecil sehingga pelebaran dapat diturunkan dan hasil resolusi dapat
ditingkatkan. Suhu injeksi yang terlalu tinggi akan menurunkan kualitas rubber
septumdan menyebabkan tempat injeksi kotor. Suhu kolom berhubungan dengan
kecepatan, sensitivitas, dan resolusi. Pada suhu kolom yang tinggi, komponen
sampel akan keluar dalam bentuk fase gas dan juga akan terelusi dengan cepat,
lambat keluar dari fase diam dan terelusi lambat, resolusi meningkat tetapi
sensitivitas menurun disebabkan oleh adanya pelebaran kurva. Suhu detektor
harus cukup tinggi untuk mencegah kondensasi komponen sampel (Christian,
2004).
E. Metode Desain Faktorial 1. Tinjauan umum
Desain faktorial merupakan aplikasi persamaan regresi yaitu teknik untuk
memberikan model hubungan antara variabel respon dengan satu atau lebih
variabel bebas. Model yang diperoleh dari analisis tersebut berupa persamaan
matematika (Bolton, 1997). Desain faktorial digunakan dalam penelitian di mana
efek dari faktor atau kondisi yang berbeda dalam penelitian ingin diketahui
(Bolton, 1997).
Penelitian desain faktorial dimulai dengan menentukan faktor dan level
yang akan diteliti, serta respon yang akan diukur. Respon yang diukur harus dapat
diekspresikan secara numerik. Deskripsi sifat (seperti besar, lebih besar, terbesar)
dan nomor urut (seperti menunjukan respon terbesar adalah 1, selanjutnya 2, dan
seterusnya) tidak dapat digunakan (Armstrong and James, 1996). Respon yang
diukur harus dapat dikuantitatifkan (Bolton, 1997).
2. Desain faktorial tiga level (3k)
Desain penelitian tiga level adalah suatu rancangan faktorial yang terdiri
20
menengah dan level tinggi. Desain faktorial ini juga disebut desain faktorial 3k
dengan jumlah percobaan sebanyak 3k. Penggunaan rancangan desain faktorial 3k
ini biasanya untuk menyelesaikan masalah optimasi (Montgomery, 1997).
Notasi-notasi yang digunakan dalam desain faktorial ini adalah
a. level rendah dinotasikan dengan -1 atau (-) atau 0,
b. level menengah dinotasikan dengan 0 atau 1,
c. level tinggi dinotasikan dengan +1 atau (+) atau 2 (Montogomery, 1997).
Pada desain faktorial tiga level dan dua faktor diperlukan sembilan
percobaan (3k = 9, dengan 3 menunjukkan level dan k menunjukkan jumlah
faktor). Rancangan percobaan desain faktorial dengan dua faktor dan tiga level
seperti tabel II berikut :
Tabel II. Rancangan percobaan desain faktorial dengan dua faktor dan tiga level
Faktor A Faktor B
0 1 2
0 00 10 20
1 01 11 21
2 02 12 22
Keterangan :
0 = level rendah 1 = level menengah 2 = level tinggi
Rumusan yang berlaku :
Y = b0+ b1(XA) + b2(XB) + b12(XA)(XB)...(2)
Dengan :
Y = respon hasil atau sifat yang diamati
b0, b1, b2, b12 = koefisien, dapat dihitung dari hasil percobaan (Armstrong and
James, 1996; Bolton, 1997).
Dari rumus dan data yang diperoleh dapat dibuat contour plot suatu
respon tertentu yang sangat berguna dalam memilih komposisi yang optimum.
Besarnya efek dapat dicari dengan menghitung selisih antara rata-rata respon pada
level tinggi dan rata-rata respon pada level rendah (Bolton, 1997).
F. Landasan Teori
Fermentasi merupakan proses pemecahan karbohidrat dan asam amino
secara anaerob, yaitu tanpa memerlukan oksigen. Senyawa yang dapat dipecah
dalam proses fermentasi terutama adalah karbohidrat sedangkan asam amino
hanya dapat difermentasi oleh beberapa jenis bakteri tertentu.
Fermentasi dapat berlangsung menggunakan molase sebagai media
fermentasi. Molase dapat digunakan sebagai media fermentasi karena molase
mengandung sukrosa, dekstrosa, asam-asam non-nitrogen, gula reduksi lain,
karbohidrat lain, senyawa nitrogen, fruktosa. Dalam fermentasi diperlukan pula
mikrobia sebagai biokatalis, yaituS. cerevisiae.Reaksi dalam fermentasi
berbeda-beda tergantung pada jenis gula yang digunakan dan produk yang dihasilkan.
Secara singkat, glukosa (C6H12O6) yang merupakan gula paling sederhana,
melalui fermentasi akan menghasilkan etanol (2C2H5OH). Reaksi fermentasi ini
22
Proses fermentasi tersebut dipengaruhi oleh beberapa faktor, antara lain
suhu, konsentrasi molase dan pH. Oleh karena itu dilakukan fermentasi dalam
berbagai variasi konsentrasi molase dan pH.
Dari hasil fermentasi tersebut didapatkan hasil fermentasi berupa etanol
dan komponen-komponen lain. Hasil fermentasi yang diperoleh distilasi untuk
memisahkan etanol hasil fermentasi. Prinsip kerja distilasi adalah pemisahan
senyawa-senyawa berdasarkan titik didihnya. Penetapan kadar etanol dilakukan
dengan metode kromatografi gas karena etanol adalah senyawa yang mudah
menguap.
G. Hipotesis
Terdapat area optimum kondisi fermentasi yaitu konsentrasi molase dan
pH) pada contour plot yang diprediksikan menghasilkan kadar etanol yang
23
A. Jenis dan Rancangan Penelitian
Penelitian berjudul Optimasi Konsentrasi Molase dan pH terhadap
Produksi Etanol Hasil Fermentasi pada Suhu 280C olehSaccharomyces cerevisiae
termasuk penelitian kuasi eksperimental.
B. Variabel Penelitian dan Definisi Operasional 1. Variabel penelitian
a. Variabel bebas dalam penelitian ini adalah pH media fermentasi,
konsentrasi molase untuk fermentasi.
b. Variabel tergantung dalam penelitian ini adalah kadar etanol yang
dihasilkan.
c. Variabel pengacau terkendali dalam penelitian ini adalah suhu fermentasi
yang dikendalikan pada suhu 280C, jumlah S. cerevisiae yang
dikendalikan dengan pengambilan sebanyak 3 ose dan etanol hasil
fermentasi yang menguap selama penyimpanan sebelum penetapan kadar
etanol menggunakan kromatografi gas.
2. Definisi operasional
a. Molase atau tetes tebu adalah hasil samping PG Madukismo yang menjadi
24
sukrosa, dekstrosa, fruktosa, gula reduksi, karbohidrat lain, abu, senyawa
nitrogen, asam-asam non-nitrogen.
b. Optimasi produksi adalah suatu proses pengkondisian pertumbuhan S.
cerevisiae untuk tumbuh dan melakukan fermentasi dalam kondisi yang
paling ideal sehingga diperoleh alkohol dengan kualitas yang lebih baik.
c. S. cerevisiaemerupakan mikrobia yang potensial dalam proses fermentasi
untuk memproduksi alkohol (etanol). S. cerevisiae merupakan yeast
berbentuk oval dan membentuk tunas (budding).
d. 0
Brix merupakan zat padat semu yang terlarut (dalam gram) di dalam 100
gram larutan.
e. Kadar etanol hasil fermentasi dari molase oleh S. cerevisiae dinyatakan
dengan satuan %v/v.
C. Bahan Penelitian
Bahan yang digunakan dalam penelitian ini adalah molase (tetes tebu)
dari PG Madukismo Yogyakarta sebagai bahan dasar produksi alkohol, Kultur
S. cerevisiae dari PS Madukismo Yogyakarta, pupuk nitrogen phosphor kalium
(NPK), pupuk urea, H2SO4, NH4OH, etanol p.a. (Merck), n-butanol p.a. (Merck),
heksan p.a. (Merck), etanol 70%, aquadest.
D. Alat Penelitian
Alat-alat yang digunakan dalam penelitian adalah seperangkat alat
Cabinet), seperangkat alat distilasi, seperangkat alat kromatografi gas (HP 5890)
denganFlame Ionization Detector(FID) dan alat-alat gelas yang digunakan untuk
penelitian di laboratorium analisis.
E. Tata Cara Penelitian 1. Pengambilan sampel
Penelitian ini menggunakan sampel molase yang diambil dari PG-PS
Madukismo. Pengambilan molase sebanyak 10 liter dalam satu kali pengambilan.
Hal ini bertujuan untuk mewakili kondisi molase yang ada di PG-PS Madukismo
dan untuk menjamin homogenitas kandungan molase yang akan digunakan dalam
penelitian.
2. Pembuatan larutan molase
Larutan molase dengan konsentrasi 14ºBrix dibuat dengan cara 164,0 ml
molase dari PS Madukismo dimasukkan dalam Erlenmeyer 1000,0 ml kemudian
diencerkan menggunakan aquadest hingga mencapai tanda. Larutan tersebut
disaring dan disterilisasi menggunakan autoklaf pada suhu 121ºC selama 15
menit. Dalam larutan ditambahkan 0,44 mg urea dan 0,34 mg NPK. Larutan
diaduk hingga homogen kemudian ditambahkan H2SO4hingga pH 4,5.
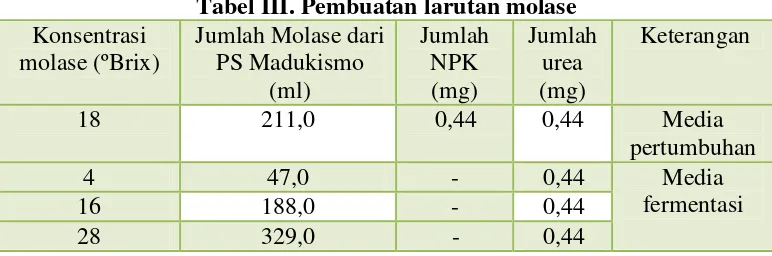
Pembuatan larutan molase dengan konsentrasi 4ºBrix, 16ºBrix, 18ºBrix
dan 28ºBrix dibuat dengan cara yang sama seperti pembuatan larutan molase
26
Tabel III. Pembuatan larutan molase Konsentrasi
molase (ºBrix)
Jumlah Molase dari PS Madukismo (ml) Jumlah NPK (mg) Jumlah urea (mg) Keterangan
18 211,0 0,44 0,44 Media
pertumbuhan
4 47,0 - 0,44
16 188,0 - 0,44
28 329,0 - 0,44
Media fermentasi
3. Tahap produksi alkohol olehS. cerevisiae
a. Pertumbuhan S. cerevisiae. Lima belas ml larutan molase 14ºBrix
dan 15 ml larutan molase 18ºBrix dimasukkan dalam Erlenmeyer 100,0 ml
kemudian diinokulasikan kultur murni S. cerevisiae dari PS Madukismo
Yogyakarta. Perlakuan ini dilakukan di dalam MSC (Microbilogy Safety
Cabinet). Erlenmeyer diinkubasi dalamshaker incubator150 rpm pada suhu 30ºC
selama 49,5 jam (Melati, 2008).
b. Fermentasi. Setelah pertumbuhan S. cerevisiae mencapai fase
stasioner (49,5 jam), isi Erlenmeyer dipindahkan dalam labu alas bulat 100,0 ml.
Ditambahkan 60,0 ml larutan molase 4ºBrix. pH diatur hingga mencapai 4,5
dengan penambahan H2SO4 atau NH4OH. Labu alas bulat tersebut dirangkai
dalam fermentor (Gambar 4). Selanjutnya fermentor diinkubasi dalam inkubator
Gambar 4. Fermentor(Jeffers, 2000)
Tahap fermentasi dilakukan dalam berbagai variasi konsentrasi molase
dan pH (tabel IV).
Tabel IV. Variasi konsentrasi molase dan pH Faktor Fermentasi Konsentrasi molase pH
1 4
2 4,5
3
8ºBrix
5
4 4
5 4,5
6
16ºBrix
5
7 4
8 4,5
9
24ºBrix
5
c. Distilasi hasil fermentasi. Hasil fermentasi yang telah diperoleh
kemudian difiltrasi menggunakan corong Buchner dengan bantuan pompa
penghisap. Filtrat yang diperoleh didistilasi menggunakan waterbath selama 4
28
4. Penetapan kadar etanol hasil fermentasi olehS. cerevisiae a. Optimasi Metode kromatografi Gas
1) Pemilihan kolom dan detektor
Kolom yang digunakan adalah CP-WAX-52 CB yang merupakan
kolom polar. Detektor yang digunakan adalah FID karena memiliki
sensitifitas yang tinggi terhadap senyawa-senyawa organik termasuk
etanol.
2) Optimasi suhu injector, kolom dan detektor
Pengaturan suhu injektor dan detektor dimulai pada suhu 100C di atas
titik didih n-butanol, yaitu 220C. Sedangkan pengaturan suhu kolom
dimulai pada suhu 50C di atas titik didih n-butanol, yaitu 120C.
3) Optimasi kecepatan aliran gas pembawa N2
Kecepatan aliran gas pembawa diatur dengan mengubah column head
pressure. Optimasi tekanan dilakukan pada tekanan awal 6 psi
kemudian diatur hingga diperoleh pemisahan yang baik antara
komponen-komponen sampel.
4) Optimasi aliran gas pembawa H2dan O2
Perbandingan kecepatan aliran gas H2 dan O2 adalah 2:1. Hal ini
dilakukan untuk menghasilkan nyala yang stabil pada detektor.
b. Validasi metode kromatografi gas
1) Pembuatan seri larutan baku etanol
Seri baku dengan konsentrasi berikut (tabel V) dibuat dalam labu ukur
kemudian ditambahkan heksan hingga mencapai 5,0 ml. Replikasi 3
kali.
Tabel V. Pembuatan seri larutan baku etanol Etanol p.a (ml) n-butanol (ml) Kadar etanol
(%v/v)
0,01 0,02 0,2
0,07 0,02 1,4
0,13 0,02 2,6
0,19 0,02 3,8
0,25 0,02 5,0
2) Penetapan seri kurva baku etanol
Satu mikroliter (1l) larutan baku dari masing-masing konsentrasi
disuntikkan ke dalam kolom melalui tempat injeksi. Pada waktu 400
detik proses elusi dihentikan. Luas puncak etanol dan n-butanol dari
kromatogram dihitung, kemudian dicari rasio luas puncak
etanol/n-butanol. Kurva baku dibuat dengan memplotkan rasio luas puncak
etanol/n-butanol vs kadar etanol (% v/v). Persamaan kurva baku dicari
dengan regresi linear.
3) Penentuan akurasi dan presisi
Larutan dengan konsentrasi berikut (tabel VI) dibuat dalam labu ukur
5,0 ml.
Tabel VI. Pembuatan larutan untuk penentuan akurasi dan presisi Etanol p.a (ml) n-butanol (ml) Kadar etanol
(% v/v)
0,01 0,02 0,2
0,13 0,02 2,6
30
Etanol dan n-butanol dimasukkan dalam labu ukur 5,0 ml kemudian
ditambahkan heksan hingga mencapai 5,0 ml. Replikasi 3 kali.
Diinjeksikan dalam kolom injeksi kromatografi gas.
c. Penetapan kadar etanol dalam sampel
Dalam labu ukur 5,0 ml dimasukkan 0,5 ml distilat dan 20,0l n-butanol
kemudian ditambahkan heksan hingga mencapai tanda. Larutan tersebut
diinjeksikan ke dalam kolom melalui tempat injeksi. Proses kromatografi
menghasilkan luas puncak kromatografi. Luas puncak etanol dan n-butanol
kromatogram dihitung, kemudian dicari rasio luas puncak etanol dan n-butanol.
Kadar etanol hasil fermentasi ditentukan menggunakan persamaan kurva baku.
F. Analisis Hasil 1. Uji ANOVA
Uji ini dilakukan untuk mengetahui apakah terdapat perbedaan kadar
etanol yang dihasilkan pada kondisi fermentasi (konsentrasi molase dan pH)
yang berbeda.
2. Desain Faktorial
Metode ini dilakukan untuk mengetahui area optimum kondisi
fermentasi (konsentrasi molase dan pH) yang diprediksikan menghasilkan
31
A. Pengambilan sampel
Sampel yang digunakan dalam penelitian ini adalah molase yang diambil
dari Pabrik Gula dan Alkohol/Spiritus Madukismo (PG-PS Madukismo)
Yogyakarta. Sampel diambil sebanyak 10 liter dalam satu kali pengambilan.
Tujuan dari pengambilan sebanyak 10 liter dalam satu kali pengambilan untuk
mewakili kondisi molase yang ada di PG-PS Madukismo. Dalam penelitian ini,
molase yang digunakan berasal dari pengambilan molase yang sama untuk
menjamin homogenitas kandungan molase. Konsentrasi molase yang diambil
adalah 85,230Brix. Molase tersebut diencerkan sesuai dengan konsentrasi yang
akan digunakan untuk media pertumbuhan dan media fermentasi.
B. Fermentasi
Penelitian ini diawali dengan tahap pertumbuhan S. cerevisiae pada
konsentrasi molase 14⁰Brix dan 18⁰Brix pada suhu 30⁰C selama 49,5 jam.
Pemilihan konsentrasi molase dan lama inkubasi ini sesuai dengan penelitian yang
telah dilakukan oleh Melati (2008). S. cerevisiae yang digunakan merupakan
kultur murniS. cerevisiaeyang didapatkan dari hasil penelitian Estelita (2008).
Setelah tahap pertumbuhan S. cerevisiae selanjutnya dilakukan
fermentasi dengan menambahkan media hingga konsentrasi molase menjadi
32
yang telah dilakukan oleh Harahap (2003) yang menyatakan bahwa fermentasi
dapat dilakukan pada konsentrasi molase 24⁰Brix sedangkan konsentrasi molase
8⁰Brix dan 16⁰Brix didapatkan dari hasil orientasi.
Molase dapat digunakan sebagai media fermentasi karena molase
mengandung sukrosa, dekstrosa, asam-asam non-nitrogen, gula reduksi lain,
karbohidrat lain, senyawa nitrogen, fruktosa. Kandungan dalam molase tersebut
dapat diubah menjadi etanol dan karbondioksida oleh S. cerevisiae. Reaksi yang
terjadi melalui 2 tahap yaitu reaksi hidrolisa oleh enzim invertase dan reaksi
fermentasi oleh enzim zymase. Enzim invertase dan enzim zymase merupakan
enzim yang dihasilkan olehS. cerevisiae.Reaksi yang terjadi adalah
1. reaksi hidrolisa
C12H22O11 + H2O 2C6H12O6……….………(3)
sukrosa glukosa dan fruktosa
2. reaksi fermentasi
C6H12O6 2C2H5OH + CO2……….(4)
glukosa dan fruktosa etanol gas karbondioksida
Proses fermentasi dapat terjadi dalam medium yang mengandung
sukrosa, garam ammonium, buffer fosfat, dan mineral yang lain dengan bantuan
S. cerevisiae. S. cerevisiae akan menghasilkan invertase yang berfungsi sebagai
katalis yang akan menghidrolisis sukrosa menjadi glukosa dan fruktosa.
mungkin terjadi jika enzim zymase dikeluarkan menuju ke dalam media sehingga
fermentasi dapat terjadi.
Optimasi pH dilakukan pada pH 4; 4,5 dan 5 karena berdasarkan
penelitian Harahap (2003) fermentasi dapat berlangsung pada suhu 4-5. Molase
untuk fermentasi memiliki pH + 4,5 sehingga perlu pengaturan pH untuk
mendapatkan pH yang diinginkan. Pengaturan pH dilakukan dengan penambahan
H2SO4 untuk mendapatkan pH 4 dan NH4OH untuk mendapatkan pH 5.
Pengaturan pH dilakukan dengan penambahan H2SO4 atau NH4OH karena
senyawa tersebut mengandung unsur-unsur yang diperlukan oleh S. cerevisiae
sebagai sumber nutrisi untuk menunjang pertumbuhan sel. Selain H2SO4 atau
NH4OH sebagai sumber nutrisi ditambahkan pula pupuk urea dan NPK.
Fermentasi dilakukan pada suhu 280C karena menurut Gaur (2006)
fermentasi menggunakan media molase dilakukan pada suhu lingkungan 25-350C.
Pada saat fermentasi berlangsung akan terjadi kenaikan panas karena reaksi terjadi
secara eksoterm. Reaksi yang terjadi adalah
C6H12O6→ 2C2H5OH + 2CO2+ 2 ATP (Energi yang dilepaskan:118 kJ per mol)
Gula (glukosa, fruktosa, atau sukrosa) → Alkohol (etanol) + Karbondioksida + 2
ATP (Energi)……….………(5)
Untuk mencegah agar suhu fermentasi tidak naik maka selama inkubasi labu alas
bulat dimasukkan dalam bekerglass yang berisi air.
Pada saat fermentasi dihasilkan karbondioksida. Karbondioksida ini harus
dikeluarkan dari medium fermentasi karena karbondioksida dapat bereaksi dengan
34
CO2 + H2O H2CO3
………...…….(6)
karbondioksida asam karbonat
Asam karbonat yang dihasilkan dapat menurunkan pH medium fermentasi. pH
medium fermentasi yang semakin rendah dapat membuat S. cerevisiae mati
karena S. cerevisiae hidup pada pH 4-5. Hal ini dihindari dengan cara
menggunakan larutan Ca(OH)2 jenuh yang dirangkai dalam fermentor.
Karbondioksida yang dihasilkan dari fermentasi akan masuk dalam larutan
Ca(OH)2jenuh menjadi endapan CaCO3. Reaksi yang terjadi adalah
CO2 + Ca(OH)2 CaCO3
karbondioksida kalsium hidroksida endapan kalsium karbonat…...…..(7)
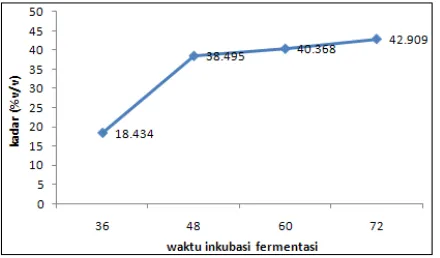
Penentuan waktu inkubasi fermentasi berdasarkan hasil optimasi.
Optimasi dilakukan pada jam ke- 36, 48, 60 dan 72. Hasil optimasi waktu
inkubasi fermentasi ditunjukkan pada gambar 5.
Gambar 5. Grafik waktu inkubasi fermentasi terhadap kadar etanol Grafik waktu inkubasi fermentasi terhadap kadar etanol menunjukkan
bahwa semakin lama waktu inkubasi fermentasi maka kadar etanol yang
dihasilkan semakin tinggi. Namun semakin lama waktu inkubasi, peningkatan
terlalu besar sehingga optimasi waktu inkubasi hanya dilakukan selama 72 jam
untuk efisiensi waktu. Berdasarkan data tersebut maka fermentasi dilakukan
selama 72 jam.
Fermentasi dilakukan dalam kondisi anaerob karena fermentasi ini
menggunakan S. cerevisiae yang dapat melakukan fermentasi alkohol dalam
kondisi anaerob. Pada kondisi aerob S. cerevisiae akan melakukan respirasi
sehingga tidak dihasilkan alkohol.
C. Distilasi
Hasil dari fermentasi didistilasi untuk memisahkan etanol hasil
fermentasi dari larutan molase. Prinsip distilasi adalah pemisahan dua atau lebih
cairan dalam larutan berdasarkan perbedaan titik didihnya. Distilasi yang
digunakan adalah distilasi sederhana karena etanol memiliki titik didih yang
rendah (780C). Distilasi dilakukan selama 4 jam. Penentuan waktu distilasi
merupakan hasil orientasi. Distilat yang diperoleh berupa campuranazeotropyang
menyebabkan alkohol dan air sukar untuk dipisahkan. Untuk mendapatkan
konsentrasi yang lebih tinggi lagi maka dapat dilakukan distilasi fraksinasi.
Sisa distilat atau residu yang tertinggal dalam labu alas bulat disebut
stillage. Residu ini masih banyak mengandung bahan-bahan organik yang tidak
36
D. Optimasi Kromatografi Gas
Optimasi kromatografi gas bertujuan untuk mendapatkan kondisi
optimum instrument kromatografi gas sehingga didapatkan pemisahan senyawa
yang sempurna. Parameter yang menunjukkan bahwa kondisi kromatografi gas
telah optimum adalah resolusi. Optimasi dilakukan menggunakan larutan yang
mengandung etanol (senyawa yang akan ditetapkan konsentrasinya), butanol
(baku internal) dan heksan (pelarut). Dalam penelitian ini digunakan baku internal
dengan tujuan sebagai faktor koreksi volume larutan yang masuk dalam loop
injektor.
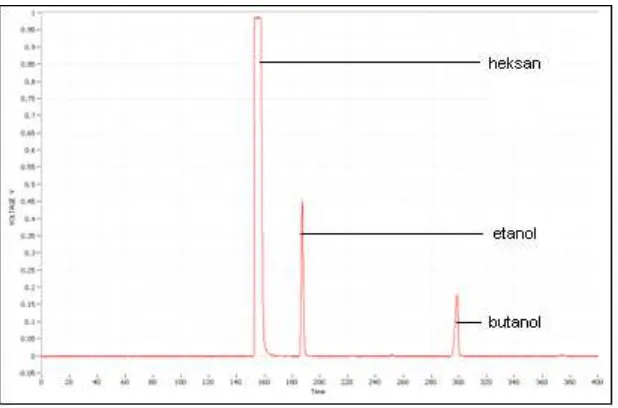
Pemisahan senyawa yang terjadi pada kondisi kromatografi gas yang
optimum adalah
Gambar 6. Hasil optimasi kromatografi gas
Pemisahan optimum jika resolusi pemisahan 1,5. Hasil optimasi
menunjukkan bahwa pemisahan antara heksan dan etanol memiliki resolusi
sebesar 2,5 sedangkan pemisahan antara etanol dan n-butanol memiliki resolusi
sehingga dapat memisahkan senyawa dengan sempurna, namun pemisahan ini
kurang efisien karena resolusi yang dihasilkan terlalu tinggi. Resolusi yang terlalu
tinggi menyebabkan waktu retensi senyawa semakin lama.
Hasil optimasi kromatografi gas:
Suhu injektor : 2200C
Suhu kolom : 700C
Suhu detektor : 2200C
Jenis detector : FID
Jenis kolom : CP-WAX-52 CB
Tipe kolom :WCOT Fused Silica
Column Head Pressure : 25 Kpa
Tekanan udara : 2.9 bar
Tekanan H2 : 1.4 bar
Tekanan N2 : 0.1 bar
Kecepatan gas total : 302 ml/menit
Kecepatan gas H2 : 32.2 ml/menit
Kecepatan gas udara : 272 ml/menit
Range : 1
Split vent : 15,2
Purge vent : 0,49
Pada penelitian ini suhu injektor yang digunakan adalah 2200C. Hal ini
bertujuan agar sampel yang diinjeksikan dapat langsung menguap dan masuk ke
38
menjaga agar sampel tertambat di kolom. Sedangkan suhu detektor yang
digunakan adalah 2200C dengan tujuan untuk mencegah terjadinya kondensasi
uap air yang dapat menimbulkan penurunan sensitivitas.
Jenis detektor yang digunakan FID karena FID memiliki sensitivitas yang
sangat baik untuk senyawa hidrokarbon. Jenis kolom yang digunakan
CP-WAX-52CB dengan tipe kolom WCOT fused silicayang di dalamnya mengandung fase
diam polietilenglikol. Jenis kolom yang digunakan bersifat polar karena etanol
bersifat polar sehingga digunakan fase diam yang bersifat polar agar terjadi
interaksi antara fase diam dan sampel sehingga sampel dapat tertambat dalam fase
diam dan dapat memberikan waktu retensi tertentu. Interaksi yang terjadi antara
fase diam dengan etanol dan butanol adalah
Gambar 7. Interaksi fase diam dengan etanol dan butanol
Interaksi antara etanol dan butanol dengan fase diam dapat menghasilkan
waktu retensi yang berbeda-beda tergantung polaritas dan titik didih senyawa,
sedangkan heksan tidak berinteraksi dengan fase diam karena heksan merupakan
senyawa non-polar. Waktu retensi merupakan salah satu analisis kualitatif yang
dapat digunakan untuk mengidentifikasi senyawa yang keluar. Waktu retensi
etanol dapat diketahui dengan cara membandingkan waktu retensi larutan yang
heksan dapat diketahui dengan melihat kedua kurva lain yang muncul pada
kromatogram yang memiliki luas area yang sama. Pada kondisi optimum
kromatografi gas dihasilkan pemisahan sebagai berikut:
Gambar 8a Gambar 8b
Gambar 8. Hasil pemisahan heksan, etanol dan butanol
Gambar 8a merupakan kurva pemisahan larutan etanol dengan
konsentrasi 0,2% sedangkan gambar 8b merupakan kurva pemisahan larutan
etanol dengan konsentrasi 2,6%. Kurva ke 2 pada gambar 8a lebih rendah
daripada gambar 8b, hal ini menunjukkan kurva ke 2 merupakan kurva etanol.
Berdasarkan data tersebut diketahui etanol memiliki waktu retensi 190 detik.
Etanol bersifat lebih polar dibandingkan butanol sehingga etanol akan
lebih tertambat pada fase diam dan memiliki waktu retensi lebih lama
dibandingkan dengan butanol, namun dari gambar 8 diketahui bahwa waktu
retensi butanol lebih lama. Hal ini disebabkan karena waktu retensi tidak hanya
dipengaruhi oleh interaksi fase diam dan senyawa namun juga dipengaruhi oleh
titik didih. Titik didih etanol lebih rendah dibandingkan butanol sehingga etanol
akan lebih mudah menjadi gas dan keluar lebih dulu. Heksan memiliki titik didih
yang lebih rendah dibandingkan etanol sehingga heksan akan keluar lebih dulu.
Dari gambar 7 diketahui waktu retensi heksan 160 detik, etanol 190 detik dan
40
E. Validasi Metode Kromatografi Gas
Validasi metode bertujuan untuk menjamin bahwa metode pengujian
yang digunakan benar dan dapat dipercaya di bawah kondisi metode yang
diterapkan.
1. Pembuatan kurva baku
Pembuatan kurva baku bertujuan untuk memperoleh persamaan garis
regresi yang selanjutnya digunakan untuk menetapkan kadar etanol hasil
fermentasi. Dalam penelitian ini digunakan etanol p.a sebagai baku etanol dan
butanol sebagai baku internal.
Hasil pengukuran seri kurva baku dapat adalah sebagai berikut:
Tabel VII. Kurva baku etanol dengan standar internal n-butanol
Replikasi I Replikasi II Replikasi III
Kadar etanol (%v/v) Kadar etanol (%v/v) Kadar etanol (%v/v)
0,2 0,257 0,2 0,297 0,2 0,247
1,4 1,41 1,4 1,415 1,4 1,327
2,6 2,59 2,6 2,491 2,6 2,437
3,8 3,762 3,8 3,4 3,8 3,242
5 5,18 5 5,156 5 5,007
Keterangan : Replikasi I : A = -0,0031; B = 1,0165; r = 0,9991 Replikasi II : A = 0,01615; B = 0,97525; r = 0,9933 Replikasi III : A = -0,0256; B = 0,9529; r = 0,9923
Ketiga seri kurva baku tersebut memiliki nilai koefisien korelasi (rhitung)
yang lebih besar dari harga rtabel. Harga rtabel dengan taraf kepercayaan 95%, df =
2 adalah 0,95. Hal ini menunjukkan bawa ketiga seri kurva baku tersebut memiliki
linearitas yang baik dan dapat digunakan untuk penetapan kadar etanol. Pada
pertama dengan persamaan Y = 1,0165 X-0,0031 karena memiliki harga koefisien
korelasi yang paling besar yaitu r = 0,9991.
Hubungan antara kadar etanol dengan AUC etanol/AUC butanol dapat
dilihat pada gambar 9.
Gambar 9. Hubungan antara kadar etanol dan AUC etanol/AUC butanol
2. Penentuan akurasi dan presisi
Penentuan akurasi dan presisi digunakan sebagai parameter validitas
untuk mengetahui validitas metode yang digunakan. Akurasi dari suatu metode
analisis dinyatakan sebagai persen perolehan kembali (recovery) sedangkan
presisi dinyatakan dalam CV.
Penentuan akurasi dan presisi menggunakan seri konsentrasi 0,2; 2,6 dan
42
Tabel. VIII. Hasil penentuan akurasi dan presisi Konsentrasi
terhitung (%v/v)
Konsentrasi terukur
(%v/v)
Rata-rata Recovery (%) Rata-rata Recovery (%) CV (%)
0,2 0,219 109,5
0,2 0,21 105
0,2 0,214
0,214
107
107,167 2,107
2,6 2,511 96,577
2,6 2,535 97,5
2,6 2,533
2,526
97,423
96,833 0,527
5,0 5,064 101,28
5,0 5,128 102,56
5,0 5,131
5,108
102,62
102,153 0,741
Menurut Harmita, recovery yang baik berada pada rentang 98-102%.
Hasil perhitungan recovery menunjukkan hasil recovery pada penelitian ini
memenuhi syarat recovery yang baik untuk penetapan kadar etanol dengan
konsentrasi 5%. Kesalahan acak (CV) yang baik kurang dari 2%. Hasil
perhitunganCV menunjukkan bahwa konsentrasi 0,2%; 2,6% dan 5% memenuhi
syaratCVyang baik.
F. Penetapan Kadar etanol Hasil Fermentasi
Distilat yang diperoleh dari hasil distilasi ditetapkan konsentrasinya
dengan menggunakan kromatografi gas. Preparasi sampel dilakukan dengan cara
melarutkan distilat dalam heksan. Heksan digunakan untuk melarutkan sampel
karena etanol larut dalam heksan. Hasil penetapan kadar etanol hasil fermentasi
Gambar 10. Hasil penetapan kadar etanol hasil fermentasi
Berdasarkan gambar 10 diketahui waktu retensi kurva kromatografi gas
penetapan kadar etanol hasil fermentasi sama dengan waktu retensi pada kurva
kromatografi gas seri kurva baku yaitu + 190 detik. Hal ini menunjukkan sampel
yang mengandung hasil fermentasi berupa etanol.
Hasil penetapan kadar etanol hasil fermentasi adalah
Tabel IX. Hasil penetapan kadar etanol hasil fermentasi pH
konst. molase
4 4.5 5
8 11,686±2,836 15,794±3,814 7,192±1,682 16 16,473±4,503 34,612±6,850 22,912±3,494 24 30,935±2,.908 46,623±2,810 24,223±2,675
Berdasarkan hasil kadar etanol yang diperoleh dapat dibuat grafik
44
Gambar 11a Gambar 11b
Gambar 11. Hubungan konsentrasi molase (a) dan pH (b) terhadap kadar etanol
Berdasarkan gambar 11a dapat diketahui bahwa pada pH 4; 4,5 maupun 5
kadar etanol tertinggi didapatkan pada konsentrasi molase 240Brix. Dengan
demikian dapat disimpulkan bahwa dengan adanya peningkatan konsentrasi
molase maka kadar etanol yang dihasilkan juga akan semakin besar, namun
konsentrasi molase yang terlalu tinggi dapat menghambat aktivitas S. cerevisiae
sehingga alkohol yang dihasilkan tidak optimum.
Berdasarkan gambar 11b dapat diketahui bahwa pada konsentrasi molase
8, 16, 240Brix kadar etanol tertinggi didapatkan pada pH 4,5. Dengan demikian
dapat disimpulkan bahwa fermentasi dapat berjalan optimal pada pH 4,5.
Dominasi konsentrasi molase, pH dan interaksi keduanya terhadap kadar
etanol ditunjukkan dengan perhitungan efek.
Tabel X. Efek konsentrasi molase, pH dan interaksi keduanya dalam menentukan kadar etanol
Efek Kadar etanol
Konsentrasi molase 33.5545
pH -2.3835
Interaksi -1.109
Berdasarkan tabel X diketahui bahwa nilai efek konsentrasi molase lebih
disimpulkan konsentrasi molase merupakan faktor dominan dalam menentukan
kadar etanol.
Kadar etanol yang diperoleh dari 6 kali replikasi kemudian dilakukan
analisis statistik menggunakan uji ANOVA untuk mengetahui perbedaan
bermakna dari faktor konsentrasi molase dan faktor pH maupun interaksi
keduanya terhadap kadar etanol. Dari uji ANOVA yang dilakukan didapatkan
hasil sebagai berikut:
Tabel XI. Hasil uji ANOVA
Df SS MS F hitung F tabel
Konsentrasi molase
2 4.547,966 2.273,98 3
159,522
3,204
pH 2 2.190,187 1.095,09
3
76,822 3,204
Interaksi 4 632,531 158,134 11,093 2,579
Error 45 641,476 14,255
Total 53 8012,160
Hasil perhitungan ANOVA dengan taraf kepercayaan 95% untuk respon
kadar etanol ditunjukkan pada tabel X. Hipotesis alternatif (H1) menyatakan <