LAPORAN PRAKTIKUM SATUAN PROSES 1
PEMBUATAN GAS HIDROGEN (H
2) DENGAN BAHAN
DASAR AIR SECARA ELEKTROLISIS
disusun untuk memenuhi salah satu tugas praktikum Satuan Proses 1 pada semester 2 Program Studi D-IV Teknik Kimia Produksi Bersih
Dosen Pembimbing : Iwan Ridwan, S.T.
Kelas : IA-Teknik Kimia Produksi Bersih Kelompok : 3
Nama Anggota :
Habibah Akmal NIM 131424011
Hesti Diana Wahyuni NIM 131424012
Ken Putri Kinanti KSP NIM 131424013
PROGRAM STUDI D-IV TEKNIK KIMIA PRODUKSI BERSIH
JURUSAN TEKNIK KIMIA
2014
Abstrak
Hidrogen adalah unsur kimia pada tabel periodik yang memiliki simbol H dan nomor atom 1. Pada suhu tekanan standar, Hidrogen tidak berwarna, tidak berbau, bersifat non-logam, bervalensi tunggal, dan merupakan gas diatomik yang sangat mudah terbakar. Dengan massa atom 1,00794 amu, hidrogen adalah unsur terinngan di dunia. Gas Hidrogen sangat mudah terbakar dan akan terbakar pada konsentrasi serendah 4 % H2 di udara bebas. Entalpi
pembakaran hidrogen adalah -286 kJ/mol. Pada praktikum pembuatan gas Hidrogen ini bertujuan untuk membuat gas hidrogen melalui bahan dasar air secara elektrolisis dengan metode elektrolisis air. Elektrolisis merupakan proses kimia yang mengubah energi listrik menjadi energi kimia. Komponen terpenting dalam proses elektrolisis ini adalah elektroda dan larutan elektrolit. Pada proses elektrolisis ini diperlukan dua kutub yaitu kutub katoda (-) dan anoda (+). Molekul air dapat diuraikan mejadi unsur-unsur asalnya dengan dengan mengalirinya arus listrik. Pada katoda, dua molekul air bereaksi dengan menangkap dua elektron, tereduksi menjadi gas H2 dan ion hidroksida (OH-). Sementara itu pada anoda, dua
molekul air lain terurai menjadi gas oksigen (O2), melepaskan 4 ion H+ serta mengalirkan
elektron menuju katoda. Ion H+ dan OH- mengalami netralisasi sehingga terbentuk kembali
beberapa molekul air.
Anoda : 2H2O(l) O2(g) + 4H+ + 4 elektron
Katoda : 2H2O(l) + 2 elektron H2(g) + 2OH
-Total : 4H2O(l) O2 + 4H+ + H2(g) + 2OH- + 2 elektron
Air yang dielektrolisis ditambahkan elektrolit. Elektrolit akan terurai menjadi ion-ion yang berfungsi sebagai penghantar arus pada proses elektrolisis. Elektrolisis yang digunakan dalam praktikum ini adalah KOH 1% dan 2% serta NaOH 1% dan 2%. Gas hidrogen dan di hasilkan pada katoda akan ditampunng dan diukur volumenya yang terbentuk dengan menggunakan gelas ukur.
Kata Pengantar
Segala puji dan syukur penulis panjatkan kehadirat Allah Swt. Karena dengan izin dan karunia-Nya penulis dapat menyelesaikan laporan ini dengan lancar. Laporan ini disusun untuk memenuhi salah satu tugas mata kuliah Praktikum Satuan Proses 1 pada semester dua jurusan Teknik Kimia program studi D-IV Teknik Kimia Produksi Bersih Politeknik Negeri Bandung. Adapun judul dari laporan ini adalah “Laporan Praktikum Pembuatan Gas Hidrogen (H2) dengan Bahan Dasar Air secara Elektrolisis”.
Dalam menyusun laporan ini, penulis memperoleh banyak bimbingan dari berbagai pihak. Untuk itu, penulis ingin mengucapkan terimakasih kepada:
1. Bapak Iwan Ridwan selaku dosen Teknik Kimia Politeknik Negeri Bandung yang telah membimbing penulis dalam menyusun laporan ini.
2. Seluruh rekan di Politeknik Negeri Bandung yang telah membantu dan memberikan arahan untuk penyusunan laporan ini.
3. Orang tua dan adik, yang telah memberikan dorongan moril dalam kelancaran penyusunan laporan ini.
4. Semua pihak yang telah membantu, membimbing dan memberikan arahan dalam penyusunan laporan ini.
Semoga bantuan dan bimbingan serta dorongan dibalas oleh Allah Swt.
Penulis menyadari bahwa dalam penyusunan laporan ini terdapat banyak kekurangan karena keterbatasan kemampuan penulis. Oleh karena itu, penulis mengharapkan saran dan kritik yang sifatnya membangun dari semua pihak agar penulis dapat memperbaiki dan meningkatkan kemampuan diri di masa yang akan datang.
Semoga laporan ini dapat memberikan manfaat khususnya bagi penulis dan menambah pengetahuan umumnya bagi keluarga besar Politeknik Negeri Bandung.
Bandung, 27 Maret 2014
BAB I
PENDAHULUAN
1.1Latar Belakang
Energi menjadi komponen penting bagi kehidupan manusia karena hampir semua aktivitas kehidupan manusia sangat tergantung pada ketersediaan energi yang cukup. Dewasa ini dan beberapa tahun kedepan, manusia masih akan tergantung pada sumber energi fosil karena sumber energi fosil inilah yang mampu memenuhi kebutuhan energi manusia dalam skala besar. Sedangkan sumber energi alternatif/terbarukan belum dapat memenuhi kebutuhan energi manusia dalam skala besar karena fluktuasi potensi pada tingkat perekonomian yang belum bisa bersaing dengan energi knvensional. Di lain pihak, manusia dihadapkan pada situasi menipisnya cadangan sumber energi fosil dan meningkatnya kerusakan lingkungan akibat penggunaan energi fosil. Melihat kondisi tersebut saat ini sangat diperlukan cara intensif untuk mencari, mengoptimalkan dan menggunakan sumber energi alternatif/terbarukan. Oleh karena itu, banyak dilakukan penelitian untuk memperoleh energi dengan menggunakan sumber yang mudah didapat, tersedia secara luas serta ramah lingkungan tuntuk mengurangi global warming, salah satunya adalah pembuatan gas Hidrogen dengan bahan baku air secara elektrolisis. Keberadaan hidrogen hanya ditemukan didalam bentuk senyawa. Hidrogen yang tersedia didalam air dan senyawa organik terbentuk senyawa hidrokarbon, seperti gas alam, batubara, dan biomassa.
1.2Tujuan
Membuat gas hidrogen dari bahan dasar air secara elektolisis dengan menggunakan elektroda stainless steel.
Mempelajari sifat-sifat hidrogen dan pemanfaatannya.
Menetukan laju alir gas hidrogen yang terbentuk dengan variasi waktu dan konsentrasi elektrolit.
1.3Landasan Teori
(1) Air
Air adalah salah satu substansi kimia dengan rumus kimia H2O. 1 molekul air tersusun atas 2
atom hidrogen yang terikat secara kovalen pada 1 atom oksigen. Air bersifat tidak berwarna, tidak berbau, dan tidak berasa pada kondisi standar, yaitu pada tekanan 100 kPa (1bar) dan temperatur 273,15 K (0°C). Zat kimia ini merupakan suatu pelarut yang penting, yang memiliki kemampuan untuk melarutkan banyak zat kimia lainnya, seperti garam-garam, gula, asam, beberapa jenis gas dan banyak macam molekul organik. Keadaan air yang berbentuk cair merupakan suatu keadaaan yang tidak umum dalam kondisi normal, terlebih lagi dengan memperhatikan hubungan antara hidrida-hidrida lain yang mirip dalam kolom oksigen pada tabel periodik, yang mengisyaratkan bahwa air seharusnya berbentuk gas, sebagaimana hidrogen sulfida. Dengan memperhatikan tabel periodik, terlihat bahwa unsur-unsur yang mengelilingi oksigen adalah nitrogen, fluor, fosfor, sulfur, dan klor. Semua elemen-elemen ini apabila berkaitan dengan hidrogen akan menghasilkan gas pada temperatur dan tekanan normal. Alasan mengapa hidrogen berkaitan denga oksigen membentuk fasa berkeadaan cair adalah karena oksigen lebih bersifat elektronegatif daripada elemen-elemen lain tersebut (kecuali fluor). Tarikan atom oksigen pada elektron-elektron ikatan jauh lebih kuat daripada yang dilakukan oleh atom hidrogen, meninggalkan jumlah muatan (+) pada kedua atom hidrogen, dan jumlah muatan (-) pada atom oksigen. Adanya muatan pada tiap-tiap atom tersebut membuat molekul air memiliki sejumlah momen dipol. Gaya tarik menarik ini membuat masing-masing molekul saling berdekatan, membuatnya sulit untuk dipisahkan dan yang pada akhirnya menaikkan titik didih air. Gaya tarik menarik ini disebut sebagai ikatan Hidrogen.
(2) Hidrogen
Hidrogen adalah unsur kimia pada tabel periodik yang memiliki simbol H dan nomor atom 1. Pada suhu tekanan standar, Hidrogen tidak berwarna, tidak berbau, bersifat non-logam, bervalensi tunggal, dan merupakan gas diatomik yang sangat mudah terbakar. Dengan massa atom 1,00794 amu, hidrogen adalah unsur terinngan di dunia. Gas Hidrogen sangat mudah terbakar dan akan terbakar pada konsentrasi serendah 4 % H2 di udara bebas. Entalpi
2H2(g) + O2(g) 2H2O(l) + 572 kJ (-286 kJ/mol)
Ketika dicampur dengan oksigen dalam berbagai perbandingan, hidrogen meledak seketika disulut dengan api dan akan meledak sendiri pada temperatur 560°C. Lidah api hasil pembakaran hidrogen-oksigen murni memancarkan gelombang ultrviolet dan hampir tidak tidak terlihat dengan mata telanjang. Oleh karena itu, sangatlah sulit mendeteksi terjadinya kebocoran hidrogen secara visual. H2 bereaksi secara langsung dengan unsur-unsur oksidator
lainnya. Ia bereaksi dengan spontan dan hebat pada suhu kamar dengan klorin dan fluorin, menghasilkan hidrogen klorida dan hidrogen fluorida.
(3) Elektolisis air
Molekul air dapat diuraikan mejadi unsur-unsur asalnya dengan dengan mengalirinya arus listrik. Pada katoda, dua molekul air bereaksi dengan menangkap dua elektron, tereduksi menjadi gas H2 dan ion hidroksida (OH-). Sementara itu pada anoda, dua molekul air lain
terurai menjadi gas oksigen (O2), melepaskan 4 ion H+ serta mengalirkan elektron menuju
katoda. Ion H+ dan OH- mengalami netralisasi sehingga terbentuk kembali beberapa molekul
air. Reaksi keseluruhan yang setara dari elektrolisis air dapat dituliskan sebagai berikut. Anoda : 2H2O(l) O2(g) + 4H+ + 4 elektron
Katoda : 2H2O(l) + 2 elektron H2(g) + 2OH
-Total : 4H2O(l) O2 + 4H+ + H2(g) + 2OH- + 2 elektron
Gas hidrogen dan oksigen yang dihasilkan dari reaksi ini membentuk gelembung pada elektroda dan dapat dikumpulkan. Prinsip ini kemudian dimanfaatkan untuk menghasilkan hidrogen dan hidrogen peroksida yang dapat digunakan sebagai bahan bakar kendaraan hidrogen. Elektrolisis merupakan proses kimia yang mengubah energi listrik menjadi energi kimia. Komponen terpenting dari proses elektrolisis ini adalah elektroda dan larutan elektrolit. Pada proses elektrolisis diperlukan 2 buah kutub yaitu katoda sebagai kutub (-) dan anoda sebagai kutub (+).
Reaksi keseluruhan yang setara dari elektrolisis air dapat dituliskan sebagai berikut : Anoda : 2H2O(l) O2(g) + 4H+ + 4 elektron
-Total : 4H2O(l) O2 + 4H+ + H2(g) + 2OH- + 2 elektron
Air yang dielektrolisis ditambahkan elektrolit. Elektrolit akan terurai menjadi ion-ion yang berfungsi sebagai penghantar arus pada proses elektrolisis. Elektrolisis yang dapat digunakan diantaranya adalah NaOH, KOH, NaHCO3. Soda kue lebih mudah didapat, ramah
BAB II
METODE
2.1 Alat dan Bahan
1. Alat
Alat Spesifikasi Jumlah
Gelas kimia 250 ml 2
Labu takar 250 ml 1
Gelas ukur 100 ml dan 10 ml 1
Corong 1
Batang pengaduk 1
Bola pipet 1
Rectifier 1
Electrolyser 1
Elektroda stainless steel 2
Kabel + mulut buaya 2
2. Bahan
Bahan Spesifikasi
Larutan NaOH 1 % dan 2 % Larutan KOH 1 % dan 2 % Aquades
Tissue
3.1 Saat bekerja di laboratorium, baju kerja yang nyaman harus telah dikenakan. Untuk beberapa eksperimen laboratorium biasa, cukup mengenakan jas laboratorium berlengan panjang yang terbuat dari bahan tidak mudah meleleh (disarankan dari katun atau kain campuran poliester dan katun). Jas
laboratorium tidak harus dikenakan di ruangan lain seperti ruang kuliah, perpustakaan, ruang makan dan lain sebagainya supaya menghindari kontaminasi dengan bahan kimia yang melekat.
3.2 Sepatu yang stabil dan tertutup harus dikenakan.
3.3 Selama bekerja di laboratorium, kacamata gelas dengan pelindung samping harus dikenakan.
3.4 Saat menjalankan eksperimen, mahasiswa tidak boleh meninggalkan laboratorium jika suatu pengukuran yang kontinyu dibutuhkan dan tidak ada orang lain yang tahu tentang eksperimen tersebut dan dapat menangani kegiatan tersebut. Pada kasus eksperimen yang berbahaya, maka paling sedikit dua orang yang harus ada.
3.5 Pada wilayah di laboratorium, makanan atau barang konsumsi harus disimpan dan dilarang dimakan supaya tidak ada risiko terkontaminasi. 3.6 Terkait dengan risiko akibat adanya peningkatan wadah yang biasa
digunakan untuk makanan atau barang konsumsi, maka tidak boleh digunakan untuk menyimpan bahan kimia, dan juga sebaliknya (makanan tidak boleh ditempatkan pada wadah yang biasa digunakan untuk bahan kimia).
3.7 Merokok tidak diijinkan di laboratorium terkait dengan risiko bahaya pernafasan akibat rokok terkontaminasi seperti halnya dengan bahan
makanan, dan terkait dengan risiko percikan api dan ledakan dengan bahan kimia yang mudah terbakar.
4. Sifat fisik dan kimia bahan
4.1 NaOH
Keadaan fisik dan penampilan : solid
Odor/bau : tidak berbau
Rasa : tidak berasa
Berat molekul : 40 molgr
Warna : putih
pH : 13,5
Titik didih : 1388 oC Titik leleh : 323 oC Suhu kritik : tidak ada
Specific gravity : 2,13 4.2 KOH
Keadaan fisik dan penampilan :
Odor/bau :
Rasa :
Berat molekul :
pH : Titik didih : Titik leleh : Suhu kritik : Specific gravity : 4.3 Oxigen
Keadaan fisik dan penampilan : gas
Odor/bau : tidak berbau
Rasa : tidak berasa
Warna : tidak berwarna
Rumus molekul : O2 Berat molekul : 32 molgr
Titik didih / titik kondensasi : -183 oC (-296,4 oF) Titik leleh / titik beku : -218,4 oC (-361,1 oF) Suhu kritik : -118 oC (-180,6 oF) Specific volume : 12,0482 ftl b3
Vapor density : 1,1 (air = 1)
Gas density : 0,083 ftlb3
4.4 Hidrogen
Keadaan fisik dan penampilan : gas
Odor/bau : tidak berbau
Rasa : tidak berasa
Warna : tidak berwarna
Rumus molekul : H2
Berat molekul : 2,02 molgr
Titik didih / titik kondensasi : -252 oC Titik leleh / titik beku : -259,2 oC Specific gravity : 0,0695 ftlb3
Efek akut : mual, pusing, sakit kepala
Efek kronis , organ target : NA
6. Prosedur kerja
1. Membuat larutan NaOH 1 % dan 2 % serta larutan KOH 1 % dan 2 % 2. Melakukan proses elektrolisis untuk menghasilkan gas hydrogen (H2)
Parameter yang diukur adalah laju pembentukan gas hydrogen pada variasi waktu (5, 10, 15, 20, 25, 30 menit) A, dan variasi konsentrasi elektrolit yang berbeda dengan arus tetap yaitu 0,2 mA. Hubungkan alat ke rectifier pada kutub anoda dan katoda. Ukur laju alir gas hydrogen per 5 menit, 10 menit, 15 menit, 20 menit, 25 menit, dan 30 menit, ulangi untuk larutan elektrolit yang berbeda.
2.2 K3
2.3 Sifat Fisik dan Kimia Bahan
2.4 Garis Besar
BAB III
NaOH 1% NaOH 2% KOH 1% KOH 2%
Waktu (t) dalam menit
Laju Alir Volumetrik Gas Hidrogen (Q H2) dalam satuan ml/menit
Grafik Laju Alir Volumetrik Gas Hidrogen vs Waktu
Pembahasan
Nama : Habibah Akmal NIM : 131424011
Larutan merupakan campuran homogen yang komponennya terdiri dari zat terlarut dan pelarut. Pelarut yang digunakan adalah air, sedangkan zat terlarut terdiri dari senyawa ion atau senyawa kovalen polar. Larutan ada 2 macam berdasarkan daya hantar listriknya, yaitu :
Larutan Elektrolit yaitu larutan yang bersifat menghantarkan arus listrik. Larutan ini adalah larutan yang dengan zat terlarutnya dalam air akan terurai menjadi ion positf dan negative . Larutan elektrolit dibagi menjadi dua, yaitu Larutan elektrolit kuat, yaitu yang dapat menghantarkan listrik dengan kuat, dan Larutan elektrolit lemah, yaitu yang dapat menghantarkan listrik dengan lemah.
Larutan Non Elektrolit yaitu larutan yang tidak dapat menghantarkan arus listrik. Larutan dengan zat terlarutnya dalam air tidak terionisasi.
Teori Ion Svante Arrhenius, yang mengatakan bahwa ion-ion yang terdapat pada larutan elektrolit itulah yang dapat menghantarkan arus listrik melalui larutan.
Senyawa-senyawa pembentuk larutan elektrolit adalah senyawa ion, yaitu senyawa yang atom-atomnya bergabung melalui ikatan ion, serta senyawa pembentuk lainnya adalah senyawa kovalen adalah senyawa yang atom-atomnya bergabung melalui ikatan kovalen.
Bila larutan elektrolit dialiri arus listrik, ion-ion dalam larutan akan bergerak menuju electrode dengan muatan yang berlawanan, melalui cara ini arus listrik akan mengalir dan ion bertindak sebagai penghantar, sehingga dapat menghantarkan arus listrik.
Senyawa ion merupakan zat elektrolit sebab jika larut dalam air dapat menghasilkan ion-ion. reaksi ionisasi dari larutan elektrolit NaOH dan KOH adalah sebagai berikut:
NaOH(s) + H2O(l) Na+(aq) + OH-(aq)
KOH(s) + H2O(l)K+(aq) + OH-(aq)
1. Membandingkan kurva elektrolit NaOH 1% dengan elektrolit NaOH 2% 2. Membandingkan kurva elektrolit KOH 1% dengan elektrolit KOH 2% 3. Membandingkan kurva elektrolit NaOH 1% dengan elektrolit KOH 1% 4. Membandingkan kurva elektrolit NaOH 2% dengan elektrolit KOH 2%
BAB IV
SIMPULAN
Larutan Elektrolit yaitu larutan yang bersifat menghantarkan arus listrik. Larutan ini adalah larutan yang dengan zat terlarutnya dalam air akan terurai menjadi ion positf dan negative. Larutan NaOH dan KOH merupakan larutan elektrolit kuat. Larutan elektrolit kuat, yaitu larutan yang dapat menghantarkan listrik dengan kuat.
LAMPIRAN
Material Safety Data Sheet (MSDS)
Perhitungan
Menggunakan Elektrolit KOH 1%
V campuran = V aquades + V H2
V H2 = Vcampuran – V aquades awal
Q H2 = V H2 / t
Diketahui V aquades awal = 65 ml 1. V H2 = 65 ml – 65ml = 0 ml Q H2 = 0 ml / 5 menit = ml/menit 2. V H2 = 66 ml – 65ml = 1 ml Q H2 = 1 ml / 10 menit = 0,1 ml/menit 3. V H2 = 66 ml – 65 ml = 1 ml Q H2 = 1 ml / 15 menit = 0,067 ml/menit 4. V H2 = 66 ml – 65 ml = 1 ml Q H2 = 1 ml / 20 menit = 0,05 ml/menit 5. V H2 = 66 ml – 65 ml = 1 ml Q H2 = 1 ml / 25 menit = 0,04 ml/menit 6. V H2 = 66 ml – 65 ml = 1 ml Q H2 = 1 ml / 30 menit = 0,03 ml/menit
Menggunakan Elektrolit KOH 2%
V campuran = V aquades + V H2
V H2 = Vcampuran – V aquades awal
Q H2 = V H2 / t
1. V H2 = 6,4 ml – 6 ml = 0,4 ml Q H2 = 0,4 ml / 5 menit = 0,08 ml/menit 2. V H2 = 6,8 ml – 6 ml = 0,8 ml Q H2 = 0,8 ml / 10 menit = 0,08 ml/menit 3. V H2 = 7,2 ml – 6 ml = 1,2 ml Q H2 = 1,2 ml / 15 menit = 0,08 ml/menit 4. V H2 = 7,2 ml – 6 ml = 1,2 ml Q H2 = 1,2 ml / 20 menit = 0,06 ml/menit 5. V H2 = 7,4 ml – 6 ml = 1,4 ml Q H2 = 1,4 ml / 25 menit = 0,056 ml/menit 6. V H2 = 7,6 ml – 6 ml = 1,6 ml Q H2 = 1,6 ml / 30 menit = 0,053 ml/menit
Menggunakan Elektrolit NaOH 1%
V campuran = V aquades + V H2
V H2 = Vcampuran – V aquades awal
Q H2 = V H2 / t
Diketahui V aquades awal = 6 ml 1. V H2 = 6,2 ml – 6 ml = 0,2 ml Q H2 = 0,2 ml / 5 menit = 0,04 ml/menit 2. V H2 = 6,4 ml – 6 ml = 0,4 ml Q H2 = 0,4 ml / 10 menit = 0,04 ml/menit 3. V H2 = 6,4 ml – 6 ml = 0,4 ml Q H2 = 0,4 ml / 15 menit = 0,027 ml/menit 4. V H2 = 6,6 ml – 6 ml = 0,6 ml Q H2 = 0,6 ml / 20 menit = 0,03 ml/menit 5. V H2 = 6,6 ml – 6 ml = 0,6 ml Q H2 = 0,6 ml / 25 menit = 0,024 ml/menit 6. V H2 = 6,65 ml – 6 ml = 0,65 ml Q H2 = 0,65 ml / 30 menit = 0,022 ml/menit
V campuran = V aquades + V H2
V H2 = Vcampuran – V aquades awal
Q H2 = V H2 / t
Diketahui V aquades awal = 6 ml 1. V H2 = 53 ml – 53 ml = 0 ml Q H2 = 0 ml / 5 menit = 0 ml/menit 2. V H2 = 55 ml – 6 ml = 2 ml Q H2 = 2 ml / 10 menit = 0,2 ml/menit 3. V H2 = 55 ml – 6 ml = 2 ml Q H2 = 2 ml / 15 menit = 0,13 ml/menit 4. V H2 = 55 ml – 6 ml = 2 ml Q H2 = 2 ml / 20 menit = 0,1 ml/menit 5. V H2 = 55 ml – 6 ml = 2 ml Q H2 = 2 ml / 25 menit = 0,08 ml/menit 6. V H2 = 55 ml – 6 ml = 2 ml Q H2 = 2 ml / 30 menit = 0,067 ml/menit
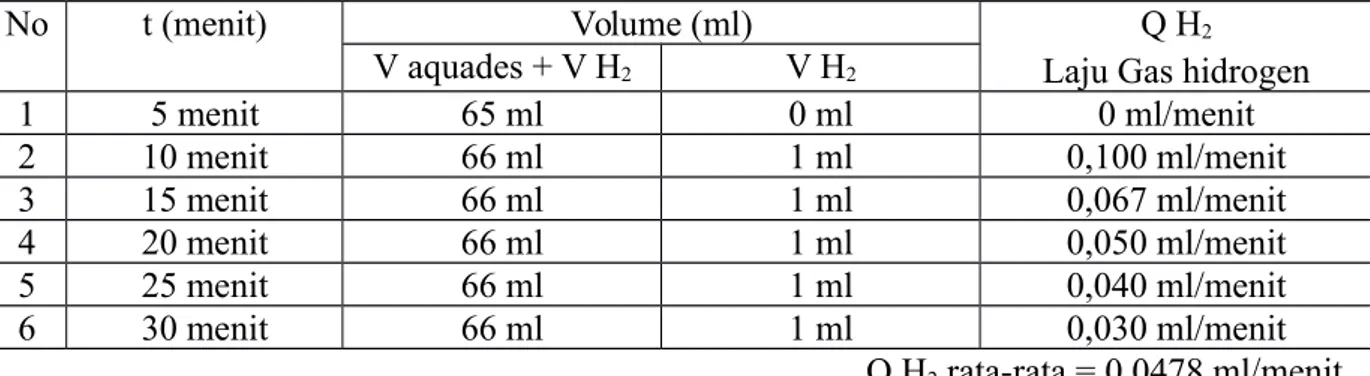
Tabel Data Percobaan
Menggunakan Elektrolit KOH 1%
V aquades awal = 65 ml
No t (menit) Volume (ml) Q H2
Laju Gas hidrogen V aquades + V H2 V H2 1 5 menit 65 ml 0 ml 0 ml/menit 2 10 menit 66 ml 1 ml 0,100 ml/menit 3 15 menit 66 ml 1 ml 0,067 ml/menit 4 20 menit 66 ml 1 ml 0,050 ml/menit 5 25 menit 66 ml 1 ml 0,040 ml/menit 6 30 menit 66 ml 1 ml 0,030 ml/menit Q H2 rata-rata = 0,0478 ml/menit
Menggunakan Elektrolit KOH 2%
V aquades awal = 6 ml
No t (menit) Volume (ml) Q H2
Laju Gas Hidrogen V aquades + V H2 V H2
1 5 menit 6,4 ml 0,4 ml 0,080 ml/menit 2 10 menit 6,8 ml 0,8 ml 0,080 ml/menit 3 15 menit 7,2 ml 1,2 ml 0,080 ml/menit 4 20 menit 7,2 ml 1,2 ml 0,060 ml/menit 5 25 menit 7,4 ml 1,4 ml 0,056 ml/menit 6 30 menit 7,6 ml 1,6 ml 0,053 ml/menit Q H2 rata-rata = 0,0282 ml/menit
Menggunakan Elektrolit NaOH 1%
V aquades awal = 6 ml
No t (menit) Volume (ml) Q H2
Laju Gas Hidrogen V aquades + V H2 V H2 1 5 menit 6,20 ml 0,20 ml 0,040 ml/menit 2 10 menit 6,40 ml 0,40 ml 0,040 ml/menit 3 15 menit 6,40 ml 0,40 ml 0,027 ml/menit 4 20 menit 6,60 ml 0,60 ml 0,030 ml/menit 5 25 menit 6,60 ml 0,60 ml 0,024 ml/menit 6 30 menit 6,65 ml 0,65 ml 0,022 ml/menit Q H2 rata-rata = 0,0305 ml/menit
Menggunakan Elektrolit NaOH 2%
V aquades awal = ml
No t (menit) Volume (ml) Q H2
Laju Gas Hidrogen V aquades + V H2 V H2 1 5 menit 53 ml 0 ml 0 ml 2 10 menit 55 ml 2 ml 0,20 ml 3 15 menit 55 ml 2 ml 0,13 ml 4 20 menit 55 ml 2 ml 0,10 ml 5 25 menit 55 ml 2 ml 0,08 ml 6 30 menit 55 ml 2 ml 0,067 ml Q H2 rata-rata = 0,0962 ml/menit