Program Studi Teknik Mesin
Universitas Mercubuana Jakarta Page 5
BAB II
TEORI DASAR
2.1. Pendahuluan
Dengan meningkatnya perkembangan teknologi yang demikian pesat, maka kebutuhan akan bahan bakar minyak dan atau gas menjadi suatu kebutuhan yang harus dipenuhi oleh pemerintah, Energi yang saat ini digunakan adalah energi yang tidak dapat diperbaharui (fosil), oleh sebeb itu sangatlah penting untuk mengembangkan energi terbarukan/energi alternatif, di karenakan semakin menipisnya cadangan energi. Untuk itu sangatlah penting jika mengembangkan atau meng-konversi energi2 yang dapat diperbaharui / energi alternatif lainnya, seperti energi matahari, aingin, air laut, air itu sendiri, air terjun,tumbuhan dll.
Air merupakan kebutuhan primer makluk hidup, karena tanpa energi makluk hidup tidak akan bisa berkembang biak, seperti air, air merupakan yang paling dibutuhkan oleh manusia karena lebih dari 60% tubuh manusia mengandung air,. Karena air berfungsi untuk membantu metabolisme tubuh., selain itu energi – energi yang ada di alam semesta sangat berfungsi untuk mendorong kemajuan peradaban manusia. Seperti minyak bumi yang digunakan
Program Studi Teknik Mesin
Universitas Mercubuana Jakarta Page 6
sebagai bahan bakar, aspal yang digunakan untuk membuat jalan yang dilalui kendaraan.
2.2. Senyawa Hidrogen (H2)
Hidrogen adalah senyawa kimia yang memiliki rumus molekul H2, hidrogen yang banyak digunakan sekarang ini dihasilkan dari elektrolisasi air (H2O) karena Air memiliki beberapa unsur kimia lainya seperti hidrogen (H2), oksigen (O2).
Hidrogen merupakan energi yang dapat kita gunakan untuk memenuhi kebutuhan energi di masa depan, karena hidrogen adalah senyawa kimia yang dapat terbakar, dan selain itu hidrogen memiiki cepat rambat bakar memlebihi bensin.
2.3. Air
Nama sistematis : Air
Nama alternatif : Aqua, dihidrogen monoksida, hidrogen hidroksida Rumus molekul : H2O
Massa molar : 18.0153 g/mol
Densitas dan fase : 0.998 g/cm³ (cariran pada 20 °C), 0.92 g/cm³ (padatan)
Titik lebur : 0 °C (273.15 K) (32 ºF) Titik didih : 100 °C (373.15 K) (212 ºF) Kalor jenis : 4184 J/(kg•K) (cairan pada 20 °C)
Program Studi Teknik Mesin
Universitas Mercubuana Jakarta Page 7
Air adalah zat kimia yang penting bagi semua bentuk kehidupan yang diketahui sampai saat ini di bumi, tetapi tidak di planet lain. Air menutupi hampir 71% permukaan bumi. Terdapat 1,4 triliun kilometer kubik (330 juta mil³) tersedia di bumi. Air sebagian besar terdapat di laut (air asin) dan pada lapisan-lapisan es (di kutub dan puncak-puncak gunung), akan tetapi juga dapat hadir sebagai awan, hujan, sungai, muka air tawar, danau, uap air, dan lautan es. Air dalam obyek-obyek tersebut bergerak mengikuti suatu siklus air, yaitu: melalui penguapan, hujan, dan aliran air di atas permukaan tanah (runoff, meliputi mata air, sungai, muara) menuju laut.
Air bersih penting bagi kehidupan manusia. Di banyak tempat di dunia terjadi kekurangan persediaan air. Selain di bumi, sejumlah besar air juga diperkirakan terdapat pada kutub utara dan selatan planet Mars, serta pada bulan-bulan Europa dan Enceladus. Air dapat berwujud padatan (es), cairan (air) dan gas (uap air). Air merupakan satu-satunya zat yang secara alami terdapat di permukaan bumi dalam ketiga wujudnya tersebut. Jika dikelola dengan baik, air merupakan sumber daya alam yang tidak akan ada habisnya.
2.4. Elektrolisa Air
Proses elektrolisis merupakan reaksi yang tidak spontan sehingga memerlukan energi dan berlangsung pada suatu rangkaian elektrode dengan diberi sumber arus listrik searah. Elektrolisis merupakan proses penguraian suatu senyawa oleh arus listrik.
Program Studi Teknik Mesin
Universitas Mercubuana Jakarta Page 8
Sel elektrolisis memerlukan energi untuk memompa elektron. Proses elektrolisis dimulai dengan masuknya elektron dari arus listrik searah kedalam larutan melalui kutub negatif. Spesi tertentu atau ion yang bermuatan positif akan menyerap elektron dan mengalami reaksi reduksi di katode. Spesi yang lain atau ion yang mermuatan negatif akan melepas elektron dan mengalami reaksi oksidasi dikutub positif atau anode.
Jenis elektrode yang digunakan dalam proses elektrolisis sangat berpengaruh pada hasil elektrolisis. Elektroda dapat dibedakan menjadi dua berdasarkan keaktifannya, yaitu :
1. elektroda tidak aktif (inert) seperti C, Pt.
2. elektroda aktif ( selain C,Pt) pada proses elektrolisis. Elektrode aktif berlangsung reaksi elektrode dan reaksi elektrolitnya, sedangkan elektrode inert hanya terjadi reaksi elektrolitnya saja.
Sudah lebih dari 80 tahun proses elektrolisa ini dipergunakan secara komersial, seperti halnya penyepuhan emas, perak dan lain sebagainya. Prinsip Elektrolisa pada air biasa adalah untuk memecahkan ikatan kimia air (H2O) menjadi H2 dan O2, diperlukan tegangan listrik searah (DC), yg dialirkan melalui lempengan plat stainless.
2.5. Elektrolisa ada 2 macam:
- Elektrolisa basah (wet cell electrolyse) : yaitu lempengan plat kathoda Dan Anoda dicelupkan kedalam air
- Elektrolisa kering (Dry cell electrolyse = Drycell) : disini lempengan plat
Program Studi Teknik Mesin
Universitas Mercubuana Jakarta Page 9
Kathoda dan Anoda berada disebelah luar dan airnya disebelah dalam.Alat yang akan telah kami buat adalah elektrolisa kering (dry cell electroda = dry cell).
2.5.1. Elektrolisa basah (wetcell electrolyse)
Elektrolisa Basah adalah elektrolisa yang biasa digunakan sampai saat ini, yaitu dengan memasukan kedua plat kondensator tersebut kedalam air destilasi atau air RO (Reverse Osmosis = air murni), apabila kedua elektroda tersebut diberi tegangan listrik maka akan terjadi proses pemisahan H2 dan O2, kemudian hasil H2 tersebut perlu dihitung dan di-data dari hasil percobaan, selain itu perlu diteliti variabel yang mempengaruhi produksi H2 tersebut, sehingga dapat diambil kesimpulan penggunaan elektrolisa yang paling efisien & efektif.
Elektrolisa Basah adalah dengan memasukan kedua plat kondensator tersebut kedalam air destilasi atau air - RO (Reverse Osmosis = air murni), apabila kedua elektroda tersebut diberi tegangan listrik maka akan
terjadi proses pemisahan H2 dan O2, kemudian hasil H2 tersebut perlu dihitung dan di-data dari hasil percobaan, selain itu perlu diteliti variable variabel yang mempengaruhi produksi H2 tersebut, sehingga dapat di ambil kesimpulan penggunaan elektrolisa yang paling efisien & efektif.
Keuntungan generator gas HHO tipe wet cell adalah :
1. Gas yang dihasilkan umumnya lebih banyak dan stabil. 2. Perawatan generator lebih muda.
3. Rancangan bangun pembuatan generator lebih mudah.
pada tipe wet cell atau tipe basah, area luasan elektroda platnya terendam air untuk proses elektrolisis menghasilkan gas HHO.
Program Studi Teknik Mesin
Universitas Mercubuana Jakarta Page 10
2.5.2. Elektrolisa kering (Drycell electrolyse = Drycell)
Elektrolisa Kering (Dry electrolyze) adalah pada proses ini plat kondensotornya tidak direndam kedalam larutan akan tetapi plat nya berada disebelah luar dan larutannya didalam plat tersebut.
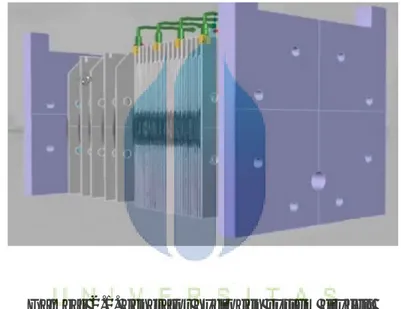
Gambar 2.1. generator hydrogen system drycell Sumber : http://hho$save.blogspot.com/feeds/posts.default
Pada proses Dry cell panas yang ditimbulkan oleh plat kondensator dapat dibuang langsung keluar, sehingga tidak membuat larutan menjadi lebih panas, dibandingkan dengan elektrolisa biasa atau elektrolisa basah (Wet Electrolyze). Keuntungan generator HHO tipy dry cell adalah :
1. air yang di elektrolisa hanya seperlunya, yaitu hanya air yang terjebak diantara lempengan cell
2. Panas yang ditimbulkan relative kecil karena selalu terjadi sirkulasi antara air panas dan air dingin di reservoir
Program Studi Teknik Mesin
Universitas Mercubuana Jakarta Page 11
3. Arus listrik yang digunakan relatif lebih kecil, karena daya yang terkonversi menjadi semakin panas semakin sedikit.
Besarnya plat elektroda yang terendam air adalah area terjadinya elektrolisis untuk menghasilkan gas HHO.
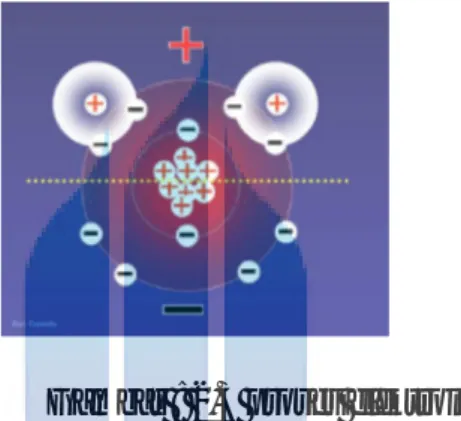
2.6. Struktur Atom Hidrogen (H )
Niels borh menerapkan teory kuantum terhadap model atom rutherford dengan mengasumsikan bahwa elektron – elektron bergerak pada orbit stasioner tertentu akibat adanya momentum anguler elektron – elektron tersebut. Model atom ini memungkinkan para ilmuwan untuk menghitung tingkat energi yang mungkin untuk orbit – orbit ini dan menghasilkan sebuah postulat bahwa emisi cahaya terjadi ketika sebuah elektron berpindah ke orbit yang energinya lebih rendah.
Meskipun pada tahun 1897 Thomson sudah menemukan elektron ,namun ukuran dan posisi elektron dalam suatu atom belum diketahui. Para ilmuwan berusaha menjelaskan bentuk atom dengan model dari yang paling sederhana sampai yang sangat rumit.
Program Studi Teknik Mesin
Universitas Mercubuana Jakarta Page 12
2.7. Teori atom Dalton.
Jauh sebelum Dalton mengemukakan teori atom, seorang filsuf yang bernama Demokritus (460-370 SM) sudah mengemukakan teori atom. Teori atom yang diajukannya tidak berdasarkan eksperimen namun didasarkan hasil pemikiran saja. Menurut Demokritus,atom adalah bagian terkecil suatu partikel/zat yang tak dapat dibagi-bagi lagi. Istilah atom berasal dari kata a yang berarti tidak dan tomos yang berarti dibagi sehingga atom mempunyai arti harfiah tak dapat dibagi. John Dalton (1766-1844),seorang ilmuwan Inggris, mengemukakan teori atomnya berdasarkan berbagai percobaan yang dilakukan ditambah kesimpulan dari percobaan orang lain. Teori atom Dalton berhasil menjelaskan peristiwa-peristiwa yang terjadi dalam reaksi kimia.
Rangkian dari teori atom Dalton, Thomson dan bohr adalah :
2.7.1 Teori atom dalton
1. Atom adalah bagian dari suatu unsur atau zat yang tak dapat di bagi-bagi.
2. Atom dari unsur mempunyai bentuk yang serupa dan tidak mungkin berubah menjadi unsur yang lain.
3. Dua atom atau lebih dari unsur yang berbeda dapat bergabung dalam reaksi kimia membentuk suatu molekul. Sebagai contoh ,dua atom hidrogen dapat bergabung dengan atom oksigen menjadi molekul air lewat sebuah reaksi kimia.
4. Dalam reaksi kimia, berbagai atom unsur yang terlibat hanya sekedar memisahkan dan bergabung sedangkan massa keseluruhan tetap. Ide
Program Studi Teknik Mesin
Universitas Mercubuana Jakarta Page 13
ini sesuai dengan hukum Lavoisier yang menyatakan massa sebelum reaksi sama dengan massa sesudah reaksi.
5. Dalam reaksi kimia, banyaknya atom yang bergabung dengan unsur lain mempunyai perbandingan yang tertentu dan sedsrhana. Gagasan ini sesuai dengan hukum Proust yang menyatakan bahwa perbandingan berat unsur-unsur yang menyusun suatu senyawa selalu tetap.
2.7.2. Teori atom Thomson
Model atom lain dikemukakan oleh Thomson. Sedikit berbeda dengan model atom sebelumnya, Thomson mengemukakan bahwa atom bukan merupakan seseuatu yang tidak dapat dibagi-bagi lagi. Pada atom terdapat sejumlah muatan negatif. Karena secara keseluruhan atom adalah netral, maka muatan negatif tersebut akan diseimbangkan oleh
Muatan positif yang jumlahnya sama.
Menurut Thomsomn, atom mempunyai massa yang jauh lebih besar dibandingkan dengan massaelektron. Ini berarti muatan positif menjadi pusat massa sebuah atom. Sebagai ilustrasi model atom Thomson, jika diandaikan sebuah atom adalah semangka, sedangkan muatan positif atom adalah ''daging'' semangka.
2.8. Teori Atom Bohr
Model atom Bohr dikemukakan oleh Niels Bohr yang berusaha menjelaskan kestabilan atom dan spektrum garis atom hidrogen yang tidak dapat
Program Studi Teknik Mesin
Universitas Mercubuana Jakarta Page 14
dijelaskan oleh model atom Rutherford. Model atom Bohr memuat tiga postulat sebagai berikut.
Ø Di dalam atom hidrogen, elektron hanya dapat mengelilingi lintasan tertentu tertentu yang diijinkan tanpa membebaskan (melepaskan) energi. Lintasan ini disebut lintasan stasioner dan memiliki energi tertentu yang sesuai.
Ø Elektron dapat berpindah dari satu lintasan ke lintasan yang lain. Energi dalam bentuk foton cahaya akan dilepaskan jika elektron berpindah ke lintasan yang lebih dalam, sedangkan Energi dalam bentuk foton cahaya akan diserapkan supaya elektron berpindah ke lintasan yang lebih luar. Energi dilepas atau diserap dalam paket sebesar hf sesuai dengan persamaan Planck.
E = hf
Dimana h adalah konstanta Planck dan f adalah frekuensi cahaya atau foton yang dilepas atau diserap.
lintasan-lintasan stasioner yang diijinkan untuk ditempati elektron memiliki momentum sudut yang merupakan kelipatan bulat dari nilai (nilai ini biasa ditulis juga sebagai ћ)
Program Studi Teknik Mesin
Universitas Mercubuana Jakarta Page 15
2.9Teknologi Elektrolisa HHO (Hydrogen-Oxygen)
Teknologi pemanfaatan air sebagai energi telah banyak dikembangkan, dari beberapa teknologi yang ada, semuanya menggunakan proses elektrolisis air sebagai prinsip dasarnya.
Hingga saat ini sudah ditemukan teknologi untuk memanfaatkan air sebagai energi yaitu fuel cell sistem HOD (Hydrogen Oxygen Demand) yaitu sistem pembangkit tenaga listrik dari hasil pencampuran H2 dengan O2 lansung pada saat listrik dibutuhkan, dan elektrolisa HHO (Hydrogen-Oxygen).
Teknologi elektrolisa HHO lebih murah dan lebih efisien. Teknologi optimalisasi air dengan fuel cell memiliki kelemahan terhadap biaya yang diperlukan dan efisiensi terhadap penerapannya. Sedangkan untuk sistem HOD memiliki kelemahan terhadap tingginya biaya yang diperlukan dan masih sulit untuk menampung gas hidrogen dalam satu tempat. Perbandingan yang lebih lengkap tentang teknologi optimalisasi air sebagai alternatif energi dapat dilihat pada tabel berikut ini.
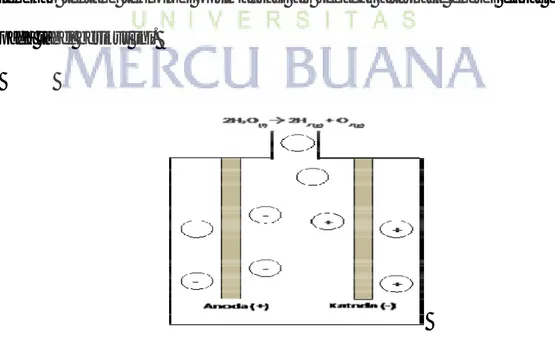
Gambar 2.2 : prosese lektrolisasi air H2O
Program Studi Teknik Mesin
Universitas Mercubuana Jakarta Page 16
2.10. Hidrogen dari Proses Elektrolisa
Proses elektrolisis telah digunakan secara luas, tapi pemanfaatannya masih terbatas untuk kapasitas kecil, mengingat efisiensi termalnya yang sangat rendah. Namun demikian pada saat ini telah banyak peneliti yang berhasil meningkatkan efisiensi termal proses elektrolisis. Sel elektrolisis yang bekerja pada suhu dan tekanan tinggi, mampu memisahkan hidrogen dan oksigen dengan tingkat efisiensi yang signifikan
Pada prinsipnya, hidrogen bisa diperoleh dengan memecah senyawa yang paling banyak mengandung unsur hidrogen. Sampai saat ini, produksi hidrogen skala komersial yang paling maju adalah produksi hidrogen berbasis bahan bakar fosil dan air. Untuk produksi hidrogen dengan bahan baku bahan bakar fosil, steam reforming metana merupakan proses yang paling maju di dunia. Lebih dari 85% kebutuhan hidrogen dunia dipasok dengan sistem produksi steam reforming metana. Produksi hidrogen dengan bahan baku air yang sudah komersial adalah proses elektrolisis. Sayangnya, karena proses elektrolisis membutuhkan listrik dalam jumlah besar sebagai pemicu terjadinya reaksi, sehingga proses ini memberikan efisiensi termal total yang relatif rendah. Proses elektrolisis hanya bisa ekonomis jika tersedia listrik dalam jumlah besar dengan harga murah.
Dengan berjalannya waktu banyak penelitian dilakukan yang mengarah pada penyempurnaan, bahkan melebihi nilai standar dari perhitungan Faraday, sehingga menjadikan gas H2 lebih bermanfaat bagi kebutuhan manusia dalam menggunakan energi, karena H2 dapat diperoleh dari air dan air cukup banyak ada dimana-mana, sehingga dapat dikatakan bahwa H2 adalah sumber energi masa depan yang berkelimpahan dan murah.
Program Studi Teknik Mesin
Universitas Mercubuana Jakarta Page 17
Berdasarkan penelitian akhir-akhir ini dapat disimpulkan bahwa kegunaannya gas hydrogen bagi masyarakat luas dapat diterapkan untuk untuk kompor rumah tangga, dan pemanas ruangan serta di industri pada burner, uap air panas (steam), metode pengelasan dan lain sebagainya.
Rumus Kimia pada proses Elektrolisa:
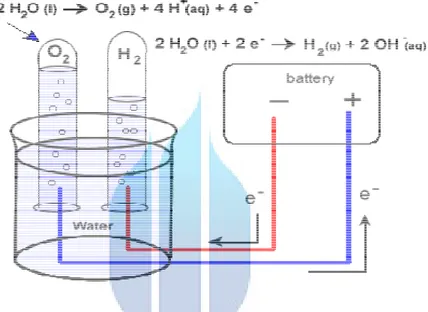
Gambar : 2.3 proses elektrolisa
http://ecopowerbooster,blogspot.com/2012/04/air-elektrolisis-air-dan-hidrogen,html/edy arifin
Pada elektroda Kathoda terjadi penambahan elektron (e−), sehingga reaksi kimia yang terjadi sbb;
Kathode (reduksi): 2H+(cair) + 2e− → H2(gas)
Sedangkan pada elektroda Anoda, terjadi proses oxidasi dimana pelepasan elektron yang bergerak kearah elektroda kathoda, reaksi kimia pada Anoda sbb;
Program Studi Teknik Mesin
Universitas Mercubuana Jakarta Page 18
Anode (oxidasi) : 2H2O(l) → O2(gas) + 4H+(cair) + 4e− ; (l = Larutan)
Reaksi kimia penye-imbangan, reaksi air dengan larutan basa sbb;
Kathode (reduksi): 2H2O(l) + 2e− → H2(gas) + 2OH−(cair) Anode (oxidasi) : 4OH−(cair) → O2(gas) + 2H2O(l) + 4e−
Gambar 2.4 .rumusan kimia pada elektroklisa air
http://ecopowerbooster,blogspot.com/2012/04/air-elektrolisis-air-dan-hidrogen,html/edy arifin
Bahwa pemisahan air (H2O) akn menjadi:
2H2O(l) 2H2(gas) + O2(gas) →H2O(liquid) disebut HHO