PEMURNIAN PARSIAL DAN KARAKTERISASI ENZIM
β-1,3-GLUKANASE DARI CAIRAN PENCERNAAN Achatina fulica
SKRIPSI
SITI MUNAWAROH WAIDAH
DEPARTEMEN KIMIA
FAKULTAS SAINS DAN TEKNOLOGI UNIVERSITAS AIRLANGGA
PEMURNIAN PARSIAL DAN KARAKTERISASI ENZIM
β-1,3-GLUKANASE DARI CAIRAN PENCERNAAN Achatina fulica
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Bidang Kimia Pada Fakultas Sains dan Teknologi
Universitas Airlangga
Disetujui oleh:
Pembimbing I,
Dr. Afaf Baktir, M.S. NIP. 19561014 198303 2 001
Pembimbing II,
Dr. Purkan, M.Si.
LEMBAR PENGESAHAN NASKAH SKRIPSI
Judul :Pemurnian Parsial dan Karakterisasi Enzim β-1,3-glukanase
Dari Cairan Pencernaan Achatina fulica
Penyusun : Siti Munawaroh Waidah
NIM : 080810496
Pembimbing I : Dr. Afaf Baktir, M.S.
Pembimbing II : Dr. Purkan, M.Si.
Tanggal Ujian : 6 Agustus 2012
Disetujui Oleh:
Pembimbing I,
Dr. Afaf Baktir, M.S. NIP. 19561014 198303 2 001
Pembimbing II,
Dr. Purkan, M.Si.
NIP. 19721116 199702 1 001
Mengetahui,
Ketua Departemen Kimia
Fakultas Sains dan Teknologi Universitas Airlangga
PEDOMAN PENGGUNAAN SKRIPSI
Skripsi ini tidak dipublikasikan, namun tersedia di perpustakaan dalam
lingkungan Universitas Airlangga, diperkenankan untuk dipakai sebagai referensi
kepustakaan, tetapi pengutipan harus seizin penyusun dan harus menyebutkan
sumbernya sesuai kebiasaan ilmiah. Dokumen skripsi ini merupakan hak milik
KATA PENGANTAR
Puji syukur kehadirat Allah SWT atas segala rahmat dan hidayah-Nya, sehingga
penulis dapat menyelesaikan skripsi dengan judul “ Pemurnian Parsial dan Karakterisasi Enzim β-1,3-glukanase Dari Cairan Pencernaan Achatina fulica”.
Penulisan skripsi ini tidak lepas dari bantuan berbagai pihak. Oleh karena
itu, dalam kesempatan ini penulis mengucapkan terima kasih kepada:
1. Ibu Dr. Afaf Baktir, M.S. selaku dosen pembimbing I yang telah meluangkan
waktunya untuk memberikan saran, nasehat dan masukan dalam penyelesaian
proposal ini.
2. Bapak Dr. Purkan, M.Si. selaku dosen pembimbing II atas bimbingan dan
nasehatnya selama penyusunan proposal ini.
3. Ibu Aning, M.Si. selaku dosen wali atas motivasi dan dukungan yang telah
diberikan.
4. Keluarga, bapak, Ibunda, adikku Muhammad Saiful Mujad, bulek Suprihatin,
nenek, kakek dan Valihudddin Rizal tercinta atas dukungan dan semangat baik
moral maupun spiritual demi terselesaikannya proposal ini.
5. Teman-teman UKM Penalaran, Ditty, Muhaymin, aezzi dimitra, nararya, bima
fajar ,fajar shodiq, sobir, ratna, yanis, nimaz, nurul dan lain-lain, terimakasih
untuk kebersamaan dan perjuangan selama ini.
6. Buat Resti, Amel, Riza, Wike, Ve, Rista, Adel, Culan, Julie, Aya, luluk dan
teman-teman kimia lain, terimakasih untuk dukungan kalian.
7. Teman-teman kozt mulyorejo, mbak eka, mbak ida, mbak dinar, mbak finda,
mbak iin, mbak ayu, Cuwi, mbak dora, mbak dyan, terimakasih sudah
merawat, mendukung dan menemani saya selama 4 tahun ini.
8. Teman-teman KKN Tanjungharjo, Fariz, Fitra, Niniz, Ekki, Nikita dan
lain-lain terimakasih untuk kebersamaan kalian.
9. Terimakasih buat Plus Minus Digital yang telah memberikan banyak pelajaran
hidup padaku tentang bagaimana susahnya bekerja. Semoga suatu saat engkau
10. Terimakasih buat temen-temen Biokim blazt (Dita, Siska, Nadya, Rohiz, Mb
Kunsah, dan Ainur) atas bantuan dan kerjasamanya.
11.Terimakasih buat temen-temen PKL, Mbak Ade dan pembimbing di
Bioteknologi, LIPI, Bogor.
Skripsi ini disusun sebagai syarat tugas akhir yang harus diselesaikan dalam
meraih gelar sarjana S1. Penulis menyadari bahwa dalam penulisan skripsi ini
masih banyak kekurangan, sehingga kritik dan saran yang membangun sangat
diharapkan demi kesempurnaan proposal ini.
Surabaya, Juli 2012
Penyusun,
Siti Munawaroh Waidah, 2012, Pemurnian Parsial dan Karakterisasi Enzim
β-1,3-glukanase Dari Cairan Pencernaan Achatina fulica. Skripsi di bawah bimbingan Dr. Afaf Baktir, M.S. dan Dr. Purkan, M.Si. Departemen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga
ABSTRAK
Enzim β-1,3-glukanase merupakan enzim yang dapat mendegradasi dinding sel jamur yang tersusun atas β-1,3 glukan. Penelitian ini bertujuan untuk pemurnian parsial dan karakterisasi enzim β-1,3-glukanase yang diisolasi dari cairan pencernaan Achatina fulica. Pemurnian parsial enzim β-1,3-glukanase dengan pelarut organik aseton dilakukan pada berbagai fraksi hingga mendapatkan fraksi optimum yaitu fraksi dengan aktivitas spesifik terbesar. Hasil pemurnian parsial enzim β-1,3-glukanase didapatkan aktivitas spesifik terbesar yaitu pada fraksi 40-75%. Pada fraksi ini aktivitas spesifik sebesar 0,249 U/mg, sedangkan aktivitas spesifik ekstrak kasar enzim sebesar 0,092 U/mg. Dengan demikian, kemurnian enzim meningkat 1,81 kali dengan % yield sebesar 90,4 %. Fraksi 40-75% yang merupakan fraksi dengan aktivitas spesifik terbesar ini kemudian dilakukan karakterisasi suhu dan pH optimum. Dari penelitian didapatkan suhu optimum aktivitas enzim β-1,3-glukanase pada 370C dan pH optimum aktivitas enzim β -1,3-glukanase pada pH 6.
Siti Munawaroh Waidah, 2012, Partial purification and characterization of
β-1 ,3-glucanase enzyme from Achatina fulica Digestive fluids. Final project under guidance Dr. Afaf Baktir, M.S. and Dr. Purkan, M.Si. Departement of Chemistry, Faculty Science and Technology, Universitas Airlangga
ABSTRACT
β-1 ,3-glucanase are enzymes that can degrade the cell walls of the fungus composed of β-1, 3 glucan. The aim of this study are to partial purification and characterization of the enzyme β-1 ,3-glucanase isolated from the digestive fluids of Achatina fulica. Partial purification of β-1 ,3-glucanase was done by organic solvent (acetone) on the various factions to get the optimum fraction. The results obtained specific activity of the largest faction is the fraction of 40-75%. In the specific activity of this fraction is 0.249 U/mg, in the other hand the specific activity of crude enzyme extract is 0.092 U/mg. Thus, the purity of the enzyme increased 1.81 times with % yield is 90.4%. The fraction of 40-75% which is a fraction with the greatest specific activity was then carried out the characterization of temperature and pH optimum. The optimum temperature obtained from the research activity of the enzyme β-1 ,3-glucanase at 370C and pH optimum enzyme activity of β-1 ,3-glucanase at pH 6.
DAFTAR ISI
LEMBAR PEDOMAN PENGGUNAAN SKRIPSI ... iv
KATA PENGANTAR ... v
2.1.4 Faktor yang mempengaruhi aktivitas enzim ... 9
2.2 Enzim β-1,3 Glukanase ... 11
2.3 β-1,3 Glukan ... 13
2.4 Achatina fulica ... 13
2.4.1 Klasifikasi Achatina fulica ... 14
2.4.2 Karakteristik umum Achatina fulica ... 15
2.4.3 Sistem pencernaan Achatina fulica ... 16
3.2.2 Bahan-bahan penelitian ... 22
3.3 Diagram Alir Penelitian ... 23
3.4 Prosedur Penelitian... 24
3.4.1 Karantina Achatina fulica ... 24
3.4.2 Panen ekstrak kasar enzim Achatina fulica ... 24
3.4.3 Uji aktivitas spesifik enzim β-1,3-glukanase ... 24
3.4.6 Pembuatan kurva standar protein ... 26
3.4.7 Penentuan kadar protein ... 27
3.4.8 Karakterisasi Enzim Enzim β-1,3 glukanase 3.4.8.1 Penentuan suhu optimum enzim β-1,3 glukanase ... 27
3.4.8.2 Penentuan pH optimum enzim β-1,3 glukanase ... 27
3.4.9 Analisis Data ... 28
BAB IV HASIL DAN PEMBAHASAN 4.1 Karantina Achatina fulica ... 30
4.2 Panen Ekstrak Enzim Kasar Achatina fulica ... 30
4.3 Uji Aktivitas Enzim ... 31
4.3.1 Pembuatan kurva standar glukosa ... 31
4.3.2 Pembuatan kurva progres enzim β-1,3 glukanase ... 32
4.3.3 Penentuan aktivitas enzim β-1,3 glukanase ... 33
4.4 Penentuan Kadar Protein Dengan Metode Lowry ... 35
4.5 Pemurnian Parsial Enzim Dengan Fraksinasi Aseton ... 36
4.6 Karakterisasi Enzim β-1,3 glukanase ... 41
4.6.1 Penentuan suhu optimum enzim β-1,3 glukanase ... 41
4.6.2 Penentuan pH optimum enzim β-1,3 glukanase ... 43
BAB V KESIMPULAN DAN SARAN 5.1 Kesimpulan ... 45
5.2 Saran ... 45
DAFTAR PUSTAKA ... 46
DAFTAR TABEL
Nomor Judul
4.1 Hasil Fraksinasi Aseton ke-1 ... 38
4.2 Hasil Fraksinasi Aseton ke-2 ... 39
4.3 Hasil Fraksinasi Aseton ke-3 ... 39
4.4 Hasil Fraksinasi Aseton ke-4 ... 40
DAFTAR GAMBAR
Nomor Judul Gambar Halaman
2.1 Mekanisme kerja enzim model lock and key... 8
2.2 Mekanisme kerja enzim model Induced fit ... 9
2.3 Aktivitas Enzim β-1,3-glukanase pada substrat β-1,3-glukan... 12
2.4 Struktur dinding sel C.albicans... 13
2.5 Anatomi Achatina fulica ... 14
2.6 Agregasi protein karena interaksi antara air dan pelarut organik ... 20
2.7 Denaturasi protein jika suhu pelarut organik lebih dari 0oC ... 21
4.1 Kurva standar glukosa ... 32
4.2 Kurva progress enzim β-1,3 glukanase ... 32
4.3 Reaksi DNS dengan gula pereduksi ... 34
4.4 Kurva standar protein ... 36
4.5 Kurva suhu optimum aktivitas enzim β-1,3 glukanase ... 42
DAFTAR LAMPIRAN
Nomor Judul
1. Pembuatan reagen
2. Tabel penentuan kurva progress
3. Tabel penentuan kurva standar protein
4. Perhitungan aktivitas spesifik enzim
5. Data Karakterisasi enzim
BAB 1
PENDAHULUAN
1.1Latar Belakang
Penerapan bioteknologi dalam beberapa bidang seperti bidang kesehatan,
kedokteran dan pertanian tidak lepas dari peranan enzim sebagai biokatalisator.
Hal ini dikarenakan penggunaan enzim sebagai biokatalisator memiliki beberapa
keuntungan, antara lain lebih efisien, ramah terhadap lingkungan, dan dapat
mengkatalis berbagai macam reaksi serta tidak menghasilkan produk samping.
Dalam fungsinya sebagai biokatalisator, enzim berikatan dengan substrat dan
membentuk kompleks enzim-substrat sehingga terjadi perubahan substrat menjadi
produk, reaksi tersebut berlangsung di daerah sisi katalitik atau sisi aktif (Dawn et
al., 2000)
Enzim dibedakan menjadi beberapa golongan berdasarkan reaksi yang
dikatalisis, salah satunya adalah enzim hidrolitik. β-1,3-glukanase merupakan salah satu enzim hidrolitik. Enzim ini dapat ditemukan pada sebagian besar
bakteri, jamur, tanaman tingkat tinggi dan hewan invertebrata. Terdapat dua
jenis β-1,3-glukanase, yang pertama ekso-β-1,3-glukanase yang menghidrolisis ikatan β-1,3-glukan secara berurutan, dari ujung non-reduksi suatu polimer atau oligomers, sehingga dihasilkan monomer glukosa (Reese, 1977). Tipe β -1,3-glukanase yang kedua adalah endo-β-1,3-glukanase, menghidrolisis ikatan β-1,3 pada sisi yang acak sepanjang rantai polisakarida, sehingga dihasilkan
oligosakarida (Reese & Mandels, 1959). Substrat spesifik bagi enzim ini adalah
ditemukan pada dinding sel jamur patogen (Adams, 2004). Oleh karena itu, enzim
β-1,3-glukanase dinyatakan sebagai komponen penting dalam mekanisme pertahanan melawan patogen termasuk infeksi jamur (Ueda et al., 2011).
Ada berbagai macam jamur yang dapat menginfeksi manusia misalnya
Candida albicans. Jamur ini bersifat patogen terutama pada tubuh yang
mengalami penurunan sistem imun. Candida albicans dapat membentuk biofilm
yang berupa campuran dari beberapa tipe sel, yaitu khamir, rizoid dan matriks
ekstraseluler yang melindungi sel-sel C.albicans (Jabra-Rizk et al., 2004).
Keberadaan biofilm menghalangi penetrasi obat ke dalam sel jamur. Biofilm
dapat dilisis dengan menguraikan penyusun utama biofilm yaitu β-1,3-glukan. Komponen ini dapat dihidrolisis dengan enzim β-1,3-glukanase (Nett et al.,2007).
Gabriel dan Kopecka (1988) melakukan penelitian tentang pengaruh
konsorsium enzim dari kelenjar pencernaan bekicot (Achatina fulica) terhadap
regenerasi dinding sel dalam protoplas Schizosaccharomyces japonicus.
Dilaporkan bahwa, keberadaan konsorsium enzim dari kelenjar pencernaan
Achatina fulica mengakibatkan produksi dinding sel tidak lengkap. Hal ini karena
komponen utama penyusun dinding sel yaitu β-1,3-glukan pada Schizosaccharomyces japonicus terdegradasi oleh konsorsium enzim dari cairan
pencernaan Achatina fulica, yang diantaranya terdiri dari enzim β-1,3-glukanase dan enzim β-1,4-glukanase.
Pada penelitian ini dilakukan isolasi enzim β-1,3-glukanase dari saluran pencernaan Achatina fulica untuk dilakukan pemurnian parsial dan karakterisasi.
protein lain sehingga aktivitas enzim dapat ditingkatkan. Pemurnian parsial enzim
dilakukan dengan fraksinasi pelarut organik karena memiliki efek presipitasi yang
bagus (Sopes, 1994). Selain itu, pelarut organik tidak memecahkan gugus
prostetik dari molekul protein seperti pada pengendapan dengan garam (Bintang,
2010). Pelarut organik yang digunakan adalah aseton karena aseton mudah
dipisahkan dengan protein yaitu dengan cara penguapan dan sentrifugasi.
1.2 Rumusan Masalah
1. Berapakah aktivitas spesifik enzimβ-1,3-glukanase dari cairan pencernaan Achatina fulica sebelum dan sesudah pemurnian parsial melalui fraksinasi
aseton?
2. Pada fraksi aseton berapakah terdapat aktivitas spesifik terbesar enzim β -1,3-glukanase yang diisolasi dari cairan pencernaan Achatina fulica ?
3. Berapakah pH dan suhu optimum aktivitas enzim β-1,3-glukanase yang di isolasi dari cairan pencernaan Achatina fulica?
1.3Tujuan Penelitian
1. Mengisolasi dan mengetahui aktivitas spesifik enzim β-1,3-glukanase dari cairan pencernaan Achatina fulica.
2. Menentukan fraksi aseton yang menunjukkan keberadaan aktivitas spesifik
terbesar enzim β-1,3-glukanase yang diisolasi dari cairan pencernaan Achatina fulica.
1.4Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi ilmiah tentang pemurnian
parsial dan karakterisasi enzim β-1,3-glukanase yang dapat dimanfaatkan pada beberapa bidang. Salah satunya untuk bidang kesehatan yaitu sebagai alternatif
BAB II
TINJAUAN PUSTAKA
2.1 Enzim
Enzim merupakan senyawa organik bermolekul besar yang berfungsi
untuk mempercepat jalannya reaksi metabolisme di dalam tubuh tanpa
mempengaruhi keseimbangan reaksi. Enzim berikatan dengan substrat dan
mengarahkannya dengan tepat untuk bereaksi. Substrat adalah substansi yang
mengalami perubahan kimia setelah bereaksi dengan enzim, sedangkan produk
adalah substansi baru yang terbentuk setelah setelah reaksi Masing-masing enzim
mengkatalisis suatu reaksi biokimia spesifik. Enzim hanya bereaksi dengan satu
substrat dan mengubah substrat tersebut menjadi suatu produk. Enzim secara
umum menghasilkan kecepatan, spesifitas, dan kendali pengaturan terhadap reaksi
yang berlangsung dalam tubuh. Hal ini disebabkan karena urutan asam amino
spesifik yang unik yang membentuk enzim serta mengikat dan mengaktifkan
molekul substrat (Voet and Voet, 2004).
2.1.1 Struktur enzim
Kebanyakan enzim merupakan protein globular yang memiliki struktur
tiga dimensi spesifik yang dibentuk oleh struktur primer, sekunder dan tersiernya.
Selain itu, enzim juga ada yang memiliki struktur kuartener karena tersusun atas
lebih dari satu rantai protein (McMurry and Marry, 1994). Struktur primer
merupakan urutan linear asam amino yang disatukan oleh ikatan peptida. Struktur
sekunder terbentuk karena daerah di dalam rantai peptida dapat membentuk
antara atom-atom ikatan peptida. Ini berhubungan dengan pengaturan kedudukan
ruang residu asam amino yang berdekatan dengan urutan linear dan membentuk
struktur α heliks, β sheet dan loop. Konformasi tersier protein terdiri atas beberapa jenis ikatan antara lain : ikatan hidrogen yang terdapat diantara gugus R residu
asam amino rantai samping yang berdekatan, ikatan ion diantara gugus R yang
berlawanan, interaksi hidrofobik dari gugus R asam amino hidrofobik dan ikatan
kovalen berupa ikatan disulfida dari residu sistein (Stryer, 2002).
2.1.2 Klasifikasi enzim
Berdasarkan jenis reaksi yang dikatalisis oleh enzim maka enzim dibagi
menjadi enam klasifikasi yaitu oksidoredutase, transferase, hidrolase, liase,
isomerase dan ligase (McMurry and Mary, 1994).
1. Oksidoreduktase
Enzim oksidoreduktase adalah enzim yang dapat mengkatalisis reaksi
oksidasi atau reduksi suatu bahan. Dalam golongan ini terdapat 2 jenis enzim
yang paling utama yaitu oksidase dan dehidrogenase.
a. Oksidase adalah enzim yang mengkatalisis reaksi antara substrat dengan
molekul oksigen. Yang termasuk enzim oksidase adalah katalase, peroksidase,
tirosinase, dan asam askorbat oksidase.
b. Dehidrogenase adalah enzim yang aktif dalam pengambilan atom hidrogen dari
substrat. Contohnya yaitu suksinat dehidrogenase, glutamat dehidrogenase, dan
2. Transferase
Enzim transferase adalah enzim yang ikut serta dalam reaksi pemindahan
(transfer) suatu radikal atau gugus. Enzim yang termasuk dalam golongan ini
adalah transglikosidase, transfosforilase, transaminase, dan transasetilase.
3. Hidrolase
Enzim hidrolase merupakan enzim yang sangat penting dalam pengolahan
pangan, yaitu enzim yang mengkatalisis reaksi hidrolisis suatu substrat atau
pemecahan substrat dengan pertolongan molekul air.
4. Liase
Enzim liase adalah enzim yang aktif dalam pemecahan ikatan C-C dan
ikatan C-O dengan tidak menggunakan melekul air. Yang termasuk dalam
golongan enzim ini adalah enzim dekarboksilase.
5. Isomerase
Enzim isomerase adalah enzim yang mengkatalisis reaksi perubahan
konfigurasi molekul substrat, sehingga dihasilkan molekul baru yang merupakan
isomer dari substrat, atau dengan perubahan isomer posisi. Yang termasuk dalam
golongan ini adalah enzim fosfoheksosa isomerise atau fosfomanosa isomerase.
6. Ligase
Enzim ligase adalah golongan enzim yang mengkatalis terjadinya ikatan
bersama atau penggabungan dua molekul substrat dengan partisipasi dari ATP.
2.1.3 Mekanisme kerja enzim
Enzim bekerja secara spesifik dalam mengkatalisis suatu reaksi. Hanya
tertentu yang dapat dikatalisis. Enzim mempunyai sisi aktif, yaitu sisi yang ada
pada enzim yang dapat melakukan fungsi pengarahan, pengikatan, dan katalisis,
yang tidak terdapat pada protein pada umumnya. Sisi aktif enzim pada umunya
berbentuk celah, yang tersusun atas sisa asam amino bagian rantai polipeptida
enzim. Substrat enzim sebelum diurai atau digandengkan harus masuk dulu ke
dalam celah. Dalam hal ini substrat yang masuk ke dalam celah harus memenuhi
beberapa syarat yaitu, komplementer dengan celah dan harus ada bagian yang
labil agar bisa digandengkan atau diurai (Martoharsono, 2006)
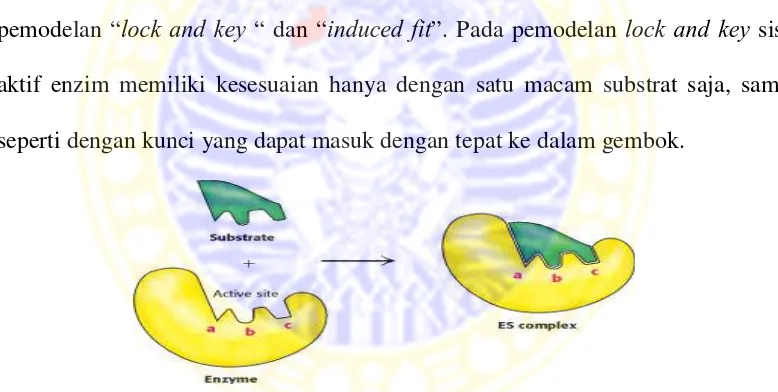
Sifat komplementer enzim dan substrat dikemukakan dengan teori
pemodelan “lock and key “ dan “induced fit”. Pada pemodelan lock and key sisi
aktif enzim memiliki kesesuaian hanya dengan satu macam substrat saja, sama
seperti dengan kunci yang dapat masuk dengan tepat ke dalam gembok.
Gambar 2.1 Mekanisme kerja enzim model lock and key (Stryer et al., 2002)
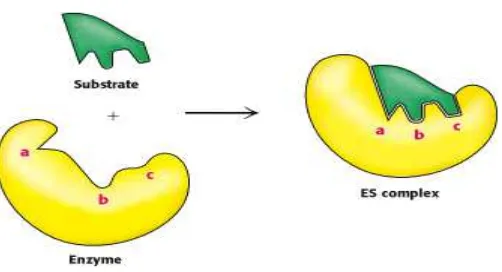
Sedangkan melalui penjelasan pemodelan induced-fit, kinerja enzim yang
spesifik dapat dijelaskan dengan lebih luas. Pada induced fit dijelaskan bahwa
beberapa enzim cukup fleksibel dalam mengubah bentuk dan ukuran sisi aktif
mereka untuk disesuaikan dengan ruang yang diperlukan oleh substrat yang
berbeda. Dengan demikian enzim dan substrat dapat bergabung dan interaksi
Gambar 2.2 Mekanisme kerja enzim model induced fit (Stryer et al., 2002)
Selain bekerja secara spesifik, enzim juga bekerja dengan mempercepat
terjadinya suatu reaksi. Hal ini karena dalam suatu reaksi enzim bekerja dengan
menurunkan energi aktivasi, yaitu jumah energi dalam kalori yang diperlukan
untuk membawa semua molekul pada 1 mol senyawa pada suhu tertentu menuju
tingkat transisi pada puncak batas energi. Enzim juga mempunyai suatu afinitas
yang tinggi terhadap substrat dan mempunyai kemampuan mengikatnya walaupun
bersifat sementara.
2.1.4 Faktor yang mempengaruhi aktivitas enzim
1. Konsentrasi Substrat
Konsentrasi substrat mempengaruhi kecepatan reaksi suatu enzim.
Konsentrasi yang tinggi dapat memperbesar laju reaksi. Tapi jika konsentrasi
substrat diperbesar maka tidak akan ada lagi penambahan laju reaksi (Stryer,
2002). Keadaan ini telah dijelaskan oleh Michealis – Menten dengan hipotesis
mereka tentang terjadinya kompleks enzim substrat. Untuk dapat terjadi kompleks
enzim substrat, perlu adanya kontak antara enzim dengan substrat.
Kontak ini terjadi pada suatu tempat atau bagian enzim yang disebut
bagian aktif. Pada konsentrasi substrat rendah, bagian aktif enzim ini hanya
substrat yang berhubungan dengan enzim pada bagian aktif tersebut. Dengan
demikian konsentrasi kompleks enzim substrat makin besar dan hal ini
menyebabkan makin besarnya kecepatan reaksi. Pada suatu batas konsentrasi
substrat tertentu, semua bagian aktif telah dipenuhi oleh substrat atau telah jenuh
dengan substrat. Dalam hal ini, bertambahnya konsentrasi substrat tidak
menyebabkan bertambah besarnya konsentrasi kompleks enzim substrat, sehingga
jumlah hasil reaksi pun tidak bertambah besar.
2. Suhu
Pada suhu rendah reaksi berlangsung lambat, sedangkan pada suhu yang
tinggi reaksi berlangsung cepat. Disamping itu, karena enzim adalah suatu
protein, maka kenaikan suhu dapat menyebabkan terjadinya proses denaturasi.
Apabila terjadi proses denaturasi, maka bagian aktif enzim akan terganggu dan
dengan demikian konsentrasi efektif enzim menjadi berkurang dan kecepatan
reaksinya pun akan menurun.
3. pH
Seperti protein pada umumnya, struktur ion enzim tergantung pada pH
lingkungannya. Enzim dapat berbentuk ion positif, ion negatif atau ion bermuatan
ganda (zwitter ion). Dengan demikian perubahan pH lingkungan akan
berpengaruh terhadap efektivitas bagian aktif enzim dalam membentuk kompleks
enzim substrat. Di samping pengaruh terhadap struktur ion pada enzim, pH rendah
atau pH tinggi dapat pula menyebabkan terjadinya proses denaturasi dan ini akan
4. Inhibitor
Hambatan atau inhibisi pada suatu reaksi yang menggunakan enzim
sebagai katalis dapat terjadi apabila penggabungan substrat pada bagian aktif
enzim mengalami hambatan. Molekul atau ion yang dapat menghambat reaksi
tersebut dinamakan inhibitor. Hambatan yang dilakukan inhibitor dapat berupa
hambatan tidak reversibel atau hambatan reversibel. Hambatan tidak reversibel
pada umumnya disebabkan oleh terjadinya modifikasi sebuah gugus fungsi atau
lebih yang terdapat pada molekul enzim. Hambatan reversibel dapat berupa
hambatan bersaing atau hambatan tidak bersaing.
5. Ko-enzim dan aktivator
Enzim sering kali memerlukan bantuan substansi lain agar berfungsi
secara efektif. Ko-enzim adalah substansi bukan protein yang mengaktifkan
enzim.
2.2 Enzim β-1,3-glukanase
Enzim β-1,3-glukanase secara luas ditemukan pada sebagian besar bakteri, jamur, tanaman tingkat tinggi dan hewan invertebrata. Enzim β-1,3-glukanase diklasifikasikan sebagai enzim hidrolisis oleh International Union Biokimia dan
Biologi molekuler (IUBMB, 1992) berkaitan dengan aktivitas hirolisisnya pada
substrat. Berdasarkan aktivitas hidrolitiknya terdapat dua jenis β-1,3-glukanase, yang pertama ekso-β-1,3-glukanase yang menghidrolisis ikatan β-1,3-glukan secara berurutan, dari ujung non-reduksi suatu polimer atau oligomers, sehingga
sepanjang rantai polisakarida, sehingga dihasilkan oligosakarida (Reese &
Mandels, 1959).
Substrat spesifik bagi enzim ini adalah polisakarida berikatan β-1,3-glukan yang dinamakan laminarin dan banyak ditemukan pada dinding sel jamur patogen
(Adams, 2004). Salah satu jamur patogen yang dapat menginfeksi manusia yaitu
C.albicans. Jamur ini merupakan jamur patogen penyebab kandiasis dalam tubuh.
Percobaan yang dilakukan oleh Nett et al. (2007) menunjukkan bahwa kandungan
β-1,3 glukan meningkat pada dinding sel C.albicans dalam bentuk biofilm dibandingkan dengan sel bebas. Dinding sel C.albicans itu sendiri terdiri dari
struktur lapisan multilayer diluar lapisan membran plasma. Struktur multilayer
inilah yang merupakan struktur yang sangat penting bagi fungsi biologik jamur
yaitu mempertahankan bentuk jamur, sebagai barrier permeabilitas dan pelindung
bagi membran dan sitoplasma didalamnya. Oleh karena itu, untuk menghambat
pertumbuhan C. albicans dengan menghidrolisis β-1,3 glukan pada dinding sel dengan enzim β-1,3 glukanase. Enzim β-1,3-glukanase melakukan penyerangan subsrat β-1,3-glukan pada sisi ikatan 1,3.
Gambar 2.3 Aktivitas enzim β-1,3-glukanase terhadap substrat β-1,3-glukan (Kirstee et al, 2005). Tanda panah menunjukkan sisi pemotongan enzim terhadap
2.3 β-1,3-glukan
β-1,3-glukan adalah komponen struktur utama dinding sel dari banyak jamur patogenik khususnya C.albicans. Strukturnya terdiri dari 1.500 residu
glukosa yang bergabung dalam konfigurasi ikatan β-glikosidik (Kirstee et al., 2005). Ikatan glikosidik adalah ikatan antara dua molekul monosakarida. Ikatan
ini terbentuk antara gugus hidroksil dari atom C nomor satu yang juga disebut
karbon anomerik dengan gugus hidroksil dan atom C pada molekul gula yang
lain.
Komposisi β-glukan dalam dinding sel C.albicans adalah 47 - 60%. Polimer ini menyajikan struktur mikrofibrillar yang memberikan elastisitas dan
kekuatan tarik ke dinding sel jamur (de Nobel et al, 2001). Dinding sel Candida
albicans juga tersusun dari mannoprotein, β-glukan, kitin, komponen protein, dan lipid ( Bernadus, 2007). Sehingga untuk menekan pertumbuhan dinding sel jamur
yaitu dengan menghidrolisis ikatan β-1,3-glukan menggunakan enzim β -1,3-glukanase yang diisolasi dari Achatina fulica.
Gambar 2.4 Struktur dinding sel C.albicans dengan komponen utama β- glukan.
2.4 Achatina fulica
Bekicot (Achatina fulica) merupakan Gastropoda paling besar, berasal dari
concha yang mengunjungi Mauritrius membawa beberapa specimen hidup ke
Calcutta. Di situ Achatina fulica berkembang baik dan tersebar luas tanpa ada
musuhnya. Di Sumatra dan Jawa hewan ini telah merusak perkebunan karet. Pada
tahun itu juga telah mencapai Taiwan dan disambut hangat orang-orang jepang
sebagai makanan menarik dan berkhasiat sebagai obat (Radiopoetro, 1988)
2.4.1 Klasifikasi Achatina fulica
Klasifikasi Achatina fulica menurut Malek (1980) adalah sebagai berikut :
Subkingdom : Metazoa
Species : Achatina fulica
2.4.2 Karakteristik umum Achatina fulica
Bekicot (Achatina fulica) merupakan salah satu jenis molusca dengan
ciri-ciri umum bertubuh lunak dan terbungkus dalam rumah berkapur yang berasal
dari sekretnya sendiri. Rumah berkapur atau biasa disebut dengan cangkang ini
berfungi sebagai pelindung badan untuk mempertahankan diri dari musuh
(Santoso, 1989). Pada bagian kepala terdapat dua tentakel sebagai alat peraba
(perasa). Tentakel ini berguna untuk merasakan perubahan suhu, sebagai
penunjuk jalan dan sebagai penunjuk adanya makanan.
Dalam mulut terdapat radula (semacam lidah) untuk memarut daun.
Bagian bawah kaki terdapat kelenjar yang dapat mengeluarkan lendir pada saat
berjalan. Achatina fulica aktif di waktu malam dan bergerak maju, dengan
gelombang aksi otot-otot pada sisi ventral kaki, di atas bekas lendir yang dibuat
oleh kelenjar kaki di bawah mulut. Dengan radula, tanaman hijau yang lunak dan
tidak berbulu dipegang oleh rahang lalu diparut dengan radula (Radiopoetro,
1988).
Tempat yang disukai Achatina fulica adalah tempat yang menyediakan
makanan, temperatur rendah, dan terlindung dari sinar matahari. Faktor-faktor
yang mempengaruhi habitatnya adalah temperatur, persediaan kalsium, pH tanah,
kelembaban dan persediaaan makanan. Achatina fulica mempunyai ketahanan
fisik dan ketahanan hidup yang tinggi serta mudah berkembang biak di daerah
tropis (Radiopoetro, 1988). Achatina fulica merupakan hewan hermaprodit, akan
fulica mempunyai sistem reproduksi, respirasi, ekskresi, dan digesti (pencernaan)
yang kompleks.
2.4.3 Sistem pencernaan Achatina fulica
Sistem pencernaan Achatina fulica terdiri dari rongga mulut dilanjutkan
kedalam esophagus yang sempit, yang kemudian melebar membentuk ingluvies.
Ingluvies berupa sebuah kantong besar dengan deretan glandulae salivales dalam
sepanjang dindingnya dan saluran- salurannya bermuara di ujung anterior
esophagus. Glandulae salivales menghasilkan lendir berair yang berisi enzim –
enzim diastase, yaitu yang menguraikan hidrat arang. Ingluvies juga berisi cairan
yang berasal dari glandulae digestoriae yang mengalir dari tempat keluarnya
kedalam ventriculus, cairan ini berisi enzim – enzim dan termasuk juga
didalamnya enzim cytase yang mencerna seluosa, seperti halnya pada Helix, yaitu
sejenis siput darat yang ada di Amerika (Radiopoetro, 1988).
Enzim cytase tersebut berasal dari bakteri hidup di dalam intestinum dan
ingluives. Enzim ini menghancurkan dinding sel tumbuh- tumbuhan sehingga isi
sel dapat dilepaskan keluar. Bagian berikutnya setelah ingluives adalah
ventriculus yang berupa kantong yang cukup luas tetapi sederhana,dilingkupi oleh
glandulae digestoriae yang menggerombol di sekeliling kebanyakan alat – alat
dalam. Glandulae digestoriae terdiri dari kumpulan tubuli yang bercabang –
cabang dan berakhir buntu pada gerombolan sel – sel. Dikenal ada tiga macam
sel, yaitu:
2) Sel yang menyerap partikel- partikel makanan dan mencernakannya intra-
seluler, juga menyerap hasil –hasil pencernaan di luar sel.
3) Sel yang mengasilkan CaCO3, fungsinya terutama ialah untuk membentuk
concha. Lanjutan ventriculus ialah intestinum yang berjalan berkelok – kelok yang
berakhir pada rektum yang bermuara keluar melalui anus. Penyerapan hasil – hasil
pencernaan terutama berlangsung di dalam intestinum (Radiopoetro, 1995).
Selain itu, Weel (1961) menyatakan bahwa ekstrak kelenjar saluran
pencernaan (digestive gland) Achatina fulica memiliki campuran enzim
carbohydrase yaitu berupa enzim kitinase, xilase, cellulase, lichenase, inulase,
hemiselulase, amilase, maltase, dan sukrase. Disamping itu, dygestive gland siput
mengandung enzim protease, dan polypeptidase. Selain itu juga mengandung
enzim hidrolitik yang terdiri dari enzim β-1,3-glukanase dan enzim β -1,4-glukanase (Gabriel and Kopecka, 1987). Enzim β-1,3-glukanase merupakan enzim yang menghidrolisis ikatan β-1,3-glukan pada dinding sel jamur patogen salah satunya C. albicans.
2.5 Pemurnian Enzim
Tujuan yang ingin dicapai dalam pemurnian enzim adalah mengisolasi
enzim spesifik dari senyawa lain yang tidak dikehendaki. Tahap-tahap pemurnian
tergantung tujuan akhir, apakah untuk tujuan komersial sebagai enzim industri
atau tujuan riset. Untuk kepentingan riset, biasanya enzim perlu dimurnikan
beberapa tahap dengan resiko terjadi kehilangan yang cukup besar (hingga 90%).
Enzim untuk kepentingan industri sedapat mungkin dicegah dari kehilangan,
menghilangkan senyawa yang mengganggu proses. Pemurnian protein dilakukan
berdasarkan sifat kelarutan, ukuran, muatan afinitas pengikatan protein itu sendiri.
Oleh karena itu campuran protein selanjutnya dipisahkan dengan berbagai seri
pemisahan.
Permasalahan dalam pemurnian protein atau enzim adalah memisahkan
enzim yang dikehendaki dari ratusan protein yang mempunyai stuktur kimia dan
fisika yang serupa. Semua langkah pemurnian menggunakan larutan penyangga
dengan pH tertentu. Larutan penyangga yang digunakan mempengaruhi sifat
biofisika protein. Jumlah protein enzim diakhir proses pemurnian tidak hanya
bergantung pada material awal tetapi juga bergantung pada proses. Ada protein
yang hilang pada setiap pemurnian, oleh karena itu perlu memaksimalkan langkah
kerja sehingga dapat memperoleh enzim yang optimal (Harris dan Angal, 1989)
Harris (1989) menyebutkan ada tiga faktor yang harus diperhatikan dalam
pemurnian enzim yaitu faktor kualitas, kuantitas dan ekonomis. Faktor kualitas
yaitu perlu tindakan untuk mempertahankan aktivitas protein dengan cara
mengurangi proteolisis dan denaturasi. Faktor kuantitas yaitu pemakaian akhir
dari protein murni akan menentukan kualitas enzim yang diperlukan sedangkan
ekonomis merupakan kunci penting bila akan dipakai dalam industri atau
diterapkan dalam skala laboratorium.
Pemurnian enzim dapat dilakukan dengan beberapa cara antara lain dengan
cara pengendapan dalam garam ammonium sulfat (salting out) atau pelarut
Penggunaan amonium sulfat untuk salting out memiliki keuntungan, antara
lain harga relatif murah, kelarutannya tinggi, pH larutan tidak berubah secara
ekstrem, dan tidak bersifat toksik. Kerugiannya ialah konsentrasi garam yang
tertinggal dalam produk tinggi sehingga kurang efisien dalam menghilangkan
pengotor. Pengendapan protein dengan pelarut organik seperti aseton lebih mudah
dilakukan karena penghilangan sisa aseton dapat dilakukan dengan sentrifugasi
dan penguapan.
2.6 Fraksinasi Pelarut Organik
Fraksinasi dengan pelarut organik dapat menggunakan aseton dan etanol.
Namun, untuk pemurnian protein lebih mudah menggunakan aseton karena aseton
tidak memilik efek azeotrop seperti etanol. Prinsip kerja dari fraksinasi dengan
pelarut aseton yaitu teknik pengendapan untuk meniadakan efek perlindungan
molekul air di sekitar permukaan molekul protein, akibatnya
molekul-molekul protein akan beragregasi sesamanya kemudian mengendap. Pengendapan
protein dengan pelarut organik aseton didasarkan pada sifat yang tidak saling larut
antara aseton (non-polar) dan molekul air (polar).
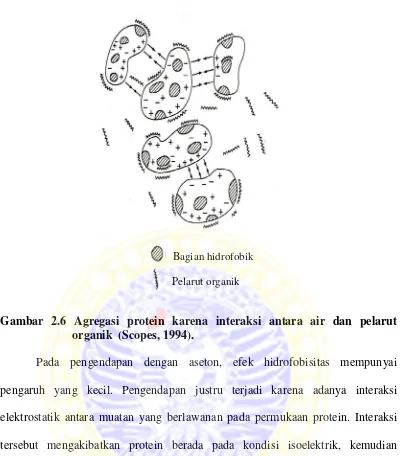
Penambahan aseton ke dalam larutan protein akan menurunkan konstanta
dielektrikum pelarut air dan mengurangi solvasi air terhadap residu hirofilik
enzim. Posisi air di sekitar daerah hidrofobik dari permukaan protein akan
Gambar 2.6 Agregasi protein karena interaksi antara air dan pelarut organik (Scopes, 1994).
Pada pengendapan dengan aseton, efek hidrofobisitas mempunyai
pengaruh yang kecil. Pengendapan justru terjadi karena adanya interaksi
elektrostatik antara muatan yang berlawanan pada permukaan protein. Interaksi
tersebut mengakibatkan protein berada pada kondisi isoelektrik, kemudian
beragregasi dan akhirnya mengendap. Pengendapan dengan aseton baik dilakukan
untuk mengisolasi protein-protein kaya akan residu hidrofobik yang lokasinya
disekitar membran (Scopes, 1994). Prosedur fraksinasi pelarut organik aseton
dilakukan pada suhu dibawah 00C. Pada suhu diatas 100C, akan terjadi
denaturasi.
Bagian hidrofobik
Gambar 2.7 Proses denaturasi protein jika suhu pelarut organik lebih dari 0oC (Scopes, 1994)
Pada proses denaturasi, konformasi protein akan segera berubah yang
memungkinkan molekul-molekul pelarut organik mendapatkan jalan masuk
kebagian dalam struktur protein, kemudian merusak interaksi hidrofobik (Harris
1989, Scopes 1994).
Interaksi internal hidrofobik
Molekul pelarut organik berinteraki dengan residu hidrofobik
Denaturasi
BAB III
METODE PENELITIAN
3. 1 Tempat dan waktu penelitian
Penelitian ini di kerjakan di laboratorium Biokimia Departemen Kimia
Fakultas Sains dan Teknologi Universitas Airlangga pada bulan Februari 2012 -
Juli 2012.
3.2 Alat dan bahan penelitian
3.2.1 Bahan penelitian
Bahan-bahan yang digunakan adalah Achatina fulica yang didapatkan dari
kota Kediri, substrat laminarin, garam Rochelle, fenol, asam 3,5-dinitrosalisilat,
glukosa anhidrat, aseton, buffer fosfat, asam sitrat, buffer sitrat, reagen Lowry C,
akuades, dan kertas saring.
3.2.2 Peralatan penelitian
Alat-alat yang digunakan dalam penelitian ini adalah seperangkat alat
gelas yang biasa digunakan di laboratorium kimia seperti gelas ukur, gelas arloji,
pipet tetes, pipet volume dll. Alat-alat yang digunakan adalah sentrifugator
(Centrific-228), inkubator (Memmert), spektrofotometer UV-Vis (Shimadzu),
blender (Philip), neraca analitik (Kern 870), timbangan (Kern 444-45), water bath,
pHmeter (Orion-420A), magnetic stirer (Thermolyne Cimarec), kulkas (Sharp),
3.4 Prosedur Penelitian
3.4.1 Karantina Achatina fulica
Sejumlah Achatina fulica dikarantina selama 1 minggu dalam sebuah
kandang tertutup dengan beberapa ventilasi. Kandang dibuat lembab sesuai
dengan habitat asli Achatina fulica. Proses karantina bertujuan agar Achatina
fulica tersebut berada pada kondisi nutrisi yang sama dengan pemberian sumber
makanan berupa serat seperti kubis, daun singkong dll sehingga kandungan enzim
hidrolase dalam cairan pencernaan Achatina fulica maksimal serta lebih homogen.
3.4.2 Panen ekstrak kasar enzim Achatina fulica
Cangkang ekor (apex) Achatina fulica dipecah, cairan yang keluar dari
ekor Achatina fulica ditampung. Cairan ini berasal dari kelenjar pencernaan yang
mengandung konsorsium enzim. Cairan yang terkumpul disentrifugasi dengan
kecepatan 4000 rpm selama 20 menit. Jika terdapat endapan dan supernatan, maka
supernatan merupakan ekstrak kasar enzim cairan pencernaan Achatina fulica.
Preparat ekstrak kasar enzim dari cairan pencernaan Achatina fulica harus segera
digunakan agar tidak rusak.
3.4.3 Pembuatan kurva standar glukosa
Untuk membuat kurva standar, ditimbang 1 gram glukosa anhidrat
kemudian dilarutkan dalam labu ukur 100 mL akuades dalam labu ukur 100 mL
diperoleh larutan induk glukosa dengan konsentrasi 10 mg/mL. Standar glukosa
dibuat pada variasi konsentrasi 2-8 mg/mL. Penentuan kurva standar glukosa
berdasarkan metode DNS (Asam 3,5-dinitrosalisilat) sebagai berikut : Larutan
DNS 3 mL, dikocok dan dipanaskan pada penangas air mendidih 100oC selama 15
menit, kemudian didinginkan dalam air es selama 20 menit. Absorbansi diukur
dengan menggunakan spektrofotometer UV-VIS pada λ 550 nm. Prosedur yang sama digunakan untuk blanko dengan mengganti glukosa dengan aquades.
3.4.4 Uji aktivitas enzim β-1,3-glukanase
Untuk menentukan aktivitas enzim β-1,3-glukanase dengan cara menentukan jumlah glukosa yang terbentuk, yaitu dengan metode DNS (Asam
3,5-dinitrosalisilat). Penentuan aktivitas enzim β-1,3-glukanase yang diisolasi dari Achatina fulica dilakukan secara kuantitatif menggunakan substrat laminarin.
Sampel berupa 75 µL ekstrak enzim β-1,3-glukanase dalam 750 µL substrat 1% dalam buffer sitrat fosfat pH 5. Campuran tersebut diinkubasi dalam waterbath
pada suhu 37oC selama 10 menit. Hasil Inkubasi ditambahkan dengan 450 µL DNS lalu tabung diletakkan dalam penangas air mendidih selama 15 menit.
Kemudian segera didinginkan dalam air es selama 20 menit. Gula pereduksi yang
terbentuk diukur pada spektrofotometer pada panjang gelombang 550 nm dengan
menggunakan glukosa sebagai standar.
Satu unit aktivitas β-1,3-glukanase didefinisikan sebagai jumlah enzim β -1,3-glukanase dalam 1 mL ekstrak β-1,3-glukanase yang membebaskan 1 µmol gula pereduksi yang dihitung sebagai glukosa per menit pada kondisi percobaan.
Sedangkan untuk penentuan aktivitas spesifik enzim β-1,3-glukanase harus diketahui kadar protein. Aktivitas spesifik adalah total unit aktivitas enzim per
3.4.5 Pemurnian parsial dengan fraksinasi aseton
Fraksinasi aseton dilakukan pada suhu rendah dibawah -100C dengan
beberapa percobaan hingga didapatkan fraksi yang optimum. Fraksinasi pertama,
dimulai dari prosentase aseton 0-40% dan 40-75%. Ekstrak enzim β -1,3-glukanase sebanyak 20 mL ditambahkan aseton pada suhu -200C. Penambahan
volume aseton sesuai dengan tabel fraksinasi pada lampiran. Setelah penambahan
aseton, kemudian disentrifuga pada kecepatan 8000 rpm selama 20 menit.
Didapatkan endapan fraksi 0-40% dan supernatan. Endapan disimpan untuk
diukur aktivitasnya sedangkan supernatan diambil dan ditambahkan aseton untuk
fraksi selanjutnya.
Setiap endapan yang terbentuk dari masing-masing fraksi dilakukan
pengukuran aktifitas dari enzim β-1,3-glukanase. Jika aktivitas spesifik yang didapatkan dari fraksinasi masih kecil maka, dilakukan fraksinasi lagi dengan
prosentase aseton yang berbeda. Setiap fraksinasi menghasilkan aktivitas spesifik
yang berbeda. Dimungkinkan dalam tahap fraksinasi ini masih belum optimum,
artinya, masih ada enzim yang belum terendapkan pada rentang prosentase aseton.
Maka, harus dilakukan fraksinasi kembali hingga mendapatkan aktifitas enzim
yang paling tinggi.
3.4.6 Pembuatan kurva standar protein
Kurva standar protein dibuat menggunakan metode Lowry. Sebanyak 1
gram BSA (Bovin Serum Albumin) pada labu ukur 100 ml. Dengan demikian
kemudian dibuat larutan standar dengan variasi konsentrasi 100-500 µg/ml. Dari masing-masing konsentrasi larutan standar diambil 0,5 ml kemudian ditambah
larutan C (Komposisi larutan di Lampiran). Kedua larutan yang sudah dicampur
di vortex pada suhu ruang selama 5-10 menit. Selesai di vortex kemudian
ditambahkan 0,25 ml larutan D dan di vortex lagi. Setelah 20-30 menit, diukur
absorbansinya pada panjang gelombang 750 nm.
3.4.7 Penentuan kadar protein
Membuat 4 larutan yaitu Larutan A, Larutan B, Larutan C dan Larutan D
(Komposisi larutan ada di lampiran). Kemudian 0,5 mL larutan sampel
ditambahkan 2,5 mL larutan C. Kedua larutan yang sudah dicampur di vortex
pada suhu ruang selama 5-10 menit. Selesai di vortex kemudian ditambahkan 0,25
ml larutan D dan di vortex lagi. Setelah 20-30 menit, diukur absorbansinya pada
panjang gelombang 750 nm.
3.4.7 Karakterisasi Enzim
3.4.7.1 Penentuan suhu optimum aktivitas enzim β-1,3-glukanase
Pengujian suhu optimal aktivitas enzim β-1,3-glukanase dilakukan dengan menginkubasikan enzim dan substrat laminarin 1 mg/mL pada variasi suhu 300C,
370, 450C dan 500C.
3.4.7.2 Penentuan pH optimum akivitas enzim β-1,3-glukanase
pH optimum enzim ditentukan dengan menguji aktivitas enzim β -1,3-glukanase dengan substrat laminarin 1 mg/mL pada kisaran pH 4-8. Buffer sitrat
digunakan untuk pendaparan pH 3-6, buffer fosfat untuk pendaparan pH 7-8,
3.4.8 Analisis data
Aktivitas enzim dapat dihitung dengan membuat kurva baku glukosa yang
dibuat dari absorbansi pada panjang gelombang 550 nm terhadap kadar glukosa
standar menggunakan persamaan regresi linier sebagai berikut :
Y=bx+a
Dengan ketentuan :
Y= absorbansi
Absorbansi = Abssampel - Abskontrol
X=kadar glukosa (ug/mL)
b=Kemiringan Kurva
a=intersept
Ativitas Enzim ditentukan menggunakan rumus :
U = (X) x FP
BM X Waktu Inkubasi
Keterangan :
U = Aktivitas Enzim (Unit/ml)
X = Kadar glukosa yang terbentuk (mg/ml)
FP = Faktor Pengenceran
BM = Berat Molekul Glukosa
Sedangkan untuk mencari aktivitas spesifik dengan menggunakan rumus :
BAB IV
HASIL DAN PEMBAHASAN
4.1 Karantina Achatina fulica
Achatina fulica yang digunakan pada penelitian ini didapat dari kota
Kediri, Jawa Timur. Sebelum dilakukan isolasi cairan pencernaan, Achatina fulica
dikarantina terlebih dahulu. Proses karantina bertujuan agar Achatina fulica
berada pada kondisi nutrisi homogen yang berupa serat seperti kubis, daun
pepaya, daun singkong dll. Dengan demikian, diharapkan kandungan enzim
hidrolase dalam cairan pencernaan Achatina fulica dapat maksimal. Hal ini
berdasarkan teori enzim induktif yaitu enzim yang dibentuk karena adanya
induksi oleh substrat atau derivatnya.
Karantina Achatina fulica berlangsung selama 1 minggu dalam sebuah
kandang tertutup dengan beberapa ventilasi. Pemberian ventilasi bertujuan untuk
pertukaran udara. Kandang dibuat lembab dan terlindung dari cahaya matahari
secara langsung agar sesuai dengan habitat asli Achatina fulica. Kandang juga
harus dalam keadaan bersih agar Achatina fulica berada dalam keadaan steril.
Kelembapan kandang dapat dijaga dengan diberi pelepah pisang atau wadah berisi
air.
4.2 Panen Ekstrak Enzim Kasar Achatina fulica
Cairan pencernaan Achatina fulica yang mengandung konsorsium enzim
dipanen setiap akan dilakukan percobaan agar enzim tidak mengalami penurunan
aktivitas. Proses pengambilan cairan pencernaan dengan cara memecah cangkang
pada gelas beker dalam es agar tidak terjadi perubahan aktivitas. Hal ini karena,
aktivitas enzim salah satunya dipengaruhi oleh faktor suhu. Dari 50 ekor Achatina
fulica didapatkan sekitar 30 mL cairan pencernaan yang merupakan konsorsium
enzim salah satunya terdiri dari enzim β-1,3 glukanase.
Konsorsium enzim dari cairan pencernaan masih mengandung partikel dan
biomassa sel sehingga harus dipisahkan dengan sentrifugasi pada kecepatan 4000
rpm selama 20 menit. Sentrifugasi bertujuan untuk sedimentasi partikel
berdasarkan peningkatan medan gravitasi. Biomassa sel yang mempunyai massa
dan kerapatan lebih besar daripada protein mengendap , sedangkan protein enzim
tetap dalam larutan sebagai supernatan.
4.3 Uji Aktivitas Enzim
4.3.1 Pembuatan kurva standar glukosa
Kurva standar diperlukan untuk menentukan konsentrasi larutan sampel
yang telah diketahui absorbansinya. Untuk membuat kurva standar glukosa,
digunakan standar glukosa pada variasi konsentrasi 2-8 mg/ml. Pembuatan kurva
standar glukosa berdasarkan metode DNS (Asam 3,5-dinitrosalisilat). Dari
pengukuran didapatkan nilai absorbansi yang kemudian dimasukkan dalam kurva
dan didapatkan persamaan regresi y= 0,121x-0,064. Persamaan ini selanjutnya
digunakan untuk pengukuran aktivitas enzim β-1,3 glukanase sebelum dan setelah dilakukan pemurnian parsial dengan fraksinasi aseton. Nilai y pada persamaan
regresi tersebut merupakan selisih antara absorbansi sampel dan absorbansi
kontrol, sedangkan nilai x merupakan kadar glukosa yang terbentuk dari aktivitas
Gambar 4.1 Penentuan kurva standar glukosa
4.3.2 Pembuatan kurva progress enzim β-1,3 glukanase
Jumlah enzim ditentukan dengan cara uji aktivitas enzim berdasarkan
metode DNS (Asam 3,5-dinitrosalisilat) menggunakan substratnya pada waktu
inkubasi tertentu. Untuk menentukan waktu inkubasi yang optimal dibuat kurva
progres aktivitas enzim terhadap waktu pada selang waktu 10-50 menit. Kurva
progres merupakan gambaran untuk mendapatkan Vo yaitu kondisi yang tepat
untuk mendapatkan waktu inkubasi yang optimal. Vo didapatkan dari titik saat
kurva berbentuk garis lurus selanjutnya kurva tidak lurus lagi dengan V lebih
rendah daripada Vo.
Gambar 4.2 Penentuan kurva progres enzim β-1,3-glukanase
12
O
D
λ550
nm
O
D
λ550
nm
Berdasarkan Gambar 4.2, didapatkan bahwa pembentukan produk
persatuan waktu maksimal dan meningkat tajam sampai masa inkubasi 10 menit.
Dalam kondisi ini enzim berada pada kecepatan awal (Vo). Pada Gambar 4..2,
nilai slope garis mula-mula tinggi namun slope menurun dimulai menit ke-12.
Nilai slope atau kemiringan tersebut menunjukkan kecepatan reaksi enzim.
Setelah waktu 12 menit, kecepatan reaksi enzim menurun dari Vo dan hampir
tidak terbentuk produk lagi. Kecepatan reaksi enzim yang mengalami penurunan
dari Vo ini antara lain dapat disebabkan karena inhibisi enzim oleh produk atau
suhu reaksi enzimatis. Semakin lama waktu inkubasi, produk yang terbentuk akan
menjenuhi enzim. Sedangkan faktor suhu yaitu pada waktu inkubasi yang
semakin lama bagi enzim tertentu dapat mengalami perubahan struktur pada sisi
aktif. Sehingga dari Gambar 4.2 dapat disimpulkan bahwa, waktu inkubasi yang
optimal yaitu 10 menit ketika kecepatan masih Vo.
4.3.3 Penentuan aktivitas enzim β-1,3-glukanase
β-1,3-glukanase merupakan enzim hidrolase yang memiliki kemampuan untuk menghidrolisis β-1,3-glukan menjadi glukosa. Satu unit aktivitas enzim β -1,3-glukanase didefinisikan sebagai jumlah enzim per ml sediaan enzim yang
diperlukan untuk membentuk 1µmol glukosa per menit dalam kondisi percobaan.
Jumlah glukosa yang dihasilkan dalam campuran reaksi berbanding lurus dengan
aktivitas enzim.
Pada pengukuran aktivitas enzim β-1,3-glukanase, 75 µL enzim ditambahkan 750 µL substrat kemudian diinkubasi pada suhu 370C selama 10
menghasilkan glukosa. Setelah inkubasi, kemudian ditambahkan 450 µl DNS.
Pada setiap penambahan DNS, tabung eppendorf harus dikocok untuk
menghomogenkan larutan. Jika ada beberapa sampel enzim yang akan ditentukan
aktivitasnya, jumlah pengocokan harus sama. Penentuan aktivitas enzim harus
dilakukan secara teliti dan kuantitatif.
Setelah penambahan DNS kemudian dipanaskan dalam air mendidih
selama 10 menit. Pemanasan dalam air mendidih bertujuan untuk menghentikan
reaksi antara substrat dan enzim. Kadar glukosa yang terbentuk ditentukan dengan
menggunakan metode DNS. Hal ini karena, gula pereduksi dapat bereaksi dengan
DNS yang kemudian diukur secara spektrofotometri pada panjang gelombang 550
nm. Reaksi ini dibuktikan dengan adanya perubahan warna larutan dari warna
kuning berubah menjadi warna kecoklatan (asam 3-amino-5-nitrosalisilat). Reaksi
yang terjadi adalah sebagai pada gambar 4.3.
Asam 3,5-dinitrosalisilat Asam 3-amino-5-nitrosalisilat
(kuning) (Coklat)
Gambar 4.3 Reaksi DNS dengan gula pereduksi
Warna coklat (Asam 3-amino-5-nitrosalisilat) pada reaksi tersebut menandakan
adanya gugus aldehid pada glukosa yang tidak lain merupakan suatu gula
pereduksi.
Pada penelitian uji aktivitas enzim β-1,3-glukanase digunakan kontrol yang berfungi untuk mengurangi pengaruh pengotor berupa glukosa yang dapat
terdeteksi dengan reagen DNS. Komposisi kontrol sama dengan komposisi sampel
tetapi berbeda pada perlakuan. Urutan perlakuan pada komposisi kontrol yaitu
enzim ditambahkan DNS kemudian dididihkan terlebih dahulu sebelum
ditambahkan substrat. Hal ini bertujuan supaya enzim menjadi non aktif saat
direaksikan dengan substrat. Sedangkan pada sampel enzim terlebih dahulu
ditambahkan substrat kemudian di inkubasi selama 10 menit supaya enzim
bereaksi dengan subtrat baru kemudian ditambahkan DNS. Uji aktivitas enzim
dilakukan pada ekstrak kasar enzim dan hasil fraksinasi parsial.
4.4 Penentuan Kadar Protein dengan Metode Lowry
Kandungan protein pada ekstrak enzim tidak dapat menggambarkan
kuantitas enzim yang terkandung, akan tetapi penting untuk menentukan aktivitas
spesifik enzim. Protein yang terkandung pada enzim β-1,3 glukanase diukur dengan metode Lowry. Metode ini mengkombinasikan pereaksi Biuret dengan
pereaksi lain (Folin-Ciocalteau phenol) yang bereaksi dengan residu tyrosine dan
tryptophan dalam protein. Reaksi ini menghasilkan perubahan warna dari kuning
menjadi biru. Semakin banyak kandungan protein pada larutan, semakin biru
warna larutan sesudah penambahan reagen folin-ciocalteau.
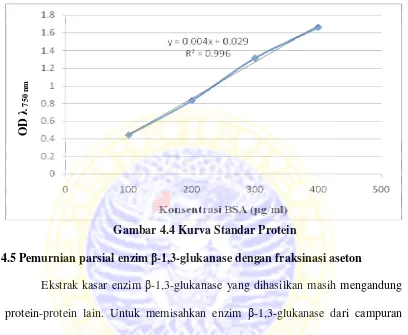
Untuk menghitung kadar protein enzim, digunakan kurva standar bovin
serum albumin (BSA). Kurva standar dibuat dari larutan BSA dengan variasi
konsentrasi 100-500 µg/ml dan diukur pada panjang gelombang 750 nm. Dari
yaitu y= 0.004x + 0.029. Kemudian persamaan ini digunakan untuk menentukan
kadar protein enzim tahap purifikasi parsial dan ekstrak kasar enzim.
Gambar 4.4 Kurva Standar Protein
4.5 Pemurnian parsial enzim β-1,3-glukanase dengan fraksinasi aseton
Ekstrak kasar enzim β-1,3-glukanase yang dihasilkan masih mengandung protein-protein lain. Untuk memisahkan enzim β-1,3-glukanase dari campuran protein-protein lain tersebut, dilakukan fraksinasi dengan aseton terhadap ekstrak
kasar enzim β-1,3-glukanase. Dalam penelitian ini dipilih aseton sebagai pelarut organik untuk fraksinasi, karena aseton lebih mudah dipisahkan dari protein yaitu
dengan cara sentrifugasi dan penguapan.
Penambahan aseton ke dalam larutan protein akan menurunkan konstanta
dielektrikum pelarut dan mengurangi solvasi air terhadap residu hirofilik enzim.
Posisi air di sekitar daerah hidrofobik dari permukaan protein akan digantikan
oleh pelarut aseton dan segera terjadi interaksi hidrofobik. Pengendapan terjadi
O
D
λ7
5
0
n
karena adanya interaksi elektrostatik antara muatan yang berlawanan pada
permukaan protein sebagaimana pada gambar 2.7.
Prosedur fraksinasi pelarut organik dengan aseton dilakukan pada suhu
dibawah 00C. Pada suhu diatas 100C, akan terjadi denaturasi (Scopes, 1994). Oleh
karena itu, digunakan dry es karena dapat menjaga suhu hingga di bawah 00C.
Pada penelitian ini, penambahan enzim pada aseton dilakukan saat suhu aseton
-200C . Volume aseton yang ditambahkan bergantung pada prosentase fraksinasi,
sesuai dengan tabel fraksinasi pada lampiran. Kemudian, campuran enzim dan
aseton diaduk dengan pengaduk magnetik stirer selama 7 menit dalam keadaan
terendam dry ice.
Pengadukan dengan pengaduk magnetik bertujuan untuk
menghomogenkan campuran aseton dan enzim sehingga dapat menyempurnakan
pengendapan protein. Penambahan aseton dan pengadukan dilakukan dengan
perlahan-lahan untuk menghindari pembentukan buih yang dapat menyebabkan
protein terdenaturasi. Kemudian dilakukan sentrifugasi dengan kecepatan 9000
rpm selama 20 menit. Suhu dalam sentrifuga adalah -100C sehingga sebelum
campuran enzim dan aseton dimasukkan dalam sentrifuga, suhu sentrifuga harus
dikondisikan terlebih dahulu sampai -100C.
Setelah sentrifugasi campuran enzim dan aseton, diperoleh endapan dan
supernatan. Endapan merupakan enzim target sedangkan supernatan merupakan
campuran berbagai protein terlarut. Ukuran molekul juga mempengaruhi
pengendapan protein oleh aseton. Pada molekul-molekul lebih besar, presentase
terbentuk dari fraksinasi hanya mengandung protein, karena biomassa sel dan
partikel padat sudah diendapakan sebelumnya melalui sentrifugasi awal ekstrak
enzim awal. Pelarut dan partikel yang relatif lebih kecil berada dalam supernatan.
Endapan yang dihasilkan kemudian dipisahkan dari supernatan sedangkan
supernatan ditambah dengan aseton untuk mengendapkan fraksi selanjutnya.
Endapan protein pada setiap fraksi harus dibebaskan dari aseton, karena
sisa aseton dapat menyebabkan denaturasi. Penghilangan aseton cukup dengan
dianginkan-anginkan karena aseton mudah menguap. Selain itu, penghilangan
aseton juga dibantu dengan kertas saring steril yaitu dengan meletakkan kertas
saring pada permukaan endapan bagian atas karena kemungkinan penguapan
aseton mengumpul dari bawah ke atas. Dengan demikian, aseton dapat
dihilangkan dan hasil fraksinasi dapat optimum. Endapan kemudian dilarutkan
dalam aquades sampai tepat larut. Setelah bau aseton hilang kemudian dilakukan
perhitungan aktivitas enzim.
Fraksinasi aseton dilakukan pada 4 percobaan dengan prosentase aseton
berbeda-beda. Percobaan pertama, fraksinasi dilakukan pada prosentase aseton
0-40% dan 40-75%.
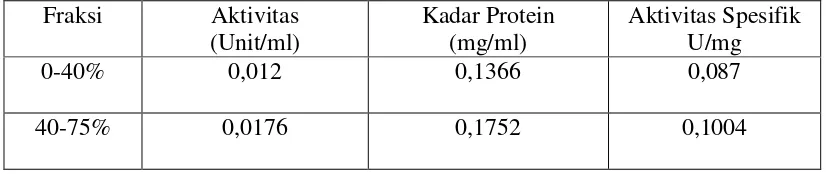
Tabel 4.1 Hasil Fraksinasi Aseton ke-1
Berdasarkan Tabel 4.1, aktivitas spesifik enzim terbesar pada fraksi 40-75
yaitu 0,1004 U/mg. Namun aktivitas spesifik enzim masih menyebar pada fraksi
0-40 yaitu sebesar 0,087. Untuk mengumpulkan aktivitas enzim pada 1 fraksi
dilakukan fraksinasi ke-2, yaitu 0-50% dan 50-70%.
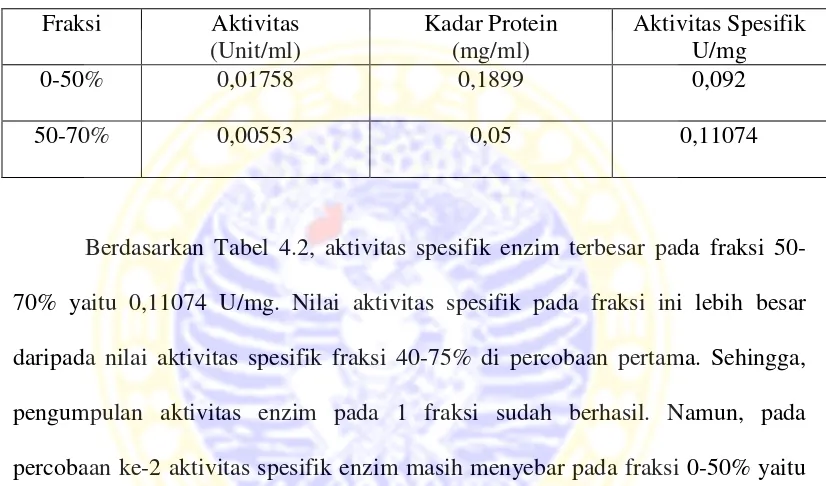
Tabel 4.2 Hasil Fraksinasi Aseton ke-2
Berdasarkan Tabel 4.2, aktivitas spesifik enzim terbesar pada fraksi
50-70% yaitu 0,11074 U/mg. Nilai aktivitas spesifik pada fraksi ini lebih besar
daripada nilai aktivitas spesifik fraksi 40-75% di percobaan pertama. Sehingga,
pengumpulan aktivitas enzim pada 1 fraksi sudah berhasil. Namun, pada
percobaan ke-2 aktivitas spesifik enzim masih menyebar pada fraksi 0-50% yaitu
sebesar 0,092. Sehingga, perlu dilakukan percobaan fraksinasi selanjutnya untuk
mencari fraksi paling optimum yang dapat mengumpulkan aktivitas enzim.
Tabel 4.3 Hasil Fraksinasi Aseton ke-3
Percobaan ke-3 dilakukan pada fraksi 0-40% dengan hasil aktivitas
spesifik sebesar 0,113 U/mg, pada fraksi 40-60% hasil aktivitas spesifik sebesar
0,119 U/mg dan pada fraksi 60-80% hasil aktivitas spesifik sebesar 0,0138 U/mg.
Berdasarkan Tabel 4.3, aktivitas spesifik terbesar pada fraksi 40-60%. Aktivitas
spesifik fraksi 40-60% ini lebih besar dari pada aktivitas spesifik terbesar dari
percobaan 2. Jadi, aktivitas enzim sudah lebih terkumpul pada 1 fraksi. Namun,
masih terdapat aktivitas spesifik pada fraksi 0-40% dan 60-80%.
Agar aktivitas enzim lebih banyak yang terkumpul pada 1 fraksi,
dilakukan percobaan lagi yaitu dengan fraksi lebih besar dari 40-60% namun lebih
kecil dari 60-80%. Pemurnian parsial dengan fraksinasi aseton memang harus
dilakukan berkali-kali unuk mendapatkan nilai fraksi yang optimum. Penentuan
untuk nilai fraksi selanjutnya harus tepat agar aktivitas enzim dapat meningkat
dan terkumpul dalam 1 fraksi. Sehingga fraksi yang tepat untuk percobaan ke-4
yaitu fraksi 0-45%, 45-70% dan 70-80%. Dari percobaan ke-4 ini diharapkan
fraksi dapat terkumpul pada fraksi 45-70% mengacu dari hasil percobaan ke-3.
Tabel 4.4 Hasil Fraksinasi Aseton ke-4
Dari percobaan ke-4, didapatkan aktivitas spesifik pada fraksi 0-45%
sebesar 0,031 U/mg. Aktivitas spesifik terbesar pada fraksi 45-70%. Dari tiga
percobaan yang sebelumnya, aktivitas spesifik pada fraksi ini paling besar. Pada
fraksi terakhir yaitu 70-80%, aktivitas spesifik sangat kecil dari aktivitas spesifik
45-70%. Sehingga, dapat disimpulkan bahwa fraksi optimum untuk pemurnian
parsial enzim β-1,3-glukanase dengan fraksinasi aseton yaitu pada fraksi 45-70%. Namun, pada fraksi 0-40% masih terdapat aktvitas spesifik enzim β -1,3-glukanase. Kemungkinan hal ini karena adanya isozim yang merupakan kelompok
enzim yang mengkatalisa reaksi yang sama tetapi berbeda dalam sifat fisik, kimia
dan imunologinya. Enzim dapat membentuk isozim memiliki sifat oligomer yang
terdiri dari 2 atau lebih monomer (subunit). Dengan demikian, pada proses
fraksinasi, isozim yang terdiri dari beberapa monomer terpisah saat pengendapan,
membentuk unit-unit dan menyebar pada fraksi berikutnya. Untuk melihat adanya
isozim ini dapat dengan menggunakan metode zimogram. Nilai aktivitas spesifik
pada hasil fraksinasi lebih besar dari ekstrak kasar yaitu 0,137. Sehingga ada
peningkatan kemurnian enzim dari ekstrak kasar enzim.
Tabel 4.5 Data Purifikasi Parsial enzim β-1,3-glukanase
4.6 Karakterisasi Enzim β-1,3-glukanase
4.6.1 Penentuan suhu optimum aktivitas enzim β-1,3-glukanase
enzim akan terganggu dan dengan demikian aktifitas enzim menjadi berkurang dan
kecepatan reaksinya pun akan menurun. Penentuan suhu optimum enzim dilakukan
pada suhu 300C, 370C, 450C dan 500C. Untuk penentuan suhu optimum prosedurnya
sama seperti penentuan aktivitas enzim, namun berbeda pada suhu inkubasi.
Gambar 4.5 Kurva suhu optimum aktivitas enzim β-1,3 glukanase
Laju reaksi enzimatik sangat dipengaruhi suhu. Pada penelitian yang telah
dilakukan, peningkatan suhu dari 300C sampai dengan 370C meningkatkan aktivitas
enzim β-1,3-glukanase, karena terjadi peningkatan energi kinetik. Peningkatan energi kinetik mempercepat gerak vibrasi, translasi, serta rotasi enzim dan substrat,
sehingga meningkatkan peluang molekul-molekul untuk saling berinteraksi.
Berdasarkan Gambar 4.5, pada suhu diatas 370C enzim mengalami
penurunan aktivitas. Tingginya suhu akan menyebabkan rusaknya interaksi non
kovalen (ikatan hidrogen, ikatan vander waals, interaksi hidrofobik, dan interaksi
elektrostatistik) yang menjaga struktur tiga dimensi enzim, sehingga enzim Suhu (0C)
O
D
λ5
5
0
n
terdenaturasi. Berdasarkan gambar 4.4, dapat disimpulkan bahwa suhu optimum
enzim pada 370C.
4.6.2 Penentuan pH optimum aktivitas enzim β-1,3-glukanase
Enzim merupakan suatu protein yang memiliki aktifitas biokimiawi
sebagai katalis suatu reaksi. Karena merupakan suatu protein, enzim sangat rentan
terhadap kondisi lingkungan. Adanya perubahan pH lingkungan akan
mengakibatkan aktivitas enzim ikut mengalami perubahan. Karena itu tiap enzim
mempunyai pH tertentu yang menyebabkan aktifitasnya mencapai keadaan
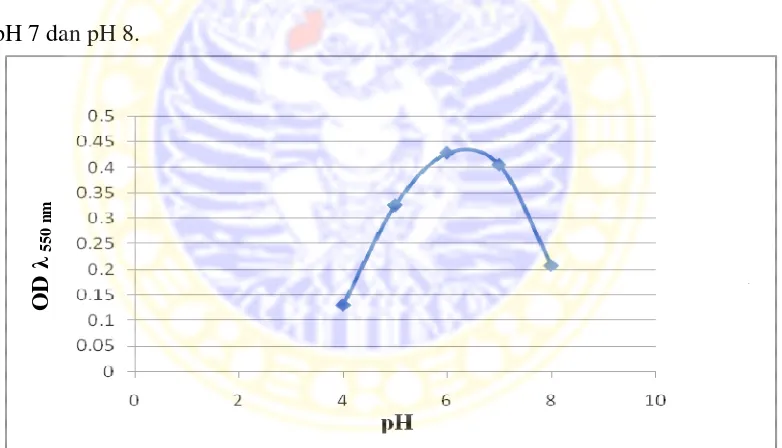
optimum. Penentuan pH optimum enzim dilakukan pada variasi pH 4, pH 5, pH 6,
pH 7 dan pH 8.
Gambar 4.6 Kurva pH optimum aktivitas enzim β-1,3 glukanase
Berdasarkan Gambar 4.6, pH optimum enzim β-1,3 glukanase pada pH 6. Pada pH ini enzim berada pada tingkat ionisasi yang paling sesuai untuk berikatan
dengan substrat. Konformasi enzim dalam bentuk yang sangat stabil, sehingga
efektifitas pengikatan enzim-substrat tinggi. Perubahan pH di sekitar pH optimum
menyebabkan berubahnya muatan residu-residu asam amino, terutama yang
O
D
λ5
5
0
n
substrat. Hal ini menyebabkan turunnya efektifitas pengikatan enzim-substrat,
sehingga perubahan pH di sekitar pH 6 menyebabkan turunnya aktivitas enzim.
Perubahan pH yang terlalu jauh dari pH optimum menyebabkan enzim mengalami
denaturasi, sehingga aktivitas yang dihasilkan sangat kecil. Hal ini terjadi ketika
BAB V
KESIMPULAN DAN SARAN
5.1 KESIMPULAN
1. Aktivitas spesifik enzim β-1,3 glukanase yang diisolasi dari cairan pencernaan Achatina fulica sebelum dilakukan pemurnian parsial dengan
fraksinasi aseton sebesar 0,137 U/mg sedangkan aktivitas spesifik enzim
β-1,3 glukanase setelah dilakukan pemurnian parsial dengan fraksinasi aseton sebesar 0,249 U/mg. Sehingga tingkat kemurnian enzim sebesar
1,81 kali.
2. Pemurnian parsial enzim β-1,3 glukanase menggunakan fraksinasi aseton menghasilkan aktivitas spesifik terbesar pada fraksi 45-70%. Pada fraksi
ini, nilai aktivitas spesifik enzim β-1,3 glukanase sebesar 0,249 U/mg. 3. Dari hasil karakterisasi enzim β-1,3 glukanase didapatkan suhu optimum
aktivitas enzim β-1,3 glukanase pada 370C dan pH optimum 6.
5.2 SARAN
Dilakukan pemurnian dengan beberapa tahap lagi untuk mendapatkan
enzim β-1,3 glukanase yang lebih murni. Dengan demikian, enzim β -1,3-glukanase dapat dimanfaatkan untuk berbagai bidang salah satunya untuk bidang