1
I. Judul Percobaan
“Hidrolisis Etil Asetat dalam Suasana Asam Lemah & dalam Suasana Asam Kuat”
II. Tanggal Percobaan
Senin, 8 April 2013 pukul 11.00 – 14.00 WIB
III. Tujuan Percobaan
Menentukan orde reaksi dan hidrolisis etil asetat dalam suasana asam lemah dan asam kuat.
IV. Dasar Teori
Hidrolisis adalah suatu reaksi antara senyawa dan air yang membentuk reaksi kesetimbangan. Senyawa yang digunakan dapat berupa senyawa organik maupun anorganik. Pada proses hidrolisis, garam akan terurai oleh air menghasilkan larutan yang bersifat asam atau basa. Persamaan reaksi pada proses hidrolisis etil asetat adalah:
+ H2O +
Etil asetat adalah senyawa organik dengan rumus CH3CH2OC(O)CH3.
Senyawa ini merupakan ester dari etanol dan asam asetat. Senyawa ini berwujud cairan tak berwarna, memiliki aroma khas. Etil asetat adalah pelarut polar menengah yang volatil (mudah menguap), tidak beracun, dan tidak higroskopis. Etil asetat merupakan penerima ikatan hidrogen yang lemah, dan bukan suatu donor ikatan hidrogen karena tidak adanya proton yang bersifat asam. Etil asetat dapat melarutkan air hingga 3%, dan larut dalam air hingga kelarutan 8% pada suhu kamar. Kelarutannya meningkat pada suhu yang lebih tinggi. Namun demikian, senyawa ini tidak stabil dalam air yang mengandungbasa atau asam. Etil asetat dapat dihidrolisis pada keadaan asam atau basa menghasilkan asam asetat dan etanol kembali. Katalis asam seperti asam sulfat dapat menghambat hidrolisis karena berlangsungnya reaksi kebalikan hidrolisis yaitu esterifikasi Fischer. Volume NaOH yang digunakan berbeda. Ketika menghidrolisis dengan menggunakan asam asetat
H3C C O OH H3C H2 C OH H3C C O O H2 C CH3
2 volume NaOH yang dibutuhkan hanya sedikit karena dalam hidrolisis etil asetat hasilnya adalah asam asetat dan etanol, sehingga mempengaruhi kecepatan reaksi dari hidrolisis tersebut maka volume NaOH yang digunakan hanya sedikit. Sementara pada hidrolisis menggunakan HCl dibutuhkan volume NaOH yang banyak karena diperlukan untuk menetralkan HCl itu dulu. Disini HCl dan asam astetat bertindak sebagai katalis.
Untuk memperoleh rasio hasil yang tinggi, biasanya digunakan basa kuat dengan proporsi stoikiometris, misalnya natrium hidroksida. Reaksi ini menghasilkan etanol dan natrium asetat, yang tidak dapat bereaksi lagi dengan etanol:
CH3COOC2H5 + NaOH → C2H5OH + CH3COONa
Untuk menghitung laju reaksi jika diperoleh data konsentrasi, maka dapat digunakan metode integral baik secara grafik maupun non-grafik. Dengan metode non-grafik, dapat ditentukan konstanta laju (k) dari beberapa orde secara trial dan error. Nilai k yang berdekatan menunjukkan orde yang sesuai. Sedangkan untuk metode grafik, orde yang sesuai diketahui dengan nilai regresi linier yang mendekati 1.
Secara teori laju hidrolisis etil asetat memiliki orde 2. Artinya, setiap penambahan konsentrasi pereaktan sebesar 2 kali semula, maka laju akan bertambah menjadi 22 kali laju semula, dan begitu seterusnya untuk penambahan pereaktan sebesar n-kali. Hukum laju reaksi untuk orde 2 adalah :
( )( ) dimana, a = konsentrasi awal (mol/L)
b = konsentrasi awal OH- (mol/L) x = konsentrasi ester atau basa (M) k = konstanta laju reaksi
Intregasi :
a
b x
x a b log b a t 2,303 k x b a x a b ln b a t 1 k 2 2 3 Untuk dapat menentukan apakah suatu reaksi orde dua atau bukan dapat diselidiki seperti pada reaksi tingkat satu yaitu :
1. Dengan memasukkan harga a, b, t dan x pada persamaan :
b x
a x a b ln b) t(a 1 k2 Bila harga-harga k2 tetap maka reaksi orde dua.
2. Secara grafik
a b log b a k 2,303 x b a x a b log b a k 2,303 t 2 2 Bila reaksi orde dua maka grafik t terhadap log
b x
x a
merupakan garis lurus
tangen atau slope :
a b
slope 2,303 k b a k 2,303 slope 2 2 Untuk konsentrasi sama :
k a 1 b a k 1 t a 1 x a 1 k 2 2 2 Jadi grafik x a 1 harus lurus bila reaksi orde dua.
V. Alat dan Bahan
1. Alat
Erlenmeyer
Stopwatch
Gelas ukur
Gelas kimia
4 2. Bahan Asam asetat 2M NaOH 0,2M Es batu Indikator pp Larutan HCl 2M Etil asetat
5
1. Hidrolisis Etil Asetat dalam Suasana Asam Lemah
Larutan Sisa (Erlenmeyer A)
Dibiarkan beberapa hari
Dititrasi dengan NaOH 0,2 M
Volum NaOH 20 mL Etil Asetat
Dimasukkan erlenmeyer B
Diletakkan pada suhu ruang selama 15 menit
CH3COOC2H5 Volum NaOH Diambil 5 mL Dimasukkan ke erlenmeyer A Diaduk
Diambil 5 mL (setelah 5 menit pencampuran)
Dimasukkan erlenmeyer C yang berisi 50 mL akuades (yang diletakkan dalam pendingin es)
Dititrasi dengan NaOH 0,2 M
Diulangi dengan mengubah selang waktu yaitu 10,20,30,50 dan 100 menit
CH3COOH encer
50 mL Asam Asetat 2M + 45 mL Akuades
Dimasukkan erlenmeyer A
6
Larutan Sisa (Erlenmeyer A)
Dibiarkan beberapa hari
Dititrasi dengan NaOH 0,2 M
Volum NaOH 20 mL Etil Asetat
Dimasukkan erlenmeyer B
Diletakkan pada suhu ruang selama 15 menit
CH3COOC2H5 Volum NaOH Diambil 5 mL Dimasukkan ke erlenmeyer A Diaduk
Diambil 5 mL (setelah 5 menit pencampuran)
Dimasukkan erlenmeyer C yang berisi 50 mL akuades (yang diletakkan dalam pendingin es)
Dititrasi dengan NaOH 0,2 M
Diulangi dengan mengubah selang waktu yaitu 10,20,30,50 dan 100 menit
HCl encer
50 mL HCl 2M + 45 mL Akuades Dimasukkan erlenmeyer A
7
VII. Data Hasil Pengamatan
ALUR KERJA HASIL AWAL HASIL AKHIR DUGAAN (REAKSI) KESIMPULAN
Asam Asetat: larutan jernih tak berwarna Akuades: larutan jernih tak berwarna Asam Asetat + Akuades (Lar. Erlenmeyer B): larutan jernih tak berwarna CH3COOH(aq) + H2O(l) CH3COOH(aq) CH3COOC2H5(aq) + H2O(l)
C2H5OH(aq) + CH3COOH(aq)
CH3COOH(aq) + NaOH(aq)
CH3COONa(aq) + H2O(aq)
Reaksi hidrolisis etil asetat dalam suasana asam lemah berorde 2
Orde reaksi hidrolisis etil asetat dalam suasana asam lemah adalah orde 1. Etil Asetat: larutan jernih tak berwarna NaOH: larutan jernih tak berwarna Indikator PP: larutan jernih tak berwarna Lar. Erlenmeyer A: larutan jernih tak berwarna Etil Asetat Dibiarkan (Lar. Erlenmeyer B): larutan jernih tak berwarna
Etil Asetat + Lar. Erlenmeyer A: larutan jernih tak berwarna Diambil 5mL Campuran AB + 50 mL Akuades : larutan tidak berwarna Ditambah Indikator PP: larutan tidak berwarna 20 mL Etil Asetat Dimasukkan erlenmeyer B
Diletakkan pada suhu ruang selama 15 menit CH3COOC2H5
Volum NaOH
Diambil 5 mL
Dimasukkan ke erlenmeyer A
Diaduk
Diambil 5 mL (setelah 5 menit pencampuran)
Dimasukkan erlenmeyer C yang berisi 50 mL akuades (yang diletakkan dalam pendingin es)
Dititrasi dengan NaOH 0,2 M
Diulangi dengan mengubah selang waktu yaitu 10,20,30,50 dan 100 menit
CH3COOH encer
50 mL Asam Asetat 2M + 45 mL Akuades
Dimasukkan erlenmeyer A
8 Dititrasi dengan NaOH: larutan merah muda Volume NaOH untuk titrasi: t (menit) V NaOH (mL) 5 2,41 10 2,50 20 2,52 30 2,55 50 2, 58 2880 2,60
Larutan Sisa (Erlenmeyer A)
Dibiarkan beberapa hari
Dititrasi dengan NaOH 0,2 M
9
ALUR KERJA HASIL AWAL HASIL AKHIR DUGAAN (REAKSI) KESIMPULAN
HCl: larutan jernih tak berwarna Akuades: larutan jernih tak berwarna HCl + Akuades (Lar. Erlenmeyer B): larutan jernih tak berwarna HCl(aq) + H2O(l) HCl(aq) CH3COOC2H5(aq) + H2O(l)
C2H5OH(aq) + CH3COOH(aq)
CH3COOH(aq) + NaOH(aq)
CH3COONa(aq) + H2O(aq)
Reaksi hidrolisis etil asetat dalam suasana asam lemah berorde 2
Orde reaksi hidrolisis etil asetat dalam suasana asam lemah adalah orde 1. Etil Asetat: larutan jernih tak berwarna NaOH: larutan jernih tak berwarna Indikator PP: larutan jernih tak berwarna Lar. Erlenmeyer A: larutan jernih tak berwarna Etil Asetat Dibiarkan (Lar. Erlenmeyer B): larutan jernih tak berwarna
Etil Asetat + Lar. Erlenmeyer A: larutan jernih tak berwarna Diambil 5mL Campuran AB + 50 mL Akuades : larutan tidak berwarna Ditambah Indikator PP: larutan tidak berwarna 20 mL Etil Asetat Dimasukkan erlenmeyer B
Diletakkan pada suhu ruang selama 15 menit CH3COOC2H5
Volum NaOH
Diambil 5 mL
Dimasukkan ke erlenmeyer A
Diaduk
Diambil 5 mL (setelah 5 menit pencampuran)
Dimasukkan erlenmeyer C yang berisi 50 mL akuades (yang diletakkan dalam pendingin es)
Dititrasi dengan NaOH 0,2 M
Diulangi dengan mengubah selang waktu yaitu 10,20,30,50 dan 100 menit
HCl encer
50 mL HCl 2M + 45 mL Akuades
Dimasukkan erlenmeyer A
10 Dititrasi dengan NaOH: larutan merah muda Volume NaOH untuk titrasi: t (menit) V NaOH (mL) 5 2,51 10 2,55 20 2,57 30 2,58 50 2,61 100 2,62
Larutan Sisa (Erlenmeyer A)
Dibiarkan beberapa hari
Dititrasi dengan NaOH 0,2 M
11
VIII. Analisis Data dan Pembahasan
1. Hidrolisis etil asetat dalam suasana asam lemah
Pada praktikum hidrolisis etil asetat dalam suasana asam lemah bertujuan untuk menentukan orde reaksi dari hidrolisis etil asetat dalam suasana asam lemah (CH3COOH). Langkah pertama yang dilakukan adalah dengan memasukkan asam
asetat 2 M 50 mL, yang berupa larutan jernih tak berwarna dan 45 mL akuades, yang berupa larutan jernih tak berwarna ke dalam Erlenmeyer A, yang tidak menghasilkan perubahan fisik secara signifikan, yaitu tetap berupa larutan jernih tak berwarna. Asam asetat akan memberikan suasana asam lemah dalam hidrolisis etil asetat sedangkan etil asetat jika direaksikan dengan air akan terjadi proses hidrolisis, garam akan terurai oleh air menghasilkan larutan yang bersifat asam atau basa. Reaksi yang terjadi adalah:
CH3COOC2H5 + H2O → CH3COOH + C2H5OH
Setelah itu diletakkan pada suhu kamar selama 15 menit. Pada erlenmeyer B dimasukkan etil asetat 20 mL, yang berupa larutan jernih tak berwarna dan diletakkan pada suhu kamar selama 15 menit. Kemudian mengambil 5 mL etil asetat dari Erlenmeyer B, dan dimasukkan dalam Erlenmeyer A (larutan campuran A). Menyiapkan Erlenmeyer C yang berisi aquades yang sebelumnya telah diletakkan dalam pendingin es. Reaksinya ditunjukkan sebagai berikut :
CH3COOC2H5(aq) + H2O(l) C2H5OH(aq) + CH3COOH(aq
Tujuan diletakkan dalam pendingin es adalah untuk memperlambat terjadinya reaksi. Memasukkan 5 mL campuran A ke dalam Erlenmeyer C. Kemudian menambahkan indicator PP, sebagai katalis. Langkah selanjutnya yaitu dititrasi dengan larutan NaOH dengan waktu pencampuran 5, 10, 20, 30, 50, 100 menit dan 2 hari (sebagai titik akhir proses hidrolisis). Reaksinya ditunjukkan sebagai berikut :
CH3COOH(aq) + NaOH(aq) → CH3COONa(aq) + H2O(l)
Hasil titrasi yang diperoleh adalah :
t (menit) Volume NaOH (mL)
5 2,41
10 2,50
20 2,52
12
50 2, 58
2880 2,60
Dari data tersebut, dapat diperoleh mmol CH3COOH dengan menggunakan
rumus MNaOH x VNaOH = MCH3COOH x VCH3COOH, sebagai berikut:
mmol ekuivalen asam = C × N = 10/20 × 5 × 0,2 = 0,5 mmol mmol ekuivalen etil asetat = 1/20 × 0,5 = 0,025 mmol
N etil asetat = n/V = 0,025/0,25 = 0,1 N Ketika t = 0, maka Ketika t = ∞, maka ( )
Dari perhitungan tersebut, kemudian dapat digunakan dalam perhitungan orde reaksi baik itu dengan metode grafik maupun non grafik, untuk metode grafik bisa dilihat nilai regresinya yang paling mendekati 2. Dengan x adalah volume NaOH dan a adalah mmol CH3COOH pada t = ∞. Untuk metode grafik
Pada orde 1 t
(menit)
a-x ln (a-x)
13 10 0,125 -2,07944 20 0,105 -2,25379 30 0,075 -2,59027 50 0,045 -3,10109 100 0,025 -3,68888 Pada orde 2 t (menit) a-x 1/(a-x) 5 0,215 -1,5371 10 0,125 -2,0794 20 0,105 -2,2538 30 0,075 -2,5903 50 0,045 -3,1011 100 0,025 -3,6889
Pada orde-orde tersebut diperoleh regresi yang mendekati satu adalah pada orde satu. Hal tersebut menunjukkan bahwa hidrolisis etil asetat dalam suasana asam lemah dengan metode grafik berorde 2 yaitu dengan nilai regresi sebesar R² = 0,906
Metode non grafik yaitu dengan melihat harga konstanta (k) reaksi yang rentang nilainya tidak jauh berbeda atau mendekati konstan dari perhitungan.
Orde 1 T (menit) kt = 5 10 20 30 50
14 100 Orde 2 T (menit) kt = ( ) 5 10 20 30 50 100
Hidrolisis etil asetat dalam suasana asam lemah lebih mengarah pada metode non grafik karena, pada perhitungan dalam metode non grafik dihasilkan orde 2 dan hal itu sesuai dengan teori.
2. Hidrolisis etil asetat dalam suasana asam kuat
Pada praktikum hidrolisis etil asetat dalam suasana asam kuat bertujuan untuk menentukan orde reaksi dari hidrolisis etil asetat dalam suasana asam kuat dimana dalam percobaan ini asam kuat yang dipakai adalah HCl 2 M. Langkah pertama yang dilakukan adalah dengan memasukkan HCl 2 M 50 mL, yang berupa larutan jernih tak berwarna dan 45 mL akuades, yang berupa larutan jernih tak berwarna ke dalam Erlenmeyer A. Reaksi pengencerannya sebagai berikut :
HCl(aq) + H2O(l) → HCl(aq)
HCl akan memberikan suasana asam kuat dalam hidrolisis etil asetat sedangkan etil asetat jika direaksikan dengan air akan terjadi proses hidrolisis, garam akan terurai oleh air menghasilkan larutan yang bersifat asam atau basa.
Setelah itu diletakkan pada suhu kamar selama 15 menit. Pada erlenmeyer B dimasukkan etil asetat 20 mL dan diletakkan pada suhu kamar selama 15 menit. Kemudian mengambil 5 mL etil asetat dari Erlenmeyer B dan dimasukkan dalam Erlenmeyer A (larutan campuran A). Menyiapkan Erlenmeyer C yang berisi aquades yang sebelumnya telah diletakkan dalam pendingin es. Tujuan diletakkan dalam pendingin es adalah untuk memperlambat terjadinya reaksi /
15 proses hidrolisis. Memasukkan 5 mL campuran A ke dalam Erlenmeyer C. Reaksi yang terjadi adalah:
CH3COOC2H5 + H2O → CH3COOH + C2H5OH
Kemudian menambahkan indicator PP, sebagai katalis. Langkah selanjutnya yaitu dititrasi dengan larutan NaOH dengan waktu 5, 10, 20, 30, 50, 100 menit dan 2 hari (sebagai titik akhir proses hidrolisis). Reaksinya ditunjukkan sebagai berikut :
CH3COOH(aq) + NaOH(aq) → CH3COONa(aq) + H2O(l)
Hasil titrasi yang diperoleh adalah :
t (menit) Volume NaOH (mL)
5 2,51 10 2,55 20 2,57 30 2,58 50 2,61 100 2,62
Dari data tersebut, dapat diperoleh mmol CH3COOH dengan menggunakan
rumus MNaOH x VNaOH = MCH3COOH x VCH3COOH, sebagai berikut:
mmol ekuivalen asam = C × N = 10/20 × 5 × 0,2 = 0,5 mmol mmol ekuivalen etil asetat = 1/20 × 0,5 = 0,025 mmol
N etil asetat = n/V = 0,025/0,25 = 0,1 N Ketika t = 0, maka Ketika t = ∞, maka
16 ( )
Perhitungan orde reaksi 1 (non grafik) a = 2,625 mL
Dari perhitungan tersebut, kemudian dapat digunakan dalam perhitungan orde reaksi baik itu dengan metode grafik maupun non grafik. Untuk metode grafik dapat dilihat dari nilai regresinya yang paling mendekati 1. Dengan x adalah volume NaOH dan a adalah mmol CH3COOH pada t = ∞.
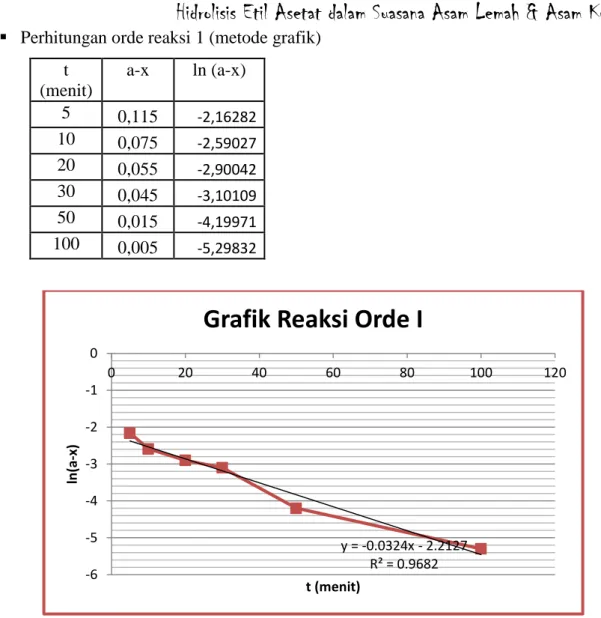
Pada orde 1 t (menit) a-x ln (a-x) 5 0,115 -2,16282 10 0,075 -2,59027 20 0,055 -2,90042 30 0,045 -3,10109 50 0,015 -4,19971 100 0,005 -5,29832 Pada orde 2 t (menit) a-x 1/ (a-x) 5 0,115 8,695652 10 0,075 13,33333 20 0,055 18,18182 30 0,045 22,22222 50 0,015 66,66667 100 0,005 200
Pada orde-orde tersebut diperoleh regresi yang mendekati satu adalah pada orde dua yaitu dengan nilai regresi sebesar R² = 0,950 Hal tersebut menunjukkan bahwa hidrolisis etil asetat dalam suasana asam kuat dengan metode grafik memiliki orde 2. Hal tersebut sudah sesuai dengan teori.
17 Sedangkan untuk metode non grafik yaitu dengan melihat harga konstanta (k) reaksi yang rentang nilainya tidak jauh berbeda atau mendekati konstan.
Orde 1 T (menit) kt = 5 10 20 30 50 100 Orde 2 T (menit) kt = ( ) 5 10 20 30 50 100
Dari dua data di atas, dapat disimpulkan bahwa hidrolisis etil asetat dalam asam kuat dengan metode non grafik berorde 2, karena pada orde 2 antara t(menit) satu dan yang lainnya rentang konstantanya tidak berbeda jauh. Hal tersebut sudah sesuai dengan teori.
IX. Kesimpulan
Berdasarkan hasil pada percobaan ini dapat disimpulkan bahwa :
1. Hidrolisis etil asetat dalam suasana asam lemah merupakan reaksi orde 1 sedangkan hidrolisis etil asetat dalam suasana asam kuat merupakan reaksi orde 2 yang ditandai dengan hasil perhitungan metode non grafik diperoleh harga k yang hampir konstan dan pada metode grafik dapat dilhat dari nilai R2 yang mendekati 1.
18 2. Pada percobaan hidrolisis etil asetat dalam suasana asam lemah diperoleh
persamaan regresinya y = - 0,020x - 1,800 dengan nilai R² = 0,906 .
3. Pada percobaan hidrolisis etil asetat dalam suasana asam kuat diperoleh persamaan regresinya y = 2,049x - 18,58 dengan nilai R² = 0,950.
X. Jawaban Pertanyaan
Jika dilihat dari hasil percobaan, apa yang membedakan antara percobaan 5A dan percobaan 5B ? Berikan penjelasan dan kaitkan dengan kajian pustakan anda !
Jawab :
Yang membedakan antara hidrolisis etil asetat dalam suasana asam lemah dan asam kuat adalah volume NaOH yang dibutuhkan dalam suasana asam lemah lebih sedikit dari pada volume NaOH yang dibutuhkan dalam susana asam kuat. Hal ini dikarenakan dalam suasana asam kuat, H+ yang dikeluarkan lebih banyak daripada H+ dalam suasana asam lemah sehingga untuk menetralkannnya dibutuhkan volume NaOH yang lebih banyak dalam suasana asam kuat.
XI. Daftar Pustaka
Bird,Tony. 1987. Kimia Fisika Untuk Universitas. Gramedia: Jakarta.
Day,R.A dan Underwood. 1987. Analisis Kimia Kuantitatif. Erlangga: Jakarta.
Endah, Soepi dan Suyono. 1990. Kinetika Kimia. Surabaya: University Press
IKIP Surabaya.
Keenan,C.W. 1999. Kimia Untuk Universitas Jilid 2 .Erlangga : Jakarta.
Laidler, Keith J. and Meister, John H. 1982. Physical Chemistry. California: The
Benjamin//CumingPublishingCompany,Inc.
Tim Dosen Kimia Fisika. 2013. Panduan Praktikum Kimia Fisika III. Surabaya:
19 DATA As. Lemah V5 2,41 ml V10 2,50 ml V20 2,52 ml V30 2,55 ml V50 2, 58 ml V100 2,60 ml As. Kuat V5 2,51 ml V10 2,55 ml V20 2,57 ml V30 2,58 ml V50 2, 61 ml V100 2,62 ml
A. Hidrolisis Etil Asetat dalam Suasana Asam Lemah
mmol ekuivalen asam = C × N = 10/20 × 5 × 0,2 = 0,5 mmol mmol ekuivalen etil asetat = 1/20 × 0,5 = 0,025 mmol
N etil asetat = n/V = 0,025/0,25 = 0,1 N Ketika t = 0, maka Ketika t = ∞, maka
20
( )
21 a) t = 5 menit = 300 s b) t = 10 menit = 600 s c) t = 20 menit = 1200 s d) t = 30 menit = 1800 s e) t = 50 menit = 3000 s f) t = 100 menit = 6000 s Perhitungan orde reaksi 1 (non grafik)
a = 2,625 mL Waktu (menit) a – x (mL) x (mL) 5 2,41 10 2,50 20 2,52 30 2,55 50 2,58 100 2,60
Perhitungan orde reaksi 2 (non grafik) Mencari nilai ( )
22 ( ) b. t = 10 menit = 600 s ( ) ( ) c. t = 20 menit = 1200 s ( ) ( ) d. t = 30 menit = 1800 s ( ) ( ) e. t = 50 menit = 3000 s ( ) ( ) f. t = 100 menit = 6000 s ( ) ( )
Perhitungan orde reaksi 1 (metode grafik)
t (menit) a-x ln (a-x) 5 0,215 -1,53712 10 0,125 -2,07944 20 0,105 -2,25379 30 0,075 -2,59027 50 0,045 -3,10109 100 0,025 -3,68888
23 Perhitungan orde reaksi 2 (metode grafik)
t (menit) a-x 1/(a-x) 5 0,215 4,65116 10 0,125 8 20 0,105 9,52381 30 0,075 13,3333 50 0,045 22,2222 100 0,025 40 y = -0.0207x - 1.8003 R² = 0.9069 -4.5 -4 -3.5 -3 -2.5 -2 -1.5 -1 -0.5 0 0 20 40 60 80 100 120 ln (a -x) t (menit)
Grafik Reaksi Orde I
y = 0.3702x + 3.0236 R² = 0.9958 0 5 10 15 20 25 30 35 40 45 0 20 40 60 80 100 120 1/( a-x) t (menit)
24 mmol ekuivalen asam = C × N = 10/20 × 5 × 0,2 = 0,5 mmol
mmol ekuivalen etil asetat = 1/20 × 0,5 = 0,025 mmol N etil asetat = n/V = 0,025/0,25 = 0,1 N Ketika t = 0, maka Ketika t = ∞, maka ( )
Perhitungan orde reaksi 1 (non grafik) a = 2,625 mL Waktu (menit) a – x (mL) 5 0,115 10 0,075 20 0,055 30 0,045 50 0,015 100 0,005 Mencari nilai a. t = 5 menit = 300 s
25 b. t = 10 menit = 600 s c. t = 20 menit = 1200 s d. t = 30 menit = 1800 s e. t = 50 menit = 3000 s f. t = 100 menit = 6000 s Perhitungan orde reaksi 2 (non grafik)
Mencari nilai ( ) a) t = 5 menit = 300 s ( ) ( ) b) t = 10 menit = 600 s ( ) ( ) c) t = 20 menit = 1200 s ( ) ( ) d) t = 30 menit = 1800 s ( ) ( ) e) t = 50 menit = 3000 s ( ) ( ) f) t = 100 menit = 6000 s
26
27 t (menit) a-x ln (a-x) 5 0,115 -2,16282 10 0,075 -2,59027 20 0,055 -2,90042 30 0,045 -3,10109 50 0,015 -4,19971 100 0,005 -5,29832
Perhitungan orde reaksi 1 (metode grafik) t (menit) a-x 1/ (a-x) 5 0,115 8,695652 10 0,075 13,33333 20 0,055 18,18182 30 0,045 22,22222 50 0,015 66,66667 100 0,005 200 y = -0.0324x - 2.2127 R² = 0.9682 -6 -5 -4 -3 -2 -1 0 0 20 40 60 80 100 120 ln (a -x) t (menit)
28 y = 2.0492x - 18.58 R² = 0.9509 -50 0 50 100 150 200 250 0 20 40 60 80 100 120 1/( a-x) t (menit)
29
Erlenmeyer A dan erlenmeyer B HCl t = 5 menit setelah dititrasi
HCl t = 10 menit setelah dititrasi HCl t = 20 menit setelah dititrasi
30
HCl t = 100 menit setelah dititrasi CH3COOH t = 5 menit setelah dititrasi
CH3COOH t = 10 menit setelah dititrasi CH3COOH t = 20 menit setelah dititrasi
31
CH3COOH t = 100 menit setelah dititrasi
HCl dan CH3COOH t = 3 hari setelah dititrasi