PRODU KSI SIRUP GLU KOSA DAR I PATI SA GU YANG BERASAL DARI BEBERAPA WILAYA H D I IND ONES IA
Oleh FRIDAYANI
F34101114
2006
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
PRODUKSI SIRUP GLUKOSA DARI PATI SAGU YANG BERASAL DARI BEBERAPA WILAYAH DI INDONESIA
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Teknologi Industri Pertanian
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh FRIDAYANI
F34101114
2006
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
FRIDAYANI. F34101114. Produksi Sirup Glukosa dari Pati Sagu yang Berasal dari Beberapa Wilayah di Indonesia . Di bawah bimbingan Titi Candra Sunarti, 2006.
RINGKASAN
Sagu adalah salah satu sumber karbohidrat yang merupakan komoditas potensial sebagai bahan pangan dan bahan baku untuk industri. Indonesia adalah pemilik areal sagu terbesar, dengan luas areal sekitar 1,128 juta ha atau 51,3% dari 2,201 juta ha areal sagu dunia dengan produktivitas pati sagu kering mencapai 25 ton/ha/tahun, namun potensinya belum dimanfaatkan secara maksimal. Daerah potensial penghasil sagu antara lain Riau, Sulawesi Utara, Sulawesi Selatan, Sulawesi Tenggara, Maluku dan Irian Jaya. Diperkirakan 90% areal sagu di Indonesia berada di Irian Jaya. Pati sagu dapat dimanfaatkan sebagai bahan baku alternatif untuk memproduksi sirup glukosa. Sirup glukosa merupakan suatu larutan yang diperoleh dari proses hidrolisis pati dengan bantuan katalis, kemudian dilakukan netralisasi dan pemekatan sampai tingkat tertentu. Sirup glukosa saat ini secara komersial diproduksi dari pati singkong dan jagung, untuk memenuhi peningkatan kebutuhan akan sirup glukosa maka diperlukan sumber-sumber pati lain yang memiliki potensi yang melimpah di Indonesia yaitu pati sagu.
Perbedaan wilayah pertumbuhan sagu diduga mempengaruhi mutu pati sagu dan produk yang dihasilkan dari pati sagu. Sagu dari varietas yang sama akan memiliki komposisi kimia yang berbeda karena adanya perbedaan kondisi tanah, iklim, dan cara pengolahan. Penelitian ini bertujuan untuk melihat keragaman jenis pati sagu dari berbagai wilayah di Indonesia berdasarkan komposisi kimia pati dan daya cerna pati oleh amilase pankreatin serta kemampuan pati dalam memproduksi sirup glukosa melalui dua metode hidrolisis yaitu asam dan enzim. Rancangan percobaan yang digunakan adalah desain faktor tunggal yaitu jenis pati sagu yang berasal dari lima wilayah di Indonesia diantaranya Riau, Jawa Barat, Sulawesi Utara, Kalimantan Selatan, dan Irian Jaya serta pati komersial yaitu pati singkong dan pati jagung sebagai pembanding.
Dalam proses pembuatan sirup glukosa digunakan dua metode hidrolisis yaitu hidrolisis asam menggunakan katalis HCl 0,1% dengan pH 2,0 dan suhu 121oC dalam otoklaf selama 1 jam, dan hidrolisis enzim menggunakan dua tahap yaitu likuifikasi dengan α-amilase dan sakarifikasi dengan glukoamilase. Likuifikasi pati menggunakan NOVO Thermamyl dari Bacillus licheniformis dengan kondisi proses suhu 95oC, pH 5,2 selama 3 jam dengan dosis enzim 1,75 U/g bobot pati kering. Tahap sakarifikasi berlangsung pada suhu 60oC, pH 4,5 selama 72 jam dengan dosis enzim 0,3 U/g bobot pati kering.
Analisis yang dilakukan terhadap pati sagu adalah analisis proksimat dan daya cerna pati oleh amilase pankreatin, sedangkan terhadap sirup glukosa adalah DE (dekstrosa ekuivalen), DP (derajat polimerisasi), kadar air, kadar abu, pH, kadar bahan kering, dan kejernihan sirup. Karakteristik kimia pati sagu telah memenuhi standar SNI 01-3279-1995, kecuali kadar air dan kadar serat. Daya cerna pati oleh amilase pankreatin menghasilkan produk dengan nilai DE berkisar antara 24,99 – 38,59, atau nilai DP berkisar antara 2,59 – 4,00. Sirup glukosa hasil hidrolisis enzim, pada tahap likuifikasi mempunyai nilai DE berkisar antara 39,56 – 46,86 dan DP antara 2,31 – 2,53 dan setelah sakarifikasi nilai DE menjadi berkisar antara 93,14 – 96,54 dan DP antara 1,04 – 1,07. Nilai DE sirup glukosa dari pati sagu yang dihasilkan masih lebih rendah dari sirup glukosa yang dihasilkan oleh pati jagung (98,59) namun tidak jauh berbeda dengan yang dihasilkan oleh pati singkong (94,28). Nilai DE sirup glukosa dari pati sagu hasil hidrolisis asam berkisar antara 47,38 – 51,35 dengan DP antara 1,95 – 2,11. DE sirup glukosa dari pati jagung (50,88) dan dari pati singkong (44,87) tidak jauh berbeda. Produk sirup glukosa yang dihasilkan memenuhi standar SNI 01-2978-1992 untuk sirup glukosa, kecuali untuk kadar bahan kering dan warna sirup dari pati sagu. Dalam penelitian tidak tidak dilakukan pemekatan terhadap sirup glukosa yang dihasilkan sehingga kadar bahan kering yang diperoleh masih rendah. Karakteristik sirup glukosa dan daya cerna pati yang dihasilkan dari pati sagu tidak jauh berbeda dengan sirup glukosa yang dihasilkan oleh pati pembanding, kecuali kejernihan sirup. Sehingga pati sagu dari seluruh wilayah Indonesia dapat diaplikasikan sebagai bahan baku pada industri sirup glukosa.
FRIDAYANI. F34101114. Production of Glucose Syrup from Sago Starch which come from Various Regions in Indonesia. Supervised by Titi Candra Sunarti, 2006.
SUMMARY
Sago is one of carbohydrates sources representing potential comodity as staple food and industrial raw material. Indonesia is the largest area owner of sago, which about 1,128 million ha or 51,3% from 2,201 million ha from all sago plantation area in the world. The productivity of dry sago starch reaches to 25 ton/ha/year, but its potency doesn’t utilize maximally. Potencial areas in Indonesia which produce sago are Riau, North Sulawesi, South Sulawesi, Southeast Sulawesi, Maluku and Irian Jaya, and estimated about 90% of sago plantation area in Indonesia found in Irian Jaya. Sago starch can be utilized as alternative raw material for glucose syrup production. Glucose syrup is defined as liquid that made from hydrolysis of starch by catalyzing aid and then neutralized and evaporated until certain degree. In industry, most of glucose syrups were produced from cassava starch and maize starch. To fulfill the increment of required glucose syrup, other source of starch is needed which have huge potency in Indonesia, and it is sago starch.
Different growth Region of sago are influenced to the quality of sago starch and the product that produced from sago starch. Sago from the same variety will express different chemical composition caused by different soil condition, climate and extraction method. The research aim is to investigate the variety of sago starch from various region in Indonesia based on chemical composition of starch and starch digestibility by pancreatin amylase, and starch ability to produce glucose syrup through two hydrolysis methods, ie. acid hydrolysis and enzymatic hydrolysis. The research design used is single factor design as sago starch type coming from 5 areas in Indonesia are Riau, West Java, North Sulawesi, South Kalimantan and Irian Jaya. Comercial starch (cassava and maize starch) are used for comparison.
Acid hydrolysis of starch was conducted using HCl 0,1% with pH 2,0 and 121oC in autoclave for 1 hour. Enzymatic hydrolysis of starch involved two phases those were liquefaction by α-amylase and saccharification by glucoamylase. Starch liquefaction using NOVO thermamyl from Bacillus licheniformis with process condition pH 5,2, 95oC for 3 hour and enzyme dose 1,75 U/g dry starch. Saccharification step took place at 60oC, pH 4,5 for 72 hours with enzyme dose of 0,3 U/g dry starch.
Analysis for sago starch were proximate analysis and starch digestibility by pancreatin amylase, and for glucose syrup were DE (Dextrose Equivalent), DP
(Degree of Polimerization), moisture content, ash content, pH, dry matter content and clarity of syrup. Moisture content and crude fiber content of native starch were not fulfilled the standard of SNI 01-3279-1995 for sago starch. Starch digestibility by pancreatin amylase gained product with DE among 24,99 to 38,59 or DP are 2,59 – 4,00. Glucose syrups from enzymatic hydrolysis, from the liquifaction step obtained DE range 39,56 - 46,86 or DP range 2,31 - 2,53. Product after saccharification obtained DE range 93,14 - 96,54 or DP range 1,04 - 1,07. DE glucose syrups from sago starch were still lower than maize starch (98,59) but not different with cassava starch (94,28). DE of glucose syrups from acid hydrolysis are 47,38 -51,35 or DP range 1,95 - 2,11. While DE of glucose syrup from maize (50,88) and cassava starch (44,87) were not different from sago starch. The obtained glucose syrups showed characteristics are fulfill the standar of SNI 01-2978-1992, except for dry matter content and color of glucose syrups from sago starch. The research was not involved evaporation process, so that dry matter content still low. Characteristic of glucose syrup and starch digestibility from sago starch were not different significantly with glucose syrup from commercially starch, except the clarity of the starch hydrolyzate syrup. So that sago starch from all Indonesian region can be applied as industrial raw material.
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
PRODUKSI SIRUP GLUKOSA DARI PATI SAGU YANG BERASAL DARI BEBERAPA WILAYAH DI INDONESIA
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Teknologi Industri Pertanian
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh FRIDAYANI
F34101114
Dilahirkan pada tanggal 19 Oktober 1984 di Jakarta
Tanggal lulus : 6 Februari 2006 Menyetujui,
Bogor, 8 Februari 2006
Dr. Ir. Titi Candra Sunarti, MSi Dosen Pembimbing
SURAT PERNYATAAN
Saya menyatakan dengan sebenar-benarnya bahwa skripsi dengan judul : “Produksi Sirup Glukosa dari Pati Sagu yang Berasal dari Beberapa Wilayah di Indonesia” adalah karya saya sendiri, dengan arahan dosen pembimbing, kecuali dengan jelas ditunjukkan rujukannya.
Bogor, Februari 2006 Pembuat pernyataan
FRIDAYANI F34101114
BIODATA PENULIS
Penulis dilahirkan di Jakarta pada tanggal 19 Oktober 1984. Penulis adalah anak ketiga dari empat bersaudara dari pasangan Bp. Mahmud dan Ibu Tursini. Penulis menyelesaikan pendidikan di SD Negeri Kramat 06 pagi Jakarta pada tahun 1995, Sekolah Lanjutan Pertama di SLTP Negeri 1 Jakarta pada tahun 1998 dan pada tahun 2001 penulis menyelesaikan Sekolah Menengah Umum di SMU Negeri 1 Jakarta.
Penulis melanjutkan pendidikan di Institut Pertanian Bogor pada tahun 2001 melalui jalur Ujian Masuk Peguruan Tinggi Negeri (UMPTN). Penulis diterima di Fakultas Teknologi Pertanian, Departemen Teknologi Industri Pertanian.
Selama menjadi mahasiswa IPB, penulis aktif dalam beberapa organisasi kemahasiswaan. Penulis menjadi pengurus pengurus BEM–FATETA pada tahun 2002–2003, pengurus HMI Komisariat Fateta IPB pada tahun 2002– 2003, anggota KOHATI HMI Cabang Bogor pada tahun 2003–2004 dan menjadi anggota Himalogin pada tahun 2001-2006.
Penulis melaksanakan Kegiatan Praktek Lapang pada tahun 2004 di PT. Mitratama Rasa Sejati, Cikarang, Bekasi. Judul Kegiatan Praktek Lapang Penulis adalah “Teknologi Proses Dan Pengawasan Mutu Bumbu Serba Guna (BSG) dan Chicken Batter Breader. Pada tahun 2005, Penulis melaksanakan penelitian sebagai tugas akhir dengan judul “Produksi Sirup Glukosa dari Pati Sagu yang Berasal dari Beberapa Wilayah di Indonesia”.
K A T A P E N G A N T A R
Alhamdulillah, puji syukur dipanjatkan ke hadirat Allah SWT, yang telah memberikan rahmat dan hidayah-Nya penulis dapat menyelesaikan penelitian dan skripsi yang berjudul “Produksi Sirup Glukosa dari Pati Sagu yang Berasal dari Beberapa Wilayah di Indonesia” ini dengan baik.
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian di Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Pada kesempatan ini penulis ingin mengucapkan terima kasih yang tak terhingga kepada :
1. Dr. Ir. Titi Candra Sunarti, MSi., sebagai dosen pembimbing akademik atas bimbingan, arahan dan saran yang diberikan selama penulis menjalani studi hingga menyelesaikan skripsi di Departemen Teknologi Industri Pertanian. 2. Dr. Ir. Liesbetini Hartoto, MS, sebagai dosen penguji yang telah memberikan
masukan dan saran kepada penulis.
3. Dr. Ir. Dwi Setyaningsih, MS, sebagai dosen penguji yang telah memberikan masukan dan saran kepada penulis.
4. Bp. Mahmud dan Ibu Tursini, kedua orangtua tercinta atas segala dukungan moril dan materil serta doa yang selalu mengiringi setiap langkah penulis. Kepada kedua kakak (Dhiar dan Yuli) dan kedua adik (Mariam dan Jeka) serta seluruh keluarga atas curahan kasih sayang dan dorongan semangatnya. 5. Seluruh Laboran Departemen Teknologi Industri Pertanian dan karyawan
FATETA IPB atas bantuannya selama penulis melaksanakan penelitian dan administrasi penulis.
6. Sri Windarwati dan Wawan Marwan S. sebagai teman satu bimbingan atas kerjasama dan kekompakannya.
7. Sahabat-sahabat tersayang, Ria, Dita, Sari, Liesda, Dian K, Febridawati, Efi Dian, dan Iyus, atas kasih sayang, persaudaraan dan dukungannya kepada penulis, semoga persahabatan ini kekal selamanya.
9. Pihak-pihak yang tidak dapat disebutkan satu persatu yang telah membantu penulis.
Penulis berharap saran dan kritik yang membangun untuk menyempurnakan skripsi ini. Semoga skripsi ini dapat memberikan manfaat bagi pembaca dan semua pihak yang membutuhkan.
Bogor, Februari 2006
DAFTAR ISI
Halaman
KATA PENGANTAR... v
DAFTAR ISI... vii
DAFTAR TABEL ... ix DAFTAR GAMBAR... x DAFTAR LAMPIRAN ... xi I. PENDAHULUAN ... 1 A. LATAR BELAKANG ... 1 B. TUJUAN ... 3 II. TINJAUAN PUSTAKA... 4
A. SAGU... 4
1. Botani Sagu... 4
2. Wilayah Pertumbuhan Sagu... 5
3. Pati Sagu ... 9 B. ENZIM ... 12 1. Aktivitas Enzim ... 12 2. Alfa -Amilase... 13 3. Glukoamilase ... 14 4. Amilase Pankreatin ... 15 C. SIRUP GLUKOSA ... 15 1. Hidrolisis Asam ... 17 2. Hidrolisis Enzim ... 20
III. METODOLOGI PENELITIAN ... 22
A. BAHAN DAN ALAT ... 22
1. Bahan ... 22
2. Alat... 22
B. METODE PENELITIAN... 22
1. Karakterisasi Pati Sagu ... 22
2. Penentuan Aktivitas α-Amilase ... 22
3. Penentuan Aktivitas Glukoamilase ... 23
4. Produksi Sirup Glukosa ... 23
C. RANCANGAN PERCOBAAN ... 26
D. METODE ANALISA... 26
IV. HASIL DAN PEMBAHASAN... 29
A. KARAKTERISASI PATI... 29
B. DAYA CERNA PATI OLEH AMILASE PANKREATIN... 32
C. AKTIVITAS ENZIM... 34
D. PRODUKSI SIRUP GLUKOSA ... 35
1. Hidrolisis Enzim ... 35
2. Hidrolisis Asam ... 41
V. KESIMPULAN DAN SARAN... 49
A. KESIMPULAN... 49
B. SARAN ... 50
DAFTAR PUSTAKA...
51DAFTAR TABEL
Halaman
Tabel 1. Potensi areal dan produksi sagu di Indonesia ... 6
Tabel 2. Klasifikasi pembagian wilayah Riau ... 8
Tabel 3. Sifat fisik dan kimia berbagai jenis pati... 11
Tabel 4. Nilai kalori dan gizi beberapa bahan pangan per 100 g... 11
Tabel 5. Syarat mutu pati sagu... 12
Tabel 6. Standar mutu sirup glukosa... 17
Tabel 7. Analisa proksimat dan daya cerna pati ... 29
Tabel 8. Karakteristik sirup glukosa dengan hidrolisis enzim... 36
DAFTAR GAMBAR
Halaman
Gambar 1. Pohon sagu ... 5
Gambar 2. Struktur amilosa ... 10
Gambar 3. Struktur amilopektin ... 11
Gambar 4. Proses hidrolisis pati menjadi glukosa ... 16
Gambar 5. Diagram alir produksi sirup glukosa katalis asam ... 24
Gambar 6. Diagram alir produksi sirup glukosa enzimatis... 25
Gambar 7. Penampakan fisik pati sagu dan pati pembanding ... 32
Gambar 8. Nilai DE pada hidrolisis pati oleh amilase pankreatin ... 33
Gambar 9. Nilai DP pada hidrolisis pati oleh amilase pankreatin ... 33
Gambar 10. Sirup glukosa hidrolisis enzim... 36
Gambar 11. Kejernihan sirup glukosa hidrolisis enzim... 37
Gambar 12. Nilai DE sirup glukosa hidrolisis enzim ... 38
Gambar 13. Nilai DP sirup glukosa hidrolisis enzim ... 39
Gambar 14. Kadar bahan kering sirup glukosa hidrolisis enzim ... 40
Gambar 15. pH sirup glukosa hidrolisis enzim... 41
Gambar 16. Sirup glukosa hidrolisis asam ... 43
Gambar 17. Kejernihan sirup glukosa hidrolisis asam ... 44
Gambar 18. Nilai DE sirup glukosa hidrolisis asam... 45
Gambar 19. Nilai DP sirup glukosa hidrolisis asam ... 46
Gambar 20. Kadar abu sirup glukosa hidrolisis asam... 46
Gambar 21. Kadar bahan kering sirup glukosa hidrolisis asam... 47
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Prosedur analisis... 55
Lampiran 2. Karakteritik proksimat dan daya cerna bahan baku ... 63
Lampiran 3. Uji homogenitas karakteristik bahan baku ... 66
Lampiran 4. Penghitungan aktivitas α-amilase ... 67
Lampiran 5. Penghitungan DE-DP sirup glukosa hidrolisis enzim ... 69
Lampiran 6. Analisa mutu sirup glukosa hidrólisis enzim... 70
Lampiran 7. Sidik ragam data hasil penelitian sirup glukosa hidrolisis enzim 71 Lampiran 8. Uji lanjut duncan pada sirup glukosa hidrolisis enzim... 73
Lampiran 9. Penghitungan DE-DP sirup glukosa hidrolisis asam... 75
Lampiran 10. Analisa mutu sirup glukosa hidrolisis asam ... 76
Lampiran 11. Sidik ragam data hasil penelitian sirup glukosa hidrolisis asam 77 Lampiran 12. Uji lanjut duncan pada sirup glukosa hidrolisis asam ... 79
I. PENDAHULUAN
A. LATAR BELAKANG
Sagu merupakan salah satu sumber karbohidrat yang potensial untuk bahan pangan dan bahan baku untuk industri. Indonesia adalah pemilik areal sagu terbesar, dengan luas areal sekitar 1,128 juta ha atau 51,3% dari 2,201 juta ha areal sagu dunia, disusul oleh Papua New Guinea 43,3% (www.perkebunan.litbang.deptan.go.id). Jika dibudidayakan, produktivitas pati sagu kering mencapai 25 ton/ha/tahun, lebih banyak apabila dibandingkan dengan ubi kayu 1,5 ton/ha/tahun, kentang 2,5 ton/ha/tahun maupun jagung 5,5 ton/ha/tahun, namun potensinya belum dimanfaatkan secara maksimal. Dari segi pemanfaatannya, Indonesia masih jauh tertinggal dibandingkan dengan Malaysia dan Thailand yang masing-masing hanya memiliki areal seluas 1,5% dan 0,2%. Pemanfaatan sagu di Indonesia baru sekitar 10% dari potensi yang ada. Daerah potensial penghasil sagu antara lain Riau, Sulawesi Utara, Sulawesi Selatan, Sulawesi Tenggara, Maluku dan Irian Jaya.
Tanaman dan bahan olahan sagu memiliki berbagai kelebihan dibandingkan dengan komoditas pertanian penghasil pangan lainnya. Dari sisi tanamannya sendiri, daya adaptasinya terhadap lingkungan tumbuh sangat luas. Mulai dari tanah marjinal sampai dengan tanah subur dapat menjadi lahan pengembangan tanaman sagu. Tanaman ini mampu tumbuh baik pada tanah masam dan berawa, dimana tanaman lain tidak dapat berkembang secara normal. Sagu juga dapat tumbuh di daerah tergenang sampai pada daerah dengan ketinggian 700 m di atas permukaan laut. Di daerah tergenang seperti di pinggir sungai/rawa, daya adaptasinya dibantu oleh adanya akar nafas seperti halnya tanaman tumbuh di pantai (Suntoro, 2005).
Di beberapa wilayah Indonesia Timur seperti Irian Jaya dan sebagian daerah Maluku, sagu merupakan bahan makanan pokok, sedangkan di propinsi lain sagu dimanfaatkan sebagai bahan baku industri dan bahan
makanan tambahan. Jepang bahkan memanfaatkan sagu sebagai bahan baku asam laktat yang menjadi monomer untuk industri plastik yang mudah hancur (biodegradable).
Wilayah pertumbuhan yang berbeda memiliki kondisi tanah dan iklim yang berbeda yang dapat mempengaruhi komposisi kimia tanaman yang tumbuh di atasnya. Berdasarkan penelitian Ehara (2005), kondisi tanah tempat tumbuh tanaman sagu mempengaruhi diameter batang pati yang akan mempengaruhi rendemen pati sagu yang dihasilkan. Namun, karakteristik pati sangat dipengaruhi oleh cara pengolahannya
Berdasarkan potensi areal, dan kebutuhan pangan masyarakat, sagu berperan sebagai sumber karbohidrat yang dapat dimanfaatkan untuk produk-produk pangan dan sumber pemanis diantaranya adalah sirup glukosa. Sirup glukosa yang saat ini sudah diproduksi secara komersial oleh industri-industri bersumber dari pati jagung dan pati singkong. Indonesia sebagai negara yang sedang berkembang banyak membutuhkan gula sebagai bahan baku untuk berbagai keperluan industri maupun rumah tangga.
Sirup glukosa dapat dipakai sebagai bahan baku beberapa industri makanan, seperti industri kembang gula, minuman, dan selai. Selain itu sirup glukosa dapat pula dipakai sebagai bahan baku industri farmasi dan industri kimia. Sirup glukosa adalah suatu larutan yang diperoleh dari pati melalui proses hidrolisis pati, kemudian dilakukan netralisasi dan pemekatan sampai tingkat tertentu.
Pembuatan sirup glukosa terdiri dari dua metode hidrolisis, yaitu proses hidrolisis pati secara enzimatis dan non enzimatis. Proses produksi sirup glukosa melalui hidrolisis enzimatis terdiri atas tahap likuifikasi dan sakarifikasi.
B. TUJUAN
Penelitian ini bertujuan untuk :
1. Menentukan karakterisasi pati sagu dari 5 wilayah yang berbeda yang meliputi komposisi kimia dan sifat daya cerna pati sagu.
2. Memproduksi sirup glukosa dari pati sagu melalui hidrolisis asam dan enzim.
3. Karakterisasi mutu sirup glukosa yang dihasilkan dari pati sagu dibandingkan dengan sirup glukosa dari pati jagung dan tapioka
I I . T I N J A U A N P U S T A K A
A. SAGU
1. Botani sagu
Sagu adalah tanaman berbiji tunggal (monokotil) yang berasal dari keluarga Palmae, marga Metroxylon, ordo Spadiciflorae. Keluarga Palmae yang memiliki kandungan pati cukup tinggi dibandingkan yang lain adalah Metroxylon dan Arenga (Flach, 1997).
Menurut Kiew (1977), tanaman sagu terbagi dalam sembilan spesies, yaitu Metroxylon vitense, Metroxylon bougarvilense, Metroxylon amiricum, Metroxylon upulense, Metroxylon warbugii, Metroxylon squarrosum, Metroxylon solomonensis, Metroxylon sagus, Metroxylon rumpii. Jenis sagu Metroxylon sagus dan Metroxylon rumpii merupakan jenis sagu yang paling banyak tumbuh di Indonesia, diantaranya di Sumatera, Jawa, Kalimantan dan Sulawesi.
Bagian terpenting dari tanaman sagu adalah batang sagu, karena merupakan tempat penyimpanan cadangan makanan (karbohidrat) yang dapat menghasilkan pati sagu. Batang sagu berbentuk silinder dengan diameter sekitar 50 cm bahkan dapat mencapai 80 – 90 cm. Ukuran batang sagu dan kandungan patinya tergantung pada jenis sagu, umur dan habitat pertumbuhannya. Struktur batang sagu secara makroskopis dari arah luar ke dalam terdiri atas lapisan sisa-sisa pelepah daun, lapisan kulit luar yang tipis dan berwarna kemerah-merahan, lapisan kulit dalam keras dan padat berwarna coklat kehitaman, dan lapisan serat dan empulur yang mengandung karbohidrat dan serat-serat (Haryanto dan Pangloli, 1992).
Sagu memiliki daun sirip, menyerupai daun kelapa yang tumbuh pada tangkai daun kelapa. Daun sagu muda umumnya berwarna hijau muda yang berangsur-angsur berubah menjadi coklat kemerah-merahan apabila sudah tua dan matang (Haryanto dan Pangloli, 1992). Bunga sagu berbentuk rangkaian yang keluar pada ujung batang. Bunga ini tumbuh didahului dengan tanda mengecilnya daun bendera. Tanaman sagu
berbunga pada umur 8 – 15 tahun, tergantung pada kondisi tanah, tinggi tempat tumbuh dan varietas. Pohon sagu dapat dilihat pada Gambar 1.
Gambar 1. Pohon Sagu (Metroxylon sp.)
Pada umur panen sagu sekitar 11 tahun ke atas empulur sagu mengandung pati sekitar 15 – 20%. Pada umur setelah panen, sagu akan mengalami penurunan kandungan pati yang biasanya ditandai dengan mulai terbentuknya primordia bunga. Setelah melewati masa primordia, kandungan pati menurun karena digunakan sebagai energi untuk pembentukan bunga dan buah. Setelah pembungaan dan pembentukan buah, batang akan menjadi kosong dan tanaman sagu mati. Keadaan tersebut mempermudah petani dalam mengetahui rendemen pati sagu maksimal (Haryanto dan Pangloli, 1992).
2. Wilayah Pertumbuhan Sagu
Hutan-hutan sagu pada umumnya terdapat pada daerah-daerah yang datar dan becek. Sagu dapat tumbuh sampai pada ketinggian 700 m di atas permukaan laut (dpl), namun produksi sagu terbaik ditemukan sampai
ketinggian 400 m dpl. Suhu optimal untuk pertumbuhan sagu berkisar antara 24,50 - 29oC dan suhu minimal 15ºC, dengan kelembaban nisbi 90% (Haryanto dan Pangloli 1992), dengan rata-rata hujan tahunan 2500 - 3000 mm/tahun.
Sentra penanaman sagu di dunia adalah Indonesia dan Papua Nugini, adapun sentra penanaman tanaman sagu di Indonesia adalah Irian Jaya, Maluku, Riau, Sulawesi Tengah dan Kalimantan (Abner dan Miftahorrahman, 2002). Daerah penghasil sagu di Indonesia sebagian besar terdapat di kawasan timur Indonesia dan hampir 90% areal sagu di Indonesia terdapat di Irian Jaya. Luas areal sagu di Indonesia sekitar 1,128 juta ha atau 51,3% dari 2,201 juta ha areal sagu dunia, disusul oleh Papua New Guinea 43,3% (Abner dan Miftahorrahman, 2002). Menurut Novarianto (2003), potensi hasil dari lebih dari 20 jenis sagu lokal Irian Jaya beragam antara 25 – 200 kg pati sagu basah per pohon, sedangkan di Maluku dari empat jenis sagu beragam antara 150 – 500 kg pati sagu basah per pohon. Pada Tabel 1 disajikan data potensi areal dan produksi sagu di Indonesia.
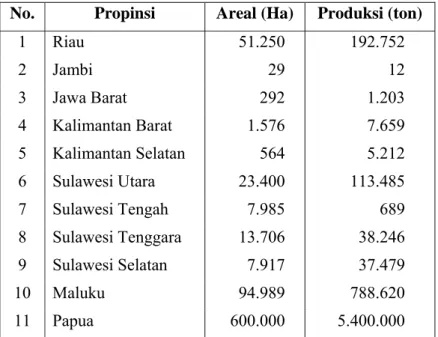
Tabel 1. Potensi areal dan produksi sagu di Indonesia
No. Propinsi Areal (Ha) Produksi (ton)
1 Riau 51.250 192.752 2 Jambi 29 12 3 Jawa Barat 292 1.203 4 Kalimantan Barat 1.576 7.659 5 Kalimantan Selatan 564 5.212 6 Sulawesi Utara 23.400 113.485 7 Sulawesi Tengah 7.985 689 8 Sulawesi Tenggara 13.706 38.246 9 Sulawesi Selatan 7.917 37.479 10 Maluku 94.989 788.620 11 Papua 600.000 5.400.000
Jumlah 801.524 6.580.090 Sumber : Dirjen Bina Produksi Perkebunan (2003)
Luas lahan tanaman sagu tergantung pada kondisi geografis dan iklim masing-masing daerah. Menurut Flach (1983), tanaman sagu umumnya tumbuh dengan baik di daerah yang terletak antara 0o LS – 15o LU dan 90o – 180o BT pada ketinggian 0 – 700 m di atas permukaan laut. Daerah pertumbuhan sagu adalah di daerah rawa yang berair tawar atau bergambut dan di daerah-daerah sepanjang aliran sungai, sektor subur air atau di hutan-hutan rawa yang kadar garamnya tidak terlalu tinggi. Lingkungan yang baik untuk pertumbuhan sagu adalah daerah yang berlumpur dimana akar nafas tidak terendam, kaya mineral dan bahan organik, air tanah berwarna kecoklatan dan bereaksi agak masam. Di Pulau Jawa tanaman sagu bisa tumbuh baik di tepi sungai dan lahan yang kurang termanfaatkan.
Wilayah Kalimantan Selatan sebagian besar berada pada ketinggian 25 - 100 m diatas permukaan laut. Tanah di wilayah propinsi Kalimantan Selatan sebagian besar berupa hutan dengan rincian hutan lebat (780.319 ha), hutan belukar (377.774 ha), dan hutan rawa (90.060 ha), hutan sejenis (352.840 ha), tanah berupa semak / alang-alang (870.314 ha), berupa rumput (50.119 ha), dan untuk lain lain (83.014 ha). Sedangkan penggunaan untuk sawah (413.107 ha), perkebunan (437.037 ha) dan untuk perkampungan (57.903 ha) serta untuk tegalan (48.612 ha) (www.kalsel.go.id). Daerah Kalimantan terkenal dengan rawa-rawanya. Rawa-rawa bertanah gambut menjadi ciri-ciri sebagian besar rawa-rawa di pulau ini, jenis tanah yang banyak dijumpai adalah tanah laterit, aluvial dan gambut (Setiawan, et al., 2005).
Data suhu udara yang dilaporkan Badan Meteorologi dan Geofisika Stasiun Meteorologi Kalimantan Selatan, suhu udara maksimum di Kalimantan Selatan berkisar antara 33,1oC - 35oC , suhu udara minimun berkisar antara 22,6oC - 23,8oC dan temperatur rata-rata 15,6oC - 26,9oC. Kelembaban udara rata-rata berkisar antara 77% - 91% tiap bulan.
Rata-rata intensitas penyinaran matahari 52,5 %, curah hujan tertinggi terjadi di bulan Maret yaitu 426,0 mm sedangkan curah hujan terendah terjadi pada bulan September yaitu 75,0 mm. Rata-rata tekanan udara berkisar antara 1.009,9 mm – 1.011,4 mm (www.kalsel.go.id).
Sulawesi Utara terletak pada 0°30' - 4°30' dan 123°00' - 127°00' BT. Sebagian besar wilayah dataran propinsi Sulawesi Utara terdiri dari pegunungan dan bukit-bukit diselingi oleh lembah yang membentuk dataran. Gunung-gunung terletak berantai dengan ketinggian di atas 1000 m dari permukaan laut. Iklim daerah Sulawesi Utara termasuk tropis yang dipengaruhi oleh angin Muzon. Pada bulan Nopember sampai dengan April bertiup angin Barat yang membawa hujan di pantai Utara, sedangkan pada bulan Mei sampai Oktober terjadi perubahan angin selatan yang kering. Curah hujan tidak merata dengan angka tahunan berkisar antara 2000-3000 mm. Struktur tanah di wilayah Sulawesi Utara terdiri atas tanah latosol (531.000 ha), aluvial (75.000 ha), andosol (15.000 ha), dan tanah kompleks (www. sulut.go.id).
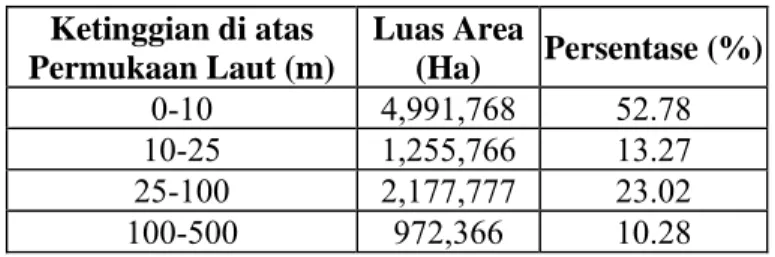
Propinsi Riau berada pada 1o15’ LS – 4o45’ LU dan 6o50’ – 1o45’ BB. Daerah Riau beriklim tropis basah dengan rata-rata curah hujan berkisar antara 2000-3000 mm/tahun yang dipengaruhi oleh musim kemarau serta musim hujan. suhu udara rata-rata optimum pada 27,6°C dalam interval 23,4-33,4°C. Sebagian besar daerah Riau terdiri dari dataran rendah dengan rata-rata ketinggian kurang dari 200 m di atas permukaan laut. Berdasarkan tingkat ketinggian di atas permukaan laut, wilayah Riau dapat diklasifikasikan ke dalam beberapa kategori disajikan pada Tabel 2.
Tabel 2. Klasifikasi pembagian wilayah Riau
Ketinggian di atas Permukaan Laut (m) Luas Area (Ha) Persentase (%) 0-10 4,991,768 52.78 10-25 1,255,766 13.27 25-100 2,177,777 23.02 100-500 972,366 10.28
500-1000 61,650 0.65
>1000 61,650 0.06
Propinsi Jawa Barat secara geografis terletak di antara 5° - 7° LS dan 104° - 104° BT. Daratan dapat dibedakan atas wilayah pegunungan curam di selatan dengan ketinggian lebih dari 1.500 m di atas permukaan laut, wilayah lereng bukit yang landai di tengah ketinggian 100 - 1.500 m dpl, wilayah dataran luas di utara ketinggian 0 – 10 m dpl, dan wilayah aliran sungai. Iklim di Jawa Barat adalah tropis, dengan suhu 9oC - 34oC, curah hujan rata-rata 2.000 mm/tahun, namun di beberapa daerah pegunungan antara 3.000 - 5.000 mm/tahun (www.jabar.go.id).
Papua terletak pada posisi 0°19' - 10°45' LS dan 130°45' - 141°48' BT. Propinsi Papua beriklim tropis dengan suhu udara maksimum 30oC dan minimum 23oC, curan hujan rata-rata adalah 1500 - 7500 mm/tahun. Sekitar 45% lahan tanaman sagu di Papua tumbuh di sepanjang daerah aliran sungai (DAS) (www.infopapua.com). Flach (1983), memperkirakan luas hutan sagu di Papua mencapai 980.000 ha dan kebun sagu 14.000 ha yang tersebar pada beberapa daerah yaitu Salawati, Teminabuan, Bintuni, Mimika, Merauke, Wasior, Serui, Waropen, Memberamo, Sarmi dan Sentani.
3. Pati Sagu
Pati sagu diperoleh dari hasil ekstraksi inti batang sagu atau empulur sagu dengan bantuan air sebagai perantara. Sebelumnya empulur batang dihancurkan terlebih dahulu dengan cara ditokok atau diparut. Tahapan proses pengolahan pati sagu secara tradisional meliputi : penebangan pohon, pemotongan dan pembelahan, penokokkan atau pemarutan, pemerasan, penyaringan, pengendapan dan pengemasan (Haryanto dan Pangloli, 1992).
Secara teoritis, dari satu batang pohon sagu dapat dihasilkan 100-600 kg pati sagu kering. Rendemen total untuk pengolahan yang ideal adalah 15% (Abner dan Miftahorrahman, 2002). Pati merupakan homopolimer glukosa dengan ikatan α–glikosidik. Pati terdiri dari dua fraksi yang dapat
dipisahkan dengan air panas, fraksi terlarut disebut amilosa dan fraksi tidak terlarut disebut amilopektin. Amilosa mempunyai struktur lurus dengan ikatan α-(1,4)-D-glikosidik sedangkan amilopektin mempunyai struktur bercabang dengan ikatan α-(1,6)-D-glikosidik sebanyak 4 – 5% dari berat total.
Amilosa merupakan rantai lurus dari polisakarida, yaitu unit glukosa yang dihubungkan melalui ikatan α-1,4-glikosidik. Panjang rantai amilosa bervariasi pada setiap jenis pati. Amilopektin adalah molekul polisakarida dengan rantai bercabang. Ikatan pada rantai utamanya (rantai lurus) adalah α-1,4-glikosidik dan pada cabangnya α-1,6-glikosidik. Titik cabang amilopektin terdapat pada interval 20 – 30 unit glukosa dengan berat molekul amilopektin lebih besar dari satu juta (Pomeranz, 1973).
Menurut Wilbraham dan Matta (1992), molekul amilosa lengkap dapat terdiri dari beberapa unit sampai 3000 unit D-glukopiranosa. Amilopektin terdiri dari molekul D-glukosa yang berikatan α-(1,4) dan juga mengandung ikatan silang α-(1,6). Ikatan ini menyebabkan penampilan molekul amilopektin bercabang-cabang seperti semak. Biasanya 24 sampai 30 unit D-glukopiranosa berada di antara titik percabangan amilopektin.
Amilosa dan amilopektin mempunyai sifat fisik yang berbeda. Amilosa lebih mudah larut dalam air dan kurang kental dibanding amilopektin. Amilosa lebih mudah membentuk senyawa kompleks dengan asam lemak dan molekul organik. Kompleks amilosadengan yodium akan memberikan warna biru, yang dapat dijadikan dasar untuk menentukan kadar amilosa. Amilopektin tidak dapat membentuk senyawa kompleks dan reaksi dengan yodium memberikan warna merah (Kulp, 1975). Struktur amilosa dan amilopektin dapat dilihat pada Gambar 2 dan Gambar 3.
Gambar 2. Struktur Amilosa (Fullbrook, 1984)
Gambar 3. Struktur Amilopektin (Fullbrook, 1984)
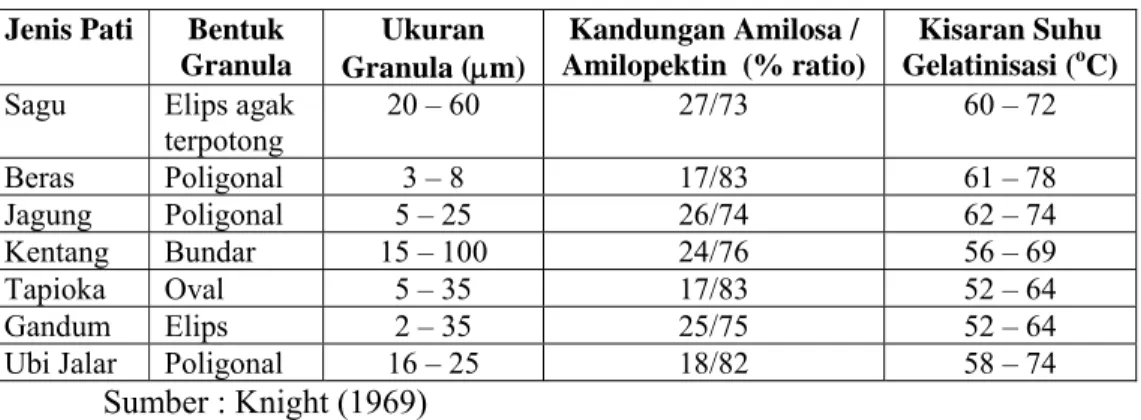
Rasio amilosa dan amilopektin akan mempengaruhi sifat-sifat pati. Sifat berbagai jenis pati dapat dilihat pada Tabel 3, sedangkan nilai kalori dan gizi beberapa bahan pangan per 100 g disajikan pada Tabel 4.
Tabel 3. Sifat fisik dan kimia berbagai jenis pati Jenis Pati Bentuk
Granula Ukuran Granula (μm) Kandungan Amilosa / Amilopektin (% ratio) Kisaran Suhu Gelatinisasi (oC) Sagu Elips agak
terpotong 20 – 60 27/73 60 – 72 Beras Poligonal 3 – 8 17/83 61 – 78 Jagung Poligonal 5 – 25 26/74 62 – 74 Kentang Bundar 15 – 100 24/76 56 – 69 Tapioka Oval 5 – 35 17/83 52 – 64 Gandum Elips 2 – 35 25/75 52 – 64 Ubi Jalar Poligonal 16 – 25 18/82 58 – 74
Sumber : Knight (1969)
Tabel 4. Nilai kalori dan gizi beberapa bahan pangan per 100 g
Komponen Beras Sagu Jagung Ubi kayu Kentang
Kalori (kal) 366 357 349 98,0 71,0 Protein (g) 0,4 1,4 9,1 0,7 1,7 Lemak (g) 0,8 0,2 4,2 0,1 0,1 Karbohidrat (g) 80,4 85,9 71,7 23,7 23,7 Kalsium (mg) 24 15 14 19 8,0 Besi (mg) 1,9 1,4 2,8 0,6 0,7
Pati sagu diperoleh dari hasil ekstraksi inti batang sagu atau empulur sagu dengan bantuan air sebagai perantara. Sebelumnya empulur batang dihancurkan terlebih dahulu dengan cara ditokok atau diparut. Tahapan proses pengolahan pati sagu secara tradisional pada prinsipnya meliputi penebangan pohon, pemotongan dan pembelahan, penokokkan atau pemarutan, pemerasan, penyaringan, pengendapan dan pengemasan (Haryanto dan Pangloli, 1992).
Pati sagu dalam bentuk aslinya merupakan butiran atau granula yang berwarna putih mengkilat, tidak berbau dan tidak berasa. Pati sagu memiliki granula yang berbentuk elips agak terpotong dengan ukuran granula sebesar 20 – 60 μm dan suhu gelatinisasinya berkisar antara 60 – 72°C (Knight, 1969).
Mutu pati sagu ditentukan oleh ukuran, bentuk, warna, aroma, rasa dan banyak faktor lainnya. Standar mutu pati sagu menurut Standar Nasional Indonesia yang dikeluarkan oleh Badan Standarisasi Nasional ditunjukkan pada Tabel 5.
Tabel 5. Syarat Mutu Pati Sagu
Karakteristik Kriteria
Kadar air (%) Maks 13
Kadar abu (%) 0,5
Kadar serat kasar (%) 0,1
Derajat asam (ml NaOH 1N/100g) 4
Kadar SO2 (mg/kg) 30
Jenis pati lain selain pati sagu Tidak boleh ada Kehalusan (lolos ayakan 100 mesh) 95 Total Plate Count (koloni/g) 106 Sumber : SNI 01-3279-1995
B. ENZIM
1. Aktivitas Enzim
Enzim merupakan molekul protein tak hidup yang dihasilkan oleh setiap sel hidup. Enzim bekerja sebagai biokatalisator dengan efisiensi dan selektifitas tinggi. Enzim tidak mengubah konstanta keseimbangan reaksi kimia. Kecepatan reaksi enzim dipengaruhi oleh suhu, pH, pelarut dan faktor-faktor lingkungan lainnya (Suhartono, 1989).
Enzim sebagai katalis proses hidrolisis pati memiliki beberapa kelebihan dibandingkan katalis asam, diantaranya adalah reaksi hidrolisis yang terjadi beragam (single chain attack, multichain attack, dan multiple attack), kondisi proses yang digunakan tidak ekstrim, seperti suhu sedang dan pH mendekati netral, mengurangi jumlah energi yang digunakan,
tingkat konversi yang lebih tinggi, polutan lebih rendah dan diperoleh reaksi yang spesifik (Judoamidjojo, 1989).
Aktivitas enzim umumnya dinyatakan dengan satuan Unit (U). Satu unit menyatakan jumlah enzim yang dibutuhkan untuk mengkatalis substrat dan menghasilkan satu μmol produk per satuan waktu (menit) pada kondisi standar. Kondisi standar adalah kondisi dimana enzim bekerja secara optimal, yaitu meliputi pH, suhu, konsentrasi kofaktor dan koenzim. Aktivitas enzim dapat dihentikan dengan beberapa cara, yaitu penurunan atau peningkatan pH dan suhu secara ekstrim (Chaplin dan Buckle, 1990).
2. Alfa-Amilase
Alfa-amilase atau endoamilase dapat diperoleh dari hewan, tumbuhan dan mikroorganisme. Enzim ini menghidrolisis secara acak ikatan α-(1,4)-glikosidik, baik yang tedapat pada amilosa ataupun amilopektin. Produk utama hidrolisis α-amilase berupa oligosakarida yang mengandung 6-7 maltosa. Aktivitas enzim optimal pada pH berkisar 4,7-5,9 tergantung dari jenis atau sumber enzimnya.
Mekanisme kerja α-amilase terdiri dari dua tahap, yaitu : tahap pertama degradasi amilosa menjadi maltosa dan maltotriosa yang terjadi secara acak. Hal ini diikuti dengan menurunnya viskositas dengan cepat. Tahap kedua terjadi pembentukan glukosa dan maltosa sebagai hasil akhir dan tidak acak. Pada tahap ini pembentukan relatif sangat lambat, sedangkan pada molekul amilopektin kerja α-amilase akan menghasilkan glukosa, maltosa dan satu seri α-limit dekstrin, serta oligosakarida yang terdiri dari empat atau lebih glukosa yang mengandung ikatan α-1,6-glikosidik (Winarno, 1986).
Enzim α-amilase menyerang ikatan dari bagian dalam substrat dan menyebabkan penurunan viskositas yang drastis pada suspensi pati serta menurunkan intensitas warna biru Iod (Reilly, 1985).
Alfa-amilase yang berasal dari Bacillus licheniformis dikenal dengan nama dagang Termamyl. Enzim ini berupa cairan dengan berat jenis 1,20-1,25 g/ml dan stabil dalam suhu 110oC. Berdasarkan standar aktivitasnya digolongkan atas dua macamnya yaitu Termamyl 120 L dan Termamyl 60 L. Termamyl 120 L berarti mempunyai aktivitas 120 Kilo Novo Unit (KNU) per gram enzim menurut standar NOVO (Anonim, 1984).
Alfa-amilase adalah kalsium metallo-enzim yang memiliki satu sampai sepuluh atom kalsium per molekul enzim. Kekuatan ikatannya dengan protein enzim tergantung pada sumber enzim. Kalsium ini dibutuhkan oleh α-amilase dalam mengkatalisis substrat. Dalam keadaan berkalsium, enzim ini tahan terhadap pH dan suhu yang ekstrim, serta perlakuan dengan urea atau penambahan protease.
Alfa-amilase dari Bachillus licheniformis optimum pada suhu tinggi bahkan dapat melebihi 90°C (Fullbrook, 1984). α-amilase ini memiliki kisaran pH optimum pada 5 – 7, dan suhu optimum antara 90 – 105oC (Naz, 2002). Dari hasil penelitian Wibisono (2004), pH optimum α-amilase adalah 5,2 dan suhu optimum 95oC.
Pengukuran aktivitas α-amilase ditentukan dengan mengukur hasil degradasi pati, yaitu dari penurunan kadar pati menjadi bahan yang terlarut atau jumlah dekstrin yang dihasilkan. Pemanfaatan substrat dapat diukur dengan pengurangan derajat pewarnaan yodium terhadap substrat. Selain itu pengukuran aktivitas α-amilase dapat juga dilakukan dengan pengukuran viskositas dan jumlah gula pereduksi yang terbentuk (Winarno, 1986).
3. Glukoamilase
Glukoamilase dikenal juga dengan amiloglukosidase (AMG) atau α-1,4-D-glukan glukohidrolase bersifat eksoamilase, yaitu dapat memutus rantai pati menjadi molekul-molekul glukosa pada bagian tak mereduksi baik pada ikatan α-1,4 maupun α-1,6. Glukoamilase terutama memutuskan rantai molekul maltosa menjadi molekul-molekul glukosa bebas (Tjokroadikoesoemo, 1986).
Glukoamilase memecah di-, oligo-, dan poli- sakarida pada ikatan α-1,4, sedangkan pada ikatan α-1,6 glukoamilase bekerja secara lambat (Reilly, 1985). Perbandingan laju hidrolisis glukoamilase pada ikatan α-1,4, α-1,6 dan α-1,3 pada tetrasakarida yaitu 300 : 6 : 1 (Chaplin dan Buckle,1990).
Kecepatan hidrolisis dipengaruhi oleh struktur dan ukuran molekul substrat, serta jenis ikatan di dalam rantai. Kecepatan hidrolisis ikatan α-(1,4) meningkat dengan meningkatnya berat molekul substrat. Glukoamilase memecah maltosa 100 kali lebih cepat dibandingkan isomaltosa (Forgaty, 1983).
Glukoamilase yang umum digunakan pada tahap sakarifikasi berasal dari Aspergillus niger. Menurut Reilly (1985), glukoamilase yang berasal dari Aspergillus niger dapat menghidrolisis dekstrin (DE 10 – 15) dengan konsentrasi substrat 30 – 40% (b/b) pada kondisi standar pH 4 – 4,5 dan suhu 60oC diinkubasi selama 48 – 72 jam dapat menghasilkan sirup glukosa dengan DE 96 (90% glukosa basis kering, 3% disakarida dan 3% maltulosa dan oligosakarida). Menurut Kulp (1975), pada umumnya aktivitas Glukoamilase optimum pada pH 4,0-5,0 dan suhu 50°-60°C.
Glukoamilase yang berasal dari Novo tersedia dalam bentuk cair dengan aktivitas standar 200, 300, dan 400 AGU/g (Kearsley dan Dziedzic, 1995). Menurut Slominska et al., (2003), satuan AGU menyatakan banyaknya enzim yang menghidrolisis 1 μmol maltosa per
menit pada kondisi standar, yaitu menggunakan substrat maltosa pada suhu 25oC, pH 4,3 dan waktu reaksi 30 menit.
4. Amilase Pankreatin
Amilase pankreatin merupakan hasil ekstraksi dari pankreatin yang berasal dari binatang. Mekanisme kerja amilase pankreatin yaitu menghidrolisis amilosa menjadi glukosa, maltosa, maltotriosa dan maltotetrosa, dan menghidrolisis amilopektin menjadi maltosa, maltotriosa, maltotetrosa, tetrasakarida dan pentasakarida (Robyt, 1984).
Enzim pankreatin mengandung amilase, lipase dan protease. Dalam tubuh hewan (mamalia), enzim pankreatin berasal dari pankreas yang berfungsi untuk mencerna makanan. Pankreatin merupakan enzim pencernaan, enzim pencernaan yang disekresi oleh pankreas memecah nutrien yang terkandung dalam makanan. Enzim pankreatin biasanya digunakan sebagai suplemen bagi manusia yang kekurangan akan enzim pencernaan, dan sering juga digunakan pada penderita pancreastitis (www.greatvistachemicals.com).
C. SIRUP GLUKOSA
Sirup glukosa adalah nama dagang dari larutan hidrolisis pati. Hidrolisis dapat dilakukan dengan bantuan asam atau dengan enzim pada waktu, suhu, dan pH tertentu (Tjokroadikoesoemo, 1986).
Definisi sirup glukosa menurut SNI 01-2978-1992 yaitu cairan kental dan jernih dengan komponen utama glukosa, yang diperoleh dari hidrolisis pati dengan cara kimia atau enzimatik. Proses hidrolisis pati menjadi molekul glukosa dapat dilihat pada Gambar 4.
(C6H10O5)n + nH2O (C6H12O6)n pati Katalis dan panas glukosa
Gambar 4. Proses hidrolisis pati menjadi glukosa
Kualitas sirup glukosa ditentukan berdasarkan nilai DE (Dextrose equivalent) atau derajat kemanisan. Menurut Maiden (1970), DE adalah kandungan gula pereduksi yang dinyatakan sebagai persen dekstrosa terhadap padatan kering. DE tidak menyatakan kandungan glukosa yang sebenarnya dari produk tetapi berhubungan dengan kandungan gula pereduksi dari semua jenis gula yang terdapat dalam produk. Standar mutu sirup glukosa menurut SNI 01-2978-1992 dapat dilihat pada Tabel 6. Menurut Tjokroadikoesoemo (1986), di dalam perdagangan, sirup glukosa
dibedakan berdasarkan nilai DE terdiri atas empat tipe, yaitu tipe I (DE 20 – 38), tipe II (DE 38 – 58), tipe III (DE 58 – 73), dan tipe IV (DE >73).
DP (derajat polimerisasi) juga digunakan sebagai parameter pada penentuan mutu sirup glukosa. DP menunjukkan jumlah dari unit glukosa sebagai komponen individual dalam sirup. DP 1 = dekstrosa (1 unit), DP 2 = maltosa (2 unit), DP 3 = maltotriosa (3 unit) (Dziedzic dan Kearsley, 1984).
Tabel 6. Standar Mutu Sirup Glukosa
No. Kriteria Uji Satuan Persyaratan
1 Keadaan : 1.1 Bau 1.2 Rasa 1.3 Warna Tidak berbau Manis Tidak berwarna 2 Air (% b/b) Max 20 3 Abu (% b/b) Max 1
4 Gula pereduksi dihitung sebagai D-Glukosa (% b/b)
Min 30
5 Pati Tidak ada
6 Cemaran Logam : 6.1 Timbal (ppm) 6.2 Tembaga (ppm) 6.3 Seng (ppm) Max 1 Max 10 Max 25 7 Arsen (ppm) Max 0,5 8 Cemaran mikroba : 8.1 Angka lempeng total 8.2 Bakteri coliform 8.3 E. coli 8.4 Kapang 8.5 Khamir Koloni/g APM/g APM/g Koloni/g Koloni/g Max 5 x 102 Max 20 Kurang dari 3 Max 50 Max 50 Sumber : SNI 01-2978-1992 1. Hidrolisis Asam
Hidrolisis asam merupakan proses pemecahan pati secara acak yang tidak dipengaruhi oleh keberadaan ikatan α-1,6-D-glukosidik. Menurut Wurzburg (1986), hidrolisis dengan asam akan lebih sensitif pada ikatan α-1,4-D-glukosidik dibanding ikatan α-1,6-D-glukosidik. Namun struktur linier dengan ikatan α-(1,4) terdapat pada bagian kristalin, bagian ini tersusun sangat rapat sehingga sangat sukar dimasuki air dan atau asam, akibatnya akan lebih tahan terhadap asam. Bagian amorf walaupun tersusun oleh ikatan α- (1,6) namun merupakan daerah yang kurang padat, amorf, dan mudah dimasuki air sehingga akan memudahkan penetrasi dan hidrolisis asam terhadap granula pati.
Proses dengan hidrolisis asam lebih mudah dilakukan dibandingkan dengan hidrolisis enzim karena peralatan yang digunakan tidak terlalu rumit, namun pembuatan sirup glukosa dengan cara hidrolisis yang mempergunakan katalis asam atau non enzimatis juga menimbulkan beberapa masalah. Peralatan yang diperlukan harus tahan korosi. Sirup yang dihasilkan mempunyai nilai kemanisan yang rendah karena nilai ekuivalen dekstrosanya rendah. Peningkatan ekuivalen dekstrosa disamping terjadi degradasi karbohidrat, juga terjadi rekombinasi produk degradasi yang dapat mempengaruhi warna dan rasa (Berghmans, 1981).
Menurut Wilbraham dan Matta (1992), hidrolisis berarti pembelahan suatu molekul dalam air. Jika molekul terbelah, hidrogen dari air melekat pada salah satu produk, sedangkan –OH pada produk lainnya. Hidrolisis gula yang termasuk rumit, dilakukan dengan memanaskan larutan karbohidrat dengan air, dan sedikit katalis asam.
Beberapa polisakarida biasanya terhidrolisis oleh asam mineral, seperti asam sulfat, baik itu langsung menggunakan pendingin balik dengan mencairkan asam maupun dengan pemisahan pendahuluan dalam konsentrasi asam tertentu. Meskipun sebelumnya pemecahan dari polisakarida dengan asam sulfat merupakan tatacara standar, tapi telah ditemukan bahwa sebagian besar dari karbohidratnya dapat tersulfitasi. Hal ini dikenal sebagai salah satu kesalahan proses hidrolisis. Dengan kata lain, hidrolisis polisakarida oleh asam sulfat tidak baik digunakan.
Asam klorida merupakan asam yang dihasilkan dari gas hidroklorat (HCl) dalam air. Kegunaan HCl sangat luas, diantaranya sebagai pereaksi laboratorium, sebagai katalis dan pelarut dalam sintetis organik, serta sebagai penghidrolisis pati dan protein pada preparasi dari berbagai produk makanan (Windholz, 1983). Seperti yang dikemukakan oleh Goutara dan Wijandi (1985), bahwa sesuai dengan sifatnya, semua karbohidrat dapat dihidrolisis oleh asam. Polisakarida jika dihidrolisis akan menghasilkan sejumlah monosakarida, dan oligosakarida akan menghasilkan dua sampai enam gula monosakarida
Menurut Meyer (1975) Pengguntingan ikatan α-1,4-D-glikosidik dapat membentuk produk antara. Gugus karbon karboksil pada atom karbon keenam menyerang ion atom karbonium pada atom karbon kesatu dengan membentuk cincin 1,6 anhidro. Oksigen dari air dapat bereaksi dengan atom karbon kesatu dan membentuk unit akhir glukosa normal.
Selain itu pada reaksi gugus hidroksil pada atom karbon keenam dapat menyerang ion karbonium pada atom karbon kesatu dari karbon unit yang lain melalui atom oksigen. Reaksi-reaksi ini pula yang menyebabkan penurunan bobot molekul dan peningkatan percabangan.
Menurut Howling (1979), hasil hidrolisis pati mengandung campuran kotoran yang mengurangi kemurnian, warna dan stabilitas warnanya. Kotoran dapat dihasilkan dari bahan dasar pati yang digunakan, atau timbul dalam proses hidrolisis.
Pemberian karbon aktif dapat menghilangkan sebagian warna (prekursor), dan menyerap protein yang terlarut (Norman, 1981). Arang aktif bersifat sebagai adsorben yang dapat menyerap kotoran sehingga setelah diberi arang aktif dan dilakukan pengadukan secara terus menerus selama 1 jam pada suhu 80°C, kotoran yang terdapat pada larutan gula akan terikat dengan arang aktif dan diperoleh larutan yang jernih.
Menurut Sastrodipuro (1985), perubahan warna sirup menjadi kekuningan disebabkan pemanasan tinggi yang dilakukan pada lingkungan asam. Hal ini karena terbentuknya senyawa hidroksi-metil furfural. Meyer (1975), juga menyatakan pemanasan suhu tinggi pada larutan gula dapat menyebabkan karamelisasi, yaitu perubahan yang terjadi pada senyawa hidrokarbonil (seperti senyawa gula pereduksi dan gula asam) yang dipanaskan pada suhu tinggi, reaksi ini dapat terjadi tanpa adanya senyawa amino.
Hidrolisis asam mempunyai keterbatasan yaitu tidak adanya perbedaan distribusi gula dalam sirup glukosa pada tingkat hidrolisis yang berbeda, sirup yang dihasilkan mudah rusak (Howling, 1979).
2. Hidrolisis Enzim
Proses hidrolisis pati pada dasarnya adalah pemutusan rantai polimer pati menjadi unit-unit dekstrosa (C6H12O6). Produk-produk hasil hidrolisis pati umumnya dikarakterisasi berdasarkan tingkat derajat hidrolisisnya dan dinyatakan dengan nilai DE (dextrose equivalent) yang menunjukkan pesentase dari dekstrosa murni dalam basis berat kering pada produk hidrolisis. Menurut Kearsley dan Dziedzic (1995), dekstrosa murni adalah dekstrosa dengan derajat polimerisasi 1 (unit dekstrosa tunggal). Suatu produk hidrolisis pati dengan nilai DE 15, menunjukkan bahwa persentase dekstrosa murni pada produk kurang lebih sebesar 15% (bk).
Pemutusan rantai polimer pati dapat dilakukan dengan berbagai metode, misalnya secara enzimatis, kimiawi ataupun kombinasi keduanya. Hidrolisis secara enzimatis memiliki perbedaan mendasar dibandingkan hidrolisis secara kimiawi dan fisik dalam hal spesifitas pemutusan rantai polimer pati. Hidrolisis secara kimiawi dan fisik akan memutus rantai polimer secara acak, sedangkan hidrolisis enzimatis akan memutus rantai polimer secara spesifik pada percabangan tertentu (Norman, 1981).
Hidrolisis enzimatis memiliki beberapa keuntungan, yaitu lebih spesifik prosesnya dan produk yang dihasilkan sesuai dengan yang diinginkan. Kondisi proses yang dapat dikontrol, biaya pemurnian lebih murah serta dihasilkan lebih sedikit produk samping dan abu serta kerusakan warna yang dapat diminimalkan (Norman, 1981).
Pembuatan sirup glukosa dengan hidrolisis enzim terdiri atas tiga tahapan dalam mengkonversi pati, yaitu gelatinisasi, likuifikasi dan sakarifikasi. Gelatinisasi merupakan pembentukan suspensi kental dari granula pati, likuifikasi merupakan proses hidrolisis pati parsial yang ditandai dengan menurunnya viskositas (Chaplin dan Buckle, 1990).
Menurut Gumbira Said (1987), proses likuifikasi adalah proses pencairan gel pati dengan menggunakan α-amilase yang menghidrolisis pati menjadi molekul-molekul yang lebih kecil dari oligosakarida atau disebut dekstrin. Sedangkan menurut Fogarty (1983), likuifikasi adalah proses dispersi granula pati yang tidak larut dalam air dan diikuti dengan hidrolisis parsial dengan menggunakan enzim α-amilase termostabil. Dalam proses ini granula pati mula-mula tidak larut, dipanaskan dalam larutan air sampai mengembang dan pecah sehingga enzim dengan mudah menyerang rantai yang telah rentan.
Dalam proses likuifikasi, hal yang perlu diperhatikan adalah konsentrasi substrat, penggunaan enzim yang stabil pada suhu tinggi, pengaturan suhu, pengaturan pH dan pengadukan serta pemanasan segera dan kontinu. Pengaturan pH larutan dapat digunakan NaOH dan HCl (Inglett dan Munch, 1980).
Tahap selanjutnya dari proses produksi sirup glukosa yaitu sakarifikasi. Sakarifikasi merupakan proses dimana oligosakarida sebagai hasil dari tahap likuifikasi dihidrolisis lebih lanjut oleh enzim tunggal atau enzim campuran menjadi glukosa. Pada proses sakarifikasi, oligosakarida sebagai hasil dari tahap likuifikasi dihidrolisis lebih lanjut menjadi glukosa oleh enzim amiloglukosidase.
Faktor yang sangat penting diperhatikan dalam proses sakarifikasi adalah dosis enzim yang digunakan dan waktu sakarifikasi. Apabila dosis enzim atau waktu sakarifikasi kurang maka hasil hidrolisis (glukosa) yang diperoleh sangat rendah. Sebaliknya jika proses sakarifikasi terlalu lama dapat menyebabkan polimerisasi glukosa. Sakarifikasi dihentikan setelah 96 – 97% pati terhidrolisis atau DE akhir sekitar 96 – 98 (Berghmans, 1981).
Produksi sirup glukosa dari pati sagu secara enzimatis berdasarkan penelitian Akyuni (2004), dengan menggunakan α-amilase pada tahap likuifikasi diperoleh DE tertinggi yaitu 50,83 pada konsentrasi α–amilase 1,75 U/g pati dan waktu likuifikasi 210 menit, dan glukoamilase pada tahap sakarifikasi diperoleh DE tertinggi yaitu 98,99 pada konsentrasi glukoamilase 0,3 U/g pati dan waktu sakarifikasi 48 jam.
A. BAHAN DAN ALAT 1. Bahan
Bahan yang digunakan dalam penelitian ini adalah pati sagu yang diperoleh dari lima wilayah di Indonesia (Jawa Barat, Riau, Sulawesi Utara, Kalimantan Selatan, dan Irian Jaya), pati jagung dan tapioka, α-amilase dari Termamyl NOVO enzyme, dan glukoamilase yang diperoleh dari PT. Puncak Gunung Mas, amilase pankreatin, CaCO3, NaOH, HCl, H2SO4, arang aktif, pereaksi DNS, fenol, soluble starch, glukosa standar serta bahan-bahan kimia lainnya yang digunakan untuk analisis pendahuluan dan analisis produk sirup glukosa.
2. Alat
Peralatan yang digunakan dalam penelitian ini adalah water bath incubator, otoklaf, spektrofotometer, neraca analitik, pH-meter, oven, hot plate, penangas, penyaring vakum, corong Buchner, termometer, stirer, oven, tanur, labu Kjeldahl, desikator, Soxhlet dan peralatan gelas untuk analisis.
B. METODE PENELITIAN 1. Karakterisasi Pati Sagu
Pati sagu yang akan digunakan sebagai bahan baku pembuatan sirup glukosa dianalisis karakteristiknya yang meliputi analisis kadar air, kadar abu, kadar lemak, kadar pati, kadar serat, dan kadar protein serta analisis daya cerna pati. Analisis daya cerna pati dilakukan untuk mengetahui persentase pati yang dapat dicerna oleh amilase pankreatin.
2. Penentuan Aktivitas α-amilase
Sebanyak 2 ml soluble starch yang telah tergelatinisasi (2% b/v) dalam tabung reaksi ditambah dengan 1,75 ml larutan buffer asetat 0.2 M pH 5.2, kemudian dilakukan penambahan 0,25 ml aquades dan 1 ml α-amilase yang telah diencerkan. Kemudian dihidrolisis dalam water bath suhu 95°C selama 180 menit (dilakukan pengamatan tiap 15 menit). Selanjutnya dilakukan
Setelah mencapai suhu ruang ditambahkan 0,1 ml HCl 0,1 N untuk menetralkan pH, kemudian dilakukan analisis gula pereduksi dengan metode Park Johnson.
3. Penentuan Aktivitas Glukoamilase (Bernfeld, 1955)
Sebanyak 1 ml glukoamilase yang telah diencerkan dengan buffer fosfat sitrat pH 4,5 diinkubasi selama 5 menit dalam water bath pada suhu 60oC. Setelah diinkubasi ditambahkan 2 ml soluble starch yang telah tergelatinisasi (2% b/v) selama 30 menit, dan dilakukan pengambilan sampel pada menit ke-0 dan 30. Hasil inkubasi yang diperoleh diukur gula pereduksinya dengan pereaksi DNS.
Aktivitas enzim = gula pereduksi (mg/l)
BM glukosa (g/mol) x waktu inkubasi (menit)
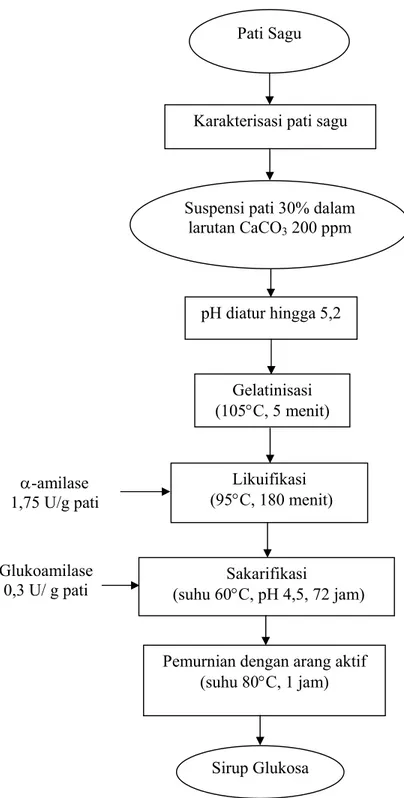
4. Produksi Sirup Glukosa
a. Hidrolisis Asam
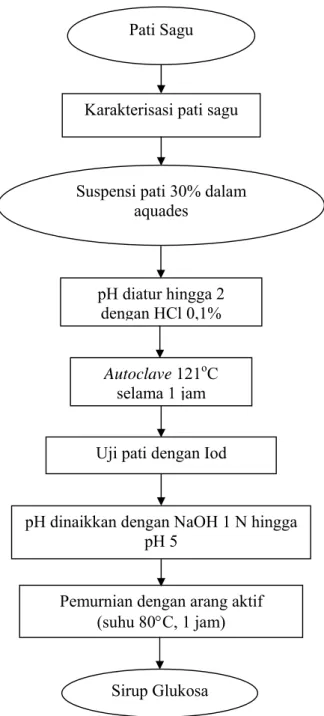
Suspensi pati sagu dalam air (30% b/v) diturunkan pH-nya dengan HCl 0,1% hingga pH 2. Labu erlenmeyer ditutup dengan plastik dan diikat menggunakan karet kuat-kuat. Suspensi pati dihidrolisis dalam otoklaf suhu 121oC selama 1 jam. Setelah dihidrolisis larutan diuji dengan iod untuk menguji apakah masih terdapat pati. Kemudian pH larutan dinaikkan dengan NaOH 1 N hingga pH netral. Untuk menjernihkan sirup glukosa digunakan arang aktif sebanyak 2% bobot pati, kemudian dipanaskan pada suhu 80oC selama 1 jam sambil diaduk. Diagram alir pembuatan sirup glukosa dengan katalis asam dapat dilihat pada Gambar 5.
b. Hidrolisis Enzimatis (Chaplin dan Buckle, 1990)
Produksi sirup glukosa dilakukan setelah diukur aktivitas masing-masing enzim untuk menentukan jumlah enzim yang ditambahkan sebagai biokatalis proses hidrolisis pati. Diagram alir pembuatan sirup glukosa dapat dilihat pada Gambar 6.
Gambar 5. Diagram alir produksi sirup glukosa dengan hidrolisis asam Suspensi pati 30% dalam
aquades
Uji pati dengan Iod
pH dinaikkan dengan NaOH 1 N hingga pH 5
Pemurnian dengan arang aktif (suhu 80°C, 1 jam) Sirup Glukosa pH diatur hingga 2 dengan HCl 0,1% Autoclave 121oC selama 1 jam Pati Sagu
Gambar 6. Diagram alir produksi sirup glukosa enzimatis Suspensi pati 30% dalam
larutan CaCO3 200 ppm
Likuifikasi (95°C, 180 menit)
Sakarifikasi
(suhu 60°C, pH 4,5, 72 jam)
Pemurnian dengan arang aktif (suhu 80°C, 1 jam) Sirup Glukosa pH diatur hingga 5,2 α-amilase 1,75 U/g pati Gelatinisasi (105°C, 5 menit) Pati Sagu
Karakterisasi pati sagu
Glukoamilase 0,3 U/ g pati
C. RANCANGAN PERCOBAAN
Rancangan percobaan yang digunakan pada pembuatan sirup glukosa adalah desain rancangan faktor tunggal yang masing-masing dilakukan pada karakteristik pati sagu, metode hidrolisis asam dan enzim. Jenis perlakuan yaitu jenis pati yang terdiri atas 5 taraf yaitu, pati sagu yang berasal dari 5 wilayah yang berbeda, diantaranya :
S1 = Sulawesi Utara S2 = Jawa Barat S3 = Riau S4 = Irian Jaya
S5 = Kalimantan Selatan
Model rancangan percobaan berdasarkan Sudjana (1985), untuk penelitian ini adalah sebagai berikut :
Yij = μ + Wi + ε ij Yij : variabel yang akan dianalisis
μ : rata-rata sebenarnya
Wi : pengaruh jenis pati pada taraf ke-i (i = S1, S2, S3, S4, dan S5) ε ij : kekeliruan yang merupakan efek acak unit eksperimen ke-j pada jenis pati
sagu ke-i
D. METODE ANALISIS
Analisis yang dilakukan meliputi karakterisasi sifat fisikokimia terhadap pati sagu, analisis sifat fisika, kimia dan mutu sirup glukosa (SNI 01-2978-1992). Karakterisasi pati meliputi analisis kadar air, kadar abu, kadar protein, kadar pati, kadar serat, dan kadar lemak, serta analisis daya cerna pati oleh amilase pankreatin.
Analisis sirup glukosa meliputi DE, DP, rendemen, kadar abu, kadar bahan kering, kejernihan, dan pH. Prosedur analisis disajikan pada Lampiran 1.
I V . H A S I L D A N P E M B A H A S A N
A. KARAKTERISASI PATI
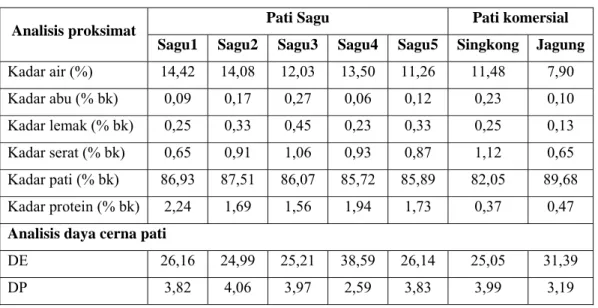
Pati sagu yang digunakan sebagai bahan baku pembuatan sirup glukosa terdiri atas lima jenis yang berasal dari lima wilayah yang berbeda yaitu Jawa Barat, Riau, Sulawesi Utara, Kalimantan Selatan, dan Irian Jaya. Karakterisasi meliputi kadar air, kadar abu, kadar lemak, kadar serat, kadar pati dan kadar protein. Pati jagung dan pati singkong sebagai pati pembanding juga dikarakterisasi seperti pati sagu. Hasil analisis proksimat pati sagu dan pati singkong dan jagung tersebut dapat dilihat pada Tabel 7.
Tabel 7. Analisis proksimat dan daya cerna pati
Pati Sagu Pati komersial Analisis proksimat
Sagu1 Sagu2 Sagu3 Sagu4 Sagu5 Singkong Jagung Kadar air (%) 14,42 14,08 12,03 13,50 11,26 11,48 7,90 Kadar abu (% bk) 0,09 0,17 0,27 0,06 0,12 0,23 0,10 Kadar lemak (% bk) 0,25 0,33 0,45 0,23 0,33 0,25 0,13 Kadar serat (% bk) 0,65 0,91 1,06 0,93 0,87 1,12 0,65 Kadar pati (% bk) 86,93 87,51 86,07 85,72 85,89 82,05 89,68 Kadar protein (% bk) 2,24 1,69 1,56 1,94 1,73 0,37 0,47 Analisis daya cerna pati
DE 26,16 24,99 25,21 38,59 26,14 25,05 31,39
DP 3,82 4,06 3,97 2,59 3,83 3,99 3,19
Dari hasil analisis ragam terhadap karakteritik bahan baku pada α = 5% menunjukkan bahwa kadar air, kadar abu, dan daya cerna pati berpengaruh nyata, sedangkan karakteristik kimia lainnya tidak berpengaruh nyata. Hasil analisis ini ditunjukkan pada Lampiran 2.
Kadar air pati sagu yang dihasilkan berkisar antara 11,26 – 14,42%, sebagian pati sagu belum memenuhi standar SNI untuk pati sagu yaitu maksimum 13%. Kadar air pati sagu dipengaruhi oleh kelembaban relatif lingkungan, jumlah air yang ditambahkan selama proses ekstraksi dan juga proses pengeringan terhadap pati. Proses pengeringan pada sistem tradisional
umumnya hanya menggunakan sinar matahari, sedangkan pada sistem yang modern, pengeringan menggunakan mesin pengering.
Pati sagu memiliki kandungan mineral yang cukup rendah dan dari hasil analisis kadar abu yang dihasilkan berkisar antara 0,063 – 0,265%. Rendahnya kadar abu pati sagu disebabkan karena rendahnya kandungan mineral yang terdapat pada pati sagu. Tempat tumbuh sagu pada umumnya yaitu lahan gambut yang memiliki kandungan mineral yang rendah. Kandungan unsur makro yaitu Ca, K, dan Mg serta unsur mikro khususnya Cu, B dan Zn sangat rendah ( Subagyo et al., 1996). Kadar abu dari wilayah Kalimantan Selatan, dan Irian Jaya, Sulawesi Utara cukup rendah, tanaman sagu di Kalimantan Selatan dan Irian Jaya tumbuh di lahan gambut ombrogen yang memiliki tingkat keasaman tanah yang cukup tinggi sehingga unsur-unsur mikro yang terdapat dalam tanah membentuk kation-kation dengan asam organik dari gugus karboksilat dan fenolat yang banyak terdapat pada lahan gambut ombrogen. Tingkat kesuburan tanah di Pulau Jawa cukup baik, kandungan unsur hara yang tersedia bagi tanaman relatif lebih tinggi karena Pulau Jawa dilalui oleh jalur pegunungan berapi Sirkum Mediterania, dan struktur tanah pada umumnya adalah alluvial, vulkanik dan humus yang baik untuk pertanian (Setiawan et al., 2005).
Uji homogenitas terhadap kadar protein dan kadar lemak pada Lampiran 3 menunjukkan sagu3, 4, dan 5 berada pada kelompok yang sama. Kadar serat dan kadar protein yang terkandung dalam pati, dipengaruhi oleh proses selama ekstraksi pati, sehingga diduga proses ekstraksi yang dilakukan pada ketiga wilayah tersebut hampir sama.
Kadar pati sagu bahkan lebih tinggi dari pati singkong yaitu 82,05%. Sagu tumbuh di lahan rawa air tawar, lahan gambut dan di sepanjang aliran sungai. Tanah gambut tropis mempunyai kandungan bahan organik yang tinggi lebih dari 90% dan kandungan unsur karbon (C) yang sangat tinggi. Sekitar 5% dari seluruh karbon bumi diperkirakan termasuk kawasan gambut tropis (Hastin, 2002). Tingginya kandungan C sebagai penyusun pati menyebabkan pati sagu memiliki kadar pati yang tinggi. Dari uji homogenitas kadar pati yang terdapat pada Lampiran 3 diketahui bahwa semua pati terdapat dalam kelompok yang sama, yang berarti bahwa antara masing-masing pati sagu tidak berbeda nyata.
Karakteristik sifat kimia pati sagu memenuhi standar SNI, kecuali pada kadar serat dan kadar air pati sagu dari beberapa daerah. Hasil analisis kadar air selanjutnya akan digunakan sebagai basis untuk menentukan dosis penggunaan enzim dan konsentrasi suspensi pati berdasarkan bobot kering pati.
Pati singkong yang dipergunakan berasal dari pabrik tapioka di Ciluar, Bogor. Proses pengeringan pati dilakukan dengan pengeringan sinar matahari sehingga kadar air pati masih tinggi. Pati jagung yang digunakan merupakan pati yang dijual di pasaran dan dikenal dengan nama maizena. Pati jagung dan tapioka memiliki kadar protein, lemak dan serat yang rendah. Hal ini karena pati jagung dan tapioka diperoleh dari industri yang memproduksi pati tersebut dalam skala besar sehingga pati tersebut sudah melalui proses
deproteinasi untuk mengurangi kandungan protein dan defatting untuk mengurangi kandungan lemak, serta proses penyaringan pada pati jagung untuk mengurangi kandungan serat. Warna pati juga lebih putih bila dibandingkan dengan pati sagu. Penampakan fisik pati sagu dan pati pembanding disajikan pada Gambar 7.
Pati sagu memiliki warna yang lebih gelap, terutama pada pati sagu4 yang berasal dari Irian Jaya. Warna pati sagu dipengaruhi oleh kandungan senyawa fenolik pada sagu yang menyebabkan aktivitas oksidase dari enzim polifenolase yang menyebabkan reaksi pencoklatan enzimatis pada pati. Senyawa-senyawa fenolik dapat berasal dari air yang digunakan untuk proses ekstraksi. Proses ekstraksi pati di Irian Jaya umumnya menggunakan air yang tergenang yang berwarna hitam sehingga mempengaruhi warna pati sagu yang dihasilkan. Menurut Subagyo et al., (1996), wilayah pertumbuhan tanaman sagu sebagian besar berada pada hutan rawa yang dialiri oleh sungai yang berwarna hitam. Sungai berwarna hitam memiliki nutrisi yang rendah dan tinggi kandungan senyawa polifenol yang memberikan warna coklat pada air.
Gambar 7. Penampakan fisik pati sagu dan pati pembanding
B. DAYA CERNA PATI OLEH AMILASE PANKREATIN
Pati dibentuk oleh tumbuhan untuk menyimpan energi, yaitu disimpan di dalam biji/butir halus pati di dalam sel, terutama di dalam akar umbi atau benih. Daya cerna pati tergantung pada sumber pati. Pati yang memiliki kandungan amilopektin tinggi akan sulit dicerna. Ukuran granula juga mempengaruhi daya cerna pati, semakin kecil ukuran granula pati maka luas permukaannya akan semakin besar sehingga lebih mudah dicerna.
Amilosa memiliki ikatan α-(1-4), sedangkan selulosa memiliki ikatan β-(1-4) antara molekul gula. Ikatan rantai pada amilosa membentuk struktur heliks, sedangkan selulosa membentuk struktur zigzag, dan banyak terdapat
Tapioka Jagung
0 20 40 60 80 100 T J S1 S2 S3 S4 S5 Bahan Baku D E 0 1 2 3 4 5 T J S1 S2 S3 S4 S5 Bahan Baku DP
pada dinding sel tumbuhan. Enzim pencernaan dapat mencerna amilosa tetapi tidak dapat mencerna selulosa.
Hasil pemecahan pati oleh amilase pankreatin menghasilkan hidrolisat yang mengandung glukosa, maltosa, maltotriosa, tetrasakarida dan pentasakarida (Robyt, 1984). Berikut ini disajikan histogram perolehan nilai DE dan DP pada hidrolisat pati yang dihasilkan oleh hidrolisis pati dengan amilase pankreatin.
Gambar 8. Nilai DE pada hidrolisis pati oleh amilase pankreatin
Gambar 9. Nilai DP pada hidrolisis pati oleh amilse pankreatin
Pada Gambar 8 dan Gambar 9 dapat dilihat hidrolisis pati oleh amilase pankreatin menghasilkan produk dengan nilai DE berkisar antara 24,99 – 38,59, dan DP berkisar antara 2,59 – 4,00. Nilai DE dapat mengindikasikan sebagai persentase pati yang dapat dicerna dari keseluruhan total karbohidrat dalam pati. Amilase pankreatin berasal dari pankreas hewan mamalia dan dapat dianalogikan dengan amilase yang disekresi oleh pankreas manusia. Sagu4 memiliki nilai DE tertinggi, hal ini berarti kemampuan pati sagu untuk dicerna dalam sistem pencernaan cukup tinggi, pati akan lebih cepat dikonversi menjadi monomer-monomer penyusunnya untuk diubah menjadi energi.
Pati selain memegang peranan penting sebagai sumber karbohidrat, juga berperan sebagai sumber karbohidrat yang tidak dapat dicerna dan dapat dikatakan sebagai pati resisten (resistant starch). Pati resisten merupakan pati yang tidak dapat dicerna oleh enzim amilolitik dalam sistem pencernaan (Bjorck, 1996). Dalam sistem pencernaan, pati resisten tidak dapat dicerna oleh usus kecil, namun dilewatkan ke dalam usus besar dan difermentasi oleh bakteri mikroflora membentuk asam lemak rantai pendek yang baik untuk kesehatan dan mencegah kanker usus. Asam lemak yang terbentuk akan diserap oleh darah dan dapat menurunkan kadar kolesterol dalam darah (www.healthyeatingclub.org).
C. AKTIVITAS ENZIM
Kondisi standar optimum α-amilase dan glukoamilase meliputi pH optimal dan suhu optimal ditentukan berdasarkan penelitian sebelumnya yang dilakukan oleh Wibisono (2004) dan Akyuni (2004) yaitu untuk α-amilase pada suhu 95oC dan pH 5,2 dan glukoamilase pada pH 4,5 dan suhu 60oC. Hal ini dilakukan karena jenis α-amilase dan glukoamilase yang digunakan berasal dari sumber yang sama, dan kemungkinan kondisi optimal dari enzim tersebut tidak akan terlalu jauh berbeda. Menurut Kulp (1975), aktivitas α-amilase terjadi pada keadaan asam, yaitu pada pH antara 4,5 sampai 7,0, tetapi bentuk kurva aktivitas dan pH optimum berbeda tergantung sumber enzimnya.
Penentuan aktivitas α-amilase dilakukan dengan mengukur hasil degradasi pati, biasanya dari kadar pati yang larut atau kadar dekstrinnya dengan menggunakan substrat jenuh (Suhartono, 1989). Substrat yang digunakan dalam penentuan aktivitas enzim adalah soluble starch 2%. Substrat sebelum digunakan digelatinisasi terlebih dahulu agar enzim dapat langsung menghidrolisis substrat. Dari hasil penghitungan aktivitas α-amilase (Bacillus licheniformis) diperoleh aktivitas enzim sebesar 1377,4152 U/ml enzim. Data hasil penghitungan dapat dilihat pada Lampiran 4.
Substrat yang digunakan untuk pengukuran aktivitas glukoamilase yaitu larutan soluble starch 2% yang telah tergelatinisasi. Dari hasil penghitungan aktivitas glukoamilase (Aspergillus niger) diperoleh aktivitasnya sebesar 145 U/ml enzim.
D. PRODUKSI SIRUP GLUKOSA
1. Hidrolisis Enzim
Pada penelitian ini kondisi α-amilase ditentukan berdasarkan penelitian sebelumnya yang dilakukan oleh Wibisono (2004) yaitu pada pH 5,2 suhu 95oC. Pati dengan konsentrasi 30% disuspensikan dalam larutan