PENGEMBANGAN TEKNIK DIAGNOSA FASCIOLOSIS PADA SAPI DENGAN
ANTIBODI MONOKLONAL DALAM CAPTURE ELISA
UNTUK DETEKSI ANTIGEN
Sawitri Endah Estuningsih, G. Adiwinata, S. Widjajanti dan D. Piedrafita*
Balai Penelitian Veteriner, Jl. Martadinata 30, Bogor 16114 *Centre for Animal Biotechnology, Melbourne University, Australia
ABSTRACT
S.E. Estuningsih, G. Adiwinata, S. Widjajanti and D. Piedrafitas. 2004. Development of Diagnosis Technique for Fasciolosis in Cattle Using Monoclonal antibody in Capture ELISA to Detect Antigen.
The purpose of this study was to develop and implement an improved test for diagnosis of fasciolosis in cattle for antigen detection using monoclonal antibody to Fasciola in capture ELISA. In order to do this work and develop this assay, a large reagents have been collected and generated. This included the collection of Fasciola gigantica Excretory/Secretory antigen, recombinan Cathepsin L, polyclonal and monoclonal antibodies. Development of two sites antigen capture ELISA using monoclonal antibodies have been standardised and applied to the abattoir and field samples. Blood for serum, fecal samples and livers were collected from 150 cattle slaughtered at the abattoir. From each animal, livers were processed for the determination of total Fasciola parasites numbers and the corresponding faecal and serum samples were analysed for coproantigen and anti-Fasciola antibodies, respectively. A field study was also undertaken in villages in Yogyakarta. A total of 305 cattle from 2 regencies in Yogyakarta were monitored, the blood (for serum) and faecal samples from the same cattle were collected monthly for a 10 months period. The serum and faecal samples were also analysed as the same as abattoir samples. Coproantigen was detected using 2 monoclonal antibodies raised against Fasciola ES antigen (one monoclonal for capture and one biotinylated monoclonal for detection). Anti-Fasciola antibody in serum was detected by coating ELISA plate with F. gigantica ES antigen, followed by incubating serum from cattle and detected with HRP-conjugated anti-bovine IgG commercial antibody. The result show that the sensitivity and specificity of coproantigen detection were 95% and 91% respectively, is comparable with indirect ELISA for detection of anti-Fasciola antibody in serum (91% and 88% respectively). In addition, the two-sites capture ELISA had the best positive correlation between increasing worm burdens and increasing absorbance value compared with anti-Fasciola antibodies in serum. Furthermore, results from field study show that most animals from 2 regencies in Yogyakarta were found to be infected with F. gigantica over the study, as determined by two-site capture ELISA. The incidence of Fasciola infection was high and a mean 40-90% in Bantul region and between 50-78% in Kulon Progo region. This capture assay will have the advantage over the conventional indirect ELISA for the detection of anti-Fasciola antibody in serum currently available in Indonesia, in that patent infections in cattle will be identified. Collection of faeces rather than serum will also allow a more cost-effective and adaptable assay. We purpose to use this assay as a diagnostic determining patent infection in the near future.
Key words: Fasciolosis, diagnosis, ELISA, monoclonal antibody.
ABSTRAK
S.E. Estuningsih, G. Adiwinata, S. Widjajanti and D. Piedrafitas. 2004. Pengembangan Teknik Diagnosis Fasciolosis pada Sapi dengan Antibodi Monoklonal dalam Capture ELISA untuk Deteksi Antigen.
Penelitian ini dilakukan untuk mengembangkan dan mengimplementasikan uji capture-ELISA, yang merupakan uji diagnosis fasciolosis pada sapi dengan cara mendeteksi antigen dengan menggunakan antibodi monoklonal Fasciola. Sebagai pendukung uji tersebut maka beberapa reagen perlu dihasilkan dan dikoleksi, seperti
Uji capture-ELISA ini distandarisasi dan diaplikasikan pada sampel hewan sapi dari rumah potong hewan (RPH) dan dari lapangan. Dari RPH diperoleh 150 sampel sapi yang terdiri dari serum darah yang akan diuji anti-Fasciola antibodi, feses yang akan diuji kandungan antigennya dan hati untuk diproses dan dikoleksi cacing F.gigantica yang ada di dalamnya. Sedangkan dari lapangan yang berlokasi di Kabupaten Bantul dan Kabupaten Kulon Progo, Yogyakarta, diperoleh 305 sampel sapi yang terdiri dari serum dan feses. Sampel dari sapi yang sama tersebut dikoleksi setiap bulan selama 10 bulan. Antigen dalam feses dideteksi dengan menggunakan 2 monoklonal antibodi terhadap FgESAg (monoklonal yang tidak dilabel untuk capture dan monoklonal yang dilabel dengan biotin untuk deteksi). Anti-Fasciola antibodi dideteksi dengan cara melapisi cawan ELISA dengan FgESAg, lalu serum sampelnya diinkubasikan dan antibodinya dideteksi dengan HRP-conjugated anti-bovine IgG komersial. Hasilnya menunjukkan bahwa uji antigen dalam feses sensitifitasnya 95 % dan spesifisitasnya 91 %. Sedangkan uji antibodi dalam serum sensitifitasnya 91 % dan spesifisitasnya 88 %. Berdasarkan uji capture-ELISA terhadap sampel dari lapangan diketahui bahwa kasus kejadian fasciolosis di Bantul antara 40-90 % dan di Kulon Progo antara 50-70 %. Uji capture-ELISA menunjukkan hasil yang lebih baik dan memberikan korelasi positif antara peningkatan kadar antigen dalam feses dan jumlah cacing F. gigantica dalam hati sapi dibandingkan dengan uji antibodi dalam serum. Sehubungan dengan sensitifitas dan spesifisitas yang tinggi dan kemudahan dalam pengambilan sampel hewan (feses) dari uji capture-ELISA dibandingkan dengan uji antibodi dalam serum, maka uji diagnosis fasciolosis dengan capture ELISA ini akan digunakan di Indonesia di masa yang akan datang
Key words: Fasciolosis, diagnosis, ELISA, antobodi monoklonal.
PENDAHULUAN
Fasciolosis merupakan salah satu penyakit parasiter yang menyerang ternak ruminansia. Di daerah tropis penyakit ini disebabkan oleh infeksi cacing hati Fasciola gigantica, sedangkan di daerah temperate disebabkan oleh F. hepatica (Boray, 1985). Di Indonesia, prevalensi fasciolosis antara 60-90% (Edney dan Muchlish, 1962; Suhardono et al., 1991). Kerugian ekonomi akibat penyakit ini diperkirakan sekitar 513,6 milyar setiap tahun (Anonymous, 1990), berupa kerusakan hati yang harus diafkir, kekurusan dan penurunan tenaga untuk membajak sawah.
Diagnosa fasciolosis pada umumnya berdasarkan penemuan telur cacing dalam feses hewan yang terinfeksi (Boray, 1985). Akan tetapi jumlah telur cacing yang terlalu sedikit dalam feses akan mengalami kesulitan dalam mendiagnosa, dan telur tidak akan ditemukan sampai cacing hati mencapai dewasa. Cacing hati mulai produksi telur biasanya antara minggu ke 10-14 setelah hewan terinfeksi F. hepatica (Armour et al., 1974) dan F. gigantica pada minggu ke 12-18 setelah infeksi. Pendekatan alternatif untuk diagnosa fasciolosis adalah dengan pemeriksaan serologi untuk deteksi antibodi terhadap Fasciola spp dengan menggunakan antigen yang spesifik (Hillyer et al., 1992; Hillyer, 1993) yang umumnya dengan uji ELISA. Antibodi F. hepatica dengan uji ELISA dapat dideteksi antara minggu ke 3-6 setelah infeksi pada saat larva cacing migrasi ke hati (Marin, 1992). Namun uji ini masih ada kekurangannya, karena titer antibodi yang tinggi hanya bisa untuk menunjukkan bahwa hewan tersebut pernah terinfeksi akan tetapi tidak bisa menunjukkan bahwa hewan tersebut sedang terinfeksi oleh Fasciola (infeksi aktif). Selanjutnya, hewan yang sudah diberi obatpun tetap menunjukkan titer yang tinggi terhadap Fasciola (Ibarra et al., 1998).
Maka dari itu perlu dikembangkan teknik diagnosa fasciolosis yang bisa mendeteksi adanya infeksi aktif. Salah satu teknik tersebut adalah dengan capture ELISA untuk mendeteksi adanya antigen dalam serum atau feses yang dikeluarkan oleh cacing F. gigantica. Abdel-Rahman et al (1998) melaporkan bahwa capture ELISA untuk deteksi coproantigen merupakan diagnosa Fasciola dengan memeberikan hasil yang sensitif, spesifik dan cepat. Tujuan dari penelitian ini adalah untuk mengembangkan dan menerapkan teknik diagnosa fasciolosis pada sapi untuk deteksi antigen F. gigantica dengan antibodi monoklonal dalam capture ELISA.
MATERI DAN METODE
Dalam pengembangan capture ELISA digunakan 2 pendekatan yaitu: Capture ELISA dengan menggunakan antibodi monoklonal dan capture ELISA dengan menggunakan antibodi poliklonal. Untuk pengembangan capture ELISA tersebut diperlukan antigen Fasciola baik dari cacing dewasa (Ekskretori/Sekretori , ES antigen) ataupun ekspresi dari rekombinan protein Fasciola (rCatL), monoklonal dan poliklonal antibodi.
1. Produksi Exkretori/Sekretori (ES) antigen F. gigantica
Metode pembuatan antigen ES dari cacing F. gigantica dewasa sama seperti yang telah diuraikan oleh Wijffels et al (1994) setelah dimodifikasi sebagai berikut: Cacing F. gigantica dewasa dikoleksi dari saluran empedu pada hati sapi yang dipotong di RPH. Cacing hati yang masih dalam keadaan hidup ditempatkan dalam kontainer yang berisi larutan Phosphate Buffer Saline (PBS) dan diinkubasikan pada suhu 370 C selama 15-20 menit (kira-kira 50 ekor cacing setiap 100 ml PBS). Cacing yang sudah terlihat bersih dipindahkan ke dalam kontainer yang berisi media RPMI yang mengandung antibiotik yang bersuhu 370 C selam 20 menit. Selanjutnya, semua cacing hati yang masih hidup dan bersih dipindahkan lagi ke dalam medium RPMI yang baru dan diinkubasikan selama 4-6 jam pada suhu 370C. Setelah inkubasi larutan yang telah mengandung ES antigen disentrifugasi dan disimpan dalam suhu –200C sampai digunakan.
2. Produksi rCatL antigen
Cara isolasi rCatL sebagai berikut: Inokulasi kultur sel yang mengandung CatL ke dalam 50 ml minimal medium (0,67% yeast nitrogen base, 2% gliserol, 0,002% urasil dan 0,003% lisin) dalam tabung erlemeyer dan dibiarkan 2 malam sambil di goyang (shaker) pada suhu 280 C. Setelah pertumbuhan sel cukup bagus, kultur sel tersebut ditransfer ke dalam 950 ml enriched medium (1 % dextrose/glucose, 3% gliserol, 20mM CaC2, 1% yeast extract and 8% peptone), lalu diinkubasikan selam 3 malam (72 jam) pada suhu 280C sambil di shaker. Setelah inkubasi 3 malam, larutan sel tersebut disentrifuse dengan kecepatan 5000 rpm selama 10 menit pada suhu 40C, kemudian supernatan didialisa dengan starter buffer (100mM Imidazole, 250 mM NaH2PO4 dan 2,5 M NaCl) pH 7,6 dan dilakukan 4 kali penggantian buffer. Setelah dialisa larutan disentrifuse dengan kecepatan 5000 rpm selama 10 menit pada suhu 40C, selanjutnya cairan ditampung untuk dilakukan purifikasi dengan menggunakan HiTrap column.
3. Produksi antibodi poliklonal
Antibodi poliklonal diproduksi dengan cara melakukan imunisasi pada kelinci dan ayam dengan antigen ES atau rCatL. Jadwal imunisasi sebagai berikut:
minggu ke 0 : imunisasi dengan antigen (100 µg) + Quil A (100 µg) minggu ke 4 : imunisasi dengan antigen (20 µg) + Quil A (20 µg) minggu ke 6 : imunisasi dengan antigen (20 µg) + Quil A (20 µg) minggu ke 8 : imunisasi dengan antigen (20 µg) + Quil A (20 µg) minggu ke 10: ELISA
Setelah minggu ke 10 atau setelah titer antibodi pada kelinci dan ayam tinggi, antibodi poliklonal dikoleksi sebanyak mungkin. Antibodi poliklonal kelinci dikoleksi dari darah jantung, sedangkan pada ayam dikoleksi dari kuning telur.
4. Antibodi monoklonal
Antibodi monoklonal terhadap antigen Fasciola diperoleh dari WEHI, Australia. Untuk capture ELISA antibodi monoklonal tersebut juga dilabel dengan biotin.
5. Standarisasi capture ELISA dengan antibodi monoklonal
Standarisasi capture ELISA dilakukan dengan menggunakan antigen ES/rCatL yang sudah diketahui konsentrasinya sebelum digunakan untuk menguji sampel. Antibodi monoklonal yang tidak dilabel digunakan sebagai capture dan antibodi monoklonal yang sudah dilabel dengan biotin digunakan sebagai secondary antibody. Selanjutnya, untuk deteksi antigen F. gigantica dilakukan dengan cara mencampurkan antigen dengan konsentrasi yang telah ditentukan ke dalam serum atau larutan feses dari sapi yang negatif F. gigantica.
Cara menyiapkan larutan feses untuk deteksi antigen menurut Espino et al (1990) sbb:
Feses dihancurkan dengan menggunakan mortar supaya homogen. Kemudian 1 gram feses yang sudah homogen dilarutkan dalam 2 ml larutan PBST 1% dan diaduk dengan vortek dan kecepatan tinggi. Selanjutnya, larutan feses tersebut disentrifugasi dengan kecepatan tinggi selama 10 menit pada suhu 40C. Supernatan dikoleksi dan disimpan dalam suhu –200C sampai digunakan.
6. Aplikasi capture ELISA i) Menentukan nilai cut-off
Nilai cut-off ditentukan dengan cara menghitung rata-rata nilai optical density (OD) dari 32 sampel negatif (feses dan serum) dari sapi yang dipotong di rumah potong hewan (RPH) ditambah 3 kali standar deviasi (std). Hasil penghitungan cut-off adalah 0,21. Selanjutnya sampel feses yang mempunyai nilai OD >0,21 dinyatakan terinfeksi aktif F. gigantica
ii) Analisis sampel dari RPH
Seratus lima puluh sampel darah, feses dan hati diambil dari sapi yang dipotong di RPH. Hati sapi diproses untuk menentukan jumlah cacing hati yang yang terdapat di dalam hati, feses diproses untuk deteksi antigen dan pemeriksaan telur cacing, sedangkan sampel darah diproses untuk diambil serum dan diperiksa antibodi F. gigantica.
iii) Analisis sampel dari lapangan
Survey lapangan dilakukan di Provinsi Daerah Istimewa Yogyakarta dimana prevalensi fasciolosis cukup tinggi. Tiga ratus lima ekor sapi di Kabupaten Kulon Progo dan Kabupaten Bantul telah dimonitor untuk diambil sampel darah dan feses. Pengambilan sampel dilakukan sebulan sekali selama 10 bulan. Sampel darah diproses untuk koleksi serum dan diperiksa antibodi terhadap F. gigantica, sedangkan feses diproses untuk diperiksa adanya telur dan antigen F. gigantica.
7. Validasi capture ELISA
Dalam melakukan validasi capture ELISA digunakan hewan percobaan domba sebanyak 7 ekor yang diinfeksi dengan 300 metaserkaria F. gigantica, dan 2 ekor domba tidak diinfeksi sebagai kontrol negatif. Antibodi F. gigantica dalam serum dan antigen F. gigantica dalam feses dimonitor pada saat infeksi (minggu ke 0) dan setiap minggu sesudah infeksi. Setelah level antibodi dan antigen cukup tinggi domba diobati dengan fasinex, selanjutnya antibodi dan antigen tetap dimonitor sampai antigen tidak terdeteksi lagi dalam feses.
HASIL DAN PEMBAHASAN
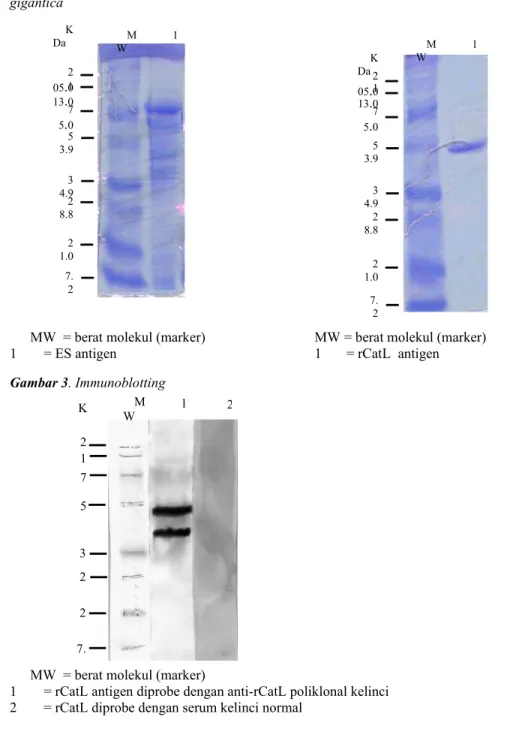
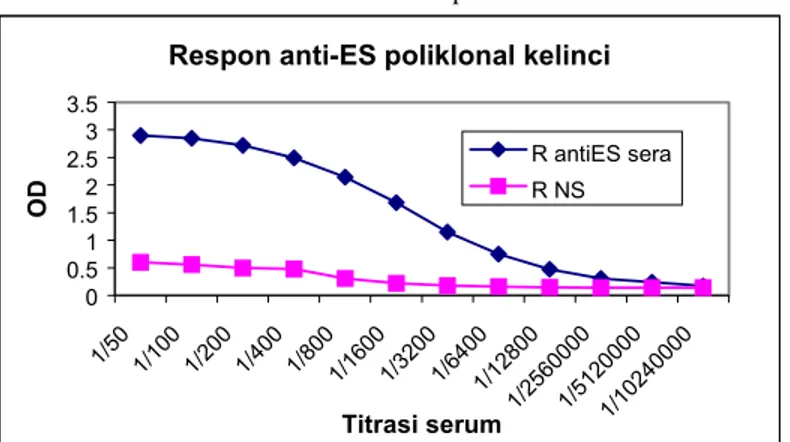
Antigen ES F. gigantica terdiri dari beberapa protein dengan berat molekul antara 7,2-75 kDa (Gambar 1). Protein yang dominan yang terlihat pada SDS-PAGE berukuran sekitar 70-75 kDa, 35-54 kDa dan 7-21 kDa. Adapun rCatL hanya mempunyai satu protein yang berukuran sekitar 50 kDa (Gambar 2). Pada reaksi
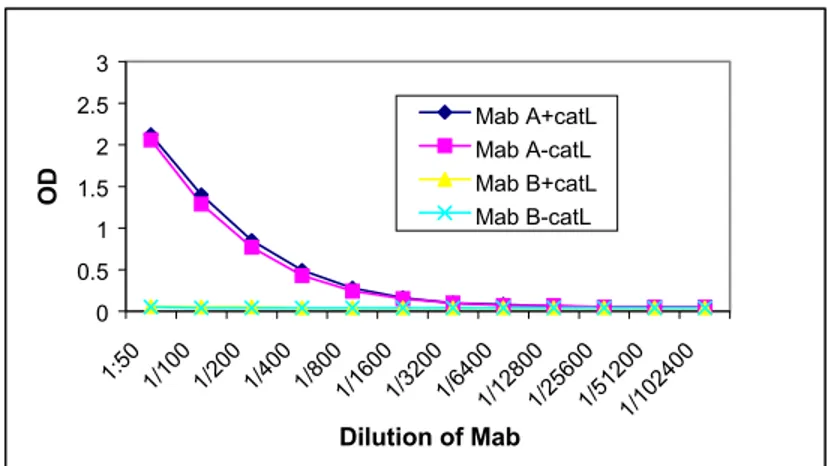
immunoblotting, serum anti-rCatL poliklonal kelinci bereaksi dengan 2 protein yang berukuran sekitar 42 kDa dan 50 kDa (Gambar 3), sedangkan pada serum kelinci normal tidak bereaksi.
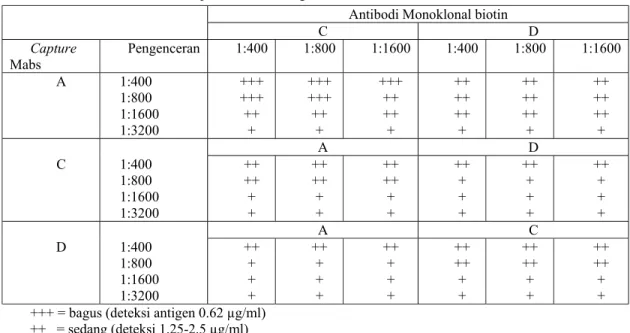
Hasil titrasi serum poliklonal kelinci dan ayam dipaparkan pada Gambar 4a, b, c dan d. Ada perbedaan respon antibodi pada serum kelinci antara yang diimunisasi dengan yang tidak diimunisasi, sedangkan antara ayam yang diimunisasi dengan yang tidak diimunisasi tidak berbeda. Hal ini disebabkan karena tingginya background pada cawan ELISA, kemungkinan karena ada kontaminasi protein yang tidak spesifik saat purifikasi antibodi dalam kuning telur dan turunnya sensitifitas dari metode tersebut. Pemakaian serum poliklonal dalam capture ELISA, dengan menggunakan poliklonal ayam sebagai capture (yang dikotingkan ke cawan ELISA), yang diikuti dengan serum poliklonal kelinci (secondary antibody) memberikan hasil yang sama antara kontrol positif dan negatif. Sedangkan, apabila serum poliklonal kelinci sebagai capture yang diikuti dengan poliklonal ayam terlihat ada perbedaan antara kontrol positif dan negatif (data tidak ditampilkan). Perbedaan ini tetap ada pada saat digunakan untuk menguji sampel feses maupun serum. Hasil ini memberikan harapan bahwa diagnosa fasciolosis dengan capture ELISA bisa dikembangkan dengan menggunakan antibodi poliklonal. Akan tetapi, implementasi dari uji ini masih memerlukan peningkatan sensitifitasnya yang hanya bisa dicapai dengan melakukan purifikasi dengan memisahkan antibodi yang spesifik dari antibodi yang tidak spesifik di dalam serum kelinci atau kuning telur. Misalnya dengan teknik presipitasi alumunium sulfat atau afinity purification. Purifikasi terhadap poliklonal antibodi telah dilakukan akan tetapi tidak berhasil mendapatkan antibodi dengan konsentrasi protein yang tinggi. Sementara itu, antibodi monoklonal sudah siap dan telah berhasil mengenal antigen ES F. gigantica. Selanjutnya untuk menguji sampel lapangan dalam capture ELISA akan digunakan antibodi monoklonal.
Hasil titrasi antibodi monoklonal dapat dilihat pada Gambar 5a dan 5b, hanya 3 antibodi monoklonal (A, C dan D) yang mempunyai titer tinggi terhadap antigen ES, sebaliknya, ke 4 antibodi monoklonal tersebut tidak bereaksi terhadap antigen rCatL (Gambar 6a dan 6b). Hasil ini memperlihatkan bahwa antibodi monoklonal tersebut sangat dominan dalam mendeteksi antigen ES daripada antigen rCatL F. gigantica. Antibodi monoklonal yang telah dilabel dengan biotin juga bereaksi dengan antigen ES (Gambar 7) yang selanjutnya akan dipakai dalam capture ELISA untuk menguji sampel feses atau serum sapi dari lapangan.
Selanjutnya, hasil standarisasi capture ELISA dengan menggunakan antibodi monoklonal non-biotin dan antibodi monoklonal biotin dipaparkan pada Tabel 1. Berdasarkan hasil pada Tabel 1 menunjukkan bahwa kombinasi antara antibodi monoklonal A non-biotin sebagai capture (1:800; 2,5 µg/ml) dan dideteksi dengan antibodi monoklonal C biotin (1:800; 0,63µg/ml) memberikan hasil yang paling bagus (titer tinggi) (Gambar 8).
Hasil capture ELISA dengan menggunakan sampel serum ataupun feses dari sapi yang negatif F. gigantica setelah penambahan antigen ES dapat dilihat pada Gambar 9. Uji ini mampu mendeteksi antigen ES dalam feses, tetapi sebaliknya tidak pada serum. Hasil ini menunjukkan bahwa deteksi antigen ES dalam feses lebih sensitif dibanding deteksi antigen ES dalam serum, dan mempunyai keunggulan karena pengambilan sampel feses lebih praktis dan cepat dibanding pengambilan sampel serum serta memerlukan biaya yang lebih murah. Maka dari itu untuk menguji sampel dari RPH maupun dari lapangan dengan capture ELISA hanya akan diterapkan pada sampel feses saja.
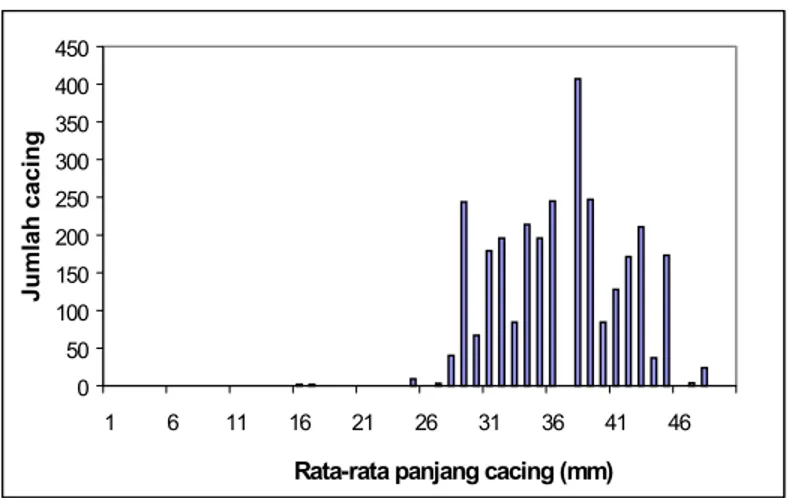
Berdasarkan hasil survey dari RPH Jakarta, 92 (61,3%) dari 150 ekor sapi yang dipotong terinfeksi F. gigantica dalam hatinya. Jumlah cacing yang ditemukan antara 1-426 cacing per ekor sapi yang berukuran antara 16-48 mm (Gambar 10). Nilai cut-off pada capture ELISA ditentukan dengan cara menghitung nilai rat-rata OD dari 32 ekor sapi yang negatif F. gigantica (negatif cacing dalam hati, negatif telur cacing dalam feses dan negatif antibodi dalam serum) ditambah 3 kali std yang memberikan hasil 0,21 (Tabel 2). Berdasarkan hasil penghitungan tersebut, sapi yang sampel fesesnya mempunyai nilai OD >0,21 dinyatakan terinfeksi F. gigantica. Selanjutnya hasil pemeriksaan sampel feses dari RPH dengan capture ELISA untuk deteksi antigen F. gigantica dapat dilihat pada Tabel 3 yang memperlihatkan bahwa sensitifitas dan spesifisitas dari uji tersebut masing-masing adalah 95% dan 91%. Hasil pemeriksaan telur cacing dalam
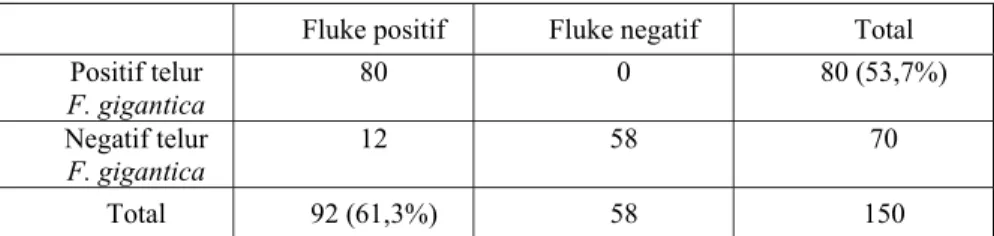
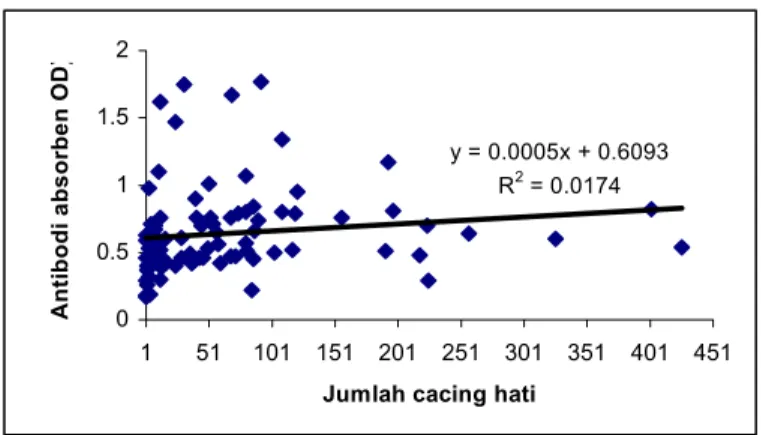
feses terpapar pada Tabel 4 yang memperlihatkan bahwa 92 (61.3%) dari 150 ekor sapi yang dipotong di RPH positif cacing dalam hatinya tetapi hanya 53% sapi-sapi tersebut ditemukan telur dalam fesesnya. Hasil pemeriksaan antibodi ELISA pada serum sapi dari RPH ada pada Tabel 5, dimana sensitifitas dari uji tersebut adalah 91% sedangkan spesifisitasnya adalah 88%. Korelasi antara antigen dalam feses dengan jumlah cacing dalam hati lebih bagus daripada korelasi antara antibodi dalam serum dengan jumlah cacing dalam hati (Gambar 11&12).
Diagnosa fasciolosis pada sapi dengan menggunakan antibodi monoklonal untuk deteksi antigen ES telah dilaporkan oleh Fafbemi et al (1995) dan Dumenigo et al. (1996) yang menyatakan bahwa antigen dalam serum dapat terdeteksi pada minggu ke 2-3 setelah infeksi. Tingkat infeksi pada hewan dapat diketahui dengan mengukur banyaknya antigen Fasciola yang berada dalam feses maupun serum hewan yang terinfeksi (Fagbemi dan Guobadia, 1995). Pada penelitian ini telah dipaparkan bahwa capture ELISA dengan menggunakan antibodi monoklonal untuk deteksi antigen F. gigantica dalam serum sapi memberikan hasil yang tidak sebagus deteksi antigen dalam feses. Hasil ini sama dengan hasil yang telah dilaporkan oleh Abdel-Rahman et al (1998) bahwa deteksi antigen F. gigantica dalam feses lebih sensitif dibandingkan deteksi antigen dalam serum. Berdasarkan laporan Espino dan Finlay (1994) dan Dumenigo et al (1996) ada korelasi antara jumlah antigen dalam feses dengan jumlah cacing dewasa dalam hati. Dari laporan ini terlihat bahwa deteksi antigen dalam feses dengan capture ELISA bisa untuk menentukan adanya infeksi aktif F. gigantica. Dari hasil-hasil yang telah dipaparkan terlihat bahwa deteksi antigen dalam feses pada hewan yang terinfeksi F. gigantica memberikan hasil yang lebih bagus dan akurat yang mempunyai beberapa keunggulan daripada uji serologi. Pada uji serologi membutuhkan tabung venojek dan jarum untuk pengambilan darah sehingga membutuhkan biaya yang mahal, sedangkan untuk deteksi antigen dalam feses hanya memerlukan kantong plastik untuk koleksi feses. Keuntungan yang lainnya adalah pada capture ELISA hanya mendeteksi adanya infeksi aktif fasciola pada hewan.
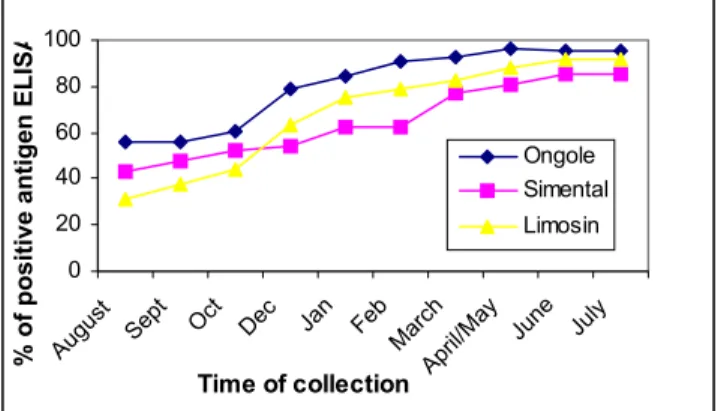
Hasil dari survey lapangan yang dilakukan di Kabupaten Bantul dan Kulon Progo, Yogyakarta selama 10 bulan pengamatan didapatkan bahwa sapi-sapi di daerah tersebut terinfeksi F. gigantica. Persentase sapi yang positif antigen dan telur F. gigantica di kedua daerah tersebut dipaparkan pada Gambar 13 &14. Kejadian fasciolosis berdasarkan deteksi antigen dalam feses di Kabupaten Bantul antara 40-90% dan di Kulon Progo antara 50-78% (Gambar 13), sedangkan berdasarkan pemeriksaan telur cacing kejadian fasciolosis di daerah tersebut lebih rendah (Gambar 14). Berdasarkan jenis sapi, sapi Ongole lebih peka terhadap infeksi F. gigantica dibanding sapi Simental dan Limosin meskipun di Kabupaten Bantul pada akhir pengamatan persentase sapi yang terinfeksi hampir sama ± 90% (Gambar 15 dan 16). Wiedosari et al (1999) juga melaporkan bahwa sapi Ongole lebih peka terhadap infeksi F. gigantica dibanding sapi Bali dan Kerbau. Penemuan telur cacing dalam feses lebih fluktuatif dibanding dengan deteksi antigen dalam feses sehingga penemuan telur dalam feses bukan sebagai indikator yang bagus untuk deteksi adanya infeksi F. gigantica pada sapi. Diagnosa fasciolosis dengan capture ELISA untuk deteksi antigen dalam feses merupakan diagnosa yang lebih tepat untuk mendeteksi adanya infeksi aktif F. gigantica pada sapi dan merupakan diagnosa yang simpel, cepat dan akurat.
Hasil validasi capture ELISA pada hewan percobaan terlihat bahwa antigen ES F. gigantica dalam feses mulai terdeteksi pada 4 ekor domba pada minggu ke 5 setelah infeksi , dan pada minggu ke 7 setelah infeksi semua domba yang diinfeksi positif antigen dalam fesesnya. Level antigen dalam feses tertinggi dicapai pada minggu ke 14 setelah infeksi dan 2 minggu setelah domba diobati level antigen sudah tidak terdeteksi lagi dalam feses (Gambar 17). Sedangkan antibodi dalam serum mulai terdeteksi pada minggu ke 3 setelah infeksi dan mencapai level yang tertinggi pada minggu ke 9-14 setelah infeksi. Antibodi mulai turun pada minggu ke 2 setelah domba diobati tapi levelnya masih tetap tinggi (± OD = 1) (Gambar 18). Adapun, telur cacing F. gigantica mulai terdeteksi pada minggu ke 15 setelah infeksi dan satu minggu setelah diobati telur sudah tidak terdeteksi lagi dalam feses (data tidak ditampilkan). Domba yang tidak diinfeksi tetap negatif selama pengamatan. Dari hasil tersebut terlihat bahwa diagnosis secara konvensional dengan pemeriksaan telur dalam feses hanya bisa dicapai setelah cacing dewasa/mulai produksi telur (15 minggu setelah infeksi). Sedangkan, diagnosis dengan capture ELISA, antigen dalam feses mulai terdeteksi pada minggu ke 5 setelah infeksi, dan mencapai puncaknya pada minggu ke 14 setelah cacing dewasa.
Positif diagnosis ini tetap terdeteksi selama hewan terinfeksi dan menjadi negatif setelah hewan diobati (cacing tereliminasi), sedangkan antibodi tetap tinggi walaupun hewan telah diobati. Jadi, diagnosis dengan capture ELISA untuk deteksi antigen dalam feses memiliki keunggulan daripada deteksi antibodi dalam serum, karena bisa untuk mendeteksi adanya infeksi aktif sehingga pengobatan bisa dilakukan secara efektif/pada hewan yang terinfeksi saja. Selain itu pengambilan sampel feses lebih mudah dilakukan dibanding pengambilan serum yang memerlukan keahlian, selain itu juga memerlukan biaya yang lebih.
Gambar 1. Gambaran protein ES antigen Gambar 2. Gambaran protein rCatL antigen F. gigantica
MW = berat molekul (marker) MW = berat molekul (marker) 1 = ES antigen 1 = rCatL antigen
Gambar 3. Immunoblotting
MW = berat molekul (marker)
1 = rCatL antigen diprobe dengan anti-rCatL poliklonal kelinci 2 = rCatL diprobe dengan serum kelinci normal
2 05.01 13.0 7 5.0 5 3.9 3 4.9 2 8.8 2 1.0 7. 2 K Da W M 1 2 05.01 13.0 7 5.0 5 3.9 3 4.9 2 8.8 2 1.0 7. 2 K Da M W 1 1 2 M W K 2 1 7. 5 2 7 3 2
Gambar 4a. Titrasi anti-ES poliklonal kelinci Respon anti-ES poliklonal kelinci
0 0.51 1.5 2 2.5 3 3.5 1/50 1/100 1/200 1/400 1/8001/16001/32001/64001/12800 1/25600001/51200001/10240000 Titrasi serum OD R antiES sera R NS
Gambar 4b. Titrasi anti-rCatlL poliklonal kelinci
0 0.5 1 1.5 2 2.5 3 3.5 1/50 1/100 1/200 1/400 1/8001/16001/32001/64001/12800 1/25600001/51200001/10240000 Titrasi serum OD R antiCatL sera R NS
Gambar 4c. Titrasi anti-ES poliklonal ayam
0 0.5 1 1.5 2 2.5 3 3.5 1/50 1/100 1/200 1/400 1/8001/16001/32001/64001/12800 1/25600001/51200001/10240000 OD chick antiES chick NS
Gambar 4d. Titrasi anti-rCatlL poliklonal ayam 0 0.5 1 1.5 2 2.5 3 3.5 1/50 1/100 1/200 1/400 1/8001/16001/32001/64001/12800 1/25600001/51200001/10240000 Titrasi kuning telur
OD
chick anti-CatL chick NS
Gambar 5a. Titrasi antibodi monoklonal A dan B terhadap ES antigen
Gambar 5b. Titrasi antibodi monoklonal C dan D terhadap ES antigen 0 0.5 1 1.5 2 2.5 3 1:50 1/100 1/200 1/400 1/8001/16001/32001/64001/128001/256001/51200 1/102400 Titrasi Mab OD Mab A+ES Mab A-ES Mab B+ES Mab B-ES 0 0.5 1 1.5 2 2.5 3 1:50 1/1001/20 0 1/40 0 1/80 0 1/160 0 1/320 0 1/640 0 1/1280 0 1/2560 0 1/5120 0 1/10240 0 Titrasi mab OD Mab C+ES Mab C-ES Mab D+ES Mab D-ES
Gambar 6a. Titrasi antibodi monoklonal A dan B terhadap rCatL antigen
Gambar 6b. Titrasi antibodi monoklonal C dan D terhadap rCatL antigen
Gambar 7. Titrasi antibodi monoklonal biotin
0 0.5 1 1.5 2 2.5 3 1:50 1/100 1/200 1/400 1/8001/16001/32001/64001/128001/256001/51200 1/102400 Dilution of Mab OD Mab A+catL Mab A-catL Mab B+catL Mab B-catL 0 0.5 1 1.5 2 2.5 3 1:50 1/100 1/200 1/400 1/8001/16001/32001/64001/128001/256001/51200 1/102400 Dilution of Mab OD Mab C+catL Mab C-catL Mab D+catL Mab D-catL 0 0.2 0.4 0.6 0.8 1 1/50 1/100 1/200 1/400 1/8001/16001/32001/64001/128001/256001/51200 1/102400 Dilution of Mabs OD MabA+ES MabA+CatL MabC+ES MabC+CatL MabD+ES MabD+CatL
Tabel 1 . Hasil standarisasi capture ELISA dengan antibodi monoklonal
Antibodi Monoklonal biotin
C D Capture Mabs Pengenceran 1:400 1:800 1:1600 1:400 1:800 1:1600 A 1:400 1:800 1:1600 1:3200 +++ +++ ++ + +++ +++ ++ + +++ ++ ++ + ++ ++ ++ + ++ ++ ++ + ++ ++ ++ + A D C 1:400 1:800 1:1600 1:3200 ++ ++ + + ++ ++ + + ++ ++ + + ++ + + + ++ + + + ++ + + + A C D 1:400 1:800 1:1600 1:3200 ++ + + + ++ + + + ++ + + + ++ ++ + + ++ ++ + + ++ ++ + + +++ = bagus (deteksi antigen 0.62 µg/ml)
++ = sedang (deteksi 1.25-2.5 µg/ml) + = tidak bagus (deteksi > 5 µg/ml)
Gambar 8. Standarisasi capture ELISA dengan antibodi monoklonal terhadap ES antigen Capture ELISA (Mab A sebagai capture,
deteksi dengan Mab C biotin)
0 0.5 1 1.5 2 2.5 3 10 5 2.5 1.25 0.62 0.31 0.15 0
Pengenceran antigen (ug/ml)
Gambar 9. Standarisasi capture ELISA pada feses dan serum negatif
Gambar 10. Jumlah dan panjang cacing hati
Tabel 2. Nilai cut-off capture ELISA Gr up Nomor hewan OD Rata-rata OD + sd 1 1-10 0.09, 0.12, 0.14, 0.1, 0.2, 0.08, 0.1, 0.11, 0.1, 0.12 0.116 ± 0.034 2 11-20 0.13, 0.18, 0.23, 0.1, 0.15, 0.12, 0.09, 0.12, 0.09, 0.1 0.13 ± 0.045 3 21-32 0.16, 0.1, 0.14, 0.15, 0.12, 0.12, 0.12, 0.13, 0.1, 0.12, 0.17, 0.1 0.1275 ± 0.0234 Nilai rata-rata OD semua hewan = 0,12 ± 0,03 ; nilai cut-off = 0,12 x (3x0,03) = 0,21
0 0.5 1 1.5 2 2.5 3 50 12.5 3.13 0.79 0.2 0.05 0.013 Pengenceran antigen ug/ml
OD Feses+ES Feses+CatL Serum+ES Serum+CatL 0 50 100 150 200 250 300 350 400 450 1 6 11 16 21 26 31 36 41 46
Rata-rata panjang cacing (mm)
Tabel 3. Jumlah sapi yang positif (OD>0.21) dan negatif (OD<0.21) terhadap antigen F. gigantica dalam feses berdasarkan uji capture ELISA
Ag ELISA Fluke positif Fluke negatif Total
Positif 87 5 92
Negatif 5 53 58
Total 92 58 150
Sensitifitas : 87/92 x 100 % = 95 % Spesifisitas : 53/58 x 100 % = 91 %
Tabel 4. Hasil pemeriksaan telur cacing F. gigantica dalam feses sapi RPH
Fluke positif Fluke negatif Total Positif telur
F. gigantica 80 0 80 (53,7%)
Negatif telur
F. gigantica 12 58 70
Total 92 (61,3%) 58 150
Tabel 5. Jumlah sapi yang positif (OD>0.38) dan negatif (OD<0.38) antibodi ELISA
Ab ELISA Fluke positif Fluke negatif Total
Positif 84 7 91
Negatif 8 51 59 Total 92 58 150 Sensitifitas : 84/92 x 100 %= 91 % Spesifisitas : 51/58 x 100 % = 88 %
Gambar 11. Korelasi antara antigen dalam feses dengan jumlah cacing dalam hati
y = 0.0016x + 0.3638 R2 = 0.2426 0 0.5 1 1.5 2 1 51 101 151 201 251 301 351 401 451
Jumlah cacing hati
Gambar 12. Korelasi antara antibodi dalam serum dengan jumlah cacing dalam hati
Gambar 13. Persentase sapi yang positif antigen F. gigantica dalam feses di Kabupaten Bantul dan Kulon
Progo
Gambar 14. Persentase sapi yang positif telur F. gigantica di Kabupaten Bantul dan Kulon Progo y = 0.0005x + 0.6093 R2 = 0.0174 0 0.5 1 1.5 2 1 51 101 151 201 251 301 351 401 451
Jumlah cacing hati
Ant ibodi a b s o rbe n OD ) 0 20 40 60 80 100 Augu st Sept Oc t Dec Jan Feb Marc h April/ May June July Waktu pengambilan % p o sitif a n ti g en E L IS A Bantul Kulon Progo 0 20 40 60 80 100
August Sept Oct Dec Jan Feb March
April/May June July Waktu pengambilan % positif telur Bantul Kulon Progo
Gambar 15. Persentase sapi (berdasarkan jenis) yang positif antigen F. gigantica dalam feses di Kabupaten Bantul
Gambar 16. Persentase sapi (berdasarkan jenis) yang positif antigen F. gigantica dalam feses di Kabupaten Kulon Progo 0 20 40 60 80 100
August Sept Oct Dec Jan FebMarchApril/May June July Time of collection
% of positive antigen ELIS
A Ongole Simental Limosin 0 20 40 60 80 100
August Sept Oct Dec Jan Feb March April/May
June July Time of collection
% of positive antigen ELIS
A
Ongole Simental Limosin
Gambar 17. Respon antigen dalam feses pada domba yang diinfeksi F. gigantica
Gambar 18. Respon antibodi dalam serum pada domba yang diinfeksi F. gigantica
DAFTAR PUSTAKA
Anonymous, 1990. Data ekonomi akibat penyakit. Direktorat jenderal Peternakan, Jakarta.
Abdel-Rahman, S.M., K.L. O’Reilly and J.B. Malone (1998). Evaluation of diagnostic monoclonal antibody-based capture enzyme-linked immunosorbent assay for detection of a 26-to 28-kd Fasciola hepatica coproantigen in cattle. Am.J. for Vet. Res., 59(5):533-537
0 0.5 1 1.5 2 2.5 3 Wk 0 Wk 1 Wk 2 Wk 3 Wk 4 Wk 5 Wk 6 Wk 7 Wk 8 Wk 9 Wk 10 Wk 11 Wk 12 Wk 13 Wk 14 Wk 15 Wk 16 Wk 17 Wk 18 Wk 19 Wk 20 Wk 21 Wk 22
Weeks after challenge
OD 40 41 43 44 45 47 48 ctrl1 ctrl2 Treated 0 0.5 1 1.5 2 2.5 3 Wk 0 Wk 1 Wk 2 Wk 3 Wk 4 Wk 5 Wk 6 Wk 7 Wk 8 Wk 9 Wk 10 Wk 11 Wk 12 Wk 13 Wk 14 Wk 15 Wk 16 Wk 17 Wk 18 Wk 19 Wk 20 Wk 21 Wk 22
Weeks after challenge
OD
40 41 43 44 45 47 48 ctrl1 ctrl2
Boray, J.C. 1985. Flukes of domestic animals. In:Gaafar, S.M., Howard, W.E. and Marsh, R.E. (Eds), Parasites, Pests and Predators. Elsevier, New York, pp. 179-218
Domenigo, B.E., Espino, A.M. and C.M.Finlay (1996). Detection of Fasciola hepatica antigen in cattle faeces by a monoclonal antibody-based sandwich immunoassay. Res. Vet. Sci., 60:278-279
Edney, J.M. and A. Muchlis (1962). Fascioliasis In Indonesian Livestock. Com.Vet., 6:49-52
Espino, A.M., R. Marcet and C.M. Finlay (1990). Detection of circulating excretory-secretory antigens in human fascioliasis by sandwich linked immonosorbent assay. J. of Clin. Microb., 28:2637-2640 Espino, A.M. and C.M. Finlay (1994). Sandwich enzyme-linked immunosorbent assay for detection of
excretory-secretory antigens in humans with fascioliasis. J. Clin. Microbiol., 32:190-193
Fagbemi, B.O., I.O. Obarisiagbon and J.V. Mbuh. 1995. Detection of circulating antigen in sera of Fasciola gigantica infected cattle with antibodies reactive with a Fasciola-specific 88-kDa antigen. Vet. Parasitol., 58:235-246
Fagbemi, B.O. and E.E. Guobadia 1995. Immunodiagnosis of fasciolosis in ruminant using a 28-kDa cysteine protease of Fasciola gigantica adult worms. Vet. Parasitol., 57:309-318
Hillyer, G.M., M. Soler DeGalanes, J. Rodriguez-Perez, J. Bjorland, M.S. DeLagrava, S.R. Guzman and R.T. Bryan. 1992. Use of the falcon assay screening test-enzyme-linked immunosorbent assay (FAST-ELISA) and the enzyme-linked immonoelectrotransfer blot (EITB) to determine the prevalence of human of fascioliasis in the Bolivian Altiplano. Am. J. Trop. Med. Hyg., 46:603-609 Hillyer, G.V. 1993. Serological diagnosis of Fasciola hepatica. Parasitol. al dia, 17:130-136
Ibarra, F., N. Montenegro, Y. Vera, C. Boulard, H. Quiroz, J. Flores and P. Ochoa. 1998. Comparison of three ELISA tests for sero-epidemiology of bovine fasciolosis. Vet. Parasitol., 77:229-236
Marin, M.S. 1992. Epizootiologia de la fasciolosis bovine Asturias Identification y expresion de un antigeno unitario. Tesis Doctoral. Facultat de Biologia, Universidad de Oviedo
Suhardono, S. Widjajanti, P. Stevenson and I.H. Carmichael 1991. Control of Fasciola gigantica with triclabendazole in Indonesian cattle. Trop. Anim. Health and Production, 23:217-220
Wiedosari, E., H. Hayakawa and B. Copeman. 1999. Response of Buffalo, Ongole and Bali calves to infection with 15 metacercariae of Fasciola gigantica twice weekly for 32 weeks. Second Annual Fasciolosis control coordination meeting. Davao, Southern Mindanao
Wijfferls, G.L., L. Salvator, M. Dosen, J. Waddington, L. Wilson, C. Thompson, N. Campbell., J. Sexton., J. Wicker, F. Bowen, T. Friedel and T.W. Spithill. 1994. Vaccination of sheep with purified cystein proteinases of Fasciola hepatica decreases worm fecundity. Exp. Parasitol., 78:132-148