RESPONS PERTAHANAN MUKOSA USUS HALUS AYAM PETELUR YANG DIIMUNISASI DENGAN PROTEASE DAN DITANTANG
DENGAN DOSIS 1000 L2Ascaridia galli
ABSTRAK
Mekanisme pertahanan usus halus terhadap nematoda parasitik berhubungan erat dengan peningkatan jumlah sel eosinofil, sel goblet, dan sel mast mukosa. Tujuan penelitian ini adalah untuk mengetahui respons pertahanan mukosa usus halus berdasarkan jumlah sel goblet, sel mast, dan sel eosinofil pada duodenum, jejunum, dan ileum ayam petelur yang diimunisasi dengan protease serin dari ekskretori/sekretori L3 A. galli. Protease serin dimurnikan dengan teknik kromatografi filtrasi gel. Ayam diimunisasi dengan dosis 80 µg (protease serin dengan aktivitas enzim 0,0098 U/ml pada crude dan 0,877 U/ml pada pure) yang dicampur dengan Fruend Adjuvant Complete. Imunisasi diulang tiga kali dengan dosis 60 µg (dengan aktivitas enzim sebesar 0,0074 U/ml pada crude dan 0,657 U/ml pada pure) protease serin yang dicampur dengan Freund Adjuvant Incomplete dalam interval waktu satu minggu secara intra muskular. Satu minggu kemudian, ayam ditantang dengan dosis 1000 L2 A. galli, dan dinekropsi dua minggu pascatantang. Respons sel eosinofil, sel goblet dan sel mast mukosa diamati dan dihitung jumlahnya pada usus halus ayam petelur. Larva A. galli yang ditemukan di dalam usus halus dihitung jumlahnya. Hasil penelitian menunjukkan bahwa imunisasi dapat meningkatkan jumlah sel goblet, sel mast, dan sel eosinofil secara signifikan (P < 0,05). Imunisasi dapat menurunkan secara signifikan jumlah larva yang bertahan di dalam usus halus ayam petelur. Protease serin dapat memicu pertahanan mukosa terhadap penyakit parasitik yang disebabkan oleh A. galli.
Kata kunci: Ascaridia galli, protease, sel goblet, sel mast, sel eosinofil
ABSTRACT
Intestinal defense mechanism against parasitic nematode has been shown previously to be associated with increased number of eosinophil, goblet, and mucosal mast cells. The aim of this research was to examine the effect of serine protease released by L3 of A. galli to trigger mucosal responses based on proliferation goblet, mast cells, eosinophil in laying hens. Serine protease purified using gel filtration chromatography. The chickens immunized with 80 µg (with enzyme activity 0,0098 U/ml in crude and 0,877 U/ml in pure) mixed with Fruend Adjuvant Complete and repeated three times with dose of each 60 µg (with enzymeactivity 0,0074 U/ml in crude and 0,657 U/ml in pure of each immunization) protease of A. galli L3 mixed with Freund Adjuvant Incomplete with an interval of one week intra muscularly. The chickens were challenged with 6000 L2 one week later. Eosinofil, goblet and mucosal mast cells response were observed and counted in intestine of laying. A. galli larvae recovered from intestines were counted. The result showed that immunization was able to increased significantly goblet, mast and eosinophil cells. A. galli larvae recovered in intestinal of immunized laying hens were decreased significantly. This research concluded that the serine protease could trigger mucosal responses against parasitic diseases caused by A. galli. Key words: Ascaridia galli, protease, eosinophil, goblet, mast cells
PENDAHULUAN
Pelepasan protease oleh cacing nematoda parasitik mempunyai peranan penting pada proses reaksi biologik seperti metabolisme protein, hatching, molting, patogenesis, dan respons imun. Aktivitas protease mempunyai korelasi yang signifikan pada saat cacing parasitik menjalani penetrasi ke jaringan seperti Ascaris suum pada babi (Rhoads et al. 1997), Ostertagia ostertagi pada sapi (Cock et al. 1993), Ostertagia circumcincta, Haemonchus contortus, Trichostrongylus spp. pada ruminansia (Knox dan Jones 1990), Onchocerca gipsoni pada sapi (Harnett et al. 1997), Trichinella spiralis pada mamalia dan manusia (Todorova 2000), dan Anisakis simplex pada ikan (Iglesias et al. 2005), Onchocerca volvulus pada manusia (Ford et al. 2005).
Invasi cacing nematoda parasitik ke jaringan dapat memicu host-parasite interaction. Respons imunitas selaput lendir mukosa saluran cerna inang definitif terhadap infeksi cacing nematoda dibangkitkan oleh antigen cacing tersebut (Tizard 1996). Vervelde et al. (2003) melaporkan bahwa antigen ekskretori/sekretori dapat memicu peningkatan respons sel T helper 2 (Th-2). Reaksi sel Th-2 dapat menggertak pelepasan sitokin terutama interleukin (IL-3, IL-4 dan IL-5). Menurut Tizard (1996) bahwa IL-3 merangsang mastopoiesis berdegranulasi untuk melepaskan mediator peradangan, senyawa vasoaktif dan kemoatraktan yang berfungsi untuk merekrut sel eosinofil. IL-5 merangsang aktivasi sel eosinofil untuk melepaskan mediator kimia seperti enzim hidrolitik dan zat sitotoksik. Aktivasi sitokin yang dilepaskan oleh sel T yaitu Th-2 merangsang proliferasi dan hiperplasia sel goblet dan pelepasan mukus yang bersifat viscoelastic gel. Sel goblet berbentuk seperti piala yang terletak diantara sel absorbtif saluran cerna. Sel goblet menurut McKeand et al (1995) mensintesis granula-granula yang bersifat netral yang mengandung musin glikoprotein dan asam sialat. Proliferasi sel goblet memberi perlindungan permukaan usus halus dari ancaman invasi A. galli (Balqis et al. 2007), dan menurut Nawa et al. (1994) mukus yang dilepaskan oleh sel goblet membatasi gerakan cacing dengan cara menutupi kutikulanya sehingga tidak mampu mengadakan perlekatan pada mukosa usus dan dengan bantuan peristaltik usus akan dikeluarkan bersama tinja.
Mekanisme pengeluaran cacing dari dalam tubuh dijelaskan oleh Roitt dan Delves (2001) bahwa kutikula cacing nematoda Nipprostrongylus brasiliensis dirusak oleh antibodi yang disekresikan ke dalam lumen intestinal tikus. Cacing dijerat melalui fragment antibodi (Fab), sedangkan fragment constant (Fc) antibodi tertanam ke dalam reseptor FcєRI yang terdapat pada permukaan sel mast mukosa saluran pencernaan dan sel eosinofil. Transduksi sinyal dari rantai γ pada reseptor FcєRI menyebabkan degranulasi sel mast mukosa untuk melepaskan senyawa faktor kemotaktik, faktor vasoaktif, histamin dan serotinin. Histamin memicu kontraksi otot pada usus halus, dan serotonin menyebabkan vasokontriksi sehingga meningkatkan tekanan darah. Kontraksi usus halus dan sel eosinofil melepaskan major basic protein yang bersifat helmintoksik sehingga cacing dapat dikeluarkan melalui self cure reaction. Tujuan penelitian ini adalah untuk mengetahui respons pertahanan mukosa usus halus berdasarkan proliferasi dan hiperplasia sel goblet dan sel mast mukosa serta reaksi sel eosinofil pada duodenum, jejunum, dan ileum ayam petelur yang diimunisasi dengan protease serin dari ekskretori/sekretori L3 A. galli.
METODE PENELITIAN
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Patologi Departemen Klinik Patologi dan Reproduksi, Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Waktu Penelitian berlangsung 9 bulan dari bulan Desember 2006 sampai dengan bulan Juni 2007.
Rancangan Penelitian
Sepuluh hari sebelum imunisasi aktif masing-masing ayam dipastikan bebas dari infeksi cacing melalui pemeriksaan telur tiap gram tinja. Ayam dipelihara secara individual dalam kandang baterei yang diberi pakan komersial dan air minum secara ad libitum. Delapan belas ekor ayam HySex Brown berumur 12 minggu digunakan sebagai
ayam percobaan yang dibagi menjadi enam kelompok, masing-masing kelompok terdiri dari tiga ekor ayam. Kelompok 1 adalah sebagai kelompok kontrol, ayam tidak disuntikkan dengan enzim (imunisasi) dan tidak diinfeksi dengan L2 A. galli. Kelompok 2 adalah ayam yang diimunisasi dengan crude ekskretori/sekretori. Kelompok 3 adalah ayam yang diimunisasi dengan pure serin protease. Kelompok 4 adalah ayam yang diimunisasi dengan crude ekskretori/sekretori L3 A. galli dan diinfeksi dengan dosis 1000 L2 A. galli. Kelompok 5 adalah ayam yang diimunisasi dengan pure serin protease dan diinfeksi dengan dosis 1000 L2 A. galli. Kelompok 6 adalah ayam yang diinfeksi dengan dosis 1000 L2 A. galli. Semua ayam percobaan dinekropsi pada minggu ke-2 pascainfeksi. Pertahanan selaput lendir mukosa saluran cerna ayam diamati dengan cara melihat reaksi proliferasi dan hiperplasia sel goblet, sel mast mukosa, dan sel eosinofil pada sediaan histologi dari duodenum, jejunum, dan ileum semua kelompok ayam percobaan. Populasi larva A. galli yang ditemukan di dalam usus halus ayam petelur kelompok 4, 5, dan 6 dihitung jumlahnya.
Teknik Imunisasi dan Infeksi pada Ayam Percobaan
Imunisasi dilakukan empat kali secara intramuskular dalam interval waktu satu minggu setiap kali imunisasi. Teknik yang digunakan adalah suntikan pertama 80 µg dengan aktivitas enzim sebesar 0,0098 U/ml pada crude dan 0,877 U/ml pada pure dalam emulsi antigen plus Freund’s Complete Adjuvant (FCA) yang diikuti dengan tiga kali suntikan booster (60 µg dengan aktivitas enzim sebesar 0,0074 U/ml pada crude dan 0,657 U/ml pada pure setiap kali imunisasi) dalam emulsi antigen plus Incomplete Freund’s Adjuvant (IFA) (Camenisch et al. 1999 dan Carlander 2002). Dosis 1000 L2 A. galli diinfeksikan langsung ke dalam oesofagus ayam pada minggu ke-5 pascaimunisasi.
Pembuatan Sediaan Histologi
Pembuatan sedian preparat histologi dilakukan dengan mengambil sampel usus sepanjang 2 cm dari duodenum, jejunum, dan ileum dan difiksasi dalam Bufer Normal Formalin 10%. Jaringan usus tersebut kemudian didehidrasi melalui etanol dengan kadar bertingkat, dijernihkan dalam xylol, diblok dalam parafin dan dipotong setebal 5 µm.
Respons Pertahanan Mukosa Usus Halus Ayam Petelur
Respons pertahanan mukosa usus halus ayam petelur dievaluasi berdasarkan proliferasi dan hiperplasia sel goblet, sel mast mukosa, dan invasi sel eosinofil ke jaringan mukosa melalui sediaan histologi duodenum, jejunum, dan ileum. Sediaan sel goblet diwarnai dengan pewarnaan khusus Periodic Acid (PAS). Jumlah sel goblet dihitung per 1000 sel-sel absorbtif pada villi. Sediaan sel mast mukosa diwarnai dengan pewarnaan Alcian blue (pH 0,3) dan Safranin-O (pH 0,1). Jumlah sel mast mukosa dihitung pada 10 vilus crypt units (VCU) (Miller dan Nawa 1979). Sediaan sel eosinofil diwarnai dengan pewarnaan Hematoxylin Eosin (HE). Rata-rata sel eosinofil dihitung pada bagian lamina propria mukosa pada 10 lapang pandang.
Jumlah Larva A. galli Pada Usus Halus Ayam Petelur
Tiga kelompok ayam percobaan yang diinfeksi dengan dosis 1000 L2 A. galli (kelompok 4, 5, dan 6) dipotong dan dinekropsi pada minggu ke-2 pascainfeksi. Usus halus diambil dan dipotong pada masing-masing bagian duodenum, jejunum, dan ileum serta dibuka secara longitudinal. Isi usus dan mukosa disaring dengan kain kasa di atas gelas Bermann yang berisi NaCl fisiologis. Satu jam kemudian, larva yang tenggelam ke dasar gelas diambil dan dihitung jumlahnya di bawah mikroskop stereo.
Analisis Data
Data diuji dengan analisis sidik ragam. Apabila terdapat perbedaan, dilanjutkan dengan uji wilayah berganda Duncan (Steel dan Torrie 1999).
HASIL PENELITIAN
Respons Sel Goblet Pada Usus Halus Ayam Petelur
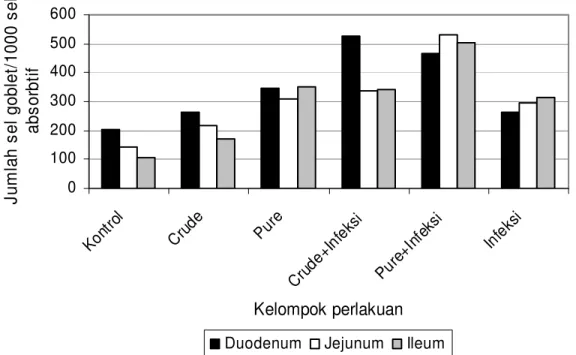
Hasil penelitian ini menunjukkan bahwa peningkatan jumlah sel goblet pada duodenum dan jejunum ayam yang diimunisasi dengan crude ekskretori/sekretori L3 A. galli tidak berbeda secara signifikan (P > 0,05) dengan kelompok kontrol, perbedaan
signifikan (P < 0,05) terjadi pada bagian ileum. Selain kelompok ayam yang diimunisasi dengan crude ekskretori/sekretori, perbedaan signifikan proliferasi sel goblet terjadi pada semua kelompok ayam percobaan dibandingkan dengan kelompok kontrol. Namun, proliferasi sel goblet pada duodenum ayam yang hanya diinfeksi dengan dosis 1000 L2 tidak berbeda secara signifikan dibandingkan kelompok kontrol. Proliferasi sel goblet secara signifikan (P < 0,05) terjadi pada duodenum, jejunum, dan ileum ayam yang diimunisasi dengan pure protease serin dan diinfeksi dengan dosis 1000 L2 A. galli dibandingkan dengan jumlah sel goblet ayam yang tidak diimunisasi tetapi diinfeksi dengan dosis 1000 L2 A. galli (Gambar 8).
0 100 200 300 400 500 600 Kont rol Cru de Pure Cru de+I nfek si Pure +Inf eksi Infe ksi Kelompok perlakuan J u m la h s e l g o b le t/ 1 0 0 0 s e l a b s o rb ti f
Duodenum Jejunum Ileum
Gambar 8. Jumlah sel goblet pada 1000 sel absorbtif usus halus
Respons Sel Mast Mukosa Pada Usus Halus Ayam Petelur
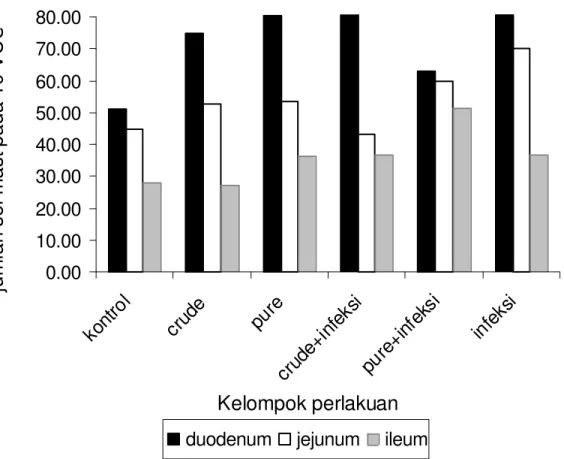
Hasil penghitungan sel mast mukosa menunjukkan bahwa peningkatan signifikan (P < 0,05) jumlah sel mast mukosa duodenum terjadi pada semua kelompok perlakuan dibandingkan dengan kelompok kontrol. Kecuali pada kelompok 4 (kelompok ayam yang diimunisasi dengan crude ekskretori/sekretori dan ditantang dengan dosis 1000 L2
A. galli), sel mast mukosa jejunum meningkat pada kelompok lainnya dibanding kelompok kontrol. Jumlah sel mast mukosa ileum pada kelompok 5 (kelompok ayam yang diimunisasi dengan pure protease serin dan ditantang dengan dosis 1000 L2 A. galli) berbeda secara signifikan (P < 0,05) dengan kelompok kontrol tetapi tidak menunjukkan perbedaan signifikan (P > 0,05) dengan kelompok perlakuan lainnya. Hasil uji statistik menunjukkan bahwa peningkatan jumlah sel mast mukosa (P < 0,05) terjadi pada tiap-tiap bagian usus halus pada semua kelompk perlakuan. Hasil penelitian ini menunjukkan bahwa protease serin yang dihasilkan oleh L3 A. galli dapat memicu proliferasi dan hiperplasia sel mast pada bagian duodenum dan jejunum usus halus ayam petelur. Hasil penghitungan jumlah sel mast mukosa pada masing-masing bagian usus halus ayam petelur disajikan pada Gambar 9. Proliferasi sel goblet dan sel mast mukosa masing-masing ditunjukkan pada Gambar 10 dan 11.
0.00 10.00 20.00 30.00 40.00 50.00 60.00 70.00 80.00 kont rol crud e pure crud e+in feks i pure +inf eksi infe ksi
Kelompok perlakuan
ju
m
la
h
s
e
l
m
a
s
t
p
a
d
a
1
0
V
C
U
duodenum jejunum ileum
Respons Sel Eosinofil Pada Usus Halus Ayam Petelur
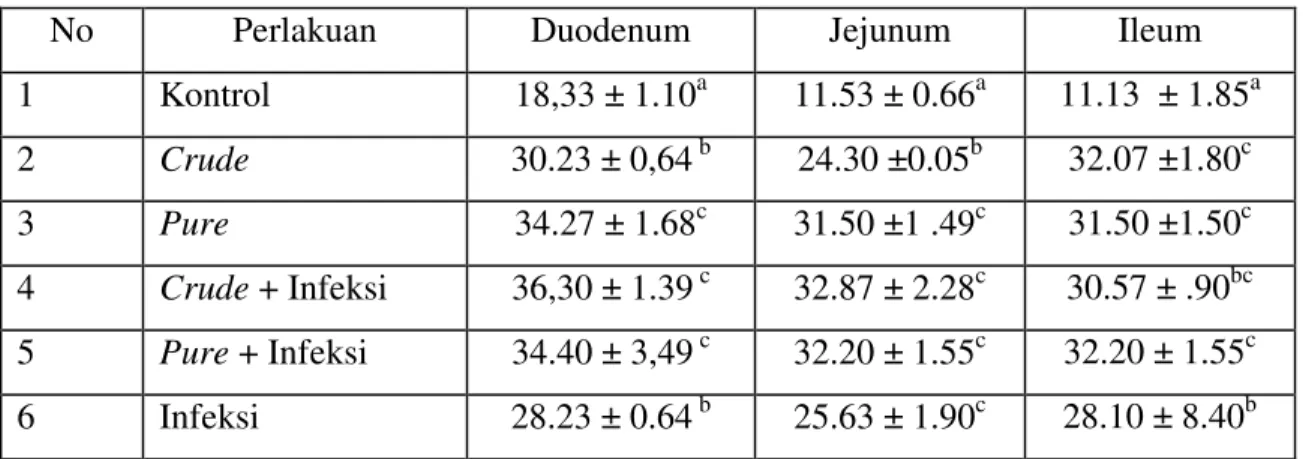
Hasil penghitungan jumlah sel eosinofil pada masing-masing bagian usus halus ayam petelur disajikan pada Tabel 5. Hasil pemerikasaan menunjukkan bahwa sel eosinofil ditemukan pada semua bagian usus dari semua kelompok ayam percobaan. Peningkatan invasi sel eosinofil ke jaringan duodenum kelompok 4 (ayam yang diimunisasi dengan crude protease serin dan ditantang dengan dosis 1000 L2) terjadi signifikan (P < 0,05) dibandingkan dengan kelompok kontrol dan kelompok ayam yang diimunisasi dengan crude ekskretori/sekretori. Pada jejunum, peningkatan invasi sel eosinofil kelompok ayam yang diimunisasi dengan crude dan kelompok ayam yang ditantang dosis 1000 L2 berbeda signifikan (P < 0,05) dibandingkan dengan kelompok ayam kontrol dan kelompok ayam yang diinfeksi dosis 1000 L2 A. galli. Peningkatan invasi sel eosinofil terjadi pada semua ileum kelompok ayam percobaan dibandingkan dengan kelompok kontrol, tetapi secara statistik tidak berbeda signifikan (P > 0,05).
Tabel 5. Jumlah sel eosinofil pada 10 lapang pandang
No Perlakuan Duodenum Jejunum Ileum
1 Kontrol 18,33 ± 1.10a 11.53 ± 0.66a 11.13 ± 1.85a 2 Crude 30.23 ± 0,64 b 24.30 ±0.05b 32.07 ±1.80c 3 Pure 34.27 ± 1.68c 31.50 ±1 .49c 31.50 ±1.50c 4 Crude + Infeksi 36,30 ± 1.39 c 32.87 ± 2.28c 30.57 ± .90bc 5 Pure + Infeksi 34.40 ± 3,49 c 32.20 ± 1.55c 32.20 ± 1.55c 6 Infeksi 28.23 ± 0.64 b 25.63 ± 1.90c 28.10 ± 8.40b Superskrip yang berbeda pada kolom yang sama menunjukkan pengaruh yang signifikan
Jumlah Larva A. galli Pada Usus Halus Ayam Petelur
Jumlah larva L3 dari kelompok ayam yang telah diimunisasi dengan protease baik dalam bentuk crude ataupun pure menunjukkan penurunan jumlah yang signifikan (P < 0,05) bila dibandingkan dengan kelompok kontrol yang tidak diimunisasi dengan protease. Perbedaan yang signifikan terjadi pada duodenum, jejunum, dan ileum antara kelompok ayam yang terlebih dahulu diimunisasi sebelum diinfeksi dengan dosis 1000
L2 A. galli dibandingkan dengan kelompok ayam yang hanya diinfeksi dosis 1000 L2 A. galli. Hasil penghitungan jumlah L3 A. galli pada duodenum, jejunum, dan ileum ayam petelur disajikan pada Tabel 6.
Tabel 6. Jumlah L3 yang ditemukan dalam usus halus setelah dua minggu infeksi
No Perlakuan Duodenum Jejunum Ileum
4 Crude + Infeksi 7,00 ± 2,00b 11,67 ± 4,16b 13.67± 3,51b 5 Pure + Infeksi 8,33 ± 3,21b 12,00 ± 3,61b 12,33 ± 2,52b 6 Infeksi 125,33 ± 6,51a 134,33 ± 7,57a 155,67 ± 4,73 a Superskrip yang berbeda pada kolom yang sama menunjukkan pengaruh yang signifikan
PEMBAHASAN
Peningkatan jumlah sel goblet ditemukan pada duodenum, jejunum, dan ileum dari kelompok ayam yang diimunisasi dengan crude ekskretori/sekretori atau pure protease L3 A. galli dan atau ayam yang diinfeksi dengan dosis 1000 L2 A. galli seperti yang disajikan pada Gambar 8. Sel goblet dihasilkan secara terus menerus pada individu yang terinfeksi pada gastrointestinal (Miller dan Nawa 1979; Douch et al. 1996; Klei 1997; Tiuria et al. 2001; Deplancke dan Gaskins 2001; dan Balqis et al. 2007). Proliferasi sel goblet berperan dalam mekanisme pengeluaran larva A. galli dengan cara mensekresikan, menyimpan, dan melepaskan musin ke dalam lumen untuk menambah kapasitas lendir sehingga larva dengan cepat dapat dikeluarkan dari tubuh inang definitif (Athaillah 1999; Tiuria et al. 2001; dan Balqis 2004).
Imunisasi yang dilakukan pada penelitian ini dapat meningkatkan pertahanan selaput lendir mukosa usus halus ayam petelur yang ditandai dengan proliferasi sel goblet. Musin yang dihasilkan sel goblet secara berkesinambungan menghasilkan lendir yang mampu menjerat larva A. galli dan dengan gerakan peristaltik usus akan dikeluarkan dari saluran cerna ayam petelur. Musin yang dihasilkan oleh sel goblet dilaporkan berperan sebagai barrier pertahanan fisik dan non-spesifik terhadap invasi
larva. Proliferasi dan hiperplasia sel goblet intestinal pada nematodosis berimplikasi terhadap kuantitas musin yang disalurkan ke dalam lumen intestinal. Musin sel goblet dengan konsentrasi garam-garam sulfat yang lebih banyak dapat berperan pada pengeluaran larva secara cepat (Roitt dan Delves 2001).
Gambaran yang diperoleh dari penelitian ini mendukung hasil penelitian terdahulu (Miller dan Nawa 1979) bahwa mekanisme pengeluaran larva N. brasiliensis secara cepat terjadi karena kolaborasi antara sel mast dengan sel goblet. Selanjutnya Khan et al (1993) juga mengatakan bahwa pengeluaran cacing genus Strongyloides dewasa dipengaruhi oleh sel mast. Abe et al. (1992) melaporkan bahwa protease produk dari ekskretori/sekretori cacing nematoda dewasa Strongyloides ratti secara in vitro dapat merangsang sel limfosit T dari sel-sel limfonodus mesenterik tikus untuk menghasilkan limfokin. Limfokin yang dihasilkan adalah IL-3 yang dapat memicu proliferasi sel mast mukosa intestinal dari differensiasi sel progenitor. Hasil penelitian Nawa et al (1994) juga membuktikan bahwa sel mast merupakan sel efektor dalam mekanisme pertahanan selaput lendir, sel mast berhubungan dengan keluarnya cacing dewasa, dan sangat tergantung pada jenis parasit dan inang percobaan yang digunakan.
Peningkatan jumlah sel mast ditemukan pada duodenum dari kelompok ayam yang diimunisasi dengan crude ekskretori/sekretori atau pure protease L3 A. galli dan atau ayam yang diinfeksi dengan dosis 1000 L2 A. galli seperti yang disajikan pada Gambar 9. Seperti halnya sel goblet, sel mast juga berperan terhadap infeksi cacing. Sel mast mukosa berdegranulasi melepaskan histamin, serotonin, yang berfungsi sebagai mediator inflamasi (Kanwar et al. 1998). Granul sel mast juga mengandung kallikrein yang menghasilkan kinin, bersama dengan mediator inflamasi mempunyai kekuatan sebagai agen vasoaktif (Tizard 1996). Substansi tersebut akan dilepaskan pada kutikula cacing nematoda apabila antibodi telah berikatan dengan antigen. Kolaborasi antigen, antibodi, dan substansi granula sel eosinofil dan sel mast mukosa akan menimbulkan respons inflamasi tipe I untuk menghambat invasi cacing ke jaringan (Kraneveld et al. 1998).
Peningkatan sel mast mukosa adalah sebagai indikasi bahwa baik ekskretori/sekretori maupun L2 dapat memicu mastositosis pada duodenum yang sangat
diperlukan untuk membantu proses pengeluaran larva secara cepat keluar tubuh ayam. Uji tantang menyebabkan peningkatan jumlah sel mast mukosa paling tinggi dibandingkan perlakuan lainnya. Fenomena tersebut menunjukkan bahwa ekskretori/sekretori asal cacing dewasa dan L2 A. galli merupakan antigen yang potensial untuk menstimulasi mediator-mediator seperti IL-3 dan IL-4. Apabila sel limfosit Th-2 berinteraksi dengan mediator-mediator tersebut, sel mast mukosa akan berdegranulasi, mengeluarkan histamin dan subtansi lainnya. Senyawa yang dilepaskan sel mast mukosa bekerja secara lokal dan merangsang kontraksi otot daging licin serta menambah permeabilitas vaskuler sehingga memungkinkan pengeluaran sekret ke dalam lumen intestinal (Kanwar et al. 1998).
Kehadirian antigen asal cacing dewasa dapat membangkitkan tanggap kebal Antigen Pesenting Cell (APC). APC mengolah, memfragmentasi, dan menyuguhkan antigen kepermukaan sel bersama-sama dengan molekul Mayor Histocompatibility Complex (MHC). Kompleks antigen dan MHC dapat dikenal oleh reseptor sel Th-2 yang merupakan penghubung APC dengan sel Th-2. APC juga tersensitisasi untuk melepaskan sitokin. IL-1 yang dilepaskankan APC dapat menggertak sel Th-2 untuk melepaskan IL-4 dan IL-5. IL-4 dan IL-5 secara bersama-sama dapat memacu aktivasi sel B untuk produksi imunoglobulin. Baik sel Th-2 maupun sel mast mukosa mampu memproduksi IL-5 yang berperan terhadap rekrutmen sel eosinofil. Aktivasi sel eosinofil dan sel mast mukosa yang diperantarai antibodi menghasilkan serangkaian reaksi hipersensitifitas tipe I berupa eksudasi vaskular, udema mukosa, sekresi mukus, infiltrasi leukosit, dan kerusakan sel-sel epitel (Else dan Finkelman 1998).
Peningkatan jumlah sel eosinofil ditemukan pada duodenum, jejunum, dan ileum dari kelompok ayam yang diimunisasi dengan crude ekskretori/sekretori atau pure protease L3 A. galli dan atau ayam yang diinfeksi dengan dosis 1000 L2 A. galli seperti yang disajikan pada Tabel 5. Mekanisme pertahanan tubuh terhadap infeksi cacing diperankan oleh sel eosinofil dengan reaksi alergik inflamasi. Sel eosinofil mengandung protein granul sitotoksik yang bersifat membunuh larva (Shin et al. 2001). Tizard (1995) mengatakan bahwa cacing nematoda akan mengeluarkan antigen selama ekdisis ketiga
(L3 menjadi L4) yang dapat berperan sebagai “allergens”. Antigen cacing tersebut akan merangsang reaksi hipersensitivitas tipe I lokal yang akut pada bagian jaringan yang mengandung parasit. Kombinasi antara antigen cacing dengan antibodi yang terikat sel mast mukosa menyebabkan terjadinya degranulasi sel mast mukosa dan dilepaskannya amin vasoaktif.
Seperti sel-sel darah lainnya, sel eosinofil berasal dari sel induk hemopoietic pluripotent terutama pada sumsum tulang. Sel eosinofil yang dibentuk di dalam sumsum tulang didesain oleh colony forming unit-eosinophil (CFU-Eos). Deferensiasi CFU-Eos dipengaruhi oleh eosinophil-colony stimulating factor (Eo-CSF). Limfosit yang terstimulasi oleh antigen merupakan sumber utama Eo-CSF, disamping sistem fagosit mononuklear. Pertumbuhan sel eosinofil banyak dipengaruhi oleh eosinophil-growth stimulating factor (Eo-GSF) yang dapat dipengaruhi oleh limfosit yang terstimulasi oleh antigen (Jain 1986). Pada keadaan normal sel eosinofil terdapat dalam jumlah yang kecil dari komponen leukosit. Eosinofilia darah perifer merupakan karakteristik reaksi sel eosinofil inang definitif terhadap infeksi cacing parasitik. Eosinofilia adalah indikator adanya rangsangan antigen dari parasit cacing. Peningkatan jumlah sel eosinofil di dalam sirkulasi menyebabkan sel eosinofil bermigrasi menembus pembuluh darah melalui sisi endotel dan tertarik ke situs infeksi.
Banyaknya jumlah sel eosinofil yang terbentuk sangat ditentukan oleh rangsangan sel T yang tersensitisasi oleh antigen dalam membangkitkan respons pertahanan untuk kelangsungan proses eosinofoiesis. Reaksi ini menurut Roitt dan Delves (2001) diawali oleh aksi Antigen Presenting Cell (APC) menyuguhkan antigen kepada reseptor sel Th2 sehingga membangkitkan reaksi sel Th2 untuk melepaskan sitokin (IL-5). IL-5 merangsang rekrutmen dan aktivasi sel eosinofil.
Dari hasil penghitungan jumlah larva pada penelitian ini terbukti bahwa imunisasi dapat mengurangi jumlah larva A. galli yang establish di dalam usus halus ayam petelur. Jumlah larva yang ditemukan pada kelompok ayam yang tidak diimunisasi berturut- turut adalah pada duodenum (125,33 ± 6,51), jejunum (134,33 ± 7,57), dan ileum (155,67 ± 4,73). Jumlah larva yang masih bertahan pada kelompok ayam yang
dimunisasi dengan cude atau pure proteinase menurun sangat signifikan (P < 0,05) yaitu berkisar antara 7,00 ± 0,00 sampai 13.67± 3,51 ekor larva (Tabel 6).
Penurunan jumlah larva yang bertahan pada kelompok ayam yang diimunisasi erat kaitannya dengan pertahanan mukosa usus halus. Pada penelitian ini terbukti pertahanan mukosa usus halus ayam yang diimunisasi terbentuk yang ditandai dengan proliferasi dan hiperplasia sel goblet, sel mast mukosa, dan invasi sel eosinofil ke jaringan. Salah satu cara untuk menghambat migrasi larva adalah dengan tanggap kebal pertahanan selaput lendir seperti reaksi hipersensitivitas tipe I yang ditandai dengan reaksi inflamasi. Sel mast mukosa pada mukosa usus halus mampu mengikat antibodi bebas terutama dalam menanggapi antigen asal cacing. Sel mast mukosa mampu melepaskan faktor kemotaksis eosinofil yang akan mengundang sel eosinofil ke jaringan terinfeksi cacing (Shin et al. 2001).
Imunisasi bersifat merangsang pertahanan tubuh ayam yang berimplikasi munculnya kemoatraktan untuk menarik sel eosinofil ke mukosa usus untuk membantu proses fagositosis. Mobilisasi sel eosinofil ke jaringan merupakan usaha pertahanan tubuh ayam untuk destruksi kutikula cacing. Penghancuran secara ekstraseluler merupakan cara terbaik melawan antigen yang lebih besar. Dalam hal ini sel eosinofil merupakan sistem kekebalan yang cocok karena mengandung bermacam mediator kimia seperti enzim hidrolitik dan zat sitotoksik baik di dalam granula maupun sitoplasmanya (Nawa et al. 1994). Musin yang dihasilkan sel goblet merupakan campuran antara air, glikoprotein, glikolipid, elektrolit-elektrolit, enzim, garam, dan sekresi kelenjar (Castagliuolo et al. 1998). Apabila musin sel goblet terlepas ke dalam lumen akan berintegrasi dengan imunoglobulin menghasilkan efek antitoksin pada permukaan mukosa dan epitel saluran pencernaan, sehingga dapat merupakan barrier yang protektif bagi sel-sel epitel usus dari ancaman agen penyakit (Harnett et al. 1997). Selain itu, sel goblet dibutuhkan untuk menjaga kapasitas lendir yang membentuk gel, kental, dan lengket di dalam lumen sehingga membatasi larva berpenetrasi ke jaringan sehingga larva akan mudah didorong ke caudal dan dikeluarkan bersama tinja oleh kontraksi peristaltik saluran cerna.
KESIMPULAN
1. Protease serin yang dilepaskan oleh L3 A. galli dapat memicu respons pertahanan mukosa yang ditandai dengan hiperplasia dan proliferasi sel goblet mukosa usus halus ayam petelur.
2. Pertahanan mukosa saluran cerna dapat mengurangi jumlah larva A. galli di dalam saluran cerna ayam petelur.
Saran
Perlu dilakukan penelitian selanjutnya untuk mengamati pengaruh imunisasi dengan crude atau pure protease serin terhadap perubahan histopatologi usus halus ayam petelur yang disebabkan oleh infeksi A. galli.