AKTIVITAS ANTIBAKTERI EKSTRAK KARANG LUNAK
Sarcophyton sp. YANG DIFRAGMENTASI DAN TIDAK
DIFRAGMENTASI DI PERAIRAN PULAU PRAMUKA,
KEPULAUAN SERIBU
SAFRINA DYAH HARDININGTYAS C34052878
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
2009
RINGKASAN
SAFRINA DYAH HARDININGTYAS. C34052878. Aktivitas Antibakteri Ekstrak Karang Lunak Sarcophyton sp. yang Difragmentasi dan Tidak Difragmentasi di Perairan Pulau Pramuka, Kepulauan Seribu. Dibawah bimbingan TATI NURHAYATI dan MUJIZAT KAWAROE.
Sarcophyton sp. merupakan salah satu jenis karang lunak yang belakangan
ini banyak dikaji kandungan bioakif sebagai bahan baku pembuatan obat-obatan. Beberapa hasil penelitian menunjukkan bahwa ekstrak Sarcophyton sp. banyak mengandung senyawa terpen yang berfungsi sebagai antimikroba, antikanker, antitumor, dan anti-inflammantori. Dewasa ini telah dilakukan usaha fragmentasi karang lunak Sarcohyton sp. ini yang bertujuan untuk menyediakan sumber bioaktif tanpa harus mengambil dari alam dan menjaga keseimbangan ekologi terumbu karang. Tujuan dari penelitian ini adalah untuk memperoleh ekstrak komponen bioaktif sebagai antibakteri dari Sarcophyton sp. yang difragmentasi dan tidak difragmentasi di Perairan Pulau Pramuka, mengetahui konsentrasi penghambatan bakteri yang terendah (MIC), tingkat toksisitas, serta kandungan kimia dari ekstrak Sarcophyton sp. yang difragmentasi dan tidak difragmentasi terpilih.
Penelitian ini dibagi menjadi beberapa tahap, yaitu koleksi dan karakerisasi, ekstraksi komponen bioaktif, uji aktivitas antibakteri, uji Minimum Inhibitory
Concentration (MIC), uji Brine Shrimp Lethality Test (BSLT) serta uji fitokimia.
Ekstraksi karang lunak Sarcophyton sp. yang difragmentasi dan tidak difragmentasi menghasilkan ekstrak kasar berupa ekstrak metanol, ekstrak etil asetat, dan ekstrak heksana. Rendemen ekstrak yang terbesar adalah ekstrak metanol. Ekstrak kasar tersebut diujikan terhadap empat bakteri uji, yaitu E. coli,
S. aureus, P. aeruginosa, dan B. cereus. Ekstrak etil asetat diketahui memiliki
diameter penghambatan yang terbesar dibandingkan dengan ekstrak lain. Ekstrak
Sarcophyton sp. yang tidak difragmentasi memiliki aktivitas antibakteri yang
terbaik karena dapat menghambat semua bakteri uji. Ekstrak etil asetat
Sarcophyton sp. yang tidak difragmentasi mempunyai nilai MIC terbaik pada
bakteri P.aeruginosa sebesar 240 µg/disk, sedangkan nilai MIC terbaik dari ekstrak etil asetat Sarcophyton sp. yang difragmentasi terhadap bakteri S. aureus dan B. cereus adalah sebesar 420 µg/disk.
Ekstrak etil asetat Sarcophyton sp. yang difragmentasi dan tidak difragmentasi terhadap Artemia salina tergolong kategori toksik, dengan nilai LC50 sebesar 149,50 ppm dan 45,15 ppm. Perbedaan aktivitas antibakteri dan tingkat toksisitas dari ekstrak etil asetat Sarcophyton sp. yang difragmentasi dan tidak difragmentasi ini berkaitan dengan kandungan bioaktifnya. Ekstrak etil asetat Sarcophyton sp. yang tidak difragmentasi mengandung senyawa alkaloid, steroid/triterpenoid, dan flavonoid, sedangkan ekstrak etil asetat Sarcophyton sp. yang difragmentasi hanya mengandung senyawa steroid/triterpenoid dan flavonoid.
AKTIVITAS ANTIBAKTERI EKSTRAK KARANG LUNAK
Sarcophyton sp. YANG DIFRAGMENTASI DAN TIDAK
DIFRAGMENTASI DI PERAIRAN PULAU PRAMUKA,
KEPULAUAN SERIBU
Skripsi
Sebagai salah satu syarat memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
SAFRINA DYAH HARDININGTYAS C34052878
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
2009
Judul Skripsi : AKTIVITAS ANTIBAKTERI EKSTRAK KARANG LUNAK Sarcophyton sp. YANG DIFRAGMENTASI DAN TIDAK DIFRAGMENTASI DI PERAIRAN PULAU PRAMUKA, KEPULAUAN SERIBU
Nama : Safrina Dyah Hardiningtyas NRP : C34052878
Menyetujui,
Pembimbing I
Dr. Tati Nurhayati, S.Pi, M.Si NIP. 19700807 1996 032002
Pembimbing II
Dr. Ir. Mujizat Kawaroe, M.Si NIP. 19651213 1994 032002
Mengetahui,
Ketua Departemen Teknologi Hasil Perairan
Dr. Ir. Ruddy Suwandi, MS., M.Phill NIP. 19580511 1985 031002
PERNYATAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi dengan judul “Aktivitas Antibakteri Ekstrak Karang Lunak Sarcophyton sp. yang Difragmentasi dan Tidak Difragmentasi di Perairan Pulau Pramuka, Kepulauan Seribu” adalah karya saya sendiri yang dibiayai sepenuhnya oleh Program Intensif Kementrian Riset dan Teknologi dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Bogor, Desember 2009
Safrina Dyah Hardiningtyas
RIWAYAT HIDUP
Penulis dilahirkan di Bandung, pada tanggal 16 April 1988. Penulis adalah anak pertama dari tiga bersaudara. Penulis memulai pendidikan formal di TK Tunas Harapan lulus tahun 1992, TK Aisyiah 10 Bandung dan lulus tahun 1993, Sekolah Dasar di SDN Gunung Rahayu 2 Bandung lulus pada tahun 1999, Sekolah Menengah Pertama di SLTPN 9 Bandung lulus tahun 2002, dan Sekolah Menengah Atas di SMUN 15 Bandung lulus pada tahun 2005.
Penulis masuk Institut Pertanian Bogor melalui jalur USMI pada tahun 2005. Penulis tercatat sebagai mahasiswa Fakultas Perikanan dan Ilmu Kelautan pada Departemen Teknologi Hasil Perairan dan Minor Teknologi dan Manajemen Lingkungan. Selama menempuh pendidikan penulis aktif di organisasi Perhimpunan Mahasiswa Bandung (2005-2006), Himpunan Mahasiswa Teknologi Hasil Perikanan (2007–2008), dan Fisheries Processing Club (2008-2009). Beberapa kegiatan yang pernah diikuti diantaranya ”Pelatihan ISO 22000” dan ”Gemar Makan Ikan”. Dalam bidang akademik penulis juga merupakan asisten dosen mata kuliah Teknologi Produk Tradisional Hasil Perairan (2008-2009).
Penulis melakukan penelitian dengan judul Aktivitas Antibakteri Ekstrak Karang Lunak Sarcophyton sp. yang Difragmentasi dan Tidak Difragmentasi di Perairan Pulau Pramuka, Kepulauan Seribu untuk memperoleh gelar sarjana di Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Penelitian tersebut didanai sepenuhnya oleh Program Intensif Kementrian Riset dan Teknologi.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segenap limpahan karunia dan hidayah-Nya, sehingga penulis dapat menyelesaikan skripsi dengan judul Aktivitas Antibakteri Ekstrak Karang Lunak Sarcophyton sp. yang Difragmentasi dan Tidak Difragmentasi di Perairan Pulau Pramuka, Kepulauan Seribu. Skripsi ini merupakan salah satu syarat untuk memperoleh gelar sarjana pada Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada seluruh pihak yang telah membantu baik moral maupun material dalam penyelesaian skripsi ini, diantaranya kepada:
(1) Dr. Tati Nurhayati S.Pi, M.Si dan Dr. Ir. Mujizat Kawaroe M.Si selaku dosen pembimbing atas segala bimbingan, pengarahan, serta segala penjelasan sehingga penulis dapat menyesaikan skripsi ini.
(2) Dr. Ir. Sri Purwaningsih, MS dan Ir. Winarti Zahruddin, MS selaku penguji sidang. Terimakasih atas masukan, nasehat, dan pengarahan yang diberikan.
(3) Prof. Dedi Soedharma DEA, Dr. Ir. Mujizat Kawaroe M.Si, dan Dr. Ir. Hefni Effendi, M.Phill atas kesempatan yang diberikan untuk
bergabung dalam Program Intensif Kementrian Riset dan Teknologi yang mendanai seluruh kegiatan penelitian ini.
(4) Ayah, Ibu, dan adik-adikku tercinta. Terima kasih untuk semuanya yang diberikan. Semuanya takkan terbalaskan sepanjang masa.
(5) Ibu Ir. Anna C. Erungan, M.Si selaku pembimbing akademik atas segala bimbingan dan motivasi yang telah diberikan.
(6) Seluruh staf dan dosen pengajar Departemen Teknologi Hasil Perairan atas segala arahan dan bimbingan.
(7) Beginer Subhan S.Pi, M.Si, Dondi Arafat S.Pi, M.Si, Citra Satrya S.Pi, Windhyka Priyatmoko S.Pi, Iis S.Pi,M.Si, Lukman, Rizky Karo, Bayu, Vidi, dan semua tim “Ristek dan Hibah Bersaing” untuk semua bantuannya baik dilapang maupun di laboratorium.
(8) Ibu Ning, Ibu Ema, Rita, Pak Dede, Mba Tatty, Mas Shefri, Mas Zacky, Mas Ipul, Endi, dan Mba Rahma atas bantuan dan bimbingannya selama ini.
(9) Keluarga Lab.Mikrobilogi “Aan, Sena, Tia, Ado, Sugara, Ari, Zaen, Febri, Fahrul, Evi, dan Ita,”. Terima kasih atas dukungan dan bantuan yang telah diberikan.
(10) Muhammad Fauzi Ridwan atas kasih sayang, perhatian, nasehat dan kesabarannya.
(11) Keluarga Besar Kawah Kelud, Mba Ila, Mba Ika, Mas Ali, Mba Farikha, Mas Alfa, Mas Aris, Mas Tyo, Mba Ulfa, Mba Rini, Dedi, Fa’i, To’o, Jo, Yoga, Sapek, Ikka, dan Heri atas kasih sayang, persaudaraan, nasehat dan dukungannya.
(12) Keluarga Besar THP 42,”Uut, Puspita, Ika, Fuad, Rustamaji, Jamal, Seno, Irfan, Bayu, Indri, Junide, Iyal, Nazar, Martca, Phite, Kokom, Niken, Ifa, Tika, Melda, Dewi, Erdita, Junide, Prilisa, Purwati, Ulfa, Erna, Liana, Anne, Sari, Fathu, Mirza, Sofia, Vivit, Hernita, Rodie, Anggi, Jamil, Adrian, Widi, Singgih, Pak Kur, Rizka, dan Nina.
(13) Kakak-kakak ku ”Opik, Anang, An’im, Laler, Glory, Andika, Ika, Tommy, dan lain-lain yang tidak dapat disebutkan satu per satu, terima kasih atas bantuan, dukunagan dan petuah yang diberikan.
(14) Sahabat setiaku, ”Delia, Siska, Fuad, Gigih, Wilda, Deni, Dika, Nicky. Terima kasih atas dukungan dan persahabatan yang indah sampai saat ini. (15) Teman-teman THP 40, 41, 42, 43, 44 dan semua penghuni perikanan terima
kasih atas persahabatannya.
(16) Semua pihak yang telah membantu dalam penelitian dan penulisan skripsi yang tidak dapat disebutkan satu persatu.
Kesempurnaan skripsi ini tidak terlepas dari segala kritik dan saran yang membangun dari semua pihak. Semoga skripsi ini dapat bermanfaat bagi pihak-pihak yang membutuhkannya.
Bogor, Desember 2009
DAFTAR ISI
Halaman
DAFTAR TABEL ... ix DAFTAR GAMBAR ... x DAFTAR LAMPIRAN ... xi 1. PENDAHULUAN ... 1 1.1 Latar Belakang ... 1 1.2 Tujuan ... 2 2. TINJAUAN PUSTAKA ... 32.1 Biologi Karang Lunak Sarcophyton sp. ... 3
2.2 Senyawa Bioaktif Karang Lunak ... 4
2.3 Fragmentasi Karang Lunak ... 7
2.4 Ekstraksi Senyawa Bioaktif ... 8
2.5 Bakteri ... 10 2.5.1 Escherichia coli ... 10 2.5.2 Staphylococcus aureus ... 11 2.5.3 Bacillus cereus ... 12 2.5.4 Pseudomonas aeruginosa... 13 2.6 Senyawa Antibakteri... 14
2.7 Minimum Inhibitory Concentration (MIC) ... 16
2.8 Uji Toksisitas Metode Brine Shrimp Lethality Test (BSLT) ... 16
3. METODOLOGI ... 19
3.1 Waktu dan Tempat Penelitian ... 19
3.2 Alat dan Bahan ... 19
3.3 Metode Penelitian... 21
3.3.1 Koleksi dan karakerisasi ... 21
3.3.2 Ekstraksi komponen bioaktif sampel karang lunak Sarcophyton sp. (Quinn 1988 diacu dalam Gunawan 2007) .... 21
3.3.3 Uji aktivitas antibakteri ... 23
a) Persiapan media padat ... 23
b) Persiapan media cair ... 23
c) Persiapan suspensi bakteri ... 24
d) Prosedur uji aktivitas antibakteri ( Lay diacu dalam Noer dan Nurhayati 2006) ... 24
3.3.4 Uji Minimum Inhibitory Concentration
(modifikasi Lopez et al. 1993) ... 26
a) Prekultur bakteri uji ... 26
b) Perhitungan MIC... 26
3.3.5 Uji Toksisitas dengan metode Brine Shrimp Lethal Test (BSLT) (Meyer et al. 1982,Carballo et al. 2002) ... 27
3.3.6 Uji Fitokimia (Harbone 1987) ... 28
a) Alkaloid ... 28
b) Steroid/triterpenoid ... 28
c) Flavonoid ... 29
d) Saponin (uji busa) ... 29
e) Fenol hidrokuinon ... 29 f) Uji molisch ... 29 g) Uji benedict ... 29 h) Uji biuret ... 29 i) Uji ninhidrin ... 30 3.4 Analisi Data ... 30
4. HASIL DAN PEMBAHASAN ... 31
4.1 Koleksi dan Karakterisasi ... 34
4.2 Senyawa Bioaktif Sarcophyton sp. ... 31
4.3 Aktivitas Antibakteri ... 36
4.4 Minimum Inhibitory Consentration (MIC) ... 40
4.5 Tingkat Toksisitas ... 41
4.6 Senyawa Fitokimia... 44
5. KESIMPULAN DAN SARAN ... 48
5.1 Kesimpulan ... 48
5.2 Saran ... 48
DAFTAR PUSTAKA ... 49
DAFTAR TABEL
Teks
No Halaman
1. Jenis-jenis senyawa terpenoid dari genus Sarcophyton ... 7 2. Beberapa pelarut organik dan sifat fisiknya ... 9 3. Kategori toksisitas bahan ... 17 4. Alat dan bahan penelitian yang digunakan pada setiap tahapan
penelitian ... 19 5. Konsentrasi ekstrak kasar Sarcophyton sp. dan kloramfenikol
(kontrol) pada uji MIC (dalam satuan yang berbeda) ... 27 6. Hasil pengukuran parameter fisika-kimia perairan Pulau Pramuka,
Kepulauan Seribu ... 32 7. Berat ekstrak kasar Sarcophyon sp. yang difragmentasi
dan tidak difragmentasi ... 35 8. Aktivitas antibakteri ekstrak karang lunak Sarcophyton sp. yang
difragmentasi dan tidak difragmentasi pada konsentrasi 20 μg/ml ... 35 9. Aktivitas ekstrak etil asetat Sarcophyton sp. dan kontrol pada
uji MIC ... 42 10. Data hasil uji BSLT ekstrak etil asetat Sarcophyton sp. yang
difragmentasi dan tidak difragmentasi ... 40 11. Hasil identifikasi kandungan fitokimia Sarcophyton sp. yang
DAFTAR GAMBAR
Teks
No Halaman
1. Karang lunak Sarcophyton sp. ... 4
2. Skema biosintesis senyawa bioaktif (Ikan 2008) ... 5
3. Escherichia coli ... 11
4. Staphylococcus aureus ... 12
5. Bacillus cereus ... 13
6. Pseudomonas aeruginosa ... 14
7. Struktur kloramfenikol ... 15
8. Diagram alir ekstraksi komponen bioaktif karang lunak Sarcophyton sp. (Quinn 1988 diacu dalam Gunawan 2007)... 21
9. Tahapan uji penapisan awal antibakteri (Noer dan Nurhayati 2006) ... 24
10. Diagam alir uji toksisitas dengan A. salina (Mclaughlin 1998) ... 26
11. Foto karang lunak Sarcophyton sp. yang difragmentasi dan tidak difragmentasi ... 31
12. Rendemen ekstrak karang lunak Sarcophyon sp. yang difragmentasi dan tidak difragmentasi ... 35
13. Hubungan antara log konsentrasi dan mortalitas ekstrak etil asetat Sarcophyton sp. yang difragmentasi dan tidak difragmentasi ... 42
DAFTAR LAMPIRAN
No Halaman
1. Peta lokasi pengambilan sampel karang lunak ... 57
2. Contoh perhitungan konsenrasi ekstrak per disk ... 58
3. Tabel probit ... 59
4. Contoh perhitungan penentuan LC50 ... 60
5. Hasil uji aktivitas antibakteri ekstrak Sarcophyton sp. yang difragmentasi dan tidak difragmentasi ... 61
6. Hasil uji MIC ekstrak Sarcophyton sp. yang difragmentasi dan tidak difragmentasi ... 62
1. PENDAHULUAN
1.1 Latar Belakang
Sarcophyton sp. merupakan salah satu jenis karang lunak yang
memproduksi senyawa kimia alami dan dikenal dengan istilah natural product. Senyawa kimia alami tersebut berpotensi sebagai sumber obat alami. Hasil penelitian yang dilakukan Badria et al. (1998) dan Swant et al. (2006) menunjukkan bahwa senyawa kimia aktif yang terdapat pada karang lunak
Sarcophyton sp. menunjukkan aktivitas sebagai antibakteri, antifungi, antitumor,
neurotoksik, dan anti-inflamantori yang bermanfaat bagi industri farmasi.
Karang lunak yang dimanfaatkan sebagai senyawa bioaktif kini dilakukan masih berasal dari alam sehingga perlu suatu upaya budidaya untuk mencegah eksploitasi organisme tersebut (over fishing). Salah satu upaya yang dapat dilakukan untuk memenuhi kebutuhan bahan baku obat tanpa mengambil dari alam adalah melakukan budidaya dengan metode fragmentasi karang.
Fragmentasi karang dilakukan dengan cara memotong koloni induk menjadi kepingan-kepingan kecil (fragmen), kemudian diletakan pada substrat. Fragmen tersebut akan menempel pada substrat dan berkembang menjadi koloni yang baru (Smith dan Hughes 1999). Sejak tahun 2007, para peneliti Program Hibah Bersaing XV dari Departemen Ilmu dan Teknologi Kelautan, Institut Peranian Bogor telah melakukan fragmentasi karang lunak pada dua kedalaman yang berbeda (3 m dan 12 m) di Perairan Pulau Pramuka, Kepulauan Seribu. Jenis karang lunak yang berhasil tumbuh setelah difragmentasi adalah
Sarcophyton sp, Sinularia sp., dan Lobophytum sp.
Penelitian mengenai aktivitas antibakteri ekstrak dari karang lunak jenis
Sinularia sp. dan Lobophytum sp. hasil fragmentasi pada dua kedalaman yang
berbeda di Perairan Pulau Pramuka, Kepulauan Seribu sudah dilakukan oleh Priyatmoko (2008) dan Triyulianti (2009). Berdasarkan hasil penelitian tersebut diketahui bahwa karang lunak hasil fragmentasi di kedalaman 10 m memiliki aktivitas antibakteri yang lebih baik dibandingkan dengan karang lunak hasil fragmentsi di kedalaman 3 m. Ekstrak karang lunak hasil fragmentasi di
kedalaman 10 m dapat menghambat bakteri Escherichia coli dan Staphylococcus aureus.
Karang lunak jenis Sarcophyton sp. telah berhasil difragmentasi dan banyak tersebar di perairan Kepulauan Seribu. Efektivitas aktivitas antibakteri karang lunak Sarcophyton sp. hasil fragmentasi dan Sarcophyton sp. yang tumbuh secara alami masih belum diketahui sehingga perlu dilakukan penelitian dan pengkajian tentang aktivitas antibakteri ekstrak karang lunak Sarcophyton sp. yang difragmentasi dan tidak difragmentasi di Perairan Pulau Pramuka, Kepulauan Seribu.
1.2 Tujuan
Penelitian ini bertujuan untuk :
(1). mengetahui aktivitas antibakteri ekstrak karang lunak Sarcophyton sp. yang difragmentasi dan tidak difragmentasi di Perairan Pulau Pramuka;
(2). mengetahui tingkat toksisitas ekstrak Sarcophyton sp. yang difragmentasi dan tidak difragmentasi; dan
(3). mengetahui kandungan kimia yang terdapat pada ekstrak Sarcophyton sp. yang difragmentasi dan tidak difragmentasi.
2. TINJAUAN PUSTAKA
2.1 Biologi Karang Lunak Sarcophyton sp.
Karang lunak Sarcophyton sp. adalah salah satu genus Alcyonaria bertangkai besar dengan ukuran koloni yang besar pula. Ukuran koloni karang lunak ini dapat mencapai 1,5 m, namun pada umumnya berukuran 10-20 cm (Fabricus dan Philip 2001). Urutan klasifikasi karang lunak ini menurut Lesson (1839) diacu dalam Fabricus dan Philip (2001) adalah sebagai berikut:
Filum : Coelenterata Kelas : Anthozoa
Sub-kelas : Octocorallia (Alcyonaria) Ordo : Alcyonacea
Famili : Alcyoniidae Genus : Sarcophyton
Sarcophyton sp. dapat ditemukan dari rataan terumbu karang sampai ke
kedalaman 15 m dengan konsentrasi pada kedalaman 3-10 m. Karang lunak ini memiliki koloni yang berukuran besar, mempunyai tangkai berwarna putih atau senanda dengan kapitalium. Kapitalium genus Sarcophyton berbentuk melebar seperti jamur atau bundar dengan tepi berlekuk atau melipat, permukaan halus seperti beludru. Bentuk koloni karang lunak ini bertangkai panjang atau pendek yang melekat di dasar (Fabricus dan Philip 2001). Morfologi karang lunak
Sarcophyton sp. dapat dilihat pada Gambar 1.
Genus Sarcophyton memiliki dimorfik, yaitu memiliki autosoid dan sifonosoid. Warna koloni genus ini adalah krem, coklat, kuning, atau hijau. Warna tersebut dihasilkan oleh sejumlah alga simbiotik (zooxanthellae) yang hidup di dalam jaringan tubuh karang. Sarcophyton sp. bereproduksi secara seksual dan aseksual. Reproduksi aseksual yang dilakukan oleh genus ini ada dua
cara, yaitu dengan fragmentasi atau memisah dan membentuk tunas (budding) (Fabricus dan Philip 2001).
Gambar 1. Karang Lunak Sarcophyton sp. Sumber : Dok. Riset dan Teknologi (2008) 2.2 Senyawa Bioaktif Karang Lunak
Menurut Khatab et al. (2008), senyawa bioaktif adalah senyawa kimia aktif yang dihasilkan oleh organisme melalui jalur biosintetik metabolit sekunder. Muniarsih (2005) melaporkan bahwa metabolit sekunder atau sering disebut
natural product diproduksi oleh organisme pada saat kebutuhan metabolisme
primer sudah terpenuhi dan digunakan dalam mekanisme evolusi atau strategi adaptasi lingkungan (fungsi penting dalam ekologi).
Menurut Khatab et al. (2008), metabolit sekunder yang dihasilkan oleh karang lunak memiliki keragaman yang tinggi dan struktur kimia yang unik. Muniarsih (2005) berpendapat bahwa hal tersebut dipengaruhi oleh tingginya keanekaragaman organisme laut dan pengaruh lingkungan laut, seperti kadar garam, rendahnya intensitas cahaya, adanya arus maupun kompetisi yang kuat sehingga mendorong organisme laut menghasilkan metabolit sekunder yang mempunyai struktur kimia relatif berbeda dengan organisme darat.
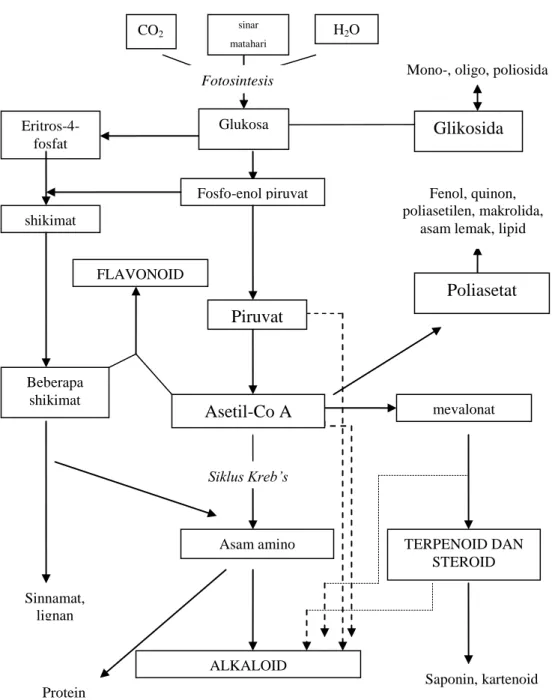
Karang lunak menghasilkan senyawa metabolit sekunder berfungsi untuk menghadapi serangan predator, media kompetisi, mencegah infeksi bakteri, membantu proses reproduksi, dan mencegah sengatan sinar ultra violet (Harper et al. 2001). Elyakov dan Stonik (2003) melaporkan bahwa karang lunak menghasilkan beberapa dari golongan senyawa hasil metabolit sekunder, seperti alkaloid, terpenoid, steroid, flavonoid, fenol, saponin, dan peptida. Skema biosintesis senyawa bioaktif secara umum (Ikan 2008) disajikan pada Gambar 2.
Fosfo-enol piruvat shikimat Eritros-4-fosfat Beberapa shikimat FLAVONOID Siklus Kreb’s Asam amino Sinnamat, lignan Protein Saponin, kartenoid TERPENOID DAN STEROID ALKALOID Glukosa Fotosintesis mevalonat
Mono-, oligo, poliosida
Glikosida
Piruvat
Fenol, quinon, poliasetilen, makrolida,
asam lemak, lipid
Poliasetat
Asetil-Co A
Gambar 2. Skema biosintesis senyawa bioaktif (Ikan 2008)
Alkaloid pada umumnya mencakup senyawa bersifat basa yang mengandung satu atau lebih atom nitrogen, biasanya dalam gabungan, sebagai bagian dari sistem siklik. Alkaloid banyak yang mempunyai kegiatan fisiologis sehingga digunakan secara luas dalam bidang pengobatan (Harbone 1987). Alkaloid memiliki efek farmakologi sebagai analgesik (pereda nyeri) dan anestetik (pembius). Alkaloid yang biasa digunakan sebagai analgesik dan anaestetik adalah morfin dan rodein (Robinson 1995).
CO2 sinar H2O
Menurut Coll dan Sammarco (1983), terpenoid merupakan senyawa kimia yang memiliki aroma atau bau yang harum. Senyawa terpen dapat digunakan dalam bidang farmasi sebagai antibiotika, anti jamur, dan senyawa anti tumor. Kegunaannya senyawa terpen bagi karang lunak itu sendiri ialah sebagai penangkal terhadap serangan predator, media untuk memperebutkan ruang lingkup, dan membantu proses reproduksi
Steroid merupakan golongan senyawa triterpenoid. Steroid alami berasal dari berbagai transformasi kimia dua triterpena, yaitu lanosterol dan sikloartenol. Senyawa steroid dapat digunakan sebagai bahan dasar pembuatan obat (Harborne 1987).
Flavonoid merupakan golongan terbesar dari senyawa fenol yang larut dalam air. Flavonoid merupakan golongan yang penting karena memiliki spektrum aktivitas antimikroba yang luas dan dapat mengurangi kekebalan pada organisme sasaran (Naidu 2002).
Saponin merupakan golongan triterpenoid yang mempunyai kerangka karbon berdasarkan isoprena. Senyawa ini tidak berwarna, berbentuk kristal, dan sering mempunyai titik lebur tinggi (Harborne 1987). Saponin merupakan golongan senyawa yang dapat menghambat atau membunuh mikroba dengan cara berinteraksi dengan membran sterol. Efek utama saponin terhadap bakteri adalah adanya pelepasan protein dan enzim dari dalam sel (Zablotowics et al. 2002).
Dipeptida dihasilkan oleh gugus karboksil suatu asam amino yang berkaitan dengan gugus amino dari molekul asam amino lain dan diikuti dengan melepaskan molekul air. Dipeptida masih mempunyai gugus amino dan karboksil bebas sehingga dapat bereaksi dengan dipeptida-dipeptida lainnya membentuk peptida dan akhirnya membentuk molekul protein (Winarno 1997).
Karang lunak genus Sarcophyton banyak mengandung senyawa bioakif terpenoid, seperti cembranoid diterpenoid (Yulin Li et al. 2006). Hasil penelitian Sawant et al. (2006) menunjukkan bahwa ekstrak karang lunak
Sarcophyton glaucum asal Laut Merah (Red sea) mengandung senyawa sarcophine. Sarcophine merupakan senyawa cembranoid diterpen yang diketahui
dapat menghambat proses tumorgenesis. Koh et al. (2000) menambahkan bahwa jenis senyawa cembranoid diterpen lain yang terdapat pada karang lunak
Sarcophyton glaucum adalah sarcophytol-A dan sarcophytonin-A. Jumlah
senyawa tersebut dalam ekstrak lipid sebesar 22% dan 8%.
Badria et al. (1998) melaporkan bahwa Sarcophyton glaucum mengandung senyawa sarcophytolide memiliki sifat neurotoksik dan berperan sebagai antibakteri dan antifungi. Ekstrak petrol eter Sarcophyton glaucum
tersebut dapat menghambat bakteri S. aureus, E. coli, dan
Saccaromyces cerevisiae, sedangkan ekstrak etil asetat dapat menghambat bakteri S. aureus, Clostridium albicans, dan S. cerevisiae. Beberapa jenis senyawa
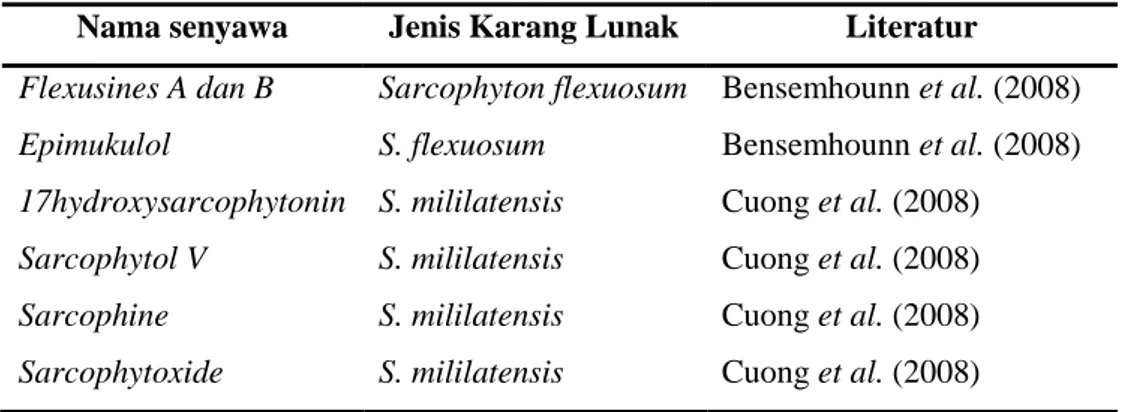
bioaktif terpenoid dari genus Sarcophyton dapat dilihat pada Tabel 1.
Tabel 1. Jenis-jenis senyawa bioaktif terpenoid dari genus Sarcophyton
Nama senyawa Jenis Karang Lunak Literatur
Flexusines A dan B Epimukulol 17hydroxysarcophytonin Sarcophytol V Sarcophine Sarcophytoxide Sarcophyton flexuosum S. flexuosum S. mililatensis S. mililatensis S. mililatensis S. mililatensis Bensemhounn et al. (2008) Bensemhounn et al. (2008) Cuong et al. (2008) Cuong et al. (2008) Cuong et al. (2008) Cuong et al. (2008)
2.3 Fragmentasi Karang Lunak
Karang lunak bereproduksi secara seksual dan aseksual. Reproduksi aseksual atau propagasi merupakan cara reproduksi yang umum terjadi pada karang lunak, karena tekstur tubuhnya yang lentur dan lunak sangat memungkinkan terjadinya cara reproduksi seperti ini. Reproduksi aseksual terjadi dalam beberapa cara, yaitu dengan fragmentasi atau memisah (fussion), membentuk stolon (runner formation), dan membentuk tunas (budding) (Fabricus dan Philip 2001).
Menurut Highsmith (1982), fragmentasi adalah proses pemisahan satu koloni menjadi dua koloni atau beberapa koloni. Fragmentasi ini dapat terjadi secara alami pada karang lunak, akibat adanya pengaruh lingkungan, seperti gelombang dan arus. Fragmentasi atau teknik pemisahan ini dapat dijadikan dasar untuk melakukan budidaya karang lunak.
Smith dan Hughes (1999) menyatakan bahwa fragmentasi dilakukan dengan cara memotong suatu koloni induk menjadi kepingan-kepingan kecil (fragmen),
kemudian diletakan pada suatu substrat. Fragmen tersebut akan menempel pada
substrat dan berkembang menjadi koloni yang baru. Menurut Oren dan Benayahu (1997), substrat yang biasa digunakan pada budidaya
fragmentasi adalah substrat semen dan karang mati (rubbel). Penempelan fragmen akan berhasil dengan baik bila didukung oleh faktor lingkungan yang optimal dan substrat dasar yang baik.
2.4 Ekstraksi Senyawa Bioaktif
Ekstraksi adalah suatu proses penarikan komponen yang diinginkan dari suatu bahan dengan cara pemisahan satu atau lebih komponen dari suatu bahan yang merupakan sumber komponennya. Faktor-faktor yang berpengaruh terhadap proses ekstraksi adalah lama ekstraksi, suhu, dan jenis pelarut yang digunakan. Hal yang harus diperhatikan dalam pemilihan jenis pelarut yang digunakan daya melarutkan, titik didih, sifat toksik, mudah tidaknya terbakar, dan sifat korosif terhadap peralatan ekstraksi (Khopkar 2003).
Ekstraksi dibedakan menjadi tiga cara menurut pengoprasiannya, yaitu (1) ekstraksi dengan penekanan yang sering disebut penekanan mekanik, (2) ekstraksi dengan menggunakan pelarut (solvent extraction), dan (3) ekstraksi dengan pemanasan (rendering). Berdasarkan jenis pelarutnya, solvent extractin dapat dilakukan dengan dua cara, yaitu aqueos phase dan organic phase. Cara aqueos
phase dilakukan dengan menggunkan air, sedangkan cara organic phase
dilakukan dengan menggunkan pelarut organik (Winarno et al. 1973). Prinsip metode ekstraksi menggunakan pelarut organik adalah bahan yang akan diekstrak kontak langsung dengan pelarut pada waktu tertentu (maserasi), kemudian diikuti
dengan melakukan pemisahan bahan yang telah diekstrak (filtrasi) (Khopkar 2003).
Pada proses maserasi, pelarut akan menembus dinding sel dan akan masuk ke dalam rongga sehingga komponen bioaktif akan larut. Adanya perbedaan konsentrasi antara larutan komponen bioaktif di dalam sel dengan di luar sel maka larutan yang terpekat didesak keluar. Peristiwa tersebut terjadi berulang kali
hingga terjadi keseimbangan antara larutan di luar dengan di dalam sel (Nur dan Adijuwana 1989).
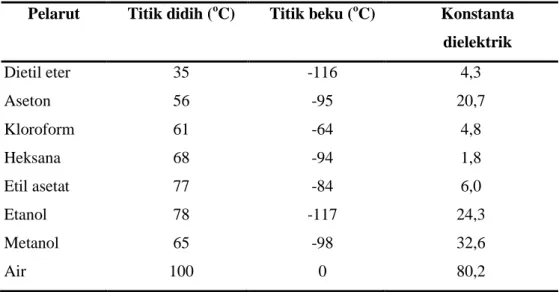
Metode ekstraksi tergantung pada polaritas senyawa yang akan diekstrak. Suatu senyawa menunjukkan kelarutan yang berbeda-beda dalam pelarut yang berbeda. Bahan dan senyawa kimia akan mudah larut pada pelarut yang relatif sama kepolarannya. Semakin besar konstanta dielektrik, maka akan semakin besar polar pelarut tersebut. Prinsip pelarutan yang dipakai pada metode ini adalah like dissolve like artinya pelarut polar akan melarutkan senyawa polar dan pelarut non polar akan melarutkan senyawa non polar (Khopkar 2003). Tingkat polaritas suatu pelarut dapat dilihat pada Tabel 2.
Tabel 2. Beberapa pelarut organik dan sifat fisiknya
Pelarut Titik didih (oC) Titik beku (oC) Konstanta dielektrik Dietil eter Aseton Kloroform Heksana Etil asetat Etanol Metanol Air 35 56 61 68 77 78 65 100 -116 -95 -64 -94 -84 -117 -98 0 4,3 20,7 4,8 1,8 6,0 24,3 32,6 80,2
Sumber : Nur dan Adijuwana (1989)
Hasil ekstrak yang diperoleh akan tergantung pada beberapa faktor, yaitu kondisi alamiah senyawa tersebut, metode ekstraksi yang digunakan, ukuran parikel sampel, lama waktu ekstrak, kondisi dan waktu penyimpanan, serta perbandingan jumlah pelarut terhadap jumlah sampel (Harbone 1987). Ekstraksi beberapa kali dengan pelarut yang lebih sedikit akan lebih efektif dibanding ekstraksi satu kali dengan semua pelarut sekaligus (Nur dan Adijuwana 1989).
Menurut Riguera (1997), komponen aktif yang dapat diekstrak dari suatu bahan tergantung pada kepolaran pelarut yang digunakan. Senyawa yang terikat pada pelarut polar antara lain alkaloid, asam amino, polihidrosisteroid, dan saponin, sedangkan senyawa yang terikat pada pelarut semi polar antara lain peptida dan depsipeptida serta senyawa yang terikat pada pelarut non polar (misalnya heksana) antara lain hidrokarbon, asam lemak, dan terpen.
2.5 Bakteri
Bakteri adalah sel prokariot yang khas dan bersifat uniseluler. Sel bakteri berbentuk bulat, batang, atau spiral. Umumnya bakteri berdiameter antara 0,5-1,0 μm dan panjang 1,5-2,5 μm. Bakteri dapat dibedakan menjadi bakteri Gram positif dan bakteri Gram negatif berdasarkan perbedaan pada komposisi dan struktur dinding selnya (Pelczar dan Chan 2005).
Bakteri Gram positif mempunyai struktur dinding sel yang tebal antara 15-80 nm dan berlapis tunggal. Komposisi dinding sel terdiri dari 90% peptidoglikan dan lapisan tipis asam teikoat. Bakteri gram positif lebih rentan
terhadap penisilin, dan persyaratan nutriennya relatif rumit pada banyak spesies (Fardiaz 1992).
Bakteri Gram negatif mempunyai struktur dinding sel berlapis tiga dengan ketebalan yang tipis berkisar antara 10-15 nm. Komposisi dinding sel bakteri Gram negatif pada lapisan luar terdiri dari 5-10% peptidoglikan, sedangkan pada lapisan lainnya terdiri dari protein, lipopolisakarida, dan lipoprotein. Lapisan ini merupakan lapisan lipid kedua yang disebut lapisan lipopolisakarida (LPS) (Fardiaz 1992). Bakteri gram negatif umumnya kurang rentan terhadap penisilin, kurang resisten terhadap gangguan fisik, dan persyaratan nutriennya relatif sederhana (Pelczar dan Chan 2005).
2.5.1 Escherichia coli
Escherichia coli termasuk dalam famili Enterobacteriaceae. Bakteri ini
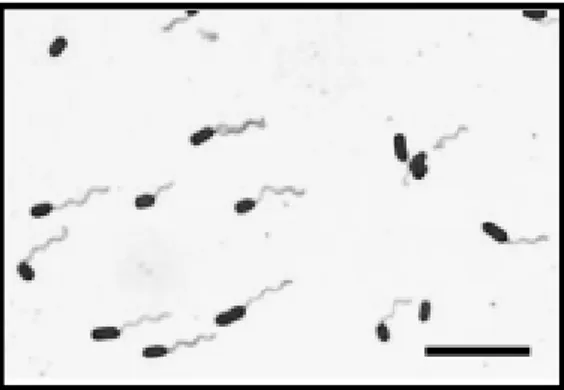
tergolong patogen gram negatif, bersifat anaerob fakultatif, dan bersifat kemoorganik dengan tipe metabolisme fermentatif dan respiratif. Bakteri ini ada yang bersifat motil bergerak dengan flagella peritrik dan ada juga yang nonmotil (Fardiaz 1992). Escherichia coli berbentuk batang, tidak berspora dan biasanya tidak berkapsul. Bakteri ini tumbuh pada suhu antara 15-45 oC dengan suhu optimum 37 oC (Pelczar dan Chan 2005). Morfologi E. coli disajikan pada Gambar 3.
Escherichia coli merupakan bakteri yang sensitif terhadap antibiotik jenis
sulfinamid, kloramfenikol, kanamicin, dan penisilin, namun kurang rentan terhadap penisilin dan kurang resisten terhadap gangguan fisik (Gross 1995).
penyakit apabila masuk ke organ atau jaringan lain, seperti timbulnya pneumonia, endokarditis, infeksi pada luka, dan abses pada berbagai organ. Berbagai penelitian menunjukkan bahwa beberapa galur atau strain dari E. coli juga dapat menyebabkan wabah diare, terutama pada anak-anak (Greenwood 1995).
Escherichia coli yang menyebabkan diare akut dapat dikelompokkan menjadi tiga
kategori, yaitu E. coli enteropatogenik (EPEC), E. coli enteroinvasif (EIEC), dan
E. coli enterotoksikgenik (ETEC) (Pelczar dan Chan 2005).
Gambar 3. Escherichia coli (Lewis et al. 2004) 2.5.2 Staphylococcus aureus
Staphylococcus aureus tergolong bakteri gram positif bersifat anaerob
fakultatif. Bakteri ini berbentuk bulat (kokus) tunggal, berpasangan atau bergerombol, tidak berkapsul dan berspora, dan non motil. Bakteri ini bersifat kemoorganotropik dengan tipe metabolisme fermentatif dan respiratif. Bakteri ini dapat tumbuh pada konsentrasi NaCl 10 % dengan suhu optimum antara 35-37 oC dan pH 6-7. Bakteri ini masih dapat tumbuh dan berkembang biak pada suhu 6,7-45,5 oC serta pH 4,0-9,8. Staphylococcus aureus umumnya sensitif terhadap antibiotik β-laktam, tetrasiklin, dan kloramfenikol, tetapi resistan terhadap polimiksin (Pelczar dan Chan 2005). Morfologi S. aureus disajikan pada Gambar 4.
Staphylococcus aureus adalah organisme yang biasanya terdapat di
berbagai tubuh manusia, termasuk hidung, tenggorokan dan kulit (Pelczar dan Chan 2005). Bakteri ini dapat menyebabkan penyakit pneumonia,
keracunan makanan, yaitu dengan cara mengeluarkan enterotoksin yang bersifat tahan panas (Arbuthnott 1995). Enterotoksik tersebut bersifat koagulase positif,
yaitu mempunyai kemampuan mengkoagulasi plasma darah yang diberi sitrat atau oksalat (Pelczar dan Chan 2005). Penyakit pneumonia biasanya diinfeksikan melalui udara, dan keracunan makanan melalui kontaminasi manusia dan lingkungan yang tercemar (Arbuthnott 1995).
Gambar 4. Staphylococcus aureus (Arbuthnott 1995) 2.5.3 Bacillus cereus
Bacillus cereus (B. cereus) adalah bakteri gram positif yang dapat
membentuk spora. Bakeri ini termasuk batang besar (basil) yang bersifat aerob hingga aerob fakultatif, katalase positif, dan membentuk rantai. Ciri khas bakteri ini adalah sel berukuran 1x3,4 μm, mempunyai ujung yang berbentuk persegi empat, dan tersusun dalam rantai panjang serta spora terletak ditengah basil yang tidak bergerak (Jawetz et al. 1996). Morfologi B. cereus disajikan pada Gambar 5.
Bacillus cereus memproduksi spora berbentuk silinder yang tidak
membengkak (Fardiaz 1992). Bakteri ini dapat tumbuh pada suhu minimum 4-5 oC, suhu maksimum 48-50 oC, dan suhu optimal pertumbuhannya 30-40 oC serta pada pH antara 4,9-9,3 (Pelczar dan Chan 2005). Bakteri ini dapat memproduksi spora tahan panas dan tahan radiasi, serta tetap aktif setelah pemanasan selama 4 jam pada suhu 135 oC (Fardiaz 1992).
Bacillus cereus dapat tumbuh pada makanan dan menghasilkan enterotoksin
yang menyebabkan keracunan makanan. Spora sel B. cereus bertunas dan sel vegetatif menghasilkan toksin selama fase eksponensial pertumbuhan atau selama masa sporulasi. Munculnya diare terjadi setelah masa inkubasi 1-24 jam dan terlihat sebagai diare terus menerus disertai demam dan kejang perut; jarang
terjadi demam dan muntah. Enterotoksin B. cereus dapat ditemukan pada bahan pangan atau dibentuk dalam usus. Bakteri ini juga merupakan penyebab penting
dari infeksi mata, keratitis berat, endoftalmitis, dan panoftalmitis (Jawetz et al. 1996).
Gambar 5. Bacillus cereus (Michel 2009) 2.5.4 Pseudomonas aeruginosa
Pseudomonas aeruginosa termasuk famili Pseudomonadaceae, bersifat
aerob, merupakan gram negatif, motil, bentuk sel beragam mulai dari batang, koma, dan kadang-kadang kokus (Greenwood 1995). Morfologi P.aeruginosa disajikan pada Gambar 6. Pseudomonas aeruginosa terkenal karena ketahanannya terhadap antibiotik, sehingga bakteri ini benar-benar berbahaya dan sangat patogen. Bakteri ini hanya efektif terhadap beberapa antibiotik yaitu fluoroquinolon, gentamisin, dan imipenem dan bahkan antibiotik ini tidak terlalu efektif melawan semua strain dari bakteri ini (Greenwood 1995).
Bakteri ini dapat menyebabkan penyakit pada sistem pernapasan (cystic fibrosis), saluran urin, penyakit kulit dan infeksi pada saluran darah (Ryan 2004). Pseudomonas aeruginosa menjadi perhatian bukan hanya dapat menyebabkan penyakit yang berbahaya, tetapi karena dapat beradaptasi dengan ruang ekologinya, yakni air, tanah, tanaman, dan jaringan hewan. Bakteri tersebut dapat memanfaatkan komponen organik dari sumber makanan untuk memproduksi protein toksin yang dapat menyebabkan kerusakan jaringan yang luas dan juga mengganggu sistem ketahanan tubuh (Ryan 2004).
Gambar 6. Pseudomonas aeruginosa (Takahashi et al. 2008) 2.6 Senyawa Antibakteri
Senyawa antibakteri didefinisikan sebagai senyawa biologis atau kimia yang dapat membunuh atau menghambat pertumbuhan dan aktivitas bakteri (Pelczar dan Chan 2005). Senyawa antibakteri dalam bidang farmakologi digunakan untuk membasmi bakteri penyebab infeksi pada manusia. Senyawa antibakteri ini harus memiliki sifat toksisitas selekif setinggi mungkin, artinya senyawa tersebut dapat merugikan bakteri tanpa merugikan inang (manusia). Berdasarkan sifat toksisitas selektifnya, antimikroba dapat bersifat bakterisidal (membunuh bakteri), bakteriostatik (menghambat pertumbuhan bakteri), dan bakterilitik (merusak germinasi spora bakeri) (Jawet 1998). Aktivitas antimikroba dipengaruhi oleh beberapa faktor, antara lain pH lingkungan, stabilitas senyawa antibakeri, suhu lingkungan, takaran inokulum mikroorganisme, waktu inkubasi, dan aktivitas metabolisme mikroorganisme (Irianto 2007).
Mekanisme kerja senyawa yang bersifat antimikroba ada beberapa cara, yaitu penghambatan sintesis dinding sel yang menyebabkan kerusakan dinding sel sehingga terjadi lisis, perubahan permeabilitas membran sel atau transpor aktif melalui membran sel yang dapat menyebabkan kebocoran dan kematian sel, penghambatan sintesis protein, dan penghambatan sintesis asam nukleat (Jawetz et al. 1996).
Menurut Davis dan Stout (1971), ketentuan kekuatan antibiotik-antibakteri sebagai berikut: daerah hambatan 20 mm atau lebih berarti sangat kuat, daerah hambatan 10-20 mm (kuat), daerah hambatan 5-10 mm (sedang), dan daerah hambatan 5 mm atau kurang (lemah). Faktor yang mempengaruhi ukuran daerah penghambatan, yaitu sensitivitas organisme, medium kultur, kondisi inkubasi, dan
kecepatan difusi agar. Faktor-faktor yang mempengaruhi kecepatan difusi agar, yaitu konsentrasi mikroorganisme, komposisi media, suhu inkubasi, media, dan waktu inkubasi (Schegel dan Schmidt 1994).
Ciri-ciri antibakteri yang baik menurut Pelczar dan Chan (2005) adalah: 1) mampu membunuh atau menghambat pertumbuhan bakteri;
2) substansi itu harus dapat larut dalam air atau pelarut-pelarut lain sampai pada taraf yang diperlukan;
3) perubahan yang terjadi pada substansi itu bila dibiarkan beberapa lama harus seminimal mungkin dan tidak boleh mengakibatkan kehilangan sifat
antimikrobialnya dengan nyata;
4) tidak bersifat racun bagi manusia maupun hewan lain;
5) komposisinya harus seragam sehingga bahan aktifnya selalu terdapat pada setiap aplikasi;
6) tidak bergabung dengan bahan organik.
7) aktivitas antimikrobial pada suhu kamar atau pada suhu tubuh; 8) kemampuan untuk menembus dinding sel;
9) tidak menimbulkan karat dan warna; dan
10) kemampuan menghilangkan bau yang kurang sedap .
Kloramfenikol merupakan senyawa antibiotik yang awalnya diisolasi dari
Streptomyces venezuelae, tetapi sekarang dapat disintesa dari turunan asam
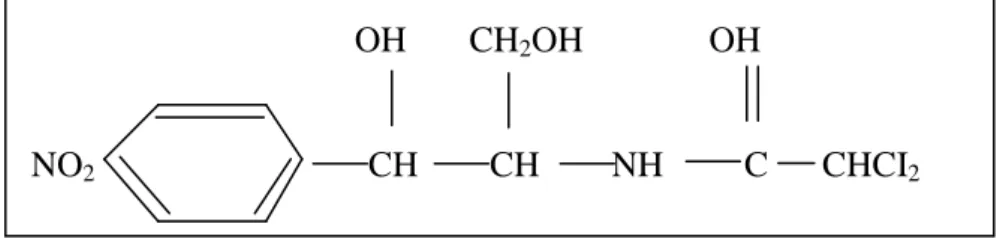
dikoroasetik. Antibiotik ini memiliki spektrum luas yang aktif terhadap bakteri gram positif dan gram negatif aerob serta anaerob (Songer dan Post 2005). Kloramfenikol merupakan antibiotik aminoglikosida, yaitu antibiotik bakteriostatik yang tidak membunuh bakteri melainkan hanya menghambat sintesa protein yang sangat diperlukan dalam perbanyakan dan pembelahan sel bakteri (Fardiaz 1992). Struktur kloramfenikol dapat dilihat pada Gambar 7.
OH CH2OH OH
NO2 CH CH NH C CHCI2
Kloramfenikol merupakan antibiotik yang paling stabil dan netral. Zat ini juga cepat dan hampir sempurna diabsorpsi oleh saluran pencernaan. Antibiotik ini masih banyak digunakan di negara-negara berkembang karena harganya yang relatif lebih murah dibandingkan dengan antibiotik-antibiotik lainnya (Fardiaz 1992). Antibiotik ini menimbulkan efek samping, yaitu dapat
menimbulkan gangguan gastrointestinal, gangguan sumsum tulang (anemia aplastik), dan menyebabkan gray baby syndrome (Jawet 1998).
2.7 Minimum Inhibitory Concentration (MIC)
Metode pengujian MIC merupakan salah satu metode yang biasa digunakan dalam pengujian aktivitas zat antimikroba secara in vitro. Metode ini dilakukan dengan cara menentukan konsentrasi terendah dari zat tersebut yang dibutuhkan untuk menghambat pertumbuhan dari mikroorganisme yang diuji (Schegel dan Schmidt 1994).
Ada 2 metode yang digunakan dalam pengujian MIC, yaitu teknik tabung pengenceran (tube dillution technique) dan metode difusi agar (agar
diffusion method). Minimum Inhibitory Concentration (MIC) dipengaruhi oleh
jenis organisme, ukuran inokulum, komponen media kultur, waktu inkubasi, serta kondisi inkubasi berupa suhu, pH atau aerasi. Metode tabung pengenceran ini tidak dapat digunakan untuk menentukan zat tersebut bersifat sidal, statik, atau litik (Schegel dan Schmidt 1994).
Aktivitas antimikroba ditentukan dengan mengukur diameter hambatannya, yaitu daerah bening yang terbentuk di sekitar kertas cakram. Antimikroba dikatakan mempunyai aktivitas yang tinggi terhadap mikroba apabila nilai konsentrasi penghambatan bakteri yang terendah (MIC) kecil, tetapi mempunyai diameter penghambatannya besar (Irianto 2007). Suatu bahan dikatakan mempunyai aktivitas antibakteri apabila diameter hambatan yang terbentuk lebih besar atau sama dengan 6 mm (Bell 1984).
2.8 Uji Toksisitas Metode Brine Shrimp Lethallity Test (BSLT)
Meyer et al. (1982) menyatakan bahwa metode Brine Shrimp Lethality Test (BSLT) merupakan salah satu metode untuk menguji bahan-bahan yang bersifat
sitotoksik, yaitu dengan uji toksisitas terhadap larva udang dari
terhadap senyawa aktif yang terkandung di dalam ekstrak tanaman karena murah, cepat, mudah (tidak perlu kondisi aseptik) dan dapat dipercaya
Menurut Meyer et al. (1982), prinsip metode BSLT adalah menggunakan tingkat kematian naupli pada berbagai tahap perkembangan hidupnya untuk mengetahui toksisitas suatu bahan. Stadia larva yang paling umum digunakan adalah larva 24-48 jam setelah menetas. Pada stadia lebih tua dari naupli atau stadia artemia dewasa juga biasa digunakan sebagai organisme penyeleksi. Konsentrasi letal untuk kematian 50% populasi naupli setelah 6 jam perlakuan (akut LC50) atau konsentrasi letal untuk kematian 50% populasi naupli setelah 24 jam perlakuan (kronik LC50) dapat diartikan sebagai ukuran toksisitas kandungan racun dalam suatu bahan. Waktu pilihan ditentukan oleh daya serap dari suatu ekstrak. Tingkat toksisitas suatu bahan dapat dilihat pada Tabel 3.
Tabel 3. Kategori toksisitas bahan
Kategori LC50 (μg/ml) Sangat toksik Toksik Tidak toksik < 30 30-1000 >1000 Sumber : Meyer et al. (1982)
Artemia atau brine shrimp termasuk golongan udang yang hidup
planktonik yang memiliki toleransi pada kisaran kadar garam yang sangat luas berkisar antara 15-300 per mil dan suhu berkisar antara 26-31 °C, serta nilai pH antara 7,3-8,4 (Djarijah 2006). Artemia salina menghasilkan siste bila lingkungannya memburuk dengan kadar garam lebih dari 150 per mil dan kandungan oksigen rendah. Ukuran A. salina dewasa antara 10-20 mm dengan berat sekitar 10 mg (Priyambodo dan Wahyuningsih 2003).
Artemia salina berkembang biak secara biseksual dan partonogenesis. A. salina dikatakan dewasa bila telah berusia 141 hari. A. salina hidup sampai
enam bulan, yang betina dapat bertelur setiap 4-5 hari sekali dengan jumlah 50-300 telur setiap kali bertelur. Telur-telur tersebut akan menetas dalam kurun waktu 24-36 jam, lalu menjadi larva atau nauptilus (Djarijah 2006).
Meyer et al. (1982) berpendapat bahwa ketersediaan telur, kemudahan dalam menetaskan telur menjadi larva, pertumbuhan yang cepat dari naupli dan
relatif mudah dalam mempertahankan populasi dalam kondisi laboratorium membuat kondisi A. salina merupakan hewan percobaan yang efektif dan sederhana dalam ilmu biologi dan toksikologi. Artemia salina sering digunakan dalam penelitian, sederhana dan yang terpenting tidak mahal, dan mudah diproduksi.
3. METODOLOGI
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan April-Juli 2009 yang bertempat di Laboratorium Mikrobiologi dan Laboratorium Bioteknologi Hasil Perairan 2, Departemen Teknologi Hasil Perairan, Fakulas Perikanan dan Ilmu Kelautan serta Laboratorium Kimia Analitik, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
3.2 Alat dan Bahan
Alat dan bahan yang digunakan pada setiap tahapan penelitian disajikan pada Tabel 4.
Tabel 4. Alat dan bahan penelitian yang digunakan pada setiap tahapan penelitian
Tahapan Alat Bahan
1. Koleksi dan karakterisasi
2. Ekstraksi bahan aktif
3. Uji aktivitas antibakteri : a. Persiapan media cair (NB)
b. Persiapan suspensi bakteri
c. Persiapan media padat
d.Prosedur uji aktivitas antibakteri
Scuba Diving Kamera underwater Plastik tahan panas Timbangan analitik
Cool box
Alat-alat gelas Evaporator
Shaker bath
Kertas saring (Whatman)
Hotplate
Tabung reaksi Kapas
Aluminium foil Otoklaf, gelas ukur Sudip Jarum ose Spektrofotom Inkubator Aluminium foil Bunsen Hotplate Tabung reaksi Kapas Aluminium foil Otoklaf, Sudip Cawan petri Refrigerator Vortex, pipet Clean bench Paper disc Es Metanol Sampel Sarcophyton sp. Metanol Heksana Etil asetat
Nutrient broth (Oxoid)
Akuades NaCl Biakan E.coli Biakan S. aureus Biakan P. aeruginosas Biakan B.cereus Nutrient Broth Muller Hinton Agar
Akuades
Muller Hinton Agar (MHA)
4 jenis bakteri uji Ekstrak sampel
Tabel 4. Lanjutan
Tahapan Alat Bahan
4. Uji MIC (Minimum
Inhibibitory concentration) :
a. Prekultur bakteri uji b. Perhitungan MIC 5. Uji BSLT 6. Uji Fitokimia a. Alkaloid b. Steroid / triterpenoid c. Flavonoid
d. Saponin (uji busa) e. Fenol hidrokuinon f. Uji molisch g. Uji benedict h. Uji biuret i. Uji ninhidrin Jarum ose Inkubator Spektrofotom Cawan petri Refrigerator Vortex, pipet Clean bench Paper disc Pinset, bunsen Tabung reaksi Aerator Lampu Pipet Tabung reaksi Pipet Tabung reaksi Pipet Tabung reaksi Pipet Tabung reaksi Pipet Tabung reaksi Pipet Tabung reaksi Pipet Tabung reaksi Pipet Tabung reaksi Pipet Tabung reaksi Penangas air Gelas piala Media NB
4 jenis biakan bakeri uji Media agar
4 jenis biakan bakteri uji Ekstrak sample terpilih
Ekstrak sampel terpilih Telur Artemia salina Akuades
Garam dapur
Ekstrak sampel terpilih Asam sulfat 2 N Pereaksi Dragendorff Pereaksi Meyer Pereaksi Wagner Ekstrak sampel terpilih Kloroform
Anhidrida asetat Asam sulfat pekat Ekstrak sampel terpilih Magnesium
Amil alkohol Alkohol
Ekstrak sampel terpilih HCl 2 N
Ekstrak sampel terpilih Etanol 70%
FeCl3 5%
Ekstrak sampel terpilih Asam sulfat pekat Pereaksi molisch Pereaksi benedict Ekstrak sampel terpilih Pereaksi biuret
Ekstrak sampel terpilih Pereaksi biuret
Ekstrak sampel terpilih Larutan ninhidrin 0,1%
3.3 Metode Penelitian
Penelitian ini beberapa tahap, yaitu koleksi dan karakerisasi, ekstraksi komponen bioaktif, uji aktivitas antibakteri, uji Minimum Inhibitory
Concentration (MIC), uji Brine Shrimp Lethality Test (BSLT) serta uji fitokimia. 3.3.1 Koleksi dan karakterisasi
Sarcophyton sp. yang difragmentasi pada kedalaman 12 m diambil pada
umur panen 10 bulan, sedangkan Sarcophyton sp. yang tidak difragmentasi diambil secara acak pada kedalaman 6-7 m di Perairan Pulau Pramuka, Kepulauan Seribu. Sampel ini diambil dengan Scuba Diving. Peta lokasi pengambilan sampel disajikan pada Lampiran 1. Karang lunak Sarcophyton sp. yang difragmentasi dan tidak difragmentasi masing-masing diambil sebanyak 300-500 g, kemudian dimasukkan ke dalam plastik tahan panas yang telah diberi metanol. Sampel tersebut ditransportasikan dalam keadaan dingin dengan menggunakan cool box yang diberi es. Sampel karang lunak yang telah sampai di laboratorium ditimbang masing-masing 100 g. Penimbangan ini bertujuan untuk menentukan rendemen dari ekstrak yang didapat. Sampel karang lunak diberi label, difoto dan dikarakterisasi.
3.3.2 Ekstraksi komponen bioktif sampel karang lunak Sarcophyton sp. (Quinn 1988 diacu dalam Gunawan 2007)
Ekstraksi komponen bioaktif pada Sarcophyton sp. menggunakan metode modifikasi Quinn (1988) diacu dalam Gunawan (2007). Pelarut yang digunakan dalam ekstraksi yaitu metanol, etil asetat, dan heksana. Perbandingan antara sampel dan masing-masing pelarut adalah 1:2 (b/v). Sampel karang lunak
Sarcophyton sp. sebanyak 100 g dipotong kecil-kecil lalu dilakukan maserasi.
Maserasi pertama kali dilakukan dalam pelarut metanol sebanyak 200 ml dengan waktu maserasi 24 jam, tujuannya agar komponen bioaktif pada
Sarcophyton sp. terlarut dalam pelarut. Penggunaan metanol (polar) di awal
ekstraksi karena sifat kepolaran pelarut sesuai dengan sifat tubuh karang lunak yang sebagian besar terdiri dari air.
Hasil maserasi disaring menggunakan kertas saring hingga diperoleh residu dan filtrat yang diinginkan. Residu sisa ekstraksi metanol dimaserasi kembali menggunakan etil asetat sebanyak 200 ml selama 24 jam, sedangkan
filtratnya dievaporasi hingga didapatkan pelarut dan ekstrak yang terpisah (ekstrak metanol). Hasil maserasi etil asetat kemudian disaring, residu yang dihasilkan dilarutkan dengan heksana sebanyak 200 ml dan dimaserasi selama 24 jam, sedangkan filtratnya dievaporasi hingga didapatkan pelarut dan ekstrak yang terpisah (ekstrak etil asetat). Hasil maserasi heksana kemudian disaring dan filtratnya dievaporasi (ekstrak heksana). Hasil ekstrak yang diperoleh dalam bentuk pasta (cair). Alur ekstraksi karang lunak Sarcophyton sp. dapat dilihat pada Gambar 8.
Gambar 8. Diagram alir ekstraksi komponen bioaktif karang lunak
Sarcophyton sp. (modifikasi Quinn 1988 diacu dalam Gunawan 2007
Keterangan : Bahan baku Proses Proses pendahuluan Ekstrak
Karang lunak Sarcophyton sp. 100 g
Maserasi 24 jam dengan metanol (200 ml)
filtrasi
Evaporasi Maserasi 24 jam dengan etil asetat (200 ml)
Maserasi 24 jam dengan heksana (200 ml) Evaporasi
metanol
etil asetat metanol
filtrasi
Maserasi 24 jam dengan heksana (200 ml) Evaporasi filtrasi heksana Filtrat 1 Residu Residu Residu Filtrat 1 Filtrat 2
3.3.3 Uji aktivitas antibakteri
Uji ini dilakukan terhadap ekstrak karang lunak Sarcophyton sp. yang difragmentasi dan tidak difragmentasi telah diekstrak. Tahapan dari uji ini meliputi persiapan media cair, persiapan media padat, persiapan suspensi bakteri dan prosedur uji aktivitas antibakteri. Bakteri uji yang digunakan antara lain
E. coli, S. aureus, P. aeruginosa, dan B. cereus. Bakteri E. coli dan P. aeruginosa
mewakili bakteri gram negatif, sedangkan bakteri S. aureus dan B. cereus mewakili bakteri gram positif. Pengujian aktivitas antibakteri dilakukan dengan metode difusi agar (Kirby-Bauer) menggunakan kertas cakram (paper disc). a) Persiapan media padat
Media padat yang digunakan adalah nurient agar (NA) dan Muller Hinton
agar (MHA). Media NA berfungsi untuk penyegaran bakteri, sedangkan media
MHA untuk pengujian aktivitas antibakteri. Media NA dibuat dengan melarutkan serbuk media NA (Difco) sebanyak 23% ke dalam akuades (b/v), kemudian dihomogenkan menggunakan hotplate hingga mendidih. Larutan NA dipipet sebanyak 9 ml, lalu dimasukan ke dalam tabung reaksi dan masing-masing tabung ditutup menggunakan kapas dan alumunium foil. Selanjutnya, media disterilisasi menggunakan otoklaf pada suhu 121 oC selama 15 menit. Media dimiringkan sekitar 45 derajat di dalam laminar (clean bench) asepik sampai agar membeku. Setelah membeku, media disimpan dalam refrigerator.
Media MHA dibuat dengan cara melarutkan 38% Muller Hinton (Oxoid) ke dalam akuades. Larutan tersebut dihomogenkan menggunakan hotplate pada suhu ± 100 oC. Larutan dipipet 20 ml, kemudian dimasukkan ke dalam tabung reaksi dan masing-masing tabung ditutup menggunakan kapas dan alumunium foil. Media yang akan digunakan sebelumnya disterilisasi terlebih dahulu dengan otoklaf pada suhu 121 oC selama 15 menit. Media didiamkan di laminar (clean bench) aseptik sampai agar membeku. Apabila media sudah membeku, media disimpan dalam refrigerator.
b) Persiapan media cair
Media cair yang digunakan untuk kultivasi bakteri adalah Nutrient Broth (NB). Nutrient Broth (Oxoid) sebanyak 13% dilarutkan dalam akuades (b/v), media tersebut dihomogenkan menggunakan hotplate pada suhu ±100 oC. Media
yang telah homogen dimasukan sebanyak 9 ml ke dalam tabung reaksi dan masing-masing tabung ditutup menggunakan kapas dan alumunium foil. Media tersebut disterilisasi dengan otoklaf pada suhu 121 oC selama 15 menit. Media didinginkan di tempat yang steril pada suhu ruang.
c) Persiapan suspensi bakteri
Sebanyak satu ose bakteri uji dimasukkan ke dalam media cair NB yang
telah dingin secara aseptik, kemudian diinkubasi pada suhu 37 oC selama 18-24 jam. Biakan bakteri yang telah diinkubasi tersebut diukur rapat optis atau
optical density (OD)nya dengan nilai antara 0,5-0,8 (Lalitha 2004) pada panjang
gelombang 600 nm.
d) Prosedur uji aktivitas antibakteri (Lay 1994 diacu dalam Noer dan Nurhayati 2006)
Tahap pertama pada uji aktivitas antibakteri ini adalah meneteskan ekstrak dengan konsentrasi 20.000 ppm pada setiap paper disc sebanyak 20 μl sehingga didapat konsentrasi eksrak per paper disc sebesar 300 μg, ekstrak dipipet 10 μl sebanyak dua kali untuk setiap paper disc dengan menggunakan pipet mikro.
Paper disc yang telah berisi ekstrak dibiarkan sampai mengering atau pelarutnya
menguap dalam clean bench steril. Contoh perhitungan penentuan konsentrasi ekstrak per disc disajikan pada Lampiran 2.
Tahap selanjutnya, sebanyak 20 ml media agar Muller Hinton dalam keadaan cair ditambahkan 20 μl bakteri uji yang telah diukur optical density (OD) dengan menggunakan pipet mikro. Media agar yang telah ditambahkan bakteri uji dihomogenkan dengan vortex, kemudian segera dituangkan ke dalam cawan petri steril dan digoyangkan membentuk angka delapan agar bakteri lebih menyebar secara merata atau dengan memutar cawan petri tersebut sampai semua bakteri dan media Muller Hinton tercampur merata. Media agar tersebut didiamkan dalam clean bench aseptik selama 15 menit atau sampai agar membeku.
Apabila media MHA tersebut telah membeku, masing-masing paper disc diletakkan dalam cawan petri berisi agar dan bakteri dengan menggunakan pinset yang telah disterilkan terlebih dahulu. Cawan tersebut kemudian diinkubasi dalam keadaan terbalik selama 18-20 jam dengan suhu 37 oC. Aktivitas antibakteri dapat dilihat dengan mengamati zona hambatan yang terbentuk di sekeliling paper disc. Antibakteri dikatakan positif jika terbentuk zona hambatan
berupa zona bening di sekeliling paper disc dan antibakteri negatif ditandai dengan tidak terbentuknya zona bening. Setelah diketahui diameter zona hambat yang terbentuk pada cawan petri, kemudian diukur lebarnya zona hambat yang terbentuk dengan menggunakan penggaris atau alat ukur yang lain. Besarnya diameter zona hambat diukur dengan cara mengurangi diameter zona hambat yang terbentuk pada cawan petri uji dengan diameter paper disc. Setelah diameter zona hambat diukur kemudian dilakukan proses dokumentasi terhadap hasil uji. Metode uji penapisan awal seyawa antibakteri dapat dilihat pada Gambar 9.
Gambar 9. Tahapan uji penapisan awal antibakteri (Lay 1994 diacu dalam Noer dan Nurhayati 2006)
Keterangan : Proses pendahuluan Proses Data
3.3.4 Uji Minimum Inhibitory Concentration (modifikasi Lopez et al. 1993) Uji Minimum Inhibitory concentration (MIC) dilakukan untuk mengetahui konsentrasi minimum dari ekstrak yang terpilih dalam menghambat aktivitas
Paper disc diberi ekstrak 20 μl konsentrasi 20.000 ppm
Paper disc yang telah berisi ekstrak dibiarkan sampai mengering atau pelarutnya menguap dalam clean bench
steril Inokulasi bakteri (20 µl) kedalam
20 ml media cair
Penghomogenan dengan vortex
Penuangan agar ke dalam cawan petri steril
Pendinginan selama 15 menit (sampai agar beku)
Paper disc diletakkan di cawan petri yang berisi bakteri uji
Inkubasi suhu 37 °C selama 18-20 jam dalam posisi terbalik
Pengamatan dan pengukuran zona bening
pertumbuhan dari bakteri uji. Beberapa tahapan dalam proses MIC, yaitu prekultur bakteri uji dan perhitungan MIC.
a) Prekultur bakteri uji
Prekutur dilakukan dengan cara mengambil biakan bakteri uji sebanyak 1 ose dan dimasukkan dalam media NB, kemudian diinkubasi dalam shaker bath pada suhu ruang dan diukur OD menggunakan spektrofotometer dengan λ=600 nm. Prekultur dilakukan bertujuan untuk mendapatkan suspensi bakteri uji dengan OD antara 0,5-0,8 (Lalitha 2004).
b) Perhitungan MIC
Ekstrak karang lunak hasil penapisan yang mempunyai aktivitas penghambatan yang cukup tinggi dilanjutkan dengan penentuan MIC. Metode yang digunakan adalah metode difusi agar. Caranya, yaitu menyiapkan cawan petri yang berisi medium agar yang telah diinokulasi dengan mikroorganisme yang masing-masing terdiri dari E. coli, S. aureus, P. aeruginosa, dan B. cereus menggunakan metode tuang. Sejumlah paper disc atau kertas cakram steril yang telah berisi zat antibakteri dengan konsentrasi berbeda-beda diletakkan diatas permukaan agar tersebut dan diinkubasi pada suhu 37 oC selama waktu 18 jam. Variasi konsentrasi ini bertujuan untuk melihat konsentrasi ekstrak terendah yang menghambat aktivitas pertumbuhan bakteri uji.
Ketika diinkubasi zat antimikroba akan terdifusi atau tersebar dari paper
disc atau kertas cakram steril yang telah berisi zat antibakteri dengan konsentrasi
yang berbeda-beda. Tiap paper disc diberi konsentrasi ekstrak kasar Sarcophyton sp. yang berbeda-beda dimulai dari konesntrasi yang rendah sampai tinggi dengan tujuan untuk mengetahui pada konsentrasi berapa bakteri uji dapat terhambat pertumbuhannya. Konsentrasi ekstrak kasar Sarcophyton sp. dan kloramfenikol (kontrol) pada uji MIC dapat dilihat pada Tabel 5.
Tabel 5. Konsentrasi ekstrak kasar Sarcophyton sp. dan kloramfenikol (kontrol) pada uji MIC (dalam satuan yang berbeda)
Konsentrasi ekstrak Sarcophyton sp. (ppm) Konsentrasi ekstrak Sarcophyton sp.
per paper disc (μg)
Konsentrasi kloramfenikol (ppm) Konsentrasi kloramfenikol per paper disc (μg) 24.000 21.000 18.000 15.000 12.000 9.000 2.000 200 480 420 360 300 240 180 40 4 24.000 21.000 18.000 15.000 12.000 9.000 2.000 200 480 420 360 300 240 180 40 4
3.3.5 Uji toksisitas dengan metode Brine Shrimp Lethality Test (BSLT) (Meyer et al. 1982, McLaughlin Rogers 1998 dan Carballo et al. 2002) Menurut Carballo et al. (2002), metode Brine Shrimp Lethality Test (BSLT) biasanya dilakukan dalam uji pendahuluan untuk penapisan aktivitas farmakologis pada produk alam. Diagram alir dari uji toksistas BSLT dapat dilihat pada Gambar 10.
Pada uji ini digunakan larva A. salina sebagai hewan uji. Mula-mula telur
A. salina diteteskan di dalam air laut di bawah lampu TL 40 watt selama 48 jam
Sebanyak 10 ekor larva A. salina dimasukkan ke dalam tabung reaksi, kemudian dimasukan larutan ekstrak sampel dengan konsentrasi masing-masing 10 ppm, 100 ppm dan 1000 ppm dan ditambahkan air laut buatan sampai volume 5 ml. Air laut buatan tanpa pemberian ekstrak (0 ppm) digunakan sebagai kontrol. Semua tabung reaksi diinkubasi pada suhu kamar selama 24 jam di bawah penerangan lampu TL 40 watt. Pengamatan dilakukan setelah 24 jam dengan menghitung jumlah A. salina yang mati pada tiap konsentrasi. Penentuan harga LC50 (ppm) dilakukan menggunakan analisis probit dan persamaan regresi. Tabel probit disajikan pada Lampiran 3. Bila masing-masing ekstrak yang diuji kurang dari 1000 μg/ml maka dianggap menunjukkan aktivitas biologik (Anderson 1991).
Gambar 10. Diagram alir uji toksisitas dengan A. salina (McLaughlin 1998) Keterangan : Bahan baku Proses
Data
3.3.6 Uji fitokimia (Harbone 1987)
Identifikasi senyawa kimia yang berperan sebagai antibakteri dalam ekstrak etil asetat Sarcophyton sp. yang difragmentasi dan tidak difragmentasi dilakukan terhadap senyawa-senyawa, yaitu alkaloid, steroid/triterpenoid, flavonoid, saponin, fenol hidrokuinon, molish, benedict, biuret, dan ninhidrin. (a) Alkaloid
Sejumlah sampel dilarutkan dalam beberapa tetes asam sulfat 2 N kemudian diuji dengan tiga pereaksi alkaloid, yaitu pereaksi Dragendorff, Meyer, dan Wagner. Hasil uji dinyatakan positif bila pereaksi Meyer terbentuk endapan putih kekuningan, endapan coklat dengan pereaksi Wagner, dan endapan merah sampai jingga dengan pereaksi Dragendorff.
LC50
Sebanyak 20 mg telur A. salina
Pemasukan dalam 500 ml air laut
Pencahayaan 48 jam (sampai menetas)
Pemasukan 10 ekor A. salina ke dalam tabung reaksi yang berisi 5 ml
air laut yang tercampur ekstrak 1000, 100, 10 ppm dan kontrol
Pencahayaan 24 jam
Pengamatan dan penghitungan A.salina yang mati
(b) Steroid/triterpenoid
Sejumlah sampel dilarutkan dalam 2 ml kloroform dalam tabung reaksi yang kering, lalu kedalamnya ditambahkan 10 tetes anhidrida asetat dan 3 tetes asam sulfat pekat. Terbentuknya larutan berwarna merah untuk pertama kali, kemudian berubah menjadi biru dan hijau menunjukkan reaksi positif.
(c) Flavonoid
Sejumlah sampel ditambah serbuk magnesium 0,1 mg dan 0,4 ml amil alkohol (campuran HCl 37% dan etanol 95% dengan volume sama) dan ditambahkan 4 ml alkohol kemudian campuran dikocok. Terbentuknya warna merah, kuning atau jingga pada lapisan amil alkohol menunjukkan adanya flavonoid.
(d) Saponin (uji busa)
Saponin dapat dideteksi dengan uji busa dalam air panas. Busa yang stabil selama 30 menit dan tidak hilang pada penambahan 1 tetes HCl 2 N menunjukkan adanya senyawa saponin.
(e) Fenol hidrokuinon (pereaksi FeCl3)
Sebanyak 1 g sampel diekstrak dengan 20 ml etanol 70%. Larutan yang
dihasilkan diambil sebanyak 1 ml kemudian ditambahkan 2 tetes larutan FeCl3 5%. Terbentuknya warna hijau atau hijau biru menunjukkan adanya
senyawa fenol dalam bahan. (f) Uji molisch
Sebanyak 1 ml larutan sampel diberi 2 tetes pereaksi molisch dan 1 ml asam sulfat pekat melalui dinding tabung. Uji positif yang menunjukkan adanya
karbohidrat ditandai oleh terbentuknya kompleks berwarna ungu diantara 2 lapisan cairan.
(g) Uji benedict
Larutan sampel sebanyak 8 tetes dimasukkan ke dalam 5 ml pereaksi benedict. Campuran dikocok dan dididihkan selama 5 menit. Terbentuknya warna hijau, kuning atau endapan merah bata menunjukkan adanya gula pereduksi.