KERAGAMAN, KISARAN INANG DAN EFISIENSI
PENULARAN
Bean common mosaic virus
DENGAN KUTUDAUN PADA TANAMAN
KACANG PANJANG
MELINDA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Keragaman, Kisaran Inang dan Efisiensi Penularan Bean common mosaic virus dengan Kutudaun pada Tanaman Kacang Panjang adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2013 Melinda NIM A352090051
RINGKASAN
MELINDA. Keragaman, Kisaran Inang dan Efisiensi Penularan Bean common mosaic virus dengan Kutudaun pada Tanaman Kacang Panjang. Dibimbing oleh TRI ASMIRA DAMAYANTI dan SRI HENDRASTUTI HIDAYAT
Bean common mosaic virus (BCMV) merupakan salah satu virus penting yang menginfeksi kacang panjang. Pada tahun 2008 ditemukan gejala mosaik kuning yang parah dan berbeda dari gejala BCMV pada umumnya pada pertanaman kacang panjang di Jawa Barat dan Jawa Tengah. Gejala mosaik kuning yang parah ini disebabkan oleh Bean common mosaic virus strain Blackeye Cowpea (BCMV-BlC) atau infeksi ganda BCMV-BlC dan Cucumber mosaic virus (CMV). Sampai saat ini belum banyak diketahui sifat-sifat BCMV-BlC pada kacang panjang, padahal informasi dasar suatu virus diperlukan untuk penentuan strategi pengendaliannya. Oleh karena itu penelitian ini bertujuan untuk mengetahui keragaman, kisaran inang dan efisiensi penularan BCMV-BlC dengan 3 spesies kutudaun.
Sampel daun dengan gejala mosaik kuning diambil dari pertanaman kacang panjang di 3 desa di Dramaga Bogor Jawa Barat yaitu Bubulak, Cangkurawok, dan Situgede serta 10 sampel daun dari beberapa daerah di Jawa Barat [Bogor (Bojong), Subang, Indramayu dan Cirebon] dan Jawa Tengah (Tegal, Klaten, Solo, Magelang, Sleman, dan Jogjakarta) koleksi Laboratorium Virologi Tumbuhan Proteksi Tanaman Fakultas Pertanian IPB. Sampel dideteksi secara serologi dengan antiserum BCMV, dan secara molekuler menggunakan primer spesifik gen coat protein (CP) BCMV. DNA hasil amplifikasi dirunut nukleotidanya dan dianalisis filogenetikanya. Uji kisaran inang terbatas dan penularan BCMV-BlC dengan tiga spesies kutudaun dilakukan menggunakan BCMV-BlC isolat Cangkurawok. BCMV-BlC diisolasi dengan cara diinokulasi pada tanaman indikator Chenopodium amaranticolor. Lesio Lokal (LL) yang muncul diambil dan diinokulasi berseri sebanyak 3 kali pada C. amaranticolor untuk memurnikan virus. LL hasil inokulasi terakhir diperbanyak pada tanaman kacang panjang kultivar Parade dan digunakan sebagai sumber inokulum dalam tiap pengujian. Uji kisaran inang dilakukan dengan menginokulasi BCMV-BlC secara mekanis pada 18 spesies tanaman dari 3 famili. Uji efisiensi penularan melalui kutudaun menggunakan 3 spesies kutudaun yaitu Aphis craccivora Koch, A. gossypii Glover dan A. glycines Matsumura dengan perlakuan jumlah kutudaun masing-masing 1, 3, 5, 7 dan 10. Uji kisaran inang dan efisiensi penularan BCMV-BlC dengan kutudaun menggunakan 15 tanaman tiap perlakuan. Parameter yang diamati pada kedua pengujian adalah masa inkubasi, tipe gejala dan kejadian penyakit. Selain pengamatan secara visual, BCMV-BlC pada tanaman uji dikonfirmasi dengan menggunakan metode Dot Immunobinding Assay (DIBA).
Hasil pengamatan gejala di lapangan menunjukkan ada 2 kelompok gejala. Kelompok gejala pertama menunjukkan gejala mosaik dengan mosaik berwarna hijau muda sampai kuning terang secara tidak merata (mosaik kuning berat), penebalan disekitar tulang daun berwarna hijau tua (vein banding), malformasi daun (daun menggulung seperti krupuk, mengerut sepanjang tulang daun), daun melepuh, dan terhambat pertumbuhannya. Kelompok gejala kedua yaitu daun
membentuk pola mosaik berwarna hijau muda sampai kuning (mosaik kuning sedang) dan penebalan disekitar tulang daun berwarna hijau tua (vein banding).
Hasil deteksi molekuler dengan RT-PCR berhasil mengamplifikasi DNA gen CP sebanyak 8 dari 13 isolat BCMV berukuran ~861 pb. Perunutan DNA berhasil merunut gen CP BCMV asal Cangkurawok, Cirebon, Subang, Tegal, Solo dan Sleman, namun tidak berhasil merunut BCMV isolat Bubulak dan Bojong. Analisis urutan nukleotida gen CP menunjukkan bahwa 4 isolat (Cangkurawok, Subang, Solo dan Sleman) memiliki homologi tertinggi dengan BCMV-BlC dari Taiwan, sedangkan 2 isolat (Cirebon dan Tegal) memiliki homologi tertinggi dengan BCMV-NL1 dari Inggris. Analisis filogenetika berdasarkan runutan nukleotida dan asam amino menunjukkan bahwa 4 isolat (Cangkurawok, Subang, Solo, dan Sleman) memiliki kekerabatan yang dekat dengan BCMV-BlC yang menginfeksi kacang panjang dari Taiwan, sedangkan 2 isolat (Cirebon dan Tegal) berdasarkan runutan nukleotida memiliki kekerabatan yang dekat dengan BCMV-NL1 yang menginfeksi buncis dari Inggris. Namun berdasarkan runutan asam amino isolat dari Cirebon dan Tegal memiliki kekerabatan yang dekat dengan BCMV-BlC Y yang menginfeksi kacang panjang dari Cina.
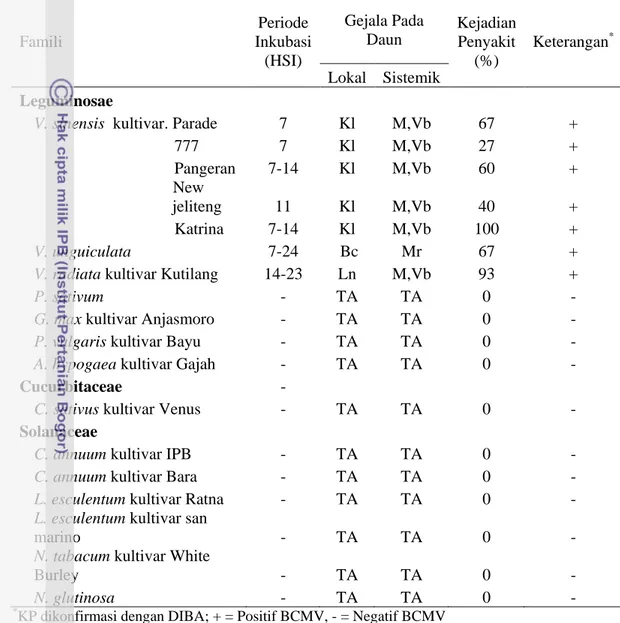
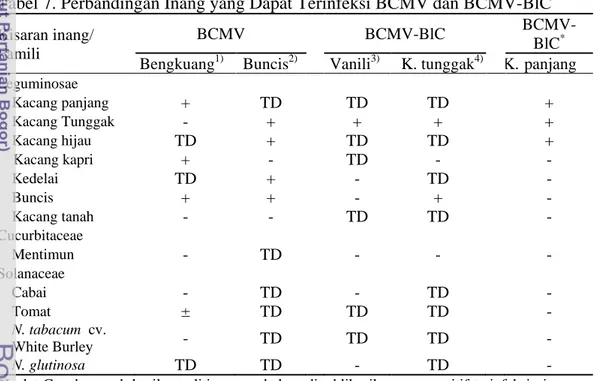
Berdasarkan uji kisaran inang, BCMV-BlC dapat menginfeksi kacang panjang (Vigna sinensis) kultivar Parade, 777, Pangeran, New Jeliteng dan Katrina, kacang tunggak (Vigna unguiculata) dan kacang hijau (Vigna radiata). Namun, BCMV-BlC tidak dapat menginfeksi kacang kapri (Pisum sativum), kedelai (Glycine max), buncis (Phaseolus vulgaris), kacang tanah (Arachis hypogaea), mentimun (Cucumis sativus), cabai (Capsicum annuum), tomat (Lycopersicon esculentum), tembakau (Nicotiana tabacum cv. White Burley dan N. glutinosa). Hal ini menunjukkan BCMV-BlC hanya menginfeksi Vigna spp.
Penularan BCMV-BlC menggunakan 3 spesies kutudaun menunjukkan bahwa A. craccivora, A. gossypii dan A. glycines dapat menjadi vektor BCMV-BlC. Diantara ketiga spesies kutudaun A. craccivora merupakan vektor yang sangat efisien menularkan BCMV-BlC karena dengan jumlah 1 ekor A. craccivora mampu menginfeksi tanaman dengan kejadian penyakit yang tinggi (53%) dibandingkan A. gossypii dan A. glycines dan efisiensinya mencapai 100% pada penularan dengan 10 ekor kutudaun. Secara umum semakin banyak kutudaun yang digunakan, semakin tinggi efisiensi penularan dan semakin berat gejala yang muncul. Selain itu penularan dengan spesies kutudaun yang berbeda menunjukkan variasi gejala yang berbeda.
Kata kunci : BCMV-BlC, keragaman genetik, kisaran inang, A. craccivora, A. gossypii, dan A. glycines
SUMMARY
MELINDA. Diversity, Host Range and Transmission Efficiency of Bean common mosaic virus by Aphids on Yard Long Beans. Supervised by TRI ASMIRA DAMAYANTI and SRI HENDRASTUTI HIDAYAT
Bean common mosaic virus (BCMV) is one of the important viruses infecting yard long beans. Severe yellow mosaic symptoms different from common symptoms of BCMV was observed in 2008 in several yard long bean growing areas in West Java and Central Java found. This severe yellow mosaic symptom is caused by Bean common mosaic virus Blackeye Cowpea strain (BCMV-BlC) or double infection of BCMV-BlC and Cucumber mosaic virus (CMV). Information on characters of BCMV-BlC on yard long beans in Indonesia is very limited, despite its importance for the determination of virus control strategy. Therefore this study aims to determine the diversity, host range and transmission efficiency of BCMV-BlC using 3 aphid species .
Leaf samples showing yellow mosaic symptoms were taken from yard long bean plants in 3 villages in Dramaga, Bogor, West Java i.e. Bubulak, Cangkurawok, and Situgede and 10 leaf samples from several areas in West Java [Bogor (Bojong), Subang, Indramayu and Cirebon], and Central Java (Tegal, Klaten, Solo, Magelang, Sleman, and Jogjakarta) collection of Plant Virology Laboratory, Department of Plant Protection, Faculty of Agriculture, IPB. Leaf samples were detected by serological using antiserum of BCMV and molecular method using specific primer for BCMV coat protein (CP). Amplified DNA products was then used for nucleotide sequencing followed by sequence allignment and phylogenetic tree analysis. Limited host range study and transmission of BCMV-BlC using three species of aphids was done for BCMV-BlC Cangkurawok isolates. BCMV-BlC isolated by inoculation on indicator plants Chenopodium amaranticolor. Local lesions (LL) were taken and inoculated serially to C. amaranticolor for 3 times to purify the virus. Finally, LL was inoculated on bean cultivar Parade and used as sources of inoculum for further test. A host range study was conducted by inoculating BCMV-BlC mechanically using 18 plant species from 3 families. Transmission efficiency test was done using 3 aphid species i.e. Aphis craccivora Koch, A. gossypii Glover and A. glycines Matsumura with treatment of aphids numbers (1, 3, 5, 7 and 10). Both host range and transmission efficiency studies was conduxted using 15 plants per treatment. Parameter for both studies includes incubation period, type of symptoms and disease incidence. In addition to visual observation, infection of BCMV-BlC on test plants was confirmed by using Dot ImmunobindingAssay (DIBA).
Based on field observations, the symptoms can be differentiated into 2 groups. The first group consist of those symptoms showing mosaic with light green to bright yellow unevenly (heavy yellow mosaic), vein banding, malformation of leaves (leaf curl like crackers, pucker along the veins), leaf blister, and stunted growth. The second group are those symptoms showing mosaic pattern of light green to yellow (medium yellow mosaic) and vein banding.
Molecular detection by RT-PCR are successfully amplified ~861 bp viral DNA from 8 out of 13 BCMV isolates. DNA analysis was able to allign sequence of BCMV collected from Cangkurawok, Cirebon, Subang, Tegal, Solo and Sleman,
but was unable to allign the sequence of BCMV isolates from Bubulak and Bojong. Further analysis showed that 4 BCMV isolates (Cangkurawok, Subang, Solo and Sleman) has the highest homology to BCMV-BlC from Taiwan, while 2 isolates (Cirebon and Tegal) has the highest homology to BCMV-NL1 from UK. Phyllogenetic analysis based on nucleotide and amino acid sequences showed that 4 isolates (Cangkurawok, Subang, Solo, and Sleman) were closely related to BCMV-BlC infected yard long bean from Taiwan. Two isolates (Cirebon and Tegal) were closely related to BCMV-NL1 that infects beans from UK based on nucleotide sequences, but they were closely related to BCMV-BlC Y that infects beans from China.
Host range study showed that BCMV-BlC was able to infect yard long bean (Vigna sinensis) cultivars Parade, 777, Pangeran, New Jeliteng and Katrina , cowpea (Vigna unguiculata) and mungbean (Vigna radiata). However, BCMV-BlC was unable to infect pea (Pisum sativum), soybean (Glycine max), French bean (Phaseolus vulgaris), peanut (Arachis hypogaea), cucumber (Cucumis sativus), hot pepper (Capsicum annuum), tomato (Lycopersicon esculentum), tobacco (Nicotiana tabacum cv. White Burley, and N. glutinosa). This host range study suggested that BMCV-BlC was limitedly infect Vigna spp.
Transmission study using 3 aphid species showed that A. craccivora, A. gossypii and A. glycines were able to transmit BCMV-BlC. Among the three aphid species A. craccivora is considered as the most efficient vector for BCMV-BlC. Single A. craccivora was capable to transmit the virus with the highest incidence (53%) compared to A. gossypii and A. glycines. Transmission efficiency reached 100% using 10 aphids. In general, the more aphids, the higher the efficiency of transmission and the more severe the symptoms. In addition, transmission using different species caused variations of symptoms.
Key words: BCMV-BlC, genes biodiversity, host range, A. craccivora, A. gossypii, and A. glycines
© Hak Cipta Milik IPB, tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini dalam bentuk apa pun tanpa izin IPB
KERAGAMAN, KISARAN INANG DAN EFISIENSI
PENULARAN
Bean common mosaic virus
DENGAN KUTUDAUN PADA TANAMAN
KACANG PANJANG
MELINDA
Tesis
sebagai salah satu syarat untuk mendapatkan gelar Magister Sains pada
Program Studi Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2013
Judul Tesis: Keragaman, Kisaran Inang dan Efisiensi Penularan Bean common
mosaic virus dengan Kutudaun pada Tanaman Kacang Panjang
Nama Melinda NIM A352090051 Disetujui Komisi Pembimbing Dr II Sri Hendrastuti H., MSc Ketua Anggota Diketahui
Ketua Program Studi Fitopatologi _H'\\lJNlllJ >-7 "'J~J('.u Pascasarjana
Dr Ir Sri Hendrastuti H., MSc
Judul Tesis: Keragaman, Kisaran Inang dan Efisiensi Penularan Bean common mosaic virus dengan Kutudaun pada Tanaman Kacang Panjang Nama : Melinda
NIM : A352090051
Disetujui Komisi Pembimbing
Dr Ir Tri Asmira Damayanti, MAgr Ketua
Dr Ir Sri Hendrastuti H., MSc Anggota
Diketahui
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, M.Sc.
Tanggal Ujian: 21 Juli 2013 Tanggal lulus: Ketua Program Studi Fitopatologi
Dr Ir Sri Hendrastuti H., MSc
Dekan Sekolah Pascasarjana
PRAKATA
Puji syukur kehadirat Allah Subhanahuwata’ala yang telah melimpahkan rahmat serta hidayahNya sehingga penulis dapat menyelesaikan tesis yang berjudul “Keragaman, Kisaran Inang dan Efisiensi Penularan Bean common mosaic virus dengan Kutudaun pada Tanaman Kacang Panjang”. Shalawat dan salam tercurah kepada Nabi Besar Muhammad Shalallahu Alaihi Wassalam beserta keluarga, sahabat dan para pengikutnya. Tesis ini dibuat untuk memenuhi syarat memperoleh gelar Magister Sains pada Program Studi Fitopatologi. Penelitian dilaksanakan dari bulan Maret 2011 sampai bulan Desember 2012.
Penulis mengucapkan terimakasih kepada orang tua, suami dan anakku tercinta serta keluarga besar yang telah sabar memberi perhatian, dukungan materi dan do`a selama penulis menempuh studi di IPB. Terimakasih kepada Dr. Ir. Tri Asmira Damayanti, M.Agr, selaku dosen pembimbing I, yang telah memberikan petunjuk, arahan dan bimbingannya dan Dr. Ir. Sri Hendrastuti Hidayat, MSc sebagai dosen pembimbing II sekaligus sebagai Ketua Program Studi Fitopatologi, Fakultas Pertanian, Institut pertanian Bogor yang telah memberikan ijin, petunjuk, arahan dan bimbingannya selama ini. Ucapan terimakasih juga disampaikan kepada NUFFIC AGRI-4 UNIPA yang telah membiayai penulis selama mengikuti program Pascasarjana di IPB.
Terimakasih penulis sampaikan pula kepada Bapak Edi Supardi sebagai teknisi laboratorium Virologi Tumbuhan Departemen Proteksi Tanaman IPB yang banyak memberi masukan dan motivasi selama penulis melaksanakan penelitian, serta Pak Saefudin dan pak Ahmad yang banyak membantu penulis selama penelitian di rumah kaca Cikabayan. Tidak lupa penulis ucapan terimaksih kepada teman-teman di laboratorium Virologi Tumbuhan Departemen Proteksi Tanaman IPB yang tidak dapat penulis sebutkan satu per satu atas segala ilmu dan keceriaan yang diberikan.
Semoga karya ilmiah ini dapat memberikan manfaat.
Bogor, Juli 2013
DAFTAR ISI
DAFTAR TABEL DAFTAR GAMBAR DAFTAR LAMPIRAN PENDAHULUAN 1 Latar Belakang 1 Tujuan Penelitian 2 Manfaat Penelitian 2 Hipotesis 2 TINJAUAN PUSTAKA 3Tanaman Kacang Panjang (Vigna sinensis ssp sesquipedalis) 3
Asal, Penyebaran dan Klasifikasi 3
Morfologi dan Syarat Tumbuh 3
Penyakit Mosaik Kacang Panjang 4
Penyebab Penyakit, Gejala, Penularan dan Morfologi 4
Penyakit Mosaik Kuning dan Sebarannya 4
Deteksi Protein dan Asam Nukleat Virus 5
BAHAN DAN METODE 7
Tempat dan Waktu 7
Metode Penelitian 7
Pengambilan Tanaman Sakit dan Kutudaun 7
Deteksi Sampel dari Lapangan dengan Metode I-ELISA 7
Deteksi BCMV dengan Teknik RT-PCR 8 Ekstrasi RNA total 8
Sintesis cDNA 8
Amplifikasi DNA dengan PCR 9
Elektroforesis 9
Perunutan dan Penyejajaran DNA 9
Isolasi dan Propagasi BCMV-BIC 9
Uji Kisaran Inang 10
Identifikasi dan Perbanyakan Kutudaun 10
Penularan BCMV-BIC dengan Kutudaun 11
Parameter Pengamatan 11
Deteksi BCMV-BIC dengan Metode DIBA 11
HASIL DAN PEMBAHASAN 13
Gejala Mosaik Kuning pada Tanaman Kacang Panjang 13
Deteksi Molekuler dan Perunutan DNA BCMV 14
Analisis Basa Nukleotida dan Asam Amino Gen Protein Selubung BCMV 15
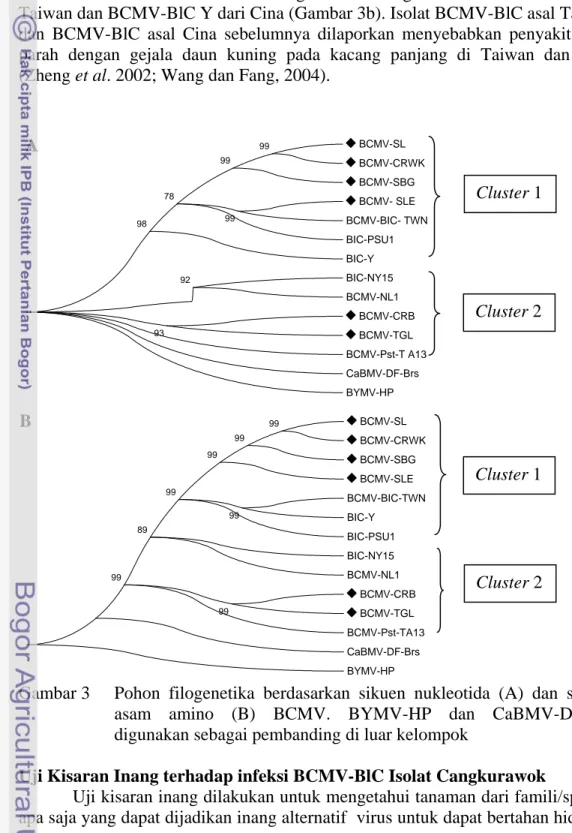
Filogenetika Berdasarkan Runutan Basa Nukleotida dan Asam Amino Gen Protein Selubung BCMV 18
Uji Kisaran Inang Terhadap Infeksi BCMV-BlC Isolat Cangkurawok 19
Efisiensi Penularan BCMV-BlC dengan 3 Spesies Kutudaun 22
SIMPULAN 25
DAFTAR PUSTAKA 26
DAFTAR TABEL
1 Tipe gejala dan hasil deteksi BCMV menggunakan metode RT-PCR 14 2 Hasil perunutan basa nukleotida gen CP beberapa isolat BCMV dari
tanaman kacang panjang dan % homologinya dengan isolat BCMV
dari Genbank 15
3 Homologi nukleotida BCMV asal Jawa Barat dan Jawa Tengah
terhadap BCMV asal negara lain 16 4 Homologi asam amino BCMV asal Jawa Barat dan Jawa Tengah
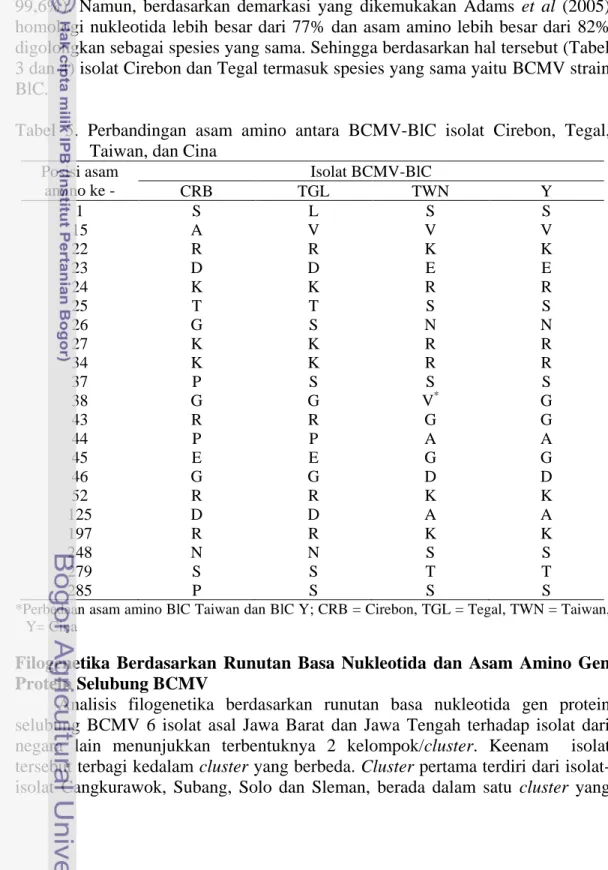
terhadap BCMV asal negara lain 17 5 Perbandingan asam amino antara BCMV-BlC isolat Cirebon, Tegal,
Taiwan, dan Cina 18 6 Hasil uji penularan BCMV-BlC secara mekanis dan deteksi DIBA
pada uji kisaran inang 20 7 Perbandingan inang yang dapat terinfeksi BCMV dan BCMV-BlC 21 8 Penularan BCMV-BlC isolat Cangkurawok dengan 3 spesies
kutudaun 22
DAFTAR GAMBAR
1 Tipe gejala kelompok 1 yaitu: a. Mosaik kuning berat; b. Mosaik kuning sedang; c. Malformasi daun (mengerut); d. rugos. Tipe gejala
kelompok 2 yaitu: e, g, dan h. Mosaik kuning sedang; f. Mosaik
kuning ringan 13
2 Pita DNA hasil amplifikasi dengan primer spesifik gen CP BCMV (BCMV-F/BCMV-R) pada gel agarosa 1 %. M = Penanda DNA 100 pb, DNA sampel asal; 1. Situgede, 2. Cangkurawok, 3. Bubulak, 4. Bojong, 5. Subang, 6. Indramayu, 7. Cirebon, 8. Tegal, 9. Klaten, 10. Solo, 11. Magelang, 12. Jogjakarta, 13. Sleman; K- = Kontrol negatif (air), K+ = Kontrol positif 15 3 Pohon filogenetika berdasarkan sikuen nukleotida (A) dan sikuen
asam amino (B) BCMV. BYMV-HP dan CaBMV-DF-Brs
digunakan sebagai pembanding di luar kelompok 19 4 Gejala BCMV-BlC pada kacang panjang. Daun sehat (A), Variasi
gejala BCMV yang ditularkan oleh A. craccivora (B1-3). A. gossypii (C1-3) dan A. glycines (D1-3). Tipe gejala 1-3 berturut-turut yaitu, mosaik, penebalan tulang daun (vein banding) dan malformasi daun 23
DAFTAR LAMPIRAN
1 Runutan basa nukleotida gen CP BCMV asal Cangkurawok, Tegal, Taiwan dan Cina. Tanda * (bintang) menunjukkan basa nukleotida yang identik. Huruf yang diberi warna merah menunjukkan
perbedaan runutan basa nukleotida antara isolat Taiwan dan Cina 28 2 Runutan asam amino gen CP BCMV asal Cangkurawok, Tegal,
Taiwan dan Cina. Tanda * (bintang) menunjukkan asam amino yang identik. Tanda titik satu (.) menunjukkan salah satu dari isolat berbeda. Tanda titik dua (:) menunjukkan terdapat dua isolat yang sama. Huruf yang diberi warna merah menunjukkan perbedaan
runutan asam amino antara isolat Taiwan dan Cina 30
1
PENDAHULUAN Latar Belakang
Tanaman kacang panjang (Vigna sinensis ssp. sesquipedalis) merupakan komoditas strategis hortikultura yang bernilai ekonomi tinggi. Sebagai komoditas sayuran, kacang panjang memiliki kriteria sebagai sumber pangan yang dapat tersedia dan terjangkau oleh daya beli semua lapisan masyarakat, mampu meningkatkan pendapatan petani (Duriat 1998) serta cukup memenuhi asupan gizi yang diperlukan oleh tubuh. Kandungan gizi yang terdapat pada kacang panjang terdiri dari protein, lemak, mineral, karbohidrat, kalsium, fosfor, besi, vitamin B1, B2 dan C3 (Pitojo 2006).
Berdasarkan data Badan Pusat Statistik (2011) produksi kacang panjang di Indonesia pada tahun 2010 mencapai 489.449 ton dan pada tahun 2011 menurun menjadi 458.307 ton. Produksi tanaman kacang panjang yang belum optimal ini dapat disebabkan oleh banyak faktor. Salah satu faktor pembatas dalam produksi tanaman yaitu gangguan beberapa penyakit tanaman. Penyakit yang umum ditemukan pada pertanaman kacang panjang diantaranya adalah layu (Fusarium oxysporum f.sp phaseoli), antraknosa (Colletotrichum lindemuthianum Sacc et Magn), mosaik yang disebabkan oleh Bean common mosaic virus (BCMV), Bean yellow mosaic virus (BYMV), Cowpea aphid-borne mosaic virus (CabMV), daun kecil kacang panjang (Cowpea witches-broom virus) dan puru akar (Meloidogyne sp) (Siregar 1996; Anwar et al. 2005; Lazuardi 2005; Haryanto et al. 2010).
Pada tahun 2008-2009, Damayanti et al. (2009) melaporkan kejadian penyakit mosaik kuning kacang panjang yang meluas di beberapa daerah pantai Utara Jawa Barat. Informasi serangan organisme pengganggu tanaman ini awalnya disampaikan oleh Dr. Ir. Suryo Wiyono, anggota Komisi Perlindungan Tanaman (KPT) pada pertemuan KPT di Bogor pada bulan November 2008. Hasil pemantauan Direktorat Perlindungan Tanaman Hortikultura pada bulan-bulan berikutnya dan laporan beberapa Unit Pelaksana Teknis Balai Proteksi Tanaman Pangan dan Hortikultura (UPTD-BPTPH) mengindikasikan bahwa penyakit ini telah menyebar ke berbagai lokasi di Jawa Barat (Bekasi, Karawang, Subang, Purwakarta, Bogor), Jawa Tengah (Brebes, Tegal), D.I. Yogyakarta (Sleman, Muntilan), dan Banten (Tangerang) (Mulyaman 2010). Tanaman yang terinfeksi akan menunjukkan gejala mosaik, penghambatan pertumbuhan dan malformasi daun. Infeksi pada tanaman yang masih muda bisa menyebabkan tidak terbentuknya polong dan jika infeksinya sangat parah bisa mengakibatkan kematian (Damayanti et al. 2009).
Identifikasi penyebab penyakit mosaik kuning pada kacang panjang tersebut telah dilakukan oleh beberapa peneliti, walaupun belum ada kesimpulan akhir yang dapat ditetapkan (Mulyaman 2010). Damayanti et al. (2009) melaporkan bahwa salah satu virus yang berasosiasi dengan gejala mosaik kuning pada tanaman kacang panjang yang berasal dari Bubulak, Dramaga Bogor dan Sidorejo, Karanganyar Pekalongan adalah Bean common mosaic virus strain Blackeye Cowpea (BCMV-BlC).
BCMV dapat ditularkan melalui beberapa cara yaitu secara mekanis, melalui kutudaun secara non-persisten, melalui benih dan serbuk sari. Gejala
2
infeksi virus pada tanaman umumnya muncul 7 sampai 10 hari setelah inokulasi. Tipe gejala yang ditimbulkan ditentukan oleh strain virus, suhu lingkungan pertanaman dan genotipe inang. Beberapa strain BCMV yang telah diketahui yaitu Blackeye Cowpea (BlC), US1, US5, NL1, NL2, NL3, NL4, NL5, NL6, NL7 dan NL8. Inang utama BCMV tidak terbatas pada spesies Phaseolus vulgaris, Vigna unguiculata, dan V. radiata namun dapat menginfeksi inang dari famili Leguminosae lainnya (Morales dan Bos 1988).
Virus mosaik kuning ditularkan secara non-persisten oleh Aphis craccivora, dengan efisiensi penularan mencapai 100% (Damayanti et al. 2009). Spesies kutudaun lainnya yang dapat menjadi vektor BCMV selain A. craccivora adalah Acyrthosiphon pisum, A. fabae, Myzus persicae, A. gossypii, A. medicaginis, A. rumicis, Hyalopterus atriplicis, Macrosiphum ambrosiae, M. pisi dan M. solanifolii. Spesies-spesies kutudaun tersebut menularkan BCMV secara nonpersisten (Morales dan Bos 1988).
Sampai saat ini belum tersedia informasi terkait keragaman genetik dan strain BCMV asal Indonesia yang menginfeksi kacang panjang. Sehingga kajian terkait hal ini perlu dilakukan untuk memperkaya pengetahuan tentang BCMV di Indonesia dan informasi dasar ini dapat digunakan sebagai landasan penentuan pengendaliannya.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengidentifikasi keragaman BCMV pada tanaman kacang panjang di beberapa daerah di Jawa Barat dan Jawa Tengah, mengetahui kisaran inang Bean common mosaic virus strain Blackeye Cowpea (BCMV-BlC) dan mempelajari efisiensi penularan BCMV-BlC melalui 3 spesies kutudaun.
Manfaat Penelitian
Penelitian diharapkan dapat memberikan informasi tentang keragaman genetik BCMV, kisaran inang dan efisiensi penularan BCMV-BlC dengan tiga spesies kutudaun yang berguna bagi landasan penentuan strategi pengendalian penyakit mosaik kuning kacang panjang.
Hipotesis
1. Terdapat keragaman gen protein selubung BCMV pada tanaman kacang panjang dengan gejala mosaik kuning di Jawa Barat dan Jawa Tengah.
2. Beberapa spesies tanaman uji dapat menjadi inang alternatif BCMV-BlC. 3. Salah satu spesies kutudaun dapat menjadi vektor yang paling efisien
menularkan BCMV-BlC.
4. Semakin banyak kutudaun, kejadian penyakit semakin tinggi.
5. Ada hubungan antara spesies kutudaun yang menularkan BCMV-BlC dan gejala
3
TINJAUAN PUSTAKA
Tanaman Kacang Panjang
Asal, Penyebaran dan Klasifikasi
Tanaman kacang panjang bukan merupakan tanaman asli Indonesia, melainkan berasal dari India dan Afrika Tengah. Kacang panjang menyebar ke daerah-daerah Asia Tropika sehingga banyak dikenal jenis-jenis lokal sesuai dengan kondisi lingkungan tempat tumbuhnya. Berbagai jenis lokal hasil seleksi petani secara tradisional banyak ditemukan di Indonesia. Sentra penanaman kacang panjang di Indonesia terdapat di Jawa Barat, Jawa Tengah, Jawa Timur, Sulawesi Selatan, Aceh, Sumatra Utara, Lampung dan Bengkulu (Rukmana 1995).
Berdasarkan kekerabatannya dalam dunia tumbuhan, tanaman kacang panjang dapat diklasifikasikan dalam Divisi Spermatophyta, SubDivisi Angiospermae, Kelas Dicotyledon, Ordo Rosales, Famili Papilionaceae, Genus Vigna dan Spesies Vigna sinensis ssp. sesquipedalis.
Morfologi dan Syarat Tumbuh
Kacang panjang merupakan tanaman perdu semusim yang tumbuhnya merambat atau menjalar. Daunnya berupa daun majemuk, tersusun atas tiga helai. Batangnya liat dan sedikit berbulu. Akarnya mempunyai bintil yang dapat mengikat nitrogen (N) bebas dari udara yang bermanfaat untuk menyuburkan tanah. Bunga kacang panjang berbentuk kupu-kupu dan dapat menyerbuk sendiri. Kemungkinan 10% penyerbukan silang dengan serangga dapat terjadi. Tidak setiap bunga dapat menjadi buah. Buah kacang panjang berbentuk polong bulat panjang dan ramping (Haryanto et al. 2010).
Tanaman ini memiliki dedaunan yang rapat namun agak tinggi dan ramping, cocok untuk dijadikan sisipan dengan tanaman-tanaman sayuran yang lebih kecil. Pada umumnya tanaman yang termasuk kacang-kacangan merupakan tanaman yang baik untuk pola pergiliran tanam setelah mentimun, bawang-bawangan atau terung-terungan karena tanaman ini dapat memperbaiki kesuburan tanah (Duriat 1998).
Tanaman kacang panjang tumbuh dan berproduksi dengan baik di dataran rendah dan dataran tinggi ± 1500 m dpl, tetapi yang paling baik di dataran rendah karena banyak menggunakan tanah-tanah marginal. Penanaman di dataran tinggi umumnya memiliki umur panen yang relatif lama dari waktu tanam, tingkat produksi maupun produktivitasnya lebih rendah bila dibandingkan dengan dataran rendah. Ketinggian optimumnya adalah kurang dari 800 m di atas permukaan laut. Suhu ideal untuk pertumbuhan tanaman kacang panjang antara 20-30 oC dengan iklim kering dan curah hujan antara 600-1.500 mm/tahun. Tumbuh baik pada tempat terbuka (mendapat sinar matahari penuh). Hampir semua jenis tanah cocok untuk budidaya kacang panjang, tetapi yang paling baik adalah tanah lempung berpasir, subur, gembur, banyak mengandung bahan organik (Rukmana 1995).
4
Penyakit Mosaik Kacang Panjang Penyebab Penyakit, Gejala, Penularan dan Morfologi
Penyakit mosaik pada tanaman kacang-kacangan merupakan penyakit yang disebabkan oleh virus yang dikenal dengan nama Bean common mosaic virus (BCMV). Virus ini umumnya menginfeksi tanaman kacang-kacangan seperti pada buncis (Phaseolus vulgaris), kacang tunggak (Vigna unguiculata), kacang hijau (V. radiata) dan dari famili Leguminosae lainnya (Morales dan Bos 1988).
Tanaman yang terinfeksi menunjukkan gejala utama mosaik dan nekrosis. Tulang daun berwarna hijau tua sedangkan daerah interveinal menjadi hijau muda. Adanya perubahan warna daun biasanya diikuti dengan malformasi daun berupa kerutan dan menggulung. Tipe gejala yang ditimbulkan ditentukan oleh strain virus itu sendiri, suhu lingkungan pertanaman dan genotipe inang. Virus dapat terbawa oleh benih dan serbuk sari, ditularkan secara mekanis dan melalui serangga vektor kutudaun (Galvez 1980; Morales dan Bos 1988).
BCMV termasuk famili Potyviridae dan genus Potyvirus. Partikel virus berbentuk batang lentur dengan panjang 750 nm dan lebar 12-15 nm. Tipe asam nukleatnya utas tunggal (single strand) RNA (ss-RNA). Kandungan asam nukleat dalam partikel virus sebesar 5% sedangkan kandungan protein dalam coat protein sebesar 95%. Kestabilan virus dalam sap tergantung strain virus dan waktu infeksi. Virus ini mempunyai titik panas inaktivasi 50-60oC, titik batas pengenceran 10-3-10-4 dan ketahanan in vitro virus 1-4 hari pada suhu ruang (Morales dan Bos 1988; ICTVdB 2006).
Penyakit Mosaik Kuning dan Sebarannya
Pada pertengahan tahun 2008 telah terjadi outbreak penyakit mosaik kuning pada kacang panjang di Jawa Barat dan Jawa Tengah dengan insiden penyakit mencapai 80-100%. Setelah diidentifikasi diketahui bahwa penyebab mosaik kuning pada kacang panjang adalah Bean common mosaic virus strain Blackeye Cowpea (BCMV-BlC) secara tunggal atau infeksi ganda BCMV-BlC dengan Cucumber mosaic virus (CMV). Gejala awal pada daun yaitu muncul bercak kuning, lalu meluas dan pada akhirnya seluruh daun menguning, mengering dan tanaman mati. Polong tanaman yang terinfeksi juga menunjukkan gejala yang sama (Damayanti et al. 2009).
Infeksi virus pada tanaman secara umum dapat menyebabkan gangguan fisiologis dan metabolisme tanaman seperti aktifitas fotosintesis menurun karena jumlah klorofil berkurang, nitrogen terlarut berkurang akibat sintesis virus yang cepat dan karbohidrat dalam jaringan tanaman menurun sehingga menimbulkan gejala mosaik (Hull 2002). Menurut Agrios (2005) penyakit tumbuhan yang disebabkan oleh virus dapat menyebabkan kerusakan pada daun, batang, akar buah, biji atau bunga dan menimbulkan kerugian ekonomi dengan menurunnya hasil dan kualitas produk tumbuhan. Kerugian hasil yang diakibatkan oleh suatu penyakit terlihat dari luas serangan, serta intensitas serangan pada suatu area. Berdasarkan nilai kerugian hasil tersebut kita dapat mengetahui arti penting suatu penyakit pada suatu lahan.
Pada tanaman kacang panjang sebaran penyakit yang disebabkan oleh virus mosaik di musim hujan lebih rendah dibandingkan pada musim kemarau. Hal ini mungkin disebabkan karena pada musim kemarau jumlah populasi serangga
5 vektor lebih banyak dibandingkan pada musim hujan, sehingga penyebaran penyakit dapat terjadi secara cepat (Lazuardi 2005).
Deteksi Protein dan Asam Nukleat Virus
Serologi merupakan salah satu pengujian berdasarkan sifat–sifat protein virus. Pada mulanya, uji serologi ini dimanfaatkan dalam identifikasi patogen yang menyerang manusia dan hewan. Namun, sejak Beale pada tahun 1928 berhasil menemukan pembentukan antibodi khas untuk Tobacco mosaic virus (TMV), uji serologi ini juga dimanfaatkan untuk diagnosis patogen tanaman. Saat ini, uji serologi sudah menjadi standar identifikasi virus pada laboratorium virologi (Wahyuni 2005).
DIBA (Dot-Immunobinding Assay) dan ELISA (Enzyme-Linked Immunosorbent Assay) merupakan dua dari beberapa teknik uji serologi yang digunakan untuk mendeteksi virus dalam konsentrasi yang rendah. Teknik ini memerlukan sejumlah reagen yang berfungsi untuk mendukung terjadinya reaksi antibodi dengan antigen. Dalam metode ini antiserum dikonjugasikan dengan enzim, sehingga bila ditambahkan substrat enzim maka kompleks antigen-antibodi dalam jumlah yang sedikit saja dapat tervisualisasi. Substrat pengikat antigen-antibodi yang digunakan dalam DIBA adalah membran nitroselulosa. Antigen yang dideteksi oleh antibodi spesifik akan divisualisasikan menjadi warna nila atau ungu oleh enzim penghidrolisis kompleks antigen-antibodi yang sudah terikat oleh membran nitroselulosa. Waktu yang diperlukan dalam pengerjaan lebih singkat namun peneraan intensitas warna yang terjadi pada membran akan relatif sekali karena belum ada alat yang dapat mengkonversi intensitas warna menjadi angka (Djikstra et al. 1998 dan Wahyuni 2005).
ELISA telah banyak mengalami modifikasi sejak pertama kali teknik ini diperkenalkan. Ciri utama ELISA adalah digunakannya enzim (alkalin fosfatase atau peroksidase) untuk reaksi imunologi. ELISA digunakan pertama kali pada tahun 1969 untuk deteksi virus. Ikatan kovalen antara molekul imunoglobulin dan enzim dapat digunakan untuk mengamplifikasi reaksi antigen-antibodi. Penemuan ini telah membawa dampak yang sangat besar dalam meningkatkan daya deteksi serologi. Pada virus tumbuhan, ELISA pertama kali digunakan pada tahun 1977. ELISA telah digunakan untuk mendeteksi antigen yang berasal dari tanaman seperti virus tumbuhan, mikoplasma (MLO), bakteri dan jamur (Bos 1990).
Teknik ELISA ada 2 macam, yaitu ELISA langsung (direct- ELISA, misalnya Double antibody sandwich, DAS) dan tidak langsung (indirect -ELISA). Teknik ini mempunyai kelebihan yaitu dapat mengidentifikasi banyak sampel sekaligus dengan biaya yang relatif murah dan cepat dilakukan. Polysterene microtiter plate selain sebagai wadah, sekaligus juga sebagai substrat pengikat antigen-antibodi karena permukaannya mempunyai molekul-molekul yang bermuatan positif. Teknik ini memerlukan sejumlah reagen yang berfungsi untuk mendukung terjadinya reaksi antibodi dengan antigen. Jenis antibodi yang digunakan untuk mendeteksi sampel dapat berupa antibodi monoklonal atau antibodi poliklonal (Wahyuni 2005). Perbedaan kedua metode tersebut adalah pada direct-ELISA, enzim konjugat terdapat pada molekul immunoglobulin pertama yang langsung beraksi dengan antigen. Pada indirect-ELISA, enzim konjugat terdapat pada molekul immunoglobulin kedua yang beraksi dengan antiserum (Crowther 1996; Djikstra dan De Jegger 1998).
6
Pada saat ini deteksi asam nukleat (DNA atau RNA) lebih populer digunakan sebagai metode deteksi molekuler yang lebih sensitif untuk mengidentifikasi patogen secara umum. Deteksi molekuler merupakan metode deteksi yang didasarkan pada sifat asam nukleat. Bila sampel asam nukleat virus berupa DNA, teknik amplifikasinya disebut Polymerase Chain Reaction (PCR). Bila sampel berupa RNA, tekniknya disebut Reverse Transcriptase- Polymerase Chain Reaction (RT-PCR) karena RNA harus ditranskripsi balik (reverse transcription) menjadi DNA sebelum digunakan sebagai templat untuk diamplifikasi (Agrios 2005; Wahyuni 2005).
RT-PCR sangat berguna untuk mengamplifikasi RNA virus atau viroid yang konsentrasinya sangat sedikit dalam tumbuhan. Genom RNA virus dengan bantuan enzim reverse transcriptase akan ditranskripsi balik sehingga diperoleh molekul complementary DNA (cDNA) dan selanjutnya digunakan sebagai cetakan dalam proses PCR. Hasil RT-PCR sangat berguna untuk mendeteksi ekspresi gen, amplifikasi RNA sebelum dilakukan kloning dan analisis, maupun untuk diagnosis agensia infektif maupun penyakit genetik (Yuwono 2006; Wahyuni 2005).
PCR merupakan suatu metode enzimatis untuk melipatgandakan secara eksponensial suatu sekuen nukleotida secara in vitro. Metode PCR sangat sensitif, sehingga mampu mendeteksi DNA dalam jumlah yang sangat sedikit. Empat komponen utama dalam proses PCR adalah (1) DNA cetakan yaitu fragmen DNA yang akan dilipatgandakan, (2) oligonukleotida primer yaitu suatu sekuen oligonukleotida pendek yang digunakan untuk mengawali sintesis rantai DNA, (3) deoksiribonukleotida trifosfat (dNTP), terdiri atas dATP, dCTP, dGTP, dTTP, dan (4) enzim Taq DNA polimerase yaitu enzim yang melakukan katalis reaksi sintesis rantai DNA. Komponen lain yang juga penting adalah senyawa bufer.
Amplikasi DNA dimulai dengan denaturasi DNA templat/cetakan pada suhu 95 ºC selama 1-2 menit sehingga DNA yang untai ganda (double stranded) akan terpisah menjadi untai tunggal. Tahap kedua adalah penempelan (annealing) primer pada DNA cetakan pada suhu 56 ºC selama 1 menit. Primer akan membentuk ikatan hidrogen dengan cetakan pada daerah sekuen yang komplementer dengan sekuen primer. Tahap ketiga adalah sintesis DNA pada suhu 72 ºC selama 1-2 menit. Pada suhu ini akan terbentuk DNA baru berdasarkan informasi yang ada pada DNA cetakan dengan bantuan enzim DNA polimerase. Ketiga tahapan tersebut diulangi 25-34 siklus. Setelah PCR suhu menjadi 4 ºC (Djikstra dan De Jegger 1998).
7
BAHAN DAN METODE
Tempat dan Waktu
Penelitian dilaksanakan di Laboratorium Virologi Tumbuhan dan rumah kaca Kebun Percobaan Cikabayan Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor mulai bulan Maret 2011- Mei 2013.
Metode Penelitian Pengambilan Tanaman Sakit dan Kutudaun
Tanaman bergejala mosaik kuning didapat dari 3 lokasi penanaman kacang panjang di Bogor yaitu di daerah Cangkurawok, Bubulak dan Situgede. Dari masing-masing lokasi diambil 20 sampel daun yang menunjukkan gejala mosaik kuning. Sampel daun sakit juga diperoleh dari koleksi Laboratorium Virologi IPB yang berasal dari Bojong, Subang, Indramayu, Cirebon, Tegal, Klaten, Solo, Magelang, Sleman dan Jogjakarta
Kutudaun A. craccivora, A. glycines, dan A. gossypii diperoleh berturut-turut dari pertanaman kacang panjang di Cangkurawok Dramaga, cabai di sekitar lingkungan rumah kaca Cikabayan IPB dan kedelai di Leuwikopo.
Deteksi Sampel dari Lapangan dengan Metode I-ELISA
Sampel dari lapangan dideteksi secara serologi dengan metode I-ELISA.
Jika dari hasil deteksi serologi menunjukkan hasil positif terhadap lebih dari satu antisera, maka akan dilakukan isolasi virus dengan menginokulasi virus ke tanaman indikator. Antiserum yang digunakan untuk pengujian ini yaitu BCMV, CMV dan Potyvirus (Agdia, USA). Daun sakit dari masing-masing lapangan diambil sebanyak 0,01 g kemudian digerus dalam 1 ml ekstrak bufer pH 9.6 (1.59 g Na2CO5, 0.293 g NaHCO3, 0.20 g NaN3 yang dilarutkan dalam 1 L air steril) dengan perbandingan 1:100 (b/v). Sap tanaman yang telah digerus dimasukkan pada sumuran ELISA sebanyak 100 µl kemudian diinkubasi semalam pada suhu 4 o
C. Setelah diinkubasi semalam, sampel kemudian dicuci 8x dengan bufer 1x PBST (Phosphate buffer saline tween-20). Tiap sumuran selanjutnya diisi dengan 100 µl antiserum pertama (1: 200) dalam conjugate buffer yaitu bufer ECI pH 7.4 (2 g bovine serum albumin, 20 g polyvinylpyrrolidone/PVP 40.000, 0.2 g NaN3 yang dilarutkan dalam 1 L air steril), dan diinkubasi selama 2 jam pada suhu 37 o
C. Selanjutnya sumuran ELISA dicuci kembali dengan bufer 1x PBST sebanyak 5x.
Sumuran plat yang telah dicuci kemudian diisi dengan 100 µl enzim konjugat RaM-AP (Rabbit antimouse IgG-Alkaline Phosphatase) dalam ECI buffer dengan perbandingan 1:200 dan diinkubasi selama 1 jam pada suhu ruang. Selanjutnya sumuran ELISA dicuci kembali dengan bufer 1x PBST sebanyak 5 kali. Setelah dicuci, sumuran diberi substrat pewarna p-nitrophenylphosphate (PNP) yang telah diencerkan dalam bufer substrat sebanyak 100 µl dan diinkubasi dalam ruang gelap selama 30-60 menit pada suhu ruang. Perubahan warna yang terjadi diamati dan akumulasi virus secara kuantitatif dibaca dengan ELISA reader
8
pada panjang gelombang 405 nm. Sampel dinyatakan positif jika nilai absorbansi ELISA (NAE) sampel uji 2 kali lebih besar dibandingkan kontrol negatif (tanaman sehat).
Deteksi BCMV dengan Teknik RT-PCR
Daun kacang panjang yang diduga terinfeksi BCMV dideteksi dengan teknik RT-PCR menggunakan primer spesifik gen protein selubung (CP) BCMV. Tahapan deteksinya terdiri dari ekstraksi RNA total tanaman, sintesis cDNA, amplifikasi DNA dengan PCR, elektroforesis, dan perunutan DNA.
Ekstraksi RNA total. RNA total diekstraksi dari jaringan daun tanaman kacang panjang yang bergejala mosaik kuning dengan menggunakan NucleoSpin RNA Plant (Macherey-Nagel Inc., USA). Tahapannya diawali dengan menghaluskan sampel sebanyak 0.1 g dengan bantuan nitrogen cair didalam mortar dan pistil steril. Hasil gerusan kemudian dimasukkan ke dalam tabung mikro 2 ml. Sebelum divortex terlebih dahulu ditambahkan 350 µl bufer RA1 yang mengandung 1% β-mercaptoethanol yaitu sebanyak 3.5 µl. Sampel dipipet lalu dimasukkan ke dalam NucleoSpin Filter violet yang telah dilapisi tabung koleksi 2 ml dan disentrifugasi selama 1 menit pada kecepatan 11 000 rpm. Tabung NucleoSpin Filter violet diangkat dan supernatan didalam tabung koleksi kemudian dipipet tanpa menyentuh pelet dalam tabung koleksi, kemudian pindahkan pada tabung koleksi 1.5 ml yang baru. Selanjutnya ditambahkan 350 µl etanol 70% ke dalam tabung koleksi tersebut kemudian dipipet naik turun. Larutan kemudian dipindahkan ke NucleoSpin RNA Plant column (kolom biru) yang ditempatkan pada tabung koleksi 2 ml dan disentrifugasi selama 30 detik pada kecepatan 11 000 rpm. Kolom biru diangkat dan ditempatkan pada tabung koleksi yang baru, kemudian Membrane Desalting Buffer (MDB) ditambahkan kedalamnya sebanyak 350 µl dan disentrifugasi pada kecepatan 11 000 rpm selama 1 menit. Campuran reaksi DNase disiapkan sebanyak 10 µl rDNase ditambah 90 µl bufer reaksi rDNase. Campuran dihomogenisasi dengan cara dibolak balik secara perlahan pada tabung koleksi yang ditutup rapat, kemudian diambil 95 µl dan dimasukkan ke dalam kolom biru tanpa menyentuh pinggiran kolom maupun membran. Inkubasi campuran reaksi DNase tersebut disuhu ruang selama 15 menit kemudian tambahkan 200 µl bufer RA2, dan disentrifugasi pada kecepatan 11 000 rpm selama 30 detik. Supernatan kemudian dipindahkan ke tabung koleksi yang baru kemudian 600 µl RA3 ditambahkan pada kolom biru dan disentrifugasi pada kecepatan dan waktu yang sama dengan sebelumnya yaitu 11 000 rpm selama 30 detik. Tabung koleksi sebelumnya diganti dengan tabung koleksi yang baru kemudian ditambahkan 250 µl RA3, dan disentrifugasi selama 2 menit pada kecepatan 11 000 rpm kemudian ditunggu sampai kering. Kolom biru dipindahkan pada tabung koleksi yang baru kemudian ditambahkan 60 µl air bebas nuklease, dan disentrifugasi 1 menit pada kecepatan 11 000 rpm. Hasil yang terkumpul dibawah tabung koleksi adalah RNA total yang akan digunakan sebagai cetakan/ templat. RNA total hasil ekstraksi, kemudian disimpan pada suhu 20 ºC sampai siap digunakan.
Sintesis cDNA. RNA total hasil ekstraksi selanjutnya digunakan untuk proses transkripsi balik (reverse transcription-RT) menjadi cDNA (complementary DNA) dengan menggunakan enzim Reverse Transcriptase. Transkripsi balik dibuat dengan urutan bahan-bahan sebagai berikut: 4 µl RNA
9 total, 4 µl 5x bufer RT, 2 µl DTT (dithiothreitol) 50 mM, 2 µl dNTP 10 mM, 1 µl M-MuLV (200 U/µl), 1 µl RNase inhibitor (40 U/µl), 2 µl oligo d(T)18 10 µM dan air bebas nuklease sampai volume total 20 µl. Reaksi RT dilakukan dalam mesin Automated Thermal Cycler (Gene Amp PCR System 9700; PE Applied Biosystem, USA) yang diprogram untuk satu siklus pada suhu 25 oC selama 5 menit, 42 oC selama 60 menit, dan 70 oC selama 15 menit untuk inaktivasi enzim M-MuLV. Siapan cDNA hasil RT ini digunakan sebagai DNA cetakan dalam reaksi PCR.
Amplifikasi DNA dengan PCR. Amplifikasi DNA virus dilakukan dengan metode Polymerase Chain Reaction (PCR) dengan menggunakan pasangan primer spesifik yang digunakan untuk mendeteksi gen coat protein BCMV yaitu primer BlC-cpF (5’- TCA GGA ACT GGG CAG CCG CAA C-3’) dan primer BlC-cpR (5’-CTG CGG GGA ACC CAT GCC AAG-3’) yang berukuran 861 pb (Anggraini 2011). Reaksi PCR terdiri dari: 1 µl cDNA, 12.5 µl premix Go Taq Green (Promega), 1 µl primer BlC-cpF dan BlC-cpR (10 µM/µl), dan air bebas nuklease sampai volume total 25 µl. Amplifikasi dilakukan pada Automated Thermal Cycler (Gene Amp PCR System 9700; PE Applied Biosystem, USA). Amplifikasi ini didahului dengan denaturasi awal pada suhu 94 oC selama 5 menit, dilanjutkan dengan 35 siklus yang terdiri dari denaturasi pada suhu 94 oC selama 1 menit, penempelan primer (annealing) pada suhu 68 oC selama 1 menit dan ekstensi pada suhu 72 oC selama 1 menit. Siklus terakhir ditambahkan 7 menit pada suhu 72 oC untuk tahapan sintesis dan siklus berakhir pada suhu 4 oC. DNA hasil PCR dielektroforesis pada agarose gel.
Elektroforesis. Gel agarosa konsentrasi 1% dibuat dari 0.3 g agarosa yang dilarutkan dalam bufer TBE 0.5x sebanyak 30 ml dengan bantuan microwave. Sebelum digunakan, larutan gel agarosa didinginkan hingga suhu 60 oC selama kurang lebih 15 menit lalu ditambahkan 3 µl ethidium bromide (0.5 µg/10 ml). Elektroforesis dilakukan pada tegangan 100 volt selama 25 menit. Hasil elektroforesis selanjutnya divisualisasi dibawah transilluminator ultraviolet dan didokumentasi dengan kamera digital.
Perunutan dan Penyejajaran DNA.
Fragmen DNA hasil amplifikasi PCR selanjutnya dikirim ke First Base Genetica Science di Singapura untuk proses perunutan nukleotida. Hasil perunutan nukleotida digunakan untuk analisis tingkat kesamaan dengan runutan nukleotida yang terdapat di GenBank menggunakan program BLAST (Basic Local Alignment Search Tool) (http://www.ncbi.nlm.nih.gov/BLAST) dan beberapa perangkat lunak lainnya yaitu Bioedit (Hall 1999), dan CLC Sequence Viewer 6.7. Analisis filogenetik dilakukan menggunakan perangkat lunak MEGA 5.05. Sampel yang teridentifikasi sebagai BCMV-BlC selanjutnya digunakan dalam penelitian.
Isolasi dan Propagasi BCMV-BlC
Berdasarkan uji serologi dan molekuler terhadap sampel dari lapangan (data tidak ditampilkan), sampel asal Cangkurawok terdeteksi positif BCMV dan CMV, sehingga untuk membedakan kedua virus dilakukan isolasi pada tanaman Chenopodium amaranticolor. C. amaranticolor merupakan salah satu tanaman indikator yang baik untuk memisahkan virus karena menunjukkan reaksi lesio
10
lokal (nekrotik atau klorotik) yang khas. BCMV menyebabkan gejala lesio lokal nekrotik (LLN) sedangkan CMV menunjukkan gejala klorotik sistemik (KS).
Metode inokulasi yang digunakan yaitu secara mekanis menggunakan sap tanaman sakit. Sap tanaman sakit dibuat dengan cara menggerus daun tanaman dalam bufer posfat pH 7.0 dengan perbandingan 1:5 (b/v). Sap yang sudah siap diinokulasikan pada permukaan daun C. amaranticolor yang sebelumnya telah ditaburi dengan carborundum 600 mesh. Sisa Carborundum yang masih menempel pada daun dibersihkan dengan menggunakan air yang mengalir. Setelah inokulasi C. amaranticolor diamati sampai muncul gejala LLN. LLN yang muncul diambil secara tunggal dan diinokulasi kembali ke C. amaranticolor. Isolasi virus pada C. amaranticolor dilakukan secara berseri sebanyak 3 kali dengan menggunakan LLN sebagai inokulum. Setelah diperoleh virus murni dilakukan propagasi virus untuk sumber inokulum pada tanaman kacang panjang kultivar Parade.
Uji Kisaran Inang
Uji kisaran inang BCMV-BlC asal Cangkurawok menggunakan 18 spesies tanaman yang berasal dari 3 famili. Tanaman uji tersebut adalah dari famili Solanaceae yaitu cabai (Capsicum annuum) kultivar IPB dan Bara, tomat (Lycopersicon esculentum L) kultivar Ratna dan San Marino, tembakau (N. tabacum cv. White Burley dan Nicotiana glutinosa L), famili Leguminosae yaitu kacang panjang (Vigna sinensis) kultivar Parade, 777, Pangeran, New Jeliteng, dan Katrina, kacang tanah (Arachis hypogaea), kedelai (Glycine max), buncis (Phaseolus vulgaris), kacang hijau (Vigna radiata), kacang tunggak (Vigna unguiculata L), kacang kapri (Pisum sativum), dan famili Cucurbitaceae yaitu mentimun (Cucumis sativus).
Inokulasi dilakukan secara mekanis yaitu menggunakan sap tanaman sakit seperti diuraikan sebelumnya. Jumlah tanaman yang diinokulasi adalah sebanyak 15 tanaman untuk setiap spesies tanaman. Perlakuan kontrol negatif dilakukan dengan menginokulasi tanaman menggunakan bufer fosfat. Deteksi BCMV-BlC dilakukan 4 minggu setelah inokulasi (MSI) dengan metode DIBA menggunakan antiserum BCMV (Agdia, Inc).
Identifikasi dan Perbanyakan Kutudaun
Kutudaun yang digunakan adalah A. craccivora, A. gossypii dan A. glycines stadia imago. Sebelum diperbanyak pada masing-masing tanaman inang (kacang panjang, cabai dan kedelai), kutudaun diidentifikasi terlebih dahulu menurut metode Blackman dan Eastop (2000) yaitu dengan membuat preparat mikroskop kutudaun.
Pembuatan preparat kutudaun mengacu pada Mound (2006). Untuk pengujian di laboratorium atau rumah kaca digunakan kutudaun yang tidak bersayap. Kutudaun dewasa yang tidak bersayap dimasukkan dalam alkohol 95% dan direbus dalam penangas air selama 5 menit, kemudian kutudaun diangkat dan dipindahkan kedalam larutan KOH 10% dan dipanaskan lagi selama 10-15 menit dalam penangas air atau sampai jernih. Kutudaun diangkat dan dimasukkan dalam alkohol 50%. Abdomen serangga bagian ventral ditusuk dengan jarum halus dan isi tubuhnya dikeluarkan. Spesimen kemudian dipindahkan dan direndam dalam alkohol dengan kepekatan bertingkat (90%, 95%, dan 100%) masing-masing
11 selama 5 menit. Selanjutnya spesimen diletakkan pada gelas obyek dan ditetesi dengan 1-2 minyak cengkeh. Pembuatan slide mikroskop kutudaun dilakukan di bawah mikroskop stereo. Spesimen diletakkan terlentang, kemudian diatur sedemikian rupa sehingga bagian-bagian tubuh seperti tungkai, antena, rostrum, kauda, kornikel dan sayap tampak jelas. Setelah itu minyak cengkeh diserap dengan menggunakan tisu, kemudian ditetesi dengan balsam kanada. Posisi kutudaun diatur kembali dengan baik, lalu ditutup dengan gelas penutup. Karakter yang diamati terdiri dari kepala, abdomen, sifunkuli, kauda, dan antene.
Kutudaun yang telah diidentifikasi selanjutnya diperbanyak dengan cara imago tiap kutudaun yang diperoleh dari lapangan pertama-tama diletakkan dalam cawan petri yang berisi daun talas untuk proses pembebasan virus. Nimfa yang dihasilkan kemudian dipindahkan ke tanaman sehat kacang panjang, cabai dan kedelai sebagai inangnya sebelum digunakan pada percobaan penularan.
Penularan BCMV-BlC dengan Kutudaun
Kutudaun yang digunakan untuk penularan adalah stadia imago. Imago yang digunakan sebanyak 1, 3, 5, 7 dan 10 ekor pada masing-masing tanaman. Kutudaun dipuasakan selama 1 jam dalam cawan petri kemudian diberikan perlakuan periode makan akuisisi pada tanaman sakit selama 5 menit kemudian kutudaun dipindahkan dan dibiarkan makan inokulasi pada tanaman sehat selama 24 jam. Setelah periode makan inokulasi (pmi) kutudaun dimatikan secara mekanis. Gejala diamati sampai 1 bulan setelah inokulasi. Jumlah tanaman yang diinokulasi adalah sebanyak 15 tanaman untuk setiap jumlah kutu daun dan setiap spesies kutudaun. Untuk kontrol negatif inokulasi menggunakan kutudaun yang bebas virus.
Deteksi BCMV-BlC dilakukan secara serologi dengan DIBA menggunakan antiserum BCMV (Agdia, Inc) pada umur tanaman 4 minggu setelah inokulasi (MSI).
Parameter Pengamatan
Pengamatan dilakukan sejak hari pertama sampai 30 hari setelah tanaman diinokulasi virus. Pengamatan yang dilakukan meliputi masa inkubasi, tipe gejala, dan kejadian penyakit (KP). Pengamatan terhadap masa inkubasi dimulai satu hari setelah inokulasi (HSI) sampai timbul gejala. Persentase kejadian penyakit dihitung dengan rumus:
KP = Jumlah tanaman bergejala X 100%
Jumlah tanaman yang diamati
Deteksi BCMV dengan Metode Dot Immunobinding Assay (DIBA)
Metode DIBA dilakukan berdasarkan metode Mahmood et al. (1997) yang telah dimodifikasi. Membran nitroselulosa (Hybond TM –P Amersham) direndam dalam metanol 100% selama 10 detik dan dikeringanginkan sebelum digunakan. Jaringan daun tanaman terinfeksi BCMV digerus dalam tris buffer saline (TBS) dengan perbandingan 1:10 (b/v) (TBS: Tris HCl 0.02 M dan NaCl 0.15 M, pH 7.5). Selanjutnya sap diteteskan ke atas membran nitroselulosa sebanyak 3 µl hingga kering. Membran selanjutnya diblocking dalam 10 ml larutan 2% non fat
12
milk dalam TBS yang mengandung 2% Triton X-100. Membran kemudian diinkubasi pada suhu ruang sambil digoyang dengan kecepatan 50 rpm selama 2 jam menggunakan EYELA multi shaker MMS. Membran selanjutnya dicuci 5 kali dengan dH2O, tiap pencucian berlangsung selama 5 menit dan di shaker dengan kecepatan 100 rpm. Membran selanjutnya direndam dalam 10 ml TBS yang mengandung antibodi dan konjugat (rabbit anti mouse) 10 µl di tambah non fat milk dengan konsentrasi akhir 2%. Selanjutnya membran di inkubasi semalam pada suhu kamar sambil di shaker dengan kecepatan 50 rpm. Membran kemudian dicuci sebanyak 3 kali selama 5 menit tiap pencucian dengan Tween 0.05% dalam TBS (TBST). Selanjutnya membran direndam selama 10 menit dalam 10 ml buffer substrat (Tris–HCl 0.1M, NaCl 0.1 M dan MgCl2 5 mM) yang mengandung
nitro blue tetrazolium (NBT) dan bromo chloro indolyl phosphate (BCIP). Perubahan warna putih menjadi ungu pada membran yang ditetesi sap tanaman yang terinfeksi virus menunjukkan reaksi positif dan reaksi dapat dihentikan dengan merendam membran dalam dH2O.
13
HASIL DAN PEMBAHASAN
Gejala Mosaik Kuning pada Tanaman Kacang Panjang
Sampel-sampel tanaman kacang panjang yang diambil dari lapangan menunjukkan gejala mosaik kuning. Gejala mosaik kuning di lapangan dapat dibedakan menjadi dua kelompok berdasarkan warna dan perubahan bentuk pada daun. Kelompok gejala pertama menunjukkan gejala dengan pola mosaik berwarna hijau muda sampai kuning terang secara tidak merata (mosaik kuning berat), penebalan disekitar pertulangan daun berwarna hijau tua (vein banding), malformasi daun (daun menggulung seperti krupuk, mengerut sepanjang tulang daun), daun melepuh, dan terhambat pertumbuhannya. Kelompok gejala kedua yaitu daun membentuk pola mosaik berwarna hijau muda sampai kuning (mosaik kuning sedang) dan penebalan disekitar pertulangan daun berwarna hijau tua (vein banding) (Gambar 1, Tabel 1).
Gambar 1. Tipe gejala kelompok 1 yaitu: a. Mosaik kuning berat; b. Mosaik kuning sedang; c. Malformasi daun (mengerut); d. rugos. Tipe gejala kelompok 2 yaitu: e, g, dan h. Mosaik kuning sedang; f. Mosaik kuning ringan Tanaman sampel pada kelompok pertama menunjukkan gejala khas tanaman terinfeksi Bean common mosaic virus (BCMV). Tanaman yang terinfeksi menunjukkan gejala utama mosaik dan nekrosis. Tulang daun berwarna hijau tua sedangkan daerah interveinal menjadi hijau muda. Adanya perubahan warna daun biasanya diikuti dengan malformasi daun berupa kerutan dan menggulung (Galvez 1980; Morales dan Bos 1988). Menurut Damayanti et al. (2009) tanaman yang terinfeksi BCMV menunjukkan gejala awal pada daun yaitu muncul bercak kuning, lalu meluas dan pada akhirnya seluruh daun menguning, mengering dan tanaman mati
a
b
c
d
14
Tabel 1. Tipe gejala dan hasil deteksi BCMV menggunakan metode RT-PCR Asal Sampel Tipe Gejala
*) Hasil PCR Vb Mkr Mks Mkb Md K Bogor Cangkurawok √ √ √ √ + Bubulak √ √ ± Situgede √ √ - Bojong √ √ ± Subang √ √ √ √ + Indramayu √ √ - Cirebon √ √ √ + Tegal √ √ √ + Klaten √ √ - Solo √ √ √ √ + Magelang √ √ - Sleman √ √ √ + Jogjakarta √ √ -
*Mkr = Mosaik kuning ringan; Mks = Mosaik kuning sedang; Mkb = Mosaik kuning berat; Md =
Malformasi daun; Vb = Vein banding; K = Kerdil, + = Target teramplifikasi, ± = Target teramplifikasi namun tidak dapat dirunut nukleotidanya, - = Target tidak teramplifikasi
Pada semua sampel uji menunjukkan gejala vein banding (Vb), namun tidak semua positif teramplifikasi BCMV (Situgede, Indramayu, Klaten, Magelang dan Jogjakarta) sedangkan sampel dengan tipe gejala mosaik kuning berat (Mkb) asal Cangkurawok, Subang, Cirebon, Tegal dan Solo serta beberapa sampel dengan tipe gejala mosaik kuning sedang (Mks) asal Bubulak, Bojong dan Sleman menunjukkan positif teramplifikasi BCMV. Dengan demikian diketahui bahwa sampel daun dengan tipe gejala vein banding saja tidak cukup dijadikan patokan tanaman positif terdeteksi BCMV namun bila gejala Vb diikuti gejala mosaik kuning berat hingga sedang kemungkinan tanaman terinfeksi BCMV.
Berdasarkan deskripsi tersebut, ada dugaan bahwa gejala mosaik kuning pada kacang panjang selain disebabkan oleh BCMV, dapat juga disebabkan oleh infeksi virus-virus lain yang kemungkinan menginfeksi secara tunggal ataupun ganda. Hal ini ditunjukkan dengan sampel-sampel asal Situgede, Indramayu, Klaten, Jogjakarta dan Magelang yang bergejala mosaik kuning, namun tidak terdeteksi positif terinfeksi BCMV.
Deteksi Molekuler dan Perunutan DNA BCMV
Pita DNA BCMV berukuran 861 pb berhasil teramplifikasi dari sampel asal Cangkurawok, Bubulak, Bojong, Cirebon, Subang, Solo, Sleman, dan Tegal dan tidak teramplifikasi dari sampel asal Situgede, Indramayu, Jogjakarta, Klaten dan Magelang (Gambar 2). Hasil deteksi ini menunjukkan bahwa pengamatan gejala penyakit saja tidak cukup untuk mendeteksi dan mengidentifikasi virus pada tanaman sehingga diperlukan diagnosis secara molekuler (Tabel 1).
15
Gambar 2 Pita DNA hasil amplifikasi dengan primer spesifik gen CP BCMV (BCMV-F/BCMV-R) pada gel agarosa 1 %. M = Penanda DNA 100 pb, DNA sampel asal; 1. Situgede, 2. Cangkurawok, 3. Bubulak, 4. Bojong, 5. Subang, 6. Indramayu, 7. Cirebon, 8. Tegal, 9. Klaten, 10. Solo, 11. Magelang, 12. Jogjakarta, 13. Sleman; K- = Kontrol negatif (air), K+ = Kontrol positif
DNA hasil amplifikasi RT-PCR dirunut nukleotidanya dan diperoleh hasil perunutan berkisar 779 sampai 861 pb (Tabel 2). Analisis homologi nukleotida gen CP terhadap sikuen yang ada di Genbank menggunakan program BLAST (http://www.ncbi.nlm.nih.gov/BLAST) diketahui bahwa isolat-isolat Cangkurawok, Subang, Solo dan Sleman memiliki 99% sampai 100% homologi dengan BCMV-BlC asal Taiwan dan 92% dengan BCMV-NL1 asal Inggris. BCMV isolat Cirebon dan Tegal memiliki 89% homologi dengan BCMV-BlC asal Taiwan dan 90% dengan BCMV-NL1 asal Inggris (Tabel 2). Hasil ini sesuai dengan penelitian Damayanti et al.(2009) yang melaporkan bahwa salah satu virus yang terdeteksi pada tanaman kacang panjang dengan gejala mosaik kuning adalah BCMV-BlC.
Tabel 2. Hasil perunutan basa nukleotida gen CP beberapa Isolat BCMV dari tanaman kacang panjang dan % homologinya dengan isolat BCMV dari genbank Isolat Panjang Nukleotida (pb) Homologi (%) Asal Strain* (Tanaman/ Negara) No. Aksesi BCMV-BlC BCMV-NL1 Cangkurawok 861 100 92 Kacang panjang/Taiwan AY575773.1 Subang 861 100 92 Kacang panjang/Taiwan AY575773.1 Cirebon 861 89 90 Buncis/Inggris AY112735.1 Tegal 861 89 90 Buncis/Inggris AY112735.1
Solo 779 99 92 Kacang
panjang/Taiwan AY575773.1 Sleman 861 100 92 Kacang
panjang/Taiwan AY575773.1
*
Berdasarkan homologi tertinggi
Analisis Basa Nukleotida dan Asam Amino Gen Protein Selubung BCMV
Hasil perunutan basa nukleotida gen protein selubung BCMV diperoleh ukuran yang berbeda (Tabel 2) sehingga untuk analisis runutan basa nukleotida digunakan ukuran yang sama yaitu 777 nukleotida yang mengkode 259 asam amino. Analisis runutan basa nukleotida gen protein selubung keenam isolat
900 pb
600 pb ± 850 pb
16
BCMV asal Jawa Barat dan Jawa Tengah menunjukkan homologi berkisar antara 89.1% sampai 100%. Isolat Cangkurawok, Subang, Solo, dan Sleman memiliki tingkat kekerabatan yang sangat dekat satu dengan lainnya (99.8% sampai 100%) tetapi tingkat kekerabatannya tidak terlalu dekat dengan isolat Cirebon dan Tegal (89.1% sampai 89.3%). Dua isolat BCMV asal Cirebon dan Tegal memiliki tingkat kekerabatan yang sangat dekat satu dengan lainnya (96.6%) tetapi tidak terlalu dekat dengan keempat isolat lainnya (Tabel 3).
Analisis kekerabatan terhadap beberapa isolate BCMV lain dari Genbank menunjukkan bahwa 4 isolat BCMV yaitu isolat Cangkurawok, Subang, Solo dan Sleman memiliki hubungan kekerabatan yang dekat dengan BCMV-BlC asal Taiwan dari tanaman kacang panjang dan BCMV-BlC PSU1 asal Thailand dari tanaman kacang tunggak dengan tingkat kesamaan berkisar 99.3% sampai 100%. Dua isolat BCMV asal Cirebon dan Tegal lebih dekat hubungan kekerabatannya dengan BCMV-NL1 asal Inggris dari tanaman buncis dengan tingkat kesamaan 89.8% sampai 90.0% dibandingkan hubungannya dengan BCMV-BlC asal Taiwan ataupun BCMV-BlC Y asal Cina. Perbedaan tingkat homologi urutan nukleotida tersebut menunjukkan adanya keragaman diantara isolat-isolat BCMV dari daerah Jawa Barat dan Jawa Tengah yang berasosiasi dengan penyakit mosaik kuning pada kacang panjang.
Tabel 3. Homologi nukleotida BCMV asal Jawa Barat dan Jawa Tengah terhadap BCMV asal negara lain
No Homologi (%) 1 2 3 4 5 6 7 8 9 10 11 12 13 14 1 - 100 89.3 89.3 99.8 100 100 99.4 90.9 96.5 92.1 89.7 60.7 69.1 2 - 89.3 89.3 99.8 100 100 99.4 90.9 96.5 92.1 89.7 60.7 69.1 3 - 96.6 89.3 89.3 89.3 88.8 88.1 89.0 89.8 87.9 59.4 67.9 4 - 89.1 89.3 89.3 88.8 88.4 89.1 90.0 88.8 59.1 68.0 5 - 99.8 99.8 99.3 90.8 96.3 92.0 89.5 60.7 69.1 6 - 100 99.4 90.9 96.5 92.1 89.7 60.7 69.1 7 - 99.4 90.9 96.5 92.1 89.7 60.7 69.1 8 - 90.7 96. 91.8 89.4 60.7 69.1 9 - 90.2 96.1 88.2 58.8 68.7 10 - 91.3 89.1 59.8 67.8 11 - 90.2 60.2 68.7 12 - 59.8 69.3 13 - 59.9 14 - *)
Tingkat homologi nukleotida dihitung menggunakan program Bioedit versi 7.0.0
1) BCMV Cangkurawok; 2) BCMV Subang; 3) BCMV Cirebon; 4) BCMV Tegal; 5) BCMV Solo; 6) BCMV Sleman; 7) BCMV-BlC-TAIWAN (AY575773.1); 8) BCMV-BlC-PSU1 (FR775796.1); 9) BlC-NY15 (S66252.1); 10) BlC-Y (AJ312438.1); 11) BCMV-NL1 (AY112735); 12) BCMV-Pst-T (HM776126.1); 13) BYMV-HP (KC011006); dan 14)
CaBMV-DF-Brs (DQ397532.1)
Analisis runutan sikuen asam amino gen protein selubung menunjukkan tingkat homologi yang tinggi antara keenam isolat BCMV asal Jawa Barat dan Jawa Tengah, yaitu berkisar antara 93.0% sampai 100%. Isolat Cangkurawok,
17 Subang, Solo, dan Sleman memiliki tingkat kekerabatan yang sangat dekat satu dengan lainnya (99.6% sampai 100%) tetapi tingkat kekerabatannya tidak terlalu dekat dengan isolat Cirebon dan Tegal (93.0% sampai 93.4%). Dua isolat BCMV asal Cirebon dan Tegal memiliki tingkat kekerabatan yang sangat dekat satu dengan lainnya (98.8%) tetapi tidak terlalu dekat dengan keempat isolat lainnya (Tabel 4).
Analisis kekerabatan terhadap beberapa isolat BCMV lain dari Genbank menunjukkan bahwa 4 isolat BCMV asal Jawa Barat dan Jawa Tengah (isolat-isolat Cangkurawok, Subang, Solo dan Sleman) memiliki hubungan kekerabatan yang dekat dengan BCMV-BIC dari Taiwan dengan tingkat kesamaan berkisar 99.6% sampai 100%. Dua isolat BCMV asal Cirebon dan Tegal lebih dekat hubungan kekerabatannya dengan BCMV-BlC Y asal Cina dengan tingkat kesamaan 93.8% dibandingkan hubungannya dengan BCMV-BlC asal Taiwan. Semua isolat BCMV asal Jawa Barat dan Jawa Tengah dan isolat BCMV asal negara lain menunjukkan homologi asam amino yang jauh terhadap BYMV (57,3-58,4%) dan CaBMV-DF-Brs (66,4-68,3%).
Tabel 4. Homologi asam amino BCMV asal Jawa Barat dan Jawa Tengah terhadap BCMV asal negara lain
No Homologi (%) 1 2 3 4 5 6 7 8 9 10 11 12 13 14 1 - 100 93.4 93.4 99.6 100 100 99.6 92.6 99.6 93.4 0,93 57.3 66.4 2 - 93.4 93.4 99.6 100 100 99.6 92.6 99.6 93.4 0,93 57.3 66.4 3 - 98.8 93.0 93.4 93.4 93.0 90.7 93.8 91.8 0,93 57.3 67.5 4 - 93.0 93.4 93.4 93.0 91.1 93.8 92.2 0,93 57.3 67.5 5 - 99.6 99.6 99.2 92.2 99.2 93.0 0,92 57.3 66.4 6 - 100 99.6 92.6 99.6 93.4 0,93 57.3 66.4 7 - 99.6 92.6 99.6 93.4 0,93 57.3 66.4 8 - 93.0 99.2 93.8 0,93 57.3 66.7 9 - 93.0 94.9 0,91 57.3 66.7 10 - 93.8 0,93 57.3 66.4 11 - 0,93 58.4 66.7 12 - 58.0 68.3 13 - 54.9 14 - *)
Tingkat homologi nukleotida dihitung menggunakan program Bioedit versi 7.0.0
1) BCMV Cangkurawok; 2) BCMV Subang; 3) BCMV Cirebon; 4) BCMV Tegal; 5) BCMV Solo; 6) BCMV Sleman; 7) BCMV-BlC-TAIWAN (AY575773.1); 8) BCMV-BlC-PSU1 (FR775796.1); 9) BlC-NY15 (S66252.1); 10) BlC-Y (AJ312438.1); 11) BCMV-NL1 (AY112735); 12) BCMV-Pst-T (HM776126.1); 13) BYMV-HP (KC011006); dan 14)
CaBMV-DF-Brs (DQ397532.1)
Berdasarkan runutan asam amino (nt 1-855) (lampiran 1 dan 2) ditemukan beberapa perbedaan asam amino antara isolat Cirebon, Tegal dengan BlC Taiwan dan BlC Y asal Cina. BlC Taiwan dan BlC Y memiliki homologi asam amino 99.6% pada posisi asam amino yang sama, sedangkan isolat Cirebon dan Tegal memiliki homologi antar sesama sebesar 98.8%, 93.8% terhadap BlC Y dan 93.4% terhadap BlC Taiwan. Dari 33 nt yang berbeda antara BlC Taiwan dan BlC