AKTIVITAS SUBSTRAT ANTIMIKROBA BAKTERI ASAM
LAKTAT YANG DIISOLASI DARI DAGING SAPI
TERHADAP BAKTERI PATOGEN DAN
KONSENTRASI MINIMUM
PENGHAMBATANNYA
SKRIPSI TRIANI WIDIASIH
PROGRAM STUDI TEKNOLOGI HASIL TERNAK FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR 2008
RINGKASAN
TRIANI WIDIASIH. D14204066.2008. Aktivitas Substrat Antimikroba Bakteri Asam Laktat yang Diisolasi dari Daging Sapi terhadap Bakteri Patogen dan Konsentrasi Minimum Penghambatannya. Skripsi. Program Studi Teknologi Hasil Ternak, Fakultas Peternakan, Institut Pertanian Bogor.
Pembimbing Utama : Irma Isnafia Arief, S. Pt., M. Si.
Pembimbing Anggota : Dr. Ir. Rarah Ratih Adjie Maheswari, DEA
Daging sebagai salah satu bahan pangan hasil ternak memiliki sifat mudah rusak atau mempunyai umur simpan yang pendek. Kerusakan bahan pangan dapat disebabkan oleh beberapa faktor, diantaranya secara biologis oleh mikroorganisme, walaupun tidak semua dari mikroorganisme tersebut memiliki efek yang negatif. Sebagian bakteri contohnya yaitu bakteri asam laktat (BAL) dapat dimanfaatkan sebagai biopreservatif (bahan pengawet alami), karena BAL dapat menghasilkan produk metabolit yang bersifat antimikroba seperti asam organik, hidrogen peroksida, karbon dioksida, diasetil, dan bakteriosin. Bakteri asam laktat sering ditemukan secara alamiah dalam bahan pangan, diantaranya dalam daging dan produk olahannya. Penggunaan BAL sebagai bahan pengawet alami dapat dilakukan melalui dua cara yaitu penambahan kultur BAL sebagai kultur starter pada produk pangan atau pemanfaatan metabolit antimikroba BAL sebagai pengawet alami.
Penelitian ini bertujuan untuk mempelajari dan mendapatkan informasi tentang kemampuan BAL hasil isolasi dari daging sapi dalam menghasilkan substrat antimikroba serta karakteristik dari substrat yang dihasilkan meliputi aktivitas penghambatannya terhadap bakteri patogen Gram negatif dan Gram positif. Penelitian ini dilaksanakan di Laboratorium Bagian Ilmu Produksi Ternak Perah dan Laboratorium Bagian IPT Ruminansia Besar Fakultas Peternakan, Institut Pertanian Bogor. Penelitian dilaksanakan selama empat bulan dari bulan Januari hingga April 2008.
Penelitian ini menggunakan 12 isolat BAL hasil isolasi dari daging sapi (Arief et al., 2006) serta tiga bakteri uji (Staphylococcus aureus ATCC 25923, Salmonella typhimurium ATCC 14028, Escherichia coli ATCC 25922) dengan metode difusi agar. Peubah yang diamati adalah diameter zona hambat yang terbentuk serta konsentrasi minimum penghambatan (MIC) terhadap bakteri uji.
Hasil penelitian ini menunjukkan bahwa 12 isolat BAL yang diujikan mempunyai kemampuan penghambatan yang berbeda terhadap bakteri uji. Isolat 2B4 memiliki diameter zona hambat terbesar terhadap tiga bakteri uji. Nilai MIC yang dibutuhkan oleh isolat 2B4 dalam menghambat E. coli, S. aureus dan S. typhimurium
berturut-turut 80%, 90 % dan 90 %. Berdasarkan hasil penelitian dapat disimpulkan bahwa substrat antimikroba yang bekerja dominan dalam menghambat bakteri uji adalah asam organik. Bakteri uji yang memiliki sensitifitas paling tinggi terhadap substrat antimikroba yang dihasilkan adalah E. coli dengan nilai MIC sebesar 80%.
ABSTRACT
Antimicrobial Substrate Activities of Lactic Acid Bacteria Isolated from Beef foward Pathogenic Bacteria and Its Minimum Inhibitory Consentration
Widiasih, T., I. I. Arief and R. R. A. Maheswari
Lactic acid bacteria (LAB) can occur naturally in several raw materials, such as beef. Some of LAB commonly used as starter cultures in food are known to have antimicrobial activity. One important attribute of LAB is their ability to produce antimicrobial substance. The objective of the research was to study the effect of antimicrobial substrate activities of LAB strains isolated from beef foward pathogenic bacteria. The antimicrobial substrate exhibited antibacterial activity against. Twelve LAB (2D2, 1D3, 2A3, 2C12, 1B2, 2D41, 1A4, 1C1, 1D42, 2B2, 1A2, 2B4) showed the best antimicrobial activities against pathogenic bacteria
Staphylococcus aureus ATCC 25923, Salmonella typhimurium ATCC 14028, and
Escherichia coli ATCC 25922 as indicator strains. Lactic acid bacteria 2B4 showed the highest inhibitor activity to Salmonella typhimurium ATCC 14028 and
Escherichia coli ATCC 25922. Minimum inhibitory concentrations (MIC) antimicrobial substrate of LAB 2B4 were 80%, 90 %, and 90% for E. coli, S. aureus, and S. typhimurium respectively.
AKTIVITAS SUBSTRAT ANTIMIKROBA BAKTERI ASAM
LAKTAT YANG DIISOLASI DARI DAGING SAPI
TERHADAP BAKTERI PATOGEN DAN
KONSENTRASI MINIMUM
PENGHAMBATANNYA
Triani Widiasih D14204066
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada Fakultas Peternakan
Institut Pertanian Bogor
PROGRAM STUDI TEKNOLOGI HASIL TERNAK FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR 2008
AKTIVITAS SUBSTRAT ANTIMIKROBA BAKTERI ASAM
LAKTAT YANG DIISOLASI DARI DAGING SAPI
TERHADAP BAKTERI PATOGEN DAN
KONSENTRASI MINIMUM
PENGHAMBATANNYA
Oleh: Triani Widiasih
D14204066
Skripsi ini telah disetujui dan disidangkan di hadapan Komisi Ujian Lisan pada tanggal 21 Juli 2008
Dekan Fakultas Peternakan Institut Pertanian Bogor
Dr. Ir. Luki Abdullah, M.Agr.Sc. NIP. 131 955 581
Pembimbing Utama
Irma Isnafia Arief, S.Pt, M.Si. NIP. 132 243 330
Pembimbing Anggota
Dr. Ir. Rarah R. A. Maheswari, DEA NIP. 132 258 289
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 23 Oktober 1986 di Bogor. Penulis adalah anak ketiga dari tiga bersaudara, pasangan Ishak Patamargana dan Munigar. Riwayat pendidikan penulis dimulai dari Taman Kanak-Kanak Kartini Bogor (1990-1992), Sekolah Dasar Yayasan Pendidikan Islam (1992-1998), Sekolah Menengah Pertama Negeri 2 Bogor (1998-2001), dan dilanjutkan ke Sekolah Menengah Umum Negeri 2 Bogor (2001-2004). Penulis kemudian masuk Institut Pertanian Bogor (IPB) melalui jalur USMI (Ujian Seleksi Masuk IPB) pada tahun 2004 dan terdaftar sebagai mahasiswa pada Program Studi Teknologi Hasil Ternak, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan.
Selama menjadi mahasiswa IPB, penulis aktif dalam organisasi kemahasiswaan Badan Eksekutif Mahasiswa Fakultas Peternakan periode 2005-2006 serta kepanitiaan kegiatan kampus lainnya. Penulis pernah menjadi asisten praktikum untuk mata kuliah Ilmu dan Teknik Pengolahan Susu dan Ilmu dan Teknik Pengolahan Daging tahun ajaran 2007/2008.
Sebagi salah satu syarat untuk memperoleh gelar sarjana pada Fakultas Peternakan, Institut Pertanian Bogor, penulis melakukan penelitian selama empat bulan dengan judul “Aktivitas Substrat Antimikroba Bakteri Asam Laktat yang Diisolasi dari Daging Sapi terhadap Bakteri Patogen dan Konsentrasi Minimum Penghambatannya“, di bawah bimbingan Irma Isnafia Arief, S.Pt., M.Si. dan Dr. Ir. Rarah R. A. Maheswari, DEA.
KATA PENGANTAR
Puji dan syukur penulis persembahkan kepada Pemilik dari segala ilmu, Sang Maha Pencipta, Raja dari alam semesta, Allah Subhanahu Wataala karena limpahan nikmat dan rahmatNya yang lebih luas dari lautan di bumi dan langit, akhirnya penulis dapat menyelesaikan karya tulis ini.
Penulis juga mengucapkan terima kasih kepada semua pihak yang telah mendukung baik secara moril maupun materil hingga skripsi dengan judul “Aktivitas Substrat Antimikroba Bakteri Asam Laktat yang Diisolasi dari Daging Sapi terhadap Bakteri Patogen dan Konsentrasi Minimum Penghambatannya“ dapat diselesaikan.
Kesadaran konsumen akan bahan pengawet dalam produk pangan lebih memilih bahan pengawet alami. Beberapa tahun ini produk metabolit dari bakteri asam laktat telah dimanfaatkan dalam bidang biopreservatif produk pangan. Bakteri asam laktat yang diisolasi dari daging sapi telah terbukti memiliki aktivitas antimikroba, yang diharapkan mampu menjadi alternatif biopreservatif dalam industri pangan. Penelitian ini juga berupaya memberikan informasi tentang karakteristik antimikroba dan konsentrasi minimum penghambatan terhadap bakteri patogen.
Semoga tulisan ini dapat menjadi sumber ilmu dan digunakan sebagai bahan tafakur atas ciptaan Allah SWT.
Bogor, Juli 2008
DAFTAR ISI
Halaman
RINGKASAN ... i
ABSTRACT ... ii
RIWAYAT HIDUP ... iii
KATA PENGANTAR ... iv
DAFTAR ISI ... v
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
Latar Belakang... 1
Tujuan ... 2
TINJAUAN PUSTAKA ... 3
Bakteri Asam Laktat ... 3
Antimikroba... 4 Asam Organik ... 4 Hidrogen Peroksida ... 5 Bakteriosin ... 6 Mikrobiologi Daging ... 7 Bakteri Patogen ... 8 Staphylococcus aureus ... 8 Salmonella typhimurium ... 9 Escherichia coli... 9
Minimum Inhibitory Concentration ... 10
METODE ... 11
Lokasi dan Waktu ... 11
Materi ... 11 Bahan ... 11 Alat ... 11 Rancangan ... 11 Prosedur ... 12 Penelitian Pendahuluan ... 12 Pewarnaan Gram ... 12 Uji katalase ... 12 Penelitian Utama ... 13 Uji Antagonistik ... 13 Pengukuran pH ... 15
Karakterisasi Substrat Antimikroba ... 16
MIC ... 16
HASIL DAN PEMBAHASAN ... 19
Penelitian Pendahuluan ... 19
Karakteristik Morfologis Isolat BAL ... 19
Populasi Awal Bakteri Uji ... 21
Penelitian Utama... 21
Identifikasi Keberadaan Substrat Antimikroba ... 21
Identifikasi Jenis Antimikroba Penyusun Supernatan ... 23
Penghambatan S. aureus oleh Asam Organik BAL ... 27
Penghambatan S. typhimurium oleh Asam Organik BAL ... 28
Penghambatan E. coli Asam Organik BAL ... 28
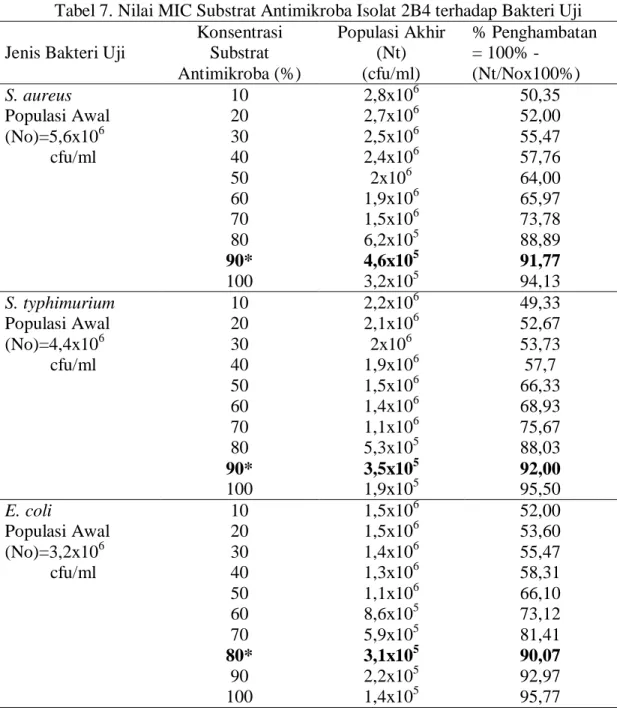
Minimum Inhibitory Concentration (MIC) ... 29
KESIMPULAN DAN SARAN ... 32
Kesimpulan... 32
Saran ... 32
UCAPAN TERIMA KASIH ... 33
DAFTAR PUSTAKA ... 34
DAFTAR TABEL
Nomor Halaman
1. Batas Maksimum Cemaran Mikroba pada Daging (cfu/g) ... 7 2. Karakteristik Isolat Bakteri yang Diisolasi dari Daging Sapi ... 18 3. Total Populasi Awal Bakteri Uji ... 20 4. Rataan Diameter Zona Hambat* 12 Isolat BAL terhadap
Bakteri Uji ... 21 5. Rataan Diameter Zona Hambat* Supernatan Bebas Sel Isolat
BAL terhadap Bakteri Uji ... 23 6. Nilai TAT Supernatan Bebas SelIsolat 2B4... 25 7. Nilai MIC Substrat Antimikroba Isolat 2B4 terhadap
DAFTAR GAMBAR
Nomor Halaman
1. Metode Pengukuran Zona Hambat ... 14 2. Persiapan Media MIC dan Penentuan Nilai MIC ... 17 3. Kemampuan Antagonistik Isolat BAL terhadap Bakteri Uji E. coli .. 22
DAFTAR LAMPIRAN
Nomor Halaman
1. Analisis RagamRataan Diameter Zona Hambat 12 Isolat
BAL terhadap S. aureus ... 38 2. Analisis RagamRataan Diameter Zona Hambat 12 Isolat
BAL terhadap S. typhimiruum ... 38 3. Analisis Ragam Rataan Diameter Zona Hambat 12 Isolat
BAL terhadap E. coli ... 38 4. Analisis RagamRataan Diameter Zona Hambat Supernatan
Bebas Sel Isolat BAL terhadap S. aureus ... 38 5. Analisis RagamRataan Diameter Zona Hambat Supernatan
Bebas Sel Isolat BAL terhadap S. typhimurium ... 39 6. Analisis Ragam Rataan Diameter Zona Hambat Supernatan
Bebas Sel Isolat BAL terhadap E. coli... 39 7. Analisis Ragam Nilai pH substrat Antimikroba 12 Bakteri
Asam Laktat ... 39 8. Morfologidan Pewarnaan Gram Isolat Bakteri Asam Laktat
yang Diisolasi dari Daging Sapi ... 39 9. Gambar Uji Antagonistik Isolat BAL yang Diisolasi dari
Daging Sapi terhadap Bakteri Patogen ... 41 10. Gambar Konsentrasi Penghambatan Minimum (MIC) ... 42
PENDAHULUAN Latar Belakang
Bahan pangan hasil ternak, salah satunya yaitu daging memiliki sifat mudah rusak atau memiliki umur simpan yang pendek. Kerusakan bahan pangan dapat disebabkan oleh beberapa faktor, diantaranya oleh bakteri, walaupun tidak semua bakteri memiliki efek yang negatif. Sebagian bakteri dapat dimanfaatkan sebagai biopreservatif (bahan pengawet alami). Salah satu kultur bakteri yang sering dimanfaatkan sebagai biopreservatif yaitu bakteri asam laktat (BAL). Hal ini dimungkinkan karena BAL dapat menghasilkan produk metabolit yang bersifat antimikroba seperti asam organik, hidrogen peroksida, karbon dioksida, diasetil, bakteriosin serta mampu menghambat pertumbuhan bakteri patogen dan mikroorganisme yang mengkontaminasi makanan.
Konsumen yang menyadari akan pentingnya kesehatan lebih tertarik pada makanan yang tidak mengandung bahan pengawet terutama yang berasal dari bahan non pangan. Oleh karena itu orientasi pencarian bahan pengawet alami adalah yang dapat diterima konsumen. Bahan-bahan pengawet tersebut terdapat di dalam bahan pangan, misalnya berasal dari tumbuhan, hewan atau dihasilkan oleh mikroorganisme yang disebut biopreservatif.
Penggunaan BAL sebagai bahan pengawet alami dapat dilakukan melalui dua cara yaitu penambahan kultur BAL sebagai starter pada produk pangan atau hanya menggunakan metabolit antimikroba BAL sebagai pengawet alami. Penambahan kultur BAL sebagai starter telah banyak dikenal masyarakat dalam pembuatan produk fermentasi seperti yogurt, dadih, salami (sosis fermentasi), serta produk fermentasi lainnya, sedangkan pemanfaatan metabolit BAL yang bersifat antimikroba telah lama digunakan dalam industri pengolahan pangan yang kemudian dikembangkan secara komersil.
Keberadaan BAL sering ditemukan secara alamiah dalam bahan pangan. Bakteri ini hidup pada susu, daging segar dan sayur–sayuran dalam jumlah yang terbatas. Penelitian terdahulu (Hidayati, 2006) telah berhasil melakukan isolasi kultur BAL dari daging sapi, namun belum dilakukan karakterisasi BAL tersebut. Karakterisasi dan pemanfaatan produk metabolit dari BAL sebagai biopreservatif menarik untuk dilakukan, sehingga seleksi BAL berdasarkan aktivitas antimikroba
BAL dapat memperkaya koleksi isolat asli Indonesia (IAI) yang secara bersamaan dapat dipelajari aplikasinya sebagai biopreservatif. Penggunaan antimikroba alami dalam pengawetan daging, memerlukan informasi besarnya konsentrasi minimum yang dapat menghambat pertumbuhan bakteri patogen.
Tujuan
Penelitian ini bertujuan untuk mempelajari dan mendapatkan informasi tentang kemampuan BAL hasil isolasi dari daging sapi untuk menghasilkan substrat antimikroba serta mengetahui karakteristik dari substrat antimikroba yang dihasilkan, meliputi aktivitas dan konsentrasi minimum dari substrat antimikroba tersebut yang dapat menghambat bakteri patogen.
TINJAUAN PUSTAKA Bakteri Asam Laktat
Pemanfaatan bakteri asam laktat (BAL) dalam industri pangan telah dikenal secara luas. Menurut Fardiaz (1992) bakteri asam laktat secara umum dibagi menjadi dua kelompok, homofermentatif dan heterofermentatif. Kelompok homofermentatif hanya menghasilkan asam laktat selama proses fermentasi gula sedangkan heterofermentatif dapat membentuk sejumlah karbon dioksida, etil alkohol, asam asetat, dan gliserol bersamaan dengan sejumlah besar asam laktat. Sifat yang terpenting dari BAL adalah kemampuannya dalam memfermentasi gula manjadi asam laktat. Bakteri asam laktat sangat cepat dalam memproduksi asam laktat sehingga dapat menghambat pertumbuhan mikroba lain yang tidak diinginkan. Menurut Ray (1996) salah satu faktor yang mempengaruhi pertumbuhan BAL ialah faktor lingkungan (suhu dan aerasi).
Bakteri asam laktat merupakan bakteri Gram positif, tidak berspora, berbentuk batang maupun coccus, tidak memiliki sitokrom, dan bersifat anaerobik tetapi toleran terhadap O2 (Fardiaz, 1992). Bakteri asam laktat terdiri atas beberapa genus. Kelompok genus Lactococcus (dalam bentuk Streptococcus), Lactobacillus,
Pediococcus, dan Leuconostoc sering digunakan dalam proses fermentasi bahan pangan hasil ternak, sayur–sayuran, buah–buahan, daging dan produk sereal (Davidson dan Hoover, 1993).
Beberapa spesies dari bakteri ini dapat digunakan dalam proses fermentasi makanan (Ray, 1996). Tujuan awal dari penambahan mikroorganisme dalam bahan pangan adalah untuk proses pengawetan. Pengawetan produk fermentasi dengan bakteri asam laktat adalah dengan mengubah gula menjadi asam organik. Hal ini menyebabkan penurunan pH dan mengubah karbohidrat menjadi sumber nutrient. Bakteri asam laktat menghasilkan hidrogen peroksida, diasetil, dan bakteriosin sebagai inhibitor yang potensial dalam menghambat mikroorganisme lain (Davidson dan Hoover, 1993). Selain itu BAL dapat digunakan sebagai probiotik untuk meningkatkan mikroflora dalam saluran pencernaan (Ouwehand, 1998).
Bakteri asam laktat yang berasal dari bahan mentah atau lingkungan, dalam proses fermentasi daging secara spontan menyebabkan terbentuknya asam laktat dari
penggunaan karbohidrat dan menurunkan nilai pH 5,9 - 4,6 (Hugas dan Monfort, 1997). Bakteri asam laktat memproduksi sistem antimikroba seperti bakteriosin, sehingga BAL digunakan sebagai pengawet makanan yang alami untuk meningkatkan keamanan pangan. Antimikroba ini dapat dimanfaatkan dengan cara penambahan langsung BAL sebagai starter atau melalui metabolit antimikroba seperti asam organik atau bakteriosin yang berasal dari BAL (Earnshaw, 1999).
Zat Antimikroba
Zat antimikroba merupakan senyawa biologis atau kimia yang dapat menghambat pertumbuhan dan aktivitas mikroba. Menurut Fardiaz (1992), zat antimikroba dapat bersifat bakterisidal (membunuh bakteri), bakteristatik (menghambat pertumbuhan bakteri), fungisidal (membunuh kapang), fungistatik (menghambat pertumbuhan kapang), dan germisidal (menghambat germinasi spora bakteri). Kemampuan suatu zat antimikroba dalam menghambat pertumbuhan bakteri dipengaruhi oleh beberapa faktor yaitu (1) konsentrasi zat pengawet, (2) waktu penyimpanan, (3) suhu lingkungan, (4) sifat-sifat mikroba (jenis, umur, konsentrasi serta keadaan mikroba), (5) sifat-sifat fisik dan kimia makanan termasuk kadar air, pH, jenis senyawa didalamnya (Davidson dan Branen, 1993).
Fardiaz (1992) menyatakan, bahwa makanan mungkin mengandung komponen yang dapat menghambat pertumbuhan jasad renik. Komponen antimikroba tersebut terdapat dalam makanan dapat melalui beberapa cara antara lain: (1) terdapat secara alamiah di dalam bahan pangan, (2) sengaja ditambahkan ke dalam makanan tersebut dan (3) terbentuk selama pengolahan atau jasad renik yang tumbuh selama fermentasi makanan. Frazier dan Westhoff (1988) menyebutkan zat– zat yang digunakan sebagai antimikroba harus mempunyai beberapa kriteria seperti tidak bersifat racun bagi bahan pangan, ekonomis, tidak menyebabkan perubahan cita rasa dan aroma makanan, tidak mengalami penurunan aktivitas karena komponen makanan, tidak menyebabkan timbulnya resisten dan sebaliknya dapat menghambat pertumbuhan mikroba lain (mikroba pembusuk).
Asam Organik
Asam organik dalam bahan pangan dapat berfungsi sebagai asidulan atau pengawet, sementara garamnya atau ester dapat menjadi antimikroba yang efektif
pada pH yang mendekati netral (Roller, 2003). Hasil utama metabolit BAL berupa asam laktat dapat menyebabkan perubahan pH secara signifikan (Earnshaw, 1999). Terbentuknya asam laktat dan asam organik oleh bakteri asama laktat dapat menyebabkan penurunan pH dan mengakibatkan mikroba yang tidak tahan terhadap kondisi pH yang relatif rendah akan terhambat (Fardiaz 1992). Aktivitas asam-asam lipofilik seperti asam laktat dan asetat dalam bentuk tidak terdisosiasi dapat menembus sel mikroba dan pada pH intraseluler yang lebih tinggi, berdisosiasi menghasilkan ion-ion hidrogen dan mengganggu fungsi metabolik esensial seperti translokasi substrat dan fosforilasi oksidatif dengan demikian mereduksi pH intraseluler (Cabo et al., 2000).
Stratford (2000) menyatakan, bahwa asam lemah dapat menurunkan pH sitoplasma, mempengaruhi struktur membran dan fluiditasnya, serta mengkelat ion-ion dinding sel bakteri. Penurunan pH sitoplasma akan mempengaruhi protein struktural sel, enzim-enzim, asam nukleat dan fosfolipid membran (Davidson dan Branen, 1993). Molekul asam lemah yang tidak bermuatan (HA) dapat masuk melalui membran plasma. Anion (A-) dan proton (H+) akan terbentuk di dalam sel, selanjutnya proton yang berlebih di dalam sitoplasma akan dikeluarkan oleh enzim ATP-ase yang terdapat pada membran (Garbutt, 1997).
Hidrogen Peroksida
Hidrogen peroksida (H2O2) merupakan salah satu substrat antimikroba yang dihasilkan oleh bakteri. Hidrogen peroksida murni tidak berwarna, berbentuk cairan seperti sirup dan memiliki bau menusuk (Branen et al., 1990). Hidrogen peroksida secara umum memiliki spektrum penghambatan luas, meliputi bakteri, kapang, khamir, virus, dan mikroorganisme penghasil spora. Hidrogen peroksida lebih efektif dalam menghambat bakteri anaerobik karena kekurangan enzim katalase, yang mampu merusak peroksida (Davidson dan Branen, 1993).
Reaksi pembentukan H2O2 akan mengikat oksigen sehingga membentuk suasana anaerob yang akan membuat tidak nyaman bakteri aerob (Surono, 2004). Kemampuan bakterisidal dari H2O2 beragam tergantung pH, konsentrasi, suhu, waktu dan tipe serta jumlah mikroorganisme. Bakteri yang paling sensitif terhadap H2O2 adalah bakteri Gram negatif terutama koliform (Branen et al., 1990).
Bakteriosin
Bahan alami yang telah digunakan dan diuji aman untuk bahan pengawet alami yaitu bakteriosin yang berasal dari berbagai bakteri asam laktat (Ray, 1996). Definisi bakteriosin merupakan protein atau peptida antimikroba yang dapat menghambat bakteri lain (Earnshaw, 1999). Bakteriosin yang diproduksi oleh bakteri asam laktat biasanya digunakan sebagai biopreservatif makanan. Beberapa bakteriosin stabil terhadap panas, sehingga membuat bakteriosin tersebut aplikatif terhadap perlakuan panas. Bakteriosin bersifat irreversible, mudah dicerna, berpengaruh positif terhadap kesehatan dan aktif pada konsentrasi rendah (Vuyst dan Vandamme, 1993).
Tagg et al. (1976) menyatakan bahwa bakteriosin memiliki beberapa kriteria sebagai berikut: (1) mempunyai spektrum aktivitas yang relatif sempit, terpusat disekitar spesies penghasil (secara philogenik dekat), (2) senyawa aktif terutama terdiri dari fraksi protein, (3) bersifat bakterisidal, (4) mempunyai reseptor spesifik pada sel sasaran, dan (5) gen determinan terdapat pada plasmid yang berperan pada produksi dan imunitas.
Beberapa genus bakteri dapat menghasilkan peptida yang bersifat antimikroba yang kemudian lebih dikenal dengan nama bakteriosin. Bakteriosin sering diartikan sebagai protein dengan efek antagonistik sebagai bakterisidal atau bakteriostatik terhadap pertumbuhan bakteri. Berbagai genus bakteri Gram positif dan Gram negatif telah dilaporkan menghasilkan bakteriosin diantaranya genus
Lactobacillus, Micrococcus, Staphylococcus, Streptococcus, Pseudomonas, dan
Carnobakterium. Bakteriosin bersifat tahan panas pada pH rendah, sedangkan pada pH alkalis bakteriosin menjadi inaktif (Suarsana, 2003).
Menurut Schnell et al. (1988) sintesis bakteriosin oleh sel galur produsen terjadi selama pertumbuhan fase eksponensial, biasanya mengikuti pola klasik sintesis protein. Beberapa bakteriosin disintesis dalam bentuk lengkap secara langsung melalui jalur ribosom, sedangkan antibiotik disintesis secara ribosomal sebagai prepeptida kemudian mengalami modifikasi. Mekanisme penyerangan bakteriosin pada bakteri indikator dikarenakan bakteriosin terikat pada reseptor spesifik. Efek hambat selanjutnya disebabkan oleh terjadinya perubahan
permeabilitas dan integritas membran sehingga tidak terjadi pembelahan sel karena keluarnya beberapa material seluler atau sel mengalami lisis (Bhunia et al., 1988).
Mikrobiologi Daging
Mutu mikrobiologis dari suatu produk pangan ditentukan oleh jumlah dan jenis mikroorganisme yang terdapat dalam bahan pangan. Kontaminasi mikroorganisme yang terdapat dalam bahan pangan seperti daging dapat berasal dari sumber di luar ternak yang dipotong yaitu selama pemotongan, penanganan dan proses pengolahannya. Kontaminasi yang berasal dari pekerja antara lain Salmonella,
Shigella, Escherichia coli, Bacillus proteus, Staphylococcus albus, Staphylococcus aureus (Lawrie, 1995). Bakteri lain seperti Clostridium botulinum yang berasal dari tanah juga dapat mengkontaminasi daging (Soeparno, 1994).
Lawrie (1995) menyatakan bahwa faktor–faktor yang mempengaruhi pertumbuhan mikroorganisme pada daging dibagi dua kelompok, yaitu (1) faktor intrinsik antara lain nilai nutrisi daging, kadar air, nilai pH, potensi oksidasi reduksi dan ada tidaknya substansi penghambat dan (2) faktor ekstrinsik meliputi: suhu, kelembaban relatif, oksigen dan kondisi daging. SNI mensyaratkan batas maksimum cemaran mikroba seperti tercantum pada Tabel 1.
Tabel 1. Batas maksimum Cemaran Mikroba pada Daging (CFU/g) SNI No. 01-6366-2000 (BSN, 2000)
No Jenis cemaran mikroba Batas maksimum cemaran mikroba Daging segar/beku Daging tanpa tulang 1 2 3 4 5 6 7 8 9
Angka lempeng total bakteri (ALTB) Escherichia coli* Staphylococcus aureus Clostridium sp Salmonella sp** Coliform Enterococci Campylobacter sp Listeria sp 1x104 5x101 1x101 0 Negatif 1x102 1x102 0 0 1x104 1x101 1x101 0 Negatif 1x102 1x102 0 0 Keterangan : (*) dalam satuan MPN/gram
Bakteri Patogen
Bakteri patogen merupakan mikroorganisme indikator keamanan pangan. Beberapa mikroba yang diamati sebagai bakteri pembusuk dan patogen pada produk fermentasi terdiri atas famili Enterobakteriaceae seperti Enterobacter, Erwinia,
Escherichia, Citobacter, Klebsiella, Proteus, Salmonella, Serattia, Shigella, dan
Yersinia (Fardiaz, 1992). Bakteri ini dapat dibedakan atas penyebab intoksikasi dan penyebab infeksi. Intoksikasi terjadi bila makanan yang dimakan telah mengandung toksin yang dihasilkan oleh bakteri yang tumbuh pada makanan tersebut. Infeksi disebabkan oleh masuknya bakteri ke dalam tubuh melalui makanan yang telah terkontaminasi dan adanya reaksi dari tubuh terhadap keberadaan atau metabolit– metabolit yang dihasilkan bakteri selama tumbuh dalam tubuh.
Berdasarkan sifat pewarnaan bakteri, bakteri patogen dapat dibedakan menjadi dua yaitu kelompok bakteri Gram positif dan Gram negatif. Kelompok bakteri patogen Gram positif diantaranya Staphylococcus aureus, dan kelompok bakteri patogen Gram negatif diantaranya Escherichia coli dan Salmonella typhimurium (Fardiaz, 1992).
Staphylococcus aureus
Menurut Fardiaz (1992) S. aureus berbentuk bulat dengan diameter 0,8–1,0 mm dan termasuk dalam famili micrococcaceae. Bakteri ini merupakan bakteri Gram positif yang tidak memiliki spora dan katalase positif. Staphylococcus aureus bersifat anaerob fakultatif, dengan bentuk tunggal, berpasangan, rantai pendek atau bergerombol seperti anggur serta bersifat non motil. Suhu optimum dari S. aureus
adalah 370C sedangkan suhu minimum dan maksimumnya berturut–turut 6,70C– 45,50C. Bakteri ini dapat tumbuh dengan baik pada pH 4,0–8,0 dan pH optimum pada 7–7,5. Waktu generasi yang dimiliki oleh S. aureus adalah 27–30 menit.
Staphylococcus masih dapat hidup pada media dengan konsentrasi NaCl 7,5%. Sebagian dari galur S. aureus bersifat koagulasi positif (mampu mengkoagulasi plasma darah) dan dapat memproduksi enterotoksin yang dapat menimbulkan keracunan makanan. Sumber penyebaran S. aureus dapat berasal dari manusia dan hewan. Penyebaran yang berasal dari manusia berasal dari infeksi saluran pernapasan pada kulit. Udara bukan salah satu faktor yang penting untuk tumbuhnya bakteri, kecuali jika berasal dari manusia sebagai sumber pembawa. Cara
untuk menginaktifkan S. aureus dapat dilakukan dengan pemanasan hingga 600C selama kurang lebih 12 menit (Frazier dan Westhoff, 1988).
Salmonella typhimurium
Salmonella sp. merupakan bakteri patogen yang berbahaya. Selain menyebabkan gejala kelainan gastrointestinal, Salmonella sp. juga dapat menyebabkan demam tifus dan paratifus (Fardiaz, 1992), dan salmonellosis (Varnam dan Sutherland, 1995). Salmonella merupakan salah satu mikroorganisme yang dapat ditemui pada daging (Frazier dan Westhoff, 1988). Salmonella typhimurium
merupakan bakteri Gram negatif, dan patogen dalam saluran pencernaan karena dapat menyebabkan enteric fever, gastro enteric atau keracunan makanan (Duerden
et al, 1993).
Salmonella sp. dapat memproduksi asam hasil fermentasi dan H2S, tumbuh pada suhu optimum 370C dengan pH 4 – 9 serta memiliki aw minimum 0,94 (Varnam dan Sutherland, 1995). Salmonella sp. termasuk dalam famili Enterobactericeae, memiliki bentuk batang, anaerob fakultatif dan memiliki flagella peritrikat. Bakteri ini sangat sensitif terhadap panas sehingga dapat dimusnahkan dengan proses pasteurisasi (Fardiaz, 1989).
Escherichia coli
Bakteri ini memiliki bentuk batang dan tergolong dalam bakteri Gram negatif. Escherichia coli tumbuh pada suhu optimum 370C dan pada kisaran suhu 100C – 400C. Nilai pH optimum pertumbuhannya 7,0 – 7,5. Bakteri ini memiliki ukuran panjang 2,0 – 6,0 mikron, sering terdapat dalam bentuk tunggal atau berpasangan, bersifat motil atau non motil dengan flagella peritrikat, bersifat anarobik fakultatif, dan tergolong dalam famili Enterobactericeae (Fardiaz, 1992).
Escherichia coli merupakan pengkatalisa karbohidrat dengan formasi asam dan gas (Holt et al., 1994).
Escherichia coli termasuk mikroorganisme tidak menguntungkan pada keadaan normal (Gaman dan Sherrington, 1992). Escherichia coli disebut juga koliform fekal karena ditemukan dalam saluran usus hewan dan manusia. Selain itu
Minimum Inhibitory Concentration (MIC)
Penghambatan mikroba oleh suatu senyawa antimikroba dapat dinyatakan dalam nilai MIC. Consentino (1999) mendefinisikan MIC sebagai konsentrasi terendah yang dapat menghambat pertumbuhan mikroba sebanyak 90% dari inokulum asal selama inkubasi 24 jam. Nilai MIC senyawa antimikroba yang lebih rendah menunjukkan bakteri lebih sensitif terhadap senyawa tersebut (Naufalin, 2005). Fase pertumbuhan berpengaruh terhadap sensitifitas bakteri terhadap senyawa antimikroba. Bakteri pada fase stasioner lebih sensitif terhadap antimikroba asam lemah rantai pendek pada fase pertumbuhan. Hal ini disebabkan penambahan asam rantai pendek seperti propionat pada fase pertumbuhan (Thompson dan Hintom, 1996), .
METODE Lokasi dan Waktu
Penelitian ini dilaksanakan selama enam bulan yaitu bulan November 2007 sampai April 2008. Lokasi penelitian dilakukan di Laboratorium Bagian Ilmu Produksi Ternak Perah dan Laboratorium Bagian Ilmu Produksi Ternak Ruminansia Besar, Fakultas Peternakan, Institut Pertanian Bogor.
Materi
Bahan–bahan utama yang digunakan dalam penelitian ini adalah 12 isolat bakteri asam laktat yang berasal dari daging sapi (Arief et al., 2006). Bakteri uji yang digunakan adalah tiga bakteri patogen: Staphylococcus aureus ATCC 25923,
Escherichia coli ATCC 25922, dan Salmonella typhimurium ATCC 14028. Media yang digunakan adalah deMan Rogosa Sharp Agar (MRSA), deMan Rogosa Sharp Broth (MRSB), Muller Hilton Agar (MHA), Nutrient Broth (NB), Yeast Extrax (YE),
Nutrient Agar (NA), Bacteriological Agar (BA), larutan pengencer Buffer Peptone Water (BPW) 1 %, NaOH 1 N, aquadest, kristal violet, iodium, etanol 95%, safranin, dan phenophtalein 1%.
Alat–alat yang digunakan dalam penelitian ini adalah cawan Petri, pipet volumetrik, pipet 5 ml, pipet Pasteur, mikro pipet, tabung reaksi, inkubator, pH meter, jarum Ose, gelas objek, labu Erlenmeyer, mikroskop, kamera digital, kertas saring, pemanas Bunsen, jangka sorong, autoclaf, alumunium foil, oven,
spektrofotometer, refrigerator, membran filter (0,22 µm) dan alat sentrifugasi.
Rancangan Percobaan
Rancangan percobaan yang digunakan untuk mempelajari aktivitas antimikroba pada bakteri uji adalah rancangan acak lengkap (RAL) pola searah dengan 3 kali ulangan.
Model analisis yang digunakan sebagai berikut: Yij = µ + Ai + εij
Keterangan:
Yij = respon pengaruh perlakuan sifat antimikroba bakteri asam laktat µ = rata – rata
Ai = pengaruh sifat antimikroba εij = galat percobaan
Peubah yang diamati adalah parameter zona hambat yang terbentuk. Data yang didapatkan dianalisis dengan menggunakan Anova. Jika berbeda nyata dilakukan uji lanjut Tukey (Steel dan Torrie, 1995).
Prosedur Penelitian Pendahuluan
Penelitian ini meliputi pemeriksaan kembali 12 isolat bakteri yang diduga bakteri asam laktat hasil isolasi dari daging sapi melalui pewarnaan Gram dan uji katalase.
Pewarnaan Gram (Hadioetomo, 1990). Sampel bakteri dari koloni yang homogen dioleskan pada kaca objek kemudian difiksasi panas. Olesan bakteri diteteskan dengan kristal violet selama satu menit, diratakan, dibilas dengan aquadest, dan dikering udarakan. Olesan bakteri selanjutnya diteteskan iodium Gram selama dua menit, kemudian dibilas aquadest dan ditiriskan. Preparat dicuci dengan pemucat warna yaitu etanol 95%, tetes demi tetes selama 30 detik, dicuci segera dengan
aquadest dan ditiriskan. Preparat selanjutnya diteteskan safranin selama 30 detik, dibilas dengan aquadest dan ditiriskan. Setelah kering preparat di amati dibawah mikroskop dengan perbesaran 100 kali. Bakteri yang termasuk dalam kelompok Gram positif akan menunjukkan warna biru keunguan sedangkan kelompok bakteri Gram negatif adalah berwarna merah safranin. Hasil pengamatan preparat didokumentasikan dalam bentuk fotografik.
Uji Katalase. Sampel bakteri dari koloni yang homogen dioleskan pada kaca objek. Olesan bakteri diteteskan H2O2. Uji katalase didapat dengan melihat gelenbung udara yang terbentuk. Terbentuknya gelembung udara (+) menyatakan bahwa bakteri memiliki katalase positif, sebaliknya bila hasil yang didapatkan tidak menunjukkan adanya gelembung (-) maka bakteri yang diujikan termasuk dalam kelompok bakteri katalase negatif.
Penelitian Utama
Penelitian ini meliputi uji antagonistik, pengukuran pH dari supernatan bebas sel 12 isolat bakteri yang diisolasi dari daging sapi, karakterisasi senyawa antimikroba, pengukuran total asam tertitrasi (TAT), serta konsentrasi minimum penghambatan terhadap bakteri uji oleh isolat bakteri yang memiliki diameter zona hambat terbesar.
Uji Antagonistik
Pembuatan Media MHA. Pembuatan media Muller Hinton Agar (MHA) adalah dengan cara melarutkan 34 gram bubuk MHA ke dalam satu liter aquadest, larutan yang terbentuk dimasukkan ke dalam botol scott kemudian dipanaskan hingga homogen. Media MHA disterilkan dalam autoclaf selama 15 menit pada suhu 1210C.
Pembuatan Media MRSB. Pembuatan media deMan Rogosa Sharp Broth (MRSB) adalah dengan cara melarutkan 52 gram bubuk MRSB dan 2,6 gram Yeast Extrax
(YE) ke dalam satu liter aquadest, larutan yang terbentuk dimasukkan ke dalam botol
scott kemudian dipanaskan hingga homogen. Media MRSB disterilkan dalam
autoclaf selama 15 menit pada suhu 1210C.
Pembuatan Media MRSA. Pembuatan media deMan Rogosa Sharp Agar (MRSA) adalah dengan cara melarutkan 52 gram bubuk MRSB dan 20 gram Bacteriological Agar (BA) ke dalam satu liter aquadest, larutan yang terbentuk dimasukkan ke dalam botol scott kemudian dipanaskan hingga homogen. Media MRSA disterilkan dalam
autoclaf selama 15 menit pada suhu 1210C.
Pembuatan Media NA. Pembuatan media Nutrient Agar (NA) adalah dengan cara melarutkan 23 gram bubuk NA ke dalam satu liter aquadest, larutan yang terbentuk dimasukkan ke dalam botol scott kemudian dipanaskan hingga homogen. Media NA disterilkan dalam autoclaf selama 15 menit pada suhu 1210C.
Pembuatan Media NB. Pembuatan media Nutrient Broth (NB) adalah dengan cara melarutkan 8 gram bubuk NB ke dalam satu liter aquadest, larutan yang terbentuk dimasukkan ke dalam botol scott kemudian dipanaskan hingga homogen. Media NB disterilkan dalam autoclaf selama 15 menit pada suhu 1210C.
Pembuatan Larutan Pengencer BPW. Pembuatan larutan pengencer Buffer Peptone Water (BPW) adalah dengan cara melarutkan 20 gram bubuk BPW ke dalam satu liter aquadest, larutan yang terbentuk dimasukkan ke dalam tabung reaksi tertutup. Media BPW disterilkan dalam autoclaf selama 15 menit pada suhu 1210C.
Persiapan Bakteri Uji. Bakteri uji yang digunakan adalah Staphylococcus aureus
ATCC 25923 sebagai bakteri patogen Gram positif, serta Escherichia coli ATCC 25922, dan Salmonella typhimurium ATCC 14028 sebagai bakteri patogen Gram negatif. Bakteri uji dibiakkan pada media NA selama 24 jam pada suhu 37oC, untuk memperoleh kultur kerja. Sebanyak satu ose kultur kerja tersebut diperbanyak dengan cara dibiakkan ke dalam tabung berisi media NB sebanyak 5 ml dan diinkubasi selama 24 jam pada suhu 37oC. Standardisasi kultur bakteri uji umur 24 jam dilakukan dengan cara penyetaraan kekeruhannya sesuai standar Mc. Farland
no. 2, untuk menghasilkan populasi bakteri setara 6 x 108 sel bakteri/ml. Konfrontasi bakteri uji dengan substrat antimikroba menggunakan konsentrasi bakteri 6 x106 sel bakteri/ml yang diperoleh dengan cara mengencerkannya dalam BPW steril.
Persiapan Supernatan Bebas Sel dari Isolat Bakteri Asam Laktat. Sebanyak 12 spesies bakteri asam laktat yang diisolasi dari daging sapi lokal masing-masing diinokulasikan ke media deMan Rogosa Sharp Broth (MRSB) dan diinkubasikan pada suhu 37oC selama 24 jam. Supernatan bebas sel dipanen melalui sentrifugasi. Supernatan bebas sel selanjutnya disebut supernatan. Kondisi sentrifugasi yang digunakan yaitu (a) kecepatan 6.000 rpm pada suhu 4oC selama 15 menit tanpa filtrasi dan (b) kecepatan 10.000 rpm pada suhu 4oC selama 20 menit dengan filtrasi (0,22 µm). Supernatan yang diperoleh siap diuji aktivitas antimikrobanya dengan menggunakan metode agar well diffusion (difusi agar).
Persiapan Media dan Metode Konfrontasi Difusi Agar (Bromberg et al., 2004). Suspensi bakteri uji yang telah diencerkan dengan populasi 6 x106 sel bakteri/ml diambil sebanyak satu ml dengan pipet steril ke dalam cawan Petri steril. Media
Muller Hinton Agar (MHA) steril bersuhu ±50oC sebanyak 20 ml dituangkan ke dalamnya. Campuran dihomogenkan dengan cara cawan Petri digerakkan membentuk angka delapan di atas bidang datar. Setelah media agar mengeras dibuat
sumur berdiameter lima mm dengan menggunakan ujung pipet Pasteur steril sebanyak jumlah isolat yang diuji yaitu delapan buah yang merupakan duplo untuk setiap bakteri uji. Di dasar sumur ditutup dengan Bacteriological Agar (BA) dengan tujuan supernatan tidak meresap di dasar media agar.
Konfrontasi dilakukan dengan menambahkan sebanyak 50 µl supernatan ke dalam sumur yang telah disiapkan. Cawan Petri beserta isinya diletakkan selama dua jam dalam refrigerator agar supernatan meresap ke dalam media agar. Selanjutnya cawan diinkubasi pada suhu 37oC selama 24 jam untuk memberikan kesempatan supernatan beraktivitas terhadap bakteri uji. Zona bening (zona hambat) yang terbentuk menunjukkan adanya hambatan terhadap pertumbuhan bakteri uji oleh supernatan. Diameter zona hambat (mm) diukur dengan jangka sorong sebanyak tiga kali pada posisi yang berbeda dan dirata-ratakan (Gambar 1).
Gambar 1. Metode Pengukuran Zona Hambat
Pengukuran pH (DSN, 1992). Sebelum persiapan karakterisasi substrat antimikroba dilakukan pengukuran nilai pH supernatan menggunakan pH meter yang terlebih dulu dikalibrasi dengan buffer untuk pH 4 dan 7. Kalibrasi dilakukan setiap akan melakukan pengukuran. Pengukuran dilakukan dengan mencelupkan elektroda ke dalam supernatan bebas sel setelah terlebih dahulu elektroda dibersihkan dengan
aquadest. Skala nilai pH dibaca pada saat muncul kata ready atau angka penunjuk telah berada pada posisi tetap.
Keterangan:
A: Sumur untuk supernatan bebas sel (5 mm) B : Zona hambat (zona bening)
C : Cawan Petri (media MHA)
Garis / / : Pengukuran diameter zona bening
C
B
A
Karakterisasi Substrat Antimikroba
Bakteriosin. Supernatan bebas sel hasil sentrifugasi dikondisikan pada pH 7,0 dengan penambahan NaOH 1 N dan disaring dengan membran filter 0,22 μm. Selanjutnya supernatan yang merupakan ekstrak kasar bakteriosin tersebut siap untuk diuji aktivitasnya dengan metode difusi agar (Bromberg et al., 2004). Setiap pengujian dilakukan sebanyak tiga kali ulangan, masing-masing ulangan dilakukan secara duplo.
Bila dihasilkan zona hambat berarti terdapat substrat bakteriosin di dalam supernatan. Aktivitas penghambatan senyawa antimikroba yang dihasilkan dinyatakan dalam satuan Arbitrary Unit (AU), satu AU = satu mm2/ml. Isolat bakteri yang memiliki penghambatan terbaik pada uji antagonistik ini akan diteliti lanjut untuk penentuan nilai minimum inhibitory concentration (MIC).
AU = Luas zona bening-Luas sumur Volume substrat
Pengukuran Total Asam Tertitrasi (DSN, 1992). Supernatan bebas sel dipipet sebanyak sepuluh ml ke dalam labu Erlenmeyer, kemudian ditambahkan tiga tetes larutan indikator phenophtalein 1%. Selanjutnya supernatan dititrasi dengan larutan NaOH 0,1 N sampai terbentuk warna merah muda.
Perhitungan :
% Jumlah Asam = b x c x 90,08 x 100% a x 1000
Keterangan : a = bobot/volume sampel, dinyatakan dalam ml b = volume larutan NaOH, dinyatakan dalam ml c = normalitas larutan NaOH
Minimum Inhibitory Concentration (MIC) (Kubo, 1993). Minimum Inhibitory Concentration (MIC) adalah konsentrasi terendah senyawa antimikroba yang mampu menghambat pertumbuhan bakteri uji pada kondisi yang telah ditentukan. Konsentrasi terendah yang dapat menghambat pertumbuhan bakteri uji dilihat dari tingkat kekeruhan setelah waktu inkubasi. Tahapan penentuan MIC meliputi :
Persiapan Bakteri Uji. Media untuk pertumbuhan bakteri uji yang digunakan adalah
reaksi masing-masing sebanyak 9 ml. Selanjutnya ditambahkan 1 ml inokulum bakteri uji (Staphylococcus aureus, Escherichia coli dan Salmonella typhimurium) hingga diperoleh konsentrasi log 7 cfu/ml.
Penentuan Minimum Inhibitory Concentration Substrat Antimikroba. Bakteri uji yang digunakan untuk penentuan MIC substrat antimikroba adalah Staphylococcus aureus, Escherichia coli dan Salmonella typhimurium. Penentuan MIC bertujuan untuk mendapatkan konsentrasi minimum dari substrat antimikroba untuk dapat menghambat pertumbuhan bakteri uji yang termasuk bakteri patogen. Prosedur penentuan MIC substrat antimikroba dilakukan sebagai berikut: supernatan bebas sel (substrat antimikroba) yang telah difilter, dipipet sebanyak 10 ml, 20 ml, 30 ml, 40 ml, 50 ml, 60 ml, 70 ml, 80 ml, 90 ml, dan 100 ml ke dalam tabung reaksi kemudian ditambahkan deMan Rogosa Sharp Broth (MRSB) masing-masing sebanyak 90 ml, 80 ml, 70 ml, 60 ml, 50 ml, 40 ml, 30ml, 20 ml, 10 ml dan 0 ml secara berurutan. Campuran media tersebut didistribusikan masing-masing konsentrasi ke dalam tabung reaksi sebanyak sembilan ml, kemudian ditambahkan masing-masing bakteri uji yang berumur 24 jam dengan konsentrasi log 7 cfu/ml. Media yang telah berisi bakteri uji diinkubasi pada suhu 370 C selama 24 jam.
Pertumbuhan bakteri uji diamati secara visual untuk menentukan tidak terjadinya pertumbuhan pada bakteri tersebut. Bakteri uji yang tidak tumbuh akan menunjukkan tingkat kekeruhan yang sama dengan media awal sebelum waktu inkubasi. Selanjutnya tingkat kekeruhan yang menunjukkan pertumbuhan bakteri uji diukur dengan spektrofotometer untuk menentukan nilai optical density (OD) pada panjang gelombang 520 nm (Gambar 2).
Perhitungan :
% Penghambatan = 100% - (Nt / No x 100%) Keterangan: No = Populasi awal
Gambar 2. Persiapan Media MIC dan Penentuan Nilai MIC
+
10 ml 20 ml 30 ml 40 ml 50 ml 60 m 70 ml 80 ml 90 ml 100 ml 11100ml 90 ml 80 ml 70 ml 60 ml 50 ml 40 m 30 ml 20 ml 10 ml 0 ml Media MRSB 9 ml 9 ml 9 ml 9 ml 9 ml 9 m 9 ml 9 ml 9 ml 9mlBakteri uji (Log 7 cfu/ml)
Inkubasi 24 Jam pada suhu 37°C
Spektrofotometer (Nilai OD)
supernatan bebas sel
Media MRSB + Supernatan Bebas Sel
+
HASIL DAN PEMBAHASAN Penelitian Pendahuluan
Penelitian pendahuluan meliputi persiapan kultur bakteri asam laktat (BAL) asal daging sapi, dan persiapan bakteri uji. Tujuan dari penelitian pendahuluan adalah untuk memeriksa karakteristik morfologis dan kemurnian isolat bakteri yang akan digunakan. Isolat bakteri yang akan digunakan berjumlah 12 isolat yang berasal dari daging sapi. Karakterisktik morfologis yang diamati meliputi respon terhadap pewarnaan Gram, bentuk dan susunan sel serta uji katalase.
Kelompok genus Lactobacillus adalah bakteri Gram positif, katalase negatif, dan memiliki bentuk batang (Fradiaz, 1992). Isolat 2B4, 1D3, 2A3, 1B2, 2D41, 1C1, 2B2, dan 1A2 tergolong dalam Gram positif yang mempunyai bentuk batang dengan susunan tunggal atau rantai serta hasil uji katalase yang negatif. Berdasarkan hasil uji fermentasi gula menunjukkan bahwa isolat 1D3 dan 2B4 merupakan spesies bakteri
Lactobacillus fermentum dengan tingkat akurasi 96% dan 99% (Tribowo, 2006).
Isolat BAL yang tergolong dalam kelompok bakteri Gram positif yang berbentuk
coccus (bulat) dengan rantai panjang maupun pendek yaitu 2D2, 2D42, 1A4 dan 2C12, jenis bakteri yang tergolong dalam kelompok ini adalah famili
Streptococcaceae. Kelompok famili Streptococcaceae merupakan bakteri berbentuk bulat yang membentuk rantai pendek dan panjang (Fardiaz, 1992). Hal ini sesuai dengan penelitian terdahulu yang menyatakan bahwa isolat bakteri tersebut tergolong dalam kelompok bakteri genus Lactobacillus sp. dan Streptococcaceae. Perbedaan kemampuan isolat dalam memfermentasi beberapa gula menunjukkan bahwa isolat-isolat tersebut adalah isolat-isolat yang berbeda(Hidayati, 2006).
Kultur asal daging sapi lokal yang digunakan merupakan kelompok BAL. Dua belas isolat BAL yang diisolasi dari daging sapi merupakan Gram positif dengan hasil uji katalase negatif. Hasil tersebut menunjukkan bahwa kultur tidak tercemar dan masih homogen seperti yang diperoleh pada penelitian sebelumnya (Hidayati, 2006). Hasil pengamatan karakteristik morfologi isolat BAL disajikan pada Tabel 2.
Tabel 2. Karakteristik Isolat BAL yang Diisolasi dari Daging Sapi Isolat BAL Pewarnaan Gram Uji Katalase Morfologi Gambar Morfologi 2D2 Gram Positif
Negatif Berbentuk bulat, susunan tunggal maupun rantai pendek
1A4 Gram
Positif
Negatif Berbentuk bulat, susunan tunggal maupun rantai pendek
2D42 Gram
Positif
Negatif Berbentuk bulat, susunan tunggal maupun rantai pendek
2C12 Gram
Positif
Negatif Berbentuk bulat, susunan tungal maupun rantai pendek
1B2 Gram
Positif
Negatif Berbentuk batang, susunan tunggal maupun rantai pendek
2D41 Gram
Positif
Negatif Berbentuk batang, susunan tunggal maupun rantai pendek
2A3 Gram
Positif
Negatif Berbentuk batang, susunan tunggal maupun rantai pendek
1C1 Gram
Positif
Negatif Berbentuk batang, susunan tunggal maupun rantai pendek
1D3 Gram
Positif
Negatif Berbentuk batang, susunan tunggal maupun rantai pendek
2B2 Gram
Positif
Negatif Berbentuk batang, susunan tunggal maupun rantai pendek
1A2 Gram
Positif
Negatif Berbentuk batang, susunan tunggal maupun rantai pendek
2B4 Gram
Positif
Negatif Berbentuk batang, susunan tunggal maupun rantai pendek
Populasi Awal Bakteri Uji
Keberadaan bakteri uji (S. aureus, S. typhimurium, dan E.coli) dalam daging menjadi standar cemaran dalam SNI seperti yang tertera pada Tabel 1. Bakteri uji yang digunakan untuk uji konfrontasi antara lain Escherichia coli ATCC 25922,
Staphylococcus aureus ATCC 25923 dan Salmonella typhimurium ATCC 14028.
Pemilihan ketiga bakteri uji ini mengacu pada ketentuan SNI 01-6366-2000 tentang cemaran mikrobiologis pada daging yang menyatakan bahwa ketiga bakteri patogen tersebut perlu mendapatkan perhatian khusus sebagai cemaran mikroba pada daging. Persiapan bakteri uji bertujuan untuk mengetahui jumlah populasi awal dari bakteri uji. Total populasi awal bakteri uji dapat dilihat pada Tabel 3.
Tabel 3. Total Populasi Awal Bakteri Uji
Jenis Bakteri Uji Populasi awal Nilai OD
(cfu/ml)
Escherichia coli ATCC 25922 3,2 x 106 0,307
Staphylococcus aureus ATCC 25923 5,6 x 106 0,283
Salmonella typhimurium ATCC 14028 4,4 x 106 0,314
Penelitian Utama
Penelitian utama adalah identifikasai keberadaan substrat antimikroba serta jenis antimikroba yang menyusun supernatan bebas sel dan nilai konsentrasi minimum yang dapat menghambat pertumbuhan bakteri uji. Identifikasi substrat antimikroba dilakukan dengan uji antagonistik antara supernatan dengan bakteri uji.
Identifikasi Keberadaan Substrat Antimikroba yang Dihasilkan Isolat BAL Asal Daging Sapi
Isolat BAL yang telah berhasil diisolasi dari daging sapi memiliki kemampuan mensekresikan substrat tertentu yang bersifat antimikroba. Substrat antimikroba diperoleh dengan cara melakukan sentrifugasi terhadap kultur untuk memisahkan sel dan supernatan bebas sel pada kecepatan 6.000 rpm.
Aktivitas substrat antimikroba dapat dibuktikan dengan uji antagonistik. Pengujian ini dilakukan untuk melihat kemampuan suatu isolat bakteri menghambat bakteri lain yang patogen. Hasil uji antagonistik menunjukkan bahwa 12 jenis isolat
BAL yang diisolasi dari daging sapi dapat memproduksi senyawa antimikroba yang dapat menghambat pertumbuhan bakteri uji (bakteri patogen). Masing-masing jenis isolat mempunyai kemampuan yang tidak berbeda nyata dalam menghambat pertumbuhan bakteri uji. Zona hambat yang terbentuk pada uji antagonistik dapat dilihat pada Tabel 4.
Tabel 4. Rataan Diameter Zona Hambat* 12 Isolat BAL terhadap Bakteri Uji Jenis Isolat
Bakteri
Bakteri Uji
S. aureus S. typhimurium E.coli
---(mm)--- 2D2 11,29± 6,35 10,36 ± 3,53 5,89 ± 0,79 1D3 8,21± 5,56 11,55 ± 5,67 6,50 ± 2,60 2A3 11,06± 5,60 7,31 ± 1,01 6,60 ± 1,69 2C12 9,6± 4,23 13,62 ± 1,27 5,00 ± 0,00 1B2 10,08± 4,56 12,19 ± 1,12 5,00 ± 0,00 2D41 10,97± 6,06 10,08 ± 1,19 5,00 ± 0,00 1A4 7,85± 4,94 10,42 ± 4,84 7,3 ± 2,00 1C1 9,62± 6,41 10,57 ± 3,50 6,72 ± 1,67 2D42 12,07± 6,73 9,07 ± 3,66 5,00 ± 0,00 2B2 8,64± 5,07 10,6 ± 5,61 7,37 ± 2,90 1A2 10,52± 5,28 9,89 ± 4,32 6,31 ± 1,15 2B4 11,58± 5,76 8,86 ± 3,35 8,97 ± 0,44
Keterangan : * Besarnya diameter zona hambat termasuk diameter lubang sumur (5 mm)
Penghambatan terhadap bakteri uji S. aureus oleh 12 jenis substrat isolat BAL yang diisolasi dari daging sapi menunjukkan hasil yang tidak berbeda nyata (P>0,05). Hal ini membuktikan bahwa 12 jenis isolat BAL tersebut memiliki daya hambat yang sama terhadap S. aureus. Penghambatan lainnya yaitu terhadap bakteri uji S. typhimurium. Penghitungan secara statistik, perbedaan isolat tidak berpengaruh nyata (P>0,05) terhadap penghambatan S. typhimurium. Hasil ini menunjukkan bahwa bakteri uji S. typhimurium memiliki sensitivitas yang sama terhadap senyawa antimikroba yang dihasilkan oleh 12 jenis isolat BAL tersebut. Penghambatan terhadap pertumbuhan bakteri uji E. coli tidak ditunjukkan oleh isolat 2C12, 1B2, 2D41, dan 2D42. Walaupun demikian, secara hitungan statistik penghambatan
terhadap pertumbuhan bakteri uji tidak berbeda nyata (P>0,05) pada jenis isolat BAL yang berbeda.
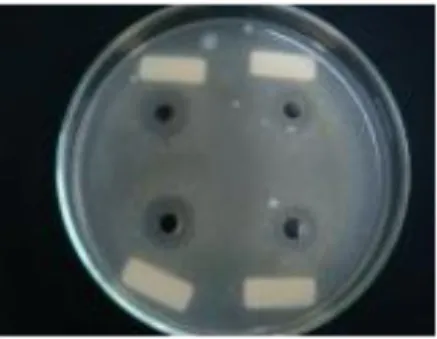
Aktivitas substrat antimikroba yang dihasilkan oleh isolat BAL ditunjukkan dengan terbentuknya daerah yang lebih bening di sekitar lubang sumur. Hal tersebut membuktikan adanya aktivitas penghambatan pertumbuhan bakteri uji oleh isolat BAL. Aktivitas penghambatan pertumbuhan bakteri uji disebabkan oleh senyawa antimikroba yang dihasilkan oleh isolat BAL asal daging sapi. Pembentukan zona hambat oleh isolat BAL dapat dilihat pada Gambar 2.
Gambar 2. Kemampuan Antagonistik Isolat BAL terhadap Bakteri Uji E. coli
Dua belas isolat dapat menghasilkan antimikroba yang mampu menghambat pertumbuhan bakteri uji (Tabel 4). Bakteri asam laktat dapat menghasilkan substansi antimikroba seperti asam-asam organik, hidrogen peroksida, dan bakteriosin. Mekanisme dari masing-masing antimikroba yang dihasilkan berbeda-beda dalam menghambat bakteri uji.
Identifikasi Jenis Antimikroba Penyusun Supernatan Bebas Sel
Hasil identifikasi substrat antimikroba yang diperoleh dengan cara melakukan sentrifugasi terhadap kultur untuk memisahkan sel dan supernatan bebas sel pada kecepatan 6.000 rpm selama 15 menit menunjukkan bahwa isolat BAL asal daging sapi menghasilkan senyawa antimikroba. Pengujian dilanjutkan dengan mengidentifikasi jenis substrat antimikroba yang dihasilkan. Tahap identifikasi jenis substrat antimikroba, supernatan diperoleh dengan cara sentrifugasi kecepatan 10.000 rpm selama 20 menit pada suhu 40C (Savadogo et al., 2004). Tujuan dari peningkatan kecepatan sentrifugasi yang lebih tinggi untuk mendapatkan supernatan yang betul-betul bebas sel. Kecepatan sentrifugasi 6.000 rpm masih menunjukkan zona hambat yang bersifat parsial diduga karena terdapat sel BAL yang belum
mengendap secara sempurna. Hasil pengamatan supernatan yang diperoleh dengan kecepatan 10.000 rpm menghasilkan zona hambat yang bening seperti yang dapat dilihat pada Tabel 5.
Tabel 5. Rataan Diameter Zona Hambat* Supernatan Bebas Sel Isolat BAL terhadap Bakteri Uji
Isolat
BAL Nilai pH
Bakteri Uji
S. aureus S. typhimurium E.coli
---(mm)--- 2D2 3,93f ±0,05 9,76a ±2,58 8,93abcde ±0,23 7,56a ±0,65 1D3 4,07def ±0,06 5,00b ±0,00 7,27e ±1,22 6,78a ±0,53 2A3 4,27c ±0,06 5,43b ±0,74 7,43de ±0,43 6,86a ±0,42 2C12 4,70a ±0,00 6,44ab ±1,57 7,77bcde ±0,66 8,37a ±2,28 1B2 3,93f ±0,06 8,47ab ±1,76 9,71ab ±1,23 9,37a ±2,44 2D41 4,03def ±0,05 7,07ab ±1,22 8,47abcde ±0,54 10,52a ±2,89 1A4 4,50b ±0,00 5,54b ±0,93 8,47abcde ±1,41 8,07a ±1.46 1C1 4,10de ±0,00 8,40ab ±1,58 10,08a ±1,64 9,5a ±0,96 2D42 4,13cde ±0,06 5,40b ±0,70 9,42 abcd ±1,51 7,38a ±0,63 2B2 4,00ef ±0,10 9,72a ±0,96 9,64abc ±1,51 10,49a ±2,17 1A2 4,03def ±0,06 5,42b ±0,45 7,69cde ±1,74 8,81a ±1,91 2B4 4,17cd ±0,06 7,63ab ±0,73 10,24a ±1,16 12,61a ±4,05 Keterangan : * Diameter zona hambat termasuk diameter lubang sumur (5 mm)
Huruf superskrip yang berbeda pada kolom yang sama berbeda nyata (P < 0,05)
Bakteriosin merupakan substrat antimikroba yang paling penting dihasilkan oleh BAL. Keberadaan bakteriosin sebagai penyusun supernatan dapat diketahui melalui beberapa pengujian diantaranya yaitu (a) netralisasi pengaruh asam dalam supernatan dengan penambahan buffer pH 7,0; (b) penambahan enzim proteolitik; (c) pengujian melalui proses pemanasan. Netralisasi pengaruh keasaman dapat dilakukan dengan penambahan NaOH 1 N pada supernatan hingga diperoleh pH supernatan yang netral. Supernatan yang telah dinetralisasi, disterilkan melalui filter 0,22 µm.
Hasil konfrontasi antara supernatan yang telah dinetralkan dengan bakteri uji tidak menunjukkan bahwa terdapat bakteriosin dalam supernatan atau bila terdapat jumlahnya dalam konsentrasi yang terlalu rendah untuk dapat menghambat pertumbuhan bakteri uji. Fardiaz (1989) menjelaskan bahwa kemampuan suatu zat antimikroba dalam menghambat pertumbuhan dipengaruhi oleh beberapa faktor,
antara lain: (1) konsentrasi zat pengawet, (2) waktu penyimpanan, (3) suhu lingkungan, (4) sifat-sifat mikroba seperti jenis, umur, konsentrasi, dan keadaan mikroba, (5) sifat-sifat fisik dan kimia makanan termasuk kadar air, pH, jenis senyawa dan jenis senyawa didalamnya. Supernatan yang sama tanpa penetralan tetap menujukkan adanya zona hambat (Tabel 5).
Dua belas jenis isolat BAL yang diisolasi dari daging sapi terbukti memiliki senyawa antimikroba yang dapat menghambat bakteri uji. Komponen utama substrat antimikroba penyusun supernatan yang mampu menghambat pertumbuhan bakteri uji adalah bentuk asam organik, ditunjukkan oleh nilai pH supernatan yang rendah. Asam organik merupakan salah satu hasil metabolit bakteri asam laktat yang bersifat antimikroba. Pembentukan asam organik terjadi melalui proses fermentasi glukosa yang terdiri dari dua tahap yaitu (1) pemecahan rantai karbon dari glukosa dan pelepasan paling sedikit dua pasang karbon atom hidrogen, menghasilkan senyawa karbon lainnya yang lebih teroksidasi dibandingkan glukosa. Senyawa yang teroksidasi tersebut direduksi kembali oleh atom hidrogen yang dilepaskan dalam tahap pertama hingga membentuk asam piruvat; (2) tahap kedua, asam piruvat bertindak sebagai penerima hidrogen, sehingga asam piruvat yang direduksi oleh NADH2 menghasilkan asam laktat dan senyawa lain seperti asam asetat, CO2, dan etanol (Fardiaz, 1992).
Asam organik yang dihasilkan oleh bakteri asam laktat dapat berupa asam lemah seperti asam laktat dan asam asetat. Mekanisme penghambatan bakteri oleh asam-asam organik berhubungan dengan keseimbangan asam-basa, penambahan proton, dan produksi energi oleh sel. Keseimbangan asam-basa pada sel mikroba ditunjukkan dengan pH yang mendekati normal. Interaksi dengan senyawa kimia akan mengganggu keseimbangan asam-basa dan mengakibatkan kerusakan sel. Protein, asam nukleat, dan fosfolipid dapat rusak oleh perubahan pH. Ketersediaan ion-ion logam akan mengganggu permeabilitas membran, karena membran kurang permeabel terhadap ion dibandingkan dengan molekul yang tidak bermuatan. Perubahan permeabilitas membran akan menghasilkan efek ganda, yaitu mengganggu transport nutrisi ke dalam sel dan menyebabkan metabolit internal keluar dari sel (Davidson dan Branen, 1993).
Efek penghambatan dari asam organik terutama berasal dari jumlah asam yang tidak terdisosiasi (Jennie, 1996a). Bentuk asam yang tidak terdisosiasi dipengaruhi oleh nilai pKa yang berbeda. Asam asetat dan asam propionat memiliki nilai pKa yang lebih tinggi yaitu sebesar 4,87 dan 4,75 dibandingkan dengan asam laktat sebesar 3,08. Nilai pKa yang tingggi akan menghasilkan asam yang tidak terdisosiasi lebih banyak (Ouwhand dan Vesterlund, 2004). Asam asetat memiliki asam yang tidak terdisosiasi dua atau empat kali lipat pada interval pH 4,0-4,6 dibandingkan dengan asam laktat (Vuys dan Vandamme, 1994).
Berdasarkan hasil uji konfrontasi supernatan yang dihasilkan dengan kecepatan sentrifugasi 10.000 rpm semua isolat BAL dapat menghambat ketiga bakteri uji (S. aureus, S. typhimurium, dan E. coli) hanya isolat 1D3 yang tidak dapat menghambat ketiga bakteri uji. Isolat 1D3 hanya mampu menghambat bakteri uji S. typhimurium dan E. coli. Hasil uji statistik menunjukkan bahwa isolat 2B4 merupakan isolat terbaik yang dapat menghambat ketiga bakteri uji (Tabel 5). Penghambatan pada pertumbuhan bakteri uji S. typhimurium dan E. coli memiliki zona hambat yang terbesar. Besarnya diameter zona hambat yang terbentuk berbeda nyata dengan isolat lainnya. Penghambatan isolat 2B4 terhadap bakteri uji S. aureus
tidak berbeda nyata dengan isolat lain yang memiliki diameter zona hambat terbesar. Isolat 2B4 merupakan Lactobacillus fermentum (Tribowo, 2006) yang termasuk dalam spesies golongan heterofermentatif. Bakteri yang tergolong dalam heterofermentatif dapat memecah gula menjadi asam laktat dan produk lainnya seperti asam asetat, alkohol, dan karbon dioksida. Asam laktat dan asam asetat yang dihasilkan oleh isolat BAL 2B4 melalui fermentasi heterofermentatif, akan berinteraksi dengan sel membran dan mengakibatkan asidifikasi intraseluler dan denaturasi protein. Keberadaan asam organik juga dibuktikan dengan nilai TAT untuk isolat 2B4 seperti dapat dilihat pada Tabel 6.
Tabel 6. Nilai TAT Supernatan Bebas Sel Isolat Bakteri 2B4
Ulangan Volume NaOH (ml) TAT (%)
1 3,6 0,32
2 4,3 0,39
3 3,1 0,28
Nilai TAT menunjukkan tingkat keasaman supernatan dengan menetralkan asam organik yang menjadi penyusun supernatan. Asam organik yang dinetralkan merupakan asam organik yang tidak terdisosiasi, sehingga persentase TAT yang tinggi membuktikan semakin banyaknya asam yang terkandung dalam supernatan.
Penghambatan S. aureus oleh Asam Organik yang Dihasilkan Isolat BAL Pengaruh perlakuan isolat yang berbeda terhadap bakteri uji S. aureus
menunjukkan hasil yang berbeda nyata (P<0,05) seperti yang ditampilkan pada Tabel 5. Artinya secara hitungan statistik respon S. aureus terhadap antimikroba yang dihasilkan oleh 12 isolat terdapat isolat yang berbeda secara signifikan. Mekanisme penghambatan pertumbuhan mikroba oleh senyawa antimikroba antara lain (1) perusakan dinding sel sehingga mengakibatkan lisis atau menghambat pembentukan dinding sel pada sel yang sedang tumbuh, (2) mengubah permeabilitas membran sitoplasma yang menyebabkan kebocoran nutrien di dalam sel, (3) denaturasi protein sel, (4) perusakan sistem metabolisme dalam sel dengan cara menghambat kerja enzim intraseluler (Pelczar dan Reid, 1979).
Bakteri uji S. aureus termasuk dalam kelompok bakteri Gram positif (Fardiaz, 1992). Hal ini membuktikan bahwa substrat antimikroba BAL yang diisolasi dari daging sapi dapat menghambat bakteri Gram positif. Penghambatan terhadap bakteri Gram positif disebabkan oleh senyawa antimikroba yang dihasilkan oleh isolat BAL. Struktur dinding sel bakteri Gram positif memiliki satu lapisan tebal peptidoglikan, sedangkan bakteri Gram negatif relatif lebih kompleks dengan tiga lapisan yaitu, lapisan luar berupa lipoprotein, lapisan tengah yang berupa lipolisakarida, dan lapisan dalam berupa peptidoglikan yang lebih tipis. Perbedaan lapisan peptidoglikan tersebut mempengaruhi penghambatan terhadap baketri uji. Penghambatan tertinggi S. aureus pada Tabel 5 ditunjukkan oleh jenis isolat 2D2 dan 2B2 (9,76±2,58 mm dan 9,72±0,96 mm). Bakteri uji S. aureus memiliki sensitifitas yang lebih tinggi terhadap dua jenis isolat BAL tersebut.
Supernatan isolat 1D3 tidak menunjukkan penghambatan terhadap bakteri uji. Hasil ini berbeda dengan konfrontasi supernatan yang dihasilkan dengan kecepatan sentrifugasi 6.000 rpm. Zona hambat yang terbentuk pada supernatan yang dihasilkan kecepatan sentrifugasi 6.000 rpm menunjukkan adanya zona hambat pada penghambatan S. aureus. Hal ini dapat disebabkan oleh antimikroba yang bekerja
pada supernatan yang dihasilkan dengan kecepatan sentrifugasi 6.000 rpm ikut mengendap dengan sel pada saat proses pemisahan sel dan supernatan, sehingga saat uji konfrontasi antimikroba tidak lagi bekerja menghambat bakteri uji S. aureus.
Penghambatan S. typhimurium oleh Asam Organik yang Dihasilkan Isolat BAL Supernatan dari berbagai isolat daging memberikan penghambatan yang berbeda nyata (P<0,05) terhadap bakteri uji S. typhimurim (Tabel 5). Secara hitungan statistik respon yang dihasilkan oleh bakteri uji melalui pembentukan zona hambat terdapat isolat yang berbeda secara signifikan. Semua jenis isolat dapat menghambat pertumbuhan bakteri uji S. typhimurium dengan besar penghambatan yang berbeda-beda. Isolat bakteri 2B4 menghasilkan penghambatan terbesar pada bakteri uji S. typhimurium (10,24±1,16 mm). Hal ini membuktikan bahwa bakteri uji S. typhimurium lebih sensitif pada antimikroba yang dihasilkan oleh jenis isolat bakteri 2B4. Jenis isolat 1D3 mempunyai penghambatan yang paling kecil (7,27±1,22 mm) terhadap bakteri uji S. typhimurium. Jenis isolat lainnya memiliki keragaman diameter zona hambat sesuai dengan tingkat kepekaan S. typhimurim terhadap antimikroba yang dihasilkan. Antimikroba yang bekerja dalam menghambat pertumbuhan S. typhimurium adalah asam organik. Efek antimikroba dari asam organik merupakan akibat dari penurunan nilai pH dan juga bentuk tidak terdisosiasi dari molekul asam organik. Kondisi pH eksternal yang yang rendah mengakibatkan asidifikasi sel sitoplasma, sementara asam yang tidak terdisosiasi menjadi lipofilik, sehingga dapat berdifusi ke dalam membran. Asam yang tidak terdisosiasi akan melumpuhkan elektrokimia proton gradien atau mengubah permeabilitas sel membran yang akan menggangu sistem transport substrat (Surono, 2000). Bakteri Gram negatif memiliki dinding sel dengan kandungan lipid tinggi yaitu 11-22 % (Fardiaz, 1992), sehingga asam yang tidak terdisosiasi dapat menembus dinding sel dan bersifat antimikroba untuk pertumbuhan S. typhimurium. Hal ini membuktikan bahwa antimikroba yang dihasilkan efektif dalam menghambat bakteri Gram negatif.
Penghambatan E. coli oleh Asam Organik yang Dihasilkan Isolat BAL
Bakteri uji E. coli yang tergolong dalam Gram negatif yang dapat dihambat oleh substrat antimikroba yang dihasilkan oleh berbagai isolat BAL asal daging sapi. Penghambatan E. coli terlihat dari zona hambat yang terbentuk. Pengaruh perlakuan