BAB I PENDAHULUAN
A. Latar Belakang
Ribosome-inactivating Protein atau disingkat dengan RIP merupakan sekelompok protein yang mempunyai aktivitas enzimatik yang khas yaitu bersifat merusak ribosom mamalia secara permanen sehingga menyebabkan sintesis protein terhambat dan akhirnya terjadi kematian sel (Stirpe, 2005). Karena aktivitas tersebut, protein ini bersifat sitotoksik terhadap sel mamalia. Selain itu, penelitian menunjukkan bahwa RIP lebih selektif untuk membunuh sel kanker dari pada sel normal (Narayan, dkk., 2005) sehingga penelitian tentang RIP berkembang terus menerus untuk menjadikannya sebagai agen anti kanker yang poten dan efektif mengingat penyakit kanker merupakan penyakit yang semakin banyak terjadi seiring berkembangnya gaya hidup instan. Penelitian-penelitian tentang RIP menghasilkan banyak informasi yang penting tentang mekanisme aksi RIP serta aktivitasnya dalam sistem biologi seperti antiviral, imunosupresan, antioksidan, fotoprotektif dan kemopreventif (Stirpe, 2005; Barbieri, dkk., 2006; Hussana, 2013), serta menjadikan imunotoksin yang selektif dengan menkonjugasikan dengan monoklonal antibodi atau molekul lain seperti lektin, hormon, dan faktor pertumbuhan (Stirpe, 2013).
Skrining tanaman yang mengandung RIP telah dilakukan pada banyak tanaman bahkan juga pada jamur dan bakteri (Stirpe, 2004). Hal ini dilakukan untuk mendapatkan sumber RIP yang baru dan poten. Di Indonesia pun berbagai penelitian
telah dilakukan untuk mengidentifikasi RIP dan aktivitasnya dari berbagai macam tanaman di Indonesia. Seperti yang telah kita ketahui bahwa Indonesia kaya akan biodiversitas dan masih banyak tanaman yang belum diteliti potensinya. Tanaman
Indonesia telah diteliti potensinya dan terbukti mengandung RIP adalah Mirabilis
jalapa L., Morinda citrifolia, Carica papaya L. (Sismindari & Lord, 2000). Tanaman Mirabilis jalapa L. merupakan tanaman yang telah banyak diteliti kandungan
RIP-nya. RIP pada tanaman Mirabilis jalapa L. dapat ditemukan pada biji, akar, dan
daunnya (Vivanco, dkk., 1999; Sismindari & Lord, 2000). RIP tersebut juga telah diuji aktivitasnya terhadap beberapa sel kanker seperti sel HeLa (kanker leher rahim), sel T47D (kanker payudara), dan sel MS1 (kanker myeloma), serta telah diketahui
mekanisme antikankernya (Ikawati, dkk.,2003). Fraksi protein daun Carica papaya
L. mempunyai aktivitas N-glikosidae pada rRNA yeast (Rumiyati, dkk., 2000) dan
mempunyai aktivitas sensitifitas tertinggi terhadap sel Hela dengan IC50 0,6 mg/mL (Rumiyati, dkk., 2003), sedangkan terhadap sel myeloma, Raji, dan T47D mempunyai IC50 2,8 mg/mL (Rumiyati, dkk., 2006).
Besarnya potensi tanaman di Indonesia sebagai penghasil bahan pangan juga diikuti berkembangnya pengetahuan masyarakat tentang pentingnya menjaga kesehatan di masa yang serba instan ini yang dapat memicu terjadinya penyakit seperti kanker. Kanker merupakan penyakit karena gaya hidup yang salah dan proses terjadinya kanker merupakan proses yang memerlukan beberapa tahap yang memerlukan waktu bertahun-tahun untuk menjadi kanker metastasis (Chen & Kong, 2006).
Kanker metastasis dalam banyak kasus sangat sulit untuk diobati sehingga pencegahan kanker sejak dini mulai diminati. Masyarakat Indonesia pun sekarang
telah sadar dan menerapkan gerakan back to nature atau kembali ke alam dengan
menggunakan obat herbal serta makan makanan organik untuk mencegah terjadinya kanker. Penelitian terbaru telah memberikan bukti kuat bahwa banyak senyawa dari bahan pangan yang dikonsumsi sehari-hari seperti sayur dan buah memiliki sifat pelindungan terhadap kanker yang dapat melindungi terhadap kerusakan sel yang disebabkan oleh karsinogen lingkungan atau spesies oksigen reaktif endogen yang dihasilkan oleh tubuh. Senyawa pada bahan pangan juga dapat mempengaruhi jalur sinyal kematian sel yang dapat mencegah perkembangan sel-sel tumor (Chen & Kong, 2006).
Tanaman pangan yang sering dijumpai dan dikonsumsi adalah berupa sayur-sayuran. Selain sumber gizi yang sangat baik, sayuran juga mempunyai potensi kadungan RIP. Perkembangan penelitian RIP pun juga telah mencakup skrining
terhadap tanaman pangan seperti biji gandum barley, jagung (Zea mays), asparagus
(Asparagus officinalis), bit (Beta vulgaris), Allium coepa, Spinacia oleracea, Apium graveolens, dan Daucus carota (Barbieri, dkk.,2006). Skrining keberadaan RIP untuk mendapat sayuran yang mengandung RIP sayuran yang sering dijumpai dan dikonsumsi oleh masyarakat Indonesia merupakan langkah awal untuk mendapatkan sayuran yang mengandung RIP. Skrining dilakukan dengan uji aktivitas pemotongan DNA superkoil plasmid pUC 19 oleh ekstrak gubal protein sayuran (selanjutnya disebut EGS) buncis, kacang panjang, kenikir, bayam, dan leunca.
Pengolahan sayuran untuk dikonsumsi dengan proses pemasakan sering melibatkan pemanasan dan berpotensi mengubah konformasi RIP yang merupakan senyawa protein. Perubahan bentuk konformasi tiga dimensi protein akan mengakibatkan hilangnya aktivitas protein (Campbell, dkk., 2002). Pemasakan sayur biasa dilakukan dengan perebusan sayur selama 5-10 menit dalam air mendidih. Kajian stabilitas RIP dalam sayur dapat diketahui dengan perbandingan hasil uji aktivitas pemotongan DNA superkoil dari EGS dan ekstrak gubal protein dari sayur yang direbus (selanjutnya disebut EGS-rebus). Informasi tentang keberadaan RIP dalam sayur serta kajian aktivitas sitotoksik dan stabilitas selama perebusan diharapkan dapat menjadi upaya preventif terjadinya kanker.
B. Perumusan Masalah
Berdasarkan latar belakang masalah di atas, maka dapat dirumuskan beberapa rumusan masalah sebagai berikut:
1. Apakah RIP terkandung dalam berbagai sayuran yang ada di Indonesia?
2. Bagaimana stabilitas dan aktivitas RIP pada sayuran yang direbus?
3. Bagaimana aktivitas sitotoksik RIP dari sayuran terhadap pertumbuhan sel
kanker payudara MCF-7?
C. Tujuan Penelitian
Berdasarkan rumusan masalah yang telah disebutkan, maka dapat dihasilkan tujuan dari penelitian ini adalah untuk:
1. Mengetahui jenis sayuran di Indonesia yang mengandung RIP.
2. Mengetahui stabilitas dan aktivitas RIP pada sayuran yang direbus.
3. Mengetahui aktivitas sitotoksik RIP dari sayuran terhadap pertumbuhan sel
kanker payudara MCF-7.
D. Tinjauan Pustaka 1. Ribosome Inactivating Protein (RIP)
Ribosome-inactivating protein atau disingkat sebagai RIP merupakan sekelompok protein pada tanaman yang merusak ribosom sel eukariot secara enzimatik yaitu aktivitas N-glikosidase sehingga proses sintesis protein terhambat (Stirpe, 2005).
a. Tipe RIP
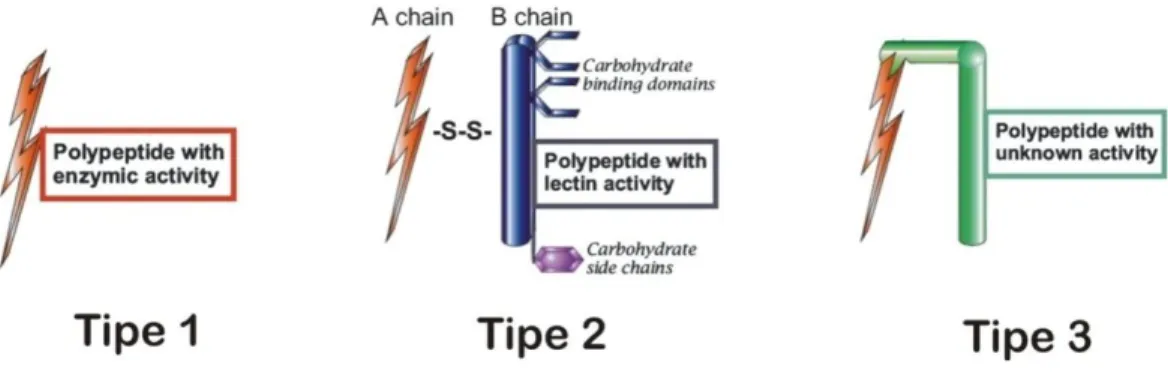
Berdasarkan strukturnya, RIP dibagi menjadi 2 kelompok besar yaitu RIP tipe 1 atau Holo-RIP dan RIP tipe 2 atau chimero-RIP. RIP tipe 1 merupakan satu polipeptida tunggal berukuran kira-kira 30 kDa. RIP tipe 2 terdiri dari dua polipeptida yaitu rantai A dengan aktivitas enzimatik yang serupa dengan RIP tipe I dan dihubungkan oleh jembatan disulfida dengan rantai B dengan ukuran kira-kira 35 kDa yang mempunyai aktivitas lektin spesifik terhadap struktur galaktosa. Selain dua kelompok RIP tersebut, terdapat kelompok RIP tipe 3 yang mempunyai struktur lain. Saat ini, terdapat 2 protein yang termasuk dalam RIP tipe 3, salah satunya adalah JIP60 dengan segmen yang mirip dengan RIP tipe 1 terhubung dengan segmen lain yang ukurannya sama tetapi belum diketahui fungsinya (Stirpe, 2004).
RIP tipe 2 mempunyai rantai B yang dapat mengikat galaktosa yang terdapat pada glikoprotein atau glikolipid pada membran plasma sehingga membantu masuknya RIP dalam sel dengan cara endositosis (Narayan, dkk., 2005). Sedangkan RIP tipe 1 tidak mempunyai rantai pengikat sehingga sulit masuk ke dalam sel
terutama oleh fluid phase pinocytosis atau melalui reseptor α-macroglobulin sehingga
toksisitasnya rendah (Stirpe, 2005).
Gambar 1. Representasi skematik dari struktur RIP (diadaptasi dari Stirpe, 2004). RIP tipe 1 hanya terdiri dari polipeptida enzimatik. RIP tipe 2 terdiri dari polipeptida yang mempunyai
aktivitas lektin (rantai B) yang dihubungkan oleh jembatan disulfide pada rantai A yang aktif secara enzimatik. RIP tipe 3 mempunyai segmen yang mirip dengan tipe 1 yang berlanjut pada segmen lain
yang belum diketahui aktivitasnya.
b. Aktivitas RIP
1) Aktivitas enzimatik RIP
Pada awalnya istilah RIP digunakan untuk protein tanaman yang menyebakan ribosom mamalia tidak aktif. Seiring perkembangan penelitian tentang mekanisme aksi RIP, istilah RIP dikhususkan pada protein dengan aktivitas enzimatik RNA N-glikosidase walaupun pada penelitian-penelitian lain menunjukkan bahwa RIP mempunyai aktivitas-aktivitas enzimatik yang lain (Peumans, dkk., 2001).
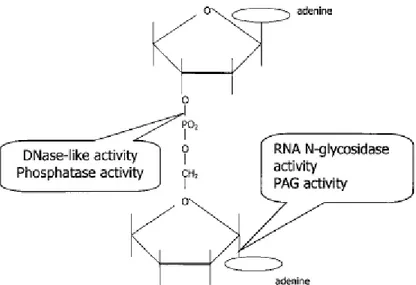
Gambar 2. Gambaran skematik dari aktivitas RNA N-glikosidase, aktivitas PAG, dan dugaan aktivitas DNAse dari RIP(diadaptasi dari Peumans, dkk., 2001).
a) Aktivitas N-glikosidase
Aktivitas RNA N-glikosidase pertama dipelajari dari ricin. Ricin mengenali suatu area pada 28S rRNA dan memotong ikatan glikosidik N-C yang spesifik antara adenine dan nukleotida pada RNA sehingga residu adenine terlepas. Terlepasnya adenine ini menyebabkan bagian yang mengalami deadenilasi menjadi tidak stabil dan reaksi eliminasi β dapat terjadi setelah RNA diberi perlakuan dengan anilin asam sehingga ujung 3’ RNA terpotong dan dapat dideteksi dengan elektroforesis. Pada ribosom hati tikus, adenine yang dipotong spesifik yaitu adenin pada posisi 4324 (Peumans, dkk., 2001). Deadenilasi ini mencegah terbentuknya konfigurasi penting stem-loop dimana faktor elongasi (EF) menempel saat tahap translokasi dari proses translasi protein dan pada akhirnya sintesis protein akan terhambat sempurna (Narayanan, dkk., 2005).
RIP baik tipe 1 dan tipe 2 mempunyai aktivitas RNA N-glikosidase dan masing-masing RIP mempunyai spesifitas pada substrat ribosom yang berbeda, tergantung pada ribosom dan struktur RIP (Peumans, dkk., 2001). Beberapa RIP juga diketahui memotong lebih dari satu adenine per ribosom dan dapat memotong adenin dari ribosom serangga (insect), tanaman, yeast, dan bakteri (Stirpe, 2004).
b) Aktivitas polinukleotida adenosin glikosidase (PAG)
Beberapa RIP diketahui dapat memotong adenine dari DNA dan polinukleotida lain yang dapat diketahui secara kualitatif dan kuantitatif dengan metode HPLC fluoresens yang telah dikembangkan. Saporin-L1 yang merupakan RIP tipe 1 dari
daun Saponaria officinalis diketahui dapat memotong adenine dari berbagai subtrat
seperti herring sperm DNA, poli(A), tRNA, dan bahkan RNA TMV (Peumans, dkk.,
2001).
c) Aktivitas polinukleotida guanosin glikosidase
RIP juga mempunyai kemampuan memotong guanin dari rRNA eukariotik maupun rRNA prokariotik. Ricin dapat memotong guanin pada posisi 4323 pada ribosom tikus. Aktivitas serupa juga ditemukan pada rekombinan PAP yang
memotong guanidine dari rRNA E.coli (Peumans, dkk., 2001).
d) Aktivitas mirip DNAse
Beberapa RIP dilaporkan dapat memotong untai tunggal M13 phage DNA dan
DNA superkoil menjadi linier. Pemotongan DNA atau aktivitas DNAse ini pada umumnya terjadi pada RIP dengan konsentrasi yang tinggi. Penelitian menunjukkan
bahwa beberapa RIP tipe 1 seperti dianthin 30, saporin-S6, dan gelonin memiliki aktivitas nuclease pada DNA untai tunggal. Selain itu, PAP, RIP yang diisolasi dari daun pokeweed, diketahui dapat memotong DNA superkoil dengan menggunakan bagian aktif yang sama untuk mendepurinasi rRNA dan DNA pG-1. Berbeda dengan aktivitas RNA N-glikosidase, DNA superkoil atau DNA untai tunggal sebagai substrat nuclease tidak mempunyai lokasi yang spesifik, tetapi mungkin ditentukan oleh struktur 3 dimensi dari DNA (Peumans, dkk., 2001).
2) Aktivitas sitotoksik pada sel mamalia
RIP tipe 2 bersifat lebih toksisk dari pada RIP tipe 1 karena rantai-B dapat berikatan pada membran sel dan memfasilitasi RIP untuk masuk ke dalam sel. Tetapi setelah masuk di dalam sel, RIP, baik tipe 1 atau tipe 2, diketahui dapat menginduksi apoptosis dan dapat berlanjut nekrosis pada organ dari hewan yang terpejani dan pada bermacam-macam kultur sel. Nekrosis juga dapat terjadi apabila RIP diberikan pada dosis yang tinggi (Stirpe, 2005). Beberapa RIP telah diketahui lebih selektif untuk membunuh sel kanker dibangdingkan pada sel normal sehingga diperhitungkan sebagai agen imunoterapi kanker yang poten melalui imunotoksin dari rantai-A RIP (Narayan, dkk., 2005).
3) Aktivitas antivirus RIP
Pokeweed Antiviral Protein (PAP) merupakan RIP tipe 1 pertama yang diidentifikasi. Selain terbukti menghambat sintesis protein seperti halnya pada ricin, PAP dan protein lain diketahui mempunyai aktivitas antiviral terhadap virus tanaman
dan hewan. Pada tanaman, RIP berada terpisah dari sitoplasma dan terletak pada protein body (seperti ricin), pada matriks dinding sel atau dalam vakuola (seperti PAP), atau pada pada ruang intraseluler (seperti saporin). Pemisahan subseluler tersebut dapat rusak karena infeksi virus dan akibatnya RIP dapat berinteraksi dan menginaktivasi ribosom tanaman sehingga sel yang terinfeksi mati dan virus tidak dapat bereplikasi. PAP juga diketahui menghambat replikasi HIV dan beberapa isoform PAP diketahui menghambat replikasi HIV-1 dan mendepurinasi RNA HIV (Stirpe, 2004).
4) Aktivitas imunologik.
Ricin dan semua RIP merupakan imunogen kuat dan pemberiannya pada hewan akan menaikkan pembentukan antibodi. RIP juga bersifat alergenik. Ricin pada ekstrak biji tanaman jarak menginduksi respon IgE dan meningkatkan respon perlawanan terhadap antigen lain. RIP mempunyai efek imunosupresif, baik respon
humoral atau cell-mediated, dalam pemberiannya untuk mebcegah pembentukan
atibodi dan memperlambat penolakan jaringan atau organ transplantasi (Stirpe, 2004).
5) Aktivitas antioksidan
RIP yang diisolasi dari Cucurbita moshata memiliki aktivitas sebagai penangkap
radikal seperti superoksid dismutase (SOD) yang setara dengan aktivitas SOD E. coli
(Barbieri, dkk., 2006). Selain itu, prorrectin, RIP yang diisolasi dari biji Cinnamumum porrectum (Li, dkk., 1996) dan protein yang mirip RIP dari daun tembakau (Sharma, dkk., 2004) terbukti mempunyai aktivitas SOD. Aktivitas SOD
juga ditemukan pada ekstrak protein total dari tanaman Mirabilis jalapa dan lebih poten daripada satu macam RIP yang diisolasi. Protein MJ dengan dosis 1,887 μg/mL mempunyai aktivitas SOD lebih dari 90% (Hussana, 2013).
6) Aktivitas fotoproteksi dan kemoprevensi
Penelitian yang dilakukan oleh Hussana (2013) membuktikan bahwa protein
dalam tanaman Mirabilis jalapa (selanjutnya disebut protein MJ) mempunyai efek
fotoproteksi yang mampu melindungi kulit akibat paparan sinar UV-B karena mempunyai efek proteksi terhadap inflamasi dan supresi imun yang melibatkan modulasi IL-10 dan IL-2. Protein MJ juga mampu mempengaruhi regulasi apoptosis. Jika protein MJ diberikan setelah terjadi paparan sinar UV-B, protein tersebut akan mempercepat eliminasi sel yang mengalami kerusakan DNA dengan menginduksi
terjadinya apoptosis (meningkatkan sun burn cells). Jika protein MJ diberikan
sebelum terjadi paparan sinar UVB, protein akan mencegah terjadinya kerusakan DNA dan menurunkan sel yang mengalami apoptosis. Selain itu, protein MJ mempunyai efek kemopreventif terhadap kanker kulit karena mampu memperlambat onset tumoringensis dan menurunkan insidensi tumor kulit dan mampu menurunkan multiplisitas tumor kulit akibat paparan UV-B.
c. Sumber RIP
Pada awalnya RIP ditemukan dalam berbagai macam tanaman, kebanyakan adalah Angiospermae, baik monokotil dan dikotil, dan juga ditemukan pada jamur dan alga. RIP ditemukan dalam berbagai kadar mulai dari 1 mg sampai 100 mg per
100 g (Stirpe, 2004). Kadar RIP yang tinggi biasanya ditemukan pada jaringan tanaman yang stress, telah mengalami penuaan, atau terinfeksi virus (Stirpe, 2005). Dalam satu tanaman, RIP dapat ditemukan dalam semua jaringan seperti di akar, batang, daun, bunga, buah, biji, dan latex, sedangkan dalam tanaman lain, RIP hanya ditemukan dalam beberapa atau satu jaringan saja seperti pada Ricin yang hanya
terdapat pada biji Ricinus communis (Stirpe, 2004).
1) RIP pada tanaman pangan
RIP juga ditemukan pada beberapa tanaman yang dapat dimakan dan beberapa
telah dimurnikan dan dikarakterisasi seperti pada barley RIP di biji gandum barley,
Maize RIP pada jagung (Zea mays), asparins pada asparagus (Asparagus officinalis),
dan betavulgin pada bit (Beta vulgaris). Ada juga indikasi adanya RIP dalam jaringan
tanaman dimakan mentah seperti dari Allium coepa, Spinacia oleracea, Apium
graveolens, Daucus carota, atau di bagian tanaman yang dapat dimakan, seperti biji Lycopersicones culentum. Selain itu, daun bayam, yang kadang-kadang ditambahkan ke salad mentah, diketahui mengandung protein mirip RIP dalam kalus bayam yang tumbuh dengan adanya asam giberelat dan, juga pada berbagai jaringan dari bibit bayam ditemukan dalam tingkat lebih rendah (Barbieri, dkk., 2006). Beberapa jamur yang dapat dimakan juga diketahui mengandung RIP seperti hypsin dan mamorin
pada Hypsizigus marmoreus (Lam & Ng, 2001; Wong, dkk., 2008), dan jamur
2. Bahan Penelitian a. Mirabilis jalapa L.
Gambar 3. Bunga, daun, dan biji Mirabilis jalapa L. (dokumentasi pribadi)
Di antara tanaman yang mengadung RIP, Mirabilis jalapa merupakan tanaman
mengadung RIP di hampir seluruh jaringan tanaman. Jaringan tanaman yang mempunyai aktivitas RIP tertinggi adalah pada biji, sedangkan aktivitas RIP sedang terdapat pada tunas bunga, daun akar, dan biji yang belum matang (Bolognesi, dkk., 2002). Protein antivirus yang aktif melawan transmisi mekanik virus tanaman seperti virus mosaik pada tanaman tembakau, tomat, lada, dan ketimun telah ditemukan dan
dimurnikan dari daun dan akar Mirabilis jalapa yaitu Mirabilis Antiviral Protein
(MAP). MAP mempunyai karakteristik kaya akan lisin, bersifat basa dengan titik isoelektrik 9,8 , dan terdiri dari polipeptida tunggal berbobot molekul sekitar 24,2
kDa (Habuka, dkk., 1989). Dalam berbagai jaringan tanaman Mirabilis jalapa
(29,771 kDa), dan MAP-4 (29,339 kDa) (Bolognesi, dkk., 2002). Selain bersifat
antivirus, RIP yang diisolasi dari Mirabilis jalapa juga diketahui bersifat antifungi
dan antibakteri (Kusamba, dkk., 1991).
RIP dari tanaman Mirabilis jalapa diketahui dapat memotong DNA superkoil
secara in vitro (Sismindari, dkk., 1998). Isolasi RIP dari daun tanaman tersebut telah
dilakukan oleh Sudjadi, dkk. (2003) menggunakan HPLC kolom penukar kation CM Sepharose CL-6B dan dimurnikan lebih lanjut dengan kolom gel filtrasi Sephacryl S-300HR menghasilkan protein aktif (MJ30) yang yang bersifat basa dengan bobot molekul 30 kDa yang mempunyai aktivitas pemotongan DNA superkoil dan RNA
N-glikosidase pada S. cereviseae. Protein MJ30 ini telah terbukti bersifat sitotoksik
terhadap sel kanker payudara T47D (IC50 0,36 mg/mL), sel kanker serviks HeLa (IC50 7,06 mg/mL), dan sel kanker myeloma darah NS1 (IC50 1,25 mg/mL) (Ikawati, dkk., 2003). Selain MJ30, terdapat pula fraksi tidak terikat yaitu MJ-C yang bersifat asam yang juga dapat memotong DNA superkoil dan lebih sitotoksik dibanding MJ30 (Sudjadi, dkk., 2007).
Selain mengandung RIP, Mirabilis jalapa juga mengandung senyawa golongan
triterpen, flavonoid, alkaloid, dan steroid (Van Steenis, 1975). Penelitian Ikawati,
dkk. (2004) menunjukkan bahwa ekstrak kloroform Mirabilis jalapa yang
mengandung alkaloid dan terpenoid bersifat sitotoksik terhadap larva Artemia salina
Leach. Ekstrak methanol daun Mirabilis jalapa L. yang mengandung flavonoid dan
terpenoid bersifat sitotoksik terhadap sel HeLa dengan LC50 1198 μg/mL dan
b. Sayur yang akan diuji
1) Buncis (Phaseolus vulgaris L.)
Gambar 4. Buah buncis (dokumentasi pribadi) Klasifikasi tanaman menurut Hutapea, dkk. (1994) :
Divisi : Spermatophyta
Sub divisi : Angiospermae
Kelas : Dicotyledonae
Bangsa : Rosales
Suku : Papilionaceae
Marga : Phaseolus
Jenis : Phaseolus vulgaris L.
Bagian yang digunakan sebagai bahan pangan adalah buah berisi biji. Buah buncis merupakan buah polong dengan panjang sekitar 10 cm. Jika masih muda, buah berwarna hijau kekuningan, setelah tua berwarna coklat. Biji buncis berada di dalam buah dan berbentuk lonjong, mengkilat dengan permukaan licin dan berwarna putih (Hutapea, dkk., 1994). Kandungan protein pada buncis per 100 g bahan yang dapat dimakan adalah 2,4 g (Depkes, 2005).
pada fase G0/G1 dan meningkatkan apoptosis sebesar 18% dibandingkan dengan sel yang tidak diberi ekstrak (Aparicio-Fernandez, dkk., 2006).
2) Kacang Panjang (Vigna sinensis L.)
Gambar 5. Buah kacang panjang (dokumentasi pribadi) Klasifikasi tanaman menurut Hutapea, dkk. (1994) :
Divisi : Spermatophyta
Sub divisi : Angiospermae
Kelas : Dicotyledoneae
Bangsa : Rosales
Suku : Papilionaceae
Marga : Vigna
Jenis : Vigna sinensis L.
Sinonim : Vigna unguiculata (L.) Walp., Vigna cylindrical Endl., Vigna
catjang (Burm.) Walp., Vigna cylindrica (L.) Skeels
Bagian yang digunakan sebagai bahan pangan adalah buah berisi biji. Buah tanaman ini berbentuk polong, berwarna hijau, dan panjang 15-25 cm dengan biji
berbentuk lonjong, pipih, berwarna coklat muda (Hutapea, dkk., 1994). Kandungan protein pada kacang panjang per 100 g bahan yang dapat dimakan adalah 2,7 g (Depkes, 2005). Fitokimia dari kacang panjang menunjukkan efek anti kanker terhadap sel kanker mamalia yaitu sel MCF-7 (Gutiérrez-Uribe, dkk., 2011). Selain berefek anti kanker, ekstrak etanolik kacang panjang mempunyai efek proliferatif terhadap sel epitel payudara T47D karena mempunyai kandungan senyawa fitoestrogen, yaitu suatu flavonoid yang berperan dalam efek tersebut. Efek berbeda ditunjukkan oleh fraksi etil asetat dari ekstrak etanolik kacang panjang yang tidak memepunyai efek proliferatif tetapi cenderung menghambat proliferasi sel epitel payudara T47D (Mayasari, 2007).
3) Kenikir (Cosmos caudatus Kunth.)
Klasifikasi tanaman menurut Hutapea, dkk. (2001) :
Divisi : Spermatophyta
Sub divisi : Angiospermae
Kelas : Dicotyledonae
Bangsa : Asterales
Suku : Asteraceae
Marga : Cosmos
Jenis : Cosmos caudatus Kunth.
Bagian yang digunakan sebagai bahan pangan adalah daun. Daun kenikir bersifat majemuk, bersilang berhadapan, berbagi menyirip, ujung runcing, tepi rata, dengan panjang 15-25 cm dan berwarna hijau. Daun tersebut menempel pada batangnya yang tegak, segi empat, beralur membujur, bercabang banyak, muda berbulu, beruas, dan berwarna hijau keunguan (Hutapea, dkk., 2001).
Kuersetin yang terkandung pada kenikir memiliki kemampuan menginduksi apoptosis sel kanker kolon Caco-2 dan HT-29 serta sel kanker leukemia HL-60 dengan cara menstimulasi pelepasan sitokrom C dari mitokondria (Taraphdar, 2001).
4) Bayam (Amaranthus hybridus L.)
Klasifikasi tanaman menurut Integrated Taxonomic Information System (ITIS) :
Divisi : Tracheophyta
Sub divisi : Spermatophytina
Bangsa : Caryophyllales
Suku : Amaranthaceae
Marga : Amaranthus
Jenis : Amaranthus hybridus L.
Gambar 7. Tanaman bayam (dokumentasi pribadi)
Bagian yang digunakan sebagai bahan pangan adalah daun. Kandungan protein pada bayam per 100 g bahan yang dapat dimakan adalah 3,5% (Depkes, 2005).
5) Leunca (Solanum nigrum L.)
Klasifikasi tanaman menurut Integrated Taxonomic Information System (ITIS) :
Divisi : Tracheophyta
Sub divisi : Spermatophytina
Kelas : Magnoliopsida
Bangsa : Solanales
Suku : Solanaceae
Marga : Solanum
Gambar 8. Buah leunca (dokumentasi pribadi)
Bagian yang digunakan sebagai bahan pangan adalah buahnya. Buah leunca berbentuk bulat, jika masih muda berwarna hijau, dan berwarna hitam mengkilat jika sudah tua ukurannya kira-kira sebesar kacang kapri. Biji berbentuk bulat pipih, kecil-kecil, dan berwarna putih. Kandungan protein leunca per 100 g bahan yang dapat dimakan adalah 1,9% (Depkes, 2005).
Leunca telah lama digunakan dalam pengobatan Cina untuk kanker saluran cerna. Solanine, alkaloid steroid diisolasi dari leunca menginduksi apoptosis juga melalui
penurunan ekspresi Bcl-2 (Ji, dkk., 2008). Ekstrak etanol dari buah leunca terbukti
menghambat proliferasi sel kanker payudara MCF-7 dan menginduksi kematian sel
dengan apoptosis. Selain itu, ektrak terrsebut mempunyai aktivitas free radical
scavenging (Son, dkk., 2003).
c. Pemasakan
Pemasakan pada bahan makanan tidak hanya membunuh mikroorganisme yang dapat membuat sakit, tetapi juga merubah struktur molekular, tekstur, rasa, aroma dan
penampilan makanan. Pemasakan dapat dilakukan dengan panas basah dan panas kering (Brown, 2011).
1) Preparasi panas basah
Preparasi panas basah (moist-heat) dapat membantu melembutkan selulosa dalam
tanaman sehingga membuat makanan lebih lembut. Ada beberapa teknik preparasi panas basah yang biasa digunakan, seperti :
- Scalding : perebusan dengan suhu mencapai 60⁰C di mana terlihat gelembung mulai muncul di dasar panci. Teknik ini biasanya digunakan untuk membunuh bakteri pada susu.
- Poaching ; perebusan dengan suhu 71-82⁰C, lebih panas dari scalding, di mana terbentuk gelembung kecil yang tidak bergerak di dasar panci tetepi belum mencapai titik didih air.
- Simmering : suhu perebusannya tidak kurang dari 82⁰C dan gelembung perlahan mulai naik. Perebusan ini lebih perlahan dan tidak merusak makanan
secara fisik. Simmering dalam cairan dengan jumlah sedang biasa disebut
stewing dan biasa digunakan untuk sayuran. Sedangkan simmering dalam
cairan dengan jumlah sedikit disebut braising.
- Boiling : perebusan dengan suhu mencapai 100⁰C di mana gelembung bergerak ke atas dengan cepat. Teknik ini digunakan untuk bahan makanan yang mempunyai tekstur yang keras seperti sayuran dan kacang-kacangan
kering. Perebusan ini juga dapat membantu melepaskan kulit buah, sayur, dan kacang-kacangan, serta merusak enzim yang berkontribusi merusak makanan. - Steaming : pemanasan makanan dengan uap dari air yang mendidih untuk
menjaga tekstur, warna, dan nutrisi (Brown, 2011).
2) Preparasi panas kering
Proses pemasakan menggunakan panas kering dapat mencapai suhu 260⁰C yang
lebih tinggi dari pada perebusan (boiling) yang hanya mencapai 100⁰C dan lebih
tinggi jika diberi tekanan. Preparasi menggunakan panas kering dapat berupa baking,
roasting, boiling, grilling, frying, dll (Brown, 2011).
3. Isolasi Protein Tanaman
Protein merupakan molekul yang terdapat pada makhluk hidup dan untuk mendapatkannya diperlukan metode ekstraksi dan isolasi yang tepat. Proses untuk mendapatkan protein dapat berupa proses yang sederhana dan murah ketika protein diproduksi secara ekstraseluler. Proses tersebut hanya membutuhkan pemisahan
biomasa dan partikel lain untuk memperoleh protein (Hatti-Kaul& Mattiasson, 2003).
a. Ekstraksi protein
Di sisi lain, protein yang berada dalam sel harus dilepaskan dari sel. Sel harus dirusak terlebih dahulu untuk melepaskan protein ke dalam ekstrak aqueous. Ada protein yang terdapat pada sitoplasma, fraksi terlarut dari sel, dan ada protein yang terdapat dalam membrane plasma yang membungkus sitoplasma dan yang lain
terdapat dalam ruang periplasmik yang memisahkan membrane dengan dinding sel. Tipe sel yang berbeda menyebabkan perbedaan pada struktur dindingnya yang berpengaruh pada elastisitas dan kekuatan mekanik pada sel yang membuat sel sulit untuk dirusak. Metode yang digunakan untuk melepaskan protein dari sel ditentukan oleh tipe sel atau jaringan yang mengandung protein tersebut dan lokasinya di dalam
sel (Hatti-Kaul& Mattiasson, 2003). Pemecahan sel dapat dilakukan secara mekanik
dan non mekanik. Secara mekanik dapat menggunakan metode solid shear dengan
penggerusan dan penekanan, sedangkan pada metode liquid shear dapat
menggunakan penekanan, agitasi mekanik dan ultrasound. Sementara itu secara non
mekanik dapat menggunakan metode lisis secara fisika, kimiawi maupun enzimatik serta dengan metode desikasi atau penguapan (Franks, 1993). Jaringan tanaman yang
masih segar dapat dihaluskan dengan food processor. Jaringan yang lunak dapat
dihaluskan dan digiling dengan sedikit buffer dalam mortar dengan pasir putih yang bersih dan pestle untuk menghancurkan sel. Semakin halus material digiling, semakin bagus hasil ekstraksi yang didapat (Cseke, dkk., 2004).
Permasalahan utama dalam preparasi protein adalah denaturasi, proteolisis, dan kontaminasi oleh pirogen, asam nukleat, bakteri dan virus. Permasalahan tersebut dapat dikurangi dengan pemilihan medium ekstraksi yang sesuai, waktu yang pendek, dan suhu yang rendah. Pemilihan medium ekstraksi harus mempertimbangkan kondisi paling stabil dari protein yang diinginkan dan kondisi agar protein dapat terlepas dari sel atau jaringan. Medium yang dipilih merupakan hasil optimasi dari
medium ekstraksi :
- pH
Nilai pH untuk medium ekstraksi biasanya merupakan pH di mana protein mempunyai aktivitas maksimal. Tetapi kadang pH yang menghasilkan efisiensi ekstraksi tertinggi bukanlah pH di mana protein mempunyai aktivitas maksimal. Oleh karena itu, nilai pH yang dipilih adalah nilai pH yang memberikan efisiensi ekstraksi yang cukup tanpa terjadi denaturasi atau kerusakan protein yang berlebihan.
- Buffer garam
Kebanyakan protein larut secara maksimal pada kekuatan ionic sedang (0,05-0,1) dan nilai tersebut dipilih bila kapasitas buffer mencukupi. Protein sendiri dapat bersifat sebagai buffer sehingga pH setelah penambahan sejumlah besar protein pada larutan yang terbufer lemah harus dicek.
- Deterjen dan chaotropic agent
- Agen pereduksi
- Agen pengkhelat atau ion logam
- Inhibitor proteolitik
- Bakteriostatik (Janson, 1998).
b. Fraksinasi protein
Ekstrak yang didapatkan masih berupa campuran dari banyak protein dan senyawa lain. Campuran protein tersebut kemudian difraksinasi dengan metode
ekstraksi dan presipitasi untuk memperoleh larutan yang lebih jernih atau lebih pekat
(Janson & Ryden 1998). Proses presipitasi protein dapat menggunakan prinsip salting
out dengan penambahan garam dengan konsentrasi tinggi dan kekuatan ionik yang
lebih besar dari pada media sehingga mengakibatkan pengendapan protein (Deutscher, 1990). Garam yang sering digunakan adalah ammonium sulfat (Franks, 1993). Presipitasi dengan menggunakan ammonium sulfat memerlukan proses dialisis untuk menghilangkan ammonium sulfat supaya tidak mengganggu proses pemurnian dengan kromatografi. Selain itu, pengendapan juga dapat dilakukan dengan menambahkan aseton yang merupakan pelarut organik dengan konstanta dielektrik rendah sehingga mampu mengurangi kekuatan air sebagai pelarut untuk melarutkan ion seperti protein (Voet & Voet, 1995). Pengendapan dengan ammonium sulfat menghasilkan protein yang lebih kompleks karena menyari hampir semua protein, sedangkan pengendapan dengan aseton lebih selektif mengendapkan protein MJ dengan berat molekul kira-kira 30 kDa (Hussana, 2013) tetapi endapan yang dihasilkan sulit untuk dilarutkan kembali (Nugraheni, 2013).
c. Pemurnian protein
Purifikasi protein dapat dilakukan dengan pemisahan dengan teknik kromatografi
seperti Size Exclusion Chromatography, Ion Exchange Chromatography, dan Reverse
Phase Chromatography atau teknik elektroforesis seperti Polyacrylaide Gel Electrophoresis dan Isoelectric focusing (Franks, 1993).
d. Perhitungan kadar protein
Jumlah protein merupakan hal penting pada proses pemurnian protein yaitu untuk menghitung hasil atau keseimbangan massa, atau menentukan aktivitas spesifik/potensi protein target. Berbagai metode yang tersedia menghitung jumlah
protein dan metode sederhana yang sering dilakukan adalah analisis
spektrofotometrik protein dalam larutan yang tidak memerlukan baik
enzimatik/reaksi kimia atau pemisahan campuran sebelum analisis. Selain itu tersedia
juga metode lain yang dapat digunakan seperti isotope dilution mass spectrometry,
metode nitrogen Kjeldahl, analisis asam amino, penentuan gravimetri, imunologi, dan elektroforesis gel kuantitatif dengan pewarnaan fluoresen (Burgess& Deutscher, 2009).
Analisis spektrofotometrik dapat dilakukan dengan metode absorbansi UVdan
metode dye-binding menggunakan deteksi kolorimetri dan berbasis fluoresen.
Dibandingkan dengan metode lain, uji ini dapat dilakukan pada jumlah sampel yang banyak, menggunakan reagen yang relatif murah dengan peralatan yang ditemukan di sebagian besar laboratorium biokimia. Analisis spektrofotometrik memerlukan standar protein yang sesuai atau informasi urutan asam amino untuk membuat perkiraan yang baik dari konsentrasi protein. Pilihan metode yang digunakan untuk menentukan konsentrasi protein atau peptide dalam larutan tergantung pada banyak faktor seperti :
- Volume sampel
- Jumlah sampel yang melewati proses uji (throughput)
- Ketahanan (robustness) alat uji
- Modifikasi struktur kimia protein
- Agregasi protein (Burgess & Deutscher, 2009)
1) Metode spektrofotometri absorbansi UV
a) Absorbansi UV pada 280 nm
Dasar dari metode pengukuran ini adalah absorbsi sinar UV dengan panjang gelombang 280 nm oleh asam amino aromatik seperti tirosin, triptofan dan fenilalanin yang terdapat pada protein. Jika asam amino ini hanya terdapat sedikit atau tidak ada sama sekali pada urutan struktur primer protein maka metode ini akan memberikan hasil yang salah. Komponen buffer dengan UV serapan kuat seperti beberapa deterjen terutama Triton X-100 harus dihindari dan harus dilakukan pengukuran blanko (larutan buffer tanpa protein) (Burgess & Deutscher, 2009). Metode ini sederhana dan sampel dapat diperoleh kambali. Selain itu, metode ini memiliki beberapa kelemahan, termasuk gangguan dari gugus kromofor lain, dan nilai absorbansi spesifik untuk protein tertentu harus ditentukan. Absorbansi sinar UV oleh asam nukleat pada panjang gelombang 280 nm dapat 10 kali lebih banyak dari protein pada panjang gelombang yang sama. Oleh karena itu, untuk mengetahui seberapa besar asam nukleat yang terkandung, dilakukan juga pengukuran absorbansi pada panjang gelombang 260 nm di mana asan nukleat menyerap sinau UV dengan kuat. Kadar protein dapat ditentukan dengan menggunakan faktor koreksi untuk menghitung rasio
absorbansi sampel pada λ 280 nm dan 260 nm atau dengan menggunakan rumus :
Protein (mg/mL) = 1.55 A280 – 0.76 A260 (Walker, 2002)
a) Absorbansi UV pada 205 nm
Ikatan peptida menyerap kuat sinar UV dengan maksimal pada panjang gelombang sekitar 190 nm. Penyerapan yang sangat kuat dari protein pada panjang gelombang ini telah digunakan dalam penentuan protein. Karena penyerapan oleh oksigen dan output yang rendah dari spektrofotometer konvensional pada panjang gelombang ini menyebabkan kesulitan pengukuran, pengukuran dilakukan pada 205 nm, dimana absorbansinya sekitar setengah dari absorbansi pada 190 nm. Berbagai rantai samping, termasuk dari triptofan, fenilalanin, tirosin, sistein, metionin, dan arginin (dalam urutan menurun) ikut berkotribusi pada absorbansi pada 205 nm. Keuntungan dari metode ini adalah sederhana, sensitif, sampel dapat diperoleh kembali dan sedikit variasi dalam respon antara protein yang berbeda. Kekurangan metode ini meliputi kebutuhan untuk kalibrasi akurat dari spektrofotometer pada sinar UV jauh dan banyak komponen lain seperti buffer, heme atau grup piridoksal dapat menyerap kuat di wilayah ini (Walker, 2002).
2) Metode spektrofotometri dye-binding
a) Coomassie Blue (Bradford) Protein Assay
Mekanisme yang terjadi pada metode ini adalah pengikatan pewarna Coomassie
Brilliant Blue G-250 pada pH asam dengan residu arginin, histidin, fenilalanin, triptofan dan tirosin, serta interaksi hidrofobik. Namun demikian, mekanisme yang tepat masih belum sepenuhnya dipahami. Setelah protein terikat dengan pewarna, pergeseran metachromatik pada panjang gelombang 465-595 nm dapat diamati karena stabilisasi bentuk anion dari pewarna (Burgess & Deutscher, 2009).
b) Metode Lowry (Alkaline Copper Reduction Assay)
Metode ini dilakukan dengan dua langkah. Tahap pertama adalah reaksi Biuret
yang melibatkan reduksi tembaga (Cu2+ menjadi Cu+) oleh protein dalam larutan
alkali, diikuti oleh tahap kedua yaitu reduksi reagen Folin Ciocalteu yang menghasilkan warna biru dengan absorbansi maximal pada panjang gelombang 750 nm (Burgess & Deutscher, 2009).
c) Metode Asam Bicinchoninic (BCA)
Metode ini pada dasarnya mirip dengan metode Lowry. Pada metode ini, asam bicinchoninic menggantikan reagen Folin-Cioalteu dan menghasilkan pengukuran protein dengan sensitivitas dan toleransi terhadap senyawa pengganggu. Reaksi BCA
membentuk kompleks ungu intens dengan ion tembaga (Cu+) yang dihasilkan dari
4. Skrining RIP
Skrining RIP dilakukan dengan pengujian ekstrak gubal (crude extract) jaringan
tanaman terhadap penghambatan sintesis protein dan dalam kebanyakan kasus
digunakan rabbit reticulocyte lysate system. Selain itu, uji penghambatan translasi
oleh fraksi protein dapat menunjukkan adanya RIP, meskipun bukan bukti langsung, karena penghambatan translasi mungkin disebabkan oleh beberapa agen lainnya (Barbieri, dkk., 2006). Konfirmasi adanya RIP dapat dilakukan juga dengan pengujian aktivitas enzimatik dari RIP seperti :
a. Aktivitas N-glikosidase pada ribosom (rRNA) yeast
Ribosom yang berasal dari yeast Saccharomyces cerevisiae mempunyai sifat
sensitif terhadap RIP tipe 1 dan rantai A pada RIP tipe 2 yang mempunyai aktivitas enzimatik yang serupa dengan RIP tipe 1. RIP memotong basa adenin dari sub unit rRNA 26S sehingga terbentuk fragmen baru yaitu sekitar 370 nukleotida. Residu adenin yang terpotong tersebut belum dapat terdeteksi pada elektroforegram karena adanya struktur sekunder dari rRNA. Perlakuan dengan anilin digunakan untuk menghilangkan struktur sekunder rRNA sehingga terpotongnya residu adenin pada sub unit 26S dapat terlihat atau terdeteksi pada elektroforegram gel agarosa. Oleh karena itu, pada saat elektroforesis digunakan lajur tanpa perlakuan anilin dan lajur perlakuan anilin baik pada setiap sampel dan kontrol (Rumiyati, dkk., 2000).
b. Aktivitas pemotongan DNA supercoil oleh RIP
tipe 2) terbukti mempunyai aktivitas enzimatik berupa aktivitas pemotongan DNA
untai ganda superkoil dan menghasilkan DNA nicked-circular dan linear (Ling, dkk.,
1994).
DNA superkoil atau “super berpilin” terlihat seolah-olah sebagai heliks ganda yang sebagian telah terbuka sebelum ujung untaian DNA bergabung menjadi bentuk lingkaran. Putaran pada arah kebalikan ini menimbulkan suatu simpul putar pada molekul DNA lingkaran sehingga DNA berpilin pada molekul itu sendiri. Bilamana DNA superkoil ini, yang menyimpan sejumlah besar kelebihan energi, dibuka dengan
suatu endonuklease yang dapat memutus (nick) satu untaian, simpul putaran yang
disebabkan oleh putaran kearah kebalikan ini disebabkan dan DNA lingkaran kembali keadaan normalnya yang terbuka dan berenergi rendah (gambar 9). DNA superkoil ini lebih kompak dibandingkan dengan lingkaran yang terbuka (Lehninger, 1994).
Menurut Bhatia dan Lodha (2005), DNA superkoil memiliki untai tunggal parsial yang banyak mengandung ikatan A-T (adenosin dan timin) sehingga mudah diserang oleh ssDNA yaitu sejenis endonuklease spesifik. Bagian-bagian dari untai tunggal
DNA ini dapat menyerupai sarcin/ricin (S/R) loop milik RNA sehingga
menjadikannya target bagi protein antivirus yang memiliki aktivitas pemotongan DNA superkoil. Menurut Ling, dkk. (1994), bagian dari RIP yang mempunyai aktivitas sebagai RNA N-glikosidase menunjukkan kemiripan struktur tiga dimensi, terutama pada konformasi konsensus aktifnya. Oleh karna itu, kemiripan aktivitas RIP terhadap pemotongan DNA superkoil mungkin merupakan cerminan dari identitas intrisik dari struktur kuatenernya (Ling, dkk., 1994).
Gambar 9. Skema pemotongan DNA superkoil.
DNA superkoil terpotong pada salah satu untainya menghasilkan DNA nik sirkuler, dan jika terpotong pada kedua untainya menghasilkan DNA linier (diadaptasi dari Anonima, 2014)
Penelitian sebelumnya telah membuktikan beberapa ekstrak gubal tanaman
mempunyai aktivitas N-glikosidase tersebut seperti pada Carica papaya L., Morinda
citrifolia L., Mirabilis jalapa, dan Annona squamosa (Sismindari & Lord, 2000). Aktivitas pemotongan DNA superkoil oleh suatu sampel juga dapat disebabkan oleh kontaminasi enzim endonuklease. Pembuktian bahwa aktivitas tersebut merupakan aktivitas dari RIP dapat dilakukan uji aktivitas pemotongan DNA
superkoil oleh RIP kembali dengan tidak adanya ion Mg2+ sebagai kofaktor yang
penting dari semua enzim restriksi endonuklease (Sismindari, dkk., 1998).
c. Elektroforesis gel agarose
Kedua pengujian aktivitas enzimatik tersebut memerlukan proses pemisahan fragmen-fragmen DNA dengan elektroforesis gel agarose. Agarose merupakan polimer linear yang diekstrak dari rumput laut yang dapat dimodifikasi secara kimia
sesuai dengan tujuan elektroforesis. Gel agarose dibuat dengan cara melelehkan agarose dalam buffer yang diinginkan hingga menjadi cairan transparan yang kemudian dicetak hingga mengeras. Selama proses pemadatan ini, agarose membentuk matriks dengan tingkat kerapatan berbanding lurus dengan konsentrasi agarose yang digunakan. Ketika diberi medan listrik yang melalui gel, DNA yang bermuatan negatif pada pH netra akan bergerak menuju anoda yang bermuatan positif. Pergerakan DNA ini dipengaruhi oleh :
- Ukuran molekul DNA
Semakin besar molekul, pergerakannya semakin lambat oleh karna adanya gaya gesek yang besar.
- Konsentrasi agarose
Semakin tinggi konsentrasi agarose, semakin kecil pori yang terbentuk sehingga sulit dilewati oleh molekul.
- Konformasi DNA
DNA dengan bentuk superheliks, nicked circular dan linear dengan bobot
molekul yang sama dapat bergerak dengan kecepatan yang berbeda. Selain dipengaruhi oleh konsentrasi gel agarose dan kekuatan ion buffer, adanya densitas pada uliran DNA superheliks membuat bergerak lebih cepat dari DNA linier
- Voltase yang digunakan
- Komposisi basa dari DNA dan suhu
digunakan untuk mendeteksi DNA pada gel dapat mengurangi kecepatan pergerakan DNA.
- Komposisi buffer elektroforesis (Sambrook, dkk., 1987).
DNA hasil elektroforesis dideteksi dengan menggunakan etidium bromida, suatu senyawa berfluoresensi. Senyawa ini sangat karsinogen sehingga harus diperlakukan dengan sangat hati-hati. Etidium bromide berinterkalasi di antara pasangan basa sepanjang molekul (Sismindari, 2012).
Gambar 10. Interkalasi EtBr terhadap molekul DNA (diadaptasi dari Anonim, tanpa tahunb). Molekul EtBr menyisip di antara pasangan basa DNA yang menyebabkan densitas DNA
menurun.
Radiasi ultraviolet pada 254 nm diabsorbsi oleh DNA dan ditransmisikan pada etidium bromida. Radiasi pada 302-366 nm diserap oleh etidium bromida dan energinya dipancarkan pada 590 nm pada daerah jingga-merah. Hasil elektroforesis gel agarose DNA saat disinari ultraviolet akan berfluoresensi jingga merah (Sismindari, 2012).
5. Stabilitas Protein
Stabilitas suatu protein sebagai suatu molekul yang aktif secara biologis tergantung dari lingkungan tertentu dan paparan yang menyebabkan kerusakan kimia atau perubahan konformasi (Franks, 1993). Ketika terjadi proses sintesis protein di dalam sel, rantai polipeptida dengan suatu urutan asam amino tertentu dapat secara spontan mengatur diri membentuk struktur tiga-dimensi yang dipertahankan oleh interaksi-interaksi yang menyebabkan struktur sekunder dan tersier (Campbell, dkk., 2002). Selain itu, ikatan peptida bersifat sangat stabil, dan hidrolisis kimia untuk memecah ikatan tersebut memerlukan kondisi yang sangat ekstrim. Dalam tubuh, ikatan peptida diuraikan oleh enzim proteolitik yang disebut protease atau peptidase
(Marks, dkk., 2000). Oleh karena itu, stabilitas protein dalam kondisi in vivo sebagian
besar diatur dan dipengaruhi oleh aktivitas enzim proteolitik (Franks, 1993)
Selain urutan asam amino dan proses dalam sel, konformasi protein juga tergantung pada kondisi fisik dan kimiawi lingkungan protein (Campbell, dkk., 2002). Stabilitas protein yang berada di luar kondisi alaminya dapat dirusak oleh reaksi kimia yang merusak secara permanen (Franks, 1993). Selain itu, perubahan lingkungan (dalam hal ini adalah pelarut) seperti pH, konsentrasi garam, suhu, atau aspek lainnya akan dapat mengakibatkan protein terbuka dan kehilangan konformasi aslinya, suatu perubahan yang disebut denaturasi (Campbell, dkk., 2002).
Setelah terdenaturasi, protein menjadi tidak aktif secara biologis. Sebagian besar protein menjadi terdenaturasi jika protein tersebut dipindahkan dalam dari lingkungan aqueous ke dalam suatu pelarut organik, seperti eter atau kloroform;
protein tersebut akan menjadi terbalik (bagian luar masuk ke bagian dalam) sehingga daerah hidrofobiknya berganti tempat dengan bagian hidrofiliknya. Agen denaturasi lain meliputi bahan kimiawi yang merusak atau mengganggu ikatan hidrogen, ikatan ionik, dan jembatan disulfide yang mempertahankan suatu bentuk protein. Denaturasi dapat juga disebabkan oleh panas yang berlebihan, yang mengagitasi (merangsang) rantai polipeptida itu sedemikian rupa sehingga cukup untuk mengatasi interaksi lemah yang menstabilkan konformasi tersebut (Campbell, dkk., 2002).
Ketika suatu protein dalam larutan didenaturasi oleh panas atah bahan kimiawi, protein tersebut seringkali akan kembali ke bentuk fungsionalnya bila agen pendenaturasi itu dihilangkan (Campbell, dkk., 2002). Sifat inilah yang dimanfaatkan dalam proses isolasi dan purifikasi protein (Franks, 1993). Akan tetapi lingkungan yang penuh sesak di dalam suatu sel, pelipatan ulang suatu protein terdenaturasi mungkin lebih merupakan masalah bagi protein tersebut (Campbell, dkk., 2002)
Gambar 11. Denaturasi dan renaturasi.
Denaturasi melalui panas menyebabkan molekul terbuka; namun ikatan disulfide tetap utuh. Suatu bahan seperti merkaptoetanol mengurangi ikatan disulfide. Di bawah kondisi yang sesuai,
molekul dapat mengalami renaturasi, yaitu kembali ke konformasi asli. Renaturasi tetap dapat terjadi walaupun ikatan disulfide telah dikurangi (diadaptasi dari Franks, 1993).
Renaturasi Denaturasi
6. Uji Sitotoksik terhadap Sel Kanker
a. Sel Kanker
Kanker adalah penyakit sel yang ditandai dengan berubahnya atau hilangnya mekanisme kontrol yang mengatur siklus hidup sel, proliferasi, dan diferensiasi. Sel-sel yang telah mengalami transformasi neoplastik biasanya mengekspresikan antigen-antigen permukaan sel yang tampak seperti tipe janin normal, memiliki tanda-tanda nyata lainnya seperti tidak terjadi maturitas, dan mungkin menunjukkan kelainan kromosom baik secara kualitatif atau kuantitatif, termasuk berbagai translokasi dan penampilan sekuens-sekuens gen teramplifikasi. Sel-sel yang demikian ini mengalami proliferasi secara berlebihan dan membentuk tumor lokal yang dapat menekan atau menginvasi struktur-struktur normal di sekitarnya (Katzung, 2004). Meskipun kanker merupakan gangguan pada tingkat sel, namun kanker dipengaruhi oleh perubahan lingkungan dalam tubuh inang. Jadi, untuk melakukan analisis eksperimental, dibutuhkan metode yang memungkinkan perubahan yang terjadi pada
sel yang terisolasi dapat dipelajari sebaik pada pengujian in vivo pada hewan. Salah
satunya dengan teknik tissue culture atau kultur jaringan. Teknik kultur jaringan
biasanya digunakan untuk mengamati secara langsung tumor dan sel normal yang diisolasi dari lingkungan normalnya. Metode ini memunkinkan untuk mempelajari efek langsung suatu senyawa atau agen pada sel yang hidup. Teknik yang sering
digunakan adalah kultur sel (cell culture) di mana fragmen dari jaringan, tumor atau
sel yang telah dipisah ditempatkan dalam suatu wadah gelas atau plastik steril yang berisi medium nutrient cair dan dijaga pada suhu tubuh dalam incubator dengan
atmosfir yang terdiri dari udara dan karbon dioksida (biasanya 5%) seperti pada
kondisi in vivo. Jika pengkulturan berhasil, sel akan tumbuh dan memenuhi wadah.
Kultur tersebut dapat dipindah dan ditrasplantasi lagi pada wadah lain atau disimpan dalam nitrogen cair. Populasi ini sifatnya campuran, tetapi sel tunggal dapat diisolasi dan ditumbuhkan menjadi sejumlah besar sel identik secara genetic yang berasal dari pembelahan atau replikasi sel tunggal tersebut. Populasi sel identik tersebut dikenal
sebagai cell line dan dapat digunakan untuk penelitian yang lebih terperinci (Franks
& Teich, 1997).
Banyak cell line tumor yang sudah dibuat dan disimpan walaupun hanya sedikit
dari populasi tumor yang akan menghasilkan cell line yang memungkinkan untuk
dikulturkan sampai tak terbatas. Sejauh ini, sel normal hanya dapat dipelihara dalam jangka waktu yang singkat. Meskipun demikian, sel normal telah digunakan untuk mempelajari induksi transformasi neoplastik dalam kondisi yang dikontrol secara ketat (Franks & Teich, 1997).
1) MCF-7 cell line
MCF-7 cell line adalah kanker payudara yang berasal dari efusi pleura yang
diambil dari wanita kaukasian berumur 69 tahun dengan kanker payudara metastatik. Nama MCF sendiri merupakan singkatan dari nama yayasan di Detroit yang
mengmbangkan cell line tersebut yaitu Michigan Cancer Foundation (Levenson &
Jordan, 1997). Sel tersebut merupakan sel epitel yang dapat melekat pada culture
(Eagle's Minimum Essential Medium) yang mengandung 0.01 mg/ml human recombinant insulin dan fetal bovine serum dengan konsentrasi akhir 10% (Anonimc, 2014).
Sel MCF-7 memiliki reseptor glukokortikoid, progestin, androgen dan estrogen
yang menjadikan sel MCF-7 model in vitro yang baik untuk mencari menaknisme
respon tumor terhadap terapi endokrin. Tidak ditemukan kompetisi silang pada reseptor estrogen, akan tetapi progestin mengalami kompetisi dengan androgen dan
glukokortikoid. Oleh karna itu, MCF-7 merupakan cell line kanker payudara pertama
yang responsif terhadap hormon sehingga penggunaannya dalam bidang penelitian sangat luas (Levenson & Jordan, 1997).
Gambar 12. Kultur sel MCF-7 ATCC® HTB-22TM.
Gambar kiri dengan densitas rendah dan gambar kanan densitas tinggi (diadaptasi dari Anonim, 2014c).
Selain itu, sel MCF-7 tidak mengekspresikan caspase-3 (Onuki, dkk., 2003;
Prunet, dkk., 2005), tetapi mengekspresikan insulin-like growth factor binding
proteins (IGFBP) BP-2; BP-4; BP-5 (Anonimc, 2014), dan P-glikoprotein (Pgp) yang
merupakan multidrug resistance transporter (Mechetner, dkk., 1998)
b. Uji Sitotoksik
Sitotoksisitas adalah sifat dari suatu senyawa yang menyebabkan kerusakan sel pada satu atau lebih jalur metabolisme, proses intraselular, atau pada struktur sel yang mengakibatkan terganggunya fungsi sel, bahkan dapat menyebabkan kematian sel. Uji sitotoksik dapat dilakukan untuk berbagai tujuan seperti pada senyawa yang digunakan sebagai obat-obatan atau kosmetik sehingga harus terbukti tidak beracun atau pada senyawa yang dirancang sebagai agen antikanker sehingga perlu diuji potensi sitotoksiknya (Freshney, 2005). Tujuan penelitian menentukan definisi sitotoksik pada senyawa tersebut, apakah senyawa tersebut sitotoksik bila merubah metabolisme sel, atau senyawa tersebut sitotoksik bila senyawa tersebut dapat membunuh sel (Doyle & Griffiths, 2000).
Uji sitotoksisk merupakan uji toksisitas secara in vitro menggunakan kultur
primer (primary cultures) atau dengan menggunakan cell line. Penggunaaan metode
in vitro ini mempunyai banyak keuntungan yaitu dapat digunakan pada tahap awal pengembangan obat, senyawa uji yang diperlukan untuk uji sedikit, dan meminimalkan penggunaan hewan uji (Doyle & Griffiths, 2000).
Sistem uji sitotoksisitas mempunyai beberapa persyaratan diantaranya adalah sistem pengujian harus dapat menghasilkan kurva dosis-respon yang reprodusibel
dengan variabilitas yang rendah, kriteria respon harus menunjukan hubungan linier dengan jumlah sel serta informasi yang didapat dari kurva dosis-respon harus sejalan
dengan efek yang muncul pada in vivo (Doyle & Griffiths, 2000).
Pada uji aktivitas anti kanker, sel akan dipejani dengan senyawa tertentu yang diduga sitotoksik dengan berbagai konsentrasi dan respon berupa kematian sel dimonitor untuk dievaluasi (Zips, 2005).
Pengujian toksisitas agen anti kanker dan evaluasi sensitivitas obat menggunakan kultur sel dapat digolongkan menjadi dua kelompok yaitu :
1) Metode pengukuran sitotoksisitas
a) Perhitungan sel dengan Haemocytometer dan pewarnaan tripan blue
Metode ini menggunakan bilik hitung dengan kedalaman 0,1 mm dan dibagi dalam beberapa kotak untuk memudahkan perhitungan. Sel hidup dan sel mati dapat dilakukan dengan menggunakan pewarna seperti Tripan blue untuk membedakan sel hidup dan sel mati. Yang perlu diperhatikan pada penggunaan metode ini adalah pada saat pengambilan sampel, pengenceran, dan pengisian pada bilik hitung memerlukan keakuratan. Selain itu bilik hitung yang kurang bersih, adanya gelembung dan pengisian yang berlebih menyebabkan kesalahan pada perhitungan. Untuk mengurangi kesalahan statistical, pengulangan perhitungan perlu dilakukan. Metode adalah metode yang paling sederhana, cepat, murah, dan hanya memerlukan sedikit sel dari suspensi sel (Doyle & Griffiths, 2000).
b) Metode MTT
Kerusakan sel oleh senyawa xenobiotik tersebut biasanya berdampak pada perubahan permeabilitas membrane sel. Akibatnya enzim sitoplasma dapat keluar dari sel dan merupakan parameter untuk evaluasi aktivitas sitotoksik yang cepat dan
sensitif. Salah satu enzim dari sitosol tersebut adalah LDH yang merupakan marker
yang baik. LDH menghasilkan NADH dan piruvat dari NAD dan laktat. Piruvat kemudian dimetabolisme oleh GPT, sedangkan NADH bersama dengan MTT
(3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolium bromid) dimetabolisme oleh
mitokindrial yaitu succinate dehydrogenase menjadi kristal formazan yang tidak larut
dalam air. Kristal formazan yang terbentuk akan menyebabkan perubahan warna dari kuning menjadi ungu. Perubahan ini yang akan diukur dengan menggunakan metode spektrofotometri. Jumlah formazan yang terbentuk berbanding lurus dengan jumlah sel yang hidup. Oleh karna itu, diperlukan kurva standar yang baik (Doyle & Griffiths, 2000).
2)Metode pengukuran ketahanan sel (cell survival)
Metode-metode ini mengukur hasil akhir dari efek paparan agen sitotoksik terhadap sel yang dapat berupa kematian sel atau pemulihan sel (Brown & Böger-Brown, 1999).
a) Colony-Forming Efficiency
Metode ini adalah metode viabilitas yang sebenarnya. Metode ini tergantung dari sel tunggal yang dapat bereplikasi dalam waktu yang cukup untuk membentuk koloni
yang dapat terlihat, biasanya setelah minimal lima sampai enam kali pembelahan untuk membentuk koloni yang paling tidak terdiri dari 50 sel. Kemampuan untuk
membentuk koloni itulah ukuran dari reproductive integrity dan dihitung sebagai
colony forming efficiency (CFE), serta kadang juga diacu sebagai Planting Efficiency
(PE) ketika koloni tumbuh dalam culture flask (Doyle & Griffiths, 2000).
E. Keterangan Empiris
Berdasarkan pengetahuan tentang aktivitas RIP yang ditemukan pada tanaman seperti aktivitas pemotongan DNA superkoil dan efek sitotoksik terhadap beberapa sel kanker, penelitian ini dapat memberi informasi tentang :
1. Sayuran di Indonesia yang mengandung RIP
2. Stabilitas RIP pada sayuran yang telah direbus selama 5 menit dan
aktivitasnya terhadap uji pemotongan DNA superkoil
3. Gambaran sitotoksik terhadap sel kanker payudara MCF-7 berupa IC50 dari