AKTIVITAS ENZIM KATEPSIN DAN KOLAGENASE
DARI DAGING IKAN BANDENG (
Chanos chanos
Forskall)
SELAMA PERIODE KEMUNDURAN MUTU IKAN
Rustamaji
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
2009
RINGKASAN
RUSTAMAJI. C34050694. Aktivitas Enzim Katepsin dan Kolagenase dari
Daging Ikan Bandeng (Chanos chanos Forskall) selama Periode Kemunduran Mutu Ikan. Dibimbing oleh TATI NURHAYATI dan ELLA SALAMAH.
Salah satu penyebab terjadinya proses kemunduran mutu ikan adalah adanya aktivitas enzim terutama enzim proteolitik diantaranya enzim katepsin dan kolagenase. Katepsin merupakan enzim proteolitik yang terdapat pada jaringan tubuh ikan. Enzim ini sangat berperan dalam proses pelunakan tekstur daging ikan akibat degradasi protein miofibril sehingga turut mempercepat proses kemunduran mutu ikan. Kolagenase secara umum didefinisikan sebagai enzim yang mampu mendegradasi ikatan polipeptida saat protein belum mengalami denaturasi.
Penelitian ini dilakukan dalam empat tahap, yaitu (1) penentukan fase post
mortem ikan secara organoleptik, (2) penentuan pola kemunduran mutu ikan,
(3) ekstraksi enzim katepsin, dan (4) ekstraksi enzim kolagenase. Pengamatan dilakukan terhadap empat kelompok ikan, yaitu ikan bandeng P (tidak dipuasakan, penyimpanan suhu ruang), ikan bandeng Q (dipuasakan, penyimpanan suhu ruang), ikan bandeng R (tidak dipuasakan, penyimpanan suhu chilling), dan ikan bandeng S (dipuasakan, penyimpanan suhu chilling). Uji organoleptik dilakukan setiap satu jam selama 19 jam penyimpanan suhu ruang dan setiap 12 jam selama 540 jam (23 hari) penyimpanan suhu chilling. Uji TVB, TPC, pH, assay aktivitas enzim katepsin dan kolagenase serta konsentrasi protein enzim dilakukan pada fase pre rigor, rigor mortis, post rigor, dan busuk.
Kondisi pre rigor, rigor mortis, post rigor, dan busuk pada penyimpanan suhu ruang (ikan P dan Q) selama 19 jam dengan interval waktu pengamatan satu jam terjadi berturut-turut pada jam penyimpanan ke-0, 10, 15 dan 19. Kondisi
pre rigor, rigor mortis, post rigor, dan busuk pada penyimpanan suhu chilling
(ikan R dan S) selama 540 jam (23 hari) dengan interval waktu pengamatan 12 jam terjadi berturut-turut pada jam penyimpanan ke-0, 84, 300, dan 540.
Berdasarkan hasil uji ragam (ANOVA α=0,05) diketahui bahwa perlakuan kombinasi kondisi ikan sebelum dipanen dan suhu penyimpanan dari masing-masing ikan P, Q, R, dan S memberikan pengaruh yang tidak berbeda nyata terhadap nilai pH, TPC (Total Plate Count), TVB (Total Volatile Base), aktivitas enzim katepsin dan kolagenase pada tingkat kepercayaan 95 %. Hasil uji ragam (ANOVA α=0,05) dengan rancangan acak kelompok pada fase kemunduran mutu ikan (pre rigor, rigor mortis, post rigor, dan busuk) menunjukkan bahwa dari masing-masing ikan P, Q, R, dan S memberikan pengaruh yang berbeda nyata terhadap nilai pH, TPC, TVB serta aktivitas enzim katepsin dan kolagenase pada tingkat kepercayaan 95 %. Analisis korelasi linier sederhana menunjukkan bahwa aktivitas enzim katepsin dan kolagenase memiliki hubungan yang sangat erat (r ≥ 0,7) secara linier dengan parameter kesegaran ikan kecuali pada nilai pH selama proses kemunduran mutu dari fase pre rigor hingga post rigor dan menjadi kurang erat setelah memasuki fase busuk. Namun aktivitas enzim kolagenase masih memiliki hubungan yang sangat erat (r ≥ 0,7) hingga fase busuk pada parameter nilai organoleptik dan TPC.
AKTIVITAS ENZIM KATEPSIN DAN KOLAGENASE
DARI DAGING IKAN BANDENG (
Chanos chanos
Forskall)
SELAMA PERIODE KEMUNDURAN MUTU IKAN
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
Oleh : Rustamaji C34050694
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
2009
Judul Skripsi : Aktivitas Enzim Katepsin dan Kolagenase
dari Daging Ikan Bandeng (Chanos chanos Forskall)
selama Periode Kemunduran Mutu Ikan
Nama : Rustamaji
NIM : C34050694
Menyetujui,
Pembimbing I Pembimbing II
Dr. Tati Nurhayati, S.Pi, M.Si. Dra. Ella Salamah, M.Si.
NIP. 197008071996032002 NIP. 195306291988032001
Mengetahui,
Ketua Departemen Teknologi Hasil Perairan
Dr. Ir. Linawati Hardjito, M.Sc
NIP. 196205281987032003
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi saya yang berjudul “Aktivitas Enzim Katepsin dan Kolagenase dari Daging Ikan Bandeng
(Chanos chanos Forskall) selama Periode Kemunduran Mutu Ikan” adalah hasil
karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau kutipan dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi.
Bogor, Agustus 2009
Rustamaji C34050694
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT, karena berkat rahmat serta hidayah-Nya, penulis dapat menyelesaikan penyusunan skripsi dengan judul
”
Aktivitas Enzim Katepsin dan Kolagenase dari Daging Ikan Bandeng(Chanos chanos Forskall) selama Periode Kemunduran Mutu Ikan”. Penelitian ini
berjalan atas pembiayaan dari program Hibah Bersaing 2008 atas nama Dr. Tati Nurhayati, S.Pi, M.Si. Penyusunan skripsi merupakan salah satu syarat
untuk memperoleh gelar Sarjana di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Pada kesempatan ini penulis mengucapkan terima kasih yang sebesar-besarnya kepada semua pihak yang telah membantu dalam penulisan skripsi ini, terutama kepada :
1. Ibu Dr. Tati Nurhayati, S.Pi, M.Si dan Ibu Dra. Ella Salamah, M.Si selaku komisi pembimbing, atas segala bimbingan dan pengarahan yang diberikan kepada penulis.
2. Ibu Dr. Ir. Linawati Hardjito, M.Sc selaku Ketua Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
3. Bapak Dr. Ir. Agoes Mardiono Jacoeb, Dipl. Biol dan Ibu Dra. Pipih Suptijah, MBA selaku dosen penguji yang telah memberikan
pengarahan dan saran kepada penulis.
4. Ayah dan ibunda tercinta, atas semua dukungan dan kasih sayang yang diberikan serta doanya selama ini.
5. Bapak Darmawan, atas dukungan moril dan materiil kepada penulis selama menjalani perkuliahan.
4. Seluruh staf dosen dan TU THP, terima kasih atas dukungan dan bantuannya selama ini.
5. Ibu Ema (Laboran THP), Pak Wahyu (FKH), serta mbak Martini dan Pak Arya (Biokimia) yang telah banyak membantu selama penelitian.
6. Tim seperjuangan : Kak Rijan, Kak Dede, Pak Kur, Nina, Irfan dan Jamal, terima kasih atas semua bantuan tenaga dan semangat selama melakukan penelitian.
7. Pak Oci beserta staf Dinas Kelautan dan Perikanan Kota Tangerang, terima kasih atas bantuannya selama pengambilan sampel penelitian.
8. Rekan-rekan THP 42 yang selalu memberi kesan indah setiap saat.
9. Kakak-kakak kelasku (THP 40 dan THP 41) dan adik-adik kelasku (THP 43 dan THP 44) atas semangat dan kebersamaannya.
10.Semua pihak yang telah membantu penulis selama penelitian dan penyusunan skripsi, yang tidak dapat penulis sebutkan satu persatu.
Penulis menyadari bahwa penulisan skripsi ini masih jauh dari sempurna. Oleh karena itu kritik dan saran yang bersifat membangun dari semua pihak sangat diharapkan. Semoga tulisan ini bermanfaat bagi semua pihak yang memerlukannya.
Bogor, Agustus 2009
Rustamaji
RIWAYAT HIDUP
Penulis bernama lengkap Rustamaji. Penulis dilahirkan pada tanggal 18 Agustus 1986 di Pati, Jawa Tengah. Penulis adalah anak ke-3 dari empat bersaudara dari pasangan Bapak Yarman dan Ibu Kasiati. Penulis mengawali pendidikan pada tahun 1993 di SDN Manjang 02 dan menyelesaikan pendidikan pada tahun 1999. Kemudian penulis melanjutkan pendidikan di SLTP Negeri 1 Jaken (1999-2002). Penulis melanjutkan pendidikan ke SMAN 1 Rembang dan menyelesaikan pendidikannya pada tahun 2005. Pada tahun yang sama, penulis diterima menjadi mahasiswa Institut Pertanian Bogor melalui Undangan Seleksi Masuk IPB (USMI) di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan.
Selama masa perkuliahan penulis pernah aktif menjadi asisten beberapa mata kuliah, antara lain asisten mata kuliah Avertebrata Air (2007/2008), asisten Pendidikan Agama Islam (2007/2008), dan asisten Fisiologi, Formasi, dan Degradasi Metabolit Hasil Perairan (2008/2009). Penulis pernah didanai oleh DIKTI dalam Program Kreativitas Mahasiswa bidang penelitian tahun 2006. Penulis juga merupakan salah satu finalis Mahasiswa Berprestasi tahun 2008 Departemen THP FPIK IPB. Pada bulan Juli 2009 penulis melaksanakan praktek lapang di PT Misaja Mitra, Pati, Jawa Tengah dengan judul “Teknik Sanitasi dan Higiene pada Unit Pembekuan Udang (Penaeus sp.) di PT Misaja Mitra, Pati, Jawa Tengah”. Selama masa kuliah penulis memperoleh beasiswa dari beberapa sumber, diantaranya adalah Beasiswa Bank Mandiri, Beasiswa Peningkatan Prestasi Akademik, Beasiswa Mahasiswa Berprestasi PPSDMS Nurul Fikri, dan Beasiswa Women’s International Club Jakarta. Penulis juga aktif berorganisasi baik intra kampus maupun ekstra kampus. Penulis pernah menjabat sebagai Sekretaris Ikatan Alumni Ikasabiq SMAN 1 Rembang (2005/2006), Kepala Divisi Profesi dan Keilmiahan Himasilkan FPIK IPB (2006/2007), Ketua Umum Ikatan Alumni Ikasabiq SMAN 1 Rembang (2006/2008), Kepala Dept. KP2K BEM FPIK IPB (2007/2008), Kepala Biro Kewirausahaan Yayasan FKP Foundation (2008), dan pada tahun 2008 penulis mendirikan sekaligus menjabat sebagai Direktur Ikasabiq Scholarship Program SMAN 1 Rembang yang merupakan
program beasiswa dari alumni bagi siswa-siswi berprestasi SMAN 1 Rembang. Pada awal tahun 2009 penulis bekerja sebagai management trainee di Lembaga Pendidikan Unggul College. Saat penyusunan skripsi ini, penulis menjabat sebagai Kepala Cabang Lembaga Pendidikan Unggul College Bogor.
Penulis menyusun skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan, dengan judul “Aktivitas Enzim Katepsin dan Kolagenase dari Daging Ikan Bandeng
(Chanos chanos Forskall) selama Periode Kemunduran Mutu Ikan”, dibawah
DAFTAR ISI
Hal
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
1. PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan ... 2
2. TINJAUAN PUSTAKA ... 3
2.1 Deskripsi dan Klasifikasi Ikan Bandeng (Chanos chanos Forskall) ... 3
2.2 Mutu Ikan ... 4
2.3 Proses Kemunduran Mutu Ikan ... 5
2.3.1 Pre rigor ... 7 2.3.2 Rigor mortis ... 7 2.3.3 Post rigor ... 8 2.4 Enzim ... 10 2.4.1 Enzim katepsin... 10 2.4.2 Enzim kolagenase ... 11
2.4.3 Peranan enzim katepsin dan kolagenase dalam kemunduran mutu ... 12
3. METODOLOGI ... 14
3.1 Waktu dan Tempat ... 14
3.2 Bahan dan Alat Penelitian ... 14
3.3 Tahapan Penelitian ... 15
3.3.1 Penentuan fase post mortem ikan secara organoleptik (BSN 2006) ... 15
3.3.2 Penentuan pola kemunduran mutu ikan ... 15
3.3.3 Ekstraksi enzim katepsin (Dinu et al. 2002) ... 15
3.3.4 Ekstraksi enzim kolagenase (Moore dan Stein 1954 diacu dalam Kim et al. 2002)... 16
3.4 Analisis ... 17
3.4.1 Uji organoleptik (BSN 2006) ... 17
3.4.2 Uji nilai pH (Apriyantono et al. 1989) ... 17
3.4.3 Uji TPC (Fardiaz 1987) ... 17
3.4.4 Uji TVB (Apriyantono et al. 1989) ... 18
3.4.6 Aktivitas enzim kolagenase (Moore dan Stein 1954 diacu
dalam Park et al. 2002) ... 20
3.4.7 Pengukuran konsentrasi protein enzim (Breadford 1976) ... 21
3.5 Analisis Data ... 21
4. HASIL DAN PEMBAHASAN ... 24
4.1 Penentuan Fase Post Mortem Ikan ... 24
4.2 Kemunduran Mutu Ikan ... 25
4.2.1 Nilai organoleptik ... 26
4.2.2 Nilai pH ... 30
4.2.3 Nilai TPC ... 32
4.2.4 Nilai TVB ... 34
4.3 Aktivitas dan Konsentrasi Enzim Katepsin... 37
4.4 Aktivitas dan Konsentrasi Enzim Kolagenase ... 40
4.5 Hubungan antara Aktivitas Enzim dan Parameter Kesegaran Ikan .... 42
4.6 Hubungan antar Parameter Kesegaran Ikan ... 45
5. KESIMPULAN DAN SARAN ... 51
5.1 Kesimpulan ... 51
5.2 Saran ... 52
DAFTAR PUSTAKA ... 53
DAFTAR TABEL
No Teks Hal
1. Kandungan gizi ikan bandeng (Chanos chanos Forskall)... 4
2. Ciri-ciri ikan segar dan ikan busuk ... 5
3. Enzim proteolitik yang berhubungan dengan lisosom otot ikan ... 11
4. Pembuatan larutan standar BSA konsentrasi 0,1-1,0 mg/ml... 21
5. Aktivitas enzim katepsin B dan L daging Longissimus porcine selama penyimpanan suhu 4 0C... 38 6. Koefisien korelasi linier sederhana aktivitas enzim dan parameter
DAFTAR GAMBAR
No Teks Hal
1. Morfologi ikan bandeng (Chanos chanos Forskall) ... 3
2. Dasar perubahan setelah ikan mati ... 6
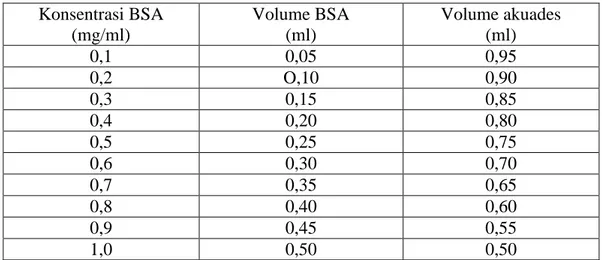
3. Rata-rata nilai organoleptik ikan bandeng utuh P, Q, R, dan S ... 26
4. Rata-rata nilai organoleptik daging ikan bandeng P, Q, R, dan S ... 29
5. Rata-rata nilai pH ikan bandeng P, Q, R, dan S ... 31
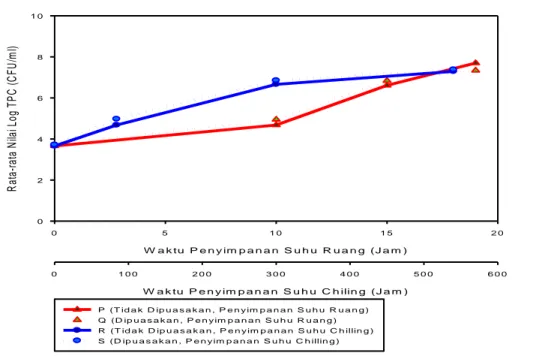
6. Rata-rata nilai log TPC ikan bandeng P, Q, R, dan S ... 33
7. Rata-rata nilai TVB ikan bandeng P, Q, R, dan S ... 35
8. Rata-rata aktivitas enzim katepsin ... 37
9. Rata-rata konsentrasi protein enzim katepsin ... 39
10. Rata-rata aktivitas enzim kolagenase ... 41
11. Rata-rata konsentrasi protein enzim kolagenase ... 42
12. Koefisien korelasi aktivitas enzim fase pre rigor hingga post rigor sampel P, Q, R, dan S ... 43
13. Hubungan antara aktivitas enzim dan parameter kesegaran sampel P ... 46
14. Hubungan antara aktivitas enzim dan parameter kesegaran sampel Q ... 47
15. Hubungan antara aktivitas enzim dan parameter kesegaran sampel R ... 48
DAFTAR LAMPIRAN
No Hal
1. Diagram alir tahapan penelitian secara keseluruhan ... 58
2. Format uji organoleptik ikan segar (SNI 01-2346-2006) ... 59
3a. Bahan-bahan untuk ekstraksi enzim katepsin (Dinu et al. 2002) ... 61
3b. Diagram alir ekstraksi enzim katepsin ... 61
4a. Bahan-bahan untuk ekstraksi enzim kolagenase (Moore dan Stein 1954 diacu dalam Park et al. 2002) ... 61
4b. Diagram alir ekstraksi enzim kolagenase ... 62
5a. Diagram alir analisis nilai pH ... 62
5b. Diagram alir analisis nilai TPC ... 62
5c. Diagram alir analisis nilai TVB ... 63
6a. Bahan-bahan untuk pengukuran aktivitas enzim katepsin (Dinu et al. 2002) ... 63
6b. Prosedur pengukuran aktivitas enzim katepsin ... 64
6c. Bahan-bahan untuk pengukuran aktivitas enzim kolagenase (Moore dan Stein 1954 diacu dalam Park et al. 2002) ... 64
6d. Prosedur pengukuran aktivitas enzim kolagenase ... 65
6e. Diagram alir pengukuran konsentrasi protein enzim ... 66
6f. Kurva standar penentuan konsentrasi protein ... 66
7a. Hasil uji ragam ANOVA terhadap pH ... 69
7b. Hasil uji ragam ANOVA terhadap Log TPC ... 69
7c. Hasil uji ragam ANOVA terhadap TVB ... 69
7d. Hasil uji ragam ANOVA terhadap aktivitas enzim katepsin ... 70
7e. Hasil uji ragam ANOVA terhadap aktivitas enzim kolagenase ... 70
8. Hasil pengujian tingkat kesegaran ikan bandeng pada penentuan pola kemunduran mutu ... 71
9. Hasil pengujian aktivitas enzim selama kemunduran mutu ... 72
1. PENDAHULUAN
1.1 Latar Belakang
Potensi lestari perikanan laut Indonesia diperkirakan sebesar 6,4 juta ton per tahun yang tersebar di perairan wilayah Indonesia dan Zona Ekonomi Eksklusif dengan jumlah tangkapan yang diperbolehkan sebesar 5,12 juta ton per tahun atau sekitar 80 % dari potensi lestari. Potensi tersebut merupakan salah satu peluang untuk meningkatkan jumlah produksi ikan baik pada perikanan tangkap maupun perikanan budidaya. Jumlah produksi perikanan tangkap dari penangkapan ikan dilaut dan di perairan umum pada tahun 2006 masing-masing sekitar 4.468.010 ton dan 301.150 ton. Produksi perikanan budidaya pada tahun 2006 mencapai 2.625.800 ton yang didominasi oleh udang 327.260 ton, rumput laut 1.079.850 ton, ikan mas 285.250 ton, bandeng 269.530 ton, nila 227.000 ton, lele 94.160 ton, gurame 35.570 ton, dan kerapu 8.430 ton (BRKP 2007). Data tersebut menunjukkan bahwa produksi ikan bandeng menduduki urutan ke-4 setelah rumput laut, udang, dan ikan mas.
Catatan Badan Pusat Statistik menyebutkan bahwa penawaran ikan bandeng nasional tahun 2002 mencapai sekitar 300.000 ton dengan pertumbuhan penawaran rata-rata 3,82 % per tahun (BPS 2002). Namun yang menjadi kendala dalam penawaran ikan bandeng tersebut adalah masalah konsistensi mutu. Hal ini disebabkan ikan bandeng sebagaimana jenis ikan pada umumnya cepat mengalami pembusukan atau penurunan mutu.
Penurunan mutu ikan terjadi segera setelah ikan ditangkap atau mati. Kecepatan penurunan mutu dipengaruhi oleh banyak faktor, antara lain jenis kelamin, jenis ikan, ukuran ikan, kondisi lingkungan, perlakuan fisik, jumlah jasad renik, dan aktivitas enzim (Ridwansyah 2002). Salah satu jenis enzim yang berperan penting dalam proses kemunduran mutu ikan adalah enzim-enzim pengurai protein (enzim proteolitik) yang menguraikan protein menjadi pepton, polipeptida, dan asam-asam amino (Kreuzer 1965).
Diantara enzim proteolitik tersebut adalah enzim katepsin dan kolagenase. Katepsin merupakan enzim proteolitik yang terdapat pada jaringan tubuh ikan. Enzim ini sangat berperan dalam proses pelunakan tekstur daging ikan akibat degradasi protein miofibril sehingga turut mempercepat proses kemunduran mutu ikan (Jiang 2000). Enzim kolagenase secara umum didefinisikan sebagai enzim yang mampu mendegradasi ikatan polipeptida dari kolagen saat protein belum mengalami denaturasi (Kim et al. 2002). Aktivitas enzim ini sangat berpengaruh terhadap proses kemunduran mutu ikan (Siswanto dan Soedarto 2008). Oleh karena itu, perlu diketahui peranan aktivitas kedua enzim tersebut dalam proses kemunduran mutu sehingga dapat mengambil langkah yang tepat dalam penanganan dan pengolahan ikan.
1.2 Tujuan
Tujuan dari penelitian ini adalah :
(1) Menentukan fase post mortem ikan bandeng selama penyimpanan suhu ruang dan chilling.
(2) Menentukan pola kemunduran mutu ikan bandeng selama penyimpanan suhu ruang dan chilling berdasarkan analisis tingkat kesegaran ikan.
(3) Menentukan aktivitas enzim katepsin dan kolagenase ikan bandeng serta korelasinya terhadap parameter kesegaran ikan.
2. TINJAUAN PUSTAKA
2.1 Deskripsi dan Klasifikasi Ikan Bandeng (Chanos-chanos)
Ikan bandeng merupakan salah satu jenis ikan budidaya air payau yang potensial dikembangkan. Jenis ikan ini mampu mentolelir salinitas perairan yang luas (0-158 ppt) sehingga digolongkan sebagai ikan euryhaline. Ikan bandeng mampu beradaptasi terhadap perubahan lingkungan seperti suhu, pH, dan kekeruhan air serta tahan terhadap serangan penyakit (Ghufron dan Kardi 1997).
Menurut Bagarinao (1994) ikan bandeng memiliki hubungan yang erat dengan ikan-ikan yang hidup di air tawar. Ikan bandeng diduga berasal dari wilayah Eropa dan Amerika Utara dan melakukan migrasi ke wilayah laut tropis. Saat ini ikan bandeng lebih banyak ditemukan pada daerah tropis.
Klasifikasi ikan bandeng menurut Saanin (1984) adalah sebagai berikut : Filum : Chordata
Sub Filum : Vertebrata Kelas : Pisces Sub Kelas : Teleostei Ordo : Malacopterigii Famili : Chanidae
Genus : Chanos
Spesies : Chanos-chanos
Gambar 1. Morfologi ikan bandeng (Chanos-chanos) Sumber : www.oceanleader.com
Ikan bandeng mempunyai badan yang memanjang seperti terpedo dengan sirip ekor bercabang sebagai tanda bahwa ikan bandeng tergolong sebagai perenang cepat. Kepala ikan bandeng tidak bersisik, mulut kecil terletak di ujung
oleh selaput bening (subcutaneus). Warna badan putih keperak-perakan dan punggung biru kehitaman (Ghufron dan Kardi 1997).
Di Indonesia, ikan bandeng dapat dengan mudah ditemukan di daerah Sumatra Selatan, Borneo, Jawa, dan Sulawesi. Ikan bandeng mempunyai komposisi zat gizi yang cukup tinggi. Kandungan masing-masing zat gizi ikan bandeng disajikan pada Tabel 1.
Tabel 1. Kandungan gizi ikan bandeng (Chanos chanos Forskall) Kandungan zat gizi per
100 g BDD Jumlah Satuan Energi 129 Kkal Protein 20,0 Gram Lemak 4,8 Gram Karbohidrat 0,0 Gram Sumber : BRKP (2007) 2.2 Mutu Ikan
Dibidang pasca panen kualitas ikan merupakan bahan pertimbangan bagi orang yang mengkonsumsi atau membeli ikan. Dengan batasan tersebut, faktor pembatas kualitas dapat mencakup nilai gizi atau nutrisi, tingkat kesegaran, kerusakan selama transportasi, penanganan, pengolahan, penyimpanan, distribusi, dan pemasaran serta hal-hal lain seperti bahaya terhadap kesehatan dan kepuasan untuk mengkonsumsinya (BPTP 2009).
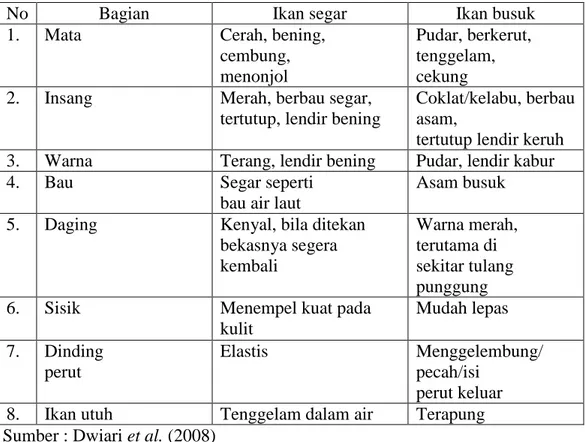
Kesegaran bisa dicapai bila dalam penanganan ikan berlangsung dengan baik. Ikan yang masih segar berarti belum mengalami perubahan-perubahan biokimiawi, mikrobiologi, maupun fisikawi yang dapat menyebabkan kerusakan berat pada daging ikan (Irawan 1995). Adapun ciri-ciri ikan segar dan ikan busuk dapat dilihat pada Tabel 2.
Tabel 2. Ciri-ciri ikan segar dan ikan busuk
No Bagian Ikan segar Ikan busuk
1. Mata Cerah, bening,
cembung, menonjol
Pudar, berkerut, tenggelam, cekung
2. Insang Merah, berbau segar,
tertutup, lendir bening
Coklat/kelabu, berbau asam,
tertutup lendir keruh 3. Warna Terang, lendir bening Pudar, lendir kabur
4. Bau Segar seperti
bau air laut
Asam busuk
5. Daging Kenyal, bila ditekan
bekasnya segera kembali Warna merah, terutama di sekitar tulang punggung
6. Sisik Menempel kuat pada
kulit Mudah lepas 7. Dinding perut Elastis Menggelembung/ pecah/isi perut keluar 8. Ikan utuh Tenggelam dalam air Terapung Sumber : Dwiari et al. (2008)
2.3 Proses Kemunduran Mutu Ikan
Proses perubahan pada ikan setelah mati terjadi karena adanya aktivitas enzim, mikroorganisme, dan kimiawi. Ketiga hal tersebut menyebabkan tingkat kesegaran ikan menurun. Penurunan tingkat kesegaran ikan tersebut dapat terlihat dengan adanya perubahan fisik, kimia, dan organoleptik pada ikan. Semua proses perubahan ini akhirnya mengarah ke pembusukan. Urutan proses perubahan yang terjadi pada ikan meliputi perubahan pre rigor, rigor mortis, aktivitas enzim, aktivitas mikroba, dan oksidasi (Junianto 2003).
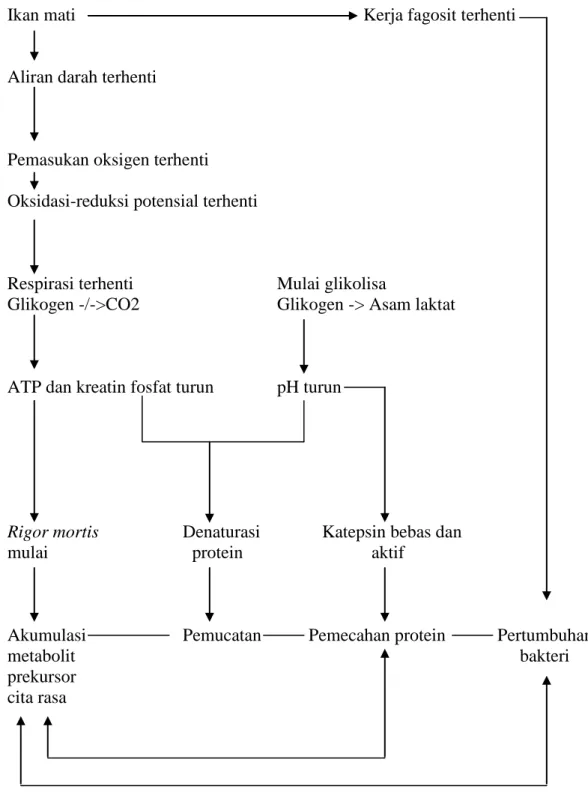
Dasar perubahan yang terjadi setelah kematian ikan disajikan secara ringkas dalam Gambar 2. Proses kemunduran mutu kesegaran ikan akan terus berlangsung jika tidak dihambat. Cepat lambatnya proses tersebut sangat dipengaruhi oleh banyak hal, baik faktor internal yang lebih banyak berkaitan dengan sifat ikan itu sendiri maupun eksternal yang berkaitan dengan lingkungan dan perlakuan manusia. Faktor biologis (internal) tidak mudah ditangani karena berkaitan dengan sifat ikan itu sendiri (Yunizal dan Wibowo 1998).
Ikan mati Kerja fagosit terhenti
Aliran darah terhenti
Pemasukan oksigen terhenti Oksidasi-reduksi potensial terhenti
Respirasi terhenti Mulai glikolisa
Glikogen -/->CO2 Glikogen -> Asam laktat
ATP dan kreatin fosfat turun pH turun
Rigor mortis Denaturasi Katepsin bebas dan
mulai protein aktif
Akumulasi Pemucatan Pemecahan protein Pertumbuhan
metabolit bakteri
prekursor
cita rasa
Gambar 2. Dasar perubahan setelah ikan mati Sumber : Tranggono dan Sutardi (1990) diacu dalam Ridwansyah (2002)
Ikan yang berpenyakit seringkali berada dalam kondisi stres dan kurang dapat menahan serangan bakteri baik internal maupun eksternal. Ikan yang sedang mengalami pemijahan banyak menggunakan energi untuk proses reproduksi, menyebabkan otot tidak sekenyal biasanya dan bila dibekukan akan terjadi
pengeluaran air berlebihan (drip loss). Adapun ikan yang kelelahan (karena menggelepar) banyak menggunakan energi sehingga proses rigor mortis
berlangsung cepat. Bila penanganan ikan dilakukan saat ikan masih mengalami
rigor mortis, maka akan terjadi kerusakan otot, yang akan semakin nyata bila ikan
difillet (BPTP 2009). Fillet ikan sebaiknya dilakukan pada saat ikan memasuki
fase pre rigor. Penelitian Park et al. (1990) menunjukkan bahwa ikan yang di fillet
saat fase pre rigor masih memiliki kandungan protein yang lebih tinggi daripada fase rigor mortis dan post rigor.
2.3.1 Pre rigor
Perubahan pre rigor merupakan peristiwa terlepasnya lendir dari kelenjar di bawah permukaan kulit. Lendir yang dikeluarkan ini sebagian besar terdiri dari glukoprotein dan musin yang merupakan media ideal bagi pertumbuhan bakteri (Junianto 2003). Lendir-lendir yang terlepas tersebut membentuk lapisan bening yang tebal disekeliling tubuh ikan. Pelepasan lendir dari kelenjar lendir ini merupakan reaksi alami ikan yang sedang sekarat terhadap keadaan yang tidak menyenangkan. Jumlah lendir yang terlepas dan menyelimuti tubuh dapat banyak hingga mencapai 1-2,5 % dari berat tubuhnya (Murniyati dan Sunarman 2000).
2.3.2 Rigor mortis
Seperti terjadi pada daging sapi dan daging hewan lainnya, fase ini ditandai oleh mengejangnya tubuh ikan setelah mati. Kekejangan ini disebabkan alat-alat yang terdapat dalam tubuh ikan yang berkontraksi akibat adanya reaksi kimia yang dipengaruhi atau dikendalikan oleh enzim (Dwiari et al. 2008).
Rigor mortis terjadi pada saat-saat siklus kontraksi relaksasi antara miosin
dan aktin didalam miofibril terhenti dan terbentuknya aktomiosin yang permanen.
Rigor mortis dianggap penting dalam industri perikanan. Selain dapat
memperlambat pembusukan oleh mikroba juga dikenal oleh konsumen sebagai petunjuk bahwa ikan masih dalam keadaan sangat segar (Eskin 1990).
Penguraian ATP berkaitan erat dengan terjadinya rigor mortis. Jika penurunan konsentrasi ATP dalam jaringan daging mencapai 1 mikro mol/gram dan pH mencapai 5,9 maka kondisi tersebut sudah dapat menyebabkan penurunan kelenturan otot. Penurunan kelenturan otot terus berlangsung seiring dengan
semakin sedikitnya jumlah ATP. Bila konsentrasi ATP lebih kecil dari 0,1 mikro mol/gram, terjadi proses rigor mortis sempurna (Dwiari et al. 2008).
Pada fase rigor mortis pH tubuh ikan menurun menjadi 6,2-6,6 dari mula-mula pH 6,9-7,2. Tinggi rendahnya pH awal ikan sangat tergantung pada jumlah glikogen yang ada dan kekuatan penyangga (buffering power) pada daging ikan. Kekuatan penyangga pada daging ikan disebabkan oleh protein, asam laktat, asam fosfat, TMAO, dan basa-basa menguap. Setelah fase rigor mortis berakhir dan proses pembusukan berlangsung maka pH daging ikan naik mendekati netral hingga 7,5-8,0 atau lebih tinggi jika pembusukan telah sangat parah. Tingkat keparahan pembusukan disebabkan oleh kadar senyawa-senyawa yang bersifat basa. Pada kondisi ini pH ikan naik dengan perlahan-lahan dan dengan semakin banyak senyawa yang terbentuk akan semakin mempercepat kenaikan pH ikan (Junianto 2003).
Kenaikan nilai pH tergantung pada lama penyimpanan. Kenaikan nilai pH selama penyimpanan dipengaruhi oleh suhu panas, komposisi garam, kondisi fisiologis, kandungan protein dan aktivitas enzim (Taskaya et al. 2003). Nilai pH daging ikan bandeng yang disimpan pada suhu 10 0C selama 6 jam adalah sebesar 5,60-5,78 dan 5,64-5,89 pada bagian kulitnya (Azanza et al. 2001).
2.3.3 Post rigor
Fase post rigor merupakan permulaan dari proses pembusukan yang meliputi autolisis dan pembusukan oleh bakteri. Autolisis merupakan proses terjadinya penguraian daging ikan sebagai akibat dari aktivitas enzim dalam tubuh ikan (FAO 1995). Proses autolisis ditandai dengan melemasnya daging ikan. Lembeknya daging ikan disebabkan aktivitas enzim yang semakin meningkat sehingga terjadi pemecahan daging ikan yang selanjutnya menghasilkan substansi yang baik bagi pertumbuhan bakteri (Dwiari et al. 2008).
Autolisis dimulai bersamaan dengan menurunnya pH. Mula-mula protein dipecah menjadi molekul-molekul makro yang menyebabkan peningkatan dehidrasi protein dan molekul-molekulnya pecah menjadi protease, lalu pecah menjadi pepton, polipeptida, dan akhirnya menjadi asam amino. Selain itu dihasilkan pula sejumlah kecil pirimidin dan purin basa yang dibebaskan pada waktu asam nukleat memecah. Bersamaan dengan itu, hidrolisis lemak
menghasilkan asam lemak bebas dan gliserol (Murniyati dan Sunarman 2000). Pemecahan penyusun jaringan ikan juga akan berakibat pada penurunan sifat organoleptik seperti bau, rasa, tekstur, dan kadang-kadang warna (BPTP 2009).
Pembusukan yang disebabkan oleh aktivitas bakteri tidak akan terjadi sebelum masa rigor mortis berakhir. Pada akhir fase rigor saat hasil penguraian makin banyak, kegiatan bakteri pembusuk mulai meningkat. Bila fase rigor telah lewat (badan ikan mulai melunak) maka kecepatan pembusukan akan meningkat (Moeljanto 1992). Bakteri yang semula hanya berada di insang, isi perut, dan kulit ikan mulai masuk ke otot dan memecahkan senyawa-senyawa sumber energi seperti protein, karbohidrat, dan lemak menjadi senyawa-senyawa busuk berupa indol, skatol, merkaptan, amonia, asam sulfida, dan lain-lain (BPTP 2009).
Jumlah bakteri yang terdapat pada tubuh ikan ada hubungannya dengan kondisi perairan tempat ikan tersebut hidup. Bakteri yang umum ditemukan pada ikan adalah bakteri Pseudomonas, Alcaligenes, Sarcina, Vibrio, Flavobacterium,
Serratia, dan Bacillus. Pada ikan air tawar juga terdapat jenis bakteri Aeromonas,
Lactobacillus, Bevibacterium, dan Streptococcus (Junianto 2003). Jumlah bakteri
ikan bandeng yang disimpan selama 6 jam pada suhu 12 0C adalah antara 2,30-5,78 log cfu/g (Azanza et al. 2001). Menurut Hidayati (2005) berbagai kondisi suhu dan lama penyimpanan memberikan pengaruh terhadap kandungan protein dan total koloni ikan bandeng.
Adapun kerusakan kimiawi yang sering kali terjadi adalah proses oksidasi lemak yang mengakibatkan rasa pahit dan bau tengik serta perubahan warna (BPTP 2009). Proses oksidasi lemak menghasilkan sejumlah substansi yang dapat menyebabkan timbulnya bau dan rasa tengik yang disebut proses ketengikan. Proses ini dipercepat dengan adanya logam-logam berat, enzim-enzim lipooksidase, cahaya, dan panas. Senyawa hasil pemecahan hidroperoksida merupakan produk sekunder yang sebagian besar berupa aldehid, keton, alkohol, asam karboksilat, dan alkana yang menyebabkan timbulnya diskolorisasi atau bau tengik pada ikan (FAO 1995).
2.4 Enzim
Enzim merupakan unit fungsional dari metabolisme sel. Unit ini bekerja dengan urutan yang teratur. Enzim mengkatalisis ratusan reaksi bertahap yang mengurai molekul nutrisi, reaksi yang menyimpan, dan mengubah energi kimiawi dan yang membuat makromolekul sel dari prekursor sederhana (Lehninger 1993).
Enzim bersifat sangat aktif. Pada reaksi-reaksi tertentu hanya diperlukan beberapa molekul enzim saja untuk mengkatalisis sejumlah substrat. Hal ini dimungkinkan karena protein enzim dapat direaksikan secara berulang-ulang. Kerja enzim dimulai saat molekul enzim berikatan dengan substrat, kemudian mengubahnya menjadi produk dalam waktu yang singkat. Enzim yang telah bebas dapat dipakai untuk mengikat molekul substrat lainnya (Suhartono 1989).
2.4.1 Enzim katepsin
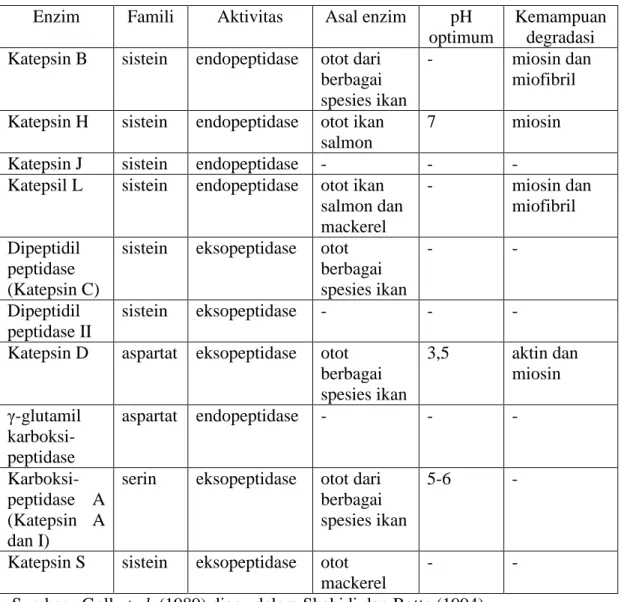
Katepsin merupakan salah satu enzim proteolitik yang ditemukan pada jaringan hewan termasuk ikan yang dapat menghidrolisis protein menjadi polipeptida. Katepsin banyak ditemukan dalam jaringan otot ikan. Pada jaringan otot ikan, katepsin dan enzim penghidrolisis lainnya ditempatkan dalam organel sub selluler atau disebut lisosom dan dibagi dalam dua tempat, yakni pada serabut otot dan matriks ekstraselluler (Shahidi dan Botta 1994). Matriks ekstraselluler terdiri dari protein fibrin, protein adesif serta gel proteoglikan. Matriks ekstraselluler berfungsi mendukung motilitas sel dan mengatur proliferasi sel (Revianti dan Parisihni 2009). Sejumlah enzim dalam lisosom mampu mengkatalisis protein jaringan. Beberapa enzim lisosom yang telah dicatat pada jaringan ikan adalah katepsin A, B, C, D, serta protein asam, netral, dan alkali (Cowey dan Walton 1988 diacu dalam Affandi dan Tang 2002). Enzim katepsin yang terdapat pada lisosom dapat dilihat pada Tabel 3.
Tabel 3. Enzim proteolitik yang berhubungan dengan lisosom otot ikan Enzim Famili Aktivitas Asal enzim pH
optimum
Kemampuan degradasi Katepsin B sistein endopeptidase otot dari
berbagai spesies ikan
- miosin dan
miofibril Katepsin H sistein endopeptidase otot ikan
salmon
7 miosin
Katepsin J sistein endopeptidase - - -
Katepsil L sistein endopeptidase otot ikan salmon dan mackerel - miosin dan miofibril Dipeptidil peptidase (Katepsin C)
sistein eksopeptidase otot berbagai spesies ikan - - Dipeptidil peptidase II sistein eksopeptidase - - -
Katepsin D aspartat eksopeptidase otot berbagai spesies ikan 3,5 aktin dan miosin γ-glutamil karboksi-peptidase aspartat endopeptidase - - - Karboksi-peptidase A (Katepsin A dan I)
serin eksopeptidase otot dari berbagai spesies ikan
5-6 -
Katepsin S sistein eksopeptidase otot mackerel
- -
Sumber : Goll et al. (1989) diacu dalam Shahidi dan Botta (1994)
2.4.2 Enzim kolagenase
Enzim kolagenase mampu mendegradasi protein dibawah kondisi fisiologis. Enzim ini berasal dari bakteri maupun dari jaringan. Enzim kolagenase dapat diproduksi oleh beberapa tipe sel yang terdapat pada periodontium, epithelium dalam, fibroblast, leukosit, makropag, dan sel tulang (Golub et al. 1976).
Kolagenase secara umum didefinisikan sebagai enzim yang mampu mendegradasi ikatan polipeptida. Enzim ini dibagi menjadi dua tipe yang berbeda berdasarkan pada fungsi fisiologisnya. Serin kolagenase terlibat dalam produksi hormon dan farmakologi. Fungsi tersebut meliputi pencernaan protein, penggumpalan darah, fibrinolisis, aktivasi kompleks, dan fertilisasi (Neurath 1984; Bond and Van Mart 1987 diacu dalam Park et al. 2002). Enzim ini
secara luas juga digunakan dalam industri kimia, industri obat, makanan, dan eksperimen biologi molekuler. Tipe kedua adalah metallokolagenase terdiri dari
zinc yang mengandung enzim yang membutuhkan kalsium untuk kestabilan
(Strieklin et al. 1977 diacu dalam Park et al. 2002). Selain itu metallokolagenase termasuk dalam enzim ekstraselluler dengan berat molekul yang bervariasi dari 30 hingga 150 kDa. Jenis enzim ini telah banyak dipelajari dari berbagai jaringan mamalia (Sellers dan Murphy 1981; Harris dan Vater 1982 diacu dalam Paark et al. 2002). Enzim kolagenase mempunyai aktivitas maksimum pada pH 7,4 sampai 8,0 (Iijima et al. 1983).
2.4.3 Peranan enzim katepsin dan kolagenase dalam kemunduran mutu ikan
Enzim proteolitik mempunyai peran dalam mengontrol berbagai proses biologis dalam tubuh (Almeida et al. 2001). Peningkatan panas yang semakin tinggi sampai batas tertentu akan meningkatkan aktivitas enzim dalam hidrolisis protein (Siswanto dan Soedarto 2008).
Proses penguraian protein terjadi akibat adanya penurunan pH jaringan otot karena terbentuknya asam laktat. Nilai pH yang rendah dengan bantuan ATP akan menyebabkan aktin dan miosin bergabung membentuk aktomiosin yang relatif mudah mengalami penguraian. Hal ini menyebabkan terjadinya peristiwa
rigor mortis (kekakuan). Selain itu proses penguraian protein ini akan
menyebabkan protein miofibril dan sarkoplasma terbongkar atau terhidrolisis menjadi peptida dan asam amino bebas yang akan mempengaruhi cita rasa dan akumulasi metabolit (Kreuzer 1965). Proses penguraian jaringan secara enzimatis (autolisis) berjalan dengan sendirinya setelah ikan mati dengan mekanisme yang kompleks. Beberapa enzim yang berperan dalam proses ini, antara lain katepsin, enzim tripsin, kemotripsin, dan pepsin (dalam organ pencernaan) serta enzim dari mikroorganisme yang ada pada tubuh ikan (Moeljanto 1992).
Katepsin berperan penting dalam proses kemunduran mutu ikan selama masa post mortem. Ketika ikan mati (fase pre rigor), maka kondisi menjadi anaerob dan ATP terurai oleh enzim yang terdapat dalam tubuh ikan dengan melepaskan energi. Proses ini kemudian diikuti dengan peristiwa glikolisis yang menguraikan glikogen menjadi asam laktat. Pembentukan asam laktat menyebabkan terjadinya penurunan pH dan jaringan otot tidak mampu
mempertahankan fleksibilitasnya (kekenyalannya). Kondisi inilah yang dikenal dengan rigor mortis. Nilai pH yang semakin menurun mengakibatkan katepsin yang terdapat dalam jaringan otot menjadi aktif (Afrianto dan Liviawaty 1989).
Pembebasan dan pengaktifan katepsin selanjutnya akan menyebabkan terjadinya penguraian protein menjadi senyawa-senyawa yang lebih sederhana.
Hal ini menimbulkan terjadinya akumulasi metabolit dan pembentukan senyawa-senyawa basa volatil yang berakibat terhadap kenaikan pH dan
peningkatan jumlah bakteri karena senyawa-senyawa basa tersebut merupakan media yang sangat cocok bagi pertumbuhan bakteri terutama golongan bakteri pembusuk (Lawrie 1985).
Peranan katepsin dalam proses kemunduran mutu ikan secara nyata terlihat dari perubahan kondisi fisik dan perubahan cita rasa ikan. Aktivitas katepsin sangat berpengaruh terhadap tekstur daging ikan karena katepsin dapat menurunkan fleksibilitas (kekenyalan) sehingga daging ikan menjadi tidak elastis dan jaringan daging ikan melunak (Haard dan Simpson 2000).
Enzim kolagenase dan beberapa subfamili metalloproteinase mampu memecah triple helical dari kolagen yang akhirnya mendegradasi kolagen yang menghasilkan hidrolisis asam amino glisin dan leusin dari rantai α molekul kolagen. Serin kolagenase dan sistein akan mendegradasi bagian lain dari kolagen yang tidak memiliki struktur helic (Saito et al. 2000).
3. METODOLOGI
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan April sampai bulan Juli 2008 di Laboratorium Karakteristik Bahan Baku Hasil Perairan, Laboratorium Biokimia Hasil Perairan, Laboratorium Mikrobiologi Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Laboratorium Terpadu Fakultas Kedoteran Hewan, dan Laboratorium Penelitian I, Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
3.2 Bahan dan Alat Penelitian
Bahan-bahan yang digunakan dalam penelitian ini terdiri dari bahan utama ikan bandeng dengan ukuran 200-250 gr/ekor. Ikan bandeng yang digunakan diberi empat perlakuan, yaitu ikan bandeng yang tidak dipuasakan sebelum dipanen dan disimpan pada suhu ruang (sampel P), ikan bandeng yang dipuasakan dan disimpan pada suhu ruang (sampel Q), ikan bandeng yang tidak dipuasakan sebelum dipanen dan disimpan pada suhu chilling (sampel R), dan ikan bandeng yang dipuasakan sebelum dipanen dan disimpan pada suhu chilling (sampel S). Bahan-bahan untuk analisis nilai pH (larutan buffer standar pH 7 dan 4, akuades), analisis TPC (larutan garam 0,85 % steril, nutrient agar), analisis TVB (H3BO3,
K2CO3, TCA 7 %, HCl 0,032 N), ekstraksi enzim katepsin (buffer tris-HCl
pH 7,4), assay aktivitas katepsin (buffer tris-HCl pH 7,4; hemoglobin, HCl 1 N, TCA 5 %, pereaksi folin, tirosin), pembuatan kolagen (kulit ikan bandeng dan asam asetat), ekstraksi enzim kolagenase (buffer tris-HCl (pH 8,0) yang terdiri dari 0,25 % Triton-X 100 dan 10 mM CaCl2), assay aktivitas kolagenase
(tris-HCl pH 7,5 yang mengandung 5 mM CaCl2, TCA 50 % ninhidrin,
50 % 1-propanol), pengukuran konsentrasi protein (bovine serum albumin,
coomassie blue G-250, etanol 95 %, asam fosfat 85 % (w/v)).
Alat-alat yang digunakan dalam penelitian ini antara lain inkubator, oven, sentrifuse suhu dingin, spektrofotometer, mikro pipet, timbangan analitik,
homogenizer, magnetic stirrer, hot plate, pipet volumetrik, bulb, pipet tetes,
bunsen, jarum ose, beaker glass, dan peralatan gelas lainnya serta peralatan uji organoleptik.
3.3 Tahapan Penelitian
Penelitian ini dilakukan dalam empat tahap, yaitu (1) penentukan fase post
mortem ikan secara organoleptik, (2) penentuan pola kemunduran mutu ikan,
(3) ekstraksi enzim katepsin, dan (4) ekstraksi enzim kolagenase (Lampiran 1).
3.3.1 Penentuan fase post mortem ikan secara organoleptik (BSN 2006)
Penelitian tahap ini bertujuan untuk mengetahui waktu terjadinya fase post
mortem ikan, meliputi pre rigor, rigor mortis, post rigor, dan busuk. Pada tahap
ini dilakukan penyimpanan pada suhu ruang (26-30 0C) dan suhu
chiling (1 0C). Penyimpanan pada suhu ruang dilakukan selama 19 jam dengan
interval waktu pengamatan satu jam, sedangkan pada suhu chilling penyimpanan dilakukan selama 540 jam (23 hari) dengan interval waktu pengamatan 12 jam. Pengamatan dilakukan secara organoleptik menggunakan scoresheet berdasarkan SNI 01-2346-2006 (Lampiran 2).
3.3.2 Penentuan pola kemunduran mutu ikan
Penentuan pola kemunduran mutu ikan bertujuan untuk mengetahui pola kemunduran ikan P, Q, R, dan S berdasarkan analisis tingkat kesegaran ikan pada setiap tahap post mortem. Pada tahap ini dilakukan pengamatan terhadap sampel ikan berdasarkan waktu yang diperoleh dari hasil penentuan fase post mortem
pada penelitian tahap 1. Analisis yang dilakukan pada setiap pengamatan meliputi uji organoleptik menggunakan score sheet berdasarkan SNI 01-2346-2006 (BSN 2006), uji nilai pH, uji TPC, dan uji TVB.
3.3.3 Ekstraksi enzim katepsin (Dinu et al. 2002)
Penelitian tahap ini bertujuan untuk memperoleh ekstrak kasar enzim katepsin yang siap digunakan dalam pengujian selanjutnya. Ekstraksi katepsin dilakukan pada sampel P, Q, R, dan S pada setiap tahap kemunduran mutu ikan. Proses ektraksi enzim katepsin dilakukan dengan metode Dinu et al. 2002 (Lampiran 3a dan 3b).
Tahap pertama dilakukan preparasi sampel untuk memperoleh ekstrak kasar protease dengan cara ikan dimatikan, kemudian bagian daging ikan diambil dengan cepat. Daging ikan disuspensikan dalam akuades dengan perbandingan daging dan akuades sebesar 1:5, lalu dihomogenisasikan pada suhu 0-4 0C. Ekstrak daging hasil homogenisasi ini disentrifuse pada 1.000 rpm selama 10 menit dan supernatan yang diperoleh kemudian disentrifuse lagi pada 10.000 rpm selama 10 menit. Pellet yang dihasilkan dari sentrifugasi ini kemudian dilarutkan dalam 0,1 M buffer tris HCl 7,4 dengan jumlah yang sama seperti jumlah akuades tadi dan disentrifuse pada 4.000 rpm selama 10 menit. Supernatan (ekstrak kasar enzim) yang diperoleh merupakan protein utama dari mitokondria dan lisosom yang siap untuk diteliti aktivitasnya lebih lanjut.
3.3.4 Ekstraksi enzim kolagenase (Moore dan Stein 1954 diacu dalam
Kim et al. 2002)
Penelitian tahap ini bertujuan untuk memperoleh ekstrak kasar enzim kolagenase yang siap digunakan dalam pengujian selanjutnya. Ekstraksi kolagenase dilakukan pada sampel P, Q, R, dan S pada setiap tahap kemunduran mutu.
Proses ekstraksi dilakukan dengan cara mencuci daging ikan bandeng dengan air dingin dan ditambahkan dengan 100 mM buffer Tris-HCl (pH 8,0) (Lampiran 4a dan 4b), dengan perbandingan bahan baku:larutan buffer 1:5, kemudian dihomogenkan dengan homogenizer. Selanjutnya daging yang telah homogen tersebut, disentrifugasi dengan kecepatan 7.000 rpm selama 20 menit. Setelah itu, pelet yang telah dihasilkan disentrifugasi kembali dengan kecepatan 7.000 rpm selama 20 menit menggunakan larutan buffer yang sama. Perbandingan antara bahan baku:larutan buffer sebesar 1:3. Selanjutnya supernatan yang
dihasilkan ditambahkan dengan 20 mM Tris-HCl (pH 8,0) yang mengandung 0,36 mM CaCl2 dan didiamkan pada suhu rendah (± 4 0C) selama 48 jam. Larutan
yang dihasilkan merupakan ekstrak kasar kolagenase yang akan digunakan untuk pengujian selanjutnya.
3.4 Analisis
Sampel daging ikan bandeng pada setiap tahap post mertem dilakukan analisis yang meliputi analisis tingkat kesegaran ikan (penilaian organoleptik, penentuan nilai pH, penghitungan jumlah total bakteri dengan metode TPC, penghitungan TVB), uji aktivitas katepsin, uji aktivitas kolagenase, dan pengukuran konsentrasi protein enzim.
3.4.1 Uji organoleptik (BSN 2006)
Metode yang digunakan untuk uji organoleptik adalah dengan score sheet
berdasarkan SNI 01-2346-2006 (BSN 2006). Pengujian organoleptik merupakan cara pengujian yang bersifat subjektif menggunakan indra yang ditujukan pada mata, insang, lendir permukaan, badan, daging, bau, dan tekstur. Pada uji organoleptik ini ada beberapa syarat yang harus disepakati oleh panelis, antara lain tertarik dan terampil serta konsisten dalam mengambil keputusan, siap sedia pada saat dibutuhkan dalam pengujian, tidak menolak contoh yang akan di uji, berbadan sehat, bebas dari penyakit THT dan tidak buta warna, serta jumlah panelis minimum untuk satu kali pengujian adalah 15 orang (semi terlatih). Dari data yang diperoleh, kemudian dilakukan analisis kesegaran ikan dengan kriteria sebagai berikut (SNI 01-2346-2006) :
Segar : nilai organoleptik berkisar antara 7-9 Agak segar : nilai organoleptik berkisar antara 5-6 Tidak segar : nilai organoleptik berkisar antara 1-3
3.4.2 Uji nilai pH (Apriyantono et al. 1989)
Pengukuran pH dilakukan dengan menggunakan pH meter dengan cara dikalibrasi terlebih dahulu. Sampel sebanyak 10 gram daging ikan dihancurkan dan dihomogenkan dengan 90 ml air destilata. Kemudian daging homogen tersebut diukur dengan pH meter yang sebelumnya telah dikalibrasi dengan buffer standar pH 4 dan 7 (Lampiran 5a).
3.4.3 Uji TPC (Fardiaz 1987)
Prinsip kerja analisis TPC adalah penghitungan jumlah bakteri yang ada di dalam sampel (daging ikan) dengan pengenceran sesuai kebutuhan dan dilakukan
secara duplo. Pembuatan larutan contoh dilakukan dengan mencampurkan 10 gram sampel yang telah dihancurkan yang diambil dari bagian punggung ikan, lalu dimasukkan ke dalam botol yang berisi 90 ml larutan garam 0,85 % steril, kemudian dikocok sampai larutan homogen. Campuran larutan contoh tersebut diambil 1 ml dan dimasukkan ke dalam botol berisi 9 ml larutan garam 0,85 % steril sehingga diperoleh contoh dengan pengenceran 10-2, setelah itu dikocok agar homogen. Banyaknya pengenceran dilakukan sesuai dengan keperluan penelitian, biasanya sampai pengenceran 10-5. Pemipetan dilakukan dari masing-masing tabung pengenceran sebanyak 1 ml larutan contoh dan dipindahkan ke dalam cawan petri steril secara duplo menggunakan pipet steril. Media agar dimasukkan ke dalam cawan petri sebanyak 10 ml dan digoyangkan sampai permukaan agar merata (metode tuang), kemudian didiamkan beberapa saat hingga dingin dan mengeras. Cawan petri yang telah berisi agar dan larutan contoh dimasukkan ke dalam inkubator pada suhu 30 0C selama 48 jam dengan posisi cawan petri yang dibalik. Selanjutnya dilakukan pengamatan dengan menghitung jumlah koloni yang ada di dalam cawan petri tersebut. Jumlah koloni bakteri yang dihitung adalah cawan petri yang mempunyai koloni bakteri antara 30-300 koloni (Lampiran 5b).
3.4.4 Uji TVB (Apriyantono et al. 1989)
Penetapan ini bertujuan untuk menentukan jumlah kandungan senyawa-senyawa basa volatil yang terbentuk akibat degradasi protein. Prinsip dari analisis TVB adalah menguapkan senyawa-senyawa basa volatil (amin, mono-, di-, dan trimetilamin). Senyawa tersebut kemudian diikat oleh asam borat dan kemudian dititrasi dengan larutan HCl.
Preparasi sampel dilakukan dengan cara menimbang 15 gram sampel yang diambil dari daging ikan, kemudian ditambahkan 45 ml TCA 7 % dan dihomogenkan selama satu menit. Hasil homogenisasi kemudian disaring sehingga diperoleh filtrat yang berwarna jernih. Setelah penyiapan sampel maka dilakukan uji TVB dengan cara memasukkan 1 ml H3BO3 ke dalam inner
chamber cawan conway dan tutup cawan diletakkan dengan posisi hampir
menutupi cawan. Dengan memakai pipet 1 ml yang lain, filtrat dimasukkan ke dalam outer chamber disebelah kiri. Kemudian 1 ml larutan K2CO3 jenuh
ditambahkan ke dalam outer chamber sebelah kanan sehingga filtrat dan K2CO3
tidak tercampur. Cawan segera ditutup dengan diolesi vaselin pada pinggir cawan agar proses penutupan sempurna, lalu digerakkan memutar sehingga kedua cairan
di outer chamber tercampur. Disamping itu dikerjakan blanko dengan prosedur
yang sama tetapi filtrat diganti dengan TCA 7 %. Kemudian kedua cawan conway tersebut diinkubasi selam 24 jam pada suhu 37 0C. Setelah diinkubasi, larutan asam borat dalam inner chamber cawan conway yang berisi blanko dititrasi dengan larutan HCl 0,032 N dan cawan digoyang-goyangkan sampai larutan asam borat berubah warna menjadi merah muda. Selanjutnya cawan conway yang berisi sampel juga dititrasi dengan larutan HCl 0,032 N yang sama dengan blanko (Lampiran 5c). Kadar TVB dapat dihitung dengan rumus :
%N (mg N/100g) = (j – i) x N HCl x 100 x fp x 14 mg N/100 g g contoh 1
Keterangan :
j : ml titrasi sampel fp : faktor pengenceran i : ml titrasi blanko N : normalitas HCl (0,032 N)
3.4.5 Aktivitas enzim katepsin (Dinu et al. 2002)
Aktivitas proteolitik dari katepsin diuji menggunakan hemoglobin terdenaturasi asam sebagai substratnya (Lampiran 6a dan 6b). Sebanyak 8 % hemoglobin dilarutkan dalam akuades dengan perbandingan 1:3. Kemudian pH dibuat menjadi 2,0 dengan HCl 1 N dan konsentrasi akhir hemoglobin dibuat sebesar 2 % dengan akuades. Selanjutnya 1 ml dari larutan substrat diinkubasi dengan 0,2 ml TCA 5 %. Campuran disaring dan hasil reaksi yang dapat larut ditambah dengan 1 ml pereaksi folin serta diukur absorbansinya pada 750 nm. Selain itu dilakukan pula pengukuran untuk larutan blanko dan larutan standar dengan prosedur yang sama seperti larutan sampel, hanya untuk larutan blanko dan larutan standar enzimnya digantikan dengan akuades dan tirosin. Aktivitas enzim katepsin dapat dihitung dengan rumus berikut :
T xPx Abl Ast Abl Asp UA 1
Dimana : UA : Jumlah enzim yang menyebabkan perubahan 1 μmol substrat per menit
Asp : Nilai absorbansi sampel Abl : Nilai absorbansi blanko Ast : Nilai absorbansi standar P : Faktor pengenceran (5) T : Waktu inkubasi (10 menit)
3.4.6 Aktivitas enzim Kolagenase (Moore dan Stein 1954 diacu dalam
Park et al. 2002)
Aktivitas enzim kolagenase dapat diukur dengan metode Moore dan Stein (1954) yang telah dimodifikasi dengan cara mereaksikan 5 ml kolagen dengan 1 ml 0,05 M Tris-HCl (pH 7,5) yang mengandung 5 mM CaCl2 dan 0,1 ml larutan
enzim diinkubasi pada suhu 37 0C selama 1 jam (Lampiran 6c dan 6d). Reaksi dihentikan dengan penambahan 0,2 ml 50 % TCA. Setelah 10 menit pada suhu ruang, disaring dengan kertas saring. Supernatan (0,2 ml) dicampur dengan 1,0 ml larutan ninhidrin dan diinkubasi pada suhu 100 0C selama 20 menit. Kemudian didinginkan pada suhu kamar. Campuran tersebut diencerkan dengan 5 ml 50 % 1-propanol untuk pengukuran absorbansi dengan panjang gelombang 570 nm. Larutan buffer (0,05 M Tris-HCl pH 7,5) yang mengandung 5 mM CaCl2
digunakan sebagai pengganti larutan enzim sebagai larutan kontrol dan larutan tirosin digunakan sebagai larutan standar enzim kolagenase. Aktivitas enzim kolagenase dapat dihitung dengan rumus sebagai berikut :
T xPx Abl Ast Abl Asp UA 1
Dimana : UA = Jumlah enzim yang menyebabkan perubahan 1 μmol substrat per menit
Asp = Nilai absorbansi sampel Abl = Nilai absorbansi blanko Ast = Nilai absorbansi standar P = Faktor pengencer (5) T = Waktu inkubasi (10 menit)
3.4.7 Pengukuran Konsentrasi Protein Enzim (Bradford 1976)
Konsentrasi protein ditentukan menggunakan metode Bradford dengan
bovine serum albumin sebagai standar. Persiapan pereaksi Bradford dilakukan
dengan cara melarutkan 25 mg coomasie brilliant blue G-250 dalam 12,5 ml etanol 95 %. Lalu ditambahkan dengan 25 ml asam fosfat 85 % (w/v). Jika telah larut dengan sempurna, maka ditambahkan akuades hingga 0,5 liter dan disaring dengan kertas saring Whatman 1 sesaat sebelum digunakan.
Konsentrasi protein ditentukan menggunakan metode Bradford dengan cara 0,1 ml enzim dimasukkan ke dalam tabung reaksi. Kemudian ditambahkan sebanyak 5 ml pereaksi Bradford, diinkubasi selama 5 menit dan diukur dengan spektrofotometer pada panjang gelombang 595 nm. Demikian pula untuk larutan standar dilakukan seperti larutan sampel dengan konsentrasi antara 1,0-1,0 mg/ml dari larutan stok BSA konsentrasi 2 mg/ml yang disajikan pada Tabel 4.
Tabel 4. Pembuatan larutan standar BSA konsentrasi 0,1-1,0 mg/ml Konsentrasi BSA (mg/ml) Volume BSA (ml) Volume akuades (ml) 0,1 0,05 0,95 0,2 O,10 0,90 0,3 0,15 0,85 0,4 0,20 0,80 0,5 0,25 0,75 0,6 0,30 0,70 0,7 0,35 0,65 0,8 0,40 0,60 0,9 0,45 0,55 1,0 0,50 0,50
Nilai absorbansi yang didapat kemudian dimasukkan ke dalam kurva standar bradford (Lampiran 6e dan 6f) untuk menentukan konsentrasi protein yang terkandung dalam sampel enzim.
3.5 Analisis Data
Hasil yang diperoleh dari pengamatan serta pengukuran terhadap nilai organoleptik, pH, TPC, TVB, aktivitas enzim katepsin dan kolagenase, serta konsentrasi protein enzim dicari nilai rata-ratanya. Nilai rata-rata tersebut dihitung menggunakan rumus berikut (Steel dan Torrie 1989) :
Keterangan :
X = Nilai rata-rata
n = Jumlah data
Xi = Nilai X ke-i
Analisis terhadap hubungan tingkat kesegaran ikan (TPC, TVB, dan nilai pH), nilai aktivitas enzim serta konsentrasi protein enzim dilakukan melalui uji ragam (ANOVA) berupa rancangan acak kelompok dengan 4 perlakuan (sampel P, Q, R dan S) dan 4 kelompok (pre rigor, rigor mortis, post rigor, dan busuk). Persamaan umum model rancangan tersebut sebagai berikut:
Yij = µ + τi + βj + εij
Keterangan:
Yij = nilai pengamatan pada perlakuan ke-i kelompok ke-j
µ = nilai tengah populasi
τi = pengaruh perlakuan τ taraf ke-i
βj = pengaruh kelompok β taraf ke-j
εij = galat percobaan pada perlakuan ke-i kelompok ke-j
Hipotesis yang digunakan adalah : 1. Hipotesis perlakuan
a. H0 : pengaruh perlakuan tidak berbeda nyata
b. H1 : minimal ada 1 perlakuan yang memberikan pengaruh berbeda nyata 2. Hipotesis kelompok
a. H0 : pengaruh kelompok tidak berbeda nyata
b. H1 : minimal ada 1 kelompok yang memberikan pengaruh berbeda nyata Apabila pengaruh perlakuan dan kelompok berbeda nyata dengan selang
kepercayaan 95 % (P<0,05), maka diadakan uji lanjut Duncan
(Steel dan Torrie 1989).
Derajat hubungan linier antara aktivitas enzim (katepsin dan kolagenase) terhadap parameter kesegaran mutu (nilai organoleptik, pH, TPC, TVB) dilihat
menggunakan koefisien korelasi linier sederhana dengan rumus (Snedecor dan Cochran 1967) :
n Xi X n i 1 n Xi X n i1
Keterangan:
x = simpangan dari rataan peubah pertama (yang mempengaruhi) y = simpangan dari rataan peubah kedua (yang dipengaruhi)
Nilai derajat korelasinya adalah: r ≥ 0,7 : hubungan sangat erat 0,5<r <0,7 : hubungan erat
r ≤ 0,5 : hubungan tidak erat
2 2 y x xy r
4. HASIL DAN PEMBAHASAN
4.1 Penentuan Fase Post Mortem Ikan
Penentuan fase post mortem ikan dilakukan untuk mengetahui dan mengenali kondisi tingkat kesegaran ikan pada beberapa fase post mortem melalui metode penilaian sensori, yaitu secara organoleptik sehingga dapat diketahui kondisi kesegaran ikan setelah ikan dimatikan. Metode organoleptik merupakan cara yang paling murah dan mudah untuk mengetahui tingkat kemunduran mutu ikan dengan bantuan panca indera manusia. Penetapan kemunduran mutu ikan secara organoleptik ini dilakukan menggunakan score sheet yang telah ditetapkan oleh Badan Standardisasi Nasional dengan SNI 01-2346-2006 (BSN 2006). Pengamatan secara organoleptik ini meliputi beberapa parameter, seperti keadaan mata, insang, lendir permukaan badan, daging, bau, dan tekstur.
Pengamatan terhadap kondisi post mortem ikan bandeng P (tidak dipuasakan, suhu ruang), Q (dipuasakan, suhu ruang), R (tidak dipuasakan, suhu
chilling), dan S (dipuasakan, suhu chilling) menghasilkan empat titik untuk
dilakukan analisis pola kemunduran mutu ikan. Pada ikan P dan Q kondisi pre
rigor (sesaat setelah ikan dimatikan) terjadi pada 0 jam penyimpanan, rigor mortis
pada jam ke-10 penyimpanan, post rigor pada jam ke-15 penyimpanan, dan fase busuk terjadi pada jam ke-19 penyimpanan. Pada ikan bandeng R dan S kondisi
pre rigor (sesaat setelah ikan dimatikan) terjadi pada 0 jam penyimpanan, rigor
mortis pada jam ke-84 penyimpanan, post rigor pada jam ke-300 penyimpanan,
dan fase busuk terjadi pada jam ke-540 penyimpanan.
Perubahan pre rigor merupakan peristiwa terlepasnya lendir dari kelenjar di bawah permukaan kulit. Lendir-lendir yang terlepas tersebut membentuk lapisan bening yang tebal disekeliling tubuh ikan. Pelepasan lendir dari kelenjar lendir ini merupakan reaksi alami ikan yang sedang sekarat terhadap keadaan yang tidak menyenangkan. Jumlah lendir yang terlepas dan menyelimuti tubuh
dapat banyak hingga mencapai 1-2,5 % dari berat tubuhnya (Murniyati dan Sunarman 2000). Pada penelitian ini ikan bandeng P dan Q
mengalami fase pre rigor sekitar 10 jam yang dapat dilihat dari rentang waktu antara fase pre rigor dan rigor mortis. Ikan bandeng R dan S mengalami fase
pre rigor sekitar 84 jam yang dapat dilihat dari rentang waktu antara fase
pre rigor dan rigor mortis.
Rigor mortis terjadi pada saat siklus kontraksi-relaksasi antara miosin dan
aktin didalam miofibril terhenti dan terbentuknya aktomiosin yang permanen (Eskin 1990). Pada penelitian ini ikan bandeng P dan Q mengalami fase rigor
mortis sekitar 5 jam yang dapat dilihat dari rentang waktu antara fase rigor mortis
dan post rigor. Pada ikan bandeng R dan S mengalami fase rigor mortis sekitar
216 jam (9 hari) yang dapat dilihat dari rentang waktu antara fase rigor mortis
dan post rigor. Menurut Dwiari et al. (2008) fase ini ditandai oleh mengejangnya
tubuh ikan setelah mati. Kekejangan ini disebabkan karena alat alat yang terdapat dalam tubuh ikan berkontraksi akibat adanya reaksi kimia yang dipengaruhi atau dikendalikan oleh enzim.
Fase post rigor terjadi setelah terjadinya fase rigor mortis. Fase ini ditandai dengan melemasnya daging ikan kembali. Lembeknya daging ikan disebabkan aktivitas enzim yang semakin meningkat sehingga terjadi pemecahan daging ikan yang selanjutnya menghasilkan substansi yang baik bagi pertumbuhan bakteri (Dwiari et al. 2008). Pada umumnya proses ini berlangsung singkat karena bakteri segera berkembang dan hanya dapat ditunda dengan menurunkan suhu. Pada tahap ini peran bakteri dalam kerusakan ikan mulai tampak menonjol setelah dihasilkan senyawa-senyawa sederhana hasil autolisis yang berfungsi sebagai media pertumbuhannya. Pertumbuhan bakteri yang luar biasa cepat ini menyebabkan proses kerusakan ikan juga berlangsung semakin cepat. Insang akan menjadi kecoklatan, lendir semakin kental dan tebal, daging lembek, dan jika ditekan sulit pulih kembali bekasnya, bau semakin amis, dan menjadi busuk (Yunizal dan Wibowo 1998).
4.2 Kemunduran Mutu Ikan
Penentuan pola kemunduran mutu ikan bertujuan untuk mengetahui pola dan perbedaan pola kemunduran mutu antara ikan P, Q, R, dan S berdasarkan analisis tingkat kesegaran ikan pada setiap tahap post mortem. Pengamatan terhadap sampel ikan P, Q, R, dan S dilakukan berdasarkan waktu yang diperoleh dari hasil penentuan fase post mortem secara subjektif, yaitu uji organoleptik dan secara objektif, yaitu uji pH, TPC, dan TVB dengan mengambil sampel dari
W a k tu P e n y im p a n a n S u h u R u a n g ( J a m ) 0 5 1 0 1 5 2 0 R at a-ra ta N ila i O rg an ol ep tik D ag in g Ik an B an de ng 0 2 4 6 8 1 0 W a k tu P e n y im p a n a n S u h u C h illin g ( J a m ) 0 1 0 0 2 0 0 3 0 0 4 0 0 5 0 0 6 0 0 P ( T id a k D ip u a s a k a n , P e n y im p a n a n S u h u R u a n g ) Q ( D ip u a s a k a n , P e n y im p a n a n S u h u R u a n g ) R ( T id a k D ip u a s a k a n , P e n y im p a n a n S u h u C h illin g ) S ( D ip u a s a k a n , P e n y im p a n a n S u h u C h illin g )
bagian daging ikan bandeng. Pengujian secara objektif pada sampel P, Q, R, dan S dilakukan pada 4 titik, yaitu pada fase pre rigor, rigor mortis, post rigor dan busuk.
4.2.1 Nilai organoleptik
Penilaian mutu secara organoleptik merupakan cara pengujian mutu yang dilakukan hanya mempergunakan panca indera. Cara ini sangat sederhana dan cepat dikerjakan, tetapi tingkat ketelitiannya tergantung dari kepekaan penguji (Dwiari et al. 2008).
Rata-rata nilai organoleptik ikan bandeng utuh P, Q, R, dan S disajikan pada Gambar 3.
Gambar 3. Rata-rata nilai organoleptik ikan bandeng utuh P, Q, R, dan S Berdasarkan Gambar 3 dapat dilihat bahwa nilai organoleptik ikan bandeng P, Q, R, dan S menunjukkan nilai organoleptik yang semakin menurun dengan semakin lamanya waktu penyimpanan. Pada umumnya semakin tinggi nilai organoleptik menunjukkan semakin segar keadaan ikannya. Pada fase rigor
mortis ikan bandeng R memiliki nilai organoleptik yang lebih rendah
dibandingkan dengan ikan bandeng S. Menurut Ridwansyah (2002) kemunduran mutu ikan dapat dipengaruhi oleh kondisi lapar/kenyang. Secara umum dapat
dikatakan bahwa antara ikan P, Q, R dan S tidak menunjukkan nilai organoleptik yang mencolok. Perbedaan yang sangat terlihat adalah pada kecepatan proses kemunduran mutu ikan dimana dari fase pre rigor hingga busuk ikan yang disimpan pada suhu ruang (ikan P dan Q) lebih cepat mengalami kemunduran mutu daripada ikan yang disimpan pada suhu chilling. Penyimpanan ikan pada suhu chilling merupakan salah satu cara untuk mengurangi laju kemunduran mutu ikan karena dapat menghambat pertumbuhan bakteri dan aktivitas enzim (Clucas dan Sutcliffe 1981).
Pada kondisi pre rigor baik ikan bandeng P, Q, R, dan S menunjukkan nilai organoleptik 9. Hal ini menggambarkan bahwa ikan bandeng dalam kondisi sangat segar. Ikan yang masih segar berarti belum mengalami perubahan-perubahan biokimiawi, mikrobiologi, maupun fisikawi yang dapat menyebabkan kerusakan berat pada daging ikan (Irawan 1995). Ikan bandeng segar ini mempunyai ciri-ciri mata yang cerah, bola mata menonjol, kornea jernih, insang merah cemerlang, tanpa lendir atau lapisan lendir jernih, transparan, mengkilat cerah, serta belum ada perubahan warna. Sayatan dagingnya sangat cemerlang, spesifik jenis, tidak ada perubahan sepanjang tulang belakang, dan memiliki dinding perut daging utuh. Bau ikan sangat segar sesuai dengan jenis. Teksturnya padat, elastis bila ditekan dengan jari, serta sulit menyobek daging dari tulang belakang.
Pada fase rigor mortis ikan bandeng memiliki nilai organoleptik sekitar 6-8 dengan ciri-ciri mata agak cerah, bola mata rata, pupil agak keabu-abuan, kornea agak keruh. Insangnya berwarna merah agak kusam tanpa lendir. Lapisan lendir mulai agak keruh, warna agak putih, kurang transparan. Sayatan daging sedikit kurang cemerlang, spesifik jenis, tidak ada pemerahan sepanjang tulang belakang, dinding perut daging utuh, dan baunya netral. Tekstur agak padat, agak elastis bila ditekan dengan jari, serta sulit menyobek daging dari tulang belakang.
Fase post rigor ikan bandeng dengan nilai organoleptik sekitar 6-5. Nilai organoleptik 6-5 ini merupakan ambang batas antara kondisi ikan baik dan jelek. Adapun ciri-cirinya adalah bola mata agak cekung, pupil berubah keabu-abuan, kornea agak keruh. Mulai adanya perubahan warna, merah kecoklatan, sedikit lendir. Lapisan lendir mulai keruh, warna putih agak kusam, kurang transparan.