BAB 2
TINJAUAN PUSTAKA
2.1 Tumbuhan Akalifa (Acalypha wilkesiana Muell. Arc.)
Pada umumnya tumbuhan akalifa ditemukan di seluruh dunia terutama daerah tropis dari Afrika, Amerika dan Asia. Berikut merupakan morfologi tumbuhan akalifa :
a. Mempunyai akar tunggang.
b. Batang berkayu, berbentuk silindris, tegak, berwarna cokelat, permukaannya halus dan memiliki ranting berambut.
c. Daun tunggal, bertangkai pendek, tersusun berseling, memiliki warna beragam (cokelat, merah, putih, ungu, hijau,dsb), berbentuk jantung atau lonjong, memiliki panjang 5-15 cm, lebar 2-12 cm, helaian daun tipis, ujung runcing, pangkal berlekuk, tepi bergerigi atau rata, pertulangan menyirip, permukaan atas dan bawah halus.
d. Bunga majemuk, berbentuk bulir, berwarna ungu, mahkota berwarna putih terkadang warna ungu, kelopak bunga berbentuk mangkuk.
e. Buah berbentuk kotak, warna merah (www.plantamor.com).
Sistematika tumbuhan akalifa yaitu :
Kingdom : Plantae
Divisi : Spermatophyta
Class : Dicotyledoneae
Ordo : Euphorbiales
Famili : Euphorbiaceae
Genus : Acalypha
2.2 Klasifikasi Senyawa Bahan Alam
Pada hakekatnya kimia bahan alam merupakan pengetahuan yang telah dikenal sejak peradaban manusia tumbuh. Sebagian besar bahkan hampir semua, kandungan senyawa kimia bahan alam adalah senyawa organik, dan sumber utama senyawa karbon atau senyawa organik ini adalah glukosa yang dibentuk melalui fotosintesis di dalam tumbuhan autotropik atau diperoleh dari organisme heterotrof. Seiring dengan kemajuan ilmu pengetahuan maka perkembangan kimia bahan alam tidak dapat lagi diragukan hingga sekarang. Berbagai cara analisis preparatif atau pemisahan telah ditemukan dan dikembangkan seperti metoda kromatografi yang meliputi: kolom kromatografi, kromatografi kertas, kromatografi lapis tipis, kromatografi gas, kromatografi cair bertekanan tinggi, elektroforesis, pertukaran ion, dan sebagainya. Metoda-metoda tersebut memungkinkan untuk mengisolasi senyawa-senyawa yang jumlahnya sangat kecil (Sastrohamidjojo, 1996).
Dengan meningkatnya jenis dan tipe senyawa yang ditemukan di dalam berbagai bahan alam, berkembang juga sistem klasifikasi senyawa yang berasal dari bahan alam, tetapi biasanya ada 4 jenis klasifikasi yang digunakan untuk membahasnya (Nakanishi et al, 1974).
1. Klasifikasi Berdasarkan Struktur Kimia
Klasifikasi ini adalah klasifikasi formal berdasarkan kerangka struktur molekul, yaitu:
a. Senyawa lemak rantai terbuka atau alifatik, seperti asam-asam lemak, gula-gula, dan hampir semua asam amino
b. Senyawa sikloalifatik atau alisiklik, seperti terpenoid, steroid, dan beberapa alkaloid
c. Senyawa benzenoid atau aromatik, seperti fenol dan kuinon.
2. Klasifikasi Berdasarkan Aktivitas Fisiologi
Biasanya pengembangan bahan alam didahului dengan pengamatan dan pengalaman empirik khasiat bahan alam tersebut untuk menyembuhkan penyakit tertentu. Oleh karena itu, salah satu cara penyelidikan bahan obat dari tumbuhan atau bahan alam lainnya adalah melalui ekstraksi dan penetapan khasiat farmakologi ekstrak, diikuti dengan isolasi komponen murni.
Suatu klasifikasi yang menggunakan landasan aktivitas fisiologi banyak digunakan, misalnya hormon, vitamin, antiobiotik, dan mikotoksin. Walaupun senyawa yang termasuk dalam golongan itu memiliki berbagai struktur dan asal-usul biosintetik, aspek dan aktivitas yang dimilikinya sama.
3. Klasifikasi Berdasarkan Taksonomi
Klasifikasi ini didasarkan pada pengkajian morfologi komparatif atau taksonomi tumbuhan. Di dalam hewan dan sebagian mikroorganisme metabolit akhir biasanya diekskresikan ke luar tubuh, sedangkan di dalam tumbuhan, metabolit tersebut disimpan di dalam tubuh tumbuhan. Walaupun beberapa metabolit selama ini diketahui spesifik pada tumbuhan tertentu, tetapi sekarang telah diketahui tersebar di dalam berbagai tumbuhan, misalnya alkaloid dan isoprenoid telah dapat diisolasi dari berbagai genus, spesies, suku, atau ordo. Bahkan di dalam satu spesies terdapat sejumlah komponen yang memiliki struktur dasar yang berkaitan.
Pengetahuan tentang kandungan komponen tumbuhan berkembang dengan sangat pesat karena berkembangnya metode ekstraksi, isolasi dan karakterisasinya. Hal ini mendorong berkembangnya suatu bidang baru yang disebut kemotaksonomi (chemotaxonomy) atau sistematik kimia (chemosystematic) yang mengarah ke pembagian kandungan tumbuhan berdasarkan taksa tumbuhan. Dengan kata lain, isi kandungan tumbuhan dianggap sebagai tanda bagi evolusi dan klasifikasi tumbuhan.
4. Klasifikasi Berdasarkan Biogenesis
pembentukan yang masih dalam taraf hipotesis, sedangkan jika reaksi tersebut telah dibuktikan secara eksperimen, digunakan istilah biosintesis.
Berbagai teori tentang pembentukan senyawa metabolit primer dan metabolit sekunder telah dikemukakan di dalam berbagai publikasi. Diawali dengan teori aturan isoprena pada tahun 1930, yang menyatakan bahwa semua terpenoid dibentuk dari unit isoprena 5-C, dilanjutkan dengan teori poliketometilena untuk senyawa fenolik, yang merupakan saran pertama bagi biosintesis asetogenin (poliketida). Komponen pembangun utama untuk atom-atom karbon dan nitrogen di dalam semua senyawa bahan alam berasal dari 5 kelompok prekursor, yaitu: (Wiryowidagdo, 2008).
a. asetil ko-A → unit 2C (MeCO-) → poliketida (asetogenin) malonil ko-A
b. asam sikimat → unit 6C-3C (6C-1C atau 6C-2C) → senyawa fenolik c. asam mevalonat → unit prenil → isoprenoid
d. unit asam amino seperti fenilanalina, tirosina, ornitina, lisina, dan triptofan → alkaloid
e. 5-5’-deoksiadenilmetionina → unit 1C
2.3 Metabolit Sekunder
Penggolongan Metabolit Sekuder
Banyak senyawa kimia tanaman yang telah diisolasi dan dipublikasikan sebelum diketahui strukturnya. Pengelompokan senyawa kimia tananam berdasarkan sifat khas yang dimiliknya (antara lain warna, rasa, bau, pH, kelarutan), merupakan hal penting sehingga sampai sekarang masih banyak dipakai. Berikut contoh pengelompokkan senyawa kimia seperti tersebut diatas.
1. Minyak Atsiri. Baunya khas dan dapat dipisahkan dari senyawa kimia tanaman lainnya, karena sukar larut dalam air dan dapat menguap bersama uap air.
2. Alkaloid. Senyawa yang bersifat basa dapat dipisahkan dari yang netral dan asam. Penyebab sifat basa sangat erat kaitannya dengan kerja farmakologi pada tubuh binatang dan manusia.
3. Zat Pahit. Berpedoman pada rasa pahit adalah suatu metode yang mudah untuk memisahkan senyawa kimia tanaman, perlu waktu yang cukup sehingga seluruh zat pahit dalam sari menjadi zat yang dapat dikristalkan.
4. Zat warna. Jumlah zat warna dari tanaman diperkirakan ± 2000 jenis. Pigmen tanaman mempunyai struktur kimia yang berlainan, begitu juga sifat fisika, kelarutan, warna, fuoresensi, dan sebagainya
5. Tannin. Ditandai oleh sifatnya yang dapat mengendapkan protein dari larutan dengan membentuk senyawa yang tidak larut.
6. Glikosida. Pada umumnya sari tanaman mengandung senyawa bersifat alkohol atau fenol yang dapat larut dalam air, tetapi gugus hidroksi dari alkohol atau fenol tidak bebas yang terikat pada satu atau lebih gula. Namun setelah dihidrolisis akan memisahkan bagian bukan gula dan bagian gula yang dimasukkan ke dalam golongan glikosida (Sirait, 2007).
2.4 Senyawa Flavonoida
bentuk yang mempunyai cincin C dengan tingkat oksidasi yang paling rendah dan dianggap sebagai struktur induk dalam nomenklatur kelompok senyawa ini (Manitto, 1992).
Sistem penomoran untuk turunan senyawa flavonoid diberikan di bawah : (Robinson, 1995).
Flavonoida umumnya terdapat pada tumbuhan sebagai glikosida. Gugus gula bersenyawa pada satu atau lebih grup hidroksil fenolik. Gugus hidroksil selalu terdapat pada karbon nomor 5 dan nomor 7 pada cincin A. Pada cincin B gugus hidroksil terdapat pada karbon nomor 3 dan nomor 4 ( Sirait, 2007).
Menurut perkiraan, kira-kira 2% dari seluruh karbon yang difotosintesis oleh tumbuh-tumbuhan ( atau kira-kira 1 x 109 ton/tahun ) diubah menjadi flavonoida atau senyawa yang berkaitan erat dengannya. Sebagian besar tannin pun berasal dari flavonoida. Jadi flavonoida merupakan salah satu golongan fenol alam yang terbesar (Markham, 1988).
Senyawa flavonoid berperan dalam memberikan banyak warna lain di alam, terutama daun mahkota kuning dan jingga, bahkan flavonoid yang tidak berwarna mangabsorbsi cahaya pada spektrum UV (karena banyak gugus kromofor) dan dapat dilihat oleh banyak serangga. Senyawa ini diduga memiliki manfaat ekologi yang besar di alam berkat warnanya sebagai penarik serangga dan burung untuk membantu penyerbukan tanaman. Flavonoid tertentu juga mempengaruhi rasa makanan secara signifikan, misalnya beberapa tanaman memiliki rasa pahit dan kesat seperti glikosida flavanon naringin.
penyakit yang diketahui bertambah parah oleh adanya radikal bebas seperti superoksida dan hidroksil, dan flavonoid memiliki kemampuan untuk menghilangkan dan secara efektif ‘menyapu’ spesies pengoksidasi yang merusak itu. Oleh karena itu, makanan kaya flavonoid dianggap penting untuk mengobati penyakit-penyakit, seperti kanker dan penyakit jantung (yang dapat memburuk akibat oksidasi lipoprotein densitas-rendah) (Heinrich et al, 2009).
2.4.1 Biosintesis Flavonoid
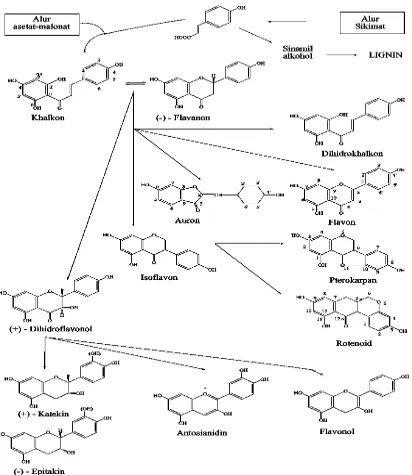
Senyawa flavonoida adalah senyawa-senyawa polifenol yang mempunyai 15 atom karbon, terdiri dari dua cincin benzena yang dihubungkan menjadi satu oleh rantai linear yang terdiri dari tiga atom karbon. Kerangka ini dapat ditullis sebagai C6-C3-C6.
Jadi senyawa flavonoida adalah senyawa 1,3 diarilpropana, senyawa isoflavonoida adalah senyawa 1,2 diarilpropana, sedang senyawa-senyawa neoflavonoida adalah senyawa 1,1 diarilpropana. Senyawa flavonoida diturunkan dari unit C6-C3 (fenil
propana) yang bersumber dari asam sikimat (via fenilalanin) dan unit C6 yang
diturunkan dari jalur poliketida. Fragmen poliketida ini disusun dari tiga molekul malonil-KoA yang bergabung dengan unit C6-C3 (sebagai KoA tioester) untuk
membentuk unit awal triketida. Oleh karena itu, flavonoid yang berasal dari biosintesis gabungan terdiri atas unit-unit yang diturunkan dari asam sikimat dan jalur poliketida (Heinrich et al 2009).
(Markham, 1988) Gambar 2.1 Biosintesa hubungan antara jenis monomer flavonoida dari alur
asetat-malonat dan alur sikimat
2.4.2 Klasifikasi Senyawa Flavonoida
1. Flavonoid O-glikosida
Flavonoid biasanya terdapat sebagai flavonoid O-glikosida, pada senyawa tersebut satu gugus hidroksi flavonoid (atau lebih) terikat pada satu gula (atau lebih) dengan ikatan hemiasetal yang tak tahan asam. Pengaruh glikosilasi meyebabkan flavonoid menjadi kurang reaktif dan lebih mudah larut dalam air (cairan). Glukosa merupakan gula yang paling umum terlibat, walaupun galaktosa, ramnosa, xilosa, dan arabinosa sering juga terdapat. Gula lain yang ditemukan adalah alosa, manosa, fruktosa, apiosa dan asam glukuronat serta galakturonat.
2. Flavonoid C-glikosida
Gula dapat juga terikat pada atom karbon flavonoid dan dalam hal ini gula tersebut terikat langsung pada inti benzena dengan suatu ikatan karbon-karbon. Glikosida yang demikian disebut C-glikosida. Gula yang terikat pada atom C hanya ditemukan pada atom C nomor 6 dan 8 dalam inti flavonoid yang disebabkan karena adanya pengisomeran ketika hidrolisis asam. Jenis gula yang terlibat ternyata jauh lebih sedikit ketimbang jenis gula pada O-glikosida. Jenis aglikon flavonoid yang terlibat pun sangat terbatas. Jadi, walau pun isoflavon, flavanon, dan flavonol kadang-kadang terdapat dalam bentuk C-glikosida, hanya flavon C-glikosida yang paling lazim ditemukan.
3. Flavonoid Sulfat
Gabungan flavonoid lain yang mudah larut dalam air yang mungkin ditemukan hanya flavonoid sulfat. Senyawa ini mengandung satu ion sulfat atau lebih, yang terikat pada hidroksil fenol atau gula. Senyawa ini dikatakan bisulfat karena terdapat sebagai garam, yaitu flavon-O-SO3K.
4. Biflavonoid
kadang-kadang ikatan eter. Monomer flavonoid yang digabungkan menjadi biflavonoid dapat berjenis sama atau berbeda, dan letak ikatannya berbeda. Biflavonoid jarang ditemukan sebagai glikosida, dan penyebarannya terbatas, terdapat terutama pada gimnospermae.
5. Aglikon flavonoid yang aktif-optik
Aglikon flavonoid mempunyai atom karbon asimetrik dan dengan demikian menunjukkan keaktifan optik (yaitu memutar cahaya terpolarisasi-datar). Yang termasuk dalam golongan flavonid ini ialah flavanon, dihidroflavonol, katekin, pterokarpan, rotenoid, dan beberapa biflavonoid (Markham, 1988).
Flavonoida mengandung sistem aromatik yang terkonjugasi sehingga menunjukkan pita serapan kuat pada daerah spektrum sinar ultraviolet dan spektrum sinar tampak, umumnya dalam tumbuhan terikat pada gula yang disebut dengan glikosida (Harborne, 1996).
Flavonoid dapat dikelompokkan berdasarkan tahanan oksidasi dan keragaman lain pada rantai C3 :
1. Flavon
O
O A C
B
2. Flavonol
O
O OH A C
B
Flavonol paling sering terdapat sebagai glikosida, biasanya 3-glikosida dan terdapat dalam berbagai bentuk terhidroksilasi. Larutan flavonol dalam suasana basa (tetapi flavon tidak) dioksidasi oleh udara tetapi tidak begitu cepat sehingga pengunaan basa pada pengerjaannya masih dapat dilakukan (Sastrohamidjojo, 1996).
3. Isoflavon
O
O A C
B
Isoflavon merupakan senyawa yang tidak begitu mencolok, tetapi senyawa ini penting sebagai fitoaleksin (senyawa pelindung) dalam tumbuhan untuk pertahanan terhadap penyakit (Robinson, 1995). Beberapa isoflavon (misalnya daidzein) memberikan warna biru muda cemerlang dengan sinar UV bila diuapi amonia, tetapi kebanyakan tampak sebagai bercak lembayung yang pudar dengan amonia berubah menjadi coklat. Isoflavon sukar dicirikan karena reaksinya tidak khas dengan pereaksi warna manapun (Markham, 1988).
4. Flavanon
O
O
A C
B
5. Flavanonol
Flavanonol (atau dihidroflavonol) barangkali merupakan flavonoid yang paling kurang dikenal, dan tidak dapat diketahui apakah senyawa ini terdapat sebagai glikosida. Senyawa ini stabil dalam asam klorida panas tetapi terurai oleh udara (Robinson, 1995).
6. Antosianin
O
OH A C
B
Antosianin merupakan turunan suatu struktur aromatik tunggal, yaitu sianidin, dan semuanya terbentuk dari pigmen sianidin ini dengan penambahan atau pengurangan gugus hidroksil atau dengan metilasi (Harborne, 1996). Antosianin adalah pigmen pada daun, bunga dan batang tanaman yang memiliki banyak warna biru, lembayung, violet, dan semua yang mendekati warna merah. Antosianin terdapat juga dalam bagian lain tumbuhan tinggi kecuali fungus. Antosianin selalu terdapat dalam bentuk glikosida. Faktor-faktor yang mempengaruhi warna dari antosianin yaitu pH, logam dalam bentuk kompleks dan juga tanin (Robinson, 1995).
7. Katekin
8. Leukoantosianidin
O
OH HO OH
OH OH
A C
B HO
Merupakan monomer flavan 3,4-diol, leukoantosianidin jarang terdapat sebagai glikosida, namun beberapa bentuk glikosida yang dikenal adalah apiferol, dan peltoginol (Robinson, 1995).
9. Auron
O
O CH
A B
Auron berupa pigmen kuning emas yang terdapat dalam bunga tertentu. Dimana apabila diberi uap ammonia dalam larutan basa , senyawa ini akan berwarna ros dan tampak pada kromatografi kertas berupa bercak kuning, dengan sinar ultraviolet warna kuning kuat berubah menjadi merah jingga (Markham, 1988).
10. Kalkon
A
O
B
Menurut Harborne (1996), dikenal sekitar sepuluh kelas flavonoida dimana semua flavonoida, menurut strukturnya, merupakan turunan senyawa induk flavon dan semuanya mempunyai sejumlah sifat yang sama yakni: (Markham, 1988).
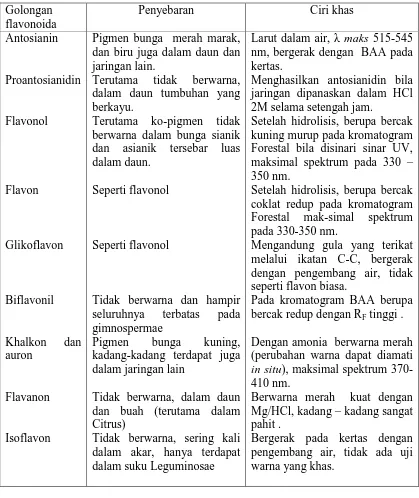
Tabel 2.1. Sifat dari golongan-golongan flavonoida menurut Harborne Golongan
flavonoida
Penyebaran Ciri khas
Antosianin dan biru juga dalam daun dan jaringan lain.
Terutama tidak berwarna, dalam daun tumbuhan yang berkayu.
Terutama ko-pigmen tidak berwarna dalam bunga sianik dan asianik tersebar luas dalam daun.
Seperti flavonol
Seperti flavonol
Tidak berwarna dan hampir seluruhnya terbatas pada gimnospermae
Pigmen bunga kuning, kadang-kadang terdapat juga dalam jaringan lain
Tidak berwarna, dalam daun dan buah (terutama dalam Citrus)
Tidak berwarna, sering kali dalam akar, hanya terdapat dalam suku Leguminosae
Larut dalam air, λ maks 515-545 nm, bergerak dengan BAA pada kertas.
Menghasilkan antosianidin bila jaringan dipanaskan dalam HCl 2M selama setengah jam.
Setelah hidrolisis, berupa bercak kuning murup pada kromatogram Forestal bila disinari sinar UV, maksimal spektrum pada 330 – 350 nm.
Setelah hidrolisis, berupa bercak coklat redup pada kromatogram Forestal mak-simal spektrum pada 330-350 nm.
Mengandung gula yang terikat melalui ikatan C-C, bergerak dengan pengembang air, tidak seperti flavon biasa.
Pada kromatogram BAA berupa bercak redup dengan RF tinggi .
Dengan amonia berwarna merah (perubahan warna dapat diamati in situ), maksimal spektrum 370-410 nm.
Berwarna merah kuat dengan Mg/HCl, kadang – kadang sangat pahit .
Bergerak pada kertas dengan pengembang air, tidak ada uji warna yang khas.
2.4.3 Sifat Kelarutan Flavonoida
dalam pelarut polar seperti etanol (EtOH), metanol (MeOH), butanol, aseton, dimetilsulfoksida (DMSO), dimetilformamida (DMF), air dan lain-lain. Flavonoid yang berupa aglikon merupakan golongan polifenol yang memiliki sifat senyawa fenol yaitu bersifat agak asam, Oleh karena itu dapat larut dalam basa. Namun apabila terlalu lama dibiarkan di dalam larutan basa dan terdapat cukup banyak oksigen, maka dapat terjadi penguraian pada senyawa tersebut. Keberadaan gugus gula yang terikat pada flavonoid (glikosida) cenderung menyebabkan flavonoid lebih mudah terlarut dalam air. Hal ini memberikan pilihan pelarut yang luas karena air dapat dicampurkan dengan pelarut-pelarut di atas. Namun hal sebaliknya tidak berlaku pada aglikon yang kurang polar seperti isoflavon, flavanon, dan flavon serta flavonol yang termetoksilasi cenderung lebih mudah larut dalam pelarut seperti eter dan kloroform (Markham, 1988).
2.5Skrining Fitokimia
Banyak reagen yang dapat digunakan untuk mengetahui keberadaan dari flavonoid, meskipun beberapa juga akan bereaksi positif dengan senyawa polifenol. Reagen yang biasa digunakan adalah :
1. Shinoda Test, yaitu dengan menambahkan serbuk magnesium pada ekstrak sampel dan beberapa tetes HCl pekat, warna orange, pink, merah sampai ungu akan terjadi pada senyawa flavon, flavonol, turunan 2,3-dihidro dan xanton. Penggunaan zinc sebagai pengganti magnesium dapat dilakukan, dimana hanya flavanonol yang memberikan perubahan warna merah pekat sampai magenta, flavanon dan flavonol akan memberi warna merah muda yang lemah sampai magenta.
2. H2SO4(p), flavon dan flavonol akan memberikan perubahan larutan kuning
pekat. Kalkon dan auron menghasilkan larutan berwarna merah atau merah kebiru-biruan. Flavanon memberikan warna orange sampai merah (Cannell, 1998).
3. NaOH 10% , menghasilkan larutan biru violet
4. FeCl3 5% telah digunakan secara luas untuk mengidentifikasi senyawa fenol,
flavonoid. Pereaksi ini memberi warna kehijauan, warna biru, dan warna hitam-biru (Robinson, 1995).
2.6 Teknik Pemisahan
Teknik pemisahan memiliki tujuan untuk memisahkan komponen yang akan ditentukan berada dalam keadaan murni, tidak tercampur dengan komponen-komponen lainnya. Ada 2 jenis teknik pemisahan:
1. Pemisahan kimia adalah suatu teknik pemisahan yang berdasarkan adanya perbedaan yang besar dari sifat-sifat fisika komponen dalam campuran yang akan dipisahkan.
2. Pemisahan fisika adalah suatu teknik pemisahan yang didasarkan pada perbedaan-perbedaan kecil dari sifat-sifat fisik antara senyawa-senyawa yang termasuk dalam satu golongan (Muldja, 1995).
2.6.1 Ekstraksi
Beberapa metode ekstraksi dapat digunakan untuk mengekstrak suatu konstituen dalam suatu bahan tanaman, yang diantaranya adalah maserasi, perkolasi, ekstraksi sokletasi, ekstraksi pelarut bertekanan, ekstraksi dengan refluks, dan destilasi uap. Dalam ekstraksi padat-cair, bahan tanaman ditempatkan dalam sebuah wadah, dan dibiarkan terjadi kontak dengan pelarut. Proses yang terjadi dari seluruh proses dinamis tersebut dapat diuraikan menjadi beberapa tahap, yaitu tahap pertama pelarut akan berdifusi ke dalam sel, kemudian pelarut akan melarutkan metabolit, dan pada proses akhir pelarut akan berdifusi keluat dari sel bersama dengan metabolit (Sarker, 2007).
memungkinkan pemisahan bahan alam berdasarkan kelarutannya (dan polaritasnya) dalam ektraksi. Hal ini sangat mempermudah proses isolasi. Ekstraksi dingin memungkinkan banyak senyawa terekstraksi, meskipun beberapa senyawa memiliki kelarutan terbatas dalam pelarut ekstraksi pada suhu kamar (Heinrich et al, 2009).
Ekstraksi dianggap selesai bila tetesan terakhir memberikan reaksi negatif terhadap senyawa yang diekstraksi. Untuk mendapatkan larutan ekstrak pekat, biasanya pelarut ekstrak diuapkan dengan menggunakan alat rotari evaporator (Harborne, 1996).
2.6.2 Partisi
Metode pemisahan yang mungkin paling sederhana adalah partisi, yang banyak digunakan sebagai tahap awal pemurnian ekstrak. Partisi menggunakan dua pelarut tak bercampur yang ditambahkan kedalam ekstrak tersebut, hal ini dapat dilakukan secara terus menerus dengan menggunakan dua pelarut yang tak bercampur yang kepolarannya meningkat. Partisi biasanya dilakukan melalui dua tahap:
1. Air/petroleum eter ringan (heksana) untuk menghasilkan fraksi nonpolar di lapisan organik
2. Air/diklorometan atau air/kloroform atau air/etil asetat untuk membuat fraksi agak polar di lapisan organik. Ini merupakan metode pemisahan yang mudah dan mengandalkan kelarutan bahan alam dan bukan interaksi fisik dengan medium lain (Heinrich et al, 2009).
2.6.3 Hidrolisis
dikeringkan dengan menggunakan natrium sulfat akan didapatkan aglikon flavonoid setelah diuapkan (Mabry et al, 1970).
2.6.4 Kromatografi
Kromatografi merupakan suatu teknik pemisahan yang menggunakan fase diam (stationary phase) dan fase gerak (mobile phase). Teknik kromatografi telah berkembang dan telah digunakan untuk memisahkan dan mengkuantifikasi berbagai macam komponen yang kompleks, baik komponen organik maupun komponen anorganik. Kromatografi pertama kali dikembangkan oleh seorang ahli botani Rusia Michael Tswett pada tahun 1903 untuk memisahkan pigmen berwarna dalam tanaman dengan cara perkolasi ekstrak petroleum eter dalam kolom gelas yang berisi kalsium karbonat (CaCO3).
Fase padat yang bertindak sebagai fase diam dalam kromatografi cair-padat (KCP) ataupun gas-padat (KGP) disebut sebagai adsorben atau penjerap, sedangkan bahan tempat melekatnya fase diam disebut sebagai penyangga. Jika fase gerak digerakkan melalui fase diam untuk menghasilkan pemisahan kromatografi, proses ini dikenal sebagai pengembangan. Setelah senyawa-senyawa dipisahkan dengan pengembangan, hasilnya didekteksi atau divisualisasi. Jika senyawa-senyawa yang dipisahkan benar-benar dikeluarkan dari sistem, maka senyawa itu telah dielusi atau elusi telah terjadi. Senyawa yang dipisahkan biasanya disebut sebagai linarut, atau secara kelompok disebut cuplikan. Dan hasil keseluruhan dari kromatografi disebut sebagai kromatogram (Gritter, 1991).
Nilai maksimum Rf adalah 1 dan ini dicapai ketika solut mempunyai perbandingan distribusi (D) dan faktor retensi sama dengan 0 yang berarti solut bermigrasi dengan kecepatan yang sama dengan fase gerak. Nilai minimum Rf adalah 0 dan ini teramati jika solut tertahan pada posisi titik awal di permukaan fase diam.
2.6.4.1 Kromatografi Lapis Tipis
Teknik kromatografi lapis tipis sering dilakukan dengan menggunakan lempeng atau gelas plastik yang dilapisi fasa diam dan fasa geraknya merupakan pelarut. Campuaran yang akan dianalisis diteteskan pada dasar lempeng dan perlarutnya akan bergerak naik oleh gaya kapiler.
Pada umumnya fasa diam bersifat polar dan senyawa polar akan melekat lebih kuat pada lempeng daripada senyawa tak polar akibat interaksi tarik menarik dipol. Senyawa tak polar kurang melekat erat pada fasa diam polar sehingga bergerak naik lebih jauh ke atas lempeng. Jarak tempuh ke atas lempeng merupakan cermin polaritas senyawa. Peningkatan polaritas pelarut akan menurunkan interaksi senyawa dengan fasa diam sehingga senyawa dalam fasa gerak bergerak lebih jauh pada lempeng (Bresnick, 2005).
Nilai utama kromatografi lapis tipis pada penelitian flavonoida adalah sebagai cara analisis cepat yang memerlukan bahan sangat sedikit. Menurut Markham, Kromatografi Lapis Tipis terutama berguna untuk tujuan berikut:
1. Mencari pelarut untuk kromatografi kolom
2. Analisis fraksi yang diperoleh dari kromatografi kolom 3. Identifikasi flavonoida secara ko-kromatografi
4. Isolasi flavonoida murni skala kecil
Penyerap dan pengembang yang digunakan umumnya sama dengan penyerap dan pengembang pada kromatografi kolom dan kromatografi kertas (Markham, 1988).
Kromatografi Lapis Tipis Preparatif
kromatografi jenis yang sukar dan kadang-kadang lama dipisahkan. KLT preparatif adalah cara ideal untuk memisahkan cuplikan kecil (50 mg sampai 1 g). Penyerap yang dipakai adalah silika gel dan dipakai untuk pemisahan campuran senyawa lipofil maupun campuran senyawa hidrofil. Ketebalan adsorben yang sering dipakai 0,5 – 2 mm. Ukuran plat kromatografi biasanya 20x20 cm atau 20x40 cm (Gritter, 1991).
Kebanyakan penjerap KLTP mengandung indikator fluorosensi yang membantu mendeteksi kedudukan pita yang terpisah sepanjang senyawa yang dipisahkan menyerap sinar UV. Pita yang kedudukannya telah diketahui dikerok dari plat dengan spatula atau pengerok berbentuk tabung. Senyawa harus diekstraksi dari penjerap dengan pelarut yang paling kurang polar yang mungkin (sekitar 5 ml pelarut untuk 1 g penjerap). Harus diperhatikan bahwa semakin lama senyawa berkontak dengan penjerap makin besar kemungkinan penguraian (Hostettmann dkk, 1995).
2.6.4.2 Kromatografi Kolom
Metode pemisahan kromatografi didasarkan pada perbedaan distribusi molekul-molekul komponen di antara fase gerak dan fase diam berdasarkan perbedaan tingkat kepolaran. Komponen akan bergerak lebih cepat meninggalkan kolom bila molekul-molekul komponen tersebut berinteraksi secara lemah dengan fase diam. Daya interaksi komponen yang akan dipisahkan dengan fase diam sangat menentukan tingkat keberhasilan kromatografi.
pelarut yang menuruni kolom akan menurun karena tersumbat oleh partikel-partikel halus (Bintang, 2010).
Ukuran partikel penjerap pada kolom biasanya lebih besar daripada untuk KLT. Walau pun banyak jenis penjerap telah dipakai untuk kolom, alumina dan silika gel adalah penjerap yang paling berguna dan mudah didapat.
Kromatografi kolom biasanya dibuat dengan menuangkan suspensi fasa diam dan pelarut yang sesuai kedalam kolom dan dibiarkan memadat. Selanjutnya pelarut diturunkan sampai tepat pada bagian atas penyerap dan cuplikan yang akan dipisahkan diletakkan pada bagian atas penyerap kemudian fasa gerak dimasukkan dan dibiarkan mengalir melewati kolom dan komponen campuran turun berupa pita dengan laju yang berlainan kemudian hasil pemisahan dari kolom dikumpulkan sebagai fraksi. Fraksi kolom yang mengandung senyawa yang sama (diperiksa dengan KLT) atau tampaknya berasal dari satu puncak (memakai pendeteksian sinambung) digabungkan, dan pelarutnya diuapkan, lebih baik dengan tekanan rendah. Jika pelarut dan penjerap murni. Maka fraksi-fraksi pun murni. Kromatografi kolom merupakan bentuk kromatografi cair (Gritter dkk, 1991).
2.7 Teknik Spektroskopi
Teknik spektroskopi adalah salah satu teknik analisis kimia-fisika yang mengamati tentang interaksi atom atau molekul dengan radiasi elektromagnetik. Ada dua macam instrumen pada teknik spektroskopik yaitu spektrometer dan spektrofotometer. Instrumen yang memakai monokromator celah yang tetap pada bidang fokus disebut spektrometer. Apabila spektrometer tersebut dilengkapi dengan detektor yang bersifat fotoelektrik disebut sebagai spektrofotometer (Muldja, 1995).
uraian teknik analisis didahului dengan mekanisme antaraksi tersebut, serta fenomena yang dipakai sebagai parameter analisisnya (Satiadarma dkk, 1995).
2.7.1 Spektrofotometer Ultraviolet-Visible (UV-Vis)
Spektrofotometer ultraviolet-visible adalah tenik analisis spektroskopik yang memakai sumber radiasi elektromagnetik ultraviolet dekat dan sinar tampak dengan memakai instrumen spektrofotometer. Apabila pada molekul sederhana tersebut hanya terjadi transisi elektronik pada satu macam gugus maka akan terjadi suatu absorpsi yang merupakan garis spektrum (Muldja,1995). Panjang gelombang cahaya ultraviolet bergantung pada mudahnya promosi elektron. Molekul-molekul yang memerlukan lebih banyak energi untuk promosi elektron, akan menyerap pada panjang gelombang yang lebih pendek (Supratman, 2010).
Senyawa polifenol memiliki dua karakteristik pita penyerapan Ultraviolet dengan maksimal jarak 240 sampai 285 nm dan 300 sampai 550 nm. Berbagai macam golongan flavonoid dapat dikenali dari spektrum UV mereka masing-masing, karakteristik spektra UV dari masing-masing flavonoid yang mengandung jumlah dari golongan hidroksil aglikon, pola substituen glikosida, dan golongan asil aromatik bahan alam (Andersen, 2006).
Flavonoida mengandung sistem aromatik yang terkonjugasi karena itu memiliki menunjukkan pita serapan kuat pada daerah spektrum ultraviolet dan spektrum tampak (Harborne, 1987). Spektrum khas terdiri atas dua maksimal pada rentang 240-285 nm (pita II) dan 300-550 nm (pita I). Kedudukan yang tepat dan kekuatan nisbi maksimal terssebut memberika informasi yang berharga mengenai sifat dan pola oksigenasinya.
Ciri spektrum khas jenis flavonoid utama dengan pola oksigenasi yang setara disajikan pada tabel dibawah :
Tabel 2.2 Rentangan Serapan Spektrum UV-Visible golongan Flavonoida Pita II (nm) Pita I (nm) Jenis Flavonoid
250-280 310-350 Flavon
250-280 330-360 Flavonol (3-OH tersubstitusi)
250-280 350-385 Flavonol (3-OH bebas)
245-275 310-330 bahu Isoflavon
275-295 300-330 bahu Flavanon dan dihidroflavonol 230-270
(kekuatan rendah)
340-390 Khalkon
230-270 (kekuatan rendah)
380-430 Auron
270-280 465-560 Antosianidin dan antosianin
Perubahan penyulihan pada cincin A cenderung tercerminkan pada serapan pita II, sedangkan perubahan penyulihan pada cincin B dan C cenderung lebih jelas tercermin pada serapan pita I (Markham, 1988).
2.7.2 Spektrofotometer Inframerah (FT-IR)
Spektrometri inframerah dapat digunakan untuk mengidentifikasi adanya gugus fungsi dalam suatu molekul. Spektrum inframerah suatu molekul adalah hasil transisi antara tingkat energi getaran (vibrasi) yang berlainan. Inti-inti atom yang terikat oleh ikatan kovalen mengalami getaran (vibrasi) atau osilasi (oscillation) dengan cara serupa dengan dua bola yang terikat oleh suatu pegas.
diserap. Ikatan nonpolar (seperti C-H atau C-C) menyebabkan absorpsi lemah, sedangkan ikatan polar (seperti misalnya O-H, N-H, dan C=O) menunjukkan absorpsi yang lebih kuat.
Suatu ikatan dalam sebuah molekul dapat mengalami berbagai vibrasi molekul. Secara umum terdapat dua tipe vibrasi molekul:
1. Streching (vibrasi regang/ulur): vibrasi sepanjang ikatan sehingga terjadi perpanjangan atau pemendekan ikatan.
2. Bending (vibrasi lentur/tekuk): vibrasi yang disebabkan oleh sudut ikatan sehingga terjadi pembesaran atau pengecilan sudut ikatan.
Oleh karena itu suatu ikatan tertentu dapat menyerap energi lebih dari satu panjang gelombang. Contohnya, ikatan O-H menyerap energi pada frekuensi 3330 cm-1, energi pada panjang gelombang ini menyebabkan kenaikan vibrasi regang ikatan O-H itu. Suatu ikatan O-H itu juga menyerap pada kira-kira 1250 cm-1, energi pada panjang gelombang ini menyebabkan kenaikan vibrasi lentur. Tipe vibrasi yang berlain-lainan ini disebut cara vibrasi fundamental (Supratman, 2010).
2.7.3 Spektrometer Resonansi Magnetik Inti Proton (1H-NMR)
Spektrometer Resonansi Magnetik Inti (Nuclear Magnetic Resonance, NMR) merupakan alat yang berguna pada penentuan struktur molekul organik. Teknik ini memberikan informasi mengenai berbagai jenis atom hidrogen dalam molekul. Spektrum Resonansi Magnetik Inti memberikan informasi mengenai lingkungan kimia atom hidrogen, jumlah atom hidrogen dalam setiap lingkungan dan struktur gugusan yang berdekatan dengan setiap atom hidrogen (Creswell, 1982).
ditunjukkan dalam jumlah resonansi proton yang bergeser dari TMS dalam bagian per juta (ppm) dari frekuensi dasar spektroskopi.
Semua proton dalam molekul yang identik dalam lingkungan kimia akan memiliki pergerseran kimia yang sama. Dengan demikian, semua proton dari TMS atau semua proton dalam benzena, siklopentana, atau aseton memiliki nilai resonansi yang berdekatan pada nilai δ. Masing-masing komponen akan memiliki penyerapan yang tunggal dalam spektrum nmr. Proton ini dikatakan sama secara kimia. Pada kenyataannya, spektrum tidak dapat hanya dibedakan dari berapa banyak tipe proton yang berbeda pada molekul tersebut, tetapi dapat memperlihatkan berapa banyak jenis perbedaan yang ada dalam molekul tersebut. Dalam spektrum nmr, daerah dibawah masing-masing peak adalah proporsional dengan jumlah dari hidrogen yang ada pada peak tersebut (Pavia, 1979).
Proton yang lebih mudah beresonansi akan menyerap energi lebih rendah, proton ini akan menimbulkan peak bawah medan (tak terperisai= deshielded downfield, lebih kekiri pada spektrumnya). Sedangkan, proton yang sukar