TINJAUAN PUSTAKA Biologi S. rolfsii
Menurut Alexopoulus & Mims (1979) jamur S. rolfsii dapat diklasifikasikan sebagai berikut : Kingdom : Mycetaceae; Devisio : Mycopyta; Class : Deuteromycetes; Ordo : Mycelia Steril; Famili : Agonomycetaceae; Genus : Sclerotium; Species : S. rolfsii Sacc.
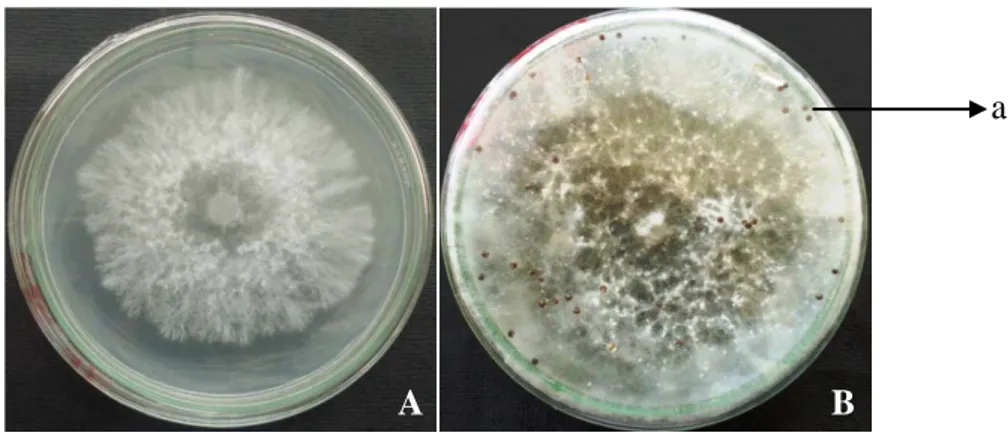
Gambar 1. Biakan S. rolfsii (A) berumur 3 hari (B) berumur 3 minggu (a) sklerotia
Sclerotium mempunyai kulit yang kuat sehingga tahan terhadap suhu tinggi dan kekeringan. Di dalam tanah Sclerotium dapat bertahan sampai 6-7 tahun. Dalam cuaca kering Sclerotium dapat mengeriput, tetapi ini justru akan berkecambah dengan cepat jika kembali berada di lingkungan yang lembab (Semangun, 2004). Pada dasarnya ada dua jenis hifa yang dihasilkan S. rolfsii yaitu kasar dan lurus dengan ukuran sel (2-9 μm x 150-250 μm) (Fichtner, 2006) dan miselium yang terdiri dari benang-benang berwarna putih, tersusun seperti
bulu dan kapas (Gambar 1 A). Di sini jamur tidak membentuk spora (Semangun, 2004)
Untuk pemencaran dan untuk mempertahankan diri jamur membentuk sejumlah sklerotia (Gambar 1 B.a). Butir-butir ini mudah sekali lepas dan
A B
terangkut air (Semangun, 2004). Pada prinsipnya sklerotia terbentuk pada musim hujan dan menjadi inokulum pertama untuk penyakit. Berada dekat dengan permukaan tanah, sklerotia mungkin ada bebas di dalam tanah atau berasosiasi dengan sisa tanaman. Sklerotia yang terkubur dalam di dalam tanah mungkin hidup lebih kurang selama setahun, ketika berada di permukaan tanah kembali aktif dan mungkin berkecambah pada respon alkohol dan bahan-bahan yang lain mudah menguap yang berasal dari dekomposisi bahan tanaman (Fichtner, 2006). Menurut Punja & Rahe (2001), untuk menjaga struktur pelindung, sklerotia terdiri dari hifa yang aktif. Suhu optimum untuk pertumbuhan sklerotia adalah 27-30° C dan tidak aktif pada suhu dibawah 0°
Menurut Ferreira & Boley (1992), ukuran sklerotia mempunyai banyak bentuk yang dihasilkan oleh miselium, bulat dan putih ketika muda kemudian menjadi coklat gelap sampai hitam. Fichtner (2006) menyebutkan bahwa sklerotia mempunyai ukuran diameter (0,5 mm-2,0 mm) yang mulai berkembang setelah 4-7 hari dari pertumbuhan miselium.
C.
Gejala Serangan
S. rolfsii pertama sekali menyerang batang, meskipun mungkin menginfeksi beberapa bagian tanaman dibawah kondisi lingkungan yang sesuai termasuk akar, buah, petiole, daun dan bunga. Tanda pertama infeksi, meskipun biasanya tidak terdeteksi, adalah coklat gelap pada batang atau di bawah tanah. Gejala pertama yang mungkin adalah proses penguningan dan kelayuan pada daun (Gambar 2 A). Gejala berikutnya (Gambar 2 B) terlihat lapisan putih atau benang miselium pada jaringan yang terinfeksi dalam tanah (Fichtner, 2006).
Gambar 2. (A) tanaman kedelai yang terserang S. rolfsii (B) tanah di sekitar perakaran tanaman terserang.
Penyakit ini sering juga disebut sebagai busuk pangkal batang atau busuk Sclerotium. S. rolfsii dapat menyerang kecambah atau semai dan menyebabkan penyakit semai (damping off). Dalam keadaan sangat lembab jamur juga dapat menyerang daun, tangkai, dan polong. Tanaman yang berumur 2-3 minggu paling rentan terhadap S. rolfsii (Semangun, 2004).
Pengendalian Penyakit
Pengendalian penyakit S. rolfsii dapat dilakukan dengan beberapa cara diantaranya memecahkan masalah lahan, pergiliran tanaman dengan jagung, padi, dan tanaman graminae lainnya, jangan menutup tanah dengan sisa tanaman yang sama setelah musim tanam, memperhatikan keberadaan gulma pada musim tanam, dan penggunaan fungisida yang berformulasi debu (Lucas et al. 1985). Selain fungisida, Rahaju (2007) menyebutkan bahwa menggunakan mikroba yang bersifat antagonis merupakan salah satu alternatif pengendalian patogen tular tanah.
Menurut Yusriadi (2004), cara pengendalian biologi perlu dipertimbangkan untuk menekan perkembangan penyakit layu. Pengendalian penyakit layu dengan menggunakan mikroorganisme belum banyak dilakukan di Indonesia, karena masih terbatasnya mikroorganisme yang berpotensi sebagai agens pengendali
hayati bagi penyakit-penyakit yang bersifat patogen tular tanah. Menurut Cook & Baker (1996), keberhasilan pengendalian hayati sangat ditentukan oleh jenis dan jumlah inokulum antagonis yang diberikan, jenis patogen yang akan dikendalikan, dan faktor lingkungan yang mempengaruhi, serta cara aplikasi ke dalam tanah.
Menurut Pracaya (1991), dalam pengendalian hayati pengertian antagonisme adalah gangguan atau hambatan terhadap proses kehidupan (pertumbuhan, perbanyakan, infeksi, penyebaran, dan lain-lain) dari suatu organisme (patogen) oleh organisme lain (antagonis). Proses ini dapat terjadi antara organisme dalam satu spesies maupun antar genus dan spesies yang berbeda.
Mutasi Mikroorganisme
Mutasi merupakan perubahan genetik yang dapat diwariskan dan bagian evolusi yang penting. Apabila perubahan terjadi dalam pertumbuhan normal, perubahan ini disebut mutasi spontan. Skala waktu untuk laju mutasi tidak
dinyatakan dalam satuan jam atau hari melainkan dalam generasi (Pelczar & Chan, 2007).
Sinar Ultra Violet (UV) adalah salah satu penyebab terjadinya mutasi, dimana sinar ini akan melepaskan energi sehingga menyebabkan eksitasi elektron sehingga ion-ion menjadi reaktif dan memungkinkan perubahan susunan kimia DNA. Mutasi dapat berakibat pada kesalahan menyandi protein dan keadaan ini jika tidak bersifat letal, biasanya menimbulkan penampakan fenotip yang berbeda dari keadaan normalnya. Karena merupakan perubahan pada materi genetik, maka mutasi diwariskan pada keturunannya (Hut et al. 2008).
Salah satu sifat sinar UV (Gambar 3 B) adalah daya penetrasi yang sangat rendah. Selapis kaca tipis pun sudah mampu menahan sebagian besar sinar UV. Oleh karena itu, sinar UV hanya dapat efektif untuk mengendalikan mikroorganisme pada permukaan yang terpapar langsung oleh sinar UV, atau mikroba berada di dekat permukaan medium yang transparan (Atlas, 1994).
Gambar 3. Lampu UV yang digunakan selama percobaan berlangsung (A) Lampu UV (B) keadaan lampu UV setelah dihidupkan
Radiasi sinar UV pada proses mutagenesis dapat mengubah patogen menjadi nonpatogenik (Freeman et al. 2002). Mekanisme yang menyebabkan
patogen berubah menjadi nonpatogenik ini, disebabkan oleh adanya perubahan biokimia pada strain nonpatogenik tersebut, yaitu berkurangnya
produksi enzimpektik lyase ekstraseluler, menurunnya aktifitas
polygalacturonase, dan terjadinya defisiensi sekresi enzim ekstraseluler (Yamaguchi et al. 1992).
Radiasi UV dapat dibagi menjadi panjang gelombang berkisar 380–200 nm dan UV vakum dengan panjang gelombang berkisar 200–10 nm.
Tingkat inaktifasi mikroorganisme sangat tergantung pada dosis UV yang digunakan. Kinetika inaktifasi mikroorganisme pada desinfeksi menggunakan UV mengikuti hukum Chick, pada persamaan berikut:
A
N = No . e Dengan:
-k.I.t
N = jumlah mikroorganisme setelah dipapari UV pada waktu pemaparan (t) No = jumlah mikroorganisme awal (t=0)
k = koef. Tingkat inaktifasi mikroorganisme selama waktu tertentu (tergantung pada faktor kualitas air)
I = intensitas UV
Bryan et al. 1992; White, 1992; USEPA, 1996; dalam Cahyonugroho, 2010, memodifikasi persamaan tersebut menjadi persamaan berikut:
In N/No = -k.I.t
Tanda negatif pada persamaan tersebut mengindikasi adanya penurunan dari jumlah mikroorganisme setelah waktu tertentu. Berdasarkan persamaan hukum Chick, maka jumlah mikroorganisme yang tersisa dapat dihitung sebagai fungsi dosis dan waktu pemaparan (Susanti et al. 2009).
Sadana et al. (1979) melaporkan dalam penelitiannya bahwa pemaparan irradiasi UV selama 20 menit terhadap isolat S. rolfsii berpengaruh terhadap kecepatan pertumbuhan dari isolat mutan yang terbentuk jika dibandingkan dengan tetuanya.
Susanti et al. (2009), melaporkan dalam penelitiannya terhadap isolat Fusarium oxysporum f.sp lycopersici yang telah dimutasi memiliki kemampuan
dan ketahanan untuk mentoleransi pengaruh-pengaruh yang bersifat merugikan menyebabkan beberapa konidia jamur dapat tetap ditumbuhkan
pada media biakan. Selain itu, terjadi perubahan pigmen dari strain F. oxysporum f.sp lycopersici bersifat genetis sehingga secara konsisten
diturunkan ke keturunannya, dan ada yang bersifat sementara. Perubahan pigmen yang bersifat sementara ini mungkin hanya disebabkan oleh kerusakan pigmen karena adanya pengaruh dari radiasi sinar UV, sehingga tidak diwariskan ke
keturunannya. Selain itu pada salah satu isolat, kembalinya warna pigmen ini mungkin disebabkan jamur tersebut karena memiliki kemampuan untuk memperbaiki kerusakan yang disebabkan oleh sinar UV. Selanjutnya pada pengujian patogenesitas F. oxysporum f.sp lycopersici, isolat-isolat yang diinokulasikan pada tanaman tomat baik dengan cara perendaman akar tanaman tomat atau pencampuran pada media tanam, menunjukkan adanya perubahan tingkat patogenesitas yang berbeda. Berdasarkan hasil tersebut, hanya dua isolat yang masih tetap bersifat patogenik, sedangkan isolat-isolat lainnya mengalami kehilangan patogenesitasnya. Day (1974), dalam penelitiannya diperoleh informasi bahwa mutanPenicillium expansum dan F. oxysporum f. sp. lycopersici yang diradiasi dengan sinar UV menunjukkan penurunan patogenesitasnya.
METODOLOGI PENELITIAN Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Penyakit Tumbuhan, Program Studi Agroekoteknologi, Fakultas Pertanian Universitas Sumatera Utara,
pada ketinggian tempat ± 25 meter dpl (di atas permukaan laut) pada bulan September sampai November 2012.
Bahan dan Alat Bahan
Adapun bahan yang digunakan dalam melaksanakan penelitian ini adalah,
aquades, Media Potato Dextrose Agar (PDA), tanaman kedelai yang terserang S. rolfsii, benih kedelai varietas Anjasmoro, cling wrap, kapas, alkohol, air suling
steril, spritus, alumunium foil, dan kertas steencil, beras, klorox. Alat
Adapun alat yang digunakan pada penelitian ini adalah cawan petri, erlemeyer, cutter, handsprayer, batang pengaduk, mikroskop binokuler, autoklaf, lampu bunsen, timbangan analitik, Laminar Air Flow, lampu UV dengan kriteria
short wave ultraviolet (Model EVF-240C/F, 230 VOLTS, 50 HZ 17 AMPS) 15 watt panjang gelombang 254 nm, tabung reaksi, polibeg, inkubator, oven, hot plate, mikropipet, pipet ukur, mortar, pestel, beaker glass, jarum inokulum,
pinset, glass root (batang L), kotak peletakan UV, jangka sorong. Metode Penelitian
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) Non Faktorial dengan 7 perlakuan, yaitu :
Isolat Mutan (M) : M0 M
: Kontrol (Tanpa Pemaparan) 1
M
: Pemaparan selama 5 menit 2
M
: Pemaparan selama 10 menit 3
M
: Pemaparan selama 15 menit 4
M
: Pemaparan selama 20 menit 5
M
: Pemaparan selama 25 menit 6
Dengan jumlah ulangan diperoleh dengan menggunakan rumus =
: Pemaparan selama 30 menit
(t-1)r ≥ 15 (7-1)r ≥ 15 6r ≥ 15 6r ≥ 15 r ≥ 15/6 r ≥ 2,5 ≈ 3
Ulangan yang digunakan adalah sebanyak 3 ulangan, Total unit percobaan : 21 Percobaan
Bagan penelitian yang dilaksanakan adalah sebagai berikut:
M0A M6C M0 M C 1A M2B M1 M C 4C M1B M2 M C 3A M6B M4 M B 4A M3C M2 M A 5A M3B M5 M C 6A M5B M0B
Data hasil penelitian dianalisis menggunakan sidik ragam dengan model linier sebagai berikut :
Yij Dimana :
= µ + αi + ∑ij
Yij
µ = efek nilai
= Respon atau nilai pengamatan pada perlakuan ke-i dan kelompok ke-j
αi = efek blok dari taraf ke-i ∑ij = efek error
(Sastrosupadi, 2000). Pelaksanaan Penelitian
1. Pembuatan Media PDA
Kentang 250 g dipotong dadu kecil kemudian direbus dalam 1 liter air. Setelah air mendidih dan kentang matang, disaring dan diambil air saringannya. Selanjutnya dekstrosa 20 g dan agar 20 g dimasukkan dalam air hasil saringan. Dipanaskan lagi sampai agar larut dan homogen. Setelah mendidih disaring dan ditambah air sampai volume akhir 1 liter, dimasukkan dalam erlemeyer kemudian disumbat kapas dan ditutup dengan alumunium foil, disterilkan dengan autoclave pada suhu 121°C dengan tekanan 15 psi selama 15 menit (Nasikhah, 2008).
2. Penyediaan Sumber Inokulum a. Isolat Tipe Liar S. rolfsii
Isolat tipe liar S. rolfsii diisolasi dari perakaran atau pangkal batang tanaman kedelai yang terinfeksi S. rolfsii. Bagian tanaman tersebut didisinfeksi dengan cara mencelupkan ke dalam larutan natrium hipoklorit 1 % selama lima detik, kemudian dicuci dengan air steril dan dikeringkan lalu ditanam di Media
PDA. Selanjutnya biakan diinkubasi selama 5 hari pada suhu kamar. Jamur yang tumbuh diamati secara makroskopis dan mikroskopis. Hasil pengamatan diidentifikasi berdasarkan deskripsi yang dikemukakan oleh Barnett dan Hunter (1972). Biakan murni hasil isolasi jamur S. rolfsii diperbanyak dalam Media PDA dan diinkubasi pada suhu kamar selama 5 hari (Astiko et al. 2009).
b. Isolat Mutan S. rolfsii
Disediakan 8-10 sklerotia, lalu digerus dengan menggunakan mortar dan pestel steril kemudian ditambahkan 2 ml air steril. Selanjutnya 1 ml suspensi sklerotia yang telah digerus dimasukkan ke dalam tabung reaksi berisi 9 ml air steril. Setelah dilakukan pengenceran 10-1, diambil suspensi sklerotia sebanyak 0,1 ml kemudian dituang dan diratakan di seluruh permukaan Media PDA. Selanjutnya Media PDA tersebut dipaparkan terhadap radiasi lampu UV 15 W dengan panjang gelombang 254 nm dengan waktu pemaparan sesuai perlakuan. Jarak antara sklerotia yang diradiasi dengan lampu UV adalah 20 cm. Setelah irradiasi dengan sinar UV, sklerotia tersebut diinkubasi selama 48 jam dengan suhu 30°
3. Uji Antagonisme Isolat Mutan S. rolfsii Terhadap Isolat Tipe Liar S. rolfsii di Laboratorium
C, setelah itu diamati bentuk morfologi dari isolat mutan yang terbentuk (Sadana et al. 1979).
Pengujian kemampuan penghambatan isolat mutan S. rolfsii terhadap isolat tipe liar S. rolfsii dilakukan pada cawan petri diameter 9 cm yang telah diisi Media PDA. Selanjutnya isolat mutan S. rolfsii ditanam pada sisi kiri media biakan, sedangkan isolat liar S. rolfsii ditanam di tengah. Selanjutnya pertumbuhan dari kedua jamur tersebut diamati mulai 3 hari setelah inokulasi (hsi) hingga pertumbuhan koloni memenuhi cawan petri (Supriati et al. 2010).
Gambar 4. Bagan peletakan kedua isolat dalam cawan petri dengan metode dual culture
Keterangan:
M = isolat mutan S. rolfsii
L = tipe liar S. rolfsii
4. Uji Patogenesitas Isolat Mutan S. rolfsii a. Persiapan Media Tanam
Media tanam yang digunakan adalah tanah ultisol yang telah disterilisasi lalu dimasukkan ke dalam polibeg ukuran ¼ kg.
b. Penanaman Benih Kedelai
Pada setiap polibeg ditanam 2 benih kedelai dengan 3 ulangan. Selanjutnya dipilih 1 tanaman yang paling sehat untuk diinokulasi isolat mutan S. rolfsii.
c. Perbanyakan Isolat Mutan S. rolfsii
Isolat mutan S. rolfsii diperbanyak dengan cara diinokulasi pada media beras 10 g steril (Lampiran 31). Kemudian biakan diinkubasi selama 7 hari pada suhu kamar. Selanjutnya biakan siap diaplikasikan ke tanaman kedelai setelah media beras ditumbuhi isolat mutan S. rolfsii (Nasikhah, 2008).
d. Inokulasi Isolat Mutan S. rolfsii
Inokulasi isolat mutan S. rolfsii dilakukan setelah tanaman kedelai
berumur 2 Minggu di sekitar perakaran dan pangkal batang tanaman (Astiko et al. 2009).
Peubah Amatan
1. Kemampuan Antagonis Isolat Mutan S. rolfsii Terhadap Isolat Tipe Liar S. rolfsii
Pengamatan kemampuan antagonis isolat mutan S. rolfsii terhadap isolat tipe liar dilakukan dengan mengukur daerah hambatan yang dihasilkan isolat mutan S. rolfsii terhadap isolat tipe liar S. rolfsii. Persentase hambatan pertumbuhan (%) diamati pada umur 3 hsi sampai pertumbuhan koloni memenuhi cawan petri dengan menggunakan rumus:
R1 – R I = x 100% 2 R dimana : 1
I = persentase daya hambat (%) R1
R
= jari-jari isolat tipe liar yang menjauhi isolat mutan S. rolfsii 2 = jari-jari isolat tipe liar yang mendekati isolat mutan S. rolfsii (Fokkema, 1976 dalam Rahaju, 2007).
2. Morfologi Isolat Mutan S. rolfsii
Pengamatan morfologi dari isolat mutan S. rolfsii diamati setelah suspensi gerusan sklerotia yang diirradiasi sinar UV diinkubasi selama 48 jam (2 hsi). Pengamatan dilakukan secara makroskopis dan mikroskopis. Secara makroskopis meliputi warna, bentuk, kerapatan koloni serta jenis miselium dan hifa. Secara mikroskopis, dilakukan pengamatan hifa dan miselium dari isolat mutan S. rolfsii dengan menggunakan mikroskop binokuler perbesaran 100 x, 400 x, 1000 x.
3. Diameter Koloni Isolat Mutan S. rolfsii
Isolat mutan S. rolfsii dibiakkan dengan metode one point (satu titik) pada media PDA di cawan petri berdiameter 9 cm volume 20 ml/petri, dilakukan pengukuran diameter koloni isolat mutan S. rolfsii mulai dari 1-3 hsi, dengan cara mempolakan bentuk perkembangan koloni pada cawan petri menggunakan plastik transparan lalu digambar mengikuti pola perkembangan koloni tersebut. Perhitungan diameter koloni dilakukan dengan menggunakan jangka sorong. 4. Pengaruh Isolat Mutan S. rolfsii Terhadap Diameter Koloni Isolat
Tipe Liar S. rolfsii
Isolat mutan S. rolfsii dan isolat tipe liar S. rolfsii dibiakkan dengan metode two point (dua titik) pada media PDA di cawan petri berdiameter 9 cm volume 20 ml/petri, dilakukan pengukuran diameter koloni isolat tipe liar S. rolfsii mulai dari 1-4 hsi, dengan cara mempolakan bentuk perkembangan koloni pada cawan petri menggunakan plastik transparan lalu digambar mengikuti pola perkembangan koloni tersebut. Perhitungan diameter koloni dilakukan dengan menggunakan jangka sorong.
5. Luas Pertumbuhan Koloni Isolat Mutan S. rolfsii
Isolat mutan S. rolfsii dibiakkan dengan metode one point (satu titik) pada media PDA di cawan petri berdiameter 9 cm volume 20 ml/petri, dilakukan pengukuran luas pertumbuhan koloni isolat mutan S. rolfsii mulai dari 1-3 hsi, dengan cara mempolakan bentuk perkembangan koloni pada cawan petri menggunakan plastik transparan lalu digambar mengikuti pola perkembangan
koloni tersebut. Perhitungan luas pertumbuhan koloni dengan menggunakan leaf area meter.
6. Pengaruh Isolat Mutan S. rolfsii Terhadap Luas Pertumbuhan Koloni Isolat Tipe Liar S. rolfsii
Isolat mutan S. rolfsii dan isolat tipe liar S. rolfsii dibiakkan dengan metode two point (dua titik) pada media PDA di cawan petri berdiameter 9 cm volume 20 ml/petri, dilakukan pengukuran luas pertumbuhan koloni isolat tipe liar S. rolfsii mulai dari 1-4 hsi, dengan cara mempolakan bentuk perkembangan koloni pada cawan petri menggunakan plastik transparan lalu digambar mengikuti pola perkembangan koloni tersebut. Perhitungan luas pertumbuhan koloni dengan menggunakan leaf area meter.
7. Jumlah Sklerotia dari Isolat Mutan S. rolfsii
Jumlah sklerotia dari isolat mutan S. rolfsii diamati mulai 1 minggu setelah inokulasi (msi) hingga 4 msi.
8. Pengaruh Isolat Mutan S. rolfsii Terhadap Jumlah Sklerotia Isolat Tipe Liar S. rolfsii
Pengaruh isolat mutan S. rolfsii terhadap jumlah sklerotia dari isolat tipe liar S. rolfsii diamati mulai 1-4 msi.
9. Patogenesitas Isolat Mutan S. rolfsii
Pengamatan terhadap patogenesitas dari isolat mutan S. rolfsii diamati tiap hari. Tanaman yang menunjukkan gejala kelayuan (terserang) dinilai berdasarkan skala di bawah ini:
Skala 1 = tidak ada gejala kelayuan Skala 2 = sebagian daun layu (ringan) Skala 3 = secara umum daun layu (sedang) Skala 4 = layu permanen
Keparahan penyakit isolat mutan S. rolfsii dihitung berdasarkan nilai skala yang diperoleh dengan menggunakan rumus yang digunakan oleh Direktorat Perlindungan Tanaman, Direktorat Jenderal Produksi Tanaman Pangan (2000) sbb: ∑ (ni x vi KP = --- x 100 % ) Z x N Keterangan : KP = Keparahan Penyakit
ni = Jumlah tanaman atau bagian tanaman contoh dengan skala kerusakan v
v
i i
N = Jumlah tanaman atau bagian tanaman contoh yang diamati = Nilai skala kerusakan contoh ke-i