TINJAUAN PUSTAKA
Fasciola gigantica Klasifikasi dan MorfologiFasciola gigantica
Fasciola gigantica dikenal dengan cacing hati merupakan parasit dari kelas trematoda yang hidup di dalam buluh empedu sapi, domba, kambing dan mamalia lainnya. KlasifikasiF.giganticamenurut Soulsby (1986) adalah
kingdom : Animalia filum : Platyhelminthes kelas : Trematoda sub kelas : Digenea ordo : Echinostomida famili : Fasciolidae genus :Fasciola
spesies :Fasciola gigantica
Gambar 1 Fasciola gigantica
Sumber: Anonim 2011
Secara makroskopis F.gigantica tampak berwarna abu-abu coklat dan memiliki ukuran tubuh lebih besar dibandingkan dengan F. hepatica. Bentuk tubuh menyerupai daun, pipih dorsoventral, tidak memiliki bentuk bahu yang jelas, tidak bersegmen, dan tidak memiliki rongga badan. Panjang tubuh cacing dewasa mencapai 7.5 cm dan lebar 1.5 cm. Hampir seluruh permukaan tubuh ditutupi dengan duri-duri kecil atau tegumen (Taylor 2007).
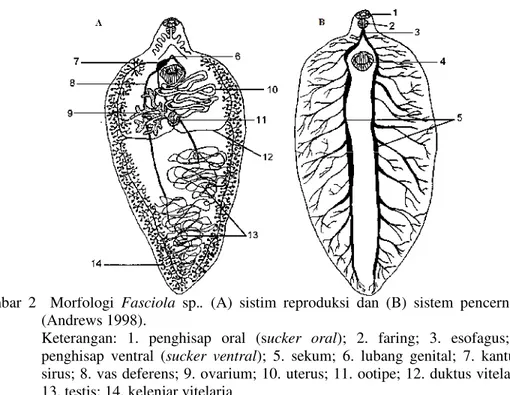
Fasciola sp. memiliki alat penghisap oral (sucker oral)dan alat penghisap ventral (sucker ventral). Alat penghisap oral terletak di ujung anterior dan mengelilingi mulut, sedangkan alat penghisap ventral terletak di sepertiga anterior permukaan ventral tubuh atau sejajar dengan bahu. Sistem pencernaan Fasciola sp. terdiri dari mulut, faring, esofagus dan percabangan sekum yang membentang sampai ujung posterior tubuh. Makanan diperoleh dari sekresi empedu dan menghisap darah induk semang. Metabolisme cacing dewasa berjalan secara anaerob. Sisa metabolisme diekskresikan melalui saluran ekskresi berupa gelembung ekskresi, tabung koleksi, sel-sel api (sel ekskresi) dan lubang ekskresi.
Fasciola sp. dilengkapi dengan sistem syaraf yang sederhana. Sistem syaraf cacing dewasa terdiri atas sistem syaraf pusat, otak, serabut syaraf, dan sistem syaraf perifer. Otak cacing dewasa dilengkapi dengan ganglia yang terletak di samping faring. Syaraf yang keluar dari ganglia menginervasi sekitar penghisap oral (sucker oral) dan faring, sedangkan sistem syaraf perifer mengelilingi esofagus kemudian berjalan bilateral pada setiap sisi tubuh menginervasi dinding tubuh, jaringan adhesi, faring dan sistem reproduksi (Fairweatheret al1998).
F.gigantica merupakan cacing hermaprodit dan memiliki sistem reproduksi yang sangat kompleks. Sistem reproduksi jantan terdiri atas dua testis, disertai dengan saluran vas eferens yang berjalan ke anterior kemudian bergabung membentuk saluran vas deferens. Saluran vas deferens melebar dan membentuk vesikula seminalis. Di depan vesikula seminalis, vas deferens dikelilingi oleh sel ekskresi yang membentuk kelenjar prostat. Vas deferens ini kemudian diteruskan oleh sebuah sirus berongga yang dapat keluar dari lubang kelamin yang berada di anterior tubuh. Sistem reproduksi betina terdiri atas satu ovarium, oviduk, ootipe, dan uterus. Sel telur yang terbentuk di ovarium diteruskan ke oviduk, kemudian menuju ootipe yang dikelilingi oleh kelenjar Mehlis sebagai kelenjar penghasil kulit telur. Bahan kuning telur dihasilkan oleh kelenjar vitelaria yang tersebar di sekitar lateral batil penghisap ventral (sucker ventral) hingga ke bagian posterior tubuh. Telur yang dihasilkan akan diteruskan melalui uterus yang berkelok-kelok kemudian keluar dari lubang kelamin. Pembuahan cacing ini umumnya terjadi secara silang. Sperma dari satu cacing keluar melewati sirus dan masuk ke uterus cacing lainnya yang telah berisi sel telur (Levine 1990).
Gambar 2 Morfologi Fasciola sp.. (A) sistim reproduksi dan (B) sistem pencernaan (Andrews 1998).
Keterangan: 1. penghisap oral (sucker oral); 2. faring; 3. esofagus; 4. penghisap ventral (sucker ventral); 5. sekum; 6. lubang genital; 7. kantung sirus; 8. vas deferens; 9. ovarium; 10. uterus; 11. ootipe; 12. duktus vitelaria; 13. testis; 14. kelenjar vitelaria
Siklus HidupFasciola gigantica
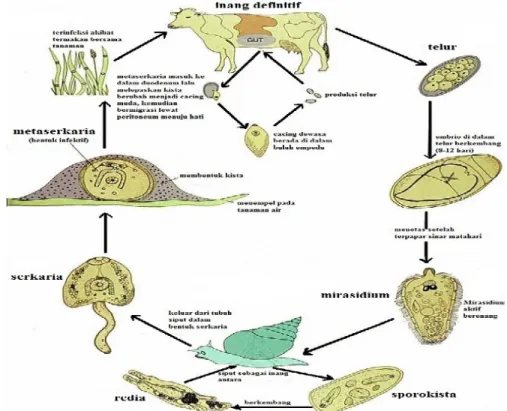
F.giganticamemiliki siklus hidup secara tidak langsung yaitu memerlukan siput sebagai inang antara. Inang antara F.gigantica adalah siput Lymnaea rubiginosa (Asia Tenggara), Lymnaea auricularia (Amerika, Asia, Pasifik) dan Lymnaea natalensis (Afrika) sedangkan inang antara F.hepatica adalah siput Lymnaea truncatula (Eropa), Lymnaea tomentosa (Australia) dan Lymnaea humilis (Amerika Utara). Perbedaan inang antara ini menyebabkan kasus fasciolosis yang terjadi di Indonesia pada umumnya disebabkan oleh F.gigantica (Levine 1990).
F.gigantica dewasa hidup di dalam buluh empedu inang definitif. Cacing dewasa mulai produksi telur sekitar 8 hingga 10 minggu setelah infeksi (Hutchinson et al 2007). Telur cacing dikeluarkan bersama tinja kemudian berkembang di lingkungan. Telur F.gigantica berbentuk oval dan memiliki ukuran yang lebih besar dibandingkan telur F. hepatica. Ukuran telur mencapai 170-190 x 90-100 µm. Pada salah satu ujung telur terdapat operkulum yang berfungsi sebagai jalan keluar mirasidium pada saat menetas (Taylor 2007).
Gambar 3 TelurFasciolasp.
Sumber: Andrews (1998).
Telur F.gigantica menetas dalam waktu 14-17 hari pada suhu lingkungan 280 C. Telur menetas mengeluarkan mirasidium. Mirasidium memiliki bentuk mirip segitiga sama sisi, bagian ujung posterior lancip, memiliki sebuah papila di pertengahan ujung anterior, epitel bersilia, dan sepasang bintik mata. Mirasidium bergerak aktif dalam air dan melakukan penetrasi masuk ke dalam siput. Di dalam tubuh siput, mirasidium melepaskan epitelnya kemudian masuk ke hepatopankreas dan berubah menjadi sporokista. Di dalam sporokista terdapat 1-6 bola-bola benih yang akan berkembang menjadi redia. Redia memiliki mulut, faring yang berotot, dan sepasang tonjolan tumpul ke lateral di pertengahan posterior tubuh. Di dalam redia terdapat bola-bola benih yang selanjutnya menetas mengeluarkan larva berupa serkaria.
Serkaria memiliki bentuk tubuh agak bulat dengan lekukan pada ujung posterior. Larva ini dilengkapi dengan sebuah alat penghisap anterior di sekeliling mulut, faring berotot, sepasang sekum sederhana, sebuah alat penghisap ventral atau asetabulum, ekor serta terdapat sejumlah kelenjar kistogenosa berwarna gelap dan bergranula terletak di bagian lateral tubuh. Serkaria keluar dari dalam siput (Lymnaea sp) sekitar 3-7 minggu setelah infeksi dan dipengaruhi oleh suhu lingkungan. Serkaria aktif berenang dalam air dan menempel pada benda-benda di sekitar permukaan air. Serkaria kemudian melepaskan ekornya dan memproduksi bahan pembungkus kista membentuk metaserkaria (Levine 1990).
Metaserkaria dapat bertahan hidup lebih dari 6 bulan pada suhu optimal 200 C. Hewan terinfeksi melalui termakannya metaserkaria yang terdapat pada rumput atau batang padi. Metaserkaria yang termakan akan mengalami ekskistasi di dalam duodenum dan berubah menjadi cacing muda. Cacing muda bermigrasi dan menembus dinding usus masuk ke rongga peritoneum dalam waktu 24 jam.
Sebagian cacing muda sudah menembus kapsula dan bermigrasi dalam parenkim hati sekitar 4-8 hari setelah infeksi. Cacing tinggal di dalam parenkim hati selama 7 minggu kemudian bermigrasi masuk ke dalam buluh empedu untuk berkembang menjadi cacing dewasa. Cacing F.gigantica dewasa mulai memproduksi telur sekitar 8-10 minggu setelah infeksi (Levine 1990).
Gambar 4 Siklus hidupFasciolasp. Sumber: Bennett 1999
Patogenesis dan Gejala Klinis Fasciolosis
Fasciolosis dapat terjadi secara akut, subakut dan kronis. Fasciolosis akut ditandai dengan adanya infeksi metaserkaria dengan jumlah yang besar dalam jangka pendek. Menurut Mitchell (2007), kasus akut pada umumnya terjadi di akhir musim gugur dan di awal musim dingin sedangkan di daerah tropis biasanya terjadi pada awal musim hujan dan awal musim kemarau. Fasciolosis akut tidak tampak gejala klinis yang jelas, ternak mati mendadak karena perdarahan akibat rusaknya jaringan parenkim hati (Soulsby 1986).
Fasciolosis subakut terjadi pada akhir musim gugur sampai musim semi (Mitchell 2007). Pada kasus ini ditemukan cacing dewasa sebanyak 500-1500 ekor di dalam buluh empedu dan telur cacing di dalam tinja kurang dari 100 (Matthews 1999). Kejadian subakut ditandai dengan adanya gejala klinis berupa ikterus, anemia, penurunan berat badan, edema submandibular (bottle jaw), serta perdarahan akibat dari cacing yang memakan jaringan hati (Soulsby 1986).
Fasciolosis kronis terjadi akibat dari migrasi dan keberadaan cacing dewasa di dalam buluh empedu sehingga menyebabkan kerusakan parenkim hati. Kejadian ini muncul pada musim dingin dan musim semi (Mitchell 2007) dengan jumlah cacing yang ditemukan sekitar 250 ekor dan telur cacing di dalam tinja mencapai 100 (Matthews 1999). Fasciolosis kronis ditandai dengan penurunan nafsu makan, anemia, anoreksia, diare kronis, penurunan berat badan, bottle jaw, cholangitis, dan fibrosis organ hati akibat dari cacing hati dewasa yang hidup dalam buluh empedu (Soulsby 1986).
Pada daerah tropis seperti Indonesia kejadian fasciolosis banyak terjadi di awal musim hujan dan di awal musim kemarau. Hal ini terjadi karena pertumbuhan optimal telur menjadi mirasidium terjadi pada awal musim hujan dan perkembangan di dalam tubuh siput mencapai tahap yang lengkap pada akhir musim hujan. Kemudian pelepasan serkaria terjadi pada awal musim kering saat curah hujan masih cukup tinggi dan menurun seiring dengan penurunan curah hujan.
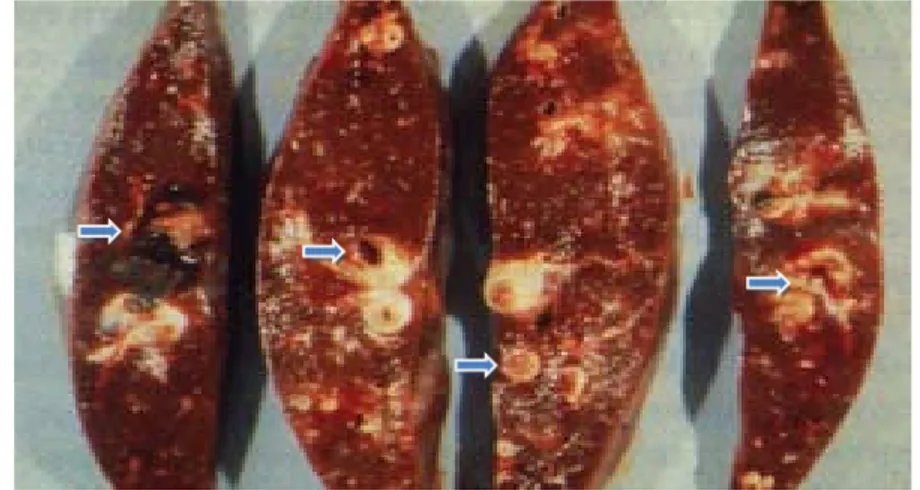
Tingkat kerusakan atau perubahan patologi anatomi pada hewan dipengaruhi oleh jumlah metaserkaria yang termakan oleh ternak, fase perkembangan cacing di dalam hati, dan spesies inang definitif. Perubahan patologi di dalam tubuh inang definitif terjadi akibat adanya migrasi cacing di dalam tubuh. Migrasi diawali dengan penetrasi intestinal (pre hepatik) kemudian sampai ke hati dan akhirnya masuk ke saluran empedu. Migrasi cacing pada organ hati menyebabkan hemoragi, kerusakan parenkim dan buluh empedu. Buluh empedu mengalami peradangan, penebalan dan penyumbatan sehingga terjadi sirosis periportal, peritonitis serta kolesistitis. Secara mikroskopis terjadi perubahan pada struktur jaringan hati. Perubahan tersebut digolongkan menjadi dua kelompok yaitu kelompok perubahan akut dan kronis. Pada stadium akut
tampak adanya perdarahan, degenerasi sel hati, peradangan, proliferasi buluh empedu, infiltrasi sel radang, serta adanya globula leukosit pada mukosa buluh empedu. Pada stadium kronis tampak fokus-fokus radang granuloma, mineralisasi, dan fibrosis (Winarsihet al1996).
Gambar 5 Perubahan anatomi hati sapi yang mengalami fasciolosis. Tanda panah menunjukkan terowongan jalur migrasi
F.gigantica.
Sumber: Copemanet al2008
Diagnosa Fasciolosis
Diagnosa fasciolosis didasarkan pada gejala klinis, pemeriksaan laboratorium dan pemeriksaan post-mortem organ hati untuk melihat adanya F.gigantica di dalam buluh empedu. Pemeriksaan laboratorium yang umum dilakukan adalah pemeriksaan tinja untuk mendeteksi telur F.gigantica, pemeriksaan enzim hati, pemeriksaan hematologi, uji serologi, dan coproantigen atau pemeriksaan antigen dalam tinja (Mitchell 2003).
Metode pemeriksaan tinja yang umum dilakukan untuk mendeteksi telur Fasciola sp adalah metode sedimentasi (Taylor 2007). Metode ini bersifat konvensional dan hanya dapat digunakan untuk infeksi kronis. Telur ditemukan dalam tinja ketika cacing sudah mencapai dewasa dan mulai produksi telur antara 8 sampai 10 minggu setelah infeksi. Metode pemeriksaan tinja memiliki kekurangan karena telur Fasciola sp. diekskresikan dalam waktu yang tidak beraturan dan jumlah telur yang terlalu sedikit dalam tinja akan mempengaruhi hasil diagnosa (Kusumamihardja 1992).
Pemeriksaan enzim hati dilakukan untuk mengukur level enzimaspartate aminotransfarase (AST), glutamate dehydrogenase (GLDH), dan L-gamma glutamyl transferase (GGT) pada sampel darah. Metode ini dapat mendeteksi adanya infeksi akut pada 2-3 minggu setelah infeksi. Jika level enzim AST lebih dari 60 iu/l, level enzim GLD lebih dari 13 iu/l (sapi) dan 10 iu/l (domba), serta level enzim GGT lebih dari 31 iu/l (domba) maka mengindikasikan adanya cacing dewasa di dalam buluh empedu. Pemeriksaan hematologi berupa deferensial leukosit dilakukan untuk menghitung jumlah sel radang eosinofil. Pemeriksaan ini merupakan indikator awal kemungkinan adanya infeksi cacing Fasciola sp. (Mitchell 2003).
Pendekatan alternatif untuk diagnosis fasciolosis adalah dengan uji serologi dan coproantigen. Uji serologi dilakukan untuk mendeteksi adanya antibodi dalam serum menggunakan ELISA. Uji ini dapat mendeteksi adanya infeksi awal pada minggu ke 2 sampai minggu ke 4 setelah infeksi dengan sensitifitas 91 % dan spesifisitas 88 % (Estuningsih et al 2004). Sedangkan coproantigen dilakukan untuk mendeteksi antigen dalam tinja menggunakan Sandwich-ELISA. Uji ini dapat mendeteksi adanya infeksi awal pada minggu ke 5 sampai minggu ke 9 setelah infeksi dengan sensitifitas 95 % dan spesifisitas 91 % (Estuningsihet al2004
Epidemiologi dan Pengendalian Fasciolosis
Fasciolosis merupakan penyakit parasiter yang disebabkan oleh infeksi Fasciola hepatica dan Fasciola gigantica. Cacing F.hepatica tersebar luas di daerah beriklim sedang dan dingin sedangkan F.gigantica tersebar di daerah beriklim tropis seperti Indonesia. Kejadian fasciolosis di Indonesia erat hubungannya dengan kegiatan di persawahan. Sumber utama infeksi adalah akibat memakan batang padi atau tumbuhan lainnya yang mengandung metaserkaria. Infeksi juga dapat terjadi akibat penggunaan tinja ternak ruminansia sebagai pupuk serta pemanfaatan tenaga ternak untuk membajak sawah. Pengendalian fasciolosis yang efektif pada ternak dilakukan dengan cara mengurangi jumlah siput inang antara, pemberian anthelmintika secara periodik, dan manajemen pemeliharaan ternak.
Populasi siput meningkat pada musim penghujan sehingga populasi harus dikendalikan. Menurut Martindah et al (2005) pengendalian populasi siput dapat dilakukan secara biologis, kimia dan mekanis. Pengendalian secara biologis yaitu dengan memelihara itik/bebek sebagai predator dan itik yang terinfeksi cacing Echinostoma sp. Cacing Echinostoma sp yang menginfeksi itik akan memproduksi telur yang akan keluar bersama tinja itik. Telur Echinostoma sp berkembang di lingkungan, menetas mengeluarkan larva mirasidium sebagai kompetitor mirasidum Fasciola sp. untuk memasuki tubuh siput. Secara alami terjadi juga persaingan antara mirasidium Fasciolasp. dengan mirasidium cacing Haplometra cylindricea (cacing paru-paru pada katak) untuk memasuki tubuh siput (Torgersonet al1998).
Pengendalian secara kimia dilakukan dengan pemberian molusida pada musim panas seiring dengan awal musim merumput bagi ternak. Molusida yang dipakai diantaranya adalah sodium pentachlorophenenate/ NaPCP, triklosamide, dan copper sulfat. Pengendalian secara mekanik dilakukan dengan pengeringan saluran irigasi dan habitat siput.
Pengendalian fasciolosis dapat dilakukan dengan pemberian anthelmintika secara periodik untuk membunuh dan mengeluarkan cacing Fasciola sp. dari dalam tubuh ternak. Pemberian anthelmintika sebaiknya dilakukan pada musim kemarau karena sebagian besar siput sudah mati sehingga sisa telur cacing dalam tinja tidak akan menemukan inang antara bila menetas (Martindah et al 2005). Pengobatan ternak disesuaikan dengan bahan aktif anthelmintika yang digunakan. Anthelmintika yang dapat membasmi semua stadium perkembangan cacing Fasciola sp. diberikan sekali setahun yaitu sekitar 6-8 minggu dari panen padi terakhir. Sedangkan anthelmintika yang hanya mampu membunuh cacing dewasa sebaiknya diberikan dua kali setahun yaitu 6-8 minggu dari panen terakhir dan beberapa minggu sebelum musim penghujan tiba. Beberapa anthelmintika yang dapat digunakan adalah triclabendazole, closantel, nitroxynil, albendazole, oxyclozanide, dan clorsulon. Triclabendazole merupakan anthelmintika yang memiliki efektivitas paling tinggi karena dapat membunuh semua stadium perkembanganFasciolasp. dalam tubuh inang definitif (Mitchell 2003).
Kejadian fasciolosis dapat dikurangi dengan penerapan manajemen pemeliharaan ternak yang baik. Beberapa hal yang dapat dilakukan adalah manajeman pemberian pakan, pengembalaan ternak, serta manajemen penggunaan tinja sebagai pupuk. Menurut Martindah et al (2005), sebaiknya ternak diberikan pakan segar yang tidak terendam dalam air. Pengambilan jerami dari sawah sebagai pakan ternak dilakukan dengan pemotongon sekitar 10 cm dari atas permukaan air. Manajemen pengembalaan ternak sebaiknya dilakukan secara rotasi untuk menghindari daerah yang tercemar oleh metaserkaria. Ternak digembalakan di daerah yang tidak berair dan lembab. Menurut Mitchell (2003), penggunaan tinja sebagai pupuk sebaiknya setelah dilakukan dekomposisi supaya telurFasciolasp. sudah mati.
Hati Anatomi Hati
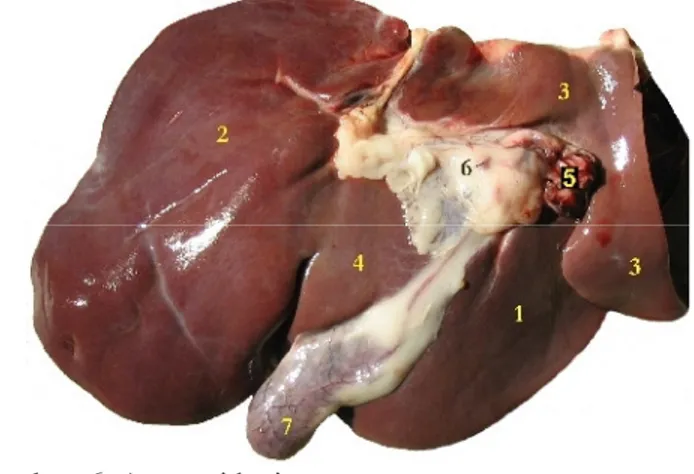
Hati merupakan kelenjar terbesar dalam tubuh yang berada di dalam rongga perut. Pada ruminansia, hati terletak di bawah diafragma pada bagian atas cavum abdominis dan cenderung terletak di sisi sebelah kanan akibat adanya dorongan dari perut besar (Fradson 1992). Hati difiksasi secara erat oleh beberapa ligamentum yaitu ligamentum coronarium hepatis, ligamentum triangulare dextrum dan sinistrum, ligamentum falciniformis hepatis dan ligamentum hepatorenale yang menghubungkan hati dengan ginjal kanan dan caecum. Pada hati terdapat ligamentum teres hepatis berupa jaringan ikat sisa vena umbilicalis yang berjalan dari pusar ke hati (Ressang 1984).
Hati terdiri dari 4 lobus yang terbagi dalam sejumlah lobulus. Lobus hati dibungkus oleh kapsula serosa dan kapsula fibrosa yang memisahkan lobulus satu dengan yang lainnya. Hati mendapat vaskularisasi ganda, yaitu melalui vena porta dan arteri hepatika. Vena porta membawa darah yang berasal dari saluran pencernaan dan pankreas. Darah ini mengandung banyak nutrisi yang akan diolah dan diserap oleh hati. Sedangkan arteri hepatika membawa darah yang mengandung banyak oksigen untuk hati. Darah yang keluar dari hati dibawa melalui vena hepatika menuju vena cava caudalis dan dibawa menuju jantung (Mills 2007).
Gambar 6 Anatomi hati
1.Lobus dexter; 2. Lobus sinister; 3. Lobus caudatus; 4. Lobus quadratus; 5. Vena porta hepatica; 6. Ductus cysticus; 7. Vesica fellea. Sumber: Atlas of Anatomy Veterinary Horse, Ruminant and
Carnivorous.
Histologi Hati
Hati dikelilingi oleh mesotelium berupa kapsula jaringan ikat yang diperluas menjadi glandula dan terbagi menjadi lobus dan lobulus. Lobulus berbentuk silindris dengan panjang beberapa millimeter dan berdiameter 0.8 sampai 2 mm. Setiap lobulus terdiri dari berbagai komponen yaitu sel-sel hati (hepatosit), vena sentralis, sinusoid, cabang-cabang vena porta, cabang-cabang arteri hepatika, sel Kupffer dan kanalikuli biliaris (Ganong 1995).
Sel hati (hepatosit) berbentuk polihedral dengan inti bulat yang terletak di tengah. Sel- sel ini tersusun secara radial ke arah luar vena sentralis. Diantara baris-baris sel hati yang berdekatan terdapat kanalikuli empedu yang dibentuk oleh dua atau lebih membran plasma hepatosit yang berbatasan. Empedu disekresikan ke dalam kanalikuli empedu dibawa ke daerah portal (segitiga Kiernan) dan akhirnya meninggalkan hati melalui duktus hepatikus (Dellmann dan Brown 1992).
Sinusoid hati merupakan suplai intralobular vaskular berupa rongga-rongga di dalam lobus yang alirannya menuju ke vena sentralis. Sinusoid membawa darah dari cabang vena porta dan cabang arteri hepatika. Darah ini bergerak dari perifer lobul menuju ke vena sentralis. Darah arterial mensuplai jaringan ikat hati (stroma) sedangkan darah dari vena portal akan mengalami aksi dari sel-sel parenkim.
Sinusoid diselaputi oleh sel-sel makrofag yang dikenal dengan nama sel Kupffer. Sel-sel ini merupakan bagian terbesar dari sistem makrofag (retikulo endotelial) yang memiliki fungsi fagositik terhadap benda asing serta merontokkan jaringan, termasuk sel-sel merah yang aus atau rusak di dalam hati.
Cabang-cabang vena porta, cabang-cabang arteri hepatik, dan saluran empedu yang kecil bergerak bersama di dalam jaringan ikat pada pertautan dari beberapa lobul hati. Pengelompokan pembuluh-pembuluh tersebut disebut trinitas portal atau triad. Pembuluh limfa terdapat di dalam pembungkus jaringan ikat, jaringan ikat interlobular, jaringan ikat disekitar vena porta, dan jaringan ikat di sekitar vena hepatik (Banks 1986).