PENETAPAN KADAR KAFEIN MINUMAN TEH INSTAN DENGAN METODE SPEKTROFOTOMETRI-UV DERIVATIF
APLIKASI PEAK TO PEAK
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Ilmu Farmasi
Oleh:
Yosepha Henny Ermawati NIM : 038114124
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
Skripsi berjudul
PENETAPAN KADAR KAFEIN DALAM MINUMAN TEH INSTAN MERK X SECARA SPEKTROFOTOMETRI-UV DERIVATIF
METODE PEAK TO PEAK
Oleh:
Yosepha Henny Ermawati NIM : 038114124
Sebagai rasa hormat dan baktiku,
Sebagai rasa hormat dan baktiku,
Sebagai rasa hormat dan baktiku,
Sebagai rasa hormat dan baktiku,
aku persembahkan karya kecil ini kepada:
aku persembahkan karya kecil ini kepada:
aku persembahkan karya kecil ini kepada:
aku persembahkan karya kecil ini kepada:
Bapak dan
Bapak dan
Bapak dan
Bapak dan IIIIbu yang telah melimpahkan kasih sayang
bu yang telah melimpahkan kasih sayang
bu yang telah melimpahkan kasih sayang
bu yang telah melimpahkan kasih sayang dan perhat
dan perhat
dan perhat
dan perhatian
ian
ian
ian
dalam membimbingku
dalam membimbingku
dalam membimbingku
dalam membimbingku
Kakak
Kakak
Kakak
Kakak----kakakku terkasih
kakakku terkasih
kakakku terkasih
kakakku terkasih Mas ”Black” Wawan, Mbak Inggit, si kecil
Mas ”Black” Wawan, Mbak Inggit, si kecil
Mas ”Black” Wawan, Mbak Inggit, si kecil
Mas ”Black” Wawan, Mbak Inggit, si kecil
PRAKATA
Puji dan syukur penulis ucapkan kepada Allah Bapa, karena hanya atas rahmat dan karuniaNya sajalah penulis dapat menyelesaikan penyusunan skripsi ini. Tak lupa pula penulis mengucapkan terima kasih kepada pihak-pihak yang memberikan bantuan baik materiil maupun non materiil.
1. Ibu Rita Suhadi, M.Si., Apt selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Ibu Christine Patramurti, M.Si., Apt. selaku dosen pembimbing yang dengan sabar telah meluangkan waktu untuk membimbing dan memberikan arahan kepada penulis selama penyusunan skripsi ini.
3. Bapak Drs. Sulasmono, Apt selaku dosen penguji yang telah memberikan kritik dan saran untuk skripsi ini.
4. Ibu Dra. M.M. Yetty Tjandrawati, M.Si selaku dosen penguji yang telah memberikan kritik dan saran untuk skripsi ini.
5. Bapak Y. Kristio Budiasmoro selaku dosen pembimbing akademik yang telah membimbing selama masa perkuliahan.
6. Seluruh staf laboratorium kimia: Pak Prapto, Pak Mukmin, Pak Parlan, dan Mas Kunto terima kasih atas bantuannya selama ini.
8. Mbak Devi terima kasih atas diskusi, bantuan, bahan dan arahan yang sangat membantu dalam penyusunan skripsi ini.
9. Untuk “Che-mistry” 2003, terimakasih untuk kebersamaan dan canda tawanya. Life must go on... but friendship never end.
10. Keluarga besar Wisma Rosari: Bapak dan Ibu Djoko Pamungkas.
11. Mbak Dinta terima kasih bahannya, Mas Layli Prasojo terimakasih atas diskusinya, Vera (Ciwa), Mbak Agnes (Kibo), Wenny, Utik, Via, Ipil, Okki, Mbak Sri (I’ie), Agnes (Con-con), Tina, Tika, dan Mbak Esti (Tong-tong), serta teman-teman yang tidak bisa penulis sebutkan satu persatu terima kasih atas bantuannya selama ini
12. Untuk semua anggota P3W, karyawan, dan staff KP3 terima kasih atas kebersamaan dan dukungannya selama ini. Pertemuan ini begitu singkat dan melelahkan, namun terasa manis.
13. Desi dan Lintang (kakak) ”TheThreeMuskenteer” terima kasih atas persahabatan kita yang indah, dukungan, dan sharing selama ini.
Akhirnya penulis menyadari bahwa skripsi ini masih banyak kekurangan. Oleh karena itu penulis menerima masukan dan kritik yang membangun demi tercapainya kesempurnaan karya ini.
Akhir kata, semoga karya ini memberikan manfaat bagi dunia ilmu pengetahuan dan semua pembaca khususnya.
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Yogyakarta, 26 Juli 2007 Penulis
INTISARI
Penetapan kadar kafein minuman teh instan merek X secara spektrofotometri ultraviolet akan terganggu oleh adanya kandungan senyawa lain dalam ekstrak teh, antara lain tanin, teofilin, dan teobromin. Senyawa teofilin dan teobromin akan memberikan serapan maksimum pada daerah panjang gelombang yang berdekatan dengan kafein. Selain itu adanya senyawa tanin akan menyebabkan larutan berwarna sehingga mengganggu pengukuran. Oleh karena itu, dalam penelitian ini dilakukan pengembangan spektrofotometri derivatif metode peak-to-peak dimana kafein dapat dianalisis tanpa perlu dilakukan pemisahan terlebih dahulu.
Penelitian ini merupakan penelitian non eksperimental deskriptif. Penelitian ini dilakukan dengan membuat spektrum serapan normal absorbansi terhadap panjang gelombang, serta membuat spektrum derivatif pertama, kedua, ketiga, dan keempat dari larutan baku dan sampel kemudian ditentukan panjang gelombang peak-to-peak kafein. Metode ini didasarkan pada pengukuran jarak vertikal antara puncak maksimum dan minimum pada panjang gelombang peak-to-peak yang selanjutnya disebut sebagai amplitudo peak-to-peak.
Hasil penelitian menunjukkan kadar kafein dalam minuman teh instan merek X adalah sebesar 13,570 ± 0,058 mg per kemasan, nilai recovery kafein berada pada rentang 95,34%-109,74% dan nilai CV sebesar 1,033%. Dapat disimpulkan bahwa penetapan kadar kafein minuman teh instan merek X secara spektrofotometri ultraviolet derivatif peak-to-peak memberikan akurasi dan presisi yang baik.
ABSTRACT
Determination of caffeine in instant tea brand X using spectrophotometry ultraviolet will be disturbed by other components in extract tea, for example tannin, theophylline, and theobromine. Theophylline and theobromine will give maximum absorbans at near wavelength with caffeine. Tannin make the solution colored which will disturb the measurement. Therefore this research will develop spectrophotometry derivative peak-to-peak method where caffeine can be analyzed without isolation.
This research is descriptive non experimental research. The research has been conducted by creating normal spectrum by plotting absorbance versus wavelength, and also first , second, third, and fourth derivative spectrum of sample and caffeine standard. This method based on measurements vertically distance of maximum and minimum peak at peak-to-peak wavelength next it is called peak-to-peak amplitude.
The result of this research shows that caffeine in instant tea brand X is 13,570 ± 0,058 mg per sachet, range recovery value 95,34%-109,74%, and CV value 1,033%. It can be concluded that determination of caffeine in instant tea brand X by spectrophotometry ultraviolet derivative peak-to-peak gives good accuracy and precision.
DAFTAR ISI
HALAMAN JUDUL ………...………...i
HALAMAN PERSETUJUAN PEMBIMBING………...……...ii
HALAMAN PENGESAHAN………..………....iii
HALAMAN PERSEMBAHAN………..………...iv
PRAKATA………….………..………...v
PERNYATAAN KEASLIAN KARYA……….….………....vii
INTISARI………..…….……….………...viii
ABSTRACT………...ix
DAFTAR ISI………..……...x
DAFTAR TABEL………..…….…xii
DAFTAR GAMBAR………...…xiii
DAFTAR LAMPIRAN………...xiv
BAB I. PENGANTAR………..…….1
A. Latar Belakang...1
1. Permasalahan...2
2. Keaslian Penelitian...3
3. Manfaat Penelitian...3
B. Tujuan Penelitian...3
BAB II. PENELAAHAN PUSTAKA……….……..………...4
A. Teh...4
B. Teh Instan...5
C. Kafein...5
D. Spektrofotometri UV...6
1. Analisis kualitatif...9
2. Analisis kuantitatif...9
E. Metode Derivatif Peak-to-peak...13
F. Validasi Metode Analisis...15
G. Keterangan Empiris...16
BAB III. METODE PENELITIAN……….…………....18
A. Jenis dan Rancangan Penelitian...18
B. Definisi Operasional...18
C. Bahan Penelitian...18
D. Alat Penelitian...19
E. Tata Cara Penelitian...19
F. Analisis Hasil...21
BAB IV. HASIL PENELITIAN DAN PEMBAHASAN…...………...……..23
A. Pemilihan Sampel...23
B. Penyiapan Sampel...24
C. Pembacaan Serapan Kafein...25
D. Penentuan Panjang Gelombang Peak-to-peak...28
E. Pembuatan Kurva Baku Kafein...33
F. Penetapan Kadar Kafein...35
BAB V. KESIMPULAN ………...…………...38
DAFTAR PUSTAKA………...………..39
LAMPIRAN………...……….………...…………41
DAFTAR TABEL
DAFTAR GAMBAR
Gambar 1. Struktur kafein...6
Gambar 2. Diagram tingkat energi elektronik...7
Gambar 3. Instrumen Spektrofotometer berkas ganda...12
Gambar 4. Penurunan spektra normal menjadi spektra derivatif...14
Gambar 5. Analisis kuantitatif metode derivatif...14
Gambar 6. Gugus kromofor kafein...26
Gambar 7. Spektra serapan kafein...27
Gambar 8. Spektra normal gabungan kafein dan sampel...28
Gambar 9. Spektra derivatif pertama gabungan kafein dan sampel...30
Gambar 10. Spektra derivatif kedua gabungan kafein dan sampel...31
Gambar 11. Spektra derivatif ketiga gabungan kafein dan sampel...32
DAFTAR LAMPIRAN
Lampiran 1. Sertifikat analisis kafein...41
Lampiran 2. Teh instan merk X...42
Lampiran 3. Data penimbangan bahan...43
Lampiran 4. Contoh perhitungan kadar larutan baku kafein...44
Lampiran 5. Data optimasi delta panjang gelombang...45
Lampiran 6. Data perhitungan kadar kafein dalam sampel...47
Lampiran 7. Perhitungan Recovery………49
BAB I PENGANTAR
A. Latar Belakang
Minuman teh telah dikenal lama. Sejak dahulu orang menyukai minuman ini karena efek yang ditimbulkan dapat menyegarkan badan. Hal ini disebabkan salah satu kandungan teh, yaitu kafein. Kafein terdapat secara alami dalam tanaman teh dalam bentuk garam alkaloid, dan menurut Sunaryo (1995) kafein dapat memberikan efek sebagai stimulan.
Salah satu cara tradisional untuk menyajikan teh adalah dengan menyeduh serbuk daun teh dengan air panas dengan atau tanpa menambahkan gula. Demi alasan kepraktisan maka produsen minuman ringan mencoba menciptakan produk teh instan yang memudahkan konsumen dalam membuatnya. Produsen teh instan mencantumkan bahwa produknya mengandung ekstrak teh alami, namun tidak mencantumkan kandungan kafein dalam setiap kemasannya. Selain itu untuk mengetahui apakah kandungan kafein dalam setiap kemasan sesuai dengan keputusan Kepala Badan Pengawas Obat dan Makanan Republik Indonesia Nomor HK.00.05.23.3644 yaitu 150 mg dibagi dalam 3 dosis, dan maksimal 50 mg per saji.
HPLC (High Performance Liquid Chromatography) atau KCKT, dimana kadar kafein dalam larutan teh yang ditetapkan secara KCKT lebih besar daripada kadar kafein yang ditetapkan secara spektrofotometri UV. Hal ini terjadi karena pada penetapan kadar kafein dalam larutan teh secara spektrofotometri UV kafein harus diisolasi terlebih dahulu dengan cara ekstraksi. Ekstraksi yang dilakukan kemungkinan kurang efektif untuk mengisolasi kafein secara optimal sehingga kemungkinan belum semua kafein terisolasi. Menurut Alpdopogan, Karabina, and
Sungur (2000) metode derivatif peak-to-peak dapat digunakan dalam menetapkan kadar kafein dalam minuman ringan tanpa melakukan isolasi terlebih dahulu dan dapat memberikan akurasi dan presisi yang baik.
Spektrofotometri derivatif adalah sebuah teknik untuk analisis kuantitatif. Teknik analisis ini relatif lebih mudah dan cepat karena tidak diperlukan pemisahan terlebih dahulu. Metode derivatif peak-to-peak didasarkan pada pengukuran jarak antara dua nilai ekstremum spektra derivatif pada daerah panjang gelombang yang sama antara sampel dan kafein baku.
1. Permasalahan
Menurut keterangan di atas timbul permasalahan yang dapat diteliti yaitu:
a. Berapakah kadar kafein dalam teh instan yang ditetapkan dengan metode spektrofotometri derivatif aplikasi peak-to-peak ?
b. Apakah penetapan kadar kafein dalam teh instan yang dilakukan secara dengan metode spektrofotometri UV derivatif metode aplikasi peak-to-peak
2. Keaslian Penelitian
Penelitian dengan metode spektrofotometri derivatif aplikasi peak-to-peak sudah pernah dilakukan sebelumnya, namun pada penetapan kadar kafein dalam minuman teh instan belum pernah dilakukan. Penelitian yang sudah pernah dilakukan dengan metode spektrofotometri derivatif aplikasi peak-to-peak antara lain penetapan kadar kafein dalam campuran parasetamol, salisilamida, dan kafein (Friamita, 2006), penetapan kadar asam askorbat dalam sayuran (Aydogmus and
Cetin, 2001), dan penetapan kadar kafein dalam minuman ringan (Alpdopogan, Karabina, and Sungur, 2000).
3. Manfaat Penelitian
Manfaat yang diharapkan dari penelitian ini antara lain:
a. Manfaat Metodologis. Penelitian ini diharapkan dapat memberikan sumbangan ilmiah terhadap perkembangan metode spektrofotometri derivatif aplikasi peak-to-peak.
b. Manfaat Praktis. Memberikan kontribusi analisis kuantitatif kadar kafein dalam minuman teh instan dengan metode yang lebih praktis.
B. Tujuan penelitian
Penelitian ini bertujuan untuk mengetahui kadar kafein dalam minuman teh instan yang ditetapkan dengan metode spektrofotometri UV derivatif aplikasi
BAB II
PENELAAHAN PUSTAKA
A. Teh
Daun muda kering dari tanaman Camellia sinensis (Linne) O. Kuntze (Fam. Tehaceae) diolah menjadi minuman teh (Robbers, Speedie, Tyler, 1996). Menurut Trease and Evans (2002) teh mengandung kafein 1-5% dan 10-24 % tanin, serta teobromin, teofilin dan minyak atsiri dalam jumlah kecil.
Teh yang banyak beredar di Indonesia menurut cara pengolahannya dapat dibedakan menjadi:
1. teh hijau, yaitu teh yang dibuat melalui inaktivasi enzim polifenol oksidase di dalam daun teh segar. Metode inaktivasi enzim polifenol oksidase teh hijau dapat dilakukan melalui pemanasan (udara panas) dan penguapan (steam/uap air).
2. teh oolong (semifermentasi), yaitu teh yang diproses melalui pemanasan daun dalam waktu singkat setelah penggulungan. Oksidasi terhenti dalam proses pemanasan, sehingga teh oolong disebut dengan teh semifermentasi. Karakteristik teh oolong berada diantara teh hijau dan teh hitam.
Menurut cara penyajiannya teh dapat dibedakan menjadi:
1. teh celup, yaitu teh yang dikemas dalam kantong dan biasanya dibuat dari kertas.
2. teh seduh, yaitu teh yang dikemas dalam kaleng atau dibungkus dengan pembungkus dari plastik atau kertas.
3. teh instan, yaitu teh berbentuk bubuk yang tinggal diseduh dalam air panas atau air dingin (Anonim, 2005).
B. Teh Instan
Salah satu bentuk minuman teh yang banyak dikonsumsi oleh masyarakat adalah teh instan. Teh instan mengandung ekstrak teh (ekstrak kering) yang dibuat dengan pengeringan semprot (spray drying) seduhan tersebut setelah dikonsentrasikan menjadi padatan 40-50% (Syah, 2006).
Menurut FAO teh instan dapat dibuat langsung dari daun teh yang masih segar kemudian cairan yang didapatkan dari daun segar difermentasikan dan dikeringkan. Cara lain pembuatan teh instan yaitu dengan memfermentasikan daun segar yang telah dimaserasi, kemudian ekstrak dipekatkan dan dikeringkan (Anonim, 1988).
C. Kafein
diuresis, peningkatan ekskresi asam lambung, dan penghambatan kontraksi uterus (Robbers, Speedie, Tyler, 1996).
N N N
N O
H3C
O
CH3
CH3
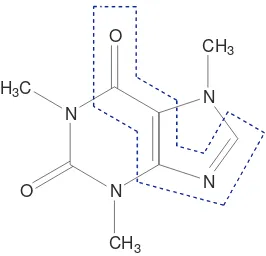
Gambar1. Struktur Kafein 1,3,7-trimetil xantin (Anonim, 1995)
Kafein memiliki sinonim 1,3,7-trimetil xantin. Bobot molekul kafein adalah 194,19 dengan rumus molekul C8H10N4O2. Pemerian kafein adalah berupa
serbuk putih atau bentuk jarum mengkilat; biasanya menggumpal; tidak berbau; rasa pahit. Titik lebur pada 235o-237o. Kafein agak sukar larut dalam air, etanol, sukar larut dalam eter, tetapi mudah larut dalam kloroform, (Anonim, 1995). Lebih larut dalam asam encer (Clarke, 1969).
Kafein dalam 0,1 N HCl, memberikan spektra absorpsi maksimum pada 272 m (A1%, 1 cm 470). Serapan dilambangkan A, serapan jenis (A1% 1 cm) 470 artinya kafein pada konsentrasi 1 g per 100 ml larutan dengan ketebalan cairan 1 cm memberikan nilai serapan sebesar 470 (Watson, 2003).
D. Spektrofotometri UV
spesies molekul mempunyai keadaan energi yang unik dan keadaan terendah elektron disebut dengan ground state. Apabila pada molekul tersebut dikenakan foton yang sesuai dengan perbedaan energi elektron dari keadaan ground state ke tingkat energi yang lebih tinggi dari suatu radiasi elektromagnetik, maka akan terjadi absorbsi energi. Tingkat energi yang lebih tinggi ini dikenal sebagai orbital elektron antibonding. Energi yang dibutuhkan tersebut sesuai dengan persamaan:
λ
Keterangan: E = tenaga foton dalam erg
= frekuensi radiasi elektromagnetik dalam hertz h = tetapan planck (6,624 x 10-34 J/det)
(Christian, 2004)
Karena elektron dalam molekul memiliki tenaga yang tak sama, maka tenaga yang diserap dalam proses eksitasi dapat mengakibatkan terjadinya satu atau lebih transisi tergantung pada jenis elektron yang terlihat (Sastrohamidjojo, 2001).
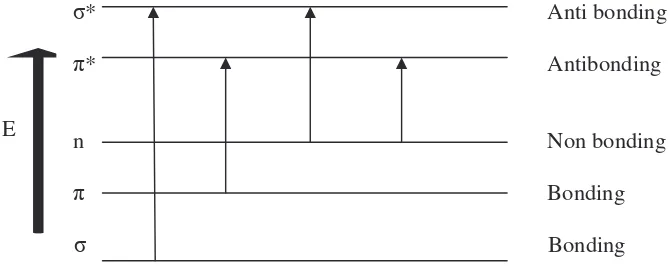
Ada empat tipe transisi elektronik yang mungkin terjadi yaitu *, n *, n *, dan *. Diagram tingkat energi elektron pada tingkat dasar dan keadaan tereksitasi ditunjukkan pada gambar 2.
Eksitasi elektron ( *) memberikan energi yang terbesar dan terjadi pada daerah ultraviolet jauh yang diberikan oleh ikatan tunggal, sebagai contoh pada alkana. Sedangkan eksitasi elektron ( *) diberikan oleh ikatan rangkap dua dan tiga (alkena dan alkuna) juga terjadi pada daerah ultraviolet jauh. Transisi ini menunjukkan pergeseran merah (batokromik) dengan adanya substitusi gugus-gugus yang memberi atau menarik elektron. Pada gugus-gugus karbonil (dimetil keton dan asetaldehid) akan terjadi eksitasi elektron (n *) yang terjadi pada daerah ultraviolet jauh. Eksitasi elektron (n *) ditunjukkan oleh senyawa jenuh yang mengandung hetero atom (oksigen, nitrogen, belerang, atau halogen) memiliki elektron-elektron tak berikatan dan menunjukkan jalur serapan yang disebabkan oleh transisi elektron-elektron dari orbital tak berikatan heteroatom ke orbital anti ikatan * (Sastrohamidjojo, 2001). Disamping itu gugus karbonil juga memberikan eksitasi elektron (n *) menunjukkan pergeseran biru (hipsokromik) yang terjadi pada panjang gelombang 280-290 nm, tetapi eksitasi elektron (n *) adalah forbidden transition karena memberikan harga maks kurang dari 1000,
yaitu maks=12-16 (Mulja dan Suharman, 1995).
Gugus atom yang mengabsorpsi radiasi UV-Vis disebut sebagai kromofor (Mulja dan Suharman, 1995). Kromofor menyatakan gugus tak jenuh kovalen yang dapat menyerap radiasi dalam daerah-daerah ultraviolet dan terlihat. Senyawa yang mengandung kromofor disebut dengan kromogen. Auksokrom adalah heteroatom yang langsung terikat pada kromofor, misal: -OCH3, –Cl, -OH,
dan –NH2 dan memberikan transisi (n *). Auksokrom tidak mengabsorbsi
absorpsi kromofor atau merubah panjang gelombang absorbsi jika terikat dengan kromofor. Auksokrom mempunyai elektron n yang akan berinteraksi dengan elektron pada kromofor. Perubahan spektra dapat dikelompokkan menjadi: a. Bathochromic shif, panjang gelombang absorpsi maksimum berubah ke
panjang gelombang yang lebih panjang. Pergeseran ini juga disebut pergeseran merah.
b. Hypsochromic shift, panjang gelombang absorpsi maksimum berubah ke panjang gelombang yang lebih pendek. Pergeseran ini disebut juga pergeseran biru.
c. Hyperchromis, peningkatan daya serap molar ( ). d. Hypochromism, penurunan daya serap molar ( ).
(Christian, 2004) 1. Analisis Kualitatif
Analisis kualitatif dengan metode spektrofotometri UV-Vis dapat ditentukan dengan dua cara, yaitu:
a. Pemeriksaan kemurnian spektrum UV-Vis dilakukan pembandingan kemiripan spektrum UV-Vis yang ditentukan reference standar.
b. Penentuan panjang gelombang serapan maksimum ( max) didasarkan atas
perhitungan pergeseran panjang gelombang maksimum karena adanya penambahan gugus pada sistem kromofor induk (Mulja dan Suharman, 1995). 2. Analisis Kuantitatif
diteruskan. Keduanya dikenal sebagai absorban (A) tanpa satuan dan transmitan
Keterangan : It = Intensitas radiasi yang ditransmisikan
Io= Intensitas radiasi mula-mula
= daya serap molar
c = konsentrasi larutan dalam (Molar) b = tebal kuvet
Intensitas dari suatu berkas radiasi akan berkurang sehubungan dengan jarak yang ditempuhnya melalui medium penyerap. Intensitas tersebut akan berkurang sehubungan dengan kadar molekul atau ion yang terserap dalam medium tersebut. kedua faktor tersebut menentukan proporsi dari kejadian total energi yang timbul. Penurunan daya radiasi monokromatis yang melalui medium penyerap yang homogen dinyatakan secara kuantitiatif oleh hukum Beer (Anonim, 1995).
c
Keterangan: A = absorbansi a = dayaserap b = tebal larutan (cm)
c = konsentrasi sampel (Molar)
Harga didefinisikan sebagai daya serap molar atau koefisien ekstingsi molar. Harga adalah karakteristik untuk molekul atau ion penyerap dalam pelarut tertentu, pada panjang gelombang tertentu dan tidak bergantung pada konsentrasi dan panjang gelombang lintasan radiasi (Sastrohamidjojo, 2001). Harga dapat diganti dengan a yang disebut sebagai daya serap, bila konsentrasi larutan dalam gram/liter hubungan dan a adalah sebagai berikut:
Dimana M adalah berat molekul larutan (Silverstein, 1991). Harga ε bergantung pada luas penampang senyawa yang terkena radiasi (A) dan probabilitas terjadinya transisi energi yang diserap (P). Hubungan ε dan variabel tersebut adalah sebagai berikut:
= 8,7 x 1019 P A (5) nilai harga P adalah 0,1 sampai 1 yang menunjukkan kekuatan pita absorbansi akibat trasisi elektronik yang diperbolehkan dengan memberikan nilai ε > 104. Sedangkan untuk harga ε < 103 atau harga P < 0,01 merupakan forbidden
transition. Secara umum dapat dikatakan bahwa harga sangat mempengaruhi puncak spektrum suatu zat. Rincian harga ε terhadap puncak spektrum adalah sebagai berikut: 1-10 : sangat lemah; 10-102 : lemah; 102-103 : sedang; 103-104 : kuat; 104-105: sangat kuat (Mulja dan Suharman, 1995).
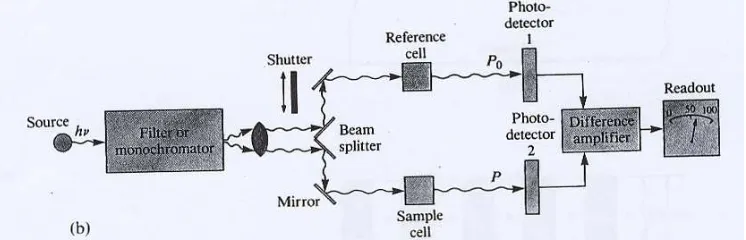
3. Instrumentasi
Untuk pelaksanaan teknik analisis spektroskopik dipakai instrumen sebagai pengukur dan perekam sinyal hasil interaksi molekul dengan radiasi elektromagnetik (Mulja dan Suharman, 1995).
Gambar 3. Instrumen spektrofotometer berkas ganda (Skoog et al, 1994) Bagian-bagian penting dalam spektrofotometer meliputi:
a. sumber radiasi
Sumber radiasi ultraviolet yang kebanyakan digunakan adalah lampu hidrogen dan lampu deuterium yang terdiri atas sepasang elektroda yang terselubung dalam tabung gelas dan diisi dengan gas hidrogen atau deuterium pada tekanan yang rendah. Sumber radiasi yang ideal untuk pengukuran serapan harus menghasilkan spektrum kontinyu dengan intensitas yang seragam pada keseluruhan kisaran panjang gelombang yang sedang dipelajari.
b. monokromator
Monokromator merupakan serangkaian alat optik yang menguraikan radiasi polikromatik menjadi jalur-jalur yang efektif/panjang gelombang tunggalnya.
c. tempat cuplikan
d. detektor
Setiap detektor menyerap energi foton yang mengenainya dan mengubah energi tersebut untuk dapat diukur secara kuantitatif sebagai arus listrik atau perubahan-perubahan panas. Persyaratan penting untuk detektor meliputi: sensitivitas tinggi, waktu respon pendek, stabilitas lama untuk menjamin respon secara kuantitatif, dan sinyal elektronik yang mudah diperjelas (Sastrohamidjojo, 2001).
e. alat pencatat
Fungsi alat pencatat adalah mengubah sinyal elektronik yang dihasilkan oleh detektor menjadi bentuk yang dapat diinterpretasikan (Pecsok et al.,1976).
E. Metode Derivatif Peak-to-Peak
Spektrofotometri derivatif merupakan metode manipulasi spektra pada spektrofotometri ultraviolet dan tampak (Connors,1982). Pada spektrofotometri konvensional, spektrum normal merupakan plot serapan A terhadap panjang gelombang . Spektrum derivatif pertama didapatkan dengan menggambarkan selisih absorban dua panjang gelombang ( A = A 1-A 2) terhadap harga rata-rata
dua panjang gelombang tersebut yang teratur berderet, yaitu:
2 2 1 m
λ λ
λ = + (6)
Gambar 4. Penurunan spektra normal menjadi spektra derivatif a: spektra normal, b: spektra derivatif pertama, c: spektra derivatif kedua, d: spektra derivatif ketiga, e: spektra derivatif keempat (Mulja dan Suharman, 1995)
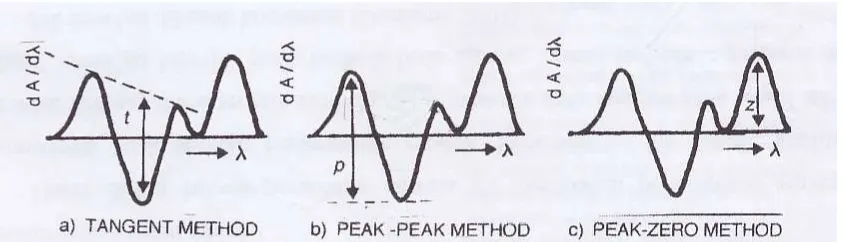
Pada prinsipnya semua spektrum yang dihasilkan oleh semua spektrofotometer UV-Vis jenis apapun dapat diturunkan spektra derivatifnya secara manual maupun otomatis. Metode ini dapat digunakan untuk analisis kuantitatif campuran tanpa pemisahan terlebih dahulu (Willard, 1988). Dalam analisis kuantitatif secara spektrofotometri ada 3 metode yang dapat digunakan antara lain metode tangent, metode peak-peak, dan metode peak-zero (Anonim, 2006).
Gambar 5. Analisis kuantitatif metode derivatif (Anonim, 2006)
peak-to-peak didasarkan pada pengukuran amplitudo peak-to-peak, yaitu jarak vertikal antara puncak maksimum dan puncak minimum dua nilai ekstremum.
F. Validasi MetodeAnalisis
Validasi metode analisis adalah proses terdokumentasi yang menjamin bahwa pelaksanaan metode analisis yang bersifat karakteristik telah sesuai dengan tujuan pelaksanaan (Mulja dan Hanwar, 2003).
Beberapa parameter analisis yang harus dipertimbangkan dalam validasi metode analisis:
1. Kecermatan (accuracy)
Akurasi suatu metode merupakan keterdekatan nilai pengukuran dengan nilai sebenarnya dari analit dari sampel (Suharman dan Hanwar, 2003). Nilai kecermatan ini dinyatakan dengan persen recovery atau perolehan kembali. Akurasi untuk bahan obat dengan kadar kecil 90-110%, untuk kadar obat yang lebih besar 95-105%, untuk bahan baku 98-102%, sedangkan untuk bioanalisis rentang akurasi 80-120% masih dapat diterima. (Mulja dan Hanwar, 2003). 2. Keseksamaan (precision)
tersebut memberikan presisi yang baik, sedangkan untuk bioanalisis CV 15-20% masih dapat diterima (Mulja dan Hanwar, 2003).
3. Linieritas
Linieritas suatu metode analisis dari suatu proedur analisis merupakan kemampuannya untuk mendapatkan hasil uji secara langsung proporsional dengan konsentrasi (jumlah) analit dari sampel. Rentang adalah jarak antar level terbawah dan teratas dari metode analisis yang telah dipakai untuk mendapatkan presisi, linieritas, dan akurasi yang bisa diterima. Persyaratan data linieritas yang bisa diterima jika memenuhi nilai koefisien korelasi (r) > 0,999 (Mulja dan Hanwar, 2003).
4. Spesifisitas
Spesifisitas merupakan kemampuan suatu metode untuk mengukur dengan akurat respon analit diantara seluruh komponen sampel potensial yang mungkin ada dalam matriks sampel (Mulja dan Hanwar, 2003).
G. Keterangan Empiris
Salah satu kandungan dalam teh adalah kafein. Kafein dapat ditetapkan dengan spektrofotometri UV karena mempunyai daerah serapan pada panjang gelombang ultraviolet. Adanya senyawa lain dalam teh seperti: tanin, teobromin, dan teofillin akan mengganggu proses analisis, oleh karena itu dikembangkan spektrofotometri derivatif.
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan penelitian non eksperimental deskriptif karena tidak ada subyek uji yang dimanipulasi atau diberi perlakuan.
B. Definisi Operasional
1. Teh instan adalah teh berbentuk bubuk yang tinggal dilarutkan dalam air panas atau air dingin.
2. Produk teh instan yang digunakan adalah produk merk X yang berbentuk bubuk.
3. Spektrofotometri derivatif merupakan metode manipulatif terhadap spektra pada spektrofotometri ultraviolet dan tampak.
4. Panjang gelombang peak-to-peak adalah panjang gelombang dimana kafein baku dan sampel memberikan nilai maksimum dan minimum pada panjang gelombang yang sama.
5. Amplitudo peak-to-peak merupakan jarak vertikal antara puncak maksimum dan puncak minimum pada panjang gelombang peak-to-peak.
C. Bahan Penelitian
Bahan yang digunakan dalam penelitian ini adalah kafein kualitas
working standar (Brataco Chemika); HCl 0,1 N; KMnO4 1,5%; larutan pereduksi
D. Alat Penelitian
Alat-alat yang digunakan dalam penelitian ini adalah Spektrofotometer UV/Vis Perkin Elmer lambda 20, kuvet, timbangan analitik merk Scaltec, timbangan elektrik merk Mettler, pipet mikroliter merk Soccorex, dan seperangkat alat-alat gelas.
E. Tata Cara Penelitian 1. Pemilihan sampel
Dalam penelitian ini digunakan sampel teh instan merk X yang beredar di pasaran yang menyatakan mengandung ekstrak teh alami.
2. Penyiapan sampel
Dari 20 kemasan sampel teh instan merk X ditimbang kemudian dicari bobot rata-ratanya. Serbuk yang sudah ditimbang dicampur menjadi satu hingga diperoleh sampel yang homogen.
3. Pembuatan larutan stok kafein baku
Kurang lebih 10 mg kafein baku ditimbang secara seksama, larutkan dalam 100 ml HCl 0,1 N.
4. Pembacaan serapan kafein
Pipet 0,300 ml; 0,450 ml; 0,600 ml larutan stok kafein baku, encerkan dalam labu ukur 10 ml. Baca serapannya pada panjang gelombang 250-310 nm dengan selisih panjang gelombang 2 nm.
a. Penentuan spektra kafein standar. Pipet 2,0 ml larutan stok baku kafein, encerkan dalam 10 ml 0,1 N HCl. Ukur serapannya pada panjang gelombang 250-310 nm.
b. Penentuan spektra sampel. Kurang lebih 2 g sampel ditimbang seksama, larutkan dalam 25 ml aquades. Pipet 10,0 ml masukkan ke dalam labu 50 ml. Tambahkan 5 ml larutan KMnO4 1,5%, diamkan selama 5 menit.
Tambahkan 10 ml larutan pereduksi, lalu tambahkan 1 ml larutan H3PO4 dan
tambahkan dengan aquades sampai batas. Ukur serapannya pada panjang gelombang 250-310 nm.
c. Penentuan panjang gelombang peak-to-peak. Spektra serapan baku dan serapan sampel dibuat derivat pertama hingga keempat dengan interval panjang gelombang 2 nm. Dari spektrum derivatif kafein baku dan sampel ditentukan panjang gelombang peak-to-peak.
6. Pembuatan kurva baku kafein
a. Pembuatan seri konsentrasi larutan baku kafein. Dari larutan stok kafein pipet 1,750 ml; 2,000 ml; 2,250 ml; 2,500 ml; dan 3,000 ml. Masing-masing diencerkan dengan HCl 0,1 N hingga volumenya tepat 10 ml.
b. Pembuatan kurva baku kafein. Seri konsentrasi larutan baku dibaca serapannya dan dibuat spektra derivatif pertama hingga keempat, lalu hitung jarak vertikal antara puncak maksimum dan puncak minimum pada panjang gelombang
persamaan y=b(x)+a, dimana x adalah konsentrasi kafein dan y adalah amplitudo
peak-to-peak.
7. Pembuatan stok kafein baku adisi
Timbang kurang lebih kafein 50 mg kafein secara seksama. Larutkan dalam 50 ml HCl 0,1 N. sehingga didapatkan konsentrasi kafein sebesar 0,1% b/v. 8. Penetapan kadar kafein dalam sampel
Timbang kurang lebih 4 g sampel secara seksama, larutkan dalam 50,0 aquades. Pipet 10,0 ml masukkan dalam labu 50 ml. Tambahkan 5 ml KMnO4
1,5% diamkan selama 5 menit. Tambahkan 10 ml larutan pereduksi, kemudian 1 ml H3PO4, larutan ini dinamakan larutan A. Tambahkan aquades sampai 50 ml,
larutan ini dinamakan larutan B. Baca serapan larutan B, lalu buat derivat keempat. Hitung amplitudo pada panjang gelombang peak-to-peak, lalu masukkan ke dalam persamaan regresi. Kadar kafein yang terukur dalam larutan B diberi notasi kafein B. Ke dalam larutan A tambahkan 0,250 ml larutan stok kafein baku adisi, kemudian encerkan sampai tanda. Hitung pada panjang gelombang peak-to-peak lalu masukkan ke dalam persamaan regresi. Kafein yang terukur dalam larutan C kemudian diberi notasi kafein C. Selisih kafein yang ditambahkan ditunjukkan dengan notasi kafein (C-B).
F. Analisis Hasil
1. Kadar kafein
Kadar kafein dalam sampel diukur dari jumlah kafein total dalam larutan B dan ditentukan oleh nilai (X ±SE)
2. Validitas metode
Validitas metode yang digunakan dalam penetapan kadar kafein dalam teh instan secara spektrofotometri derivatif metode peak-to-peak ditentukan oleh parameter berikut:
a. Akurasi
Akurasi metode analisis dinyatakan dengan nilai recovery atau perolehan kembali yang diukur dari kadar terukur dibandingkan kadar sebenarnya dikalikan 100%.
BAB IV
HASIL DAN PEMBAHASAN
A. Pemilihan Sampel
Pada penelitian ini akan ditetapkan kadar kafein dalam produk minuman teh instan. Produk minuman teh instan yang digunakan adalah minuman teh instan berbentuk serbuk yang beredar di Yogyakarta, memiliki nomor registrasi dan mencantumkan kandungan ekstrak teh pada kemasannya. Produk yang memiliki nomor registrasi tertentu sebagai ijin edar, yaitu : MD. 650110122007 menunjukkan bahwa produk tersebut merupakan produk yang diproduksi di Indonesia. Dengan mencantumkan kandungan ekstrak teh alami diasumsikan bahwa dalam sampel terkandung kafein, karena secara alami teh mengandung kafein.
Produk merek X adalah produk teh instan yang dipilih karena produk merek X merupakan salah satu produk teh instan yang banyak dikonsumsi oleh masyarakat, selain itu produk merek X memiliki nomor registrasi dan mencantumkan kandungan ekstrak teh pada kemasannya.
B. Penyiapan sampel
Tanin merupakan komponen yang paling banyak terkandung dalam teh, yaitu sebesar 10-24 % (Trease and Evans, 2002) dan mempunyai struktur yang paling kompleks terdiri dari molekul karbon, hidrogen, dan oksigen (CxHyOz).
Adanya tanin dapat mengganggu pembacaan absorbansi karena senyawa tanin akan menyebabkan larutan sampel berwarna coklat pekat, oleh karena itu senyawa tanin harus dihilangkan terlebih dahulu dengan reaksi reduksi oksidasi (redoks).
Senyawa tanin yang tersusun atas molekul karbon, hidrogen, dan oksigen dioksidasi menggunakan larutan kalium permanganat (KMnO4).
Senyawa-senyawa mangan(VII) mengandung ion manganat(VII) atau permanganat (MnO4–
) merupakan oksidator yang kuat (Vogel, 1979). Dengan adanya ion permanganat (MnO4-) tanin (CxHyOz) dioksidasi menjadi CO2 dan H2O.
Oksidator yang digunakan untuk mengoksidasi tanin yaitu KMnO4 harus berlebih
supaya benar-benar yakin bahwa semua tanin sudah teroksidasi. Kelebihan KMnO4 ini ditandai dengan adanya warna ungu dari KMnO4 setelah larutan
dicampur selama 5 menit. Hal ini menunjukkan bahwa ada sisa KMnO4 yang
tidak bereaksi dengan tanin karena tanin sudah teroksidasi semua.
Kelebihan KMnO4 ini harus dihilangkan dengan menggunakan larutan
pereduksi. Larutan pereduksi yang digunakan berisi KSCN dan Na2SO3. Dalam
suasana asam KSCN dan Na2SO3 ini mampu mereduksi ion permanganat menjadi
Oksidasi : CxHyOz a CO2 + b H2O + n e x 3
Reduksi : MnO4- + 4H+ + 3 e MnO2 + 2H2O x n
Mn2+. Penambahan asam lemah, yaitu asam fosfat bertujan untuk memberikan suasana asam dalam larutan sehingga reaksi reduksi terhadap ion permanganat dapat dilaksanakan.
Reaksi yang terjadi adalah sebagai berikut: Reduksi dengan KSCN
Ion sulfit (SO32-) merupakan zat pereduksi yang kuat yang akan
mereduksi MnO4-.
Reduksi dengan Na2SO3:
MnO2 yang terbentuk berupa endapan dan akan menyebabkan larutan menjadi
coklat, untuk menghilangkan MnO2 ini digunakan asam phosphat. Asam phosphat
ini akan memberikan suasana asam yang menyebabkan terjadinya reaksi reduksi MnO2 menjadi ion Mn2+.
6MnO2 + 4H3PO4 2Mn3(PO4)2 + 6H2O + 3O2 (12)
Ion Mn2+ selanjutnya akan membentuk garam Mn3(PO4)2 yang larut dalam air
(Vogel, 1969) sesuai dengan persamaan 12 sehingga larutan menjadi jernih. Oksidasi : SCN - + 4H2O SO42- + CN- + 8H+ + 6e x 6
2 CN - + 4 H2O 2CO2 + N2 + 8 H+ + 10e x 3
Reduksi : MnO4- + 4H+ + 3 e MnO2 + 2H2O x 22
22MnO4- + 6SCN- + 16H+ 22MnO2 + 6SO42-+ 6CO2 + 3 N2 + 8H2O (10)
Oksidasi : SO32- +H2O SO42- + 2H+ + 2e- x 3
Reduksi : MnO4- + 4H+ + 3 e MnO2 + 2H2O x 2
N N N
N O
H3C
O
CH3
CH3
C. Pembacaan Serapan Kafein
Spektra serapan dibuat dengan cara melakukan pembacaan serapan pada panjang gelombang 250 nm sampai dengan panjang gelombang 310 nm, dengan selisih panjang gelombang pengamatan 2 nm. Selisih panjang gelombang 2 nm adalah hasil optimasi, dimana pada selisih panjang gelombang tersebut didapatkan panjang gelombang peak-to-peak yang jelas. Pembacaan serapan dilakukan pada panjang gelombang 250-310 nm, karena menurut Clarke (1969) kafein dalam HCl 0,1 N mempunyai serapan maksimal pada panjang gelombang 272 nm. Aquades memberikan serapan pada panjang gelombang 190 nm, maka panjang gelombang 250 nm sebagai batas bawah pengamatan tidak akan mengganggu serapan kafein.
Spektra serapan kafein dapat diamati pada panjang gelombang UV karena kafein dapat menyerap radiasi sinar UV. Hal tersebut dikarenakan kafein memiliki gugus kromofor yang ditunjukkan pada gambar 6. Gugus kromofor yang dimiliki kafein mengandung ikatan rangkap yang menyediakan elektron pada orbital yang mudah tereksitasi ke tingkat energi yang lebih tinggi yaitu * apabila dikenai radiasi sinar UV yang memiliki energi yang sesuai dengan energi yang dibutuhkan untuk terjadinya eksitasi.
Penentuan panjang gelombang serapan maksimal dapat digunakan untuk analisis kualitatif (data sekunder) pada spektrofotometri ultraviolet. Dalam Farmakope Indonesia edisi IV disebutkan bahwa pengujian panjang gelombang serapan maksimum mempunyai makna jika serapan maksimum tersebut tepat atau dalam batas 2 nm dari panjang gelombang yang ditentukan (Anonim, 1995).
Spektrum serapan kafein dibuat 3 seri kadar, yaitu 0,3.10-3 % b/v; 0,4.10
-3
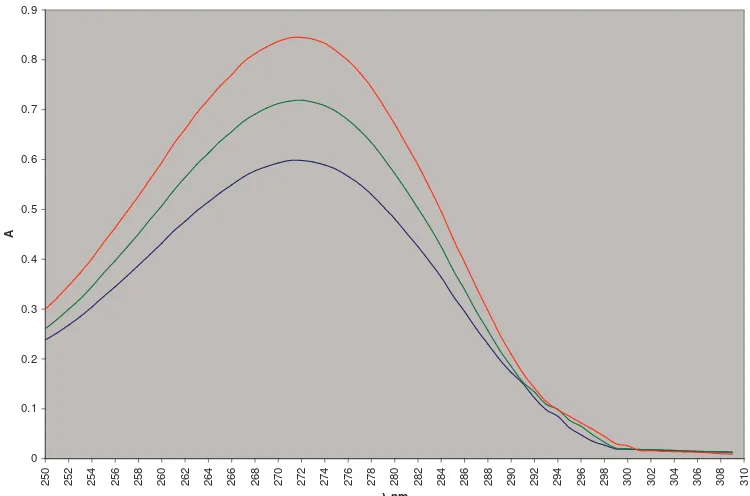
% b/v; dan 0,5.10-3% b/v. Digunakan ketiga konsentrasi tersebut dengan tujuan untuk mengetahui apakah pada kenaikan konsentrasi senyawa yang dimaksud akan memberikan serapan maksimum pada panjang gelombang yang sama. Ketiga konsentrasi tersebut menunjukkan serapan maksimum pada panjang gelombang 271,9 nm, seperti ditunjukkan pada gambar 7.
0
Gambar 7. Spektra serapan kafein ( max = 271,9 nm)
Menurut Clarke (1969) spektrum serapan ultraviolet kafein dalam HCl 0,1 N memiliki serapan maksimum pada 272 nm. Dalam penelitian ini tidak terjadi penyimpangan dan masih memenuhi persyaratan yang tercantum dalam Farmakope Indonesia edisi IV. Hal ini membuktikan bahwa senyawa yang digunakan adalah kafein.
D. Penentuan Panjang Gelombang Peak-to-Peak
Dalam analisis kuantitatif spektrofotometri derivatif peak-to-peak
dilakukan pengamatan panjang gelombang peak-to-peak terlebih dahulu. Sebelum dilakukan derivatisasi spektra, dilakukan pengamatan spektra normal kafein baku dan sampel.
-0.5 0 0.5 1 1.5 2 2.5 3 3.5 4 4.5
250 255 260 265 270 275 280 285 290 295 300 305 310
(nm)
A
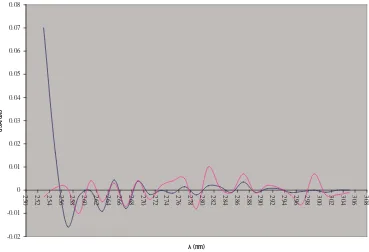
Selisih panjang gelombang yang digunakan pada pengamatan ini adalah 2 nm karena pada selisih panjang gelombang inilah didapatkan pengamatan panjang gelombang peak-to-peak yang optimal.
Pada spektra sampel terlihat spektra yang tidak berbentuk kerucut, hal ini disebabkan adanya senyawa-senyawa lain dalam sampel yang berasal dari kandungan ekstrak teh antara lain teofillin dan teobromin yang juga memiliki serapan pada daerah panjang gelombang pengamatan. Menurut Clarke (1986) teofillin dalam larutan asam mempunyai serapan maksimum pada panjang gelombang 270 nm, sedangkan teobromin dalam larutan asam mempunyai serapan maksimum pada panjang gelombang 272 nm. Kedua senyawa tersebut mempunyai daerah panjang gelombang serapan maksimum yang berdekatan dengan daerah panjang gelombang serapan maksimum kafein yang akan menyebabkan peningkatan absorbansi total. Absorbansi total adalah penjumlahan absorbansi masing-masing konstituen penyerap pada larutan (Day and
Underwood, 1980).
-0.35 -0.3 -0.25 -0.2 -0.15 -0.1 -0.05 0 0.05 0.1
250 260 270 280 290 300 310
(nm)
d
A
/d
Gambar 9. Spektra derivatif pertama gabungan kafein dan sampel Keterangan: kafein ( ), sampel ( )
-0.14 -0.12 -0.1 -0.08 -0.06 -0.04 -0.02 0 0.02 0.04 0.06 0.08
250 255 260 265 270 275 280 285 290 295 300 305 310
(nm)
d
2
A
/d
2
Gambar 10. Spektra derivatif kedua gabungan kafein dan sampel Keterangan: kafein ( ), sampel ( )
-0.02
Gambar 11. Spektra derivatif ketiga gabungan kafein dan sampel Keterangan: kafein ( ), sampel ( )
-0.03 -0.025 -0.02 -0.015 -0.01 -0.005 0 0.005 0.01
252 254 256 258 260 262 264 266 268 270 272 274 276 278 280 282 284 286 288 290 292 294 296 298 300 302 304 306
(nm)
d
4
A
/d
4
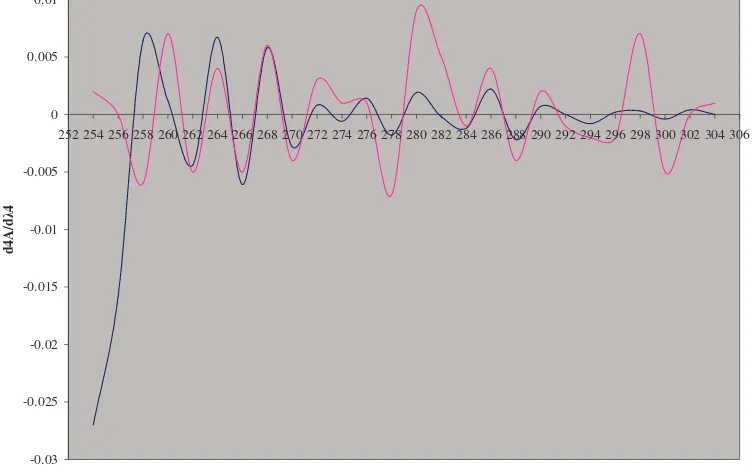
Gambar 12. Spektra derivatif keempat gabungan kafein dan sampel Keterangan: kafein ( ), sampel ( )
Pada spektra derivatif keempat terdapat spektra berhimpitan satu sama lain secara total dan menghasilkan puncak maksimum pada panjang gelombang 268 nm, dan puncak minimum pada 270 nm. Panjang gelombang inilah yang disebut dengan panjang gelombang peak-to-peak dan selanjutnya digunakan pengamatan amplitudo peak-to-peak.
E. Pembuatan Kurva Baku Kafein
baku menyatakan hubungan linier antara konsentrasi dan amplitudo peak-to-peak. Sebagai parameter linieritasnya digunakan koefisien korelasi (r). Koefisien korelasi menunjukkan konsentrasi dan amplitudo. Dalam penelitian ini nilai r yang digunakan adalah nilai r yang lebih besar dari nilai r tabel untuk lima data dengan derajat bebas (db) = 3, yaitu sebesar 0,878 (pada taraf kepercayaan 95%).
Dari replikasi yang dilakukan sebanyak 3 kali, dapat dilihat bahwa nilai r yang diperoleh semuanya lebih besar dari nilai r tabel, hal ini menunjukkan persamaan kurva baku tersebut mempunyai korelasi yang baik sehingga dapat digunakan untuk menghitung kadar kafein.
Tabel I. Data persamaan kurva baku kafein
Replikasi 1 Replikasi 2 Replikasi 3
konsentrasi
F. Penetapan Kadar Kafein
Pada penetapan kadar kafein dalam sampel, dilakukan preparasi sampel yang bertujuan untuk menghilangkan senyawa tanin yang dapat mengganggu pembacaan absorban. Selanjutnya spektrum serapan sampel dibuat derivatif keempat, dan pada panjang gelombang peak-to-peak, yaitu pada panjang gelombang 268 nm sebagai puncak maksimum dan 270 nm sebagai puncak minimum kemudian dihitung amplitudonya. Nilai amplitudo yang terukur dihitung sebagai nilai y yang kemudian dimasukkan ke dalam persamaan kurva baku replikasi pertama, yaitu y = 6,29209 (x) – 0,11106 sehingga didapatkan kadar kafein dalam larutan.
Perhitungan kadar kafein dari keenam replikasi dimana setiap replikasi dilakukan duplo didapatkan hasil perhitungan sebagai berikut:
Tabel II. Data Perhitungan Kadar kafein
1 13,87079 VI
2 13,64265
Kadar rata-rata = 13,57067 SE = 0,05832
Dari data di atas dapat dilihat bahwa dengan spektrofotometri derivatif peak-to-peak didapatkan kadar kafein rata-rata perkemasan sebesar 13,570 ± 0,058 mg.
Untuk memperhitungkan nilai recovery pada larutan sampel ditambahkan larutan kafein baku sebagai adisi dengan konsentrasi yang telah diketahui. Dari hasil enam kali replikasi, dimana masing-masing replikasi dilakukan duplo didapatkan hasil recovery sebagai berikut:
Tabel III. Data perhitungan recovery dan CV
Replikasi Selisih Kafein (C-B) Recovery (%) (mg / 50 ml larutan)
Rentang recovery = 95,34% - 109,74% Rata-rata kafein (C-B) terukur = 0,25663
CV = 1,033%
Salah satu parameter validitas metode yang digunakan yaitu akurasi, dinyatakan dengan nilai recovery atau perolehan kembali. Berdasarkan data di atas rentang recovery yang diperoleh adalah 95.34%-109,74 %. Nilai ini memenuhi untuk persyaratan nilai recovery yang baik untuk sampel dengan kadar kecil yaitu 90-110% (Mulja dan Hanwar, 2003). Hasil ini menunjukkan bahwa metode yang digunakan memiliki akurasi yang baik. Parameter validitas metode presisi dinyatakan dengan nilai CV (Coefficient of Variation).
BAB V KESIMPULAN
1. Kadar kafein dalam minuman teh instan merek X adalah sebesar 13,570 ± 0,058 mg per kemasan dan masih dalam batas yang ditentukan oleh BPOM, yaitu kurang dari 50 mg per saji dan maksimal 150 mg per hari.
DAFTAR PUSTAKA
Aldopogan, Guzin., Karabina, Kadir, and Sungur, Sidika., 2000, Derivatif Spechtrophotometric Determination of Caffein in Some Beverages, Turk Journal Chemistry, 26, 295-302
Anonim, 1986, Clarke’s Isolation and Identification of Drugs, Second Edition, 254, The Pharmaceutical Press, London
Anonim, 1988, Tea Processing, Agricultural Services Bulletin,26, Compiled by J. Werkhoven, Food and Agricultural Organization, Italia
Anonim, 1990, Official Methods of Analysis, 15th Edition, 753, Edited by Kenneth Helrich, Association of Official Analytical Chemistry Inc., USA.
Anonim, 1995, Farmakope Indonesia, Edisi IV, 254, Departemen Kesehatan Republik Indonesia, Jakarta
Anonim, 2003, United States of Pharmacopeia, 26thEd, New York, U.S.A, 2442. Anonim, 2005, Teh, http//id.wikipedia.org/wiki/Teh. Diakses pada 13 Maret 2007
Anonim,2006,http//www.iupac.org/publications/analytical_compendium/Cha10se c352.pdf, Diakses pada 27 Maret 2006.
Aydogmus, Z., Cetin, S.M., Uzgur, M.U., 2001, Determination of Ascorbic Acid in Vegetables by Derivative Spectrophotometry, Turk Journal Chemistry, 26, 697-704 oleh R. Sendoro, Edisi 4, 417-419, Erlangga, Jakarta
Mulja, M., Suharman, 1995, Analisis Instrumental, 19-61, Penerbit Erlangga, Surabaya
Mulja, M., dan Hanwar, D., 2003, Prinsip-Prinsip Cara Berlaboratorium yang Baik (Good Laboratory practice), Majalah Farmasi Airlangga, Vol III, No.2, 71-76
Pecsok, R.L., Shields, L.D., Cairns, T., dan Mc. William, I.G., 1976, Modern Methods of Chemycal Analysis, 2nd Ed, 148-158, Jhon Wiley and Sons, New York
Robbers, E. James; Speedie, K. Marilyn; Tyler, E. Vavro, 1996, Pharmacognosy and Biotechnology, 182-185, Williams & Wilkins, USA
Sartondo, T. R., 2003, Perbandingan Metode Spektrofotometri UV dan HPLC (High Performance Liquid Chromatography) pada Penetapan Kadar Kafein dalam Larutan Teh, Skripsi, Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta
Sastrohamidjojo, H., 2001, Spektroskopi, 1-43, Liberty, Yogyakarta
Silverstein, R.M., 1991, Spectrometric Identification of Organic Compound, 5th Ed, 289-294, John Wiley and Sons. Inc., Singapura
Skoog, West, and Holler, 1994, Analytical Chemistry, 6th Edition, 424, Saunders College Publisher, Philadelphia
Vogel, 1979, Textbook of Macro and Semimicro Qualitative Inorganic Analysis, 114-116, Longman Group Limited, London
Watson, D.G., 2003, Pharmaceutical Analysis, 79, Churchill Livingstone, British Willard, H.H., Merrit, Jr., L.L., Dean, J.A., and Settle Jr., F.A., 1988,
Lampiran 2. Teh instant merk X
Komposisi:
Gula, ekstrak teh alami, aspartame 20 mg/sachet, perasa jasmin
Lampiran 3. Data Penimbangan Bahan
Data Penimbangan Bahan a. Kafein baku
Replikasi 1 : 0,01030 gram Replikasi 2 : 0,01082 gram Replikasi 3 : 0,01034 gram
b. Data Penimbangan Sampel
Lampiran 4. Contoh perhitungan kadar larutan baku kafein
Contoh perhitungan kadar larutan baku: a. Skema pembuatan
Kurang lebih 10 mg kafein ditimbang secara seksama
larutkan dalam 100 ml HCl 0,1 N
Pipet 1,750 ml; 2,000 ml; 2,250 ml; 2,500 ml; dan 3,000 ml
Encerkan dengan HCl 0,1 N hingga volumenya tepat 10 ml
b. Perhitungan seri kadar kafein
Bobot kafein hasil penimbangan = 0,01030 gram
Kadar kafein dalam larutan = b v
Lampiran 5. Data optimasi delta panjang gelombang Data optimasi panjang gelombang d
a. Derivatif pertama
250 260 270 280 290 300 310
(nm)
250 260 270 280 290 300 310
(nm)
d
A
/d
b. Derivatif keempat
260 262 264 266 268 270 272 274 276 278 280 282 284 286 288 290 292 294 296 298 300 302 304 306 308
(nm)
Tidak ditemukan panjang gelombang peak-to-peak. d = 2 nm
252 254 256 258 260 262 264 266 268 270 272 274 276 278 280 282 284 286 288 290 292 294 296 298 300 302 304 306
Data perhitungan kafein a. Skema pembuatan
Timbang kurang lebih 4 gram sample secara seksama
Larutkan dengan aquades hingga 50,0 ml
Pipet larutan sebanyak 10,0 ml lalu masukkan dalam labu ukur 50 ml
Tambahkan larutan KMnO4 1,5% sebanyak 5 ml, diamkan selama 5 menit.
Tambahkan larutan pereduksi (KSCN dan Na2SO3) sebanyak 10 ml
Tambahkan 1 ml H3PO4
Encerkan dengan menambahkan aquades sampai tanda
b. Perhitungan kadar kafein terukur
Persamaan kurva baku; Y = 6,29209 (x) – 0,11106 = 4,892056 mg dalam 3,99965 gram sampel Kafein tiap sachet
= BobotRata rataPenimbanganTiapKemasan
Replikasi
Amplitudo Larutan B
Jumlah kafein total Larutan B
Kafein (mg per kemasan)
1 1 0,006938 4.688427 13,28789
2 0,011250 4.859774 13,77352
2 1 0,010875 4.844874 13,73287
2 0,011875 4.884606 13,84549
3 1 0,008438 4.748026 13,45772
2 0,007000 4.690911 13,29583
4 1 0,008750 4.760442 13,48670
2 0,009375 4.785275 13,55706
5 1 0,009063 4.772858 13,50143
2 0,008125 4.735610 13,39606
6 1 0,012063 4,892,056 13,87079
2 0,009938 4,809,700 13,64265
Analisis dari data tersebut:
X = 13,57067 mg per kemasan SD = 0,202038
SE = 0,05832
Lampiran 7. Perhitungan Recovery
a. Skema Pembuatan
Timbang kurang lebih kafein 50 mg kafein secara seksama
Larutkan dalam 50 ml HCl 0,1 N
Persiapkan larutan B sampel
Pipet larutan kafein adisi sebanyak 0,250 ml, tambahkan pada larutan B
Kemudian larutan ini disebut larutan C
b. Perhitungan kadar kafein sebenarnya Bobot kafein hasil penimbangan : 50,01 mg Kafein yang ditambahkan :
ml
Replikasi Kafein (C-B) Perhitungan Recovery
2 0,26323
d. Perhitungan Coefficient of Variancy (CV)
Replikasi Selisih Kafein (C-B) (mg / 50 ml larutan)
1 1plo 0,25578
2plo 0,25576
2 1plo 0,25329
2plo 0,26323
3 1plo 0,26074
2plo 0,24833
4 1plo 0,25580
2plo 0,23840
5 1plo 0,25329
2plo 0,25329
6 1plo 0,26729
2plo 0,27440
Rata-rata kafein (C-B) terukur = 0,25663 SD = 0,00918
SE = 0,00265 CV = 1,033%
Rata-rata = 0,25663 SD = 0.00918 SE =
n SD
SE = 0.002650
273.5 0.002 274 -0.044
BIOGRAFI PENULIS
Penulis skripsi berjudul “Penetapan Kadar Kafein Minuman Teh Instan dengan Metode Spektrofotometri-UV Derivatif Aplikasi Peak-to-Peak ” bernama lengkap Yosepha Henny Ermawati. Penulis dilahirkan di Cilacap pada tanggal 10 Maret 1985 sebagai anak bungsu dari tiga bersaudara dari pasangan Amandus Kartono dan Maria Christina Sri Widyanti.