ABSTRAK
Senyawa fenolik yang terkandung dalam tanaman, khususnya asam fenolat dan flavonoid, telah diketahui memiliki aktivitas antioksidan yang dapat menghambat radikal bebas dan peroksidasi lipid. Kemukus (Piper cubeba L.) merupakan salah satu tanaman dari famili Piperaceae yang telah diketahui memiliki berbagai kandungan fitokimia yang memiliki potensi sebagai antioksidan.
Menurut hasil penelitian Nahak dan Sahu (2011), daun kemukus memiliki kandungan fitokimia berupa alkaloid, glikosida, steroid, flavonoid, tanin, dan antrakuinon. Flavonoid merupakan salah satu senyawa fenolik utama yang bersifat kurang polar. Etil asetat dapat menarik senyawa yang bersifat kurang polar sehingga dapat digunakan sebagai penyari untuk mengambil kandungan flavonoid yang ada dalam daun kemukus secara optimal.
Tujuan dari penelitian ini adalah untuk mengetahui kandungan fenolik total dan aktivitas antioksidan daun kemukus yang diekstrak dengan metanol dan difraksinasi dengan etil asetat. Kandungan fenolik total diukur dengan metode Folin-Ciocalteu, sedangkan aktivitas antioksidan diukur dengan metode FTC (Ferric Thiocyanate) dan TBA (Thiobarbituric Acid) untuk mengetahui kemampuan penghambatan peroksida pada tahap pertama dan kedua peroksidasi lipid.
Hasil penelitian menunjukkan bahwa kandungan fenolik total yang terdapat dalam fraksi etil asetat ekstrak metanol daun kemukus sebesar 155,157 ± 5,642 mg ekivalen asam galat per gram sampel. Aktivitas antioksidan fraksi etil asetat ekstrak metanol daun kemukus yang ditunjukkan dalam persen penghambatan peroksidasi lipid diukur dengan metode FTC dan TBA secara berturut-turut sebesar (9,378 ± 0,263)% dan (90,942 ± 0,750)%.
ABSTRACT
Phenolic compound contained in plants, especially phenolic acid and flavonoid, has been known to have antioxidant activity which can inhibit free radical and lipid peroxidation. Cubeb (Piper cubeba L.) is a plant in Piperaceae family which has been known to have some phytochemical content that can exhibit potential antioxidant activity.
According to the research by Nahak and Sahu (2011), Cubeb leaves have some phytochemical compounds such as alkaloid, glycoside, steroid, flavonoid, tannin, and anthraquinon. Flavonoid is one of major phenolic compound which is less polar. Ethyl acetate can extract less polar compound, therefore ethyl acetate can be used as an extractor to extract flavonoid contained in cubeb leaves optimally.
The aim of this research were to measure total phenolic content and antioxidant activity from cubeb leaves extracted by methanol and fractionated by ethyl acetate. Total phenolic content were measured by Folin-Ciocalteu method, meanwhile antioxidant activity were measured by FTC (Ferric Thiocyanate) method and TBA (Thiobarbituric Acid) method to evaluate the percent inhibition of peroxide in the first and second stage of lipid peroxidation.
The results showed that total phenolic content in ethyl acetate fraction of methanol extract of cubeb leaves was 155.157 ± 5.642 mg Gallic Acid Equivalents (GAE). Antioxidant activity of ethyl acetate fraction of methanol extract of Cubeb leaves showed as percent inhibition value was (9.378 ± 0.263)% and (90.942 ± 0.750)% for FTC and TBA method respectively.
PENETAPAN KANDUNGAN FENOLIK TOTAL DAN UJI AKTIVITAS ANTIOKSIDAN FRAKSI ETIL ASETAT EKSTRAK METANOL DAUN
KEMUKUS (Piper cubeba L.)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Farmasi
Oleh:
Maria Indah Rosari
NIM: 128114037
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
PENETAPAN KANDUNGAN FENOLIK TOTAL DAN UJI AKTIVITAS ANTIOKSIDAN FRAKSI ETIL ASETAT EKSTRAK METANOL DAUN
KEMUKUS (Piper cubeba L.)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Farmasi
Oleh:
Maria Indah Rosari
NIM: 128114037
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
vi
HALAMAN PERSEMBAHAN
“Sakèhing prakara bisa daksangga ana ing Panjenenganè kang
paring kakuwatan marang aku.”
-Filipi 4:13-
“Success is falling nine times and getting up ten.”
-Jon Bon Jovi-
Kupersembahkan skripsi ini untuk:
Tuhan Yesus Kristus, Penyelamatku, yang kasihnya tak pernah
berkesudahan, yang selalu menguatkan dan menolongku dalam
segala perkara apapun,
Papa dan Mama yang kusayangi, yang telah membesarkan,
merawat, mendidik, dan menyayangiku hingga sekarang,
keluarga besar, sahabat, teman,
vii PRAKATA
Puji syukur penulis panjatkan kepada Tuhan Yang Maha Kuasa atas berkat
dan bimbingan-Nya penulis dapat menyelesaikan Skripsi yang berjudul “Penetapan Kandungan Fenolik Total dan Uji Aktivitas Antioksidan Fraksi Etil Asetat Ekstrak Metanol Daun Kemukus (Piper cubeba L.)” ini dengan bbaik. Skripsi ini disusun untuk memenuhi salah satu syarat memperoleh gelar Sarjana
Strata Satu Program Studi Farmasi, Fakultas Farmasi, Universitas Sanata Dharma.
Penulis mengalami berbagai macam kesulitan dan masalah dalam proses
pengerjaan Skripsi ini. Kesulitan dan masalah ini dapat diatasi penulis dengan
bantuan dari segala pihak. Oleh karena itu penulis hendak mengucapkan terima
kasih kepada:
1. Aris Widayati, M.Si., Ph.D., Apt., selaku Dekan Fakultas Farmasi Universitas
Sanata Dharma
2. Dr. Yustina Sri Hartini, M.Si., Apt., selaku Dosen Pembimbing dan Dosen
Penguji Skripsi atas segala kesabaran dan masukan sehingga skripsi ini dapat
diselesaikan dengan baik
3. Yohanes Dwiatmaka, M.Si., selaku Dosen Penguji Skripsi atas masukan,
kritik, dan saran kepada penulis dalam penyusunan skripsi ini
4. Dr. Erna Tri Wulandari, M.Si., Apt., selaku Dosen Penguji Skripsi atas
masukan, kritik, dan saran kepada penulis dalam penyusunan skripsi ini
5. Agustina Setiawati, M.Sc., Apt., selaku Kepala Laboratorium Fakultas
Farmasi yang telah memberikan izin dalam penggunaan laboratorium
6. Pak Wagiran selaku Laboran Laboratorium Farmakognosi-Fitokimia, Pak
Suparlan selaku Laboran Laboratorium Kimia Organik, Mas Kunto selaku
Laboran Laboratorium Kimia Analisis, Mas Bimo selaku Laboran
Laboratorium Kimia Instrumen, Pak Heru selaku Laboran Laboratorium
Biofarmasetika, Pak Kayat selaku Laboran Laboratorium Biokimia, Mas
Agung selaku Laboran Laboratorium Kimia-Fisika, Pak Mus selaku Laboran
Laboratorium FTS-Solid, Mas Sigit selaku Laboran Kebun Tanaman Obat
viii
7. Keluarga (Papa dan Mama) atas kasih sayang, pengorbanan, dukungan, doa,
dan bantuan yang telah diberikan kepada Penulis, baik secara moral maupun
materiil
8. Rekan-rekan seperjuangan skripsi sekaligus sahabat-sahabatku, Agatha Herny
S. N., Yuliana Ratih Kamara Dewi, Violeta Jesmile, dan Clementia Nova,
yang telah berjuang bersama dengan Penulis menyelesaikan skripsi ini.
Terima kasih atas segala bantuan, kerjasama, dan semangat dalam penelitian
ini dari awal hingga akhir
9. Sahabat-sahabatku (Monik, Dewi Anugerah, dan Melani) atas dukungan,
semangat, canda tawa, dan persabatan selama empat tahun ini
10. Teman-teman Kos Putri Palantai (Elisa, Ridha, dan Irest) atas semangat,
dukungan, masukan, dan canda tawanya
11. Seluruh dosen, teman-teman FSM A, teman-teman FKK A 2012, serta
seluruh angkatan 2012 Fakultas Farmasi Universitas Sanata Dharma
12. Semua pihak yang tidak dapat Penulis sebutkan satu per satu sehingga Penulis
dapat menyelesaikan skripsi ini dengan baik
Penulis menyadari bahwa skripsi ini masih memiliki kekurangan dalam
berbagai macam hal. Untuk itu penulis mengharapkan kritik dan saran yang
membangun dari segala pihak. Semoga skripsi ini dapat berguna bagi seluruh
pembaca.
Yogyakarta, 23 Juni 2016
ix DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
PERNYATAAN KEASLIAN KARYA ... iv
PERNYATAAN PERSETUJUAN PUBLIKASI ... v
HALAMAN PERSEMBAHAN ... vi
PRAKATA ... vii
DAFTAR ISI ... ix
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiii
ABSTRAK ... xiv
ABSTRACT ... xv
PENDAHULUAN ... 1
METODE PENELITIAN ... 3
HASIL DAN PEMBAHASAN ... 6
KESIMPULAN DAN SARAN ... 14
DAFTAR PUSTAKA ... 15
LAMPIRAN ... 17
x
DAFTAR TABEL
Halaman
Tabel I. Hasil penetapan kandungan fenolik total fraksi etil asetat
ekstrak metanol daun Kemukus ... 9
Tabel II. Nilai persen inhibisi sampel dengan metode FTC ... 12
xi
DAFTAR GAMBAR
Halaman
Gambar 1. Kurva baku asam galat untuk penetapan kandungan
fenolik total ... 8
Gambar 2. Pembentukan kompleks Fe3+-tiosianat dari kompleks
Fe2+-tiosianat oleh hidroperoksida ... 10
Gambar 3. Profil kenaikan rata-rata absorbansi sampel dengan
metode FTC selama tujuh hari ... 11
xii
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Surat determinasi tanaman ... 18
Lampiran 2. Gambar daun Kemukus ... 19
Lampiran 3. Perhitungan pengujian kadar air serbuk simpllisia
daun Kemukus ... 20
Lampiran 4. Uji pendahuluan penetapan kandungan fenolik total
dengan metode Folin-Ciocalteu ... 20
Lampiran 5. Perhitungan rendemen ekstrak dan fraksi ... 20
Lampiran 6. Data penimbangan untuk penetapan kandungan
fenolik total ... 21
Lampiran 7. Data perhitungan konsentrasi asam galat dan fraksi
etil asetat untuk penetapan kandungan fenolik total... 22
Lampiran 8. Hasil optimasi operating time untuk penetapan
kandungan fenolik total ... 23
Lampiran 9. Optimasi panjang gelombang maksimum untuk penetapan
kandungan fenolik total ... 25
Lampiran 10. Hasil pengukuran kurva baku untuk penetapan
kandungan fenolik total ... 27
Lampiran 11. Perhitungan kandungan fenolik total fraksi etil asetat... 27
Lampiran 12. Data penimbangan untuk optimasi operating time uji
aktivitas antioksidan dengan metode FTC ... 28
Lampiran 13. Hasil optimasi operating time untuk uji aktivitas
antioksidan dengan metode FTC (triplo) ... 28
Lampiran 14. Data penimbangan untuk optimasi panjang
gelombang maksimum untuk uji antioksidan dengan
xiii
Lampiran 15. Hasil optimasi panjang gelombang untuk uji aktivitas
antioksidan dengan metode FTC ... 29
Lampiran 16. Data penimbangan untuk uji antioksidan dengan
metode FTC-TBA ... 32
Lampiran 17. Hasil pengukuran uji aktivitas antioksidan dengan
metode FTC ... 32
Lampiran 18. Hasil pengukuran uji aktivitas antioksidan dengan
metode TBA ... 33
Lampiran 19. Gambar larutan sampel fraksi etil asetat ekstrak
metanol daun kemukus pada metode FTC setelah
penambahan FeCl3 selama 7 hari (tiga kali replikasi) ... 35
xiv ABSTRAK
Senyawa fenolik yang terkandung dalam tanaman, khususnya asam fenolat dan flavonoid, telah diketahui memiliki aktivitas antioksidan yang dapat menghambat radikal bebas dan peroksidasi lipid. Kemukus (Piper cubeba L.) merupakan salah satu tanaman dari famili Piperaceae yang telah diketahui memiliki berbagai kandungan fitokimia yang memiliki potensi sebagai antioksidan.
Menurut hasil penelitian Nahak dan Sahu (2011), daun kemukus memiliki kandungan fitokimia berupa alkaloid, glikosida, steroid, flavonoid, tanin, dan antrakuinon. Flavonoid merupakan salah satu senyawa fenolik utama yang bersifat kurang polar. Etil asetat dapat menarik senyawa yang bersifat kurang polar sehingga dapat digunakan sebagai penyari untuk mengambil kandungan flavonoid yang ada dalam daun kemukus secara optimal.
Tujuan dari penelitian ini adalah untuk mengetahui kandungan fenolik total dan aktivitas antioksidan daun kemukus yang diekstrak dengan metanol dan difraksinasi dengan etil asetat. Kandungan fenolik total diukur dengan metode Folin-Ciocalteu, sedangkan aktivitas antioksidan diukur dengan metode FTC (Ferric Thiocyanate) dan TBA (Thiobarbituric Acid) untuk mengetahui kemampuan penghambatan peroksida pada tahap pertama dan kedua peroksidasi lipid.
Hasil penelitian menunjukkan bahwa kandungan fenolik total yang terdapat dalam fraksi etil asetat ekstrak metanol daun kemukus sebesar 155,157 ± 5,642 mg ekivalen asam galat per gram sampel. Aktivitas antioksidan fraksi etil asetat ekstrak metanol daun kemukus yang ditunjukkan dalam persen penghambatan peroksidasi lipid diukur dengan metode FTC dan TBA secara berturut-turut sebesar (9,378 ± 0,263)% dan (90,942 ± 0,750)%.
xv ABSTRACT
Phenolic compound contained in plants, especially phenolic acid and flavonoid, has been known to have antioxidant activity which can inhibit free radical and lipid peroxidation. Cubeb (Piper cubeba L.) is a plant in Piperaceae family which has been known to have some phytochemical content that can exhibit potential antioxidant activity.
According to the research by Nahak and Sahu (2011), Cubeb leaves have some phytochemical compounds such as alkaloid, glycoside, steroid, flavonoid, tannin, and anthraquinon. Flavonoid is one of major phenolic compound which is less polar. Ethyl acetate can extract less polar compound, therefore ethyl acetate can be used as an extractor to extract flavonoid contained in cubeb leaves optimally.
The aim of this research were to measure total phenolic content and antioxidant activity from cubeb leaves extracted by methanol and fractionated by ethyl acetate. Total phenolic content were measured by Folin-Ciocalteu method, meanwhile antioxidant activity were measured by FTC (Ferric Thiocyanate) method and TBA (Thiobarbituric Acid) method to evaluate the percent inhibition of peroxide in the first and second stage of lipid peroxidation.
The results showed that total phenolic content in ethyl acetate fraction of methanol extract of cubeb leaves was 155.157 ± 5.642 mg Gallic Acid Equivalents (GAE). Antioxidant activity of ethyl acetate fraction of methanol extract of Cubeb leaves showed as percent inhibition value was (9.378 ± 0.263)% and (90.942 ± 0.750)% for FTC and TBA method respectively.
1 PENDAHULUAN
Radikal bebas merupakan jenis molekul yang tidak stabil dengan elektron
yang tidak berpasangan dan terdapat pada berbagai sistem biologi dan makanan.
Senyawa oksigen reaktif seperti hidrogen peroksida, hidroksil radikal, oksida
nitrat, peroksinitrit, oksigen tunggal, peroksil radikal, dan anion superoksida
termasuk ke dalam contoh radikal bebas (Halliwell, 2001). Produksi berlebihan
dari senyawa reaktif tersebut dapat menghasilkan stres oksidatif yang disebabkan
oleh ketidakseimbangan sistem pertahanan antioksidan dengan pembentukan
radikal bebas dalam tubuh (Mayne, 2003).
Stres oksidatif terlibat dalam patogenesis berbagai gangguan dan
penyakit termasuk penyakit kronis yang berhubungan dengan usia, seperti
atherosklerosis, rheumatoid arthritis, opthalmologi, dan penyakit neurodegeneratif.
Stres oksidatif juga dapat memicu kanker. Di antara semua molekul biologi, lipid
paling rentan terhadap serangan reactive oxygen species (ROS) dan reactive
nitrogen species (RNS) (Niki, et al., 2005). Lipid yang mengandung asam lemak
tak jenuh teroksidasi oleh molekul oksigen dan oksidasi tersebut dilakukan
dengan mekanisme rantai radikal bebas (Aruoma, 1998). Peroksidasi lipid dapat
mengakibatkan penuaan, penyakit jantung koroner, diabetes mellitus, penyakit
rematik, gangguan hati, multiple sclerosis, penyakit Parkinson, penyakit autoimun,
Alzheimer, dan karsinogenesis (Lin, et al., 2003; Loliger, 1991).
Antioksidan merupakan senyawa yang dapat menghambat kerusakan
yang disebabkan oleh radikal bebas. Antioksidan memiliki kemampuan dalam
menstabilkan atau menon-aktifkan radikal bebas sebelum menyerang komponen
seluler. Antioksidan bekerja dengan cara memberikan sebagian elektronnya dan
mengurangi energi radikal bebas reaktif, sehingga membentuk radikal bebas yang
lebih stabil (El-Missiry, 2012).
Beberapa tanaman telah diketahui dapat menjadi sumber antioksidan
alami dan memiliki peran penting dalam pencegahan penyakit kanker dan
penuaan. Salah satu famili tanaman yang telah diketahui menunjukkan potensi
yang besar sebagai antioksidan adalah Piperaceae (Dodson et al., 2000). Piper
2
Menurut hasil penelitian Nahak dan Sahu (2011), daun kemukus memiliki
kandungan fitokimia berupa alkaloid, glikosida, steroid, flavonoid, tannin, dan
antrakuinon. Flavonoid merupakan salah satu senyawa fenolik utama yang dapat
berfungsi sebagai antioksidan karena kemampuannya dalam meniadakan radikal
bebas dan radikal peroksida sehingga efektif dalam menghambat oksidasi lipid
(Kinsella, et al., 1993).
Pemilihan fraksi etil asetat didasarkan pada kemampuannya dalam
menarik senyawa-senyawa yang bersifat kurang polar. Flavonoid yang terkandung
dalam daun kemukus merupakan senyawa fenolik yang bersifat kurang polar
sehingga dengan penyari etil asetat diharapkan senyawa flavonoid yang
terkandung dapat terambil secara optimal (Andersen dan Markham, 2006).
Sedangkan pemilihan ekstrak metanol didasarkan pada jurnal Cowan (1999), yang
menyatakan bahwa metanol dapat menarik lebih banyak senyawa metabolit
dibandingkan air, etanol, kloroform, diklorometanol, eter, dan aseton.
Metode yang banyak digunakan untuk penetapan kandungan fenolik total
adalah metode Folin-Ciocalteu. Metode ini dapat mengukur kandungan fenolik
total dan substrat oksidasi lainnya. Selain itu metode ini dikenal sebagai metode
yang sederhana dan mampu memberikan hasil yang sama atau reprodusibel
(Ainsworth, 2007).
Pengukuran aktivitas antioksidan dapat dilakukan dengan metode Ferric
Thiocyanate (FTC) dan Thiobarbituric Acid (TBA) yang mampu mengukur
jumlah peroksida yang terbentuk akibat proses peroksidasi lipid. Metode FTC
digunakan untuk mengukur jumlah peroksida pada tahap awal peroksidasi lipid,
sedangkan metode TBA digunakan untuk mengukur jumlah peroksida pada tahap
kedua peroksidasi lipid dan mengukur radikal bebas yang terbentuk setelah
oksidasi peroksida (Aqil, et al., 2006; Rezaeizadeh, et al., 2011).
Penelitian ini dilakukan untuk mengetahui kandungan fenolik total dan
aktivitas antioksidan fraksi etil asetat ekstrak metanol daun kemukus (Piper
cubeba L.). Hasil penelitian ini diharapkan dapat memberikan informasi mengenai
3 METODE PENELITIAN
Bahan penelitian yang digunakan adalah daun kemukus segar yang
diperoleh dari kebun obat Merapi Farma, akuades, methanol teknis, metanol p.a.
99,6%, etanol p.a. 99,6%, etanol 75%, etil asetat p.a., buffer fosfat 0,05M (pH 7),
asam galat p.a. (Sigma), reagen Folin-Ciocalteu, larutan natrium karbonat
(Na2CO3) 1M, amonium tiosianat 30%, besi klorida (FeCl3) 0,02M, asam linoleat
2,5%, larutan asam trikloroasetat (TCA) 10%, larutan tiobarbiturat 0,67%, dan
BHT (Butylated hydroxytoluene) p.a. (Sigma).
Alat penelitian yang digunakan adalah pisau stainless steel, blender, oven,
neraca analitik, orbital shaker, corong Buchner, pompa vakum, kertas saring,
vacuum rotary evaporator, waterbath, vortex, spektrofotometer UV-Vis
(Shimadzu UV-1240), mikropipet, desikator, tabung sentrifuge, dan alat-alat gelas
(Pyrex).
Tata Cara Penelitian:
1. Determinasi tanaman
Determinasi tanaman kemukus dilakukan di Fakultas Biologi Universitas
Gadjah Mada Yogyakarta.
2. Preparasi daun kemukus
Daun kemukus dilakukan sortasi basah untuk membersihkan
kotoran-kotoran atau bahan asing lainnya yang terbawa pada waktu panen, kemudian
dicuci dengan cara dialiri air sambil dibersihkan kotoran yang melekat pada
daun. Pencucian dilakukan hingga daun bersih. Daun kemukus dirajang
kemudian dikeringkan di dalam oven pada suhu 60oC. Posisi daun kemukus
tidak boleh saling menumpuk dan harus sering dibalik agar pengeringan merata.
Pengeringan dianggap selesai apabila daun sudah dapat pecah atau patah
apabila diremas. Setelah itu, daun kemukus kering dipisahkan dari
bahan-bahan pengganggu yang ikut serta selama proses pengeringan. Daun kemukus
dibuat menjadi serbuk dengan blender, kemudian dilakukan pengayakan
4 3. Pembuatan ekstrak daun kemukus
Serbuk simplisia daun kemukus dimaserasi dengan metanol teknis hingga
simplisia terendam sempurna. Maserasi dilakukan selama 24 jam pada suhu
ruangan sambil dilakukan penggojogan secara otomatis dengan menggunakan
orbital shaker. Setelah 3 hari dimaserasi, filtrat disaring dengan corong
Buchner dibantu oleh pompa vakum dan ampasnya diremaserasi dengan
metanol teknis selama 2 hari lalu disaring. Remaserasi dilakukan satu kali
karena filtrat sudah terlihat jernih. Penyari pada filtrat dihilangkan dengan cara
diuapkan dengan menggunakan vacuum rotary evaporator pada suhu 60oC.
Kemudian diuapkan kembali dengan menggunakan waterbath untuk diperoleh
ekstrak kental. Setelah itu dilakukan penimbangan bobot tetap untuk
memastikan ekstrak bebas dari penyari.
4. Fraksinasi
Ekstrak kental yang diperoleh difraksinasi menggunakan metode
ekstraksi cair-cair. Ekstrak kental dilarutkan dalam akuades hangat, kemudian
difraksinasi menggunakan etil asetat dengan perbandingan akuades : etil asetat
1:1 v/v di dalam corong pisah. Terbentuk dua lapisan, yaitu lapisan air dan
lapisan etil asetat. Lapisan etil asetat (bagian atas) diambil dan ditampung
dalam wadah sedangkan lapisan air (bagian bawah) difraksinasi kembali
menggunakan etil asetat dengan perbandingan yang sama. Tahapan ini diulang
hingga fraksi jernih. Fraksi etil asetat kemudian dipekatkan menggunakan
vacuum rotary evaporator pada suhu 77oC. Fraksi etil asetat pekat kemudian
diuapkan menggunakan waterbath untuk menghilangkan sisa penyari,
dilanjutkan dengan penimbangan bobot tetap. Fraksi etil asetat yang sudah
bebas dari penyari tersebut kemudian disimpan dalam desikator.
5. Penetapan kandungan fenolik total
Larutan sampel dibuat dengan menimbang fraksi etil asetat ekstrak
metanol daun kemukus sebanyak 10 mg kemudian dilarutkan dalam 10 mL
metanol:air (1:1) sehingga didapatkan konsentrasi larutan stok 1 mg/mL.
5
0,5 mL larutan intermediet dicampur dengan 2 mL reagen Folin-Ciocalteu dan
diinkubasi selama 5 menit. Selanjutnya ditambahkan 4 mL larutan Na2CO3 1M
kemudian didiamkan selama operating time yang telah ditentukan sebelumnya,
yaitu 30 menit dan dibaca pada panjang gelombang 735 nm, yang merupakan
hasil dari penentuan panjang gelombang maksimum. Replikasi dilakukan
sebanyak tiga kali. Kurva baku asam galat dibuat dengan konsentrasi 40; 50;
60; 70; dan 80 µg/mL. Hasil dinyatakan sebagai mg ekivalen asam galat per
gram ekstrak.
6. Uji aktivitas antioksidan dengan metode FTC (Ferri-Tiosianat)
a. Pembuatan larutan A kontrol positif dan kontrol negatif
Kontrol positif yang digunakan adalah BHT. Sebanyak 4 mg BHT
ditimbang kemudian dilarutkan dalam 4 mL etanol absolut dalam tabung
reaksi bertutup. Kemudian ditambahkan 4,1 mL asam linoleat 2,5%, 8 mL
buffer fosfat pH 7 0,05M, dan 3,9 mL akuades. Larutan tersebut diinkubasi
dalam oven dengan suhu 40oC selama 24 jam. Pembuatan kontrol negatif
sama seperti pembuatan kontrol positif tanpa penambahan BHT.
b. Pembuatan larutan A sampel
Larutan sampel dibuat dengan menimbang fraksi etil asetat daun kemukus
sebanyak 4 mg kemudian dilarutkan dalam 4 mL etanol absolut dalam
tabung reaksi bertutup. Kemudian ditambahkan 4,1 mL asam linoleat 2,5%,
8 mL buffer fosfat pH 7 0,05M, dan 3,9 mL akuades. Larutan tersebut diberi
label larutan A dan dilakukan replikasi sebanyak 3 kali. Larutan tersebut
diinkubasi dalam oven dengan suhu 40oC selama 24 jam.
c. Pengujian antioksidan
Dibuat larutan B untuk masing-masing larutan A kontrol positif, kontrol
negatif, dan sampel untuk pengujian antioksidan dengan mencampur 9,7 mL
etanol 75% dan 0,1 mL ammonium tiosianat 30% dalam tabung sentrifuge.
Masing-masing larutan A kontrol positif, kontrol negatif, dan sampel yang
telah diinkubasi selama 24 jam diambil sebanyak 100µL dan ditambahkan
ke dalam larutan B. Larutan tersebut divortex kemudian ditambahkan
6
homogen. Larutan tersebut didiamkan selama operating time yang telah
ditentukan sebelumnya, yaitu 5 menit, kemudian diukur dengan
spektrofotometer UV-Vis pada panjang gelombang 488,5 nm, yang
merupakan hasil dari penentuan panjang gelombang maksimum.
Pengukuran dilakukan setiap 24 jam selama beberapa hari hingga larutan
kontrol negatif jenuh yang ditunjukkan dengan menurunnya nilai absorbansi
(dalam penelitian ini, inkubasi dilakukan selama 8 hari).
7. Penegasan aktivitas antioksidan dengan metode TBA (asam tiobarbiturat)
Larutan sampel dan larutan standar yang digunakan pada metode FTC
pada hari terakhir diambil sebanyak 2 mL dan ditambahkan 1 mL larutan asam
trikloroasetat 20% dan 2 mL larutan asam tiobarbiturat 0,67%. Setelah
didihkan selama 10 menit, sampel didinginkan. Larutan tersebut kemudian
disentrifugasi pada kecepatan 3.000 rpm selama 30 menit. Absorbansi
supernatan dibaca pada panjang gelombang 532 nm dengan spektrofotometer
visibel.
6. Analisis statistik
Hasil dari tiga kali replikasi sampel ditampilkan sebagai rata-rata ± SD.
Data dihitung dengan metode One Sample T-Test menggunakan program PSPP
untuk menentukan signifikansi perbedaan pada level p<0,05.
HASIL DAN PEMBAHASAN
Senyawa fenolik merupakan penangkal radikal oksigen yang baik
dikarenakan potensi reduksi elektron dari radikal fenolik lebih rendah daripada
potensi reduksi elektron dari radikal oksigen (Grace, 2005; Bors, et al., 1990).
Selain itu radikal fenolik bersifat kurang reaktif dibandingkan radikal oksigen
(Bors, et al., 1990) sehingga senyawa fenolik dapat menghambat radikal oksigen.
Berbagai metode penetapan kandungan fenolik total pada produk
makanan atau sampel biologis didasarkan pada reaksi senyawa fenolik dengan
reagen kolorimetri, salah satunya adalah reagen Ciocalteu. Metode
Folin-Ciocalteu merupakan salah satu metode yang sering digunakan dalam pengukuran
Folin-7
Ciocalteu diketahui sebagai metode yang cepat dan sederhana untuk mengukur
kandungan fenolik total dan senyawa oksidasi dalam ekstrak tanaman.
Prinsip metode Folin-Ciocalteu didasarkan pada transfer elektron dalam
medium alkali, akibat penambahan Na2CO3, dari senyawa fenolik ke dalam
kompleks asam fosfomolibdat dan asam fosfotungstat untuk membentuk
kompleks biru yang dapat dideteksi secara spektroskopis pada panjang gelombang
sekitar 760 nm (Singleton, et al., 1999). Reaksi yang terjadi adalah sebagai
Penetapan kandungan fenolik total dimulai dengan penetapan operating
time dan panjang gelombang maksimum. Penentuan operating time bertujuan
untuk mengetahui waktu pengukuran yang stabil, di mana pada waktu tersebut
tercapai reaksi yang optimal dan diperoleh absorbansi yang stabil. Pada saat awal
terjadi reaksi, absorbansi senyawa yang berwarna ini meningkat sampai waktu
tertentu hingga diperoleh absorbansi yang stabil. Semakin lama waktu pengukuran
maka ada kemungkinan senyawa yang berwarna tersebut menjadi rusak atau
terurai sehingga intensitas warnanya turun akibatnya absorbansinya juga turun.
Maka pengukuran senyawa berwarna (hasil suatu reaksi kimia) harus dilakukan
pada saat operating time (Gandjar dan Rohman, 2007).
Penentuan operating time dilakukan dengan menggunakan asam galat
sebagai senyawa pembanding selama 60 menit dengan selang waktu pengukuran 5
menit. Pengukuran dilakukan dengan menggunakan spektrofotometer UV-visibel
pada panjang gelombang teoritis 760 nm. Operating time yang diperoleh untuk
penetapan kandungan fenolik total adalah 30 menit. Pada waktu tersebut diperoleh
absorbansi yang stabil, terlihat dari selisih yang kecil antar absorbansinya.
Setelah diperoleh operating time, selanjutnya dilakukan penentuan
panjang gelombang maksimum untuk penetapan kandungan fenolik total. Tujuan
8
gelombang yang mempunyai nilai absorbansi maksimal. Pengukuran panjang
gelombang maksimum dilakukan pada rentang panjang gelombang 600-800 nm.
Pada penentuan panjang gelombang untuk penetapan fenolik total didapatkan
panjang gelombang maksimum 735 nm. Pada panjang gelombang tersebut nilai
absorbansi yang diperoleh menunjukkan nilai yang maksimal.
Pembuatan kurva baku dilakukan dengan asam galat sebagai standar
karena asam galat merupakan salah satu jenis asam fenolat yang masuk ke dalam
golongan senyawa fenolik utama. Larutan standar asam galat dibuat dalam lima
tingkat konsentrasi, yaitu 40, 50, 60, 70, dan 80 µg/mL dengan tiga kali replikasi.
Kurva baku asam galat dibuat dengan memplotkan nilai absorbansi versus
konsentrasi.
Gambar 1. Kurva baku asam galat untuk penetapan kandungan fenolik total
Persamaan yang digunakan dalam menentukan kandungan fenolik total
adalah persamaan regresi linier replikasi ketiga, yaitu y = 0,00624x + 0,0974
dengan linearitas r = 0,9924. Absorbansi sampel yang didapat kemudian
dimasukkan ke dalam persamaan tersebut untuk memperoleh nilai kandungan
fenolik total sampel ditunjukkan dengan satuan mg ekivalen asam galat per gram
sampel. Hasil perhitungan menunjukkan bahwa fraksi etil asetat ekstrak metanol
daun kemukus memiliki nilai kandungan fenolik total sebesar 155,157 ± 5,642 mg
9
3,75 mg ekivalen asam galat per gram sampel. Hasil kandungan senyawa fenolik
pada penelitian ini lebih tinggi dibandingkan dengan penelitian yang dilakukan
oleh Aqil et al. (2006). Hal ini dikarenakan senyawa fenolik, khususnya flavonoid,
umumnya banyak terkandung di dalam daun.
Tabel I. Hasil penetapan kandungan fenolik total fraksi etil asetat ekstrak metanol daun kemukus
Konsentrasi Absorbansi Kandungan fenolik total
Pada penetapan kandungan fenolik total fraksi etil asetat ekstrak metanol
daun kemukus, larutan menunjukkan warna biru setelah ditambahkan reagen
Folin-Ciocalteu dan larutan Na2CO3. Hal tersebut menunjukkan bahwa terdapat
senyawa fenolik yang terkandung di dalam fraksi etil asetat ekstrak metanol daun
kemukus.
Polifenol merupakan senyawa utama pada tanaman yang menghasikan
aktivitas antioksidan. Senyawa fenolik utama yang memiliki aktivitas antioksidan
adalah asam fenolat dan flavonoid (Demiray, et al., 2009). Menurut hasil
penelitian Nahak dan Sahu (2011), tanaman kemukus memiliki kandungan
fitokimia berupa alkaloid, glikosida, steroid, flavonoid, tanin, dan antrakuinon.
Flavonoid merupakan salah satu jenis senyawa fenolik utama di dalam tanaman.
Kandungan senyawa fenolik berupa flavonoid yang dimiliki tanaman kemukus
menghasilkan aktivitas antioksidan yang dapat menghambat radikal bebas.
Pengujian aktivitas antioksidan fraksi etil asetat ekstrak metanol daun
kemukus dilakukan dengan metode FTC dan TBA dengan mekanisme asam
lionoleat. Asam linoleat merupakan salah satu asam lemak tak jenuh yang rentan
mengalami auto-oksidasi. Faktor-faktor yang mempengaruhi proses oksidasi asam
linoleat adalah panas, cahaya, oksigen, dan ion logam.
Peroksidasi lipid diawali oleh ROS (Reactive Oxygen Species) atau
10
(O2+), oksigen tunggal (O2), oksigen triplet (3O2), ozon (O3), radikal hidroksil
(+OH), radikal alkoksil (RO+), dan radikal peroksil (ROO+). ROS mengambil
atom hidrogen dari gugus metil asam lemak tak jenuh dan membentuk radikal
bebas seperti radikal peroksil. Saat radikal bebas ini terbentuk, peroksidasi lipid
berkembang sehingga lipid memproduksi bebagai produk oksidasi sekunder.
Beberapa produk oksidasi sekunder yang dibentuk dari lipid digunakan sebagai
biomarker untuk mengetahui peran produk oksidasi sekunder dalam penyakit
kanker dan neurodegeneratif (Matsuo, 1985).
Keberadaan antioksidan (A˙) dapat memecah reaksi berantai dengan
bereaksi dengan lipid peroksida (LOO˙) yang membentuk radikal yang stabil yang
bersifat relatif tidak reaktif atau produk non-radikal.
LOO˙ + AH LOOH + A˙
A˙ + LOO˙ Produk non-radikal A˙ + A˙ Produk non-radikal
(Halliwel dan Chirico, 1993)
Metode FTC digunakan untuk menentukan tingkat hidroperoksida lipid
dalam suatu sistem biologis. Pada metode ini, asam linoleat digunakan sebagai
sumber peroksida. Peroksida yang terbentuk bereaksi dengan FeCl2 untuk
membentuk ion Fe3+ yang kemudian bereaksi dengan ammonium tiosianat (SCN-)
membentuk kompleks ferri-tiosianat (Fe(SCN)3) berwarna merah yang dibaca
absorbansinya dengan spektrofotometer pada panjang gelombang teoritis 500 nm.
Gambar 2. Pembentukan kompleks Fe3 +
-tiosianat dari kompleks Fe2 +
-tiosianat oleh hidroperoksida (Moon dan Shibamoto, 2009)
Kontrol positif yang digunakan adalah BHT (Butyl hydroxytoluene) yang
merupakan salah satu antioksidan sintetis. Kontrol positif digunakan sebagai
pembanding aktivitas antioksidan dengan fraksi etil asetat ekstrak metanol daun
11
berperan sebagai acuan untuk melihat kenaikan jumlah peroksida yang terbentuk
setiap harinya selama waktu pengukuran.
Sebelum dilakukan pengujian aktivitas antioksidan dengan metode FTC,
dilakukan optimasi metode berupa penentuan operating time dan panjang
gelombang maksimum. Operating time yang diperoleh adalah 5 menit, sementara
panjang gelombang yang mampu menunjukkan absorbansi maksimum adalah
488,5 nm.
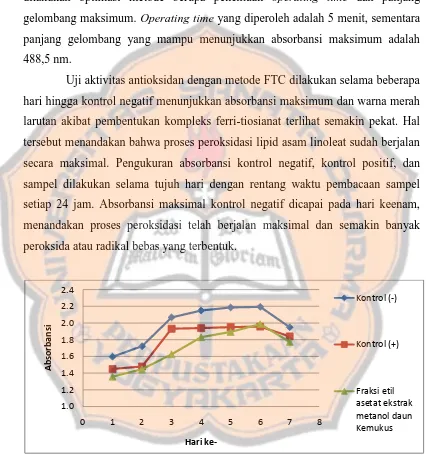
Uji aktivitas antioksidan dengan metode FTC dilakukan selama beberapa
hari hingga kontrol negatif menunjukkan absorbansi maksimum dan warna merah
larutan akibat pembentukan kompleks ferri-tiosianat terlihat semakin pekat. Hal
tersebut menandakan bahwa proses peroksidasi lipid asam linoleat sudah berjalan
secara maksimal. Pengukuran absorbansi kontrol negatif, kontrol positif, dan
sampel dilakukan selama tujuh hari dengan rentang waktu pembacaan sampel
setiap 24 jam. Absorbansi maksimal kontrol negatif dicapai pada hari keenam,
menandakan proses peroksidasi telah berjalan maksimal dan semakin banyak
peroksida atau radikal bebas yang terbentuk.
Gambar 3. Profil kenaikan rata-rata absorbansi sampel dengan metode FTC selama tujuh hari
Hasil yang diperoleh menunjukkan kesesuaian dengan mekanisme reaksi
di mana nilai absorbansi kontrol negatif lebih tinggi dibandingkan nilai absorbansi
12
pada kontrol negatif yang dapat menghambat proses peroksidasi lipid, sehingga
ion Fe3+ yang terbentuk semakin banyak dan warna merah akibat pembentukan
kompleks ferri-tiosianat lebih pekat dibandingkan kontrol positif yang berisi BHT
dan sampel yang berisi fraksi etil asetat ekstrak metanol daun kemukus.
Pada pengukuran hari keenam, saat proses peroksidasi lipid sudah
berjalan secara maksimal, kontrol positif yang berisi BHT menunjukkan nilai
persen inhibisi yang lebih besar dibandingkan fraksi etil asetat ekstrak metanol
daun kemukus, yaitu sebesar (10,306 ± 0,734)%, sementara fraksi etil asetat
ekstrak metanol memiliki nilai persen inhibisi sebesar (9,378 ± 0,263)%. Secara
statistik nilai persen inhibisi kedua sampel tersebut berbeda bermakna (p<0,05).
Hal tersebut menunjukkan bahwa fraksi etil asetat ekstrak metanol daun kemukus
kurang mampu menghambat peroksidasi yang terbentuk dibandingkan BHT yang
merupakan antioksidan sintetis. Namun fraksi etil asetat ekstrak metanol daun
kemukus tetap memiliki aktivitas antioksidan yang mampu menghambat proses
peroksidasi lipid, ditunjukkan dengan nilai absorbansi yang lebih kecil
dibandingkan kontrol negatif.
Tabel II. Nilai persen inhibisi sampel dengan metode FTC
% Inhibisi kontrol (+)
Keterangan: R1 = Replikasi 1; R2 = Replikasi 2; Replikasi 3
Potensi fraksi etil asetat ekstrak metanol daun kemukus dapat dikaitkan
dengan kandungan senyawa fenolik yang dimilikinya. Gugus hidroksil yang
terdapat dalam senyawa fenolik berkontribusi secara langsung pada aktivitas
antioksidan dan kemampuan penghambatan radikal bebas dan peroksidasi lipid.
Senyawa fenolik dapat berperan sebagai antioksidan dengan menon-aktifkan
radikal bebas lipid atau mencegah dekomposisi hidroperoksida ke dalam radikal
13
Setelah dilakukan pengujian aktivitas antioksidan dengan metode FTC,
dilakukan pengujian aktivitas antioksidan dengan metode TBA. Metode TBA
digunakan untuk mengukur jumlah peroksida pada tahap kedua peroksidasi lipid
dan mengukur radikal bebas yang ada setelah oksidasi peroksida. Pada tahap
kedua peroksidasi lipid, asam linoleat yang sudah banyak terbentuk menjadi
radikal terdekomposisi menjadi senyawa yang lebih sederhana dan relatif stabil,
yaitu MDA (malonaldehida). MDA digunakan sebagai biomarker untuk
mengetahui tahap akhir peroksidasi lipid. Prinsip metode ini adalah pengukuran
serapan dengan spektrofotometer dari reaksi MDA dengan asam tiobarbiturat
yang berwarna merah muda pada panjang gelombang 532 nm.
Gambar 4. Pembentukan kompleks MDA-TBA (Moon dan Shibamoto, 2009)
Pada hari kedelapan setelah pengujian dengan metode FTC, dilakukan
pengujian aktivitas antioksidan dengan metode TBA untuk mengukur nilai
penghambatan MDA, produk oksidasi sekunder yang terbentuk setelah tahap
pertama peroksidasi lipid. Pada hari ketujuh, jumlah peroksida yang terbentuk
sudah mulai menurun, ditunjukkan dengan menurunnya nilai aborbansi kontrol
negatif. Hal tersebut disebabkan mulai terbentuknya senyawa MDA dari asam
linoleat sehingga pengukuran dengan metode TBA dilakukan pada hari kedelapan.
Tabel III. Aktivitas antioksidan sampel dengan metode TBA
Absorbansi % Inhibisi (%) Kontrol negatif 1,001 ± 0,004 0
BHT 0,168 ± 0,009 83,916 ± 0,888
Fraksi etil asetat ekstrak metanol daun kemukus
14
Tabel III menunjukkan bahwa nilai absorbansi dan persen inhibisi fraksi
etil asetat ekstrak metanol daun kemukus terhadap MDA lebih besar dibandingkan
BHT dengan nilai persen inhibisi fraksi etil asetat ekstrak metanol daun kemukus
sebesar (90,942 ± 0,750)%, sementara nilai persen inhibisi BHT sebesar (83,916 ±
0,888)%. Secara statistik, nilai persen inhibisi kedua sampel tersebut berbeda
bermakna (p<0,05). Hal tersebut menunjukkan bahwa pada tahap kedua
peroksidasi lipid, aktivitas penghambatan MDA oleh fraksi etil asetat ekstrak
metanol daun kemukus lebih besar dibandingkan penghambatan peroksida pada
tahap pertama peroksidasi lipid.
Metode FTC dan TBA memiliki kelemahan yaitu hanya mampu
menunjukkan aktivitas antioksidan dengan hasil persen penghambatan peroksida.
Kedua metode ini tidak dapat menunjukkan pada konsentrasi berapa sampel yang
diuji mampu menghambat radikal bebas secara efektif. Selain itu metode FTC
memiliki kelemahan pada pembentukan kompleks warna, di mana semakin lama
operating time kompleks warna akan semakin memudar sehingga dapat
mempengaruhi akurasi.
KESIMPULAN DAN SARAN
Kandungan fenolik total yang dinyatakan dalam mg ekivalen asam galat
per gram sampel pada fraksi etil asetat ekstrak metanol daun kemukus sebesar
155,157 ± 5,642 mg ekivalen asam galat per gram sampel. Aktivitas antioksidan
fraksi etil asetat ekstrak metanol daun kemukus yang dinyatakan dalam persen
inhibisi dengan metode FTC dan TBA berturut-turut adalah (9,378 ± 0,263)% dan
(90,942 ± 0,750)%. Hasil tersebut menunjukkan bahwa fraksi etil asetat ekstrak metanol daun kemukus memiliki potensi sebagai antioksidan.
Saran untuk penelitian selanjutnya perlu dilakukan pembuatan sampel
dalam berbagai tingkat konsentrasi untuk mengetahui konsentrasi sampel yang
mampu menghambat lipid peroksidasi secara efektif. Perlu dilakukan juga
penambahan jumlah replikasi sampel untuk mengatasi masalah ketidakakuratan
pembacaan absorbansi dengan metode FTC akibat kelemahan dalam pembentukan
15
senyawa dalam daun kemukus yang berperan dalam penghambatan lipid
peroksida.
DAFTAR PUSTAKA
Agbor, G.A., Vinston, J.A., Donnelly, P.E., 2014, Folin-Ciocalteau Reagent for Polyphenolic Assay, International Journal of Food Science, Nutrition and Dietetics, Vol. 3, Issue 8, pp. 147-156.
Ainsworth, E.A., Gillespie, K.M., 2007, Estimation of Total Phenolic Content and Other Oxidation Substrate in Plant Tissues Using Folin-Ciocalteu Reagent, Nature Publishing Group, Vol. 2, No. 4, pp. 875-877.
Andersen, O.M., Markham, K.R., 2006, Flavonoids: Chemistry, Biochemistry, and Applications, Taylor & Francis Group, London, p. 2.
Aqil, F., Ahmad, I., Mehmood, Z., 2006, Antioxidant and Free Radical Scavenging Properties of Twelve Traditionally Used Indian Medicinal Plants, Turk. J. Biol., Vol. 30, pp. 177-183.
Aruoma, O.I., 1998, Free Radicals, Oxidative Stress, and Antioxidants in Human Health and Disease, J. Am. Oil Chem. Soc., Vol. 75, pp. 199-212.
Bors, W., Heller, W., Michel, C. & Saran, M., 1990, Flavonoids as Antioxidants: Determination of Radical-Scavenging Efficiencies, Methods Enzymol, Vol. 186, pp. 343–355.
Cowan, M.M., 1999, Plant Products as Antimicrobial Agents, Clinical Microbiology Review, Vol. 12, No. 4, pp. 564-582.
Demiray, S., Pintado, M.E., Castro, P.M.L., 2009, Evaluation of Phenolic Profiles and Antioxidant Activities of Turkish Medicinal Plants: Tilia argentea, Crataegi folium leaves and Polygonum bistorta roots, World Acad, Sci. Eng. Technol., Vol. 54, pp. 312-317.
Dodson, C.D., Dyer, L.A., Searcy, J., Wright, Z., Letourneau, D.K., 2000, Cenocladamide: A Dihydropyridone Alkaloid from Piper cenocladum, Phytochemistry, Vol. 53, pp. 51-54.
El-Missiry, M.A., 2012, Antioxidant Enzyme, InTech, Croatia, pp. 3-15.
Gandjar, I. G., Rohman, A., 2007, Kimia Farmasi Analisis, Pustaka Pelajar, Yogyakarta, hal. 220-265.
Grace, S.C., 2005, Phenolics as Antioxidants in Antioxidants and Reactive Oxygen Species in Plants (ed. Smirnoff, N.), Blackwell Publishing, Oxford, UK, pp. 141–168.
Halliwel, B., 2001, Vitamin C and Genomic Stability, Mutat. Res., Vol. 45 (1-2), pp. 29-35.
Halliwel, B., Chirico, S., 1993, Lipid Peroxidation: Its Mechanism, Measurements, and Significance, Am. J. Clin. Nutr., Vol. 57, pp. 715S-725S.
Kinsella, J.E., Frankel, E., German, B., Kanner, J., 1993, Possible Mechanism for The Protective Antioxidants in Wine and Plants Food, J. Food Technology, Vol. 4, Issue 5, p. 89.
16
Loliger, J., 1991, Free Radicals and Food Additives, Taylor and Francis, London, p. 121.
Matsuo, M., 1985, Synthesis and Degradation of Lipid Peroxides in Bodies, Center for Academic Publications Japan, pp.13-44.
Mayne, S.T., 2003, Antioxidant Nutrition and Chronic Disease: Use of Biomarkers of Exposure and Oxidative Stress Status in Epidemiological Research, J. Nutr., Vol. 133, p. 933.
Moon, J.K., Shibamoto, T., 2009, Antioxidant Assays for Plant and Food Components, J. Agric. Food. Chem., Vol. 57, pp. 1655-1666
Nahak, G., Sahu, R.K., 2011, Phytochemical Evaluation and Antioxidant Activity of Piper cubeba and Piper nigrum, Journal of Applied Pharmaceutical Science, Vol. 01 (08), pp. 153-157.
Niki, E., Yoshida, Y., Saito, Y., Noguchi, N., 2005, Lipid Peroxidation: Mechanisms, Inhibition, and Biological Effects, Biochem Biophys. Res. Commun., Vol. 388, pp. 668-676.
Pitchaon, M., Suttajit, M., Pongsawatmani, R., 2007, Assesment of Phenolic Content and Free Radical Scavenging Capacity of Some Thai Indigenous Plants, Food Chem, Vol. 100, pp. 1409-1418.
Rezaeizadeh, A., Zuki, A.B.S., Abdollahi, M., Goh, Y.M., Noordin, M.M., Hamid, M., Azmi, T. I., 2011, Determination of Antioxidant Activity in Methanolic Extract and Chloroformic Extract of Momordica charantia, African Journal of Biotechnology, Vol. 10, Issue 24, pp. 4392-4940. Singleton, V.L., Orthofer, R., Lamuela-Ravento´s, R.M, 1999, Analysis of total
17
19 Lampiran 2. Gambar daun kemukus
Lampiran 3. Perhitungan pengujian kadar air serbuk simplisia daun kemukus
% Kadar air = � −� ℎ�
� × 100%
a. Replikasi 1
Bobot awal = 5,013 gram
Bobot akhir = 4,596 gram
% Kadar air = 8,318%
b. Replikasi 2
Bobot awal = 5,016 gram
Bobot akhir = 4,571 gram
% Kadar air = 8,872%
c. Replikasi 3
Bobot awal = 5,019 gram
Bobot akhir = 4,588 gram
20
Lampiran 4. Uji pendahuluan penetapan kandungan fenolik total dengan metode Folin-Ciocalteau
A
B C
Keterangan:
A = Kontrol positif (asam galat + reagen Folin-Ciocalteau + Na2CO3)
B = Kontrol negatif (metanol : air (1:1) + reagen Folin-Ciocalteau + Na2CO3)
C = Sampel (fraksi etil asetat ekstrak metanol daun kemukus + reagen
Folin-Ciocalteau + Na2CO3)
Lampiran 5. Perhitungan rendemen ekstrak dan fraksi a. Ekstrak metanol daun kemukus
Bobot (gram) Bobot simplisia yang
digunakan
41,840
21 Bobot cawan + ekstrak 75, 3560
Bobot ekstrak 2,0285
% rendemen ekstrak = �
� � �
×
100%% rendemen ekstrak = 2,0285
41,84
×
100% = 4,8482%b. Fraksi etil asetat daun kemukus
Bobot (gram) Bobot simplisia yang
digunakan
41,8400
Bobot cawan kosong 70,6085 Bobot cawan + fraksi
etil asetat
72,6300
Bobot fraksi etil asetat 2,0215
% rendemen fraksi = �
� � �
×
100%% rendemen fraksi = 2,0215
41,84
×
100% = 4,8315%Lampiran 6. Data penimbangan untuk penetapan kandungan fenolik total a. Penimbangan asam galat (larutan stok)
Replikasi 1 (gram) Replikasi 2 (gram) Replikasi 3 (gram) Bobot gelas beker 63,7284 61,4635 62,1535 Bobot gelas beker
+ isi
63,7385 61,4735 62,1636
Bobot zat 0,0101 0,0100 0,0101
b. Penimbangan fraksi etil asetat
Replikasi 1 (gram) Replikasi 2 (gram) Replikasi 3 (gram) Bobot gelas beker 61,0840 61,5200 61,6020 Bobot gelas beker
+ isi
61,0940 61,5300 61,6120
22
Lampiran 7. Data perhitungan konsentrasi asam galat dan fraksi etil asetat untuk penetapan kandungan fenolik total
a. Contoh perhitungan konsentrasi asam galat replikasi 1
Bobot asam galat replikasi 1 = 0,0101 g = 10,1 mg
Konsentrasi larutan stok asam galat = 10,1 �
10 �
=
1010 µg/mLPerhitungan seri konsentrasi replikasi 1
Seri 1 :
V1 . C1 = V2 . C2
0,4 mL . 1010 µg/mL = 10 mL . C2
C2 = 40,4 µg/mL
Seri 2 :
V1 . C1 = V2 . C2
0,5 mL . 1010 µg/mL = 10 mL . C2
C2 = 50,5 µg/mL
Seri 3 :
V1 . C1 = V2 . C2
0,6 mL . 1010 µg/mL = 10mL . C2
C2 = 60,6 µg/mL
Seri 4 :
V1 . C1 = V2 . C2
0,7 mL . 1010 µg/mL = 10mL . C2
C2 = 70,7 µg/mL
Seri 5 :
V1 . C1 = V2 . C2
0,8 mL . 1010 µg/mL = 10 mL . C2
23
Replikasi 1 Replikasi 2 Replikasi 3 Seri 1 40,4 µg/mL 40 µg/mL 40,4 µg/mL Seri 2 50,5 µg/mL 50 µg/mL 50,5 µg/mL Seri 3 60,6 µg/mL 60 µg/mL 60,6 µg/mL Seri 4 70,7 µg/mL 70 µg/mL 70,7 µg/mL Seri 5 80,8 µg/mL 80 µg/mL 80,8 µg/mL
b. Contoh perhitungan konsentrasi fraksi etil asetat
Bobot fraksi etil asetat replikasi 1 = 0,0100 gram = 1000 µg/mL
Pengenceran fraksi etil asetat replikasi 1
V1 . C1 = V2 . C2
2 mL . 1000 µg/mL = 10mL . C2
C2 = 200 µg/mL
Replikasi 1 Replikasi 2 Replikasi 3 Konsentrasi fraksi 200 µg/mL 200 µg/mL 200 µg/mL
Lampiran 8. Hasil optimasi operating time untuk penetapan kandungan fenolik total
a. Replikasi 1
Menit ke- Absorbansi pada panjang gelombang 750 nm 40 µg/mL 60 µg/mL 80 µg/mL
24 b. Replikasi 2
Menit ke-
Absorbansi pada panjang gelombang 750 nm 40 µg/mL 60 µg/mL 80 µg/mL
Pada replikasi 2, operating time yang didapat adalah 30 menit
c. Replikasi 3
Menit ke-
Absorbansi pada panjang gelombang 750 nm 40 µg/mL 60 µg/mL 80 µg/mL
25
Lampiran 9. Optimasi panjang gelombang maksimum untuk penetapan kandungan fenolik total
a. Konsentrasi 40 µg/mL
27
Lampiran 10. Hasil pengukuran kurva baku untuk penetapan kandungan fenolik total
a. Replikasi 1
Seri Konsentrasi Absorbansi Persamaan kurva baku 1 40,4 µg/mL 0,349 A = 0,0700
Seri Konsentrasi Absorbansi Persamaan kurva baku 1 40,0 µg/mL 0,390 A = 0,1264
Seri Konsentrasi Absorbansi Persamaan kurva baku 1 40,4 µg/mL 0,369 A = 0,0974
Lampiran 11. Perhitungan kandungan fenolik total fraksi etil asetat Konsentrasi Absorbansi Kandungan
fenolik total
Contoh perhitungan kandungan fenolik total replikasi 1 :
y = 0,0062x + 0,0974
0,298 = 0,0062x + 0,0974
x = 29,985 µg/mL = 0,029985 mg/mL
28
Kandungan fenolik total = X = 0,029985 . 50
0,0100 = 149,925
Maka kandungan fenolik total dalam sampel replikasi 1 sebesar 149,925 mg
ekivalen asam galat per gram sampel.
Lampiran 12. Data penimbangan untuk optimasi operating time uji aktivitas antioksidan dengan metode FTC
a. Penimbangan BHT (kontrol positif)
Bobot gelas beker = 63,0377 gram
Bobot gelas beker + isi = 63,0418 gram
Bobot zat = 0,0041 gram
Lampiran 13. Hasil optimasi operating time untuk uji aktivitas antioksidan dengan metode FTC (triplo)
Menit ke
Absorbansi pada panjang gelombang 500 nm
Pengukuran 1 Pengukuran 2 Pengukuran 3
1 0,985 0,959 0,948
3 0,918 0,907 0,899
5 0,875 0,875 0,874
7 0,864 0,862 0,860
10 0,855 0,853 0,853
Operating time yang didapat adalah 5 menit
Lampiran 14. Data penimbangan untuk optimasi panjang gelombang maksimum uji antioksidan dengan metode FTC
a. Penimbangan BHT (kontrol positif)
Replikasi 1 (gram) Replikasi 2 (gram) Replikasi 3 (gram) Bobot gelas beker 61,5081 61,7617 63,6569 Bobot gelas beker
+ isi
61,5122 61,7657 63,6609
29
Lampiran 15. Hasil optimasi panjang gelombang untuk uji aktivitas antioksidan dengan metode FTC
31 c. Replikasi 3
Lampiran 16. Data penimbangan untuk uji antioksidan metode dengan FTC-TBA
a. Penimbangan BHT (kontrol positif)
32
b. Penimbangan sampel fraksi etil asetat ekstrak metanol daun kemukus
Replikasi 1 (gram) Replikasi 2 (gram) Replikasi 3 (gram) Bobot cawan 27,9630 20,6332 27,1955 Bobot cawan + isi 27,9670 20,6372 27,1995 Bobot zat 0,0040 0,0040 0,0040
Lampiran 17. Hasil pengukuran uji aktivitas antioksidan dengan metode FTC
a. Nilai absorbansi kontrol negatif, kontrol positif, dan sampel
Ha
b. Rata-rata nilai absorbansi kontrol negatif, kontrol positif, dan sampel
Hari
b. Perhitungan nilai % inhibisi dengan metode FTC (hari keenam)
33
Contoh perhitungan nilai % inhibisi sampel replikasi 1 hari ke- 1:
Persen inhibisi = 2,193−1,984
2,193 × 100%
= 9,530%
c. Grafik absorbansi kontrol negatif, kontrol positif, dan sampel selama tujuh hari
Lampiran 18. Hasil pengukuran uji aktivitas antioksidan dengan metode TBA
a. Nilai absorbansi kontrol negatif, kontrol positif, dan sampel
Kontrol (-) Kontrol (+) Sampel
b. Perhitungan nilai % inhibisi dengan metode TBA
Persen inhibisi = (A0– A1/A0) x 100%
Profil Kenaikan Rata-rata Absorbansi Kontrol Negatif, Kontrol Positif, dan Sampel
34
Kontrol (+) (%)
Rata-rata ± SD
% CV
Sampel (%)
Rata-rata ± SD
% CV
R1 R2 R3 R1 R2 R3
82,218 83,516 83,916 83,916 ± 0,888
1,058 91,708 90,210 90,909 90,942 ± 0,750
0,825
Contoh perhitungan nilai % inhibisi sampel replikasi 1:
Persen inhibisi = 1,000−0,083
1,000 × 100%
35
Lampiran 18. Gambar larutan sampel fraksi etil asetat ekstrak metanol daun kemmukus pada metode FTC setelah penambahan FeCl3 selama 7 hari (tiga
kali replikasi)
1 2 3 4
5 6 7 Keterangan gambar:
Gambar 1: Sampel fraksi etil asetat ekstrak metanol daun kemukus hari ke-1
Gambar 2: Sampel fraksi etil asetat ekstrak metanol daun kemukus hari ke-2
Gambar 3: Sampel fraksi etil asetat ekstrak metanol daun kemukus hari ke-3
Gambar 4: Sampel fraksi etil asetat ekstrak metanol daun kemukus hari ke-4
Gambar 5: Sampel fraksi etil asetat ekstrak metanol daun kemukus hari ke-5
Gambar 6: Sampel fraksi etil asetat ekstrak metanol daun kemukus hari ke-6
36
Lampiran 20. Gambar larutan uji pada metode TBA a. Larutan kontrol positif dan kontrol negatif
Keterangan gambar:
A: Sampel berisi kontrol negatif (ethanol 96%)
B: Sampel berisi kontrol positif (BHT)
b. Larutan uji berisi fraksi etil asetat ekstrak metanol daun kemukus (tiga kali
37
BIOGRAFI PENULIS
Penulis skripsi berjudul “Penetapan
Kandungan Fenolik Total dan Uji Aktivitas
Antioksidan Fraksi Etil Asetat Ekstrak Metanol
Daun Kemukus (Piper cubeba L.)” ini memiliki
nama lengkap Maria Indah Rosari. Dilahirkan di
kota Cirebon pada tanggal 3 Januari 1994 dari
pasangan Bapak Antonius Suroso dan Ibu Yulia
Sugiartini. Penulis telah menyelesaikan pendidikan
di TK Santa Maria Cirebon pada tahun 1998 hingga
2000, kemudian melanjutkan pendidikan dasar di SD
Santa Maria Cirebon pada tahun 2000 hingga 2006, pendidikan menengah di SMP
Santa Maria Cirebon pada tahun 2006 hingga 2009, dan SMA Santa Maria
Cirebon pada tahun 2009 hingga 2012. Penulis kemudian melanjutkan pendidikan
perguruan tinggi di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta pada
tahun 2012 hingga 2016.
Selama menjadi mahasiswa di Fakultas Farmasi Universitas Sanata
Dharma, penulis cukup aktif dalam kegiatan kemahasiswaan, kepanitiaan, dan
kegiatan lain. Penulis cukup aktif dalam Tim Redaksi Majalah Pharmaholic
sebagai Anggota Divisi Design dan Layout periode 2013-2014. Penulis juga aktif
sebagai asisten dosen mata kuliah praktikum Biofarmasetika pada tahun 2016.
Penulis aktif dalam kegiatan kepanitiaan, antara lain: Panitia Pelepasan Wisuda
(2012), Panitia Perayaan Pekan Suci (2013), Panitia Seminar Nasional JMKI
(2013), Panitia Titrasi (2013), Panitia Donor Darah JMKI (2014), Panitia