INTISARI
Tujuan dari penelitian ini adalah untuk mengetahui seberapa besar aktivitas antioksidan dan kandungan fenolik total yang terdapat dalam fraksi etil asetat ekstrak etanol buah jambu mete (Anacardium occidentale L.). Tanaman ini diduga memiliki kandungan senyawa fenolik terutama senyawa golongan flavonoid yang merupakan salah satu golongan senyawa dengan sifat sebagai antioksidan. Pengukuran aktivitas antioksidan dilakukan dengan metode deoksiribosa dan penetapan kandungan fenolik total dilakukan dengan metode Folin-Ciocalteu.
Metode deoksiribosa didasarkan pada pendegradasian deoksiribosa oleh radikal hidroksil yang dihasilkan dari sistem Fenton. Hasil degradasi berupa malonaldehida ketika direaksikan dengan TBA pada pH rendah akan menghasilkan kromogen berwarna merah muda. Kromogen yang dihasilkan selanjutnya dibaca serapannya dengan spektrofotometer. Data yang diperoleh kemudian diolah sehingga menghasilkan nilai IC25.
Metode Folin-Ciocalteu didasarkan pada reduksi asam fosfotungstat dalam larutan alkali menjadi fosfotungstat biru. Senyawa berwarna yang terbentuk kemudian diukur serapannya menggunakan spektrofotometer. Nilai serapan yang diperoleh sebanding dengan jumlah senyawa fenolik yang terdapat dalam sampel. Berdasarkan hasil penelitian ini, fraksi etil asetat buah jambu mete mempunyai kandungan fenolik total sebesar 339,3 ± 13,1 mg ekivalen asam galat. Nilai IC25 yang diperoleh pada fraksi etil asetat buah jambu mete sebesar 285,4 ±
17,9 µg/mL, sedangkan nilai IC25 rutin sebagai kontrol positif sebesar 18,9 ± 1,2
μg/mL.
ABSTRACT
The purpose of this study was to determine how much antioxidant activity and total phenolic content in ethyl acetate fraction ethanolic extract of cashew apple (Anacardium occidentale L.). This plant is thought to contain phenolic compounds, especially flavonoids which is one of the compounds with antioxidant properties. Antioxidant activity was measured by deoxyribose method and determination of total phenolic content was measured by Folin-Ciocalteu method.
Deoxyribose method is based on the degradation of deoxyribose by hydroxyl radicals generated from Fenton system. Degradated deoxyribose will produce malonaldehyde (MDA). When MDA reacted with TBA at low pH will produce pink chromogen. The chromogen absorption was measured with a spectrophotometer. The data obtained are then processed to produce IC25 value.
Folin-Ciocalteu method based on the reduction phosphotungsten acid in alkaline solution becomes blue phosphotungsten. Absorbance of colored compound was measured using spectrophotometer. Uptake value obtained is proportional to the amount of phenolic compounds contained in the sample.
Based on these results, the ethyl acetate fraction of cashew apple has a total phenolic content of 339.3 ± 13.1 mg Gallic Acid Equivalents (GAE). IC25 of
ethyl acetate fraction were obtained for 285.4 ± 17.9 μg/mL. While IC25 of rutin
as a positive control was 18.9 ± 1.2 μg / mL.
UJI AKTIVITAS ANTIOKSIDAN MENGGUNAKAN METODE DEOKSIRIBOSA DAN PENETAPAN KANDUNGAN FENOLIK TOTAL
PADA FRAKSI ETIL ASETAT EKSTRAK ETANOL BUAH JAMBU METE ( Anacardium occidentale L. )
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Yoanes Kapistran Ervan Prasetio Kusumanto NIM : 118114096
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
UJI AKTIVITAS ANTIOKSIDAN MENGGUNAKAN METODE DEOKSIRIBOSA DAN PENETAPAN KANDUNGAN FENOLIK TOTAL
PADA FRAKSI ETIL ASETAT EKSTRAK ETANOL BUAH JAMBU METE ( Anacardium occidentale L. )
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Yoanes Kapistran Ervan Prasetio Kusumanto NIM : 118114096
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
vi PRAKATA
Puji syukur penulis panjatkan kepada Tuhan atas berkat dan
bimbingan-Nya penulis dapat menyelesaikan Skripsi yang berjudul “Uji Aktivitas Antioksidan Menggunakan Metode Deoksiribosa Dan Penetapan Kandungan Fenolik Total Pada Fraksi Etil Asetat Ekstrak Etanol Buah Jambu Mete (Anacardium occidentale L.)” ini dengan baik. Skripsi ini disusun untuk memenuhi salah satu syarat memperoleh gelar Sarjana Strata Satu Program Studi Farmasi, Fakultas Farmasi, Universitas Sanata Dharma.
Penulis mengalami berbagai macam kesulitan dan masalah dalam proses pengerjaan Skripsi ini. Kesulitan dan masalah ini dapat diatasi penulis dengan bantuan dari segala pihak. Oleh karena itu penulis hendak mengucapkan terima
3. Prof. Dr. C.J. Soegihardjo, Apt., selaku Dosen Penguji Skripsi atas masukkan,
kritik, dan saran kepada penulis dalam penyusunan Skripsi ini.
4. Dr. Erna Tri Wulandari, M.Si., Apt., selaku Dosen Penguji Skripsi atas
masukkan, kritik, dan saran kepada penulis dalam penyusunan Skripsi ini.
5. Agustina Setiawati, M.Sc., Apt., selaku Kepala Laboratorium Fakultas
Farmasi yang telah memberikan izin dalam penggunaan laboratorium.
6. Pak Wagiran selaku Laboran Laboratorium Farmakognosi - Fitokimia, Pak
Suparlan selaku Laboran Laboratorium Kimia Organik, Mas Kunto selaku
vii
Tanaman Obat atas segala bantuan dan kerja samanya selama proses
penelitian.
7. Keluarga yang selalu memotivasi dan mendukung penulis dalam
menyelesaikan Skripsi ini.
8. Rose Verginie Erita, selaku sahabat dan orang tersayang dari penulis yang
selalu memberikan kasih sayang dan semangat untuk kesuksesan penulis
dalam Skripsi ini.
9. I Putu Abhiseka Pranajaya, selaku teman seperjuangan dalam menyelesaikan
Skripsi ini.
10. Teman-teman FST A 2011, FSM C 2011 dan teman-teman Fakultas Farmasi
Sanata Dharma angkatan 2011 yang selalu memberikan dukungan dan
semangat dalam penyusunan Skripsi ini.
11. Semua pihak yang telah membantu dan memberikan dukungan yang tidak
dapat disebutkan satu per satu.
Penulis menyadari bahwa Skripsi ini masih memiliki kekurangan dalam
berbagai macam hal. Untuk itu penulis mengharapkan kritik dan saran yang
membangun dari segala pihak. Semoga Skripsi ini dapat berguna bagi seluruh
pembaca.
Yogyakarta, 18 Juni 2015
viii DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
PERNYATAAN KEASLIAN KARYA ... iv
PERNYATAAN PERSETUJUAN PUBLIKASI ... v
ix
BAB III METODE PENELITIAN... 21
A.Jenis dan Rancangan Penelitian ... 21
B.Variabel ... 21
4. Penetapan kandungan fenolik total ... 25
5. Uji aktivitas antioksidan ... 27
F. Analisis Data ... 33
1. Penetapan kandungan fenolik total ... 33
x
BAB IV HASIL DAN PEMBAHASAN ... 35
A.Hasil Determinasi Tanaman ... 35
B.Hasil Pengumpulan Tanaman ... 35
C.Hasil Preparasi Buah Jambu Mete ... 37
1. Hasil pembuatan serbuk simplisia ... 37
2. Hasil proses ekstraksi ... 38
3. Hasil proses fraksinasi ... 39
D.Hasil Uji Kualitatif ... 40
1. Hasil uji kualitatif senyawa fenolik ... 40
2. Hasil uji kualitatif aktivitas antioksidan ... 41
E. Hasil Optimasi Metode Uji Fenolik Total ... 43
1. Penentuan operating time ... 43
2. Penentuan panjang gelombang maksimum ... 44
F. Penetapan Kandungan Fenolik Total ... 45
G.Hasil Optimasi Metode Uji Aktivitas Antioksidan ... 48
1. Penentuan operating time ... 48
2. Penentuan panjang gelombang maksimum ... 49
H.Hasil Uji Aktivitas Antioksidan ... 50
xi
DAFTAR TABEL
Halaman Tabel I. Hasil scanning panjang gelombang maksimum untuk
penentuan fenolik total ... 45 Tabel II. Hasil pengukuran absorbansi kurva baku asam galat ... 47 Tabel III. Hasil penetapan kandungan fenolik total fraksi etil
asetat buah jambu mete ... 48 Tabel IV. Hasil penentuan operating time uji aktivitas antioksidan ... 49 Tabel V. Hasil scanning panjang gelombang maksimum untuk
uji aktivitas antioksidan ... 50 Tabel VI. Hasil pengukuran absorbansi fraksi etil asetat buah
xii
DAFTAR GAMBAR
Halaman Gambar 1. Struktur dasar asam fenolat dan flavonoid ... 9 Gambar 2. Buah jambu mete ... 36 Gambar 3. Reaksi oksidasi polifenol oleh enzim polifenol oksidase
(PPO) ... 38 Gambar 4. Hasil uji kualitatif senyawa fenolik pada fraksi etil asetat
buah jambu mete ... 41 Gambar 5. Reaksi pembentukan kromogen MDA-TBA ... 42 Gambar 6. Hasil uji kualitatif aktivitas antioksidan pada fraksi etil
asetat buah jambu mete ... 43 Gambar 7. Grafik operating time (replikasi 1) untuk penetapan
fenolik total ... 44 Gambar 8. Struktur asam galat ... 46 Gambar 9. Kurva baku asam galat untuk penetapan kandungan
xiii
DAFTAR LAMPIRAN
Halaman Lampiran 1. Surat determinasi tanaman ... 61 Lampiran 2. Gambar tanaman jambu mete di desa Karangtengah,
Imogiri, Bantul ... 62 Lampiran 3. Perhitungan rendemen ekstrak dan fraksi... 64 Lampiran 4. Data penimbangan untuk penetapan kandungan fenolik total 65 Lampiran 5. Data perhitungan konsentrasi asam galat dan fraksi etil asetat
untuk penetapan kandungan fenolik total ... 66 Lampiran 6. Hasil optimasi operating time untuk penetapan kandungan
fenolik total ... 68 Lampiran 7. Optimasi panjang gelombang maksimum untuk penetapan
kandungan fenolik total ... 70 Lampiran 8. Hasil pengukuran kurva baku untuk penetapan kandungan
fenolik total ... 73 Lampiran 9. Perhitungan kandungan fenolik total fraksi etil asetat ... 74 Lampiran 10. Perhitungan konsentrasi bahan untuk metode deoksiribosa 75 Lampiran 11. Penimbangan dan perhitungan konsentrasi fraksi etil asetat
untuk pengukuran aktivitas antioksidan ... 77 Lampiran 12. Penimbangan dan perhitungan konsentrasi rutin untuk
pengukuran aktivitas antioksidan ... 79 Lampiran 13. Optimasi operating time metode deoksiribosa ... 81 Lampiran 14. Optimasi panjang gelombang maksimum metode
xiv
Lampiran 15. Hasil pengukuran absorbansi dan perhitungan aktivitas
antioksidan rutin ... 85 Lampiran 16. Hasil pengukuran absorbansi dan perhitungan aktivitas
xv INTISARI
Tujuan dari penelitian ini adalah untuk mengetahui seberapa besar aktivitas antioksidan dan kandungan fenolik total yang terdapat dalam fraksi etil asetat ekstrak etanol buah jambu mete (Anacardium occidentale L.). Tanaman ini diduga memiliki kandungan senyawa fenolik terutama senyawa golongan flavonoid yang merupakan salah satu golongan senyawa dengan sifat sebagai antioksidan. Pengukuran aktivitas antioksidan dilakukan dengan metode deoksiribosa dan penetapan kandungan fenolik total dilakukan dengan metode Folin-Ciocalteu.
Metode deoksiribosa didasarkan pada pendegradasian deoksiribosa oleh radikal hidroksil yang dihasilkan dari sistem Fenton. Hasil degradasi berupa malonaldehida ketika direaksikan dengan TBA pada pH rendah akan menghasilkan kromogen berwarna merah muda. Kromogen yang dihasilkan selanjutnya dibaca serapannya dengan spektrofotometer. Data yang diperoleh kemudian diolah sehingga menghasilkan nilai IC25.
Metode Folin-Ciocalteu didasarkan pada reduksi asam fosfotungstat dalam larutan alkali menjadi fosfotungstat biru. Senyawa berwarna yang terbentuk kemudian diukur serapannya menggunakan spektrofotometer. Nilai serapan yang diperoleh sebanding dengan jumlah senyawa fenolik yang terdapat dalam sampel. Berdasarkan hasil penelitian ini, fraksi etil asetat buah jambu mete mempunyai kandungan fenolik total sebesar 339,3 ± 13,1 mg ekivalen asam galat. Nilai IC25 yang diperoleh pada fraksi etil asetat buah jambu mete sebesar 285,4 ±
17,9 µg/mL, sedangkan nilai IC25 rutin sebagai kontrol positif sebesar 18,9 ± 1,2
μg/mL.
xvi antioxidant properties. Antioxidant activity was measured by deoxyribose method and determination of total phenolic content was measured by Folin-Ciocalteu method.
Deoxyribose method is based on the degradation of deoxyribose by hydroxyl radicals generated from Fenton system. Degradated deoxyribose will produce malonaldehyde (MDA). When MDA reacted with TBA at low pH will produce pink chromogen. The chromogen absorption was measured with a spectrophotometer. The data obtained are then processed to produce IC25 value.
Folin-Ciocalteu method based on the reduction phosphotungsten acid in alkaline solution becomes blue phosphotungsten. Absorbance of colored compound was measured using spectrophotometer. Uptake value obtained is proportional to the amount of phenolic compounds contained in the sample.
Based on these results, the ethyl acetate fraction of cashew apple has a total phenolic content of 339.3 ± 13.1 mg Gallic Acid Equivalents (GAE). IC25 of
ethyl acetate fraction were obtained for 285.4 ± 17.9 μg/mL. While IC25 of rutin
as a positive control was 18.9 ± 1.2 μg / mL.
1 BAB I PENGANTAR
A. Latar Belakang
Radikal bebas terbentuk melalui suatu reaksi oksidasi. Radikal bebas yang terbentuk memiliki reaktivitas yang tinggi sehingga dapat menyebabkan kerusakan sel. Kerusakan oksidatif yang ditimbulkan karena terpapar radikal bebas dapat menyebabkan penuaan dan beragam penyakit seperti arterosklerosis, diabetes, sirosis, dan kanker (Aruldoss and Thangavel, 2011).
Kerusakan yang disebabkan oleh radikal bebas dapat dihambat oleh antioksidan. Antioksidan merupakan senyawa pemberi elektron atau reduktan. Antioksidan menghambat suatu radikal bebas dengan cara bereaksi dengan radikal bebas reaktif membentuk radikal bebas tak reaktif dan relatif stabil (Fessenden dan Fessenden, 1982). Tubuh secara alami memiliki antioksidan untuk membatasi kerusakan yang disebabkan oleh radikal bebas. Salah satu contoh antioksidan alami yang terdapat pada tubuh adalah enzim superoxyde dismutase (SOD). Antioksidan dalam tubuh jumlahnya cukup terbatas, oleh karena itu dibutuhkan asupan antioksidan tambahan dari luar tubuh.
(BHA) dan butylated hydroxytoluene (BHT) belakangan diketahui berbahaya bagi kesehatan manusia. Oleh karena hal tersebut penelitian terkait bahan alam yang efektif, tidak toksik, dan memiliki aktivitas sebagai antioksidan semakin gencar dilakukan (Gupta and Sharma, 2006).
Antioksidan yang berasal dari alam dapat diperoleh dari buah dan sayuran. Jambu mete merupakan salah satu sumber antioksidan yang potensial. Hasil penelitian yang dilakukan oleh Adou et al. (2012) menunjukkan bahwa jus buah jambu mete memiliki kandungan fenolik total sebesar 1653,8 ± 2,3 sampai 2374,2 ± 5,4 mg/L dan kandungan flavonoid total sebesar 298,6 ± 1,5 sampai 479,8 ± 2,6 mg/L. Senyawa fenolik termasuk juga flavonoid memiliki aktivitas sebagai antioksidan yang mampu menangkal radikal bebas.
B. Permasalahan
1. Berapakah kandungan fenolik total pada fraksi etil asetat ekstrak etanol buah jambu mete dalam massa ekivalen asam galat yang diukur dengan metode Folin - Ciocalteu?
2. Berapakah nilai aktivitas antioksidan pada fraksi etil asetat ekstrak etanol buah jambu mete dalam nilai IC25 yang diukurdengan metode deoksiribosa?
C. Keaslian Penelitian
Sejauh pengetahuan penulis, penelitian mengenai uji aktivitas antioksidan menggunakan metode deoksiribosa dan penetapan kandungan fenolik total pada fraksi etil asetat ekstrak etanol buah jambu mete belum pernah dilakukan. Penelitian lain terkait dengan penelitan ini antara lain:
1. Penelitian yang dilakukan oleh Jaiswal et al. (2010). Pada penelitian Jaiswal et al. (2010) dilakukan penetapan kandungan fenolik total dan pengujian aktivitas antioksidan pada ekstrak daun jambu mete dengan metode DPPH. Perbedaan antara penelitian ini dengan penelitian Jaiswal et al. (2010) terletak pada bagian tanaman yang digunakan dan metode uji aktivitas antioksidan yang digunakan. Hasil pada penelitian Jaiswal et al. (2010) menunjukkan bahwa ekstrak etanol daun jambu mete memiliki kandungan fenolik total sebesar 40,26 mg ekivalen asam galat dan aktivitas antioksidan yang dinyatakan dalam IC50 sebesar 9,41 μg/mL.
2. Penlitian yang dilakukan oleh Adou et al. (2012). Pada penelitian yang dilakukan oleh Adou et al. (2012) dilakukan pengujian terkait dengan kandungan fenolik total, flavonoid total, dan pengujian terkait profil senyawa fenolik yang ada pada jus buah jambu mete. Hasil pada penelitian Adou et al. (2012) menunjukkan jus buah jambu mete memiliki kandungan fenolik total sebesar 1653,8 ± 2.3 sampai 2374,2 ± 5.4 mg/L dan kandungan flavonoid total sebesar 298,6 ± 1,5 sampai 479,8 ± 2,6 mg/L. Senyawa fenolik yang terdeteksi antara lain kuersetin, naringenin, asam kafeat, asam kumarat, asam ferulat, dan asam galat.
D. Manfaat Penelitian
1. Manfaat teoritis : penelitian ini diharapkan dapat memberikan informasi mengenai aktivitas antioksidan pada fraksi etil asetat ekstrak etanol buah jambu mete yang diukur dengan metode deoksiribosa.
2. Manfaat praktis : penelitian ini diharapkan dapat memberikan informasi tentang aktivitas antioksidan yang terdapat pada jambu mete sehingga dapat dimanfaatkan untuk meningkatkan pertahanan tubuh manusia dari radikal bebas.
E. Tujuan Penelitian
2. Tujuan khusus :
a. Mengetahui nilai kandungan fenolik total pada fraksi etil asetat ekstrak etanol buah jambu mete.
b. Mengetahui nilai aktivitas antioksidan dengan metode deoksiribosa yang dinyatakan dengan nilai IC25 pada fraksi etil asetat ekstrak etanol buah
6 BAB II
PENELAAHAN PUSTAKA
A. Jambu Mete
Menurut United States Depatement of Agriculture (USDA), tanaman jambu mete diklasifikasikan sebagai berikut.
Kerajaan : Plantae
Subkerajaan : Tracheobionta Superdivisi : Spermatophyta Divisi : Magnoliophyta
Tanaman jambu mete memiliki nama ilmiah yaitu Anacardium occidentale L. dan memiliki sinonim Acajuba occidentalis atau Cassuvium pomiferum. Tanaman jambu mete memiliki nama yang berbeda di beberapa negara, contohnya maranon, cajuil, merey (Spanyol), caju (Portugal), acaju
Barat), gayu (Lampung), jambu mede (Jawa Barat), jambu monyet (Jawa Tengah dan Jawa Timur), jambu jipang atau jambu dwipa (Bali), dan buah yaki (Sulawesi Utara) (Prihatman, 2000).
Pada umumnya, tanaman jambu mete merupakan tanaman yang lebat, bercabang rendah dan menyebar. Tingginya dapat mencapai 10,6 meter. Daunnya berbentuk lonjong atau bulat telur, panjangnya berkisar antara 10-20 cm dan lebarnya antara 5-10 cm. Bunga dari tanaman ini berwarna merah muda kekuningan, dengan jumlah kelopak 5 (Morton, 1987).
B. Senyawa Fenolik
Tumbuhan merupakan sumber makanan yang kaya akan senyawa fenolik. Senyawa fenolik ini merupakan molekul yang dapat bertindak sebagai antioksidan untuk mencegah penyakit jantung, mengurangi peradangan, menurunkan kejadian kanker dan diabetes, serta mengurangi tingkat mutagenesis pada sel manusia. Perlindungan yang diperoleh dari mengonsumsi produk tanaman seperti buah-buahan, sayuran dan kacang-kacangan sebagian besar terkait dengan adanya senyawa fenolik pada tanaman tersebut (Khoddami et al., 2013). Senyawa fenolik dapat memberikan perlindungan sebagai antioksidan dikarenakan senyawa fenolik dapat bereaksi dengan reactive oxygen species
(ROS) dan menghilangkan aktivitas radikalnya sehingga tidak berbahaya lagi terhadap sel tubuh manusia (Sochor, 2010).
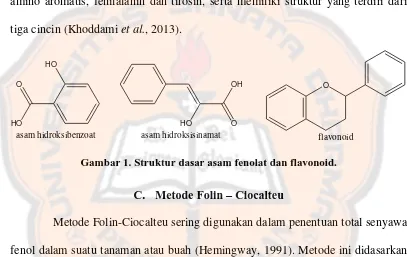
Secara umum senyawa fenolik merupakan zat atau senyawa yang mengandung satu atau lebih cincin aromatik dengan satu atau lebih gugus hidroksil yang menempel. Senyawa fenolik dapat diklasifikasikan menjadi tiga kategori utama, yaitu (1) fenol sederhana yang meliputi asam fenolik, (2) polifenol yang dibentuk oleh flavonoid dan tanin, (3) macam-macam kelompok lainnya yang terdiri dari senyawa seperti kumarin, stilben dan lignan (Vermerris dan Nicholson, 2006).
Flavonoid merupakan senyawa fenolik yang paling umum, karena tersebar luas di jaringan tanaman, dan bersama karotenoid dan klorofil bertanggung jawab memberikan warna seperti biru, ungu, kuning, oranye dan merah pada tanaman. Flavonoid meliputi flavon, flavonol, iso-flavonol, anthocyanin, anthocyanidin,
proanthocyanidin dan katekin. Semua flavonoid merupakan turunan dari asam amino aromatis, fenilalanin dan tirosin, serta memiliki struktur yang terdiri dari tiga cincin (Khoddami et al., 2013).
Gambar 1.Struktur dasar asam fenolat dan flavonoid.
C. Metode Folin – Ciocalteu
Reaksi kolorimetrik banyak digunakan dalam metode spektrofotometri UV / VIS, karena mudah dilakukan, cepat dan dapat digunakan di laboratorium secara rutin, dan biayanya rendah. Metode ini mengukur konsentrasi total senyawa fenolik dalam ekstrak tumbuhan. Polifenol dalam ekstrak tumbuhan bereaksi dengan reagen Folin Ciocalteu untuk membentuk kompleks biru yang dapat diukur dengan cahaya tampak spektrofotometri. Reagen ini memiliki kelemahan, yaitu sangat cepat terurai dalam larutan alkali, sehingga perlu untuk menggunakan reagen secara berlebih untuk mendapatkan reaksi yang lengkap. Namun, penggunaan reagen berlebih dapat menimbulkan endapan dan kekeruhan yang tinggi, sehingga membuat analisis spektrofotometri tidak mungkin untuk dilakukan. Untuk mengatasi masalah ini, didalam reagen Folin Ciocalteu terdapat garam lithium, yang dapat mencegah kekeruhan. Reaksi ini pada umumnya memberikan data yang akurat dan spesifik pada beberapa kelompok senyawa fenolik, walaupun beberapa senyawa menimbulkan warna yang sedikit berbeda karena adanya perbedaan dalam satuan massa dan kinetika reaksi (Blainski et al., 2013).
D. Radikal Bebas
Dalam struktur atom dan molekul, elektron biasanya dalam keadaan berpasangan, setiap pasangan bergerak dalam orbitnya. Namun mungkin pula terdapat suatu spesies elektron yang mampu bergerak dalam orbital dengan keadaan tanpa pasangan. Spesies elektron yang mampu bergerak dalam orbitnya
tanpa pasangan biasa masuk dalam istilah “free”. Atom tanpa pasangan tersebut
radikal dan akan mudah dalam berinteraksi dengan senyawa-senyawa lain. Senyawa dengan elektron tak berpasangan tersebut disebut dengan radikal bebas (Nonhebel, 1974).
Oxigen free radicals atau lebih umum dikenal sebagai Reactive Oxigen Species (ROS), serta Reactive Nitrogen Species (RNS), adalah produk dari metabolisme sel normal. ROS dan RNS juga diakui memainkan peran ganda baik sebagai spesies yang memberikan manfaat dan spesies yang dapat merusak bagi sistem kehidupan. Efek menguntungkan dari ROS terjadi pada konsentrasi rendah/ sedang, misalnya dalam pertahanan terhadap agen infeksi dan fungsi dari sejumlah sistem sinyal seluler (Valko et al., 2006).
Efek berbahaya dari radikal bebas menyebabkan potensi kerusakan biologis yang disebut oxidative stress dan nitrosative stress. Hal ini terjadi dalam sistem biologi bila ada produksi lebih dari ROS / RNS dan kekurangan enzim dan antioksidan non-enzimatik. Kelebihan ROS dapat merusak jaringan lipid, protein, atau DNA seluler sehingga menghambat fungsi normal mereka. Oleh karena hal tersebut maka oxidative stress disimpulkan terlibat dalam menimbulkan sejumlah penyakit pada manusia serta dalam proses penuaan. Radikal hidroksil, •OH, adalah bentuk netral dari ion hidroksida. Radikal hidroksil memiliki reaktivitas yang tinggi, membuatnya menjadi sangat berbahaya dan radikal hidroksil ini memiliki in vivo half-life yang sangat singkat kira-kira 10-9 s (Valko et al., 2006).
E. Antioksidan
menunda atau menghambat reaksi oksidasi dari substrat tersebut (Cadenas and Packer, 2002). Secara umum antioksidan dibedakan menjadi dua, yaitu antioksidan enzimatis dan antioksidan non-enzimatis.
Antioksidan enzimatis disebut juga sebagai antioksidan primer atau antioksidan endogenus. Suatu senyawa dapat dikatakan sebagai antioksidan primer apabila dapat memberikan atom hidrogen secara cepat kepada senyawa radikal, kemudian radikal antioksidan yang terbentuk segera menjadi senyawa yang lebih stabil. Contoh antioksidan enzimatis adalah superoksida dismutase (SOD), katalase, dan glutation peroksidase. Antioksidan non enzimatis disebut juga sebagai antioksidan sekunder atau antioksidan eksogenus. Kerja sistem antioksidan non enzimatis yaitu dengan cara memotong reaksi oksidasi berantai dari radikal bebas atau dengan cara menangkap radikal bebas sehingga radikal bebas tidak akan bereaksi dengan komponen seluler (Winarsi, 2007).
Aktivitas antioksidan dinyatakan dalam nilai inhibition concentration
(IC). Nilai IC yang biasanya digunakan adalah nilai IC50. Nilai IC50 merupakan
konsentrasi antioksidan yang mampu menghambat radikal bebas sekitar 50%. Konsep nilai IC50 ini mirip dengan konsep nilai LD50 pada bidang ilmu
toksikologi. Nilai LD50 merupakan dosis suatu zat yang dapat menyebabkan
kematian sekitar 50% dari populasi. Tak hanya LD50, Sweet (1997) menjelaskan
terdapat beberapa nilai yang lain untuk menyatakan persen kematian. Nilai lain seperti LD1, LD10, LD30, dan LD99 dapat digunakan untuk tujuan tertentu dari
menyatakan tingkat ketoksikan. Salah satunya adalah nilai IC25 yang digunakan
untuk pengujian toksisitas kronis (DEP Division of Water, 2011).
Umumnya nilai IC50 digunakan karena dapat menggambarkan setengah
dari kekuatan maksimal antioksidan. Nilai lain seperti IC25, IC75, ataupun IC90
juga dapat digunakan tergantung dari tujuan penulis. Seperti pada penelitian Fernandes et al. (2007), dimana IC25 digunakan untuk membandingkan hasil
ketika aktivitas penangkapan radikal bebas tidak mencapai 50%. F. Metode Deoksiribosa
Metode deoksiribosa atau sering disebut juga sebagai hydroxyl radical scvenging assay merupakan suatu metode untuk pengukuran aktivitas penghambatan radikal bebas oleh suatu senyawa antioksidan. Prinsip dari metode ini adalah radikal hidroksil yang dihasilkan oleh reaksi kompleks Fe-EDTA dengan H2O2 dengan penambahan asam askorbat (Sistem Fenton), akan
Secara singkat proses pembentukan kromogen berwarna merah muda dijelaskan melalui reaksi berikut.
Fe2+- EDTA + O2 Fe3+-EDTA + O2
-Fe3+-EDTA + ascorbate Fe2+- EDTA + oxidized ascorbate
Fe2+- EDTA + H2O2 OH- +
.
OH + Fe3+-EDTA.
OH + deoxyribose MDA
2TBA + MDA chromogen
G. Ekstraksi
Ekstraksi merupakan pemisahan zat aktif jaringan tanaman atau hewan dari komponen inaktif atau inert dengan menggunakan pelarut yang selektif sesuai dengan prosedur standar. Tujuan dari ekstraksi simplisia adalah untuk mendapatkan zat aktif yang diinginkan. Beberapa teknik ekstraksi yang sering digunakan menurut Handa et al. (2008) adalah :
1. Maserasi
Maserasi merupakan proses dimana serbuk simplisia ditempatkan dalam wadah bertutup dengan pelarut dan didiamkan pada suhu kamar dengan agitasi.
2. Perkolasi
3. Digesti
Digesti adalah maserasi dengan pengadukan pada temperatur yang lebih tinggi daripada temperatur ruangan.
4. Penyarian dengan alat Soxhlet.
Merupakan ekstraksi menggunakan pelarut yang selalu baru, dengan menggunakan alat soxhlet sehingga terjadi ekstraksi terus menerus dengan jumlah pelarut relatif konstan dengan adanya pendinginan balik.
5. Dekok
Dekok adalah ekstraksi dengan pelarut air pada temperatur 90oC selama 30 menit.
6. Infundasi
Infundasi adalah ekstraksi menggunakan pelarut air pada suhu 90oC selama 15 menit.
Ekstrak yang diperoleh dapat difraksinasi untuk mengisolasi suatu senyawa kimia yang lebih spesifik. Salah satu metode untuk fraksinasi adalah ekstraksi cair-cair. Metode ekstraksi cair-cair menggunakan dua pelarut yang tidak bercampur. Salah satu pelarut biasanya adalah air dan pelarut lainnya merupakan pelarut organik. Distribusi analit antara fase air dan fase organik didasarkan pada Hukum Nernst, dimana koefisien ditribusi (KD) sama dengan
Keterangan : KD = koefisien distribusi
Corg = konsentrasi analit pada pelarut organik
Caq = konsentrasi analit pada pelarut air
Faktor-faktor berikut harus dipertimbangkan ketika memilih pelarut untuk ekstraksi:
(1) Kekuatan pelarut (selektivitas)
Konstituen yang diinginkan harus terekstrak dari bahan tanaman, oleh karena itu selektivitas yang tinggi sangat diperlukan.
(2) Titik didih
Titik didih pelarut adalah serendah mungkin untuk memudahkan penghilangan pelarut dari produk.
(3) Reaktivitas
Pelarut seharusnya tidak bereaksi secara kimia dengan ekstrak. (4) Viskositas
Pelarut dengan viskositas rendah akan menyebabkan penurunan tekanan dan perpindahan massa yang baik.
(5) Keamanan
Pelarut harus tidak mudah terbakar dan non-korosif, tidak menimbulkan bahaya beracun, dan tidak merusak lingkungan lingkungan.
(6) Biaya
(7) Tekanan uap
Untuk mencegah hilangnya pelarut oleh penguapan, tekanan uap rendah pada suhu operasi diperlukan.
(8) Recovery
Pelarut harus dapat dipisahkan dengan mudah dari ekstrak untuk menghasilkan ekstrak bebas pelarut.
H. Spektrofotometri
Spektrofotometri UV/Visibel memiliki prinsip yaitu radiasi pada rentang panjang gelombang 200–700 nm dilewatkan melalui suatu larutan senyawa. Elektron pada ikatan dalam molekul menjadi tereksitasi sehingga berada pada keadaan energi yang lebih tinggi dalam proses menyerap sejumlah energi yang melewati larutan tersebut. Semakin longgar elektron tersebut ditahan di dalam ikatan molekul, panjang gelombang radiasi yang diserap semakin panjang (Watson, 2010).
Absorpsi cahaya ultraviolet atau cahaya tampak mengakibatkan adanya transisi elektronik, yaitu perpindahan elektron dari orbital dasar yang energinya rendah menuju keadaan tereksitasi yang energinya lebih tinggi. Panjang gelombang cahaya ultraviolet atau cahaya tampak bergantung pada mudahnya perpindahan elektron. Molekul – molekul yang memerlukan energi lebih banyak untuk memindahkan elektron, akan menyerap pada panjang gelombang yang lebih pendek dan begitu sebaliknya (Fessenden dan Fessenden, 1982).
merupakan bagian dari metode spektroskopi sinar tampak berdasarkan panjang gelombang sinar tampak pada suatu larutan berwarna. Reaksi kolorimetrik banyak digunakan dalam metode spektrofotometri UV / VIS, karena mudah dilakukan, cepat dan dapat digunakan di laboratorium secara rutin, dan biayanya rendah.
Beberapa hal yang perlu diperhatikan dalam analisis spektrofotometri antara lain waktu operasional dan panjang gelombang maksimum. Waktu operasional ditentukan dengan mengukur hubungan antara waktu pengukuran dengan absorbansi larutan. Tujuan dari waktu operasional untuk mengetahui waktu pengukuran yang stabil. Pada awal terjadi reaksi absorbansi akan terus meningkat hingga pada waktu tertentu absorbansi yang dihasilkan stabil. Terdapat kemungkinan senyawa mengalami kerusakan atau terurai sehingga menyebabkan intensitas warna dan absorbansinya menurun seiring bertambahnya waktu. Oleh karena hal tersebut perlu dilakukan pengukuran pada saat waktu operasional yang tepat (Gandjar dan Rohman, 2007).
Panjang gelombang yang digunakan dalam pengukuran adalah panjang gelombang yang memiliki absorbansi maksimal. Pada panjang gelombang maksimal kepekaan yang dihasilkan tinggi. Oleh karena itu perubahan absorbansi untuk setiap satuan konsentrasi adalah yang paling besar (Gandjar dan Rohman, 2007).
I. Landasan Teori
Antioksidan sintetik belakangan diketahui sebagai penyumbang kerusakan pada tubuh, oleh karena itu antioksidan alami lebih baik untuk digunakan.
Tanaman jambu mete merupakan sumber antioksidan yang potensial. Beberapa penelitian menyebutkan bahwa pada buah jambu mete memiliki kandungan senyawa fenolik yang tinggi. Flavonoid merupakan salah satu senyawa fenolik yang memiliki aktivitas sebagai antioksidan. Buah jambu mete memiliki kandungan flavonoid aglikon, yaitu kuersetin dan naringenin. Kuersetin (flavonol) dan naringenin (flavonon) merupakan flavonoid yang tingkat kepolarannya rendah, sehingga dapat diekstraksi menggunakan etil asetat.
J. Hipotesis
1. Fraksi etil asetat ekstrak etanol buah jambu mete memiliki kandungan senyawa fenolik yang dapat diukur dengan metode Folin-Cioucalteu.
21 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk dalam jenis penelitian eksperimental murni dengan rancangan acak sederhana.
B. Variabel
1. Variabel bebas dalam penelitian ini adalah konsentrasi fraksi etil asetat ekstrak etanol buah jambu mete.
2. Variabel tergantung dalam penelitian ini adalah % IC.
3. Variabel pengacau terkendali dalam penelitian ini adalah waktu pemanenan, umur buah yang dipanen, waktu inkubasi, suhu pada saat inkubasi.
4. Variabel pengacau tak terkendali dalam penelitian ini adalah kondisi cuaca pada tempat tumbuh tanaman.
C. Definisi Operasional
1. Buah jambu mete adalah buah semu jambu mete yang sudah masak dari tanaman jambu mete yang tumbuh di Desa Wisata Karangtengah, Mojolegi, Imogiri, Bantul, Daerah Istimewa Yogyakarta.
2. Ekstrak etanol buah jambu mete adalah hasil dari proses maserasi serbuk simplisia kering buah jambu mete dengan menggunakan pelarut etanol 70%. 3. Fraksi etil asetat adalah hasil fraksinasi dengan metode ekstraksi cair-cair dari
4. Persen inhibitiory concentration (%IC) adalah nilai yang menyatakan kemampuan fraksi etil asetat ekstrak etanol buah jambu mete dalam menangkap radikal bebas hidroksi.
5. Inhibitory concentration 25 (IC25) merupakan nilai konsentrasi fraksi etil
asetat yang menghasilkan penangkapan 25% radikal bebas hidroksi.
D. Bahan dan Alat Penelitian 1. Bahan penelitian
Bahan – bahan yang digunakan dalam penelitian ini antara lain: buah jambu mete dari Desa Wisata Karangtengah, Mojolegi, Imogiri, Bantul, Daerah Istimewa Yogyakarta. Akuades (Laboratorium Kimia Organik Universitas Sanata Dharma Yogyakarta). Bahan – bahan kualitas teknis : etanol 70%, natrium karbonat, asam etilendiamin tetrasetat (EDTA). Bahan – bahan kualitas pro analisis E. Merck : metanol, etil asetat, dinatrium hidrogen fosfat, kalium dihirogen fosfat, ferri klorida heksahidrat, larutan hidrogen peroksida 35%, asam askorbat, asam tiobarbiturat (TBA), asam trikloroasetat (TCA). Bahan kualitas pro analisis Sigma Chem Co. USA : asam galat, rutin, reagen Folin-Ciocalteu, 2-deoxy-D-ribose.
2. Alat penelitian
Alat – alat yang digunakan dalam penelitian ini adalah pisau stainless steel, blender, neraca analitik, maserator / orbital shaker, corong Buchner, pompa
vaccum, vaccum rotary evaporator, waterbath, spektrofotometer UV-Vis (Shimadzu), oven, vortex, micropipet 50 – 200 μl, 200 – 1000 μl, dan alat-alat
E. Tatacara Penelitian 1. Determinasi tanaman
Determinasi tanaman jambu mete dilakukan di Laboratorium Kebun Tanaman Obat, Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Pengumpulan buah jambu mete
Buah jambu mete yang sudah masak dikumpulkan dari tanaman jambu mete yang tumbuh di kawasan Desa Wisata Karangtengah, Mojolegi, Imogiri, Bantul, Daerah Istimewa Yogyakarta. Buah dipanen pada awal bulan November 2014. Pemanenan dilakukan pada pagi hari.
3. Preparasi buah jambu mete
Buah jambu mete dicuci menggunakan air mengalir. Buah jambu mete yang telah dicuci kemudian dipotong tipis – tipis menggunakan pisau stainless steel. Buah jambu mete yang telah dipotong selanjutnya ditimbang kemudian ditata di atas tampah. Buah jambu mete selanjutnya dikeringkan dibawah sinar matahari pada pagi hari pukul 08.00 – 11.00 dan sore hari pukul 15.00 – 17.00 dengan ditutup kain hitam. Pengeringan dilakukan hingga potongan buah mudah dipatahkan. Hasil pengeringan kemudian diblender dan diayak menggunakan ayakan 40 mess. Serbuk hasil pengayakan kemudian ditimbang.
dengan penggojogan selama 24 jam menggunakan orbital shaker pada suhu ruang. Hasil dari proses maserasi disaring menggunakan kertas saring dengan bantuan corong Buchner dan pompa vakum. Filtrat kemudian disimpan dalam kondisi penyimpanan yang sesuai. Ampas dari proses penyaringan kemudian dimaserasi kembali selama 24 jam. Proses maserasi dan penyaringan ini dilakukan sebanyak tiga kali. Dilakukan replikasi sebanyak tiga kali.
4. Penetapan kandungan fenolik total a. Pembuatan larutan asam galat
Asam galat ditimbang sebanyak 10 mg, kemudian dimasukkan ke dalam gelas Beker dan dilarutkan dengan aquades : metanol p.a (1:1). Larutan dimasukkan ke dalam labu takar 10 mL, tambahkan akuades : metanol p.a (1:1) sampai batas tanda. Larutan tersebut diambil sebanyak 0,4; 0,5 ; 0,6 ; 0,7 ; dan 0,8 mL, masukkan ke dalam labu takar 10 mL dan tambahkan aquades : metanol p.a (1:1) sampai batas tanda, sehingga diperoleh konsentrasi larutan baku asam galat sebesar 40; 50; 60; 70; dan 80
μg / mL.
b. Pembuatan larutan uji untuk penentuan kandungan fenolik total
Fraksi etil asetat ditimbang sebanyak 10 mg, larutkan menggunakan aquades : metanol p.a ( 1:1 ) dalam gelas beker. Kemudian masukkan ke dalam labu takar 10 mL dan ditambahkan aquades : metanol p.a ( 1:1 ) hingga batas tanda. Larutan diambil 2,0 mL, masukkan ke dalam labu takar 10 mL dan ditambahkan aquades : metanol p.a ( 1:1 ) hingga batas tanda. Konsentrasi larutan uji sebesar 200,0 μg / mL.
c. Penentuan operating time
panjang gelombang 750 nm selama 60 menit. Lakukan replikasi sebanyak 3 kali.
d. Penentuan panjang gelombang maksimum
Larutan asam galat dengan konsentrasi 40; 60; dan 80 μg / mL diambil sebanyak 0,5 mL. Reagen Folin-Ciocalteu ditambahkan sebanyak 2 mL pada masing – masing larutan, diamkan selama 5 menit. Selanjutnya, ditambahkan dengan 4,0 mL natrium karbonat 1 M. Diamkan selama
operating time yang telah didapat, kemudian dilakukan scanning panjang gelombang maksimum dengan spektrofotometer visibel dengan panjang gelombang 600-800 nm.
e. Pembuatan kurva baku asam galat
Larutan asam galat dengan konsentrasi 40; 50; 60; 70; dan 80 μg / mL diambil sebanyak 0,5 mL. Reagen Folin-Ciocalteu ditambahkan sebanyak 2 mL, diamkan selama 5 menit. Selanjutnya, ditambahkan dengan 4,0 mL natrium karbonat 1 M, diamkan selama operating time yang telah didapat. Baca absorbansinya pada panjang gelombang maksimum yang telah diperoleh. Lakukan replikasi sebanyak 3 kali.
f. Estimasi kandungan fenolik total larutan uji
Larutan uji dengan konsentrasi 200,0 μg/mL diambil sebanyak 0,5
5. Uji aktivitas antioksidan
a. Pembuatan larutan stok rutin
Rutin ditimbang sebanyak 10 mg. Masukkan ke dalam gelas beker dan larutkan dengan akuades hangat. Larutan dimasukkan ke dalam labu takar 100 mL dan tambahkan akuades hingga batas tanda sehingga diperoleh konsentrasi larutan stok rutin sebesar 100 μg / mL.
b. Pembuatan larutan pembanding
Larutan stok rutin diambil sebanyak 0,5; 1; 1,5; 2,0; 2,5 mL. Masukkan ke dalam labu takar 10 mL dan tambahkan aquades sampai batas tanda, sehingga diperoleh konsentrasi larutan pembanding rutin sebesar 5; 10; 15; 20; dan 25 μg / mL.
c. Pembuatan Reagen Fenton 1. Larutan FeCl3 1mM
Ferri klorida heksahidrat ditimbang sebanyak 13,5 mg, masukkan ke dalam gelas bekker dan larutkan dengan aquades secukupnya. Larutan dimasukkan ke dalam labu takar 10 mL, kemudian tambahkan aquades hingga batas tanda. Ambil 2,0 mL larutan, masukkan ke dalam labu takar 10 mL, tambahkan aquades hingga batas tanda.
2. Larutan EDTA 1mM
hingga batas tanda. Ambil 2,0 mL larutan, masukkan ke dalam labu takar 10 mL, tambahkan aquades hingga batas tanda.
3. Larutan asam askorbat 1 mM
Asam askorbat ditimbang sebanyak 17,6 mg, masukkan ke dalam gelas beker dan larutkan menggunakan aquades. Larutan dimasukkan ke dalam labu takar 10 mL, kemudian tambahkan aquades hingga batas tanda. Ambil 1,0 mL larutan, masukkan ke dalam labu takar 10 mL, tambahkan aquades hingga batas tanda.
4. Larutan H2O2 20 mM
Sebanyak 0,078 mL larutan H2O2 35% diambil, kemudian di
masukkan ke dalam labu takar 10 mL dan tambahkan aquades hingga batas tanda. Sebanyak 2,5 mL larutan tersebut diambil dan dimasukkan ke dalam labu takar 10 mL. Tambahkan aquades hingga batas tanda. d. Pembuatan larutan Deoksiribosa 2,5 mM
Deoksiribosa ditimbang sebanyak 20,9 mg, masukkan ke dalam gelas beker dan larutkan menggunakan aquades. Larutan dimasukkan ke dalam labu takar 10 mL dan tambahkan aquades hingga batas tanda. Ambil 4,0 mL larutan, masukkan ke dalam labu takar 25 mL. Tambahkan akuades hingga batas tanda.
e. Pembuatan larutan TCA 5%
f. Pembuatan larutan TBA 1%
TBA ditimbang sebanyak 0,25 g, masukkan ke dalam gelas beker dan larutkan menggunakan akuades secukupnya, proses pelarutan dilakukan di atas hot plate hingga seluruh TBA larut. Larutan dimasukkan ke dalam labu takar 25 mL dan tambahkan akuades hingga batas tanda. g. Pembuatan larutan bufer fosfat
Na2HPO4 ditimbang sebanyak 1,4196 g, masukkan ke dalam gelas
beker dan larutkan menggunakan aquades. Larutan dimasukkan ke dalam labu takar 500 mL, tambahkan aquades hingga batas tanda. Kemudian timbang sebanyak 0,6805 gram KH2PO4, masukkan ke dalam gelas beker
dan larutkan menggunakan aquades. Larutan dimasukkan ke dalam labu takar 250 mL dan tambahkan aquades hingga batas tanda. Masukkan larutan Na2HPO4 secukupnya ke dalam gelas beker dan tambahkan larutan
KH2PO4 tetes demi tetes hingga pH larutan sebesar 7.
h. Larutan uji untuk aktivitas antioksidan
i. Penentuan Operating time
Sebanyak 300 μL larutan FeCl3 1 mM, 300 μL larutan EDTA 1
mM, 300 μL larutan H2O2 20 mM, 300; μL larutan deoksiribosa 2,5 mM,
4500 μL bufer fosfat dan 300 μL larutan asam askorbat 1 mM dimasukkan pada tabung reaksi bertutup. Larutan dicampur menggunakan vortex
selama lebih kurang 10 detik. Larutan kemudian diinkubasi selama 1 jam pada suhu 37oC menggunakan oven. Setelah larutan diinkubasi, tambahkan 1 mL TCA 5% dan 1 mL TBA 1%. Larutan dicampur menggunakan
vortex selama lebih kurang 10 detik. Larutan tersebut dipanaskan pada
waterbath dengan suhu 80oC selama 30 menit. Dinginkan dengan bantuan air mengalir selama 5 menit. Baca absorbansinya setiap 5 menit pada panjang gelombang maksimum teoritis 532 nm selama 1 jam.
j. Penentuan panjang gelombang maksimum
Pada 3 tabung reaksi bertutup, masukkan sebanyak 300 μL larutan FeCl3 1 mM, 300 μL larutan EDTA 1 mM, 300 μL larutan H2O2 20 mM,
menit. Diamkan selama operating time yang telah didapat. Lakukan
scanning pada panjang gelombang 400 – 600 nm. k. Pengujian aktivitas penangkapan radikal hidroksil
1. Kontrol negatif
Sebanyak 300 μL larutan FeCl31 mM, 300 μL larutan EDTA 1
mM, 300 μL larutan H2O2 20 mM, 300 μL larutan deoksiribosa 2,5
mM, 1 mL akuades, 3500 μL bufer fosfat dan 300 μL larutan asam askorbat 1 mM dimasukkan ke dalam tabung reaksi bertutup. Larutan dicampur menggunakan vortex selama lebih kurang 10 detik. Larutan kemudian diinkubasi selama 1 jam pada suhu 37oC menggunakan oven. Setelah larutan diinkubasi, tambahkan 1 mL TCA 5% dan 1 mL TBA 1%. Larutan dicampur menggunakan vortex selama lebih kurang 10 detik. Larutan tersebut dipanaskan pada waterbath dengan suhu 80oC selama 30 menit. Dinginkan dengan bantuan air mengalir selama 5 menit. Diamkan selama operating time. Ukur serapan pada panjang gelombang maksimum yang telah ditetapkan sebelumnya.
2. Larutan pembanding rutin
Pada 5 tabung reaksi bertutup, masukkan sebanyak 300 μL larutan FeCl31 mM, 300 μL larutan EDTA 1 mM, 300 μL larutan H2O2
kurang 10 detik. Larutan kemudian diinkubasi selama 1 jam pada suhu 37oC menggunakan oven. Setelah larutan diinkubasi, tambahkan 1 mL TCA 5% dan 1 mL TBA 1%. Larutan dicampur menggunakan vortex
selama lebih kurang 10 detik. Larutan tersebut dipanaskan pada
waterbath dengan suhu 80oC selama 30 menit. Dinginkan dengan bantuan air mengalir selama 5 menit. Diamkan selama operating time. Ukur serapan pada panjang gelombang maksimum yang telah ditetapkan sebelumnya. Persen IC dihitung dari hasil absorbansi yang diperoleh. Dibuat persamaan regresi linier antara konsentrasi larutan pembanding rutin vs % IC untuk menentukan nilai IC25. Dilakukan
replikasi sebanyak 3 kali. 3. Larutan uji
Pada 5 tabung reaksi bertutup, dimasukkan sebanyak 300 μL larutan FeCl31 mM, 300 μL larutan EDTA 1 mM, 300 μL larutan H2O2
20 mM, 300 μL larutan deoksiribosa 2,5 mM, 1 mL larutan uji dengan
konsentrasi 100; 200; 300; 400; dan 500 μg / mL, 3500 μL bufer fosfat
dan 300 μL larutan asam askorbat 1 mM pada masing – masing tabung
reaksi. Larutan dicampur menggunakan vortex selama lebih kurang 10 detik. Larutan kemudian diinkubasi selama 1 jam pada suhu 37oC menggunakan oven. Setelah larutan diinkubasi, tambahkan 1 mL TCA 5% dan 1 mL TBA 1%. Larutan dicampur menggunakan vortex selama lebih kurang 10 detik. Larutan tersebut dipanaskan pada waterbath
mengalir selama 5 menit. Diamkan selama operating time. Ukur serapan pada panjang gelombang maksimum yang telah ditetapkan sebelumnya. Dari hasil absorbansi yang diperoleh, hitung % IC dan dibuat persamaan regresi linier yang merupakan hubungan antara konsentrasi larutan pembanding rutin vs %IC untuk menentukan nilai IC25. Lakukan replikasi sebanyak 3 kali.
F. Analisis Data 1. Penetapan kandungan fenolik total
Kandungan fenolik total dinyatakan dalam nilai mg ekivalen asam galat per gram fraksi etil astat. Nilai tersebut didapatkan dari analisis regresi linier dengan data kurva baku asam galat, sehingga akan diperoleh kandungan fenolik total dengan perhitungan menggunakan rumus :
X = kadar fenolik yang diperoleh dari persamaan kurva baku (mg / mL) v = volume akhir larutan dikali faktor pengenceran (mL)
m = bobot fraksi (gram)
2. Aktifitas penangkapan radikal hidroksil
Aktivitas penangkapan radikal hidroksil dinyatakan dalam % IC, yang dapat dihitung dengan rumus :
A kontrol = Absorbansi campuran reaksi kontrol negatif
Nilai IC25 ditetapkan menggunakan persamaan regresi linier, dengan
35 BAB IV
HASIL DAN PEMBAHASAN
A. Hasil Determinasi Tanaman
Determinasi tanaman bertujuan untuk memastikan kebenaran tanaman yang digunakan sebagai sampel. Kebenaran bahan merupakan salah satu syarat utama dalam penelitian. Determinasi tanaman dilakukan di Laboratorium Kebun Tanaman Obat Fakultas Farmasi Universitas Sanata Dharma Yogyakarta dengan acuan van Steenis (1981). Hasil determinasi menunjukkan tanaman yang digunakan adalah Anacardium occidentale L. (Lampiran 1).
B. Hasil Pengumpulan Tanaman
Buah jambu mete dikumpulkan dari tanaman jambu mete yang tumbuh di kawasan Desa Wisata Karangtengah, Mojolegi, Imogiri, Bantul, Daerah Istimewa Yogyakarta. Tanaman jambu mete dapat dipanen untuk pertama kali pada umur 3-4 tahun. Pada dasarnya masa panen buah jambu mete berlangsung selama 4 bulan, yaitu sekitar bulan November sampai bulan Februari tahun berikutnya. Pada penelitian ini buah jambu mete dipanen pada awal bulan November 2014. Buah yang dipanen adalah buah yang sudah masak. Ciri – ciri buah yang sudah masak dan dapat dipanen menurut Prihatman (2000) adalah :
1. Warna kulit buah semu menjadi kuning, oranye, atau merah tergantung pada jenisnya.
2. Ukuran buah semu lebih besar dari buah sejati.
4. Warna kulit bijinya menjadi putih keabu-abuan dan mengkilat.
Buah hasil panen (Gambar 2) memiliki ciri-ciri seperti yang disebutkan oleh Prihatman (2000). Buah jambu mete yang dipanen berwarna kuning dan merah. Ukuran buah semu lebih besar daripada buah sejati. Tekstur buah semu lunak, berair, rasanya asam, dan beraroma khas. Bagian buah yang digunakan pada penelitian ini adalah buah semu, tanpa buah sejati (mete).
Gambar 2. Buah jambu mete
C. Hasil Preparasi Buah Jambu Mete 1. Hasil pembuatan serbuk simplisia
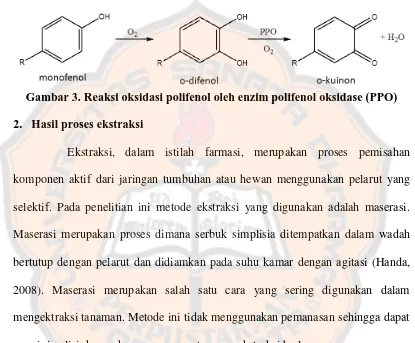
Sebanyak lebih kurang 3 kg buah jambu mete segar yang telah dicuci, dipotong tipis-tipis menggunakan pisau stainless steel. Pemotongan dengan pisau stainless steel karena bahan dari pisau ini bersifat inert, tahan terhadap korosi, mudah dibersihkan dan disterilkan (Newson, 2003). Buah yang telah dipotong dikeringkan di bawah sinar matahari. Tujuan pengeringan adalah untuk menginaktivasi enzim yang ada dalam buah jambu mete. Pengeringan dilakukan dengan menutup buah jambu mete menggunakan kain hitam. Pengeringan dengan ditutup kain hitam bertujuan untuk menghindari kontak langsung antara sampel dengan sinar matahari. Adanya kontak langsung dengan sinar matahari dapat merusak senyawa yang terkandung dalam sampel.
pengeringan ini terjadi perubahan warna buah jambu mete menjadi coklat. Hal ini menunjukkan masih ada enzim polifenol oksidase yang belum terinaktivasi dan bereaksi dengan senyawa fenolik yang terdapat dalam buah jambu mete.
Gambar 3. Reaksi oksidasi polifenol oleh enzim polifenol oksidase (PPO) 2. Hasil proses ekstraksi
Ekstraksi, dalam istilah farmasi, merupakan proses pemisahan komponen aktif dari jaringan tumbuhan atau hewan menggunakan pelarut yang selektif. Pada penelitian ini metode ekstraksi yang digunakan adalah maserasi. Maserasi merupakan proses dimana serbuk simplisia ditempatkan dalam wadah bertutup dengan pelarut dan didiamkan pada suhu kamar dengan agitasi (Handa, 2008). Maserasi merupakan salah satu cara yang sering digunakan dalam mengektraksi tanaman. Metode ini tidak menggunakan pemanasan sehingga dapat meminimalisir kerusakan senyawa saat proses ekstraksi berlangsung.
fenolik dapat diekstraksi dengan pelarut polar, salah satunya etanol. Etanol juga memiliki titik didih yang cukup rendah sehingga mudah diuapkan. Dari segi ekonomi etanol merupakan pelarut yang cukup murah.
Maserasi dilakukan selama 3 hari. Setiap harinya dilakukan remaserasi dengan mengganti pelarut yang digunakan dengan pelarut yang baru. Remaserasi ini bertujuan untuk menarik lebih banyak senyawa dari sampel dan juga menghindari kejenuhan pelarut dalam sistem. Ekstrak yang diperoleh selanjutnya dipekatkan menggunakan vaccum rotary evaporator. Prinsip pemekatan dengan
vaccum rotary evaporator adalah menguapkan pelarut dibawah titik didihnya seiring dengan penurunan tekanan dalam sistem. Hal ini memberikan keuntungan yaitu menghindari kerusakan terhadap senyawa hasil ekstraksi. Hasil pemekatan kemudian diletakkan diatas waterbath dan dipanaskan hingga menjadi ekstrak kental bebas penyari. Ekstraksi ini dilakukan sebanyak 3 kali replikasi. Hasil rata-rata rendemen ekstrak yang diperoleh sebesar 34,0 %.
3. Hasil proses fraksinasi
bagian bawah dalam corong pisah. Hal ini disebabkan berat jenis etil asetat lebih kecil (0,898) dibandingkan berat jenis air (0,996). Fraksi etil asetat ditampung dalam wadah. Kemudian fase air diekstraksi kembali menggunakan etil asetat baru. Hal ini dilakukan sebanyak 3 kali. Semakin banyak ekstraksi cair – cair dilakukan maka efektifitas semakin tinggi (Wells, 2003). Hasil rata-rata persen rendemen fraksi yang diperoleh sebesar 0,6 %.
Pemilihan etil asetat sebagai pelarut yang digunakan pada proses ekstraksi cair-cair didasarkan pada penelitian sebelumnya. Dalam penelitian yang dilakukan oleh Adou et al. (2012) disimpulkan bahwa jus buah jambu mete mengandung senyawa fenolik dan flavonoid yang tinggi. Penelitian Adou et al.
(2012) menunjukkan hasil bahwa jus buah jambu mete mengandung flavonoid aglikon, yaitu kuersetin (flavonol) dan naringenin (flavonon). Etil asetat merupakan pelarut organik yang dapat menarik senyawa – senyawa flavonoid dalam sampel. Senyawa-senyawa flavonoid yang bersifat kurang polar seperti isoflavon, flavanon, methylated flavones, dan flavonol dapat diekstraksi menggunakan etil asetat (Andersen and Markham, 2006).
D. Hasil Uji Kualitatif 1. Hasil uji kualitatif senyawa fenolik
menjadi warna biru inilah yang digunakan sebagai indikator keberadaan senyawa fenolik dalam sampel. Hasil dari uji kualitatif fraksi etil asetat buah jambu mete (Gambar 4) menunjukkan perubahan warna menjadi biru, sama seperti kontrol positif. Hal ini berarti dalam fraksi etil asetat buah jambu mete mengandung senyawa – senyawa fenolik.
Gambar 4. Hasil uji kualitatif senyawa fenolik pada fraksi etil asetat buah jambu mete
Keterangan Gambar 4:
A = kontrol negatif (reagen Folin-Cioucalteu, dan natrium karbonat) B = kontrol positif (asam galat, reagen Folin-Cioucalteu, dan natrium
karbonat)
C = larutan uji (fraksi etil asetat buah jambu mete, reagen Folin- Cioucalteu, dan natrium karbonat)
D = larutan asam galat dalam metanol : air (1:1)
E = larutan fraksi etil asetat buah jambu mete dalam metanol : air (1:1) 2. Hasil uji kualitatif aktivitas antioksidan
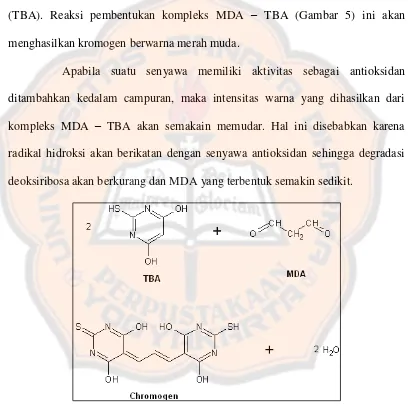
Uji kualitatif ini bertujuan untuk melihat ada atau tidaknya aktivitas antioksidan pada fraksi etil asetat buah jambu mete. Uji ini didasarkan pada
metode deoksiribosa. Pada prinsipnya reaksi Fenton akan menghasilkan suatu radikal hidroksi. Radikal hidroksi ini akan mendegradasi senyawa deoksiribosa menjadi malonaldehida (MDA). Dengan suatu pemanasan, produk degradasi berupa malonaldehida ini akan membentuk kompleks dengan asam tiobarbiturat (TBA). Reaksi pembentukan kompleks MDA – TBA (Gambar 5) ini akan menghasilkan kromogen berwarna merah muda.
Apabila suatu senyawa memiliki aktivitas sebagai antioksidan ditambahkan kedalam campuran, maka intensitas warna yang dihasilkan dari kompleks MDA – TBA akan semakain memudar. Hal ini disebabkan karena radikal hidroksi akan berikatan dengan senyawa antioksidan sehingga degradasi deoksiribosa akan berkurang dan MDA yang terbentuk semakin sedikit.
Gambar 6. Hasil uji kualitatif aktivitas antioksidan pada fraksi etil asetat buah jambu mete
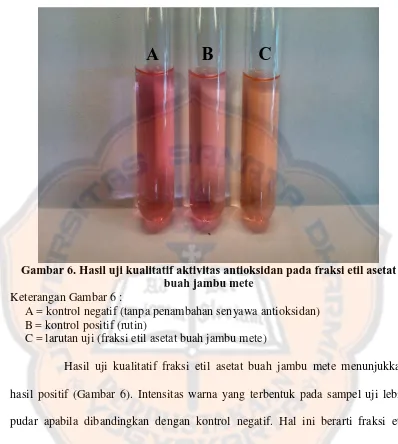
Keterangan Gambar 6 :
A = kontrol negatif (tanpa penambahan senyawa antioksidan) B = kontrol positif (rutin)
C = larutan uji (fraksi etil asetat buah jambu mete)
Hasil uji kualitatif fraksi etil asetat buah jambu mete menunjukkan hasil positif (Gambar 6). Intensitas warna yang terbentuk pada sampel uji lebih pudar apabila dibandingkan dengan kontrol negatif. Hal ini berarti fraksi etil asetat buah jambu mete memiliki aktivitas sebagai antioksidan.
E. Hasil Optimasi Metode Uji Fenolik Total 1. Penentuan Operating time
Penentuan operating time bertujuan untuk mendapatkan waktu dimana reaksi antara sampel dan pereaksi berada pada kondisi optimum. Keadaan reaksi yang optimum ditunjukkan dengan nilai absorbansi yang relatif stabil. Pada saat awal terjadi reaksi, absorbansi senyawa yang berwarna akan terus meningkat hingga pada waktu tertentu akan diperoleh absorbansi yang stabil. Namun
semakin lama waktu pengukuran, ada kemungkinan senyawa berwarna tersebut akan mengalami kerusakan sehingga menyebabkan intensitas warnanya menurun dan absorbansinya juga menurun (Gandjar dan Rohman, 2007).
Gambar 7. Grafik operating time (replikasi 1) untuk penetapan fenolik total
Penentuan operating time pada metode Folin – Ciocalteu untuk penetapan kandungan fenolik total ini dilakukan selama 60 menit. Setiap 5 menit absorbansi larutan diukur pada panjang gelombang teoritis (750 nm). Absorbansi yang diperoleh selama 60 menit kemudian dilihat pada waktu keberapa menghasilkan absorbansi yang cenderung stabil atau selisihnya kecil. Gambar 7 menunjukkan grafik operating time pada replikasi 1. Operating time yang didapat untuk penetapan kandungan fenolik total adalah 35 menit. Pada waktu tersebut diperoleh nilai absorbansi yang stabil.
2. Penentuan panjang gelombang maksimum
Penentuan panjang gelombang maksimum bertujuan untuk mendapatkan nilai serapan maksimum dari hasil reaksi antara asam galat dengan
reagen Folin-Cioucalteu. Pengukuran suatu analit harus pada panjang gelombang maksimum karena pada panjang gelombang maksimum kepekaannya tinggi, sehingga perubahan absorbansi untuk setiap satuan konsentrasi adalah yang paling besar (Gandjar dan Rohman, 2007). Pada penentuan panjang gelombang maksimum digunakan tiga tingkat konsentrasi yaitu rendah (40 µg/mL), sedang (60 µg/mL), dan tinggi (80 µg/mL). Tujuan dilakukan scanning pada tiga tingkat konsentrasi yang berbeda adalah untuk merepresentasikan panjang gelombang maksimum pada tiap konsentrasi. Pengukuran lambda maksimum dilakukan pada rentang panjang gelombang antara 600 – 800 nm.
Tabel I. Hasil scanning panjang gelombang maksimum untuk penentuan fenolik total
Panjang gelombang maksimum yang digunakan adalah 739 nm. Hasil yang diperoleh dari hasil scanning panjang gelombang maksimum menunjukkan hasil yang berbeda dengan lambda maksimum teoritis (Tabel I). Hal ini dapat disebabkan oleh beberapa hal antara lain jenis pelarut, pH larutan, suhu, konsentrasi tinggi, dan zat – zat pengganggu (Gandjar dan Rohman, 2007).
F. Penetapan Kandungan Fenolik Total
2013). Berdasarkan pada peran yang cukup penting maka keberadaan senyawa fenolik dalam suatu tanaman perlu untuk dikuantifikasi.
Banyak metode yang digunakan untuk mengkuantifikasi senyawa fenolik. Salah satu metode yang sering digunakan adalah kuantifikasi dengan spektrofotometri. Reaksi kolorimetri banyak digunakan dalam metode spektrofotometri UV/VIS. Metode ini akan mengukur konsentrasi senyawa fenolik secara total dalam ekstrak tumbuhan. Pada prinsipnya, senyawa fenolik dalam ekstrak tumbuhan akan bereaksi dengan reagen redoks tertentu (Folin Ciocalteu-reagen) untuk membentuk kompleks biru yang dapat diukur dengan cahaya tampak. Reaksi pembentukan kromofor biru didasari oleh kompleks fosfotungstat-fosfomolibdat. Pada reaksi ini serapan yang dihasilkan bergantung pada larutan alkali dan konsentrasi senyawa fenolik (Blainski et al., 2013).
Gambar 8. Struktur asam galat
menentukan kandungan fenolik total. Persamaan regresi dengan linieritas terbaik (nilai R mendekati 1) akan digunakan untuk menentukan kandungan fenolik total. Tabel II menunjukkan hasil pengukuran absorbansi kurva baku asam galat.
Tabel II. Hasil pengukuran absorbansi kurva baku asam galat. Replikasi 1 Replikasi 2 Replikasi 3
Konsentrasi Absorbansi Konsentrasi Absorbansi Konsentrasi Absorbansi
40,4 μg/mL 0,3108 40,8 μg/mL 0,3674 40,4 μg/mL 0,3093
Gambar 9. Kurva baku asam galat untuk penetapan kandungan fenolik total Persamaan yang digunakan dalam menentukan kandungan fenolik total adalah persamaan regresi dari replikasi ketiga, yaitu y = 0,0069x + 0,0335 dengan linieritas sebesar 0,9994. Nilai linieritas menunjukkan korelasi antara konsentrasi
dan absorbansi yang dihasilkan. Semakin baik nilai linieritas (nilai R sama dengan 1 atau mendekati 1) maka korelasi juga semakin baik.
Tabel III. Hasil penetapan kandungan fenolik total fraksi etil asetat buah jambu mete
Tabel III menunjukkan hasil pengukuran sampel uji untuk penentuan kandungan fenolik total. Absorbansi sampel yang diperoleh kemudian dimasukkan ke dalam persamaan regresi linier yang telah didapatkan. Hasil perhitungan menunjukkan bahwa fraksi etil asetat buah jambu mete memiliki nilai kandungan fenolik total sebesar 339,3 ± 13,1 mg ekivalen asam galat. Penelitian yang dilakukan oleh Adou et al. (2012) menyatakan kandungan senyawa fenolik pada jus buah jambu mete sebesar 1653,8 ± 2.3 sampai 2374,2 ± 5.4 mg ekivalen asam galat. Apabila dibandingkan antara penelitian ini dengan penelitian yang dilakukan oleh Adou et al. (2012), hasil senyawa fenolik pada penelitian ini tergolong rendah. Hal ini dikarenakan adanya proses oksidasi oleh enzim polifenol oksidase saat proses pengeringan, sehingga menyebabkan kerusakan pada senyawa polofenol yang ada pada buah jambu mete.
G. Hasil Optimasi Metode Uji Aktivitas Antioksidan 1. Penentuan Operating time
Pada umumnya penentuan operating time dilakukan jika pengukuran yang dilakukan merupakan hasil reaksi atau pembentukan warna. Operating time
senyawa lain hingga terbentuk senyawa produk yang stabil. Produk yang stabil ini dapat dilihat dari hasil pembacaan absorbansi yang menunjukkan nilai absorbansi yang tetap atau selisihnya kecil.
Tabel IV. Hasil penentuan operating time uji aktivitas antioksidan
Penentuan operating time metode deoksiribosa untuk menentukan aktivitas antioksidan dilakukan selama 60 menit. Pengukuran absorbansi dilakukan setiap 5 menit sekali pada panjang gelombang teoritis, yaitu 532 nm.
Operating time ditentukan dengan melihat pada menit keberapa absorbansi yang dihasilkan stabil. Hasil menunjukkan bahwa pada waktu 20 menit absorbansi yang dihasilkan stabil (Tabel IV).
2. Penentuan panjang gelombang maksimum
Penentuan panjang gelombang maksimum perlu dilakukan karena pada panjang gelombang maksimum serapan yang dihasilkan suatu sampel juga maksimum. Pada panjang gelombang maksimum perubahan konsentrasi akan menghasilkan selisih serapan yang paling besar karena pada panjang gelombang
maksimum memiliki kepekaan yang paling tinggi. Pada penelitian ini dilakukan tiga variasi penambahan larutan deoksiribosa dalam penentuan lambda maksimum. Tiga variasi penambahan larutan deoksiribosa, yaitu sebesar 200 µL, 300 µL, dan 400 µL. Variasi penambahan larutan deoksiribosa akan menyebabkan konsentrasi larutan deoksiribosa dalam sistem berbeda – beda sehingga diharapkan dapat merepresentasikan panjang gelombang maksimum pada tiap tingkat konsentrasi.
Tabel V menunjukkan hasil scanning panjang gelombang maksimum untuk uji aktivitas antioksidan. Penentuan panjang gelombang maksimum dilakukan pada rentang panjang gelombang 400 – 600 nm. Panjang gelombang maksimum yang digunakan dalam penelitian ini adalah 530,5 nm. Hasil scanning
ini tidak jauh berbeda dengan panjang gelombang maksimum teoritis.
Tabel V. Hasil scanning panjang gelombang maksimum untuk uji aktivitas antioksidan
Uji aktivitas antioksidan dilakukan dengan metode deoksiribosa. Pada prinsipnya metode ini akan menghasilkan suatu radikal hidroksi dari reaksi Fenton yang melibatkan ferri klorida, EDTA, dan H2O2. Radikal hidroksi yang terbentuk
Pembentukan kromogen ini dipercepat dengan adanya pemanasan. Kromogen inilah yang kemudian diukur absorbansinya dan digunakan dalam menentukan aktivitas antioksidan. Berikut persamaan reaksi yang terjadi :
Fe2+- EDTA + O2 Fe3+-EDTA + O2
-Proses pembentukan kromogen berwarna merah muda diawali dengan mereaksikan campuran yang telah diinkubasi dengan asam trikloroasetat dan asam tiobarbiturat. Penambahan TCA akan menurunkan kecepatan degradasi deoksiribosa oleh radikal hidroksi. Hal ini dapat terjadi karena pada suasana asam oksidasi vitamin C akan terhambat. Akibatnya reduksi Fe3+ menjadi Fe2+ terhambat sehingga pembentukan radikal hidroksi juga akan terhambat. Suasana asam yang ditimbulkan oleh TCA akan mengkatalis pembentukan kompleks MDA-TBA.
Intensitas warna yang terbentuk akan berkurang seiring dengan adanya senyawa antioksidan yang ditambahkan ke dalam sistem. Menurut penelitian Adou et al. (2012) buah jambu mete segar memiliki kandungan flavonoid yang cukup tinggi sehingga dapat memberikan aktivitas antioksidan. Aktivitas antioksidan dinyatakan dalam IC25. Nilai IC25 merupakan konsentrasi sampel yang
persamaan regresi linier yang didapat dari 3 kali replikasi pengukuran fraksi etil asetat buah jambu mete.
Tabel VI. Hasil pengukuran absorbansi fraksi etil asetat buah jambu mete Replikasi Konsentrasi
Tabel VII. Hasil aktivitas antioksidan fraksi etil asetat buah jambu mete IC25 (μg/mL) Rata - rata % CV
mencapai 50%. Pada umumnya parameter aktivitas antioksidan yang sering digunakan adalah IC50. Parameter IC50 dapat menggambarkan setengah dari
baik. Oleh karena itu untuk menjaga perhitungan tetap akurat maka parameter yang digunakan adalah IC25 dan dihitung secara intrapolasi.
Aktivitas antioksidan kemudian ditetapkan menggunakan persamaan regresi linier yang diperoleh pada tiap replikasi. Hasil dari penelitian ini menunjukkan bahwa fraksi etil asetat buah jambu mete memiliki potensi yang kecil dalam memberikan aktivitas antioksidan. Tabel VII menunjukkan hasil pengukuran aktivitas antioksidan yang dinyatakan dalam IC25 pada fraksi etil
asetat buah jambu mete. Hasil IC25 pada fraksi etil asetat buah jambu mete yang
diperoleh sebesar 285,4 ± 17,9 µg/mL.
Tabel VIII. Hasil pengukuran absorbansi rutin Replikasi Konsentrasi (μg/