II. TINJAUAN PUSTAKA
2.1 Fraktur
2.1.1 Definisi dan Klasifikasi Fraktur
Fraktur adalah rusaknya kontinuitas dari struktur tulang, tulang rawan dan lempeng pertumbuhan yang disebabkan oleh trauma dan non trauma. Tidak hanya keretakan atau terpisahnya korteks, kejadian fraktur lebih sering mengakibatkan kerusakan yang komplit dan fragmen tulang terpisah. Tulang relatif rapuh, namun memiliki kekuatan dan kelenturan untuk menahan tekanan. Fraktur dapat diakibatkan oleh cedera, stres yang berulang, kelemahan tulang yang abnormal atau disebut juga fraktur patologis (Solomon et al., 2010).
2.1.2 Klasifikasi Fraktur
Secara klinis, fraktur dibagi menurut ada tidaknya hubungan patahan tulang dengan dunia luar, yaitu fraktur terbuka dan fraktur tertutup. Fraktur tulang terbuka dibagi menjadi tiga derajat yang ditentukan oleh berat ringannya luka dan fraktur yang terjadi, seperti yang dijelaskan pada tabel 1.
Tabel 1. Derajat fraktur terbuka menurut Gustillo
Derajat Luka Fraktur
I Laserasi <1 cm kerusakan
jaringan tidak berarti relatif bersih
II Laserasi >1cm tidak ada kerusakan jaringan yang hebat atau avulsi, ada kontaminasi
III Luka lebar dan rusak hebat
atau hilangnya jaringan disekitarnya. Kontaminasi hebat
(Sumber: Sjamsuhidajat & Jong, 2010)
Sederhana, dislokasi fragen minimal
Dislokasi fragmen jelas
Kominutif, segmental, fragmen tulang ada yang hilang
Fraktur sangat bervariasi dari segi klinis, namun untuk alasan praktis, fraktur dibagi menjadi beberapa kelompok, yaitu :
a. Complete fractures
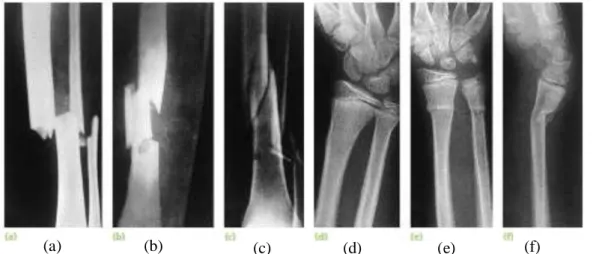
Tulang terbagi menjadi dua atau lebih fragmen. Patahan fraktur yang dilihat secara radiologi dapat membantu untuk memprediksi tindakan yang harus dilakukan setelah melakukan reduksi. Pada fraktur transversal (gambar 1a), fragmen tetap pada tempatnya setelah reduksi, sedangkan pada oblik atau spiral (gambar 1c) lebih cenderung memendek dan terjadi pergeseran meskipun tulang telah dibidai. Fraktur segmental (gambar 1b) membagi tulang menjadi 3 bagian. Pada fraktur impaksi fragmen menumpuk saling tumpang tindih dan garis fraktur tidak jelas. Pada raktur kominutif terdapat lebih dari dua fragmen, karena kurang menyatunya permukaan fraktur yang membuat tidak stabil (Solomon et al., 2010).
b. Incomplete fractures
Pada fraktur ini, tulang tidak terbagi seutuhnya dan terdapat kontinuitas periosteum. Pada fraktur buckle, bagian yang mengalami fraktur hampir tidak terlihat (gambar 1d). Pada fraktur greenstick (gambar 1e dan 1f), tulang melengkung atau bengkok seperti ranting yang retak. Hal ini dapat terlihat pada anak‒anak, yang tulangnya lebih elastis daripada orang dewasa. Pada fraktur kompresi terlihat tulang spongiosa tertekan kedalam (Solomon et al., 2010).
(a) (b) (c) (d) (e) (f)
Gambar 1. Variasi fraktur. Keterangan : Complete fractures: (a) transversal; (b) segmental; (c) spiral. Incomplete fractures: (d) fraktur buckle; (e, f) fraktur greenstick (Solomon et al., 2010).
2.1.3 Proses Penyembuhan Fraktur
Penyembuhan fraktur umumnya dilakukan dengan cara imobilisasi. Akan tetapi, penyembuhan fraktur alamiah dengan kalus dan pembentukan kalus berespon terhadap pergerakan bukan terhadap pembidaian. Pada umumnya fraktur dilakukan pembidaian hal ini dilakukan tidak untuk menjamin penyatuan tulang namun untuk meringankan nyeri dan menjamin penyatuan
tulang pada posisi yang benar dan mempercepat pergerakan tubuh dan pengembalian fungsi (Solomon et al., 2010).
Fraktur disembuhkan dengan proses perkembangan yang melibatkan pembentukan fibrokartilago dan aktivitas osteogenik dari sel tulang utama. Fraktur merusak pembuluh darah yang menyebabkan sel tulang terdekat mati. Pembekuan darah dibuang bersamaan dengan debris jaringan oleh makrofag dan matriks yang rusak, tulang yang bebas dari sel di resorpsi oleh osteoklas (Mescher, 2013).
2.1.3.1 Penyembuhan dengan kalus
Proses ini adalah bentuk alamiah dari penyembuhan fraktur pada tulang tubular tanpa fiksasi, proses ini terdiri dari lima fase, yaitu (Solomon et
al., 2010) :
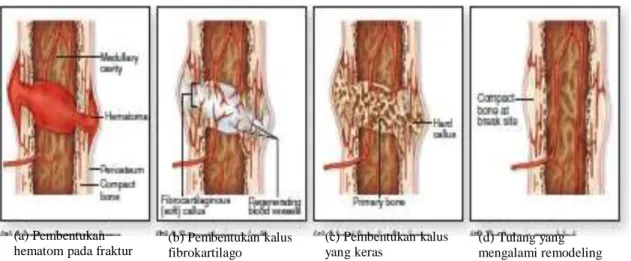
1. Destruksi jaringan dan pembentukan hematom
Pembuluh darah robek dan terjadi pembentukan hematom disekitar fraktur. Tulang pada permukaan yang patah, kehilangan asupan darah, dan mati (gambar 2a).
2. Inflamasi dan proliferasi selular
Dalam 8 jam, fraktur mengalami reaksi inflamasi akut dengan migrasi sel inflamatorik dan inisiasi proliferasi dan diferensiasi dari stem sel mesenkimal dari periosteum menembus kanal medular dan sekitar otot.
Sejumlah besar mediator inflamasi seperti sitokin dan beberapa faktor pertumbuhan dilibatkan. Selanjutnya bekuan darah hematom diabsorbsi perlahan dan membentuk kapiler baru pada area tersebut.
3. Pembentukan kalus
Diferensiasi stem sel menyediakan sejumlah sel kondrogenik dan osteogenik. Pada kondisi yang tepat mereka akan mulai membentuk tulang dan pada beberapa kasus, juga membentuk kartilago (gambar 2b). Di sejumlah sel ini terdapat osteoklas yang siap membersihkan tulang yang mati. Massa seluler yang tebal bersama pulau‒pulau tulang imatur dan kartilago, membentuk kalus atau rangka pada permukaan periosteum dan endosteum. Saat anyaman tulang yang imatur termineralisasi menjadi lebih keras (gambar 2c), pergerakan pada lokasi fraktur menurunkan progresivitas dan fraktur menyatu dalam 4 minggu setelah cidera.
4. Konsolidasi
Tulang anyaman terbentuk menjadi tulang lamelar dengan aktivitas osteoklas dan osteoblas yang kontinyu. Osteoklas pada proses ini melakukan pelubangan melalui debris pada garis fraktur, dan menutup kembali jaringan tersebut. Osteoblas mengisi ruang yang tersisa antara fragmen dan tulang baru. Proses ini berjalan lambat sebelum tulang cukup kuat untuk menopang beban dengan normal.
5. Remodeling
Fraktur telah dijembatani dengan lapisan tulang yang solid. Pada beberapa bulan atau bahkan tahun, dilakukan pembentukkan ulang atau
reshaped dengan proses yang kontinu dari resorpsi dan pembentukan
tulang (gambar 2d).
(a) Pembentukan hematom pada fraktur
(b) Pembentukan kalus fibrokartilago (c) Pembentukan kalus yang keras (d) Tulang yang mengalami remodeling
Gambar 2. Proses penyembuhan fraktur (Mescher, 2013).
2.1.3.2 Penyembuhan dengan penyatuan langsung (direct union)
Proses penyatuan langsung tidak lagi melibatkan proses pembentukan kalus. Jika lokasi fraktur benar‒benar dilakukan imobilisasi dengan menggunakan plate, tidak dapat memicu kalus. Namun, pembentukan tulang baru dengan osteoblas timbul secara langsung diantara fragmen. Gap antar permukaan fraktur diselubungi oleh kapiler baru dan sel osteoprogenitor tumbuh dimulai dari pangkal dan tulang baru terdapat pada permukaan luar (gap healing). Saat celah atau gap sangat kecil, osteogenesis memproduksi tulang lamelar, gap yang lebar pertama‒
tama akan diisi dengan tulang anyaman, yang selanjutnya dilakukan remodeling untuk menjadi tulang lamelar. Setelah 3‒4 minggu, fraktur sudah cukup kuat untuk melakukan penetrasi dan bridging mungkin kadang ditemukan tanpa adanya fase pertengahan atau contact healing (Solomon et al., 2010).
Penyembuhan dengan kalus, meskipun tidak langsung (indirect) memiliki keuntungan antara lain dapat menjamin kekuatan tulang di akhir penyembuhan tulang, dengan peningkatan stres kalus berkembang lebih kuat sebagai contoh dari hukum Wolff. Dengan penggunaan fiksasi metal, disisi lain, tidak terdapatnya kalus berarti tulang akan bergantung pada implan metal dalam jangka waktu yang cukup lama. Karena, implan akan mengurangi stress, yang mungkin dapat menyebabkan osteoporotik dan tidak sembuh total sampai implan dilepas (Solomon et al., 2010).
2.2 Penilaian Proses Penyembuhan Fraktur secara Histopatologi
Proses perbaikan tulang dimulai dari korteks perifer beberapa sentimeter dari lokasi fraktur. Meskipun terdapat perubahan pada perbaikan lingkungan dan jaringan hipoksia akibat dari kerusakan suplai darah, hal ini mengawali pembentukan oleh lapisan dalam periosteum dan sel mesenkimal yang belum berdiferensiasi dari massa kartilago baik di luar korteks disebut external callus dan di dalam korteks disebut internal callus (Shapiro, 2008).
Kalus diawali dengan kartilago dan fibrokartilago untuk menstabilisasi lokasi fraktur. Kemudian melalui peran vaskuler, kalus bertambah dari lapisan korteks paling jauh dari lokasi fraktur dan dari periosteum yang terletak pada batas luar
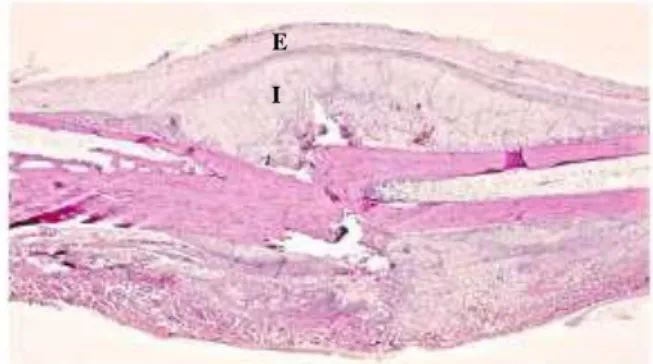
external callus. Terlihat fase awal pembentukkan tulang endokondral, terdapat external dan internal callus (gambar 3).
E I
Gambar 3. Potongan longitudinal proses penyembuhan fraktur mid diafisis os femur (Shapiro, 2008). Keterangan : E : external callus, I : internal
callus
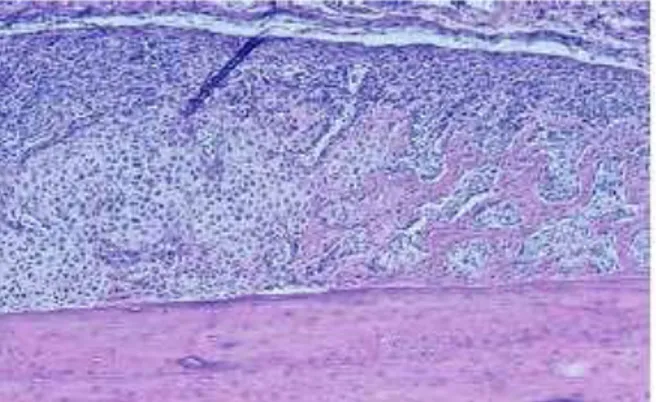
External callus (gambar 4), terlihat jaringan fibrosa pada bagian atas dan awal
perbaikan kartilago pada bagian bawah gambar. Secara keseluruhan external
callus yang baru terbentuk ini dikatakan terdapat jaringan fibrokartilago.
Gambar 4. Memperlihatkan bagian external callus pada fraktur (Shapiro, 2008).
Setelah satu minggu terlihat pembentukkan periosteum tulang baru pada sebelah kanan dari korteks dan pembentukkan kartilago pada sebelah kiri korteks yang lebih mobile dan kurang stabil pada lokasi fraktur (gambar 5). Dengan cara seperti ini tulang anyaman disintesis pada kartilago yang terkalsifikasi dari kalus hingga perbaikan kartilago telah diubah dengan sempurna oleh tulang melalui mekanisme endokondral (Shapiro, 2008).
Gambar 5. Pembentukkan periosteum tulang baru (Shapiro, 2008).
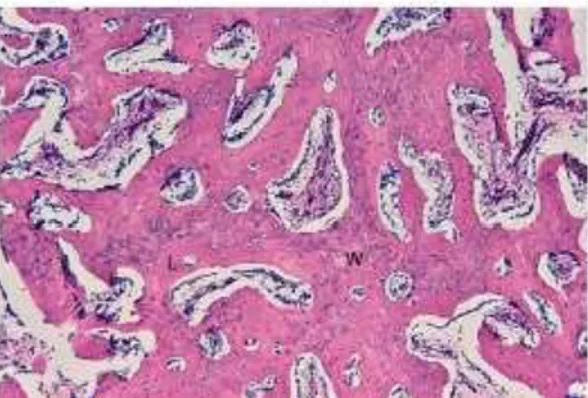
Proses selanjutnya adalah dengan melibatkan transformasi tulang anyaman menjadi tulang kompak. Proses ini melalui resorbsi external callus yang tidak lagi dibutuhkan sejak ujung patahan tulang telah mengalami bridging dan stabil dengan pemulihan jaringan dan remodeling korteks tulang Havers. Pada fase ini, external callus yang digambarkan secara mikroskopis terdapat tulang anyaman yang telah dilapisi dengan proses sintesis tulang lamelar. Tulang lamelar membesar dan berubah menjadi jaringan tulang kompak (gambar 6).
Gambar 6. Tulang anyaman (W) dan tulang lamelar (L) (Shapiro, 2008)
Setelah 6 minggu gap telah terisi dengan tulang baru. Terlihat (gambar 7) tulang anyaman berwarna ungu gelap, dikelilingi dengan tulang lamelar berwarna ungu terang dan osteoblas yang mengisi rongga kosong. Jaringan ini disebut juga woven bone atau tulang anyaman (Shapiro, 2008)
Gambar 7. Tulang anyaman (ungu gelap), tulang lamelar (ungu terang) dan osteoblas (Shapiro, 2008).
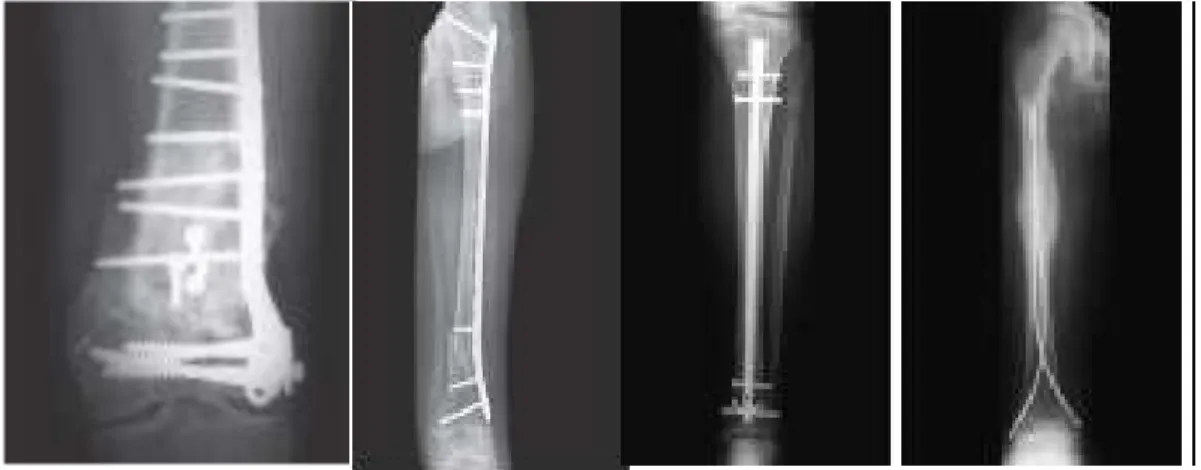
2.3 Open Reduction Internal Fixation (ORIF)
Meskipun konsep teknik internal fiksasi telah dikemukakan pada pertengahan tahun 1800‒an, Lister mengenalkan ORIF fraktur patella pada tahun 1860.
Penggunaan plate, screw dan kawat pertama kali dilakukan pada tahun 1880 dan 1890. Awal mula dilakukan pembedahan fiksasi internal mengalami berbagai macam rintangan seperti infeksi, sedikit pengetahuan tentang implant dan tekniknya, metal allergic dan keterbatasan pengetahuan tentang proses penyembuhan fraktur secara biologis. Pada tahun 1950, Dannis dan Muller menetapkan prinsip dan teknik fiksasi internal. Setelah 40 tahun kemudian, kemajuan ilmu biologi dan mekanikal saat ini telah mempermudah teori dan teknik fiksasi (Lakatos, 2014).
ORIF merupakan reposisi secara operatif yang diikuti dengan fiksasi interna. Fiksasi interna yang dipakai biasanya berupa plate and screw. Keuntungan ORIF adalah tercapainya reposisi yang sempurna dan fiksasi yang kokoh sehingga pascaoperasi tidak perlu lagi dipasang gips dan mobilisasi segera bisa dilakukan. Kerugiannya adalah adanya risiko infeksi tulang (Sjamsuhidajat & Jong, 2010). Indikasi tindakan ORIF pada fraktur femur bagian distal antara lain fraktur terbuka, fraktur yang dihubungkan dengan neurovascular
compromise, seluruh displaced fractures, fraktur ipsilateral ekstrimitas bawah, irreducible fractures, dan fraktur patologis (Thomson & Jonna, 2014).
Prinsip umum dari fiksasi interna antara lain dengan menggunakan pin and
wire, plate and screw, tension‒band principle, intramedullary nails dan biodegradable fixation (gambar 8). Pin and wires menggunakan metode Kirschner wires (K‒wires) dan Steinmann pins memiliki beberapa kegunaan,
Metode ini juga memberikan fiksasi sementara untuk rekonstruksi dari fraktur yang melibatkan kerusakan tulang dan soft tissue yang minimal (Lakatos, 2014).
Bone screw adalah bagian dasar dari metode fiksasi interna modern dan dapat
digunakan baik secara independen atau dengan kombinasi dengan tipe implantasi lain. Kekuatan dipengaruhi oleh pemasangan pengencangan screw. Seiring berjalannya waktu, sejumlah kekuatan kompresif menurun secara lambat saat tulang mengalami remodeling terhadap tekanan. Namun, waktu penyembuhan fraktur biasanya lebih singkat dibandingkan waktu yang dibutuhkan dari substansi yang hilang akibat kompresi dan fiksasi (Lakatos, 2014). Metode lain dengan menggunakan plate memiliki berbagai macam ukuran dan bentuk untuk tulang dan lokasi yang berbeda. Dynamic
compression plates (DCPs) tersedia dalam ukuran 3,5 mm dan 4,5 mm. Lubang screw pada DCP membentuk sudut kemiringan pada satu sisi berlawanan dari
bagian tengah plate (Lakatos, 2014).
Pada tahun 1930 an, Küntscher memperbaiki nailing technique, sehingga
intramedullary (IM) nails menjadi teknik fiksasi standar untuk tulang femur. IM nails memiliki keuntungan dari plate dan fiksasi eksternal karena lokasi
intramedular memungkinkan penjajaran sumbu aksis dan pengurangan beban. Implantasi IM nails memberikan fiksasi yang stabil, akan tetapi penyembuhan berlangsung secara primer melalui pembentukan dari kalus periosteum (Lakatos, 2014).
Gambar 8. Variasi ORIF (Solomon et al., 2010)
2.4 Amnion Liofilisasi Steril Radiasi (ALS‒R)
Amnion liofilisasi steril radiasi (ALS‒R) adalah amnion yang dikeringkan dengan cara liofilisasi kemudian dilakukan sterilisasi dengan mengggunakan radiasi sinar γ. Proses pengeringan amnion di Bank Jaringan Riset Batan dilakukan dengan dua metode yaitu dengan liofilisasi dan suhu ruangan (air
dried), liofilisasi adalah penghilangan air melalui sublimasi yakni perubahan
wujud padat (es) langsung menjadi wujud gas (uap) sehingga menghambat aktifitas mikroorganisme dan enzim secara normal dapat mendegradasi senyawa di dalam bahan biologi. Sehingga pengeringan dengan cara ini dapat mengurangi kerusakan jaringan secara minimal (Suryani, 2013).
Proses pengawetan jaringan agar jaringan biologi dapat disimpan dalam waktu lama, BJRB melakukan beberapa cara proses pengawetan, antara lain (Abbas, 2010) :
Liofilisasi, yaitu suatu proses pengeringan dari bahan biologi dengan cara sublimasi. Bahan biologi dibekukan dan dikeringkan
tanpa melalui fase cair. Dengan cara ini tidak mengalami perubahan kimia dan fisika.
Pembekuan pada suhu ‒80°C, dilakukan untuk menjaga keamanan dari jaringan alograf agar tetap awet sebelum diproses. Disamping itu juga digunakan untuk menyimpan jaringan autograf untuk dipakai kembali oleh pasien yang sama di kemudian hari. Penyimpanan jaringan pada suhu ‒80°C dapat digunakan sebelum 5 tahun.
Sterilisasi Radiasi, untuk menjaga keamanan dari jaringan biologi, jaringan disterilkan dengan cara radiasi dengan sinar γ atau partikel elektron. Sterilisasi radiasi sangat cocok untuk jaringan biologi, karena prosesnya dingin sehingga tidak mengubah struktur jaringan, tidak meninggalkan residu beracun, sangat ampuh membunuh mikroorganisme dan juga virus sampai batas tertentu, sehingga aman digunakan untuk implantasi pada manusia.
Jaringan yang telah diproses dengan cara liofilisasi hingga kadar air 5‒7%, dikemas dalam kantung plastik poli etilen, dan diiradiasi dengan dosis 25kGγ. Jaringan tersebut dapat disimpan pada suhu 4‒10°C dan terhindar dari cahaya matahari langsung. Cara penyimpanan ini direkomendasikan hanya untuk 2‒5 tahun, tergantung dari jenis jaringannya. Untuk menjaga kualitas dan sterilitas jaringan, kemasan yang rusak atau terbuka akibat pemakaian (jaringan sisa) tidak boleh digunakan lagi (Abbas, 2010).
Proses liofilisasi tetap menjaga morfologi membran amnion seperti struktur epitel yang terlihat kuboid selapis, beberapa lapisan stratifikasi dan stroma edematosa yang diamati secara makroskopis. Perwarnaan dengan PAS mengindikasikan terdapat membran dasar yang terlihat seperti pembatas dibawah stroma pada membran amnion terliofilisasi (Rodriguez et al., 2009). Kolagen IV terlihat pada membran amnion terliofilisasi membentuk selapis tipis yang memmanjang pada membran dasar yang ditunjukkan secara imunohistokimia.
Selain kandungan kolagen, membran amnion terliofilisasi tetap menjaga kandungan growth factor yang berperan dalam bone healing antara lain
transforming growth factor‒β1 (TGF‒β1), fibroblast growth factor basic
(bFGF) (Rodriguez et al., 2009). Penelitian Grzywocz et al. (2014), menunjukkan beberapa growth factor dari membran sel amnion manusia, seperti FGF‒6, VEGF‒R3, M‒SCF‒R, IGFBP‒4, IGFBP‒6 dan PDGF‒AB (Grzywocz et al., 2014). Membran sel amnion mengekspresikan bone
morphogenetic protein (BMP)‒2 dan ‒4 dan juga kolagen tipe 2 yang memiliki
potensi terapeutik sebagai terapi dari kerusakan atau penyakit kartilago (Toda
et al., 2007).
Growth factor adalah protein yang disekresikan oleh sel yang aktif pada sel
target atau sel yang memiliki aksi yang spesifik. Growth factor memiliki kegunaan klinis yang potensial dalam meningkatkan perbaikan tulang, termasuk
mempercepat penyembuhan tulang, tatalaksana kejadian nonunion, dan juga sebagai salah satu elemen dari strategi tissue‒engineering yang komprehensif yang termasuk dalam terapi gen untuk tatalaksana permasalahan bone loss dalam jumlah besar (Lieberman et al., 2002).
Transforming growth factor‒beta (TGF‒β) memiliki super family yang
termasuk kedalamnya adalah bone morphogenetic protein (BMPs), growth
differentiation factor (GDF), activins, inhibins dan Mullerian inhibiting substance. Pada proses penyembuhan fraktur, TGF‒β berperan sebagai
mitogenik dan kemotaktik poten bagi sel pembentuk tulang, faktor kemotaktik bagi makrofag. Sedangkan BMPs berperan dalam diferensiasi pada
undifferentiated mesenchymal cell menjadi kondrosit dan osteoblas, dan
osteoprogenitor menjadi osteoblas (Dimitriou et al., 2005).
Selain TGF‒β dan BMPs, growth factor lain yang terkandung dalam ALS‒R adalah fibroblast growth factor (FGFs) berperan dalam angiogenetik dan mitogenik pada sel mesenkimal dan epitel, osteoblas dan kondrosit. α‒FGF memiliki efek terhadap proliferasi kondrosit, β‒FGF (lebih poten) mempengaruhi maturasi kondrosit dan resorpsi tulang. Insulin‒like growth
factor‒I (IGF‒I) berperan dalam proliferasi dan melibatkan sel mesenkimal dan
osteoprogenitor yang diekspresikan pada penyembuhan fraktur. IGF‒I mempromosikan pembentukkan matriks tulang (kolagen tipe‒1 dan matriks protein non‒kolagen) oleh osteoblas yang telah berdiferensiasi. Sedangkan IGF‒II aktif kemudian saat pembentukkan tulang endokondral dan
menstimulasi produksi kolagen tipe‒1, matriks kartilago dan proliferasi seluler.
Platelet‒derived growth factor (PDGF) memiliki peran yang sama seperti
TGF‒β dalam mitogenik bagi sel mesenkimal dan osteoblas, kemotaktik bagi sel inflamatorik dan mesenkimal (Dimitriou et al., 2005).
Vascular endothelial growth factor (VEGF) diproduksi oleh sel endotel,
makrofag, fibroblas, sel otot polos, osteoblas dan kondrosit hipertrofik. VEGF berperan dalam angiogenesis pada proses penyembuhan fraktur. Selain itu secara tidak langsung VEGF menginduksi proliferasi dan diferensiasi dari sel prekursor osteoblas. Hal ini dihasilkan dari sekresi faktor osteoanabolik seperti endotelin‒I dan IGF‒I oleh sel endotel yang distimulasi VEGF (Beamer et al., 2009).
Baik secara seluler, atau aseluler membran amnion memiliki fungsi dalam penyembuhan fraktur. Penelitian menunjukkan human acellular amniotic
membran (HAAM) dapat memuat bone marrow mesechymal stem cell
(BMSCs) yang dapat memperbaiki jaringan kartilago sendi pada kelinci percobaan pada lingkungan in vitro. Komponen utama dari tissue‒engineered kartilago adalah seed cell, scaffold, dan growth factors. Seed cells adalah elemen dasar dari perbaikan jaringan dan menjadi kandungan utama dalam perbaikan defek kartilago. Sebagai sel pemicu (cell scaffold), human amniotic
membranes (HAM) memiliki komposisi sel yang mempromosikan proliferasi
dan diferensiasi dengan lebih banyak substansi adhesi (seperti kolagen dan laminin) (Liu et al., 2014).
Growth factor memiliki peran dalam aktivitas molekuler masing‒masing
berdasarkan waktu dan proses penyembuhan seperti yang dijelaskan pada tabel 2.
Tabel 2. Waktu dan aktivitas molekuler pada penyembuhan fraktur
Hari Proses Aktivitas molekuler
Hari ke‒1 Pembentukan hematom, inflamasi
Perekrutan sel mesenkimal Diferensiasi osteogenik MSCs dari sumsum tulang
Sitokin: IL‒1, IL‒6, TNF‒ α
PDGF, TGF‒ β BMP‒2
Hari ke‒3 Proliferasi MSCs dimulai Proliferasi dan diferensiasi dari preosteoblast dan osteoblas di lokasi oleh osifikasi intramembranosa
Proses angiogenesis dimulai Hari ke‒7 Puncak proliferasi sel pada
osifikasi intramembranosa antara hari ke‒7 dan 10
Kondrogenesis dan osifikasi endokondral dimulai (maturasi kondrosit hari ke 9‒14)
Hari ke‒14 Penghentian proliferasi sel
pada osifikasi
intramembranosa, namun aktivitas osteoblas tetap berlangsung
Mineralisasi soft callus,
resorpsi kartilago dan pembentukkan tulang anyaman Neo‒angiogenesis yang diinfiltrasi bersamaan dengan sel mesenkimal
Hari ke‒21 Remodeling tulang anyaman dan mulai berganti menjadi tulang kompak
(Sumber: Dimitriou et al., 2005)
Penurunan kadar sitokin Ekspresi TGF‒β2, ‒β3, GDF‒10, BMP‒5, ‒6 Induksi angiopoietin‒1 Puncak ekspresi TGF‒β2 dan –β3 Ekspresi GDF‒5 dan mungkin GDF‒1 Penurunan ekspresi TGF‒ β2, GDF‒5 dan mungkin GDF‒1 Ekspresi dari BMP‒3, ‒4, ‒7 dan ‒8
Ekspresi dari VEGFs
Penurunan ekspresi TGF‒ β1 dan TGF‒β3, GDF‒10 dan BMPs
Winanto et al., telah melakukan penelitian pada tikus Sprague Dawley yang mengalami fraktur femur yang diberikan ALS‒R dan xenograf. Hasil yang didapatkan meliputi ALS‒R memiliki skor radiologi yang sama dibandingkan dengan kelompok kontrol, namun secara skor histopatologi lebih baik daripada kelompok kontrol. Xenograf memiliki hasil yang sama dengan kelompok kontrol baik secara radiologi maupun histopatologi. Kombinasi antara pemberian membran amnion dengan xenograf lebih baik secara histopatologi dibandingkan kelompok kontrol, dengan hasil yang sama pada skor radiologi (Winanto et al., 2013).
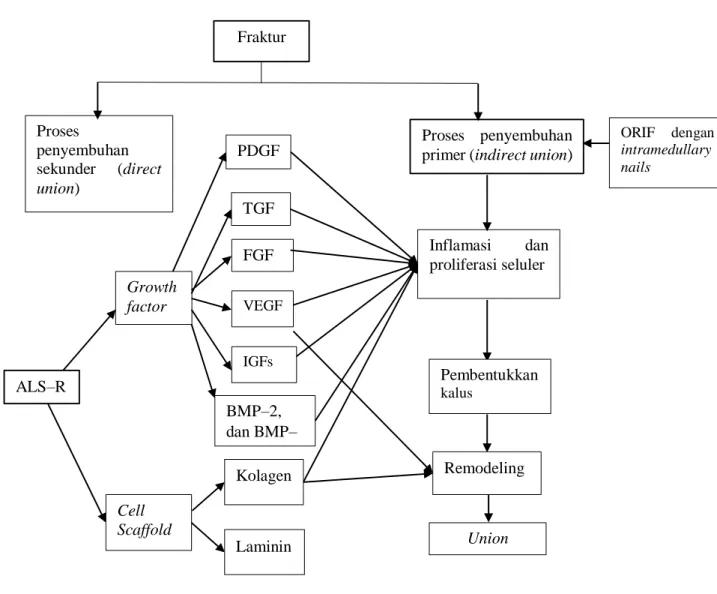
2.5 Kerangka Teori
Penyembuhan fraktur dibagi menjadi direct union dan indirect union. Penanganan operatif pada fraktur dilakukan ORIF dengan menggunakan
intramedullary nails akan melibatkan proses penyembuhan indirect union.
Terdapat beberapa tahapan proses penyembuhan fraktur indirect union seperti inflamasi dan proliferasi seluler, pembentukan kalus, dan remodeling (Solomon
et al., 2010). Dengan penambahan ALS‒R yang mengandung beberapa growth factor seperti PDGF, TGF, FGF, VEGF, IGFs, BMP‒2, BMP‒4 dan cell scaffold seperti kolagen dan laminin diharapkan dapat mempercepat penyatuan
tulang atau union. Pengaruh growth factor dan cell scaffold tersaji pada gambar 9 (Dimitriou et al., 2005; Grzywocz et al., 2014; Rodriguez et al., 2009).
Gambar 9. Kerangka Teori Pengaruh ALS‒R terhadap perbaikan fraktur (Dimitriou et al., 2005; Grzywocz et al., 2014; Rodriguez et al., 2009; Solomon et
al., 2010) PDGF ALS‒R Growth factor Cell Scaffold TGF IGFs VEGF Kolagen Laminin FGF Fraktur ORIF dengan intramedullary nails Proses penyembuhan primer (indirect union)
Inflamasi dan proliferasi seluler Pembentukkan kalus Remodeling Union Proses penyembuhan sekunder (direct union) BMP‒2, dan BMP‒ 4
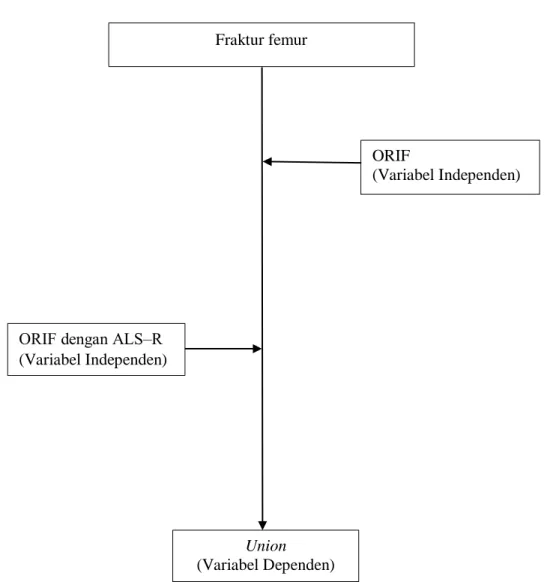
2.6 Kerangka Konsep
Gambar 10. Kerangka konsep perbandingan penyembuhan fraktur femur yang dilakukan ORIF dan ALS‒R dengan tanpa ALS‒R
2.7 Hipotesa Penelitian
Hipotesis penelitian ini adalah sebagai berikut:
a. Terdapat pengaruh ORIF terhadap penyembuhan fraktur femur pada tikus Sprague Dawley secara histopatologi
b. Terdapat pengaruh penambahan ALS-R pada ORIF terhadap penyembuhan fraktur femur pada tikus Sprague Dawley secara histopatologi
ORIF dengan ALS‒R (Variabel Independen) Fraktur femur ORIF (Variabel Independen) Union (Variabel Dependen)
c. Terdapat pengaruh penambahan ALS-R pada ORIF terhadap penyembuhan fraktur femur yang dilakukan ORIF pada tikus