1
A. Latar Belakang
Nifedipin adalah obat anti hipertensi yang memiliki aksi sebagai antagonis kanal kalsium. Nifedipin sering digunakan karena mudah didapatkan dan juga toksisitasnya yang rendah. Namun obat ini memiliki kekurangan yaitu memiliki waktu paruh pendek berkisar 4 jam, yang menyebabkan frekuensi penggunaan semakin meningkat (2-3 kali sehari). Hal tersebut menyebabkan berkurangnya kepatuhan pasien akan penggunaan obat nifedipin.
Sediaan lepas lambat dapat digunakan sebagai solusi untuk permasalahan tersebut. Sediaan lepas lambat merupakan suatu sistem yang dapat melepaskan obat dengan jumlah tertentu secara perlahan-lahan. Sediaan tersebut ditujukan untuk menjaga agar kadar obat dalam tubuh tetap konstan berada dalam jendela terapetik dalam jangka waktu yang lama.
Pada umumnya obat-obat yang cocok digunakan menjadi sediaan lepas lambat ialah obat yang memiliki laju absorbsi dan ekskresi yang tinggi, obat yang dosisnya relatif kecil, dan obat yang digunakan untuk mengobati keadaan kronik daripada akut (Ansel, 1985). Berdasarkan hal tersebut, maka nifedipin dapat diformulasikan menjadi obat sediaan lepas lambat.
Sediaan tablet lepas lambat yang akan dibuat, ditahan sedemikian rupa di dalam lambung, jangan sampai turun ke saluran cerna bagian bawah hingga proses disolusi berakhir. Hal ini disebabkan karena nifedipin memiliki absorbsi
yang baik dan hampir sempurna (90%) dalam lambung (Hardjono, 2008). Bioavailibilitasnya akan meningkat seiring dengan banyaknya obat yang terabsorbsi di lambung. Bentuk sediaan yang dapat dipertahankan di dalam lambung disebut Gastroretentive Drug Delivery System (GRDDS). GRDDS dapat memperbaiki pengontrolan penghantaran obat yang memiliki jendela terapeutik sempit dan obat yang tidak merata diabsorbsi di saluran cerna namun absorbsinya baik di dalam lambung. Salah satu sistem penghantaran obat yang dapat meningkatkan waktu tinggal di lambung dengan cara mengontrol densitas sediaan lebih kecil dari densitas cairan lambung disebut sebagai sistem floating (Gohel, dkk., 2004).
Sediaan tablet lepas lambat banyak diformulasikan dengan menggunakan matriks-matriks hidrofilik. Karena saat polimer berhidrasi, intensitas pelepasan obatnya akan menurun akibat matriks yang mengembang dan menjadi gel penghalang pada bagian luar tablet (Moes, 2003). Dengan pertimbangan tersebut, maka pada formula ini digunakan kombinasi antara Hidroksipropil metilselulosa (HPMC) dan CMC-Na.
HPMC yang merupakan polimer hidrofilik, akan mengalami hidrasi dan peregangan rantai ketika terjadi kontak dengan air atau cairan GIT, sehingga membentuk lapisan gel kental. Pelepasan obat dapat terjadi melalui difusi dan/atau erosi dari matriks. Semakin meningkat konsentrasi HPMC maka kekuatan gel polimer yang terbentuk akan meningkat. HPMC umumnya ditambahkan dalam formula tablet sediaan lepas lambat dengan zat aktif yang memiliki dosis yang
besar atau kelarutan yang tinggi dengan konsentrasi 15-35% (Cabelka, dkk., 2010).
Natrium karboksimetilselulosa (CMC-Na) merupakan polimer semi sintetik, yang bersifat anionik, hidrofilik dan merupakan polimer biodegradable. CMC-Na sering digunakan untuk formulasi sediaan farmasi terutama untuk penggunaan oral dan topikal, karena sifatnya yang dapat meningkatkan viskositas. CMC-Na juga dapat digunakan sebagai bahan pengikat dan disintegran pada tablet, juga sebagai stabilizer pada emulsi. Konsentrasi tinggi (3-6%) digunakan untuk menghasilkan massa gel yang dapat digunakan sebagai basis (Rowe, dkk., 2009). Pada pH 4,5 – 6,8 terbentuk rantai makromolekular dalam gel yang terdiri dari ikatan yang lemah sehingga pelepasan obat dapat terjadi dengan cara erosi dari matriks natrium karboksi metil selulosa (Rowe, dkk., 2009).
Sistem floating dapat dibuat dengan menambahkan effervescent agent
(asam dan basa) yang menghasilkan gas CO2, sehingga membuat tablet dapat mengapung. Selain itu, penggunaan matriks HPMC dan CMC-Na yang dapat mengembang jika terkena air, juga dapat membantu tablet untuk mengapung di cairan lambung.
Selanjutnya, untuk mengetahui komposisi optimal campuran HPMC dan CMC-Na, dapat digunakan metode optimasi dalam formulasi yang digunakan. Salah satu metode optimasi yang dapat digunakan adalah metode Simplex Lattice Design (SLD).
B. Rumusan Masalah
1. Bagaimana pengaruh kombinasi matriks campuran HPMC dan CMC-Na terhadap sifat fisik, kemampuan floating, dan profil disolusi tablet lepas lambat nifedipin?
2. Berapakah campuran HPMC dan CMC-Na yang digunakan untuk mendapatkan formula yang optimum pada tablet lepas lambat nifedipin?
C. Tujuan penelitian
1. Mengetahui pengaruh kombinasi matriks campuran HPMC dan CMC-Na terhadap sifat fisik, kemampuan floating, dan profil disolusi tablet lepas lambat nifedipin.
2. Mengetahui jumlah campuran HPMC dan CMC-Na yang digunakan untuk mendapatkan formula yang optimum pada tablet lepas lambat nifedipin.
D. Manfaat Penelitian 1. Manfaat bagi peneliti
Penelitian ini diharapkan dapat menghasilkan sediaan tablet lepas lambat nifedipin dengan sistem floating yang memiliki sifat fisik tablet yang baik, serta dapat memberikan pelepasan yang terkontrol. Sehingga tujuan utama untuk meningkatkan bioavailibilitas nifedipin dapat dicapai.
2. Manfaat bagi instansi
Untuk menambah khasanah ilmu pengetahuan di bidang teknologi formulasi khususnya sistem penghantaran tablet secara lepas lambat.
3. Manfaat bagi ilmu pengetahuan
Sebagai pengetahuan dalam mengembangkan sistem penghantaran tablet secara lepas lambat sebagai alternatif pengobatan.
E. Tinjauan Pustaka
1. Tablet
Tablet adalah sediaan adat mengandung bahan obat dengan atau tanpa bahan pengisi. Berdasarkan metode pembuatan, dapat digolongkan sebagai tablet cetak dan tablet kempa. Sebagian besar tablet dibuat dengan cara pengempaan dan merupakan bentuk sediaan yang paling banyak digunakan. Tablet kempa dibuat dengan memberikan tekanan tinggi pada serbuk atau granul menggunakan cetakan baja. Tablet dapat dibuat dalam berbagai ukuran, bentuk dan penandaan permukaan tergantung pada desain cetakan. Tablet cetak dibuat dengan cara menekan massa serbuk lembab dengan tekanan rendah ke dalam lubang cetakan. Kepadatan tablet tergantung pada ikatan kristal yang terbentuk selama proses pengeringan selanjutnya dan tidak tergantung pada kekuatan tekanan yang diberikan (Departemen Kesehatan, 2014).
2. Sediaan lepas lambat
Bentuk sustained-release dirancang supaya pemakaian satu unit dosis tunggal menyajikan pelepasan sejumlah obat segera setelah pemakaiannya, secara tepat menghasilkan efek terapeutik yang diinginkan secara
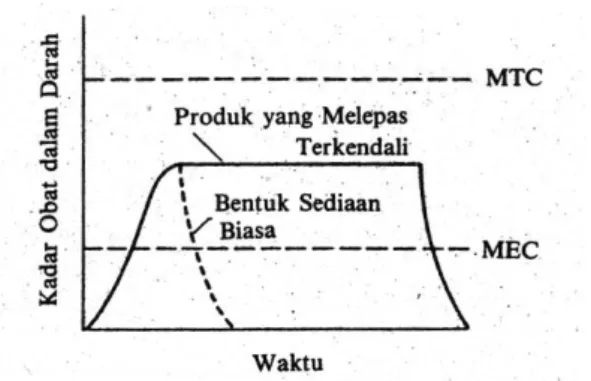
berangsur-angsur dan terus menerus melepaskan sejumlah obat lainnya untuk memelihara tingkat pengaruhnya selama periode waktu yang diperpanjang, biasanya 8 sampai 12 jam. Keunggulan tipe bentuk sediaan ini menghasilkan kadar obat dalam darah yang merata tanpa perlu mengulangi pemberian unit dosis (Ansel, 1985). Profil kadar obat dalam darah untuk bentuk sediaan lepas lambat dapat dilihat pada gambar 1.
Gambar 1. Kurva hipotesis level obat dalam darah terhadap waktu untuk bentuk sediaan konvensional dan produk penglepasan terkendali (Ansel, 1985).
Faktor yang perlu diperhatikan dalam formulasi sediaan lepas lambat adalah faktor fisikokimia, biologi, dan farmasetik (Shargel, dkk., 1999).
1. Faktor fisikokimia yang mempengaruhi formulasi bentuk sediaan lepas lambat per oral adalah : dosis, ionisasi, pKa dan kelarutan, koefisien partisi, stabilitas.
2. Faktor-faktor biologi yang mempengaruhi formulasi bentuk sediaan lepas lambat per oral adalah : waktu paruh (t½), absorbsi, distribusi, metabolisme, jendela terapetik.
Profil pelepasan obat pada sediaan lepas lambat diharapkan sesuai dengan kinetika orde nol baik secara in vitro maupun in vivo, namun sebagian besar tidak menunjukkan hal yang sama antara in vitro dan in vivo. Hal ini disebabkan karena beberapa prose salami yang tidak dapat diperkirakan dalam saluran cerna yaitu pada lambung, usus, dan kolon.
Sediaan lepas lambat memiliki banyak keuntungan antara lain (Aulton & Taylor, 2013):
1. Meningkatkan kepatuhan pasien karena cukup dengan memberikan 1-2 tablet tiap harinya
2. Frekuensi penggunaan tablet untuk memperoleh efek yang diinginkan dapat berkurang
3. Memperpanjang aktivitas obat untuk memberikan efek dalam waktu yang lama
4. Mengurangi efek samping yang tidak menguntungkan akibat pemakaian obat berulang-ulang
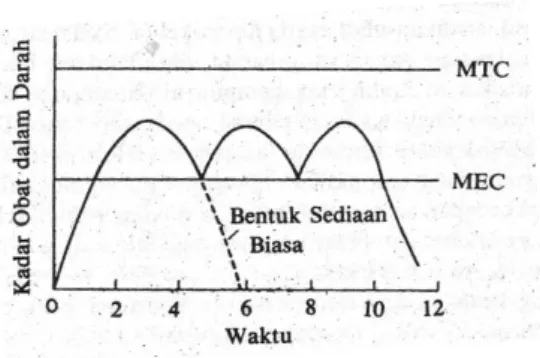
5. Menghasilkan kadar obat dalam darah yang lebih stabil daripada tablet konvensional dengan dosis berulang (Gambar 2).
Gambar 2. Kurva kadar dari hipotesis dalam darah terhadap waktu untuk bentuk sediaan padat konvensional dan produk aksi berulang (Ansel, 1985).
Beberapa metode dapat digunakan untuk merancang bentuk sediaan lepas lambat. Diantaranya adalah metode yang didasarkan pada modifikasi obat yang meliputi pembentukan kompleks, pembentukan obat-absorbat serta pembentukan prodrug. Metode lain adalah metode yang didasarkan pada modifikasi bentuk sediaan yaitu matrix embedded (bahan obat didispersikan kedalam suatu matriks) dan konsep matrix barier (bahan obat disalut dalam retardan material) (Lachman, dkk., 1986).
3. Tablet floating
Floating drug delivery system (FDDS) merupakan gastroretentive drug delivery system (GRDDS) yang paling banyak digunakan dalam pengembangan sediaan farmasi. Mekanisme kerja terjadinya floating secara umum yaitu sediaan akan dapat mengapung karena memiliki kerapatan lebih rendah dibandingkan dengan kerapatan cairan lambung yaitu 1.4 g/mL (Paradkar & Bakliwal, 2008).
Pada sistem effervescent kemampuan mengapung dapat dicapai dengan pembentukan gas CO2 karena adanya reaksi antara karbonat atau bikarbonat dengan asam pada formula. Sistem penghantaran daya apung dapat juga menggunakan matriks polimer yang dapat mengembang, seperti methocel atau polisakarida. Sistem lainnya dapat dibuat dari cairan yang berubah menjadi gas pada temperature tubuh (Shah, dkk., 2009).
Pada tablet dan kapsul, komponen effervescent dicampur dalam matriks hidrofilik dan gas CO2 terjebak didalam matriks yang mengembang. Ketika berada di lambung, CO2 dibebaskan dengan adanya asam dan terjebak
dalam hidrokoloid gel. Akibatnya sediaan dapat naik dan mengapung dalam cairan lambung (Khan & Bajpai, 2011).
4. Optimasi simplex lattice design
Ada beberapa metode yang dapat dilakukan untuk mendapatkan optimasi formula. Salah satunya adalah metode simplex lattice design. Metode ini cocok untuk prosedur optimasi formula dimana jumlah total dari bahan yang berbeda adalah konstan. Pelaksanaan metode simplex lattice design yaitu dengan mempersiapkan formula yang bervariasi terdiri dari kombinasi bahan tambahan (Bolton, 2010).
Metode simplex lattice design dapat digunakan untuk menentukan proporsi relatif bahan-bahan yang digunakan dalam suatu formula, sehingga diharapkan akan dapat dihasilkan suatu formula yang paling baik (dari campuran tersebut) sesuai kriteria yang ditentukan (Sulaiman, 2012).
5. Pemerian bahan a. Nifedipin
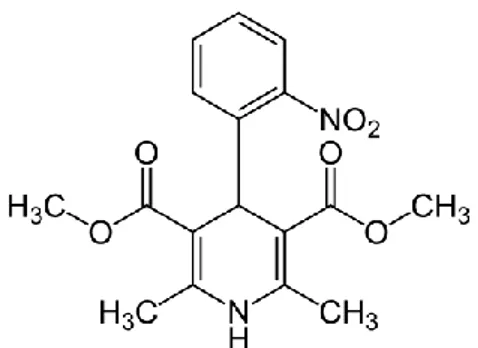
Nifedipin mengandung tidak kurang dari 98,0% dan tidak lebih dari 102,0% C17H18N2O6, dihitung terhadap zat yang telah dikeringkan. Nifedipin mempunyai nama kimia 1,4-dihidro-2,6-dimetil-4-(O-nitrofenil)-3,5-piridinadikarboksilat dengan berat molekul 346,34. (Departemen Kesehatan, 2014). Struktur molekul nifedipin ditunjukkan pada gambar 3.
Gambar 3. Struktur molekul nifedipin
Nifedipin merupakan senyawa yang sensitif terhadap cahaya. Nifedipin akan segera berubah menjadi turunan nitrosofenilpiridin jika terpapar cahaya biasa dan cahaya buatan pada panjang gelombang tertentu Cahaya ultraviolet sangat berpengaruh dalam pembentukan turunan nitrofenilpiridin. Penetapan kadar dan semua pengujian harus dilakukan di tempat gelap atau berfluoresensi keemasan atau cahaya aktinik rendah (Departemen Kesehatan, 2014).
Nifedipin merupakan obat golongan dihidropiridin sebagai calcium channel blocker yang sering digunakan pada terapi hipertensi dan angina. Mekanisme kerja nifedipin adalah menghambat masuknya ion Ca2+ sehingga menghambat terjadinya kontraksi otot polos jantung dan otot polos vaskuler. Nifedipin akan menimbulkan vasodilatasi pada otot polos pembuluh darah sehingga terjadi penurunan tekanan darah. Untuk pengobatan jangka panjang pada angina stabil dan kronik, sering digunakan antagonis kalsium sebagai obat pilihan pertama. Untuk pengobatan hipertensi dan angina, sediaan lepas lambat nifedipin diberikan
dengan dosis 10-40 mg dua kali sehari satu tablet atau 20-90 mg satu kali sehari satu tablet (Sweetman, 2009).
b. PVP K-30 (Copovidone)
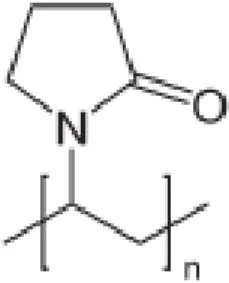
Polivinilpirolidon berupa serbuk halus, putih sampai berwarna putih krem, tidak berbau, serbuk bersifat higroskopis. Nama kimia 1-etenil-2-pirolidon homopolimer dan rumus molekul (C6H9NO)n. Struktur molekul PVP K-30 ditunjukkan pada gambar 4.
Gambar 4. Struktur molekul PVP Keterangan : Jumlah n > 1.000.000
Beberapa kegunaan PVP dalam formulasi farmasetik adalah sebagai pensuspensi dan pengikat tablet baik sebagai pengikat kering (serbuk) atau sebagai pengikat dalam granulasi basah (larutan); peningkatan viskositas pada beberapa sediaan topikal, suspensi maupun larutan oral. PVP juga dapat meningkatkan kelarutan obat-obat yang sukar larut (Rowe, dkk., 2009).
Polivinilpirolidon larut dalam asam, kloroform, etanol, keton, methanol, dan air, praktis tidak larut dalam eter, hidrokarbon, dan minyak mineral. Polivinilpirolidon akan menjadi lebih gelap pada pemanasan suhu
diatas 150°C dan dapat menurunkan kelarutannya dalam air (Rowe, dkk., 2009).
c. Hidroksipropil metilselulosa (HPMC)
Rumus molekul : C8H15O6-(C10H18O6)n – C8H15O6
Nama Kimia : Cellulose, Hydroxypropil methyl ether
BM : 10.000 – 1.500.000
HPMC memiliki sifat larut dalam air dingin, praktis tidak larut dalam kloroform, etanol (95%) dan eter; namun larut dalam campuran etanol dan klorometana, campuran metanol dan diklorometana, dan campuran air dan alkohol. Larut dalam larutan aseton encer, campuran diklorometana dan propan-2-ol, dan pelarut organik lain. (Parfitt, 1999). Struktur molekul HPMC ditunjukkan pada gambar 5.
Gambar 5. Struktur molekul HPMC Keterangan : Jumlah n = 30-4600,R = H, CH3, atau C3H6OH
HPMC merupakan polimer hidrofilik, dimana ketika terjadi kontak dengan air atau cairan GIT maka akan terjadi hidrasi dan peregangan rantai sehingga dapat membentuk lapisan gel kental.
d. Carboxymethylcellulose sodium (CMC Na)
CMC-Na dengan berat molekul 90.000 – 700.000, praktis tidak larut dalam aseton, etanol (95%), eter dan toluene. Merupakan polimer
semi sintetik yang mudah terdispersi dalam air pada semua temperatur membentuk larutan koloid yang jernih. Struktur molekul CMC-Na ditunjukkan pada gambar 6.
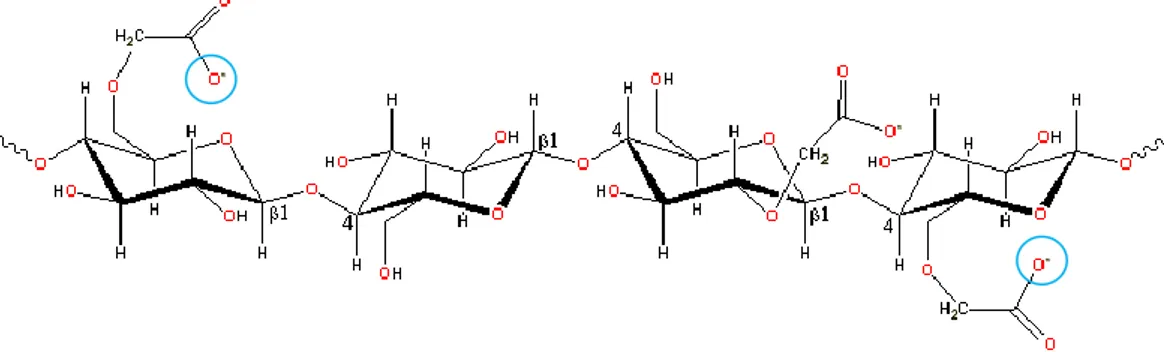
Gambar 6. Struktur molekul Carboxymethilcelulose (CMC)
Keterangan : Na+ akan mengikat O- pada gugus karboksil
CMC-Na merupakan polimer semi sintetik, yang bersifat anionik, hidrofilik dan merupakan polimer biodegradable. Pada pH 4,5 – 6,8 terbentuk rantai makromolekular dalam gel yang terdiri dari ikatan yang lemah sehingga pelepasan obat dapat terjadi dengan cara erosi dari matriks CMC-Na.
e. Aerosil
Nama lain : koloidal silica, Cab-O-Sil, silica, koloidal silicon dioksida
Rumus empiris : SiO2 Berat molekul : 60.08
Aerosil merupakan uap silica submikroskopik dengan ukuran partikel sekitar 15 nm. Berwarna putih terang, tidak berbau, tidak berasa. Ukuran partikel yang kecil dengan luas permukaan yang besar membuatnya
memiliki sifat alir yang baik. Sehingga dapat meningkatkan sifat alir serbuk kering dan membantu dalam proses kempa tablet atau pengisian kapsul. Aerosil digunakan sebagai pelican (glidant) pada konsentrasi 0.1-1% (Rowe, dkk., 2009).
f. Mg Stearat
Magnesium stearat merupakan serbuk, putih, licin, mudah melekat pada kulit, bau yang khas dari asam stearat dan rasa yang khas. Berat molekul magnesium stearat adalah 591,34. Rumus empiris C36H70MgO4. Struktur molekul Mg Stearat ditunjukkan pada gambar 7.
Gambar 7. Struktur molekul Mg Stearat
Magnesium stearat tidak larut dalam air, alcohol, eter, dan aseton, serta sedikit larut dalam alkohol dan benzen panas. Mempunyai titik lebur 88,5°C, kemampuan untuk mengalir rendah dan merupakan serbuk kohesif. Magnesium stearat digunakan sebagai lubrikan, glidan dan anti adheren pada tablet dan kapsul dengan kadar 0,25-2,0 %. Nama lain Magnesium Stearat adalah metalik stearat dan garam stearat (Rowe, dkk., 2009).
g. Avicel
Avicel atau microcristallin cellulose merupakan selulosa yang terdepolimerisasi parsial berwarna putih, tidak berasa, tidak berbau, serbuk
kristal yang terdiri atas partikel porous, tidak larut dalam asam encer dan sebagian pelarut organik. Nama lainnya adalah cellulose gel, fibrocel, dan pharmacel, dengan rumus kimia (C6H10O5)n (Rowe, dkk., 2009).
h. Na-Bikarbonat
Gambar 8. Struktur molekul Na-Bikarbonat
Natrium Bikarbonat memiliki penampakan tidak berbau, berwarna putih, berbentuk serbuk kristal salin, memiliki sedikit rasa basa. Struktur molekul Na-Bikarbonat ditunjukkan pada gambar 8. Na-Bikarbonat biasa digunakan dalam formulasi sediaan farmasi sebagai pembentuk gas karbon dioksida pada tablet dan granul efferfescent. Selain itu juga banyak digunakan untuk menghasilkan atau menjaga suasana basa (Rowe, dkk., 2009).
Dalam tablet dan granul efferfescent, Na-Bikarbonat biasa diformulasikan bersama dengan asam sitrat dan/atau asam tartrat. Saat tablet atau granul kontak dengan air, akan timbul reaksi kimia, terbentuknya karbon dioksida, dan selanjutnya produk akan mengalami proses disintegrasi (Rowe, dkk., 2009).
i. Asam Sitrat
Asam sitrat anhidrat (C6H8O7), memiliki bobot molekul 192,12. Asam sitrat memiliki penampakan tidak berbau atau hampir tidak berbau, kristal tidak berwarna atau serbuk kristal putih. Memiliki densitas 1,665 g/cm3 dan titik lebur 153˚C.
Asam sitrat (baik yang monohidrat maupun anhidrat) banyak digunakan dalam formulasi sediaan farmasi dan produk makanan, terutama untuk menyesuaikan pH. Asam sitrat monohidrat digunakan dalam preparasi granul efferfescent, sedangkan Asam sitrat anhidrat banyak digunakan dalam preparasi tablet efferfescent (Rowe, dkk., 2009).
6. Pengujian sifat fisik tablet a. Kekerasan
Kekerasan tablet merupakan sebuah parameter yang menggambarkan ketahanan tablet terhadap tekanan mekanik (goncangan), yang disebabkan karena proses produksi, pengemasan, dan juga distribusi. Kekerasan ini akan berpengaruh pada waktu hancur tablet dan kecepatan disolusi zat aktif dari sediaan (Voigt, 1984).
Alat yang digunakan dalam uji kekerasan tablet disebut hardness tester. Kekerasan tablet konvensional yang baik berkisar 4-8 kg. Sedangkan untuk sediaan lepas lambat, kekerasan tablet yang baik adalah 7-14 kg. Tablet dibuat lebih keras dari tablet konfensional agar proses disintegrasi obat dapat tejadi secara perlahan-lahan.
b. Keseragaman bobot
Uji keseragaman bobot dilakukan untuk mengetahui keseragaman sediaan dengan cara keragaman bobot. Persyaratan keragaman bobot dapat diterapkan pada produk yang mengandung zat aktif 50 mg atau lebih, yang merupakan 50% atau lebih dari bobot satuan sediaan (Departemen Kesehatan, 2014).
c. Keseragaman kandungan
Uji keseragaman kandungan diperlukan untuk sediaan padat yang mengandung bahan inaktif atau aktif yang ditambahkan, kecuali bahwa uji keseragaman bobot dapat diterapkan untuk situasi khusus (Departemen Kesehatan, 2014).
d. Kerapuhan tablet
Friability test atau uji kerapuhan tablet adalah sebuah metode untuk menentukan / mengukur kekuatan fisik tablet non salut terhadap tekanan mekanik atau gesekan. Uji kerapuhan tablet menggunakan alat
friability atau abrasive tester (Voigt, 1984). 7. Total floating time dan floating lag time
Total Floating time adalah lamanya suatu tablet dapat mengapung. Sedangkan floating lag time adalah waktu yang diperlukan dari tablet dimasukkan ke media sampai tablet tersebut dapat mengapung.
8. Uji disolusi
Disolusi merupakan proses dimana suatu bahan kimia atau bahan obat menjadi terlarut dalam suatu pelarut dalam suatu sistem biologis. Pelarutan
atau disolusi obat dalam media air merupakan suatu bagian penting sebelum kondisi absorbsi sistemik (Shargel, dkk., 1999).
Proses disolusi partikel padat mencakup dua proses. Pertama, molekul yang terdapat pada antarmuka padat-cair akan terlarut dan terlepas dari permukaan padat. Kedua, molekul yang terlarut akan berdifusi dari antarmuka ke dalam bulk larutan. Tahap pertama secara umum jauh lebih cepat daripada tahap kedua. Oleh karena itu pada steady state dari proses disolusi, konsentrasi dari zat terlarut pada antarmuka adalah sama atau mendekati kelarutannya.
Disolusi merupakan proses kinetik, sehingga cerminan prosesnya dapat diamati dari jumlah zat aktif yang terlarut ke medium sebagai fungsi waktu (Fudholi, 2013). Penggambaran proses yang terjadi selama disolusi dapat dilihat pada persamaan Noyes Whitney berikut ini:
𝑑𝑊 𝑑𝑡 = 𝐷.𝑆 ℎ (𝐶𝑠 − 𝐶) (1) atau dC dt = ( 𝐷𝑆 𝑉ℎ) (𝐶𝑠 − 𝐶) (2)
W adalah berat zat aktif yang terlarut dalam medium selama waktu t, sehingga dW/dt adalah kecepatan disolusi zat aktif. D adalah koefisien difusi zat yang terlarut dalam medium yang digunakan, S adalah luas kontak muka zat aktif-medium, h adalah tebal lapisan tipis (film-difusi), sedangkan Cs adalah konsentrasi dalam keadaan saturasi, yang besarnya sama dengan kelarutan zat aktif tersebut dalam medium. Harga C menunjukkan konsentrasi
zat aktif terlarut pada saat t. Apabila berat zat terlarut dinyatakan dalam konsentrasi sebagai dC/dt, maka persamaan akan berubah dengan menyertakan faktor volume medium (V).
9. Linearitas, presisi, dan akurasi
Liniearitas merupakan kemampuan suatu metode untuk memperoleh hasil-hasil uji yang secara langsung proporsional dengan konsentrasi analit pada kisaran yang diberikan. Linearitas suatu metode merupakan ukuran seberapa baik kurva kalibrasi yang menghubungkan antara resspon (y) dengan konsentrasi (x). Linearitas dapat diukur dengan melakukan pengukuran tunggal pada konsentrasi yang berbeda-beda. Data yang diperoleh selanjutnya dapat ditentukan nilai kemiringan (slope), intersep, dan koefisien korelasinya (r) (Gandjar & Rohman, 2012).
Linearitas paling baik dievaluasi dengan pengamatan visual terhadap suatu plot yang menyatakan hubungan antara fungsi konsentrasi analit dengan signal yang diukur (absorbansi, luas puncak, tinggi puncak, area dibawah kurva, dsb). Pada uji linearitas, paling tidak 6 konsentrasi yang berbeda digunakan pada uji. Pada keadaan normal, linearitas diperoleh ketika nilai koefisien determinasi (r2) ≥ 0,997.
Presisi merupakan ukuran keterulangan metode analisis dan biasanya diekspresikan sebagai simpangan baku relatif atau relative standard deviation
(biasanya disingkat dengan RSD) dari sejumlah sampel. Sesuai dengan ICH, presisi harus dilakukan pada 3 tingkatan yang berbeda yaitu:
yakni presisi pada kondisi percobaan yang sama (berulang) baik orangnya, peralatannya, tempatnya, maupun waktunya.
2. presisi antara (intermediate precision)
yakni presisi pada kondisi percobaan yang salah satunya berbeda baik orangnya, peralatannya, tempatnya, maupun waktunya.
3. ketertiruan (reproducibility)
Reprodusibilitas mengukur presisi antar laboratorium sebagaimana studi-studi kolaboratif atau studi-studi uji banding antar laboratorium dan atau uji profisiensi.
Pengujian presisi pada saat awal validasi metode, seringkali hanya menggunakan parameter keterulangan dan presisi antara. Untuk mengamati keterulangan, dilakukan pengukuran sebanyak 9 kali (minimal) yang mencakup kisaran yang digunakan dalam prosedur analisis misalkan dengan 3 konsentrasi yang berbeda pada kisaran konsentrasi tertentu (80%, 100%, dan 120% dari konsentrasi analit) dengan masing-masing dilakukan replikasi sebanyak 3 kali, atau dengan satu konsentrasi tertentu dan dilakukan replikasi sebanyak 6 kali. Dokumentasi presisi seharusnya mencakup: simpangan baku, simpangan baku relatif (RSD) atau koefisien variasi (CV), dan kisaran kepercayaan sebagaimana dipersyaratkan oleh ICH. Nilai RSD dirumuskan dengan:
CV = 100 𝑥 𝑆𝐷
𝑋 (3)
X merupakan rata-rata data dan SD adalah standar deviasi serangkaian data. Sementara itu nilai SD dihitung dengan :
𝑆𝐷 = √∑(𝑥−𝑋)2
(𝑁−1) (4)
x adalah nilai dari masing-masing pengukuran, X adalah rata-rata (mean) dari pengukuran, N adalah banyaknya data, dan N-1 merupakan derajat kebebasan.
Akurasi merupakan ketelitian metode analisis atau kedekatan antara nilai terukur dengan nilai yang diterima baik nilai konvensi, nilai sebenarnya, atau nilai rujukan. Akurasi diukur sebagai banyaknya analit yang diperoleh kembali pada suatu pengukuran dengan melakukan spiking pada suatu sampel. Untuk pengujian senyawa obat, akurasi diperoleh dengan membandingkan hasil pengukuran dengan bahan rujukan standar (standard reference material, SRM) (Gandjar & Rohman, 2007).
Untuk mendokumentasikan akurasi, ICH merekomendasikan pengumpulan data dari 9 kali penetapan kadar dengan konsentrasi yang berbeda (misal 3 konsentrasi dengan 3 kali replikasi). Data harus dilaporkan sebagai presentase perolehan kembali. Rata-rata perolehan kembali (recovery) analit harus antara 80-110 % pada tiap level, untuk analit dengan unit 10 ppm (AOAC, 1998).
F. Landasan Teori
Sediaan lepas lambat merupakan suatu sistem yang dapat melepaskan obat dengan jumlah tertentu secara perlahan-lahan. Sediaan tersebut dibuat agar dapat segera melepaskan obat hingga mencapai konsentrasi terapetik dan dapat menjaga kadar obat dalam tubuh tetap konstan berada dalam jendela terapetik dalam jangka
waktu yang lama. Oleh karena itu, sediaan ini sesuai untuk mengobati penyakit kronis seperti hipertensi.
Nifedipin merupakan obat yang sering digunakan dalam terapi hipertensi karena mudah didapatkan dan juga toksisitasnya yang rendah. Nifedipin memiliki absorbsi yang baik dan hampir sempurna (90%) dalam lambung (Hardjono, 2008). Bioavailibilitasnya akan meningkat seiring dengan banyaknya obat yang terabsorbsi di lambung. Berdasarkan hal tersebut, maka nifedipin dapat diformulasikan menjadi obat sediaan lepas lambat gastroretentive.
Sediaan tablet lepas lambat banyak diformulasikan dengan menggunakan matriks-matriks hidrofilik. Dalam sistem ini, partikel obat didispersikan dalam suatu matriks yang larut (soluble matriks). Obat akan dilepaskan ketika matriks kontak dengan air dan mengembang membentuk suatu lapisan matriks yang terhidrasi.
HPMC yang merupakan matriks hidrofilik akan mengalami hidrasi dan peregangan rantai sehingga dapat membentuk lapisan gel kental jika kontak dengan cairan. HPMC umumnya ditambahkan dalam formula tablet sediaan lepas lambat dengan zat aktif yang memiliki dosis yang besar atau kelarutan yang tinggi dengan konsentrasi 15-35% (Cabelka, dkk., 2010).
CMC-Na merupakan polimer semi sintetik, yang bersifat anionik, hidrofilik dan merupakan polimer biodegradable. CMC-Na sering digunakan untuk formulasi sediaan farmasi terutama untuk penggunaan oral dan topical, karena sifatnya yang dapat meningkatkan viskositas. Dengan meningkatkan
konsentrasi CMC-Na dalam sediaan, dapat memperlambat kecepatan pelepasan obat (Varshosaz, dkk., 2006).
Kedua matriks tersebut merupakan polimer yang bersifat hidrofilik, akan mengembang dan membentuk gel jika terkena air. Intensitas pelepasan obat akan menurun akibat matriks yang mengembang dan menjadi gel penghalang pada bagian luar tablet (Moes, 2003). Diharapkan campuran keduanya dapat menghambat pelepasan nifedipin dari sediaan, dan pada akhirnya dapat meningkatkan bioavailibilitas nifedipin.
G. Hipotesis
1. Kombinasi matriks campuran HPMC dan CMC-Na dapat memberikan hasil sifat fisik tablet, floating lag time, total floating time, serta profil pelepasan nifedipin yang optimum.
2. Kombinasi matriks hidrofilik HPMC dengan konsentrasi 15-30% dan CMC-Na dengan konsentrasi yang tinggi, dapat menghasilkan formula optimum pada tablet lepas lambat nifedipin.