OPTIMASI PROSES ELEKTROKOAGULASI LARUTAN ZAT
WARNA METILEN BIRU DENGAN ELEKTRODA BESI
Arenst Andreas*, Livia Effendi, Yandi Junaidi
Jurusan Teknik Kimia, Universitas Katolik Parahyangan Jalan Ciumbuleuit 94, Bandung 40141
*
) arenst_andreas@yahoo.com
Intisari
OPTIMASI PROSES ELEKTROKOAGULASI LARUTAN ZAT WARNA METILEN BIRU DENGAN ELEKTRODA BESI. Limbah yang dihasilkan dari industri – industri kimia sangat berbahaya bagi
lingkungan dan kehidupan makhluk hidup. Oleh karena itu, limbah harus diolah sebelum akhirnya dibuang ke lingkungan. Zat warna merupakan senyawa kimia yang bersifat ionik dan merupakan komponen organik aromatik dengan struktur cincin aryl. Limbah zat warna banyak ditemukan pada industri tekstil. Salah satu metode pengolahan limbah zat warna yang saat ini sedang diteliti lebih dalam lagi untuk dipublikasikan ke seluruh dunia adalah metode elektrokoagulasi. Prinsip dasar dari proses elektrokoagulasi sendiri adalah gabungan antara proses elektrolisis dan koagulasi. Terdapat juga proses adsorpsi dalam proses tersebut. Larutan zat warna akan terelektrolisis dengan adanya elektroda yang kemudian akan menghasilkan flok – flok (gumpalan) yang akan mengadsorpsi zat warna dalam larutan. Gumpalan akan terangkat ke permukaan larutan dan dapat dipisahkan dari larutan.
Kata kunci : Elektrokoagulasi, limbah, zat warna.
Abstract
OPTIMIZATION OF ELECTROCOAGULATION PROCESS IN METHYLENE BLUE DYE SOLUTION WITH IRON ELECTRODE. Waste from chemical industry is very dangerous for the environment and living
beings. This kind of waste is usually being generated during the process. Therefore, the waste must be treated before being discharged into the environment. Dye is a chemical compound which has an aromatic aryl ring structure. Dye wastes commonly found in the textile industry. One of the method for treating dye waste that is currently being investigated more deeply to be published to the world is the method of electrocoagulation. The basic principle of the electrocoagulation process itself is a combination of electrolysis and coagulation. There is also an adsorption process following behind. Dye solution will be electrolysed with an electrode which will result in adsorption of dyes. Flocks which is formed during the process will adsorp dyes and can be separated from the solution.
Keywords : Dye, electrocoagulation, waste.
PENDAHULUAN
Salah satu penyebab terjadinya pencemaran adalah banyaknya air limbah yang dibuang tanpa melalui pengolahan lebih dahulu atau sudah diolah tetapi belum memenuhi persyaratan. Hal ini dimungkinkan karena adanya keengganan mengolah air limbah, di samping itu belum tersedianya sebuah teknologi pengolah air limbah yang mudah dan efisien yang dapat diterapkan di sebuah industri. Sebagai contoh, industri tekstil menimbulkan masalah yang serius bagi lingkungan
terutama masalah yang diakibatkan oleh limbah cair yang dihasilkan. Industri tekstil mengeluarkan air limbah dengan zat warna yang relatif tinggi. Umumnya tujuan dari pengolahan limbah cair industri tekstil adalah mengurangi tingkat polutan organik, logam berat, padatan tersuspensi dan zat warna sebelum dibuang ke badan air. Limbah yang mengandung zat warna seringkali menimbulkan kesulitan dalam penggunaan selanjutnya dalam masalah estetika.
Zat warna banyak digunakan pada proses pencelupan dan pencapan industri
tekstil. Limbah cair dari kedua proses ini merupakan salah satu sumber pencemaran air yang cukup tinggi jika tidak dilakukan pengolahan limbah. Teknologi pengolahan limbah cair baik secara biologi, kimia, fisika, maupun kombinasi antara ketiga proses tersebut dapat digunakan untuk mengolah limbah cair Industri tekstil. Tetapi metode konvensional dinilai kurang efektif. Untuk mengatasi masalah tersebut diperlukan altematif baru untuk mengolah limbah cair indutri tekstil yang efektif dan efisien dalam menurunkan polutan organik dan zat warna. Salah satu alternatifnya yaitu dengan metode elektrokoagulasi.
LANDASAN TEORI
Elektrokoagulasi merupakan gabungan dari elektrokimia dan koagulasi. Mekanisme dari proses elektrokoagulasi terdiri dari koagulasi, adsorpsi, presipitasi, dan flotasi. Pada proses elektrokoagulasi menggunakan besi sebagai anoda untuk menghasilkan flok besi hidroksi yang dihasilkan dari hasil hidrolisis anoda dengan air. Elektrokoagulasi adalah sebuah metode yang sederhana dan efisien untuk pengolahan berbagai limbah air. Tetapi metode ini belum dapat diterima secara global karena biaya yang cukup tinggi dibandingkan dengan metode pengolahan limbah yang lainnya (Retno, 2008). Pada proses elektrokimia akan terjadi pelepasan Fe3+ dari plat elektrode (anoda) sehingga membentuk flok Fe(OH)3 yang mampu
mengikat kontaminan dan partikel-partikel dalam limbah. Flok yang terbentuk dari proses elektrokoagulasi akan memisahkan dan menghilangkan warna dan kekeruhan dari limbah (Lazare Etiegni, 2010).
Proses yang terjadi selama proses elektrokoagulasi dapat dijelaskan melalui Gambar 2.4. Reaksi elektrolitik terjadi pada permukaan elektroda karena adanya rapat arus yang mengalir dari sumber tegangan. Kemudian akan terbentuk ion hidroksil, dimana kation logam akan berinteraksi dengan ion OH- dan membentuk hidroksida yang memiliki kemampuan adsorpsi yang
tinggi. Lalu terjadilah proses adsorpsi larutan atau polutan koloid dalam koagulan yang mana akan menghasilkan flok (partikel halus yang tersuspensi dalam cairan). Selama proses elektrolisis berlangsung, terbentuk pula gas hidrogen pada katoda dan gas oksigen yang akan mengangkat flok – flok yang dihasilkan ke atas permukaan larutan. Lalu flok – flok tersebut akan dapat mudah dipisahkan, misalnya dengan penyaringan (Peter Holt, 2006). Reaksi utama yang terjadi pada elektroda jika digunakan elektroda besi yaitu :
1. Dalam larutan asam Anoda : Fe(s) → Fe2+
(aq) + 2e
-4Fe2+(aq) + 10 H2O(l) + O2 (g) → 4 Fe
(OH)3(s) + 8H+ (aq)
Katoda : 2H+ (aq) + 2e- → H2 (g)
Total :4 Fe(s) + 10 H2O(l) + O2 (g) →
4Fe(OH)2(s) + 4H2 (g)
Gambar 2.4 Rangkaian Alat Elektrokoagulasi (Lazare Etiegni, 2010)
2. Dalam larutan basa Anoda : Fe(s) → Fe2+
(aq) + 2e
Fe2+(aq) + 2OH-(aq)→ Fe(OH)2(s)
Katoda : 2H2O(l) + 2e-→ H2(g) + 2OH
-(aq)
Total : Fe (s) + 2H2O(l)→ Fe(OH)2(s) +
H2(g) .
Pada reaksi juga akan terbentuk gas oksigen yang akan membantu mengangkat flok ke atas permukaan larutan, reaksi yang terjadi yaitu :
2H2O → O2+ 4H+ + 4e
-Dalam larutan juga dapat terjadi reaksi sekunder dimana akan terjadi oksidasi langsung komponen organik dan menghasilkan ion Cl- dalam limbah :
-Klorin yang dihasilkan merupakan oksidan kuat yang akan mengoksidasi komponen organik lainnya dan mempercepat proses reaksi elektroda dan berasal dari larutan elektrolit yang digunakan.
Pada anoda dihasilkan gas, buih dan flok Fe(OH)3 dimana selanjutnya flok yang
terbentuk akan mengikat komponen yang ada di dalam limbah, sehingga flok akan memiliki kecenderungan mengendap. Selanjutnya flok yang telah mengikat kontaminan tersebut lama – lama akan mengapung ke permukaan larutan dengan bantuan gas hidrogen yang dihasilkan oleh katoda sehingga mudah untuk dipisahkan.
METODOLOGI
Percobaan Pendahuluan. Percobaan pendahuluan dilakukan untuk menentukan rentang kuat arus yang digunakan, perlu tidaknya penambahan elektrolit dalam percobaan utama, dan penentuan lamanya proses elektrokoagulasi. Percobaan ini dilakukan menggunakan variasi yang sama yaitu dengan konsentrasi larutan zat warna sebesar 5 ppm. Penentuan dilakukan dengan menggunakan persen removal untuk melihat efisiensi proses. Selain itu dilakukan pula penentuan panjang gelombang maksimum dan penentuan kurva standar yang akan digunakan selama percobaan.
Percobaan Utama. Percobaan utama dilakukan dengan berbagai variasi antara lain :
- Konsentrasi awal larutan : 2 ppm; 3 ppm; 4,5 ppm; 5 ppm; dan 5,34 ppm.
- Jumlah elektrolit : tidak ditambahkan, ditambahkan sebanyak 2 g.
- Kuat arus : 0,33 A; 0,4 A; 0,5 A; 0,6 A; 0,66 A .
- Waktu elektrokoagulasi : 20 menit, 30 menit, 45 menit, 60 menit, dan 70 menit.
Langkah kerja percobaan secara lengkap yaitu pertama, 3 pasang elektroda di celupkan ke dalam larutan. Kemudian dialirkan kuat arus selama 60 menit dan perubahan – perubahan yang terjadi pada larutan diamati. Setiap 5 menit, sampel larutan diambil, di sentrifugasi dengan
kecepatan 6000 rpm selama 10 menit. Kemudian sentrat yang telah terpisah dari flok dimasukkan kedalam kuvet, dan dianalisis menggunakan spektrofotometer. Dari absorbansi yang diperoleh serta kurva kalibrasi yang ada maka konsentrasi zat warna dapat ditentukan. Banyaknya zat warna yang terkoagulasi dapat ditentukan dengan rumus :
%R =
dimana Co adalah konsentrasi awal larutan zat warna dan C adalah konsentrasi larutan zat warna pada kondisi terakhir. Prosedur di atas dilanjutkan dengan variasi percobaan yang telah ditentukan.
HASIL DAN PEMBAHASAN
Percobaan Pendahuluan
Panjang gelombang maksimum yang didapatkan adalah sebesar 665 nm. Persamaan kurva standar yang diperoleh yaitu :
Y = 0,2336 x
Dengan y sebanding dengan A, dan x sebanding dengan C (konsentrasi).
Penambahan NaCl. Percobaan dilakukan
dengan menggunakan konsentrasi larutan zat warna sebesar 5 ppm dengan waktu elektrokoagulasi selama 60 menit. Hasil persen Removal dapat dilihat pada gambar 4.2.
Gambar 4.1 Perbandingan Persen Removal Larutan dengan NaCl dan Tanpa NaCl
Berdasarkan data percobaan, terlihat larutan zat warna yang ditambahkan NaCl memiliki proses elektrokoagulasi yang cenderung lebih cepat dibanding larutan zat warna
0 20 40 60 80 0 50 100 % R e m o val Waktu ( menit ) Tanpa NaCl NaCl
tanpa tambahan NaCl. Hal ini dikarenakan pada penambahan NaCl menyebabkan adanya reaksi samping (A. K. Golder, 2005) yaitu dengan terbentuknya senyawa HOCl. Saat peristiwa elektrokoagulasi terjadi, bagian anoda akan mengalami peristiwa oksidasi dan menghasilkan Cl2 . Senyawa
Cl2 akan bereaksi dengan air dan
membentuk HOCl. Ion OCl- tergolong oksidator kuat yang dapat membantu menguraikan zat organik. Ion OCl- mampu mengoksidasi zat warna sehingga terurai dalam proses elektrokoagulasi.
Peningkatan konduktivitas larutan mengakibatkan kekuatan ion semakin meningkat pada beda potensial yang sama. Penambahan elektrolit NaCl tidak hanya menghasilkan konduktivitas larutan yang meningkat tetapi juga terciptanya agen oksidasi. Jika dibandingkan pada larutan yang tidak diberi penambahan NaCl, proses elektrokoagulasi tetap berjalan tetapi tidak terlihat efisiensi proses yang baik karena proses elektrokoagulasi berlangsung lebih lama untuk mendapatkan persen removal yang lebih tinggi. Berdasarkan hasil ini, variasi percobaan selanjutnya dilakukan dengan penambahan zat elektrolit ( NaCl ) sebanyak 2 g / L. Penambahan NaCl yang terlalu banyak dapat menghasilkan reaksi samping lainnya yaitu reaksi antara besi dengan ion Cl- yang akan menghasilkan FeCl3 sehingga menghambat proses
elektrokoagulasi (A. K. Golder, 2005) . Penambahan NaCl yang terlalu sedikit juga tidak diperbolehkan karena akan mempengaruhi jumlah produksi kuat arus yang dialirkan menjadi lebih kecil.
Penentuan Rentang Waktu
Elektrokoagulasi. Hasil percobaan pada
berbagai rentang waktu elektrokoagulasi dapat dilihat pada gambar 4.2. Berdasarkan hasil percobaan ini, persen removal yang didapatkan cukup bervariasi. Data persen removal yang diperoleh cenderung meningkat hingga menit ke 100 sedangkan pada proses di atas 100 menit data persen removal cenderung naik turun. Oleh karena itu, dipilih rentang waktu antara 0-100 menit untuk proses elektrokoagulasi, tetapi untuk
mengoptimalkan efisiensi proses maka ditetapkan waktu elektrokoagulasi maksimum selama 60 menit.
Penentuan Rentang Kuat Arus. Hasil
persen removal yang didapat pada penentuan rentang kuat arus dapat dilihat pada gambar 4.3. Berdasarkan hasil percobaan, terlihat kecenderungan semakin meningkatnya kuat arus, nilai persen removal cenderung meningkat. Nilai persen removal terkecil didapatkan pada rentang 0,05 A dan nilai terbesar didapat pada kuat arus 0,4 A. Hal ini sesuai karena semakin tinggi kuat arus maka proses elektrokoagulasi berjalan lebih cepat (Mukimin, 2005). Berdasarkan hasil ini dipilih rentang kuat arus yang digunakan pada percobaan antara 0,4-0,6 A agar proses elektrokoagulasi dapat berjalan efektif.
Gambar 4.2 Perubahan Warna Larutan Pada Penentuan Rentang Waktu Elektrokoagulasi
Gambar 4.3 Perbandingan Persen Removal Pada Berbagai Kuat Arus.
Percobaan Utama
Percobaan utama dilakukan dengan berbagai variasi antara lain variasi elektrolit, variasi
0 20 40 60 80 100 0 200 400 600 Per sen R e m o val Waktu ( menit ) Waktu elektrokoagulasi 7,5 jam 6 jam 4 jam 2 jam 1 jam 0 10 20 30 40 50 60 70 0 20 40 60 80 % R e m o val Waktu Elektrokoagulasi 0,05 A 0,24 A 0,4 A
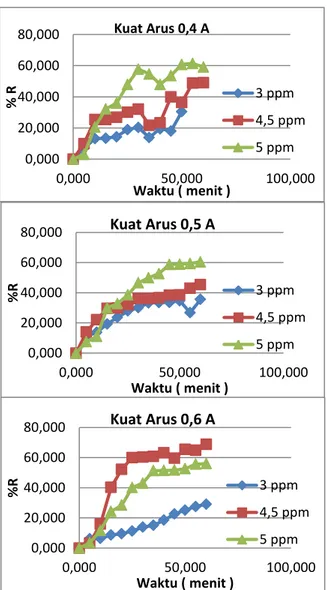
kuat arus, variasi konsentrasi zat warna dan variasi waktu elektrolisis. Hasil persen removal yang diperoleh untuk variasi kuat arus dan konsentrasi zat warna dapat dilihat
pada gambar 4.4.
Gambar 4.4 Persen Removal Variasi Kuat Arus dan Konsentrasi
Pada variasi kuat arus dapat terlihat bahwa persen removal terbesar cenderung diperoleh pada kuat arus 0,5 A, sedangkan untuk persen removal terkecil tidak terdapat kecenderungan yang pasti. Pada variasi kuat arus tidak dapat disimpulkan suatu hasil perubahan persen removal yang berarti karena hasil data yang naik turun. Pada variasi konsentrasi zat warna, pada kuat arus 0,4 A didapatkan kecenderungan semakin tinggi konsentrasi larutan semakin tinggi pula persen removal. Pada kuat arus 0,5 A
dan 0,6 A didapatkan persen removal tertinggi pada konsentrasi 4,5 ppm sedangkan persen removal terkecil pada konsentrasi 3 ppm. Kecenderungan data pada variasi konsentrasi zat warna secara keseluruhan tidak dapat disimpulkan pada variasi ini karena pada kuat arus yang berbeda kecenderungan data yang diperoleh juga berbeda.
Model Regresi. Hasil percobaan di regresi
dan diperoleh hasil regresi seperti pada tabel 4.1.
Tabel 4.1Model Summary Statistics
Source R2 Adjuste d R2 Predicte d R2 Linier 0,8640 0,8385 0,7532 Interaks i 2 faktor 0,8789 0,8320 0,6881 Kuadrat ik 0,9672 0,9376 0,7494 Sugge sted Kualitas dari model dievaluasi berdasarkan dari koefisien korelasi yaitu nilai R2. Model dengan nilai R2 yang tinggi merupakan model yang paling tepat dimana model tersebut akan memberikan nilai yang mendekati nilai sesungguhnya. Dapat dilihat pada tabel 4.1 bahwa nilai R2 terbesar diperoleh pada model kuadratik dan terkecil pada model linier. Nilai R2 yang tinggi mendukung korelasi yang tinggi pula antara yang diamati dengan yang diprediksi. Selain itu, nilai adjusted R2 untuk kuadratik lebih besar dibanding linier dan interaksi 2 faktor. Oleh karena itu model kuadratik diusulkan pada percobaan.
Analisis Varian. Hasil analisis varian removal percobaan dapat dilihat pada tabel 4.3. Analisis varian (ANOVA) dilakukan untuk memastikan signifikansi dari hasil percobaan dan kecukupan model. Istilah model signifikan dikehendaki untuk menghasilkan model yang cocok karena hanya hasil signifikan yang digunakan dalam pembuatan model. Jika nilai prob> F lebih kecil dari 0,05 maka model signifikan
(www.statease.com, 2011). Besarnya F
percobaan yaitu 32,75 dan prob> F sebesar
0,000 20,000 40,000 60,000 80,000 0,000 50,000 100,000 %R Waktu ( menit ) Kuat Arus 0,5 A 3 ppm 4,5 ppm 5 ppm 0,000 20,000 40,000 60,000 80,000 0,000 50,000 100,000 %R Waktu ( menit ) Kuat Arus 0,6 A 3 ppm 4,5 ppm 5 ppm 0,000 20,000 40,000 60,000 80,000 0,000 50,000 100,000 % R Waktu ( menit ) Kuat Arus 0,4 A 3 ppm 4,5 ppm 5 ppm
0,0001 menyatakan bahwa model tersebut signifikan.
Faktor A, B, C, A2, B2, dan C2 merupakan model signifikan dimana faktor AB, AC dan BC bersifat tidak signifikan terhadap respon. Faktor AB, AC dan BC menandakan respon orde 2 yang merepresentasikan interaksi antar berbagai faktor (Mohr Azmier Ahmad, R. A, 2011). Berdasarkan hasil ANOVA diketahui bahwa interaksi antar variabel tidak menghasilkan pengaruh yang signifikan.
Tabel 4.3 Tabel Analysis Of Variance
Sourc e Sum of Squ ares Deg ree of free dom Mea n Squ are F p-valu e Val ue Pro b > F Model 357 1.30 9 396. 81 32. 75 < 0.00 01 Signif icant A-Wakt u 617. 50 1 617. 50 50. 96 < 0.00 01 B-Konse ntrasi 250 1.11 1 250 1.11 206 .40 < 0.00 01 C-Kuat arus 71.8 3 1 71.8 3 5.9 3 0.03 52 A2 83.9 3 1 83.9 3 6.9 3 0.02 51 B2 67.0 5 1 67.0 5 5.5 3 0.04 05 C2 145 .08 1 145 .08 11. 97 0.0 061
Optimasi Percobaan. Optimasi yang dilakukan pada percobaan adalah respon persen removal. Untuk menentukan kondisi optimal maka fungsi desirability percobaan dapat ditentukan dengan bantuan software Design Expert Version 8.06. Pada optimasi ini ditentukan bahwa persen removal yang ingin dicapai diatur untuk mencapai target maksimum sebesar 63,29 % sedangkan variabel yang digunakan dalam percobaan ditentukan dalam rentang percobaan.Solusi untuk percobaan pengolahan larutan zat warna menggunakan proses elektrokoagulasi dengan elektroda besi seperti yang ditunjukkan pada tabel 4.4. Solusi terbaik
yang diberikan yaitu waktu elektrokoagulasi selama 60 menit, konsentrasi zat warna sebesar 5 ppm, dan kuat arus sebesar 0,47A. Hasil solusi yang didapatkan memiliki persen desirability sebesar 95,4 % . Solusi tersebut menyatakan bahwa kondisi tersebut adalah kondisi optimum percobaan yang memungkinkan untuk mendapatkan persen removal yang optimum pula.
Tabel 4.4 Desirability Percobaan N o. Wa ktu Konse ntrasi K ua t Ar us % Remov al Desira bility 1 1,00 1,00 -0,2 4 61,009 9 0.954 Se le ct ed 2 1,00 1,00 -0,2 7 61,004 5 0.954 3 1,00 1,00 -0,1 6 60,987 5 0.953 4 1,00 1,00 -0,1 2 60,965 7 0,953 5 1,00 0,99 -0,2 0 60,923 7 0,952
KESIMPULAN DAN SARAN
Berdasarkan hasil percobaan dan analisis yang dilakukan, maka dapat disimpulkan bahwa proses elektrokoagulasi larutan zat warna dengan penambahan NaCl lebih efektif dengan rentang waktu yang relatif cepat dibandingkan dengan tanpa adanya penambahan NaCl. Pada variasi kuat arus, persen removal tertinggi dicapai pada kuat arus 0,5A. Kondisi optimum proses elektrokoagulasi yaitu waktu elektrokoagulasi selama 60 menit, konsentrasi zat warna sebesar 5 ppm, dan kuat arus sebesar 0,47 A. Model percobaan yang didapatkan adalah model kuadratik. Semua variabel tunggal signifikan, sedangkan variabel yang berinteraksi tidak signifikan. Persen removal optimum pada kondisi percobaan berdasarkan software
Design Expert Version 8,06 adalah sebesar 61%.
Berdasarkan kesimpulan yang didapat, maka dapat diberikan beberapa saran untuk percobaan yang selanjutnya, antara lain : 1. Variasi kuat arus dan jumlah NaCl yang
ditambahkan diharapkan memiliki rentang yang lebih besar sehingga pengaruh dari variabel – variabel dapat terlihat lebih signifikan.
2. Melakukan analisis sludge yang terbentuk selama proses elektrokoagulasi berlangsung untuk mengetahui karakteristik dan komposisi sludge yang terbentuk.
3. Mengukur berat elektroda besi yang terkonsumsi sehingga dapat digunakan untuk menghitung efiisiensi proses serta dapat juga untuk menentukan kinetika adsorpsi yang terjadi selama proses elektrokoagulasi.
DAFTAR PUSTAKA
A.K. Golder, N. H., A.N. Samanta, S. Ray (2005). "Electrocoagulation of methylene blue and eosin yellowish using mild steel electrodes." Journal of Hazardous Materials: 134-140.
Anonim ( 2000 ). “Simple Comparative Experiment“.
http://www.statease.com/pubs/edm e7_one-factor_tut.pdf, diunduh pada tanggal 20 Desember 2011. Lazare Etiégni, K. S., B. K. Balozi, K.
Ofosu-Asiedu, and D. O. O. A. Yitambé, and B. O. Orori (2010). Treatment Of Wastewater By Electrocoagulation Method And The Effect Of Low Cost Supporting Electrolytes Fluid Waste Disposal. K. W. Canton. New York, Nova Science Publishers, Inc.: 1-48. Mohr Azmier Ahmad, R. A. (2011).
"Optimization of Rambutan Peel Based Activated Carbon Preparation Conditions for Remazol Brilliant Blue R
Removal." Chemical Engineering Journal: 280 - 285.
Mukimin, A (2005). Model Penurunan COD Fungsi Arus Pada Pengolahan Air Limbah Industri Dengan Teknologi Elektrokoagulasi-Flotasi.
Semarang: 215-220.
Peter Holt, G. B. a. C. M. (2006). "Electrocoagulation As A Wastewater Treatment." The Third Annual Australian Environmental Engineering Research Event.
Retno Susetyaningsih, E. K., Prayitno
(2008). Kajian Proses
Elektrokoagulasi Untuk Pengolahan Limbah Cair. Yogyakarta.