BAB II
TINJAUAN PUSTAKA 2.1 Biologi Kakao
Kakao (Theobroma cacao, L.) merupakan salah satu anggota familia
Sterculiaceaeyang memiliki habitat asli di daerah hutan tropis di Amerika tengah dan Amerika selatan bagian utara (Siregaret al., 2010). Kakao pertama kali diolah secara sederhana oleh suku Maya yang hidup didaerah Amerika tengah tepatnya di Guatemala, Yucatan dan Honduras. Pada saat itu biji kakao yang dipanggang digunakan untuk membuat minuman yang sering digunakan untuk ritual pemujaan. Runtuhnya peradaban suku Maya pada saat itu menyebabkan suku Aztec menguasai kebun-kebun kakao milik suku Maya hingga akhirnya pada abad 15 bangsa Spanyol datang dan belajar tentang pengolahan kakao kepada suku Aztec (Pusat Penelitian Kopi dan Kakao Indonesia, 2004).
Bangsa Spanyol mempunyai peranan penting dalam penyebaran kakao di berbagai negara di dunia. Pada abad ke-17, bangsa Spanyol mentransfer beberapa tanaman kakao ke Manila di Filipina. Sejak saat itu budidaya kakao menyebar ke Indonesia melalui Sulawesi (Vos et al., 2003). Pada akhir abad 18, penyebaran tanaman kakao di Indonesia semakin meluas dengan dibukanya beberapa perkebunan kakao oleh orang Belanda, seperti di daerah Jawa Tengah, Jawa Timur serta Sumatera (Pusat Penelitian Kopi dan Kakao Indonesia, 2004).
2.1.1 Manfaat Kakao
Kakao merupakan tanaman yang dibudidayakan secara masal karena mempunyai nilai ekonomi yang cukup tinggi khususnya untuk dipanen buahnya (Mariani, 2011). Kulit buah kakao dapat diolah menjadi bahan pakan ternak, kompos, substrat budidaya jamur, dan bahan bakar serta memiliki potensi untuk digunakan sebagai bahan baku pembuatan zat pewarnaβ-karoten, dan briket arang (Saputra, 2012; Mayerniet al., 2009; Wulan, 2001; Usman, 2007).
Pulpa dari kakao juga dapat digunakan untuk industri rumah tangga maupun industri kimia. Untuk industri rumah tangga pulpakakao banyak diolah menjadi pupuk hijau, gas bio, bahan bakar atau jus pulpa kakao. Pada industri kimia, pulpa kakao dapat diolah menjadi jelli, nata de cocoa, pektin, alkohol, herbisida cair, serta aktivator untuk proses pengomposan (Setyawati et al., 2007; Widyotomo dan Mulato, 2008).
Gambar 2.1 Kulit ka oa (C), biji kakao dapat diolah menjadi cocoa but
der (D), berbagai produk olahan cocoa butter da men coklat (E), kue coklat (F), dark coklat (G) susu coklat (I), masker coklat (J), sabun cokla pedia).
an Perkembangan Kakao
upakan tanaman perennial dengan morfologi ingkungan serta jenis kultivarnya (Pusat Pene 2004). Akar kakao berupa akar tunggang denga
Batang tanaman kakao berupa batang yang keras dan kuat dengan tinggi dapat mencapai 4,5 – 10 meter tergantung dari kondisi lingkungan dan faktor-faktor tumbuh yang tersedia. Pada batang tanaman kakao terdapat dua percabangan, yaitu percabangan dengan arah pertumbuhan keatas yang disebut dengan cabang ortrotop dan percabangan dengan arah pertumbuhan kesamping yang disebut dengan cabang plagiotrop (Pusat Penelitian Kopi dan Kakao Indonesia, 2004).
Daun tanaman kakao bertangkai, berbentuk bulat telur terbalik memanjang, ujung daun meruncing, dan pangkal daun runcing serta susunan tulang daun menyirip. Daun kakao muda berwarna merah muda sedangkan daun yang tua cenderung berwarna hijau tua dengan panjang daun sekitar 10-48 cm dan
lebar 4-20 cm (Gambar 2.2;van Steeniset al., 1987).
Gambar 2.2 Morfologi daun kakao; daun kakao muda yang berwarna merah muda (A), daun kakao yang sudah tua cenderung berwarna hijau tua (B) (Sumber : Philipset al., 2013).
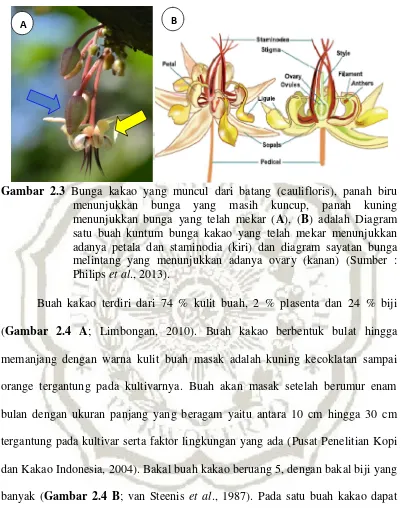
Gambar 2.3 Bunga kakao yang muncul dari batang (caulifloris), panah biru menunjukkan bunga yang masih kuncup, panah kuning menunjukkan bunga yang telah mekar (A), (B) adalah Diagram satu buah kuntum bunga kakao yang telah mekar menunjukkan adanya petala dan staminodia (kiri) dan diagram sayatan bunga melintang yang menunjukkan adanya ovary (kanan) (Sumber : Philipset al., 2013).
Buah kakao terdiri dari 74 % kulit buah, 2 % plasenta dan 24 % biji (Gambar 2.4 A; Limbongan, 2010). Buah kakao berbentuk bulat hingga memanjang dengan warna kulit buah masak adalah kuning kecoklatan sampai orange tergantung pada kultivarnya. Buah akan masak setelah berumur enam bulan dengan ukuran panjang yang beragam yaitu antara 10 cm hingga 30 cm tergantung pada kultivar serta faktor lingkungan yang ada (Pusat Penelitian Kopi dan Kakao Indonesia, 2004). Bakal buah kakao beruang 5, dengan bakal biji yang banyak (Gambar 2.4 B; van Steenis et al., 1987). Pada satu buah kakao dapat mengandung biji dengan jumlah antara 20-50 butir biji (Siregaret al., 2010). Biji kakao umumnya berbentuk bulat lonjong dengan warna kulit biji coklat hingga keunguan tergantung dari kultivarnya (Gambar 2.4 C). Biji kakao dilapisi oleh lapisan lunak berwarna putih dengan rasa manis yang disebut denganpulpa.
Gambar 2.4(A) adalah buah kakao utuh dan buah kakao yang dibelah membujur menunjukkan posisi kulit buah (panah merah) serta biji yang diselimuti oleh pulpa (Panah biru); (B) adalah buah kakao yang dipotong melintang menunjukkan bakal buah beruang 5; (C) morfologi biji kakao dari varietasCriollo(Panah merah), Forestero
(Panah kuning) dan Trinitario(Panah biru) (Sumber: www.Jochen Weber picture.com).
2.1.3 Varietas
Berdasarkan varietasnya, ada 3 varietas kakao yang banyak dibudidayakan di negara-negara di dunia (Voset al., 2003), yaitu kakao varietas Criollo(Gambar 2.5 A), Forestero(Gambar 2.5 B) danTrinitario(Gambar 2.5 C). Kakao varietas
Criollomempunyai biji yang mutunya sangat baik sehingga sering disebut dengan cokelat mulia. Ciri khas varietas ini adalah buah berwarna merah atau hijau dengan bentuk yang bulat telur, kulit luarnya tipis lunak dengan namun kasar, biji bulat sedangkan kotiledonnya berwarna putih (Rubiyo, 2009). Selain itu produksi kakao varietas ini lebih rendah dibandingkan dengan varietasForesteroserta lebih rentan terkena hama penyakit (Badan Penelitian dan Pengembangan Pertanian, 2012).
Varietas kedua adalah kakao varietas Forestero. Varietas ini memiliki mutu yang sedang dan dikenal dengan kakao jenis lindak. Ciri khas kakao varietas ini adalah buah berwarna hijau karena tidak mengandung antosianin dengan kulit C B
yang tebal dan permukaan yang halus. Biji lebih kecil dan lebih pipih dibanding kakao varietasCriollosedangkan kotiledon berwarna ungu (Pusat Penelitian Kopi dan Kakao Indonesia, 2004; Rubiyo, 2009).
Varietas yang ketiga yaitu kakao varietas Trinitario. Varietas ini merupakan persilangan dari varietas Criollo dengan varietas Forestero, sehingga varietas ini memiliki morfologi dan fisiologi yang beragam dengan mutu yang sangat bervariasi (Badan Penelitian dan Pengembangan Pertanian, 2012). Kakao varietas ini dapat menghasilkan biji yang berkualitas bagus tetapi dapat juga menghasilkan biji kualitas rendah dengan warna biji bervariasi dari ungu muda hingga ungu tua serta buah berwarna hijau atau merah dengan bentuk yang bervariasi pula (Rubiyo, 2009).
Gambar 2.5 Morfologi buah kakao varietas Criollo(A), Forestero(B) dan
Trinatario(C) (Sumber : Philipset al., 2013). C B
2.2 Budidaya Kakao di Dunia
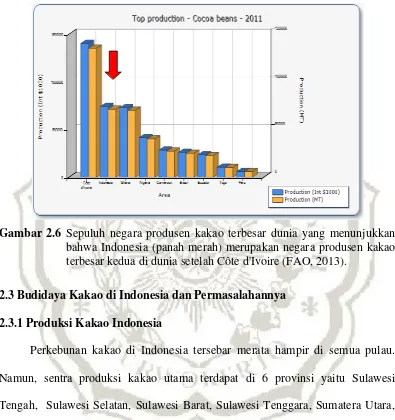
Produksi kakao di berbagai negara di dunia memang cenderung meningkat setiap tahunnya. Pada tahun 2009 produksi kakao dunia mencapai sekitar 4,2 juta ton sedangkan pada tahun 2011 total kakao dunia yang diproduksi meningkat menjadi sekitar 4,4 juta ton kakao (FAO, 2013). Negara produsen kakao ada di kawasan tropis yang secara geografis dibagi dalam empat wilayah yaitu Afrika, Asia, Oceania dan Amerika. Benua dengan tingkat produksi kakao tertinggi di dunia adalah Afrika (65.1%) diikuti Asia (18,1 %), Amerika (15,4 %) dan Oceania (1,3 %; FAO, 2013). Di antara negara-negara produsen kakao tersebut, Côte d'Ivoire menempati urutan pertama dengan total produksi mencapai sekitar 1,3 juta ton per tahun (30,7% dari total produksi dunia) pada tahun 2011. Pada tahun yang sama, Indonesia menempati urutan kedua dengan total produksi mencapai sekitar 712 ribu ton (16,2% dari total produksi dunia; FAO, 2013). Negara lain dengan total produksi tertinggi secara berturut-turut adalah sebagai berikut: Ghana, Nigeria, Cameroon, Brazil, Equador, Togo serta Peru (Gambar 2.6).
permintaan sebanyak 750 ribu ton biji kakao yang tidak dapat dipenuhi oleh negara-negara penghasil kakao (World Cocoa Foundation, 2012).
Gambar 2.6 Sepuluh negara produsen kakao terbesar dunia yang menunjukkan bahwa Indonesia (panah merah) merupakan negara produsen kakao terbesar kedua di dunia setelah Côte d'Ivoire (FAO, 2013).
2.3 Budidaya Kakao di Indonesia dan Permasalahannya 2.3.1 Produksi Kakao Indonesia
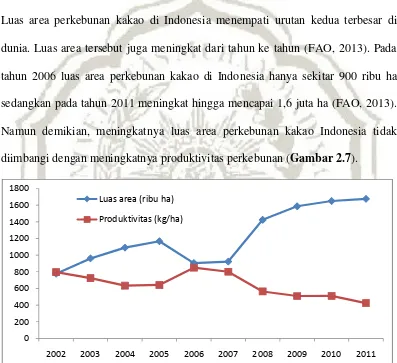
Total produksi kakao di Indonesia meningkat dari tahun ke tahun. Pada tahun 2007, total produksi kakao Indonesia mencapai sekitar 740 ribu ton per tahun sedangkan pada tahun 2010 total produksi kakao Indonesia meningkat hingga sekitar 845 ton per tahun (FAO, 2013). Peningkatan produksi kakao tersebut lebih banyak disebabkan oleh meningkatnya luas area perkebunan kakao. Luas area perkebunan kakao di Indonesia menempati urutan kedua terbesar di dunia. Luas area tersebut juga meningkat dari tahun ke tahun (FAO, 2013). Pada tahun 2006 luas area perkebunan kakao di Indonesia hanya sekitar 900 ribu ha sedangkan pada tahun 2011 meningkat hingga mencapai 1,6 juta ha (FAO, 2013). Namun demikian, meningkatnya luas area perkebunan kakao Indonesia tidak diimbangi dengan meningkatnya produktivitas perkebunan (Gambar 2.7).
Gambar 2.7 Luas area perkebunan kakao di Indonesia yang semakin meningkat sejak tahun 2002 dibandingkan dengan produktitivitas perkebunan kakao di Indonesia yang semakin menurun (FAO, 2013).
Produktivitas perkebunan kakao di Indonesia cenderung menurun dari tahun ke tahun. Pada tahun 2007, produktivitas kakao Indonesia mencapai sekitar 800 kg/ha, sedangkan pada tahun 2011 terjadi penurunan produktivitas kakao
0
2002 2003 2004 2005 2006 2007 2008 2009 2010 2011 Luas area (ribu ha)
sebesar 56% menjadi sekitar 425 kg/ha (FAO, 2013). Dengan angka tersebut produktivitas Indonesia menempati urutan 19 besar di dunia (FAO, 2013). Jika dibandingkan dengan negara lain seperti Guatemala dan Thailand, produktivitas kakao di Indonesia hanya sekitar sepertujuh dari produktvitas kakao di kedua negara tersebut.
2.3.2 Permasalahan Budidaya Kakao di Indonesia
Beberapa faktor diduga menjadi penyebab rendahnya produktivitas kakao di Indonesia antara lain adanya serangan penyakit dan hama, belum diaplikasikannya teknologi budidaya yang baik dan benar (Wahyudi & Misnawi 2007). Serangan penyakit dan hama tanaman memang secara langsung berperan dalam penurunan produksi kakao (Santoso & Soedarsianto, 2009). Salah satu penyakit tanaman yang menjadi masalah utama pada budidaya kakao di Indonesia adalah penyakit busuk buah (Phytophthora palmivora; Rubiyo, 2009). Gejala penyakit busuk buah kakao ditunjukkan dengan terjadinya pembusukan disertai
dengan bercak coklat kehitaman dengan batas yang tegas (Gambar 2.8A; Rubiyo,
2009). Kerugian yang terjadi akibat penyakit busuk buah pada tanaman kakao di
Indonesia dapat mencapai hingga lebih dari 50% (Pusat Penelitian Kopi dan
Kakao Indonesia, 2004 ).
Selain itu, serangan hama penggerek tanaman (PBK) serta layu pentil juga
merupakan penyakit yang sering di temui pada tanaman kakao (Santoso &
soedarsianto, 2009). Gejala serangan hama PBK baru akan tampak ketika buah
sudah matang, yaitu buah akan berwarna pudar, jika dibelah daging buahnya dan
Produktivitas serta mutu biji dapat berkurang hingga mencapai 80% jika tanaman
terserang penyakit PBK (Wahyudi & Misnawi, 2007).
Layu pentil merupakan penyakit fisiologis yang khas pada tanaman kakao
yang menyebabkan buah kakao yang masih sangat muda (pentil) mengalami
kematian/mengering (Gambar 2.8C; Widiancas, 2010). Adanya penyakit layu
pentil dapat menimbulkan penurunan produktivitas kakao sebesar 70-90%
(Widiancas, 2010).
Gambar 2.8 Buah kakao yang terserang penyakit busuk buah, terlihat adanya bercak hitam dengan batas jelas pada kulit buah kakao (A); (B) adalah gambar buah kakao yang dibelah, sebelah kiri menunjukkan kakao yang sehat sedangkan sebelah kanan menunjukkan buah kakao yang terserang hama penggerek tanaman (PBK); Buah kakao yang mengalami layu pentil (C).
(Sumber : http://cacaoorganicfairtrade.blogspot.com).
Penerapan teknik budidaya kakao yang kurang tepat seperti perawatan
tanaman yang kurang baik serta pemupukan yang tidak berimbang juga
berpengaruh terhadap penurunan produktivitas perkebunan kakao di Indonesia
(Sutardi & Hendrata, 2009). Pada umumnya petani melakukan perawatan secara
sederhana yaitu dengan melakukan pemangkasan yang asal asalan dan
pemupukan secara berlebihan (Sutardi & Hendrata, 2009). Waktu serta cara
C B
pemangkasan yang tidak tepat dapat berakibat meningkatnya serangan hama dan
penyakit yang bisa berpengaruh terhadap penurunan produktivitas buah kakao
(Pusat Penelitian Kopi dan Kakao Indonesia, 2004). Pemberian pupuk yang
mengandung unsur tertentu secara berlebih baik dosis, jenis, maupun waktu juga
akan mengganggu perkembangan tanaman kakao yang akan berakibat pada
penurunan produktivitas tanaman (Sutardi & Hendrata, 2009).
Kondisi lain yang berpengaruh terhadap penurunan produktivitas
perkebunan yang ada di Indonesia adalah umur tanaman yang relatif tua
(Wahyudi & Misnawi, 2007). Produktivitas tanaman kakao umumnya akan turun
setengah dari produktivtas awalnya setelah berumur 20 tahun (Santoso &
Soedarsianto, 2009). Untuk mengatasi permasalahan tersebut salah satu caranya
adalah dengan rehabilitasi dan peremajaan perkebunan kakao (Santoso &
Soedarsianto, 2009).
Salah satu faktor yang diduga menjadi penyebab utama rendahnya
produktivitas kakao di Indonesia adalah rendahnya kualitas bibit kakao yang
dibudidayakan (Wahyudi & Misnawi, 2007). Oleh karena itu, penyediaan bibit kakao yang berkualitas sangat dibutuhkan guna meningkatkan produktivitas
kakao.
2.3.3 Pembibitan Kakao
kecambah dipindahkan ke medium tanam dan dipelihara selama 6-7 bulan agar siap ditanam di lapang (Badan Penelitian dan Pengembangan Pertanian, 2012).
Perbanyakan dengan teknik ini mempunyai beberapa keuntungan diantaranya memiliki tingkat keberhasilan tinggi, murah dan mudah dilakukan serta mampu menghasilkan bibit dalam jumlah yang banyak. Namun, perbanyakan tersebut dapat menghasilkan tanaman yang memiliki variasi genetik yang tinggi. Hal tersebut karena dalam proses pembuahan kakao mengalami penyerbukan silang (cross pollination; Liet al., 1998; Issaliet al., 2012).
Salah satu cara yang dapat digunakan untuk mengatasi kelemahan perbanyakan melalui biji adalah secara vegetatif melalui stek dan okulasi (Limbongan, 2010). Perbanyakan kakao melalui stek dilakukan dengan cara memotong ranting atau pucuk tanaman dengan jumlah daun antara 2 - 5 helai , kemudian ditanam pada medium tanam. Bibit siap dipindahkan ke lapang jika tingginya sudah mencapai sekitar 50 cm dan jumlah daun minimum 15 helai (Pusat Penelitian Kopi dan Kakao Indonesia, 2004).
Keunggulan dari perbanyakan vegetatif ini adalah lebih ekonomis, lebih mudah dan cepat serta tidak memerlukan ketrampilan yang khusus. Namun, teknik ini tidak mampu menghasilkan bibit dalam jumlah yang besar, merusak tanaman induk serta memiliki tingkat keberhasilan yang rendah (Li et al., 1998; Aviviet al., 2010).
teknik ini, bibit memerlukan waktu sekitar 4-5 bulan agar siap ditanam di lahan (Basri, 2009). Kelebihan dari teknik perbanyakan ini adalah dapat dihasilkan bibit yang seragam dan memiliki produktivitas yang sama dengan induknya (Basri, 2009). Namun, teknik ini tidak mampu dihasilkan bibit dalam jumlah yang masal karena keterbatasan jumlah mata tunas (Avivi et al., 2010). Kendala lain dari teknik ini adalah adanya kerusakan pada tanaman induknya serta keberhasilan teknik ini masih relatif rendah.
Salah satu alternatif untuk mengatasi kelemahan-kelemahan dalam perbanyakan bibit kakao secara vegetatif seperti di atas adalah dengan menggunakan teknik kultur jaringan tumbuhan. Kultur jaringan adalah teknik perbanyakan tanaman dengan mengisolasi bagian tertentu dari tanaman serta menumbuhkannya pada media buatan secara aseptis (Hendaryono & Wijayani, 1994).
Kultur jaringan tumbuhan untuk menyediakan bibit tanaman dapat dilakukan melalui beberapa cara seperti melalui kultur meristem, kultur pucuk, kultur tunas aksiler maupun melalaui organogenesis (Sandra, 2012). Kultur meristem merupakan teknik kultur jaringan dengan menggunakan eksplan jaringan meristem (Suyadi et al, 2003). Teknik ini banyak dilakukan untuk menghasilkan bibit tanaman yang bebas virus, namun teknik ini belum berhasil diaplikasikan untuk perbanyakan bibit kakao (Purnamaningsih, 2002).
paling sederhana karena hanya memerlukan tahapan perbanyakan dan induksi akar guna menghasilkan bibit tanaman (Sandra, 2012). Namun teknik tersebut juga belum berhasil diaplikasikan untuk pembibitan kakao (Figueraet al.,1991).
Teknik lain yang banyak digunakan untuk perbanyakan tanaman melalui kultur jaringan adalah organogenesis. Teknik tersebut digunakan untuk menginduksi munculnya tunas baik secara langsung maupun tidak langsung dari eksplan yang ditanam. Setelah tunas berhasil dimultiplikasikan, kemudian tunas diinduksi akar untuk menghasilkan tanaman yang lengkap (Nugrahani et al,. 2011). Teknik ini banyak diaplikasikan untuk perbanyakan bibit tumbuhan, namun teknik tersebut juga belum diaplikasikan pada tanaman kakao (Nugrahani
et al,. 2011).
Salah satu teknik kultur jaringan yang mulai banyak dikembangkan untuk memperbanyak bibit kakao secara in vitro adalah teknik embriogenesis somatik (Winarsihet al., 2003; Aviviet al., 2010).
2.4 Perkembangan Penelitian Embriogenesis Somatik Kakao
Tahapan pelaksanaan teknik embriogenesis somatik untuk penyediaan bibit tumbuhan biasanya melalui empat tahap, yaitu (1) induksi kalus embriogenik, (2) induksi embrio, (3) perkecambahan, dan (4) aklimatisasi (Gambar 2.9;Purnamaningsih, 2002).
Gambar 2.9Eksplan staminodia (A), kalus yang berasal dari eksplan staminodia (B), embrio fase globular (C), embrio fase heart (D), embrio fase torpedo (E), kotiledon yang terbentuk (F), plantet kakao (G), plantet yang ditumbuhkan di greenhouse (H) (Sumber :Liet al., 1998).
Tahap induksi kalus embriogenik biasanya dilakukan dengan cara menanam eksplan pada medium tanam yang mengandung auksin dengan konsentrasi tinggi ataupun dengan menggunakan auksin serta sitokinin secara bersamaan (Winarsih et al., 2003). Pada tahapan ini dapat dihasilkan beberapa jenis kalus, namun kalus yang diharapkan adalah kalus yang bersifat embriogenik yaitu mampu diinduksi membentuk embrio. Kalus embriogenik memiliki ciri-ciri mudah dipisah-pisah (friable), berwarna kuning muda ataupun merah muda (Avivi
et al., 2010).
Tahap selanjutnya setelah induksi kalus adalah tahapan induksi embrio. Tahapan ini merupakan tahapan yang paling sulit dan paling lama dari semua tahapan embriogenesis somatik (Winarsihet al., 2003). Pada tahap ini, kalus akan
H G
F E
C D
mulai berkembang membentuk embrio melalui tahapan-tahapan seperti pada perkembangan embrio zygotik (Purnamaningsih., 2002). Perkembangan pembentukan embrio somatik yang sering diamati terjadi melalui 4 tahapan, yaitu globular, hati (heart), torpedo hingga kotiledon (Liet al., 1998).
Setelah terbentuk embrio pada fase kotiledon, maka embriogenesis somatik selanjutnya adalah tahap perkecambahan. Pada tahap ini embrio dikecambahkan pada media tertentu sehingga tumbuh dan berkecambah membentuk tunas dan akar (Purnamaningsih, 2002). Setelah terbentuk tanaman lengkap, maka kecambah kemudian dipelihara di dalam ruang kultur sampai berdaun dua tau tiga dan siap dipindahkan ke tanah (Sandra, 2012).
Tahapan pemindahan bibit ke lingkungan eksternal dilakukan secara bertahap melalui teknik aklimatisasi (Purnamaningsih, 2002). Teknik ini perlu dilakukan secara hati-hati karena adanya perbedaan kondisi lingkungan antara steril di dalam botol kultur yang memiliki tingkat kelembapan tinggi dan suhu yang konstan dengan lingkungan eksternal yang memiliki tingkat kelembapan yang rendah dan suhu yang bersifat fluktuatif (Sandra, 2012). Keberhasilan teknik aklimatisasi menentukan berhasil tidaknya teknik embriogenesis somatik digunakan dalam produksi bibit suatu tumbuhan (Purnamaningsih, 2002).
kentang (Lengkong, 2009), serta kacang tanah (Srilestari, 2005). Namun, tidak semua tanaman berhasil diperbanyak dengan menggunakan teknik ini.
Pada tanaman kakao, banyak penelitian telah dilakukan untuk mengaplikasikan teknik embriogenesis somatik untuk menyediakan bibit tanaman tersebut, namun sampai saat ini tingkat keberhasilannya masih cukup rendah yaitu sekitar 0-52% tergantung dari genotip eksplan kakao yang digunakan (Avivi et al., 2010). Berbagai upaya telah dilakukan untuk meningkatkan keberhasilan embriogenesis somatik pada kakao seperti melalui pemilihan eksplan yang tepat, pemilihan medium dasar yang sesuai, maupun penambahan beberapa zat aditif ke dalam medium tanam.
Penelitian embriogenesis somatik kakao diawali pada tahun 1977 - 1979 dengan menggunakan eksplan embrio zigotik. Namun teknik ini tidak dikembangkan lebih lanjut karena bibit yang dihasilkan akan memiliki variasi genetik yang tinggi sebagai akibat dari penggunaan embrio zygotik sebagai sumber eksplan (Maximovaet al., 2002). Penelitian selanjutnya dilakukan dengan menggunakan eksplan daun, namun memiliki tingkat keberhasilan yang sangat rendah (Maximovaet al., 2002; Liet al., 1998).
Jenis eksplan yang paling banyak digunakan untuk induksi embrio somatik kakao adalah petala dan staminodia yang diisolasi dari bunga yang masih kuncup (Gambar 2.3). Keberhasilan dari penggunaan eksplan tersebut sangat bervariasi yaitu 0,9-52 % untuk eksplan petala dan 0-8,5% untuk eksplan staminodia (Avivi
et al., 2010). Hasil tersebut jauh lebih rendah dari hasil penelitian yang dilaporkan Li et al., (1998) bahwa penggunaan eksplan staminodia mampu menginduksi embrio somatik kakao dengan persentase keberhasilan 0,8-100% tergantung dari variasi genotip kakao yang digunakan.
Beberapa penelitian lain juga telah menggunakan beberapa jenis medium dasar guna meningkatkan keberhasilan induksi embrio pada tanaman kakao. Medium dasar pertama yang diujikan adalah medium dasar MS (Murashige dan Skoog, 1962) (Alemano et al., 1997; Winarsih et al., 2003; Avivi et al., 2010). Persentase keberhasilan penggunaan medium MS untuk menginduksi embrio kakao mencapai 47% (Winarsih et al., 2003). Namun, penggunaan MS untuk berbagai eksplan seperti daun, kotiledon, maupun embrio memiliki pertumbuhan yang kurang baik, penuaan cepat dan sering terjadi nekrosis jaringan (Li et al., 1998).
Upaya peningkatan keberhasilan induksi embrio somatik kakao juga telah dilakukan dengan menambahkan bahan aditif ke dalam medium tanam. Penambahan air kelapa ke dalam medium tanam dengan konsentrasi 10% telah berhasil meningkatkan jumlah embrio yang terinduksi hingga mencapai 0 - 70% tergantung genotipenya (Dinarti, 1991).
Reformulasi media kultur jaringan dengan menambahkan sulfat pada konsentrasi tertentu juga telah dilakukan (Emile et al., 2008). Hasilnya menunjukkan bahwa pemberian sulfat (K2SO4) kedalam medium tanam juga bervariasi antara 0 - 55 % tergantung genotipe yang digunakan (Emile et al., 2008).
Faktor utama lainnya yang diduga berperan penting dalam meningkatkan keberhasilan embriogenesis somatik adalah pemilihan zat pengatur tumbuh dengan jenis dan konsentrasi yang tepat.
2.5 Zat Pengatur Tumbuh
Zat pengatur tumbuh adalah senyawa organik bukan hara yang mampu mendukung, menghambat dan dapat merubah proses fisiologi tumbuhan walaupun dalam jumlah yang sedikit (Hendaryono & Wijayani, 1994). Setiap ZPT mempunyai ciri khas dan pengaruh yang berlainan terhadap proses fisiologis tanaman (Salisbury & Ross, 1992).
berkembang (Sandra, 2012). Pada kultur jaringan giberelin berfungsi sebagai pemacu pertumbuhan akar atau tunas. Sampai saat ini telah ditemukan lebih dari 60 macam GA, namun ada dua macam yang sering digunakan dalam kultur jaringan yaitu GA1dan GA3(Salisbury & Ross, 1992).
Auksin merupakan ZPT yang diproduksi dalam jaringan meristematik yang masih aktif. Peran fisiologis auksin diantaranya adalah mempercepat pertumbuhan akar, mendorong pemanjangan dan pengembangan sel serta mempercepat perkecambahan sedangkan pada kultur jaringan auksin berperan dalam merangsang pertumbuhan kalus, akar, suspensi sel dan organ (Hendaryono & Wijayani, 1994). Beberapa zat pengatur tumbuh auksin yang sering digunakan dalam kultur jaringan antara lain 2,4-diklorofenoksiasetat (2,4-D), indole-3-acetic acid (IAA), α-naftalenacetic acid (α-NAA) dan indole butaratacid (IBA; Hendaryono dan Wijayani, 1994).
Dalam kultur j
ur jaringan, untuk menginduksi kalus dan embri digunakan ZPT auksin dan sitokinin secara sendi
antara keduanya (Salisbury & Ross, 1992). Je lah 2,4-D sedangkan jenis sitokinin yang se niar, 2002).
klorofenoksiasetat (2,4-D)
upakan salah satu auksin yang paling sering di belahan sel, pertumbuhan kalus, pertumbuha
organ (Andaryani, 2010). 2,4-D memiliki empunyai berat molekul 221,04 g mol-1 ( ). Penambahan 2,4-D ke dalam medium merangsang pembelahan serta pembesaran se emacu pembentukan dan pertumbuhan kalus
upakan auksin kuat yang tidak mudah diur kan dalam jumlah kecil dan dalam waktu
ijayani, 1994).
umus bangun asam 2,4-D (Sumber: Salisbury da
n 2,4-D dalam merangsang pembelahan sel se us dan embrio somatik diduga karena auksin dapa
sel mengeluarkan H+ke dinding sel primer yang mengelilinginya, sehingga H+ini akan menurunkan pH dan akan terjadi pertumbuhan serta pengenduran dinding sel. pH yang rendah akan mengaktifkan enzim yang akan memutuskan ikatan polisakarida dinding sehingga dinding lebih mudah merenggang. Mekanisme kerja auksin ini dikenal sebagai hipotesis pertumbuhan asam (Salisbury & Ross, 1992).
Penelitian tentang pengaruh 2,4-D terhadap keberhasilan induksi kalus dan embrio somatik telah banyak dilakukan pada berbagai tanaman seperti pada tanaman jati (Armaniar, 2002), kopi arabika (Oktavia et al., 2003), kacang (Srilestari, 2004), palem (Alkhateeb, 2006), bawang merah (Hellyanto, 2008), serta ketela (Wongtiemet al., 2011).
Pada penelit
litian-penelitian tersebut 2,4-D telah dig us dan embrio somatik tanaman kakao de kisar antara 0-52%. Sebagian besar peneliti
diun MS sebagai medium dasarnya sehingga d uh 2,4-D dalam menginduksi kalus dan embrio dium DKW untuk meningkatkan keberhasilan da eksplan petala dan staminodia.
zil Amino Purine)
upakan sitokinin sintetik yang memiliki kandung gen dengan rumus kimia C12H11N5 dan berat 2.10 B). BAP memiliki peran penting dalam pe
buhan karena berperan penting dalam memacu ristem ujung (Sandra, 2012). BAP merupa dak mudah terurai sehingga banyak digunaka
ono & Wijayani, 1994).
Kemampuan BAP dalam memacu pembelahan sel, menginduksi pembentukan tunas dan embrio somatik tersebut diduga karena BAP mempunyai cincin adenin yaitu suatu basa purin yang terdapat pada DNA dan RNA, sehingga BAP diduga mampu berperan dalam metabolisme asam nukleat dan sintesa protein (Sukartiningrum & Sukendah, 2008). Penambahan BAP kedalam medium tanam akan meningkakan laju sintesis protein (Salisbury & Ross, 1992).
Pada kultur jaringan, BAP banyak digunakan untuk menginduksi pembentukan embrio somatik berbagai tanaman seperti pada tanaman jambu bol (Trina, 2002), cendana (Sukmadjaja et al., 2003), kopi (Oktavia et al., 2003), pepaya (Susantoet al., 2005), jahe (Baktiet al., 2005), bawang merah (Hellyanto, 2008 ), Manggis (Purba, 2009), kentang (Lengkong, 2009) maupun nanas (Roostikaet al., 2012).
Pada tanaman kakao, BAP juga sudah banyak diujikan untuk menginduksi pembentukan kalus dan embrio somatik. Penambahan BAP dengan konsentrasi 4,4 x 10-7M ke dalam medium dasar DKW (Driver Kuniyuki for Walnut) yang ditambahkan vitamin MS (Murashige dan Skoog, 1962) mampu menginduksi embrio kakao dari eksplan staminodia dengan persentase keberhasilan kurang dari 2% (Tan & Furtek, 2004). Selain itu penambahan BAP dengan konsentrasi 2 x 10 -6