i
SINTESIS SENYAWA 2-(4'-KLOROBENZILIDENA) SIKLOHEKSANADION DARI SIKLOHEKSANA-1,3-DION DAN 4-KLOROBENZALDEHID
DENGAN KATALIS NATRIUM HIDROKSIDA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh: Ardi Prasetyo NIM : 078114097
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
ii
SINTESIS SENYAWA 2-(4'-KLOROBENZILIDENA) SIKLOHEKSANADION DARI SIKLOHEKSANA-1,3-DION DAN 4-KLOROBENZALDEHID
DENGAN KATALIS NATRIUM HIDROKSIDA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh: Ardi Prasetyo NIM : 078114097
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
v
HALAMAN PERSEMBAHAN
SAAT KITA BERUSAHA MERAIH SESUATU KEMUDIAN
KITA TIDAK BISA MERAIHNYA ADALAH SEBUAH
KEGAGALAN, BUKAN BERARTI KEBERHASILAN
YANG TERTUNDA, TETAPI DIBALIK KEGAGALAN
TERSEBUT ADA KEBERHASILAN LAIN, YAITU KITA
MENGETAHUI CARA MERAIH SESUATU YANG SALAH,
SEHINGGA KITA TIDAK AKAN MENGULANG CARA
TERSEBUT……
Karya tulis ini kupersembahkan kepada:
Orang tuaku tercinta, “Mama dan Papa”
Kakakku yang kusayangi, “Cik Wiwied”
“Almamaterku” yang telah membesarkanku
Dan….. semua orang yang telah kukenal maupun
vii PRAKATA
Puji syukur kepada Tuhan yang Maha Esa atas berkat dan karunia-Nya, sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi yang berjudul “Sintesis Senyawa 2-(4'-klorobenzilidena) sikloheksanadion dari Sikloheksana-1,3-dion dan 4-klorobenzaldehid dengan Katalis Natrium Hidroksida” sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi (S.Farm) di Universitas Sanata Dharma Yogyakarta.
Selama proses penelitian dan penyusunan skripsi ini, penulis mendapat bantuan dari berbagai pihak, untuk itu penulis mengucapkan terimakasih kepada:
1.
Ipang Djunarko, M.Sc., Apt., selaku Dekan Fakultas Farmasi UniversitasSanata Dharma.
2. Jeffry Julianus, M.Si., selaku dosen pembimbing atas kesediannya dalam memberi arahan, masukan, dan dukungan dalam penelitian dan penyusunan skripsi ini.
3. Dra. M.M. Yetty Tjandrawati, M.Si., selaku dosen penguji atas pengarahan, saran, dan kritiknya.
4. Prof. Dr. Sri Noegrohati, Apt., selaku dosen penguji atas pengarahan, saran, dan kritiknya.
5. Christine Patramurti, M.Si., Apt., atas nasihat dan bantuan yang diberikan kepada penulis untuk penyusunan proposal.
viii
7. Pak Pudjono, atas masukan yang sudah diberikan selama berjalannya penelitian.
8. Mas Parlan, Mas Kunto, Mas Bimo, Mas Wagiran, dan segenap laboran Fakultas Farmasi yang sudah membantu penulis selama bekerja di laboratorium.
9. Staf Laboratorium Kimia Organik Fakultas MIPA Universitas Gadjah Mada Yogyakarta.
10.Mama, Papa, Cik Wiwied, dan segenap keluarga besar penulis atas doa, dukungan, dan semangat yang diberikan.
11.Anin, Fandri, dan Wiwit, terimakasih atas kerjasama, suka, dan duka selama perjuangan di laboratorium.
12.Andy dan Edhi, terimakasih atas usaha dan bantuan dalam mengurusi ujian tertutup dan ujian terbuka.
13.Teman-teman FST angkatan 2007 yang tidak dapat disebut satu per satu. Terimakasih atas kebersamaannya selama kuliah dan praktikum. Sukses selalu bagi kita semua.
14.Teman-teman KKN Kraton angkatan XL dan seluruh warga dusun Kraton. Sukses selalu bagi kita semua.
15.Ibu dan Bapak Suhardiyanto, serta teman-teman kos Tasura 52, terimakasih atas doa dan dukungannya.
ix
Akhir kata, penulis menyadari penyusunan skripsi ini masih jauh dari sempurna mengingat keterbatasan dan pengetahuan yang dimiliki. Oleh karena itu, saran dan kritik yang bersifat membangun sangat dibutuhkan oleh penulis demi kesempurnaan skripsi ini. Semoga skripsi ini dapat memberi sumbangsih yang bermanfaat bagi perkembangan ilmu pengetahuan.
xi DAFTAR ISI
Halaman
HALAMAN JUDUL ... ii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN ... iv
HALAMAN PERSEMBAHAN ... v
PRAKATA ... vii
PERNYATAAN KEASLIAN KARYA ... x
DAFTAR ISI ... xi
DAFTAR TABEL ... xv
DAFTAR GAMBAR ... xvi
DAFTAR LAMPIRAN ... xviii
INTISARI ... xix
ABSTRACT ... xx
BAB I PENGANTAR ... 1
A. Latar Belakang ... 1
1. Permasalahan ... 3
2. Keaslian Penelitian ... 4
3. Manfaat Penelitian ... 4
B. Tujuan Penelitian ... 4
BAB II PENELAAHAN PUSTAKA... 5
xii
B. Sintesis 2-(4'-klorobenzilidena) sikloheksanadion ... 7
C. Rekristalisasi ... 9
D. Uji Pendahuluan ... 10
1. Pemeriksaan organoleptis ... 10
2. Pemeriksaan kelarutan ... 10
3. Pemeriksaan titik lebur ... 11
4. Uji kemurnian menggunakan kromatografi lapis tipis (KLT) ... 12
5. Kromatografi gas-spektrometri massa ... 13
E. Elusidasi Struktur Senyawa Hasil Sintesis ... 13
1. Spektrofotometri inframerah ... 13
2. Spektrometri massa ... 14
F. Landasan Teori ... 15
G. Hipotesis ... 16
BAB III. METODE PENELITIAN ... 17
A. Jenis dan Rancangan Penelitian ... 17
B. Definisi Operasional ... 17
C. Bahan Penelitian ... 18
D. Alat Penelitian ... 18
E. Tata Cara Penelitian ... 19
1. Sintesis 2-(4'-klorobenzilidena) sikloheksanadion ... 19
2. Uji pendahuluan ... 19
a. Uji organoleptis ... 19
xiii
c. Uji titik lebur ... 20
d. Uji kemurnian menggunakan kromatografi lapis tipis (KLT) ... 20
e. Kromatografi gas-spektrometer massa ... 20
3. Elusidasi struktur senyawa hasil sintesis ... 21
a. Spektrofotometri inframerah ... 21
b. Spektrometri massa ... 21
F. Analisis Hasil ... 22
1. Penghitungan rendemen ... 22
2. Analisis pendahuluan ... 22
3. Elusidasi struktur ... 22
BAB IV. HASIL DAN PEMBAHASAN ... 23
A. Sintesis 2-(4'-klorobenzilidena) sikloheksanadion ... 23
B. Analisis Pendahuluan ... 26
1. Uji organoleptis ... 26
2. Uji kelarutan ... 27
3. Uji titik lebur ... 28
4. Uji kemurnian menggunakan kromatografi lapis tipis (KLT) ... 28
5. Kromatografi gas ... 30
C. Elusidasi Struktur Senyawa Hasil SIntesis ... 31
1. Spektra inframerah ... 31
2. Spektra massa ... 37
BAB V. KESIMPULAN DAN SARAN ... 44
xiv
B. Saran... ... 44
DAFTAR PUSTAKA ... 45
LAMPIRAN ... 48
BIOGRAFI PENULIS ... 58
xv
DAFTAR TABEL
Halaman
Tabel I. Istilah kelarutan menurut Farmakope Indonesia IV ... 11
Tabel II. Hasil uji organoleptis senyawa hasil sintesis dibandingkan dengan starting material ... 27
Tabel III. Hasil uji kelarutan senyawa hasil sintesis dibandingkan dengan starting material ... 27
Tabel IV. Interpretasi spektra inframerah senyawa hasil sintesis ... 33
Tabel V. Interpretasi spektra inframerah sikloheksana-1,3-dion ... 34
Tabel VI. Interpretasi spektra inframerah 4-klorobenzaldehid ... 36
Tabel VII. Hasil interpretasi spektra inframerah senyawa hasil sintesis dengan sikloheksana-1,3-dion dan 4-klorobenzaldehid sebagai pembanding ... 36
xvi
DAFTAR GAMBAR
Halaman
Gambar 1. Struktur senyawa 2-benzilidena-sikloheksana-1,3-dion ... 2
Gambar 2. Struktur kurkumin dibagi menjadi tiga farmakofor yaitu A, B, dan C ... 5
Gambar 3. Reaksi umum sintesis senyawa 2-(4'-klorobenzilidena) sikloheksanadion ... 15
Gambar 4. Mekanisme reaksi pembentukan ion enolat pada sikloheksana-1,3-dion ... 24
Gambar 5. Mekanisme reaksi sintesis 2-(4'-klorobenzilidena) sikloheksanadion ... 25
Gambar 6. Resonansi pada 4-klorobenzaldehid ... 26
Gambar 7. Kromatogram pada KLT ... 29
Gambar 8. Kromatogram kromatografi gas senyawa hasil sintesis ... 31
Gambar 9. Spektra inframerah senyawa hasil sintesis ... 32
Gambar 10. Spektra inframerah sikloheksana-1,3-dion sebagai pembanding ... 34
Gambar 11. Spektra inframerah 4-klorobenzaldehid sebagai pembanding ... 35
Gambar 12. Spektra massa senyawa hasil síntesis ... 37
Gambar 13. Fragmentasi senyawa hasil sintesis ... 40
xvii
Gambar 15. Mekanisme reaksi pembentukan 4-(4-klorobenzilidena)-
xviii
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Data penimbangan crude product ... 48
Lampiran 2. Foto senyawa hasil sintesis ... 49
Lampiran 3. Data uji titik lebur senyawa hasil sintesis ... 50
Lampiran 4. Penghitungan kepolaran fase gerak ... 51
Lampiran 5. Penghitungan Rf senyawa hasil sintesis... 52
Lampiran 6. Spektra inframerah senyawa hasil sintesis ... 53
Lampiran 7. Spektra inframerah sikloheksana-1,3-dion sebagai pembanding ... 54
Lampiran 8. Spektra inframerah 4-klorobenzaldehid sebagai pembanding ... 55
Lampiran 9. Kromatogram kromatografi gas senyawa hasil sintesis ... 56
Lampiran 10. Spektra massa senyawa hasil sintesis ... 57
xix
INTISARI
Senyawa enadion aromatis diketahui mempunyai aktifitas sebagai inhibitor angiogenesis. Aktifitasnya dapat ditingkatkan dengan menambahkan gugus kloro pada cincin aromatis. Salah satu hasil modifikasi struktur ini adalah senyawa 2-(4'-klorobenzilidena) sikloheksanadion, yang pada strukturnya terdapat gugus kloro sebagai gugus penarik elektron pada cincin benzena. Cincin benzena yang kekurangan elektron akan menarik elektron pada rantai karbon yang mempunyai ikatan rangkap dua dan menyebabkan pada posisi beta menjadi lebih positif.
Penelitian ini termasuk dalam penelitian eksperimental deskriptif non-analitik. Sintesis dilakukan menggunakan sikloheksana-1,3-dion (3 mmol) dan 4-klorobenzaldehid (3 mmol) sebagai starting material dengan natrium hidroksida sebagai katalis. Analisis senyawa hasil sintesis dilakukan dengan uji organoleptis, uji kelarutan, uji titik lebur, uji kromatografi lapis tipis, kromatografi gas dan penghitungan rendemen serta elusidasi struktur dengan spektrofotometri inframerah dan spektrometri massa.
Senyawa hasil sintesis berbentuk serbuk halus, berwarna putih, tidak berbau, larut dalam aseton; mudah larut dalam etanol dan metanol; sangat mudah larut dalam kloroform dan piridin; dan sukar larut dalam aquades, jarak lebur antara 217-221oC, dan crude product 0,174 g. Berdasarkan hasil spektra inframerah dan massa, dapat disimpulkan bahwa senyawa 2-(4'-klorobenzilidena) sikloheksanadion tidak terbentuk. Senyawa hasil sintesis yang terbentuk adalah 4-(4-klorobenzilidena)-2-(3-oksosikloheksenil) sikloheksanadion dengan rumus molekul C19H17ClO3 dan berat molekul 328 g/mol.
xx
ABSTRACT
Enadion aromatic compounds are known to have activity as an inhibitor angiogenesis. Activities can be enhanced by adding a chloro group on the aromatic ring. The result of this structural modification is the compound 2-(4'-chlorobenzylidene) cyclohexanedione, which the chloro group as an electron withdrawing groups on benzene. Electron deficient on benzene will attract electrons in the carbon chain that have a double bond and causing the beta position became more positive.
This research was non-experimental descriptive and non-analytic research. Synthesis carried out using cyclohexane-1,3-dione (3 mmol) and 4-chlorobenzaldehyde (3 mmol) as the starting material with sodium hydroxide as a catalyst. Analysis of compounds synthesized by organoleptic test, solubility test, melting point test, thin layer chromatography, gas chromatography and calculating the yield and structure elucidation by infrared spectrophotometry and mass spectrometry.
1 BAB I
PENGANTAR
A. Latar Belakang
Angiogenesis adalah proses pembentukan pembuluh darah baru, yang penting untuk reproduksi sel, pengembangan dan penyembuhan luka di bawah kondisi normal. Proses ini diketahui merupakan hal yang sangat penting untuk pertumbuhan dan metastasis tumor. Tumor tidak dapat membesar lebih dari 1-2 mm kecuali tumor ini memiliki vaskularisasi yang baik. Zona 1-2 mm merupakan jarak maksimal nutrisi dan oksigen yang berasal dari pembuluh darah dapat berdifusi ke jaringan sekitarnya. Oleh karena itu, untuk dapat mencapai ukuran yang lebih besar, maka diperlukan neovaskularisasi (angiogenesis) guna mendukung nutrisi jaringan tumor baru. Jadi pada dasarnya pertumbuhan tumor dikontrol oleh keseimbangan faktor angiogenik dan faktor yang menghambat faktor angiogenik (Chrestella, 2009). Menurut National Cancer Institute, dua protein yang memainkan peran dalam pembentukan pembuluh darah (faktor angiogenik) yang tampak paling penting dalam mempertahankan pertumbuhan tumor adalah vascular endothelial growth factor (VEGF) dan basic fibroblast growth factor (bFGF) (Anonim, 2003).
Robinson et al., (2003) merancang senyawa-senyawa enon aromatik dan dienon aromatik yang merupakan analog kurkumin sebagai inhibitor
2
tumor. Senyawa ini juga telah diteliti dan berpotensi sebagai inhibitor
angiogenesis (Gururaj, Belakavad, Venkatesh, Marm, Salimatha, 2002). Senyawa tersebut dilaporkan aktif sebagai inhibitor angiogenesis dengan penghambatan antara 87,1%-98,2% pada konsentrasi 3 µg/mL dan antara 90,4%-98,1% pada konsentrasi 6 µg/mL. (Ireson et. al., 2001).
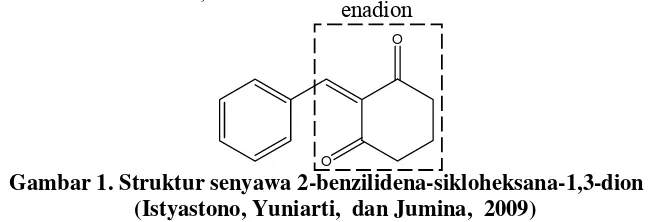
Istyastono, Yuniarti, dan Jumina (2009) melaporkan hasil sintesis tentang senyawa turunan kurkumin sebagai senyawa enadion aromatis yaitu 2-benzilidena-sikloheksana-1,3-dion.
O
O
Gambar 1. Struktur senyawa 2-benzilidena-sikloheksana-1,3-dion (Istyastono, Yuniarti, dan Jumina, 2009)
Senyawa enadion aromatis tersebut diketahui berpotensi sebagai inhibitor angiogenesis. Untuk meningkatkan aktifitas sebagai inhibitor
angiogenesis, maka salah satu senyawa enadion aromatis yang dapat dikembangkan adalah senyawa 2-(4'-klorobenzilidena) sikloheksanadion. Adanya gugus kloro (-Cl) pada senyawa 2-(4'-klorobenzilidena) sikloheksanadion berfungsi sebagai gugus penarik elektron pada cincin benzena, menyebabkan cincin benzena kekurangan elektron. Cincin benzena yang kekurangan elektron akan menarik elektron pada rantai karbon tetangganya yang mempunyai ikatan rangkap dua dan menyebabkan pada posisi beta menjadi elektropositif. Senyawa ini diharapkan memiliki aktifitas sebagai inhibitor angiogenesis yang lebih poten dibandingkan 2-benzilidena-sikloheksana-1,3-dion.
3
Reaksi yang mendasari sintesis senyawa 2-(4'-klorobenzilidena) sikloheksanadion adalah reaksi kondensasi aldol silang, yaitu suatu reaksi antara sebuah aldehid yang tidak mempunyai hidrogen alpha (α) dengan suatu senyawa aldehid maupun keton yang mempunyai hidrogen alpha (α). Prinsip reaksi kondensasi aldol silang adalah suatu senyawa dengan sedikitnya satu hidrogen
alpha (α)dapat mengalami reaksi kondensasi dengan senyawa karbonil lain yang tidak memiliki hidrogen alpha (α) dalam suasana basa. Produk reaksi kondensasi
aldol silang adalah senyawa enon berkonjugasi alpha-beta (Fessenden and Fessenden, 1994).
Katalis dibutuhkan dalam sintesis organik untuk menurunkan energi aktivasi sehingga dapat meningkatkan laju reaksi. Pada sintesis 2-(4’-klorobenzilidena) sikloheksanadion, digunakan katalis basa yaitu natrium hidroksida. Adanya katalis basa akan dihasilkan intermediet enolat yang lebih reaktif daripada intermediet enol yang dihasilkan dari katalis asam (Fessenden and Fessenden, 1986). Digunakan natrium hidroksida yang bersifat basa kuat, untuk mengambil satu hidrogen alpha (α) pada sikloheksana-1,3-dion yang terintangi oleh dua gugus karbonil (C=O), sehingga dapat membentuk ion enolat pada sikloheksana-1,3-dion yang bertindak sebagai nukleofil.
1. Permasalahan
4
2. Keaslian penelitian
Sejauh penelusuran penulis, penelitian sintesis senyawa 2-(4'-klorobenzilidena) sikloheksanadion dari sikloheksana-1,3-dion dan 4-klorobenzaldehid dengan katalis natrium hidroksida berdasarkan reaksi kondensasi aldol silang belum pernah dilakukan.
3. Manfaat penelitian
a. Manfaat teoritis. Penelitian ini diharapkan dapat memberikan informasi mengenai sintesis 2-(4'-klorobenzilidena) sikloheksanadion dari sikloheksana-1,3-dion dan 4-klorobenzaldehid dengan katalis natrium hidroksida.
b. Manfaat metodologi. Penelitian ini diharapkan dapat memberikan pengetahuan tentang tata cara sintesis 2-(4'-klorobenzilidena) sikloheksanadion dengan menggunakan reaksi kondensasi aldol silang.
B. Tujuan Penelitian
Kurkumin (1,7-bis(4’-hidroksi-3’-metoksifenil)-1,6-heptadiena-3,5-dion) yang merupakan komponen aktif dari rhizoma Curcuma longa L. Senyawa ini memiliki rumus molekul C21H20O6 dengan berat molekul 368,126 g/mol. Kristal kurkumin berwarna kuning atau oranye. Warna larutan kurkumin tidak konstan, tergantung pada pH. Pada pH asam, warna kurkumin menjadi kuning, namun warna berubah menjadi merah tua jika pada pH basa (Tonnesen et al., 1986). Kestabilan kurkumin tergantung pada pH. Pada suasana basa, kurkumin mengalami degradasi menjadi trans-6-(4-hidroksi-3-metoksi fenil)-2,3-diokso-5-heksanal, asam ferulat, feruloilmetana dan vanillin. Kestabilan kurkumin juga dipengaruhi cahaya atau sinar. Cahaya dapat menyebabkan terjadinya degradasi secara fotokimiawi. Hal ini disebabkan kurkumin memiliki gugus metilen aktif (-CH2-) di antara dua gugus keton (Tonnesen dan Karlsen, 1985).
6
Robinson et al., (2003) membagi molekul kurkumin menjadi tiga bagian farmakofor yaitu bagian A, B, dan C. Bagian A dan C merupakan gugus aromatis, sedangkan bagian C adalah ikatan diena-dion. Dua gugus aromatis tersebut baik simetris atau tidak simetris menentukan potensi ikatan antara senyawa obat dengan reseptor, oleh karena itu modifikasi dilakukan pada ketiga bagian farmakofor tersebut. Modifikasi pada farmakofor A dan C dapat dilakukan dengan substitusi pada cincin aromatis tersebut dengan gugus yang lain. Beberapa hasil pengujian membuktikan bahwa analog kurkumin dengan modifikasi pada farmakofor A dan C dengan substituen berbeda maupun modifikasi pada farmakofor B menjadi monoketon, menunjukkan hasil modifikasi memiliki potensi penghambatan pertumbuhan sel kanker yang lebih baik/poten dari kurkumin itu sendiri (Da’i, 2003).
Modifikasi terhadap senyawa penuntun kurkumin dapat dilakukan melalui: 1. Modifikasi gugus pada bagian terminal atau sayap dari inti aromatik/inti
benzaldehidnya dengan memasukkan substituen-substituen tertentu.
2. Modifikasi gugus pada bagian tengahnya yaitu menggunakan turunan 3-aril/alkil pentana-2,4-dion untuk modifikasi struktur pada gugus metilen aktifnya.
7
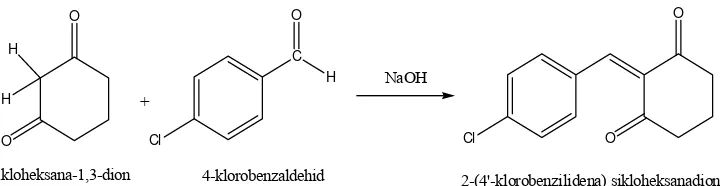
B. Sintesis 2-(4'-klorobenzilidena) sikloheksanadion
Senyawa 2-(4'-klorobenzilidena) sikloheksanadion dapat disintesis dari
starting material sikloheksana-1,3-dion dan 4-klorobenzaldehid dengan katalis basa seperti natrium hidroksida. Nama lain dari sikloheksana-1,3-dion adalah dihidroresorsinol. Senyawa ini berupa kristal, dengan rumus molekul C6H8O2 dan berat molekul 112,12 g/mol. Titik lebur senyawa ini adalah 105°C. Sikloheksana-1,3-dion larut dalam air, kloroform, aseton dan benzena panas. Tidak larut dalam eter, karbondioksida dan petroleum eter (Budavari, O’Neil, Smith, dan Heckelmann, 1989). Sedangkan, 4-klorobenzaldehid termasuk golongan aldehid aromatis dengan substituen golongan halogen yaitu kloro. Berat molekul 4-klorobenzaldehid adalah 140,57 g/mol dengan rumus molekul C7H5OCl. Pemerian senyawa ini berupa kristal berwarna putih dengan titik lebur 45oC-47oC dan titik didik sebesar 213oC-214oC dan mempunyai karakteristik bau menyengat. 4-klorobenzaldehid larut dalam etanol (Anonim, 2009). Aldehid aromatis cenderung kurang reaktif sebagai elektrofil dibandingkan dengan aldehid alifatis. Hal ini disebabkan karena adanya donor elektron dari resonansi cincin benzena pada gugus karbonil (McMurry, 2004).
8
hidroksida adalah 40 g/mol, mempunyai titik lebur 318oC, titik didih 1390oC (Anonim, 1995). Di dalam reaksi organik ada beberapa mekanisme yang dapat dilakukan oleh katalis, yaitu meningkatkan kemampuan elektrofil untuk diserang oleh nukleofil dan meningkatkan reaktifitas dari suatu nukleofil. Katalis dapat meningkatkan kemampuan gugus pergi untuk meninggalkan senyawanya (Bruice, 1998).
Reaksi yang mendasari sintesis senyawa 2-(4'-klorobenzilidena) sikloheksanadion adalah reaksi kondensasi aldol silang, yaitu suatu reaksi antara sebuah aldehid yang tidak mempunyai sebuah hidrogen alpha (α) dan suatu senyawa aldehid maupun keton yang mempunyai hidrogen alpha (α) (Fessenden and Fessenden, 1994).
Mula-mula dalam suasana basa, hidrogen alpha (α) pada sikloheksana-1,3-dion akan membentuk ion enolat yang berperan sebagai nukleofil. Pembentukan ion enolat akan meningkatkan nukleofilisitas dari atom karbon
9
C. Rekristalisasi
Pemurnian padatan dengan rekristalisasi didasarkan pada perbedaan kelarutannya dalam pelarut atau campuran pelarut (Anwar, Pranowo, dan Wahyuni, 1994). Rekristalisasi merupakan proses pemurnian suatu zat padat dengan cara melarutkan zat tersebut dengan pelarut panas kemudian didinginkan. Dengan pemanasan maka kelarutan akan meningkat dan ketika dingin kelarutan akan berkurang secara cepat dan senyawa mulai mengendap (Bresnick, 1996).
Beberapa metode rekristalisasi adalah:
1. Mengkristalkan kembali secara langsung dari cairan pelarut. 2. Mengkristalkan kembali dengan asam basa.
3. Mengkristalkan kembali secara presipitasi dengan solven kedua (Reksohadiprojo, 1996).
Agar rekristalisasi dapat berjalan dengan baik, pengotor harus dapat larut dengan pelarut untuk rekristalisasi atau mempunyai kelarutan lebih besar dari senyawa yang diinginkan agar pengotor tidak ikut mengkristal (Bresnick, 1996). Pelarut yang baik untuk rekristalisasi adalah:
1. Dapat melarutkan senyawa pada suhu tinggi namun sedikit pada suhu rendah. 2. Harus dapat melarutkan kotoran dengan segera pada temperatur rendah. 3. Dapat menghasilkan bentuk kristal yang baik dari senyawa yang dimurnikan
serta dapat dipisahkan dari bahan utama.
10
D. Uji Pendahuluan
Uji pendahuluan dilakukan untuk mengetahui karakteristik dari senyawa hasil sintesis, meliputi pemeriksaan organoleptis, pemeriksaan kelarutan, pemeriksaan titik lebur, kromatografi gas-spektrometri massa, dan uji kemurnian menggunakan kromatografi lapis tipis (KLT).
1. Pemeriksaan organoleptis
Uji ini merupakan uji yang paling sederhana dan memuat paparan mengenai suatu zat secara umum meliputi bentuk, warna, dan bau. Pernyataan dalam pemeriksaan organoleptis tidak cukup kuat dijadikan syarat baku. Namun secara tidak langsung dapat membantu dalam penilaian pendahuluan terhadap zat yang bersangkutan (Direktorat Jenderal Pengawasan Obat dan Makanan RI, 1995).
2. Pemeriksaan kelarutan
Pemeriksaan kelarutan dilakukan untuk mengidentifikasi atau mengetahui sifat fisik suatu zat. Pemeriksaan kelarutan zat padat dalam cairan dilakukan dengan melarutkan suatu zat hingga larutan tepat jenuh pada suhu yang terkontrol, kemudian hasilnya dibandingkan dengan standar. Hasil pemeriksaan kelarutan diharapkan sesuai dengan yang tercantum dalam standar. Dalam setiap pemeriksaan kelarutan, kemurnian zat dan pelarut harus terjamin karena adanya sedikit pengotor dapat menyebabkan terjadinya variasi hasil (Jenkins, 1965)
11
derajat polaritas tertentu dalam molekul pelarut non polar, sehingga menjadi dapat larut dalam alkohol. Maka pelarut semipolar ini dapat bertindak sebagai pelarut perantara yang dapat menyebabkan bercampurnya cairan polar dan nonpolar. Pelarut nonpolar dapat melarutkan zat terlarut non polar melalui interaksi dipol induksi. Selain momen dipol, faktor lain yang berpengaruh terhadap kelarutan zat antara lain tetapan dielektrik, asosiasi, solvasi, tekanan dalam, dan reaksi asam-basa (Martin and Bustamante, 1993).
Istilah kelarutan tidak saja merupakan standar atau uji kemurnian dari suatu zat, tetapi lebih dimaksudkan sebagai informasi dalam penggunaan, pengolahan, dan peracikan suatu bahan, kecuali disebutkan secara khusus dalam judul tersendiri dan disertai cara ujinya secara kuantitatif (Direktorat Jenderal Pengawasan Obat dan Makanan RI, 1995).
Tabel I. Istilah kelarutan menurut Farmakope Indonesia IV (Direktorat Jenderal Pengawasan Obat dan Makanan RI, 1995)
Istilah kelarutan Jumlah bagian pelarut yang diperlukan untuk melarutkan 1 bagian zat Sangat mudah larut Kurang dari 1
Mudah larut 1 sampai 10
Larut 10 sampai 30
Agak sukar larut 30 sampai 100 Sukar larut 100 sampai 1.000 Sangat sukar larut 1.000 sampai 10.000 Praktis tidak larut Lebih dari 10.000
3. Pemeriksaan titik lebur
12
energi yang diserap cukup besar maka akan terjadi vibrasi dan rotasi dari molekul tersebut. Bila suhu tetap dinaikkan terus maka molekul akan rusak dan berubah menjadi cairan (Bradstatter, 1971).
Pemeriksaan titik lebur merupakan aspek yang sangat penting, yang seringkali dilakukan dalam penelitian sintesis. Penelitian titik lebur dapat memberikan informasi mengenai kemurnian dari suatu produk hasil sintesis. Pada umumnya suatu senyawa mempunyai kemurnian yang baik bila jarak leburnya tidak lebih dari 2°C. Rentangan lebih besar dari harga ini dapat dikatakan senyawa kurang murni (MacKenzie, 1967).
4. Uji kemurnian menggunakan kromatografi lapis tipis (KLT)
Kromatografi lapis tipis dapat digunakan untuk mengidentifikasi komponen tertentu. Teknik ini sering dilakukan dengan lempeng kaca atau plastik yang dilapisi dengan fase diam. Senyawa yang akan dianalisis ditotolkan pada dasar lempengan yang dilapisi fase diam dan dielusi dengan fase gerak yang akan bergerak naik oleh karena gaya kapilaritas (Bresnick, 2004).
Jika fase diam bersifat polar maka senyawa yang bersifat polar akan melekat lebih kuat pada lempeng daripada senyawa non polar akibat interaksi tarik-menarik dipol-dipol. Senyawa non polar kurang melekat pada fase diam polar sehingga terelusi lebih cepat. Berdasarkan hal tersebut dapat disimpulkan bahwa jarak rambat senyawa pada lempengan dapat digunakan sebagai cerminan polaritas suatu senyawa (Bresnick, 2004).
13
menyemprotkan larutan yang dapat bereaksi dengan senyawa sehingga dapat menimbulkan warna (Bresnick, 2004).
5. Kromatografi gas-spektrometri massa
Kromatografi gas merupakan instrumen analitis yang memberikan informasi baik kualitatif maupun kuantitatif mengenai komponen suatu sampel. Sampel akan mengalami proses pemisahan dalam kolom, kemudian dideteksi dan direkam sebagai pita elusi (Day and Underwood, 1996).
Metode kromatografi gas dan spektrometri massa memberikan keuntungan saat keduanya digunakan secara bersamaan. Proses pemisahan dilakukan oleh kromatografi gas, sedangkan proses identifikasi dan kuantitatif dilakukan oleh spektrometri massa. Keuntungan dari kromatografi gas-spektrometri massa antara lain metode ini dapat digunakan untuk hampir semua jenis analit, memiliki batas deteksi yang rendah, dan memberi informasi penting tentang spektra massa dari suatu senyawa organik (Dean, 1995).
E. Elusidasi Struktur Senyawa Hasil Sintesis 1. Spektrofotometri inframerah
Spektrofotometri inframerah biasanya digunakan untuk mengetahui gugus fungsional yang terdapat dari suatu senyawa. Namun demikian, spektrofotometri ini tidak memberikan informasi mengenai struktur sebanyak yang diberikan spektroskopi Nuclear Magnetic Resonance (Bresnick, 2004).
14
inframerah yang dilewatkan pada suatu molekul sama dengan frekuensi mengulur atau menekuknya ikatan maka energi tersebut akan diserap. Serapan inilah yang dapat direkam oleh detektor pada spektrofotometri inframerah (Bresnick, 2004). 2. Spektrometri massa
Prinsip dalam spektroskopi massa adalah terjadinya tabrakan antara sebuah molekul organik dengan salah satu elektron berenergi tinggi yang menyebabkan lepasnya sebuah elektron dari molekul tersebut dan membentuk ion positif organik. Ion positif organik yang dihasilkan dari penembakan elektron berenergi tinggi ini tidak stabil dan pecah menjadi fragmen kecil, baik berbentuk radikal bebas maupun ion-ion lain. Dalam sebuah spektrometer massa, hanya fragmen bermuatan positif yang akan terdeteksi.
Spektra massa merupakan grafik antara kelimpahan relatif fragmen bermuatan positif terhadap perbandingan massa/muatan (m/z). Muatan ion dari partikel yang terdeteksi dalam spektra massa adalah +1. Nilai m/z ion semacam ini sama dengan massanya. Dari segi praktis, spektra massa adalah rekaman dari massa partikel terhadap kelimpahan relatif partikel tersebut.
15
F. Landasan Teori
Reaksi kondensasi aldol silang adalah suatu reaksi antara sebuah aldehid yang tidak mempunyai sebuah hidrogen alpha (α) dan suatu senyawa aldehid maupun keton yang mempunyai hidrogen alpha (α). Dengan mereaksikan sikloheksana-1,3-dion yang memiliki hidrogen alpha (α) yang diapit oleh dua gugus keton dengan 4-klorobenzaldehid yang merupakan senyawa karbonil yang tidak memiliki hidrogen alpha (α) dapat menghasilkan senyawa 2-(4'-klorobenzilidena) sikloheksanadion.
Gambar 3. Reaksi umum sintesis senyawa 2-(4'-klorobenzilidena) sikloheksanadion
+
Cl
C O
H NaOH
O
O Cl
O
O H
H
16
G. Hipotesis
17
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk dalam penelitian eksperimental deskriptif non-analitik karena tidak ada perlakuan pada subjek uji dan hanya dipaparkan fenomena yang terjadi yang tidak terdapat hubungan sebab akibat.
B. Definisi Operasional 1. Starting material
Starting material adalah bahan awal yang digunakan untuk penelitian.
Starting material yang digunakan dalam penelitian ini adalah sikloheksana-1,3-dion dan 4-klorobenzaldehid.
2. Katalis
Katalis adalah suatu senyawa yang digunakan dalam reaksi untuk meningkatkan laju reaksi kimia. Dalam penelitian ini, katalis yang digunakan adalah natrium hidroksida.
3. Senyawa hasil sintesis
Senyawa hasil sintesis adalah senyawa yang diharapkan terbentuk dari
18
4. Rendemen senyawa hasil sintesis
Rendemen senyawa hasil sintesis adalah jumlah senyawa hasil sintesis yang terbentuk dan dapat dihitung dari jumlah starting material yang digunakan. Rendemen senyawa hasil sintesis dalam penelitian ini adalah rendemen 2-(4'-klorobenzilidena) sikloheksanadion.
C. Bahan Penelitian
Sikloheksana-1,3-dion (p.a., Nacalay), aquades (Laboratorium Kimia Organik Fakultas Farmasi Universitas Sanata Dharma), 4-klorobenzaldehid (p.a., Nacalay), etanol (p.a., Merck), asam asetat glasial (p.a., Merck), natrium hidroksida (p.a., Merck), metanol (p.a., Merck), kloroform (p.a., Merck), etil asetat (p.a., Merck), aseton (p.a., Merck), piridin (p.a., Merck), es batu.
D. Alat Penelitian
Pengaduk magnetik, pemanas listrik (Herdolph MR 2002), pengering (Memmert Oven Model 400), neraca analitik (Mextler PM 100), thermophan
19
E. Tata Cara Penelitian
1. Sintesis 2-(4'-klorobenzilidena) sikloheksanadion
Sikloheksana-1,3-dion 3,0 mmol (0,33 g) dimasukkan ke dalam labu erlenmeyer 250 mL, kemudian ditambahkan 10 mL larutan natrium hidroksida 4% b/v dan diaduk selama 15 menit pada suhu kamar menggunakan pengaduk magnetik. 4-klorobenzaldehid 3,0 mmol (0,43 g) dimasukkan dalam labu erlenmeyer 250 mL, kemudian ditambahkan 20 mL etanol. Campuran 4-klorobenzaldehid dengan etanol dimasukkan dalam labu alas bulat 1000 mL dan dipanaskan pada temperatur 80oC. Campuran sikloheksana-1,3-dion dengan larutan natrium hidroksida ditambahkan tetes demi tetes ke dalam labu alas bulat 1000 mL yang berisi campuran 4-klorobenzaldehid dengan etanol. Selanjutnya, dilakukan refluks selama tiga jam. Senyawa yang diperoleh diisolasi dengan cara maserasi selama satu jam menggunakan campuran asam asetat glasial-aquades (1:1), disaring, dicuci dengan aquades, dikeringkan, dan dihitung rendemennya. 2. Uji pendahuluan
a. Uji organoleptis
Uji organoleptis meliputi bentuk, warna, dan bau senyawa hasil sintesis. Kemudian hasil pengamatan dibandingkan dengan starting material yang digunakan dalam penelitian yaitu sikloheksana-1,3-dion dan 4-klorobenzaldehid.
b. Uji kelarutan senyawa hasil sintesis
20
kelarutannya. Pelarut lain yaitu etanol, metanol, kloroform, aseton, dan piridin dilakukan dengan prosedur yang sama. Kemudian dibandingkan dengan starting material yang digunakan dalam penelitian yaitu sikloheksana-1,3-dion, dan 4-klorobenzaldehid.
c. Uji titik lebur
Sedikit kristal hasil sintesis dimasukkan ke dalam electrothermal capillary tubes, kemudian dimasukkan ke dalam alat pengukur titik lebur (thermophan). Amati peleburan kristalnya dan catat suhu waktu pertama kali melebur hingga kristal melebur seluruhnya dengan kenaikan suhu 0,2°C tiap menitnya.
d. Uji kemurnian menggunakan kromatografi lapis tipis (KLT)
Senyawa hasil sintesis dan starting material masing-masing dilarutkan dalam etanol. Masing-masing larutan tersebut ditotolkan sebanyak 1 µL dengan menggunakan mikropipet pada lempeng silika gel GF254 yang sudah diaktifkan pada suhu 1000C selama 30 menit dan fase gerak yang digunakan yaitu kloroform-etil asetat (9:1 v/v). Pengembangan dilakukan dengan jarak rambat 10 cm.
e. Kromatografi gas-spektrometer massa
21
pengangkut helium akan membawa cuplikan yang sudah diuapkan masuk kedalam kolom Rtx-5MS yang dilapisi fase cair dimethylpolysiloxane. Selanjutnya cuplikan diukur oleh detektor hingga diperoleh suatu kromatogram.
3. Elusidasi Struktur Senyawa Hasil Sintesis
Elusidasi struktur senyawa hasil sintesis dilakukan oleh petugas laboratorium kimia organik, Fakultas MIPA, Universitas Gadjah Mada, Yogyakarta. Prinsip kerja secara umum yaitu:
a. Spektrofotometri inframerah
Senyawa hasil sintesis sebanyak kurang lebih 0,5 mg – 1,0 mg dicampur homogen dengan kurang lebih 10 mg KBr, kemudian dikempa dan dibuat tablet. Cahaya inframerah dari sumber dilewatkan melalui cuplikan, kemudian dipecah menjadi frekuensi-frekuensi individunya dalam monokromator dan intensitas relatif dari frekuensi individu diukur oleh detektor hingga didapat spektra inframerah dari senyawa yang bersangkutan. Bilangan gelombang yang digunakan 400-4000 nm.
b. Spektrometri massa
22
sebanding dengan kelimpahan relatif setiap fragmennya. Kelimpahan relatif setiap fragmen akan dicatat dan menghasilkan data spektra massa.
F. Analisis Hasil 1. Penghitungan rendemen
2. Analisis pendahuluan
Analisis pendahuluan senyawa hasil sintesis berdasarkan data organoleptis, data kelarutan, data kromatografi lapis tipis, data titik lebur, dan data kromatografi gas.
3. Elusidasi struktur
23
BAB IV
HASIL DAN PEMBAHASAN
A. Sintesis 2-(4’-klorobenzilidena) sikloheksanadion
Sintesis 2-(4’-klorobenzilidena) sikloheksanadion dilakukan berdasarkan reaksi kondensasi aldol silang dari starting material sikloheksana-1,3-dion dan 4-klorobenzaldehid menggunakan katalis natrium hidroksida. Sikloheksana-1,3-dion yang memiliki hidrogen alpha yang diapit oleh dua gugus karbonil keton bertindak sebagai nukleofil, yang akan bereaksi dengan 4-klorobenzaldehid yang bertindak sebagai elektrofil. Natrium hidroksida digunakan sebagai katalis karena bersifat basa dan tergolong dalam basa hidroksida. Reaksi kondensasi aldol silang berlangsung dalam suasana basa. Oleh karena itu, penggunaan natrium hidroksida dapat memberi suasana basa pada jalannya reaksi pembentukan 2-(4'-klorobenzilidena) sikloheksanadion.
Berdasarkan hasil orientasi untuk mendapatkan kondisi sintesis yang optimal, tahap awal sintesis dilakukan dengan mencampur sikloheksana-1,3-dion dengan larutan natrium hidroksida 4% b/v untuk membentuk ion enolat dari sikloheksana-1,3-dion. klorobenzaldehid dilarutkan dalam etanol. Larutan 4-klorobenzaldehid ditambahkan pada campuran sikloheksana-1,3-dion dengan natrium hidroksida tetes demi tetes. Selama proses sintesis, digunakan refluks untuk mempertahankan kondisi sistem termodinamika sehingga reaksi dapat berjalan sempurna. Pada penelitian ini, proses refluks dilakukan selama tiga jam.
24
starting material tersebut. Adanya pengadukan disertai pemanasan dapat meningkatkan mobilitas molekul starting material, sehingga frekuensi terjadinya tumbukan antar starting material menjadi tinggi.
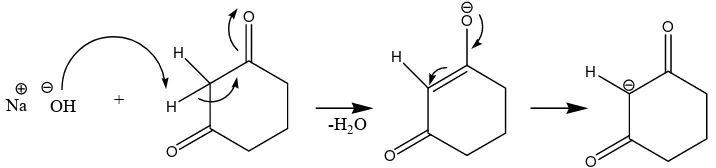
Penambahan natrium hidroksida sebagai katalis, menyebabkan ion hidroksida dari natrium hidroksida bereaksi dengan sikloheksana-1,3-dion membentuk ion enolat. Hal ini dapat terjadi karena terdapat atom hidrogen alpha
(α) pada sikloheksana-1,3-dion yang bersifat asam. Satu hidrogen alpha (α) diambil oleh ion hidroksida, menyebabkan atom karbon bermuatan negatif yang disebut ion enolat. Hal ini menyebabkan sikloheksana-1,3-dion bertindak sebagai nukleofil. Gambar 4. Mekanisme reaksi pembentukan ion enolat pada
sikloheksana-1,3-dion
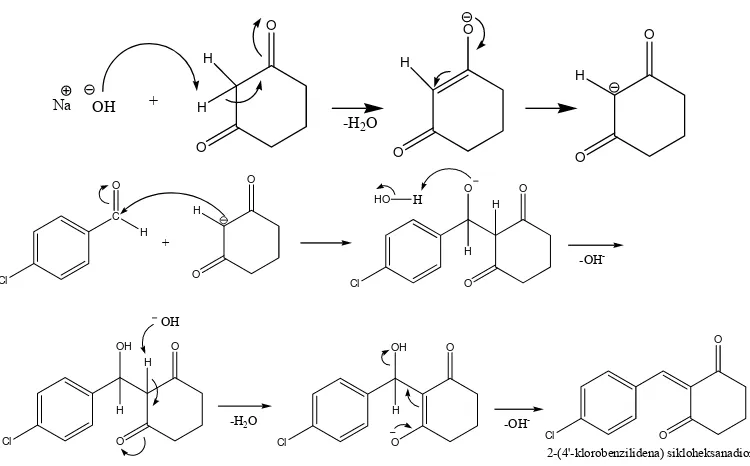
25
Gambar 5. Mekanisme reaksi sintesis 2-(4'-klorobenzilidena) sikloheksanadion
Selanjutnya, senyawa hasil sintesis dilakukan isolasi dengan cara maserasi menggunakan campuran asam asetat glasial-aquades (1:1 v/v). Isolasi bertujuan untuk mendesak serbuk yang ada dalam produk. Asam asetat glasial-aquades diketahui memiliki nilai kepolaran yang besar, sehingga mampu mendesak serbuk atau kristal yang terperangkap dalam produk. Setelah terbentuk serbuk, maka dilakukan filtrasi dengan bantuan kertas saring untuk mendapatkan serbuk. Berikutnya, dicuci dengan aquades untuk menghilangkan sisa asam asetat glasial dan menetralkan serbuk dari senyawa-senyawa yang larut dalam aquades, seperti sikloheksana-1,3-dion.
Crude product hasil sintesis diperoleh sebesar 0,174 gram. Disebut crude product sebab senyawa hasil sintesis belum dapat dikatakan murni. Diperoleh
4-26
klorobenzaldehid kurang elektrofil karena adanya donor elektron dari resonansi cincin benzena pada gugus karbonil.
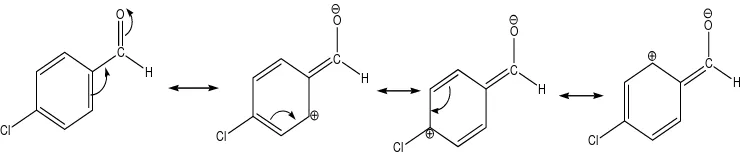
C Gambar 6. Resonansi pada 4-klorobenzaldehid (McMurry, 2004)
Adanya reaksi self-condensation sikloheksana-1,3-dion yang menyebabkan berkurangnya sifat nukleofilisitas ion enolat dari sikloheksana-1,3-dion untuk menyerang 4-klorobenzaldehid. Pengaruh konsentrasi natrium hidroksida sebesar 4% b/v dan urutan pencampuran starting material yang cenderung menyebabkan reaksi self condensation pada sikloheksana-1,3-dion. Penyebab lainnya adalah pada sikloheksana-1,3-dion terdapat sisi yang bersifat nukleofil dan elektrofil. Sisi nukleofil berada pada atom karbon yang dekat dengan gugus karbonil (C=O), sedangkan sisi elektrofil berada pada atom karbon karbonil tersebut.
B. Analisis Pendahuluan 1. Uji organoleptis
27
Tabel II. Hasil uji organoleptis senyawa hasil sintesis
dibandingkan dengan starting material
Pemeriksaan Sikloheksana-1,3-dion
4-klorobenzaldehid Senyawa hasil sintesis
Bentuk Serbuk Kristal Serbuk
Warna Putih Putih Putih
Bau Khas Khas dan menyengat Khas
Dari hasil uji organoleptis, tampak bahwa belum ada perbedaan nyata antara senyawa hasil sintesis dengan starting material. Perlu dilakukan uji lainnya untuk mengetahui terbentuknya senyawa hasil sintesis.
2. Uji kelarutan
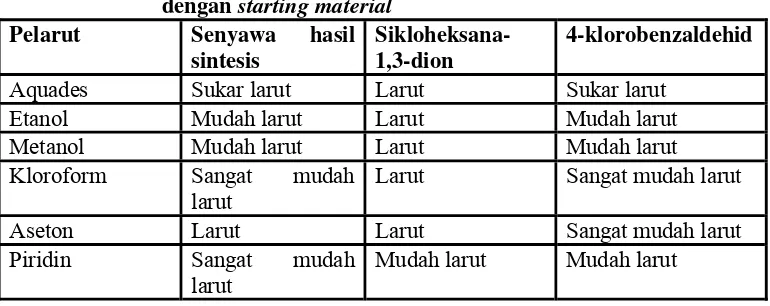
Uji kelarutan senyawa hasil sintesis dilakukan untuk mengetahui kelarutan senyawa hasil sintesis dalam berbagai pelarut yang memiliki sifar polar maupun non polar. Hasil uji kelarutan senyawa hasil sintesis dapat digunakan sebagai acuan untuk pemilihan pelarut pada uji kromatografi gas-spektrometer massa. Data uji kelarutan senyawa hasil sintesis ditunjukkan pada tabel berikut :
Tabel III. Hasil uji kelarutan senyawa hasil sintesis dibandingkan dengan starting material
Pelarut Senyawa hasil
sintesis
Sikloheksana-1,3-dion
4-klorobenzaldehid
Aquades Sukar larut Larut Sukar larut
Etanol Mudah larut Larut Mudah larut
Metanol Mudah larut Larut Mudah larut
Kloroform Sangat mudah
larut
Larut Sangat mudah larut
Aseton Larut Larut Sangat mudah larut
Piridin Sangat mudah
larut
28
Berdasarkan data hasil uji kelarutan, senyawa hasil sintesis sukar larut pada aquades, yang bersifat polar, tetapi larut pada pelarut yang bersifat semipolar seperti metanol, etanol, dan kloroform, serta pelarut yang bersifat nonpolar seperti aseton dan piridin.Hal ini disebabkan senyawa hasil sintesis cenderung bersifat nonpolar serta bersifat asam. Pelarut yang bersifat semipolar bertindak sebagai pelarut perantara yang dapat menyebabkan bercampurnya cairan polar dan nonpolar.
3. Uji titik lebur
Uji titik lebur senyawa hasil sintesis digunakan untuk mengetahui kemurnian senyawa hasil sintesis dan memastikan bahwa senyawa hasil sintesis berbeda dengan starting material. Suatu senyawa dikatakan murni jika jarak leburnya tidak lebih dari 2oC. Dari hasil uji titik lebur diketahui bahwa senyawa hasil sintesis mempunyai jarak lebur sebesar 217-221oC. Hasil ini menunjukkan adanya perbedaan dengan starting material yang titik leburnya telah diketahui, yaitu untuk senyawa sikloheksana-1,3-dion titik leburnya adalah 105oC (Budavari, O’Neil, Smith, dan Heckelmann, 1989). Pada senyawa 4-klorobenzaldehid jarak leburnya adalah 45-47oC (Anonim, 2009). Dengan demikian, dapat dikatakan bahwa senyawa hasil sintesis berbeda dengan starting material.
4. Uji kemurnian menggunakan kromatografi lapis tipis (KLT)
29
pada pelarut yang sama adalah spesifik sesuai dengan tingkat kepolarannya. Pemeriksaan senyawa hasil sintesis dengan KLT diamati dibawah sinar ultraviolet (UV) pada panjang gelombang 254 nm dengan sikloheksana-1,3-dion dan 4-klorobenzaldehid sebagai pembanding. Campuran fase gerak yang dipilih adalah fase gerak yang relatif bersifat nonpolar daripada fase diam. Pada penelitian ini, pemeriksaan kemurnian dengan KLT menggunakan sistem kromatografi fase normal dimana fase diam yang digunakan adalah bersifat lebih polar dibanding fase geraknya. Fase diam silika gel merupakan senyawa yang bersifat polar karena mengandung gugus hidroksil (-OH) pada strukturnya serta adanya atom oksigen yang letaknya berselang-seling dengan atom silika (Si). Kepolaran silika gel akan mengikat senyawa yang bersifat lebih polar.
Gambar 7. Kromatogram pada KLT Keterangan : A = 4-klorobenzaldehid
B = Sikloheksana-1,3-dion C = Senyawa hasil sintesis Fase diam silika gel GF254
Fase gerak kloroform-etil asetat (9:1 v/v)
Fase gerak yang digunakan dalam penelitian ini adalah campuran antara kloroform dan etil asetat dengan perbandingan 9:1 v/v. Berdasarkan penghitungan indeks polaritas campuran, didapatkan sebesar 41,3. Secara visual, semua bercak tidak terlihat, oleh karena itu diamati dibawah sinar UV pada panjang gelombang 254 nm. Berdasarkan hasil uji dengan KLT yang menggunakan fase gerak kloroform etil asetat 9:1 v/v diperoleh nilai Rf 4-klorobenzaldehid adalah 0,68 ;
A
30
nilai Rf sikloheksana-1,3-dion adalah 0,03 ; nilai Rf senyawa hasil sintesis adalah 0,40. Nilai Rf 4-klorobenzaldehid lebih besar dibandingkan sikloheksana-1,3-dion dan senyawa hasil sintesis karena afinitas 4-klorobenzaldehid lebih tinggi terhadap fase gerak daripada fase diam. Pada struktur 4-klorobenzaldehid, terdapat cincin aromatis yang bersifat lebih nonpolar. Sikloheksana-1,3-dion pada strukturnya terdapat dua gugus yang bersifat polar yaitu C=O karbonil, dimana terdapat perbedaan elektronegatifitas dan muatan yang dikandung atom karbon dan atom oksigen, menyebabkan afinitas sikloheksana-1,3-dion lebih tinggi terhadap fase diam daripada fase gerak. Pada senyawa hasil sintesis terdapat gugus yang bersifat polar dan nonpolar. Gugus yang bersifat polar akan berinteraksi dengan fase diam, sedangkan gugus yang bersifat nonpolar akan berinteraksi dengan fase gerak. Berdasarkan nilai Rf, menunjukkan bahwa terbentuk senyawa baru yang berbeda dengan starting material.
5. Kromatografi gas
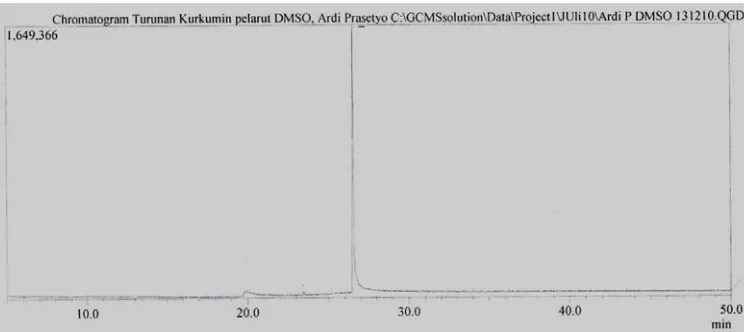
31
Gambar 8. Kromatogram kromatografi gas senyawa hasil sintesis Dari gambar 8, dapat diketahui bahwa senyawa hasil sintesis mempunyai satu puncak dengan waktu retensi 26,542 menit. Kromatogram kromatografi gas ini mendukung data uji titik lebur yang telah dilakukan sebelumnya.
C. Elusidasi Struktur Senyawa Hasil Sintesis 1. Spektra inframerah
32
Gambar 9. Spektra inframerah senyawa hasil sintesis
33
ikatan C-H pada cincin aromatis, yang diperkuat dengan serapan pada 1905,67 cm-1.
Tabel IV. Interpretasi spekra inframerah senyawa hasil sintesis No Bilangan
gelombang (cm-1)
Intensitas Gugus fungsi
1 825,53 Sedang-tajam Cincin aromatis 1,4 disubstitusi (posisi para)
2 1111,00 Sedang-tajam Cincin aromatis yang tersubstitusi dengan gugus kloro
3 1427,32 Lemah C-H pada alkena
4 1489, 05 Sedang-tajam C=C pada cincin aromatis
5 1604,77 Kuat C=C ena (terkonjugasi dengan cincin aromatis dan gugus karbonil)
6 1720,50 Kuat C=O keton terkonjugasi dengan α,β tidak jenuh
7 1905,67 Lemah C-H pada cincin aromatis 8 2947,23 Sedang C-H hibridisasi sp3 9 3078,39 Sedang-lemah C-H pada cincin aromatis
34
Gambar 10. Spektra inframerah sikloheksana-1,3-dion sebagai pembanding
(Kinugasa, Tanabe, dan Tamura, 2009a)
Pada spektra inframerah sikloheksana-1,3-dion terdapat beberapa bilangan gelombang yang menunjukkan keberadaan gugus fungsional. Serapan sikloalkana dengan enam atom karbon pada 1460 cm-1, hal ini dipertegas lagi pada 2894 cm-1. Bilangan gelombang 1626 cm-1 dengan intensitas kuat menunjukkan adanya C=O keton. Ikatan C-H hibridisasi sp3 muncul pada 2949 cm-1.
Tabel V. Interpretasi spektra inframerah sikloheksana-1,3-dion No Bilangan
gelombang (cm-1)
Intensitas Gugus fungsi
1 1460 Kuat-tajam Sikloalkana dengan enam atom karbon 2 1626 Kuat-tajam C=O keton
3 2894 Lemah Sikloalkana dengan enam atom karbon 4 2949 Lemah C-H hibridisasi sp3
35
Gambar 11. Spektra inframerah 4-klorobenzaldehid sebagai pembanding
(Kinugasa, Tanabe, dan Tamura, 2009b)
Pada spektra inframerah 4-klorobenzaldehid terdapat beberapa bilangan gelombang yang menunjukkan gugus-gugus yang dimilikinya. Adanya cincin aromatis ditunjukkan pada 794 cm-1 dan 817 cm-1. Pada bilangan gelombang 841 cm-1 menunjukkan adanya cincin aromatis yang tersubstitusi pada posisi para
36
Tabel VI. Interpretasi spektra inframerah 4-klorobenzaldehid
No Bilangan gelombang
(cm-1)
Intensitas Gugus fungsi
1 794 dan 817 Sedang-tajam Adanya cincin aromatis
2 841 Kuat-tajam Cincin aromatis 1,4 disubstitusi (posisi
para)
3 1094 Kuat-tajam Cincin aromatis yang terkonjugasi dengan gugus kloro (-Cl)
4 1419 dan 1588 Sedang C=C pada cincin aromatis
5 1699 Kuat-tajam C=O aldehid
6 2769 dan 2833 Lemah C-H aldehid
7 3089 Lemah C-H pada cincin aromatis
(Silverstein, Bassler, dan Morril, 1991) Dari spektra sikloheksana-1,3-dion dan 4-klorobenzaldehid sebagai pembanding, dapat diketahui bahwa bilangan gelombang dan jenis intensitas yang terdapat pada senyawa hasil sintesis berbeda dengan sikloheksana-1,3-dion dan 4-klorobenzaldehid. Perbedaan yang nyata adalah tidak terdapat vibrasi C=C ena pada sikloheksana-1,3-dion dan 4-klorobenzaldehid. Perbedaan hasil interpretasi spektra senyawa hasil sintesis terhadap sikloheksana-1,3-dion dan 4-klorobenzaldehid dapat dijelaskan sebagai berikut:
Tabel VII. Hasil interpretasi spektra inframerah senyawa hasil sintesis dengan sikloheksana-1,3-dion dan 4-klorobenzaldehid sebagai pembanding
37
Perbedaan gugus fungsional pada senyawa hasil sintesis dengan sikloheksana-1,3-dion dan 4-klorobenzaldehid menunjukkan bahwa senyawa hasil sintesis mempunyai struktur molekul yang berbeda dengan starting material. 2. Spektra massa
Senyawa hasil sintesis dideteksi dengan spektrometer massa setelah mengalami proses pemisahan dengan instrumen kromatografi gas. Spektra massa digunakan untuk menentukan berat molekul senyawa hasil sintesis. Selain itu, dapat digunakan untuk mengetahui kerangka molekul senyawa hasil sintesis melalui interpretasi fragmen-fragmen molekul.
Gambar 12. Spektra massa senyawa hasil sintesis
Pada puncak dengan waktu retensi 26,542 menit hasil kromatografi gas, didapatkan m/z = 328, dimana m/z = 328 sesuai dengan berat molekul produk
38
senyawa 2-(4'-klorobenzilidena) sikloheksanadion. Berikut adalah proses fragmentasi senyawa hasil sintesis. Proses fragmentasi berdasarkan pembacaan spektra massa.
Puncak dengan m/z = 293 merupakan fragmen dari ion molekul yang mengalami pelepasan radikal .Cl. Pelepasan ini menghasilkan ion C19H17O3+. Pada m/z = 301, molekul C19H17O3 melepaskan molekul C2H4, sehingga membentuk ion C17H14ClO3+. Kemudian, ion C17H14ClO3+ mengalami fragmentasi menjadi ion C9H8O3+ dengan m/z = 82 dan ion C8H6Cl+ dengan m/z = 137. Pelepasan molekul C2H2 dari ion C8H6Cl+ membentuk ion C6H4Cl+ dengan m/z = 111.
40
Gambar 13. Fragmentasi senyawa hasil sintesis
Berdasarkan proses fragmentasi kerangka molekul dengan melihat fragmen-fragmen yang terbentuk, menunjukkan bahwa senyawa hasil sintesis mempunyai berat molekul 328 g/mol dengan rumus molekul C19H17ClO3 dan struktur molekul yang ditunjukkan pada gambar 14. Jika digabungkan dengan data uji organoleptis, titik lebur, kromatografi lapis tipis, kromatografi gas, dan spektra inframerah, maka dapat dikatakan senyawa hasil sintesis merupakan senyawa baru, bukan merupakan starting material.
O O
O Cl
Gambar 14. Struktur molekul senyawa hasil sintesis
41
enolat mengalami resonansi membentuk karbanion dan melakukan adisi pada gugus karbonil sikloheksana-1,3-dion.
42
Gambar 15. Mekanisme reaksi pembentukan 4-(4-klorobenzilidena)- 2-(3-oksosikloheksenil) sikloheksanadion
(Fessenden and Fessenden, 1994)
Dalam suasana basa, terjadi dehidrasi secara spontan pada produk aldol. Hal ini disebabkan adanya hidrogen alpha (α) yang bersifat asam, yang memungkinkan untuk diserang oleh suatu basa sehingga dapat melepaskan ion hidroksida.
43
Kemudian, senyawa intermediet tersebut mengalami dehidrasi menghasilkan senyawa enon yaitu 4-(4-klorobenzilidena)-2-(3-oksosikloheksenil) sikloheksanadion.
44 BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Senyawa 2-(4'-klorobenzilidena) sikloheksanadion tidak terbentuk dari hasil reaksi antara sikloheksana-1,3-dion dan 4-klorobenzaldehid dengan menggunakan katalis natrium hidroksida. Senyawa yang terbentuk dari hasil reaksi antara sikloheksana-1,3-dion dan 4-klorobenzaldehid dengan menggunakan katalis natrium hidroksida adalah senyawa 4-(4-klorobenzilidena)-2-(3-oksosikloheksenil) sikloheksanadion dengan rumus molekul C19H17ClO3 dan berat molekul sebesar 328 g/mol dengan jumlah crude product 0,174 gram.
B. Saran
1. Perlu dilakukan optimasi proses sintesis untuk mendapatkan senyawa hasil sintesis yaitu 2-(4'-klorobenzilidena) sikloheksanadion.
45
DAFTAR PUSTAKA
Anonim, 2003, Angiogenesis, The Leukemia & Lymphoma Society, New York. Anonim, 2009, Electronic Nacalai Search Version Product Detail,
https://www.nacalai.co.jp/ss/ec/ECsrchdetl.cfm?Dum=1&syohin=0811792 & syubetsu, diakses tanggal 21 Juni 2010
Anwar, C., Pranowo, H. D., dan Wahyuni, T. D., 1994, Pengantar Praktikum Kimia Organik, UGM Press, Yogyakarta, 73, 189.
Bradstatter, M. K., 1971, Thermomicroscopy’s Analysis of Pharmaceutical, Pergamon Press, London, 1-10.
Bresnick, S. D., 2004, Intisari Kimia Organik, Hipokrates, Jakarta, 96-97, 101-107.
Bruice, P.Y., 1998, Organic Chemsitry, 2nd edition, Prentice Hall Inc., USA, 953. Budavari, S., O’Neil, M.J., Smith, A., Heckelmann, P.Z., 1989, The Merck Index:
an Encyclopedia of Chemicals, Drugs, and Biologicals, 11th edition, Merck and Co., Inc., USA, 501.
Chrestella, J., 2009, Neoplasma, Departemen Patologi Anatomi Fakultas Kedokteran Universitas Sumatera Utara, Medan, 2-6.
Cotton and Wilkinson, 1989, Basic Inorganic Chemistry, diterjemahkan oleh Sahati, S., UI Press, Jakarta.
Da’i, M., 2003, Uji Aktifitas Antiproliferatif PGV-0 terhadap Sel Raji, Sel Hela dan Sel Myeloma, Tesis, Program Pasca Sarjana Fakultas Farmasi Universitas Gadjah Mada, Yogyakarta.
Day, Jr., R. A. and Underwood, A. L., 1996, Analisis Kimia Kuantitatif, edisi IV diterjemahkan oleh Pudjaatmaka, A. H., Penerbit Erlangga, Jakarta, 519. Dean, J. A., 1995, Analytical Chemistry Handbook, McGraw-Hill, Inc., New
York, 13, 26.
Direktorat Jenderal Pengawasan Obat dan Makanan RI, 1995, Farmakope Indonesia, jilid IV, Departemen Kesehatan RI, Jakarta, 589.
Fessenden, R.J and Fessenden J.S., 1986, Kimia Organik, jilid 1, diterjemahkan oleh Pudjaatmaka, A.H, Penerbit Erlangga, Surabaya, 314-351.
Fessenden, R.J and Fessenden, J.S., 1994, Kimia Organik, jilid 2, diterjemahkan oleh Pudjaatmaka, A.H., Penerbit Erlangga, Jakarta, 179-183.
Gururaj, A. E., Belakavadi M., Venkatesh, D. A., Marm, D., and Salimatha, B. P., 2002, Molecular Mechanisms of Anti-Angiogenic Effect of Curcumin,
Biochem. Biophys. Res. Commun., 297, 934–942.
46
and Gescher, A., 2001, Characterization of metabolites of the chemopreventive agent curcumin in human and rat hepatocytes and in the rat in vivo, and evaluation of their ability to inhibit phorbol ester-induced prostaglandin E2 production, Cancer Research, 61, 1058-1064.
Istyastono, E.P., Yuniarti, N., Jumina, 2009, Sintesis Senyawa Berpotensi Sebagai Inhibitor Angiogenesis: 2-benzlidena-sikloheksana-1,3-dion, Majalah Farmasi Indonesia, 20, 1-8.
Jenkins, G.L., Knevel, A. M., Digangi, F. E., 1965, Quantitative Pharmaceutical Chemistry, Sixth Edition, McGraw-Hill Book Company, New York. Keenan, C.W., 1995, General College Chemistry, 6th edition, diterjemahkan oleh
Pudjaatmaka, A.H., Penerbit Erlangga, Jakarta.
Kinugasa, S., Tanabe K., Tamura, T., 2009a, Spectral Databases for Organic Compunds, AIST, http://riodb01.ibase.aist.go.jp/sdbs/cgi-bin/direct_frame_top.cgi, diakses tanggal 27 Desember 2010.
Kinugasa, S., Tanabe K., Tamura, T., 2009b, Spectral Databases for Organic Compunds, AIST, http://riodb01.ibase.aist.go.jp/sdbs/cgi-bin/cre_frame_disp.cgi?spectrum_type=ir&sdbsno=1285, diakses tanggal 27 Desember 2010.
MacKenzie, 1967, Experimental Organic Chemistry, 3rd Edition, Prentice-Hall Inc., Englewood Cliffs, New Jersey.
Martin, A., and Bustamante, P., 1993, Physical Pharmacy Chemical Principles in the Pharmaceutical Sciences, 4th Edition, Lea and Febriger, Philadelphia. McMurry, J., 2004, Organic Chemistry, 6th edition, Thomson Learning Inc, USA,
362-365, 822, 854-860.
Nugroho, A. E., 1998, Sintesis 2,5-bis-(4-hidroksi-3-metoksibenzilidena) siklopentanon dengan Variasi Suhu 28oC, 38oC, dan 48oC pada Fase Pengadukan, Skripsi, 9-10, Fakultas Farmasi Universitas Gadjah Mada, Yogyakarta.
Reksohadiprojo, S., 1996, Seri Kimia Fisika Organik : Kuliah dan Praktika Kimia Farmasi Preparatif, volume 07, Universitas Gadjah Mada Press, Yogyakarta, 15, 33-38.
Robinson, T. P., Ehlers, T., Hubbard IV, R. B., Bai, Xianhe, Arbiser, J. L., Goldsmith, D. J, and Bowen, J.P., 2003, Design, Synthesis, and Biological Evaluation of Angiogenesis Inhibitors: Aromatic Enone and Dienone Analogues of Curcumin, Bioorg. Med. Chem. Lett., 13, 115-117.
47
Tonnesen, H.H., Karlsen, J., 1985, Studies On Curcumin And Curcuminoid VI,
Kinetics Of Curcumin Degradation In Aqueous Solution, Z. Lebensm Unters, 180, 402-404.
48 LAMPIRAN Lampiran 1. Data penimbangan crude product
Penimbangan senyawa hasil sintesis
Berat kertas saring = 0,567 g Berat kertas saring + senyawa hasil sintesis = 0,741 g Berat senyawa hasil sintesis = 0,174 g
49
50
51
Lampiran 4. Penghitungan kepolaran fase gerak
Rumus penghitungan indeks polaritas campuran pada fase gerak : P´ AB = ФA PA
+ ФB PB
ФA = fraksi pelarut A P = polaritas fraksi ФB = fraksi pelarut B P´= polaritas campuran dimana : P kloroform = 4,1
P etil asetat = 4,4
52
Lampiran 5. Penghitungan Rfsenyawa hasil sintesis
Pada lempeng silika gel GF254 ditotolkan senyawa hasil sintesis dan
starting material yaitu sikloheksana-1,3-dion dan 4-klorobenzaldehid. Setelah dielusi pada fase gerak kloroform : etil asetat (9:1 v/v) dengan jarak pengembangan 10 cm, kemudian dilihat dibawah sinar UV pada panjang gelombang 254 nm, diperoleh bercak berwarna ungu. Dengan rumus penghitungan Rf, diperoleh nilai Rf masing-masing bercak :
Rf =
Keterangan Jarak bercak
setelah elusi (cm)
Jarak elusi (cm) Rf
Senyawa hasil sintesis 4,0 10 0,40
Sikloheksana-1,3-dion 0,3 10 0,03
53
54
55
56
57
58
BIOGRAFI PENULIS
Ardi Prasetyo, yang akrab disapa Ardi adalah anak kedua dari dua bersaudara dari pasangan Boediono dengan Fanny Theresia. Lahir di Yogyakarta pada tanggal 16 April 1989. Penulis menempuh pendidikan pertamanya di TK Kanisius Sidowayah Klaten, kemudian melanjutkan pendidikan dasar di SD Kanisius Sidowayah Klaten pada tahun 1995. Enam tahun kemudian, penulis melanjutkan pendidikannya di SMP Pangudi Luhur 1 Klaten dan selanjutnya menyelesaikan pendidikan SMA di SMA Padmawijaya Klaten. Lulus dari jenjang SMA, penulis melanjutkan pendidikan Strata 1 pada pertengahan tahun 2007 di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta. Selama menjadi mahasiswa, penulis pernah mengikuti kegiatan bakti sosial pada Desember 2009 dan menjadi asisten pendamping praktikum Farmakognosi Fitokimia II. Selain itu, penulis mempunyai hobi bermain catur.